Что такое дисколорация кожи
Обновлено: 27.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Утолщение кожи: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Гиперкератоз – это аномальное утолщение верхнего слоя кожи (эпидермиса) в результате избыточной инсоляции, воздействия химических веществ, частого трения или давления. Кроме того, гиперкератоз может возникать на фоне некоторых заболеваний.
Утолщение кожи происходит в роговом слое эпидермиса, который является конечной точкой процесса дифференцировки кератиноцитов - клеток, содержащих белок кератин. Именно в роговом слое кератиноциты теряют воду и ядро и превращаются в чешуйки рогового слоя – корнеоциты.
При гиперкератозе происходит ускоренная дифференцировка кератиноцитов, а физиологическое слущивание роговых чешуек с поверхности кожи, наоборот, замедляется.
Разновидности гиперкератоза
В зависимости от происхождения выделяют приобретенный и наследственный гиперкератоз.
По клиническим проявлениям.
- Мозоли – часто встречающаяся разновидность гиперкератоза. Различают несколько видов мозолей, но все они появляются вследствие утолщения кожи в местах, наиболее подверженных механическому воздействию. Причем такое изменение кожи может быть связано как с усиленными физическими нагрузками, так и с различными хроническими заболеваниями, что характерно для пожилых пациентов.
- Роговая (тилотическая) экзема проявляется гиперкератозом ладоней и подошв.
- Псориаз - аутоиммунное воспалительное заболевание, при котором на коже формируются гиперкератотические чешуйчатые бляшки.
- Актинический кератоз обычно представлен небольшими красноватыми чешуйчатыми выпуклостями, которые появляются после избыточной инсоляции. Актинический кератоз – серьезное состояние с высокой вероятностью озлокачествления и требует обязательной консультации врача.
- Себорейный кератоз характеризуется маленькими коричневыми или черными пятнами, обычно локализующимися на лице, шее, плечах и спине. Это одно из наиболее распространенных доброкачественных новообразований кожи у взрослых.
- Фолликулярный гиперкератоз («гусиная кожа») характеризуется закупоркой устьев фолликулов ороговевшими клетками эпидермиса.
- Эпидермолитический гиперкератоз - редкое наследственное заболевание, которое проявляется сразу при рождении. Новорожденные имеют красноватую кожу, иногда покрытую небольшими волдырями.
Гиперкератоз кожи может возникнуть у людей, которые пренебрегают регулярными процедурами по уходу за кожей, в результате чего отмершие клетки рогового слоя скапливают и формируют кератомы – доброкачественные новообразования.
Наша кожа постоянно подвергается воздействию неблагоприятных внешних факторов, таких как хлорированная вода и моющие средства, УФ-излучение. В результате повреждается защитный липидный слой кожи, и влага начинает интенсивно испаряться с ее поверхности, а корнеоциты теряют способность к физиологическому слущиванию.
При сахарном диабете гиперкератоз становится следствием нарушения обмена веществ и ухудшения микроциркуляции кожи.
Ношение тесной или неудобной обуви, особенно при плоскостопии, врожденных патологиях стоп, ожирении, может стать причиной утолщение кожи на стопах.
Развитию гиперкератоза шейки матки (лейкоплакии) способствует вирус папилломы человека.
Причиной гиперкератоза может стать хроническое грибковое поражение, а также опоясывающий лишай.
Считается, что симптомы утолщения и сухости кожи могут быть вызваны дефицитом витаминов А, Е, D и С.
Гиперкератоз нередко становится следствием недостатка гормона эстрогена у женщин в период менопаузы.
Заболевания и состояния, при которых развивается гиперкератоз
- Сахарный диабет.
- Ожирение.
- Плоскостопие.
- Ихтиоз.
- Псориаз.
- Экзема.
- Менопауза.
- Грибковое поражение кожи.
- Опоясывающий лишай.
- Эритродермия.
- Атопический дерматит.
- Себорейный кератоз.
Чаще всего за первой консультацией по поводу утолщения кожи обращаются к врачу-дерматологу. После тщательного осмотра, сбора жалоб, выяснения медицинской и семейной истории пациента, проведения лабораторных и инструментальных исследований может потребоваться консультация врача-эндокринолога , врача-онколога , врача-инфекциониста.
Диагностика и обследования при утолщении кожи
Тщательный сбор анамнеза с учетом всех жалоб пациента, осмотр и проведение дополнительных методов диагностики помогут установить причину гиперкератоза.
-
Клинический анализ крови с развернутой лейкоцитарной формулой для выявления воспалительных процессов в организме.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Красивая, привлекательная улыбка очень важна для коммуникации в современном мире. При встрече принято улыбаться, как минимум из вежливости, а в моменты радости мы непроизвольно смеемся с открытым ртом.
К сожалению, различные патологии могут приводить к тому, что происходит заметное изменение цвета одного из центральных зубов. Это существенно снижает эстетическое восприятие всей улыбки в целом. Даже один зуб другого оттенка непроизвольно привлекает внимание на себя.
Дисколорит зубов – это патологическое изменение цвета в области эмали, дентина или того и другого. Различают два типа – внешний и внутренний.
Внешний дисколорит

Причина – пигментированный налет, который образуется на шероховатостях эмали, в микроскопических трещинках или анатомических полостях.
Дисколорит зубов в этом случае – следствие употребления красящих продуктов (чай, кофе, красное вино, газировка и т.д.), курения, сниженного уровня гигиены.
Избавится от него поможет профессиональная чистка зубов у стоматолога с обязательной полировкой эмали, обучение пациента правилам личной гигиены, ограничение приема красящих продуктов. В некоторых случаях возможно применение абразивных препаратов.
Внутренний дисколорит зубов
Изменения цвета в данном случае происходит на более глубоком уровне в самой эмали или дентине зуба. На зубах образуются белесые эрозивные пятна, которые могут со временем желтеть и чернеть.

Причиной дисколорита зубов в этом случае является проникновение определенных веществ в организм. В частности, влияет повышенное содержание фтора в питьевой воде (флюороз), использование антибиотиков тетрациклинового ряда.
Нарушение минерального, белкового обмена веществ вызывает гипоплазию эмали – её отсутствие или недостаточное развитие.
Возрастные изменения организма также приводят к истончению эмали и в сочетании с внешними факторами может развиться её пожелтение и потемнение.
Перечислим локальные причины возникновения дисколорита:
- «мертвый зуб» или депульпация (удаление нерва). Со временем зуб становится темнее, серее, желтее витальных,
- ранее проведенное лечение корневых каналов резорцин-формалиновым методом. Со временем происходит окрашивание коронки в розово-коричневый оттенок,
- травма во время роста зубочелюстной системы с проникновением крови в зону минерализации,
- неправильно проведенное ортодонтическое лечение может нарушить связочный аппарат (периодонт) зуба, как следствие происходит нарушение трофики и потеря витальности.
Лечение дисколорита зубов
Эстетическая стоматология располагает различными способами лечения дисколорита:

- внутриканальное отбеливание – поможет вернуть светлый оттенок депульпированному зубу,
- кабинетное отбеливание зубов – осветляет и выравнивает цвет эмали на несколько порядков, – может проводится дома, но под врачебным контролем, в зоне улыбки поможет устранить дисколорит при внутренних причинах организма,
- установка коронки из прессованной керамики полностью имитирует живой зуб в ряду и скроет любой дефект.
Цены на лечение пигментации эмали
| Рекомендуемые процедуры | Цена, руб. |
| Ультразвуковая чистка зубов (3 этапа + полировка пастами) | 2880 |
| Чистка зубов Air Flow | 2880 |
| Капа для домашнего отбеливания зубов | 7500 |
| Кабинетное отбеливание | от 6900 |
| Установка виниров | от 21750 |
| Установка ультраниров | 26570 |
Как лечить дисколорит в домашних условиях
Пигментированный желтый и коричневый налет можно попробовать удалить зубным порошком или пищевой содой. Здесь главное не перестараться и не повредить эмалевый слой.
Высоко абразивные пасты нужно использовать очень осторожно – паста с углем может стереть эмаль или оставить на ней царапины. Такие зубные пасты рекомендуется применять не более 2-3 раз в неделю.
В сети встречаются способы борьбы с дисколоритом лимонным соком, перекисью водорода. Скорее всего, такие способы не навредят зубам, но и эффект будет незначительный.
Более эффективные способы основаны на высокой концентрации пероксида или карбамида водорода. Это различные стики, полоски, капы с гелем сомнительного производства из масс-маркета. Данные средства часто вызывают болезненность и чувствительность зубов.
Для лечения внутренних дисколоритов данные способы не подходят, стоит посетить стоматологическую клинику и проконсультироваться у врача-стоматолога.
Анализ и описание существующих методов первичной диагностики диабетической полиневропатии (ДПН), включая шкалы и опросники.
МАТЕРИАЛ И МЕТОДЫ
Проведен поиск и анализ рекомендаций по диагностике ДПН, методик оценки периферической чувствительности, шкал и опросников, применяемых для диагностики ДПН. Поиск публикаций осуществлялся в базах данных eLibrary, PubMed, Web of Science, Springer, Google Scholar, ClinicalKey. Глубина поиска — 20 лет; также включались публикации, имеющие исторический интерес.
РЕЗУЛЬТАТЫ
Всего в настоящий обзор включено 79 публикаций. В большинстве публикаций с целью первичной диагностики ДПН предлагается проводить сбор жалоб и анамнеза больного, оценку температурной и/или болевой чувствительности (оценку функции тонких нервных волокон), оценку вибрационной и тактильной чувствительности (оценку функции толстых нервных волокон). Для первичной диагностики ДПН возможно использование валидизированных диагностических опросников, таких как Мичиганский инструмент скрининга невропатии (Michigan Neuropathy Screening Instrument — MNSI), Невропатический дисфункциональный счет (модифицированный вариант) (Neuropathy Disability Score modified — NDSm). Для оценки выраженности болевой симптоматики рекомендованы Шкала симптомов невропатии (Neuropathy Symptom Score — NSS) и визуально-аналоговая шкала боли (ВАШ), для подтверждения невропатического характера боли — опросник DN4. Большинству пациентов с помощью методов первичной диагностики удается поставить диагноз, расширенная диагностика используется в случаях, требующих дифференциальной диагностики, и может включать электронейромиографию (ЭНМГ), конфокальную микроскопию тонких нервов роговицы, интраэпидермальную панч-биопсию, количественное сенсорное тестирование.
ЗАКЛЮЧЕНИЕ
Использование предложенных алгоритмов позволит объективизировать диагноз и улучшить своевременность и качество оказываемой медицинской помощи пациентам с ДПН.
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский университет)
ФГБНУ «Научно-исследовательский институт общей патологии и патофизиологии» Минобрнауки России
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский университет);
ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского» Минобрнауки России
Дата принятия в печать:
Диабетическая полиневропатия (ДПН) является самым ранним и наиболее частым осложнением сахарного диабета (СД) 1-го и 2-го типов, нарушающим качество жизни, приводящим к инвалидности, значительному повышению риска развития язвенных дефектов стоп и ампутаций — синдрома диабетической стопы (СДС). ДПН также ассоциируется с более высоким уровнем смертности и увеличением расходов здравоохранения [1, 2]. У пожилых пациентов с СД 2-го типа ДПН увеличивает риск падений, что приводит к переломам, госпитализации и в некоторых случаях к смерти больных [3, 4]. Диабетическая полиневропатия может развиваться на ранних стадиях нарушения углеводного обмена, более того, дистальная сенсорная полиневропатия может развиваться и у пациентов с метаболическим синдромом, не имеющих нарушений углеводного обмена.
Своевременная диагностика ДПН крайне важна, так как определяет возможность применения лекарственной терапии на ранних стадиях болезни, что повышает ее эффективность.
Цель обзора — систематизировать и представить данные по диагностике ДПН для врачей первичного звена здравоохранения.
Введение
ДПН в настоящее время определяется как дистальная симметричная сенсорно-моторная полиневропатия с поражением длинных нервных волокон (length-dependent polyneuropathy), развивающаяся в результате метаболических и микрососудистых нарушений на фоне хронической гипергликемии и факторов сердечно-сосудистого риска, сопровождающаяся клинической симптоматикой или без таковой и характеризующаяся поражением периферической нервной системы при исключении других этиологических причин полиневропатии [5, 6].
На основании наличия или отсутствия болевого невропатического синдрома с достаточной долей условности выделяют болевой вариант течения ДПН. Болевая диабетическая полиневропатия не только ухудшает качество жизни пациентов из-за развития болевой симптоматики, но и является одной из ведущих причин госпитализации в России, что, безусловно, отражается на стоимости лечения данных пациентов [7].
Диабетическая полиневропатия развивается на фоне хронической гипергликемии, обусловлена патологическими метаболическими изменениями (активацией полиолового пути, накоплением конечных продуктов гликирования, оксидативным стрессом, дислипидемией) и ассоциирована с основными факторами сердечно-сосудистого риска. Изменения микроциркуляторного русла типичны и универсальны как для развития диабетической ретинопатии и нефропатии, так и для диабетической полиневропатии. Следует отметить, что микрососудистые нарушения появляются раньше признаков полиневропатии. При этом прослеживается четкая связь в течении и совместном развитии этих микрососудистых осложнений. Наличие диабетической ретинопатии и/или нефропатии значительно повышает риск развития ДПН. В патогенезе всех форм ДПН участвуют взаимосвязанные и синергично действующие механизмы, триггером которых является гипергликемия [8]. Экспериментальные исследования подтверждают мультифакторную модель патогенеза ДПН. Превалирующее значение отводится оксидативному стрессу, метаболическим нарушениям и воспалению, ведущим к поражению структур нервной системы [9—12]. Риск развития ДПН ассоциирован с гликемией, ростом, курением, артериальным давлением, весом и дислипидемией [13, 14]. Сроки развития ДПН после диагностики СД зависят от полиморфизма генов антиоксидантных ферментов [15].
Эпидемиология
Диабетическая дистальная симметричная сенсорно-моторная полиневропатия — наиболее распространенная форма диабетической невропатии, на ее долю приходится около 75% всех диабетических невропатий [16, 17].
По данным Государственного регистра сахарного диабета, распространенность ДПН у больных СД 1-го и 2-го типов в РФ широко варьирует. Так, по данным на 2017 г., ДПН выявляется в среднем у 33,6% больных СД 1-го типа и 18,6% больных СД 2-го типа, причем в разных регионах России показатели колеблются от 0,1 до 67,2% при СД 1-го типа и от 0,1 до 42,4% при СД 2-го типа [18].
Однако, судя по широкомасштабным эпидемиологическим исследованиям, истинная распространенность ДПН гораздо выше. Частота выявления ДПН составляет 10—15% при впервые выявленном СД 2-го типа [19, 20] и 50% при увеличении длительности СД 2-го типа более 10 лет [21, 22]. Распространенность ДПН при СД 1-го типа достигает как минимум 20% при длительности СД 20 лет и более [23—26]. У стационарных больных СД 1-го типа ДПН выявляется гораздо чаще, и рост числа больных с ДПН увеличивается значительно при длительности СД больше 10 лет [27].
Болевая ДПН выявляется у 20% взрослых с СД и как минимум у 30% пациентов с диагнозом ДПН. [28]. Также стоит принять во внимание возможность развития болевой ДПН с преимущественным поражением тонких нервных волокон у 10—30% пациентов с нарушенной толерантностью к глюкозе [29—34].
Клинические проявления
ДПН гетерогенна по клиническому течению и паттерну поражения периферической нервной системы. В зависимости от первичного поражения толстых или тонких нервных волокон возможно различное начало, течение и клинические проявления полиневропатии. Также было предложено разделить дефиниции типичной диабетической дистальной симметричной сенсорно-моторной полиневропатии и атипичной диабетической полиневропатии [6, 35]. Представленные градации «типичная» и «атипичная» ДПН не совсем удачны. Так, в консенсусе Американской диабетологической ассоциации по ДПН 2017 г. предлагается классифицировать ДПН на три варианта: с первичным поражением тонких нервных волокон; с первичным поражением толстых нервных волокон; смешанный вариант поражения (наиболее частый) [28]. При этом следует понимать, что форма ДПН с первичным поражением толстых волокон является крайне редкой.
По представленности болевой симптоматики выделяют болевую и безболевую формы ДПН. К болевой форме ДПН относят клинические случаи, когда болевая симптоматика (невропатическая боль) доминирует в клинической картине. По наличию и отсутствию позитивной невропатической симптоматики (сенсорные ощущения у больных: боль, жжение, онемение, парестезии) выделяют субклиническую и симптомные стадии ДПН [6]. Субклиническая форма диагностируется у больных без жалоб и неврологического дефицита, но с наличием ЭНМГ-изменений в двух нервах ног, причем одним из этих нервов обязательно должен быть сенсорный икроножный нерв (n. suralis). Выявление этой формы позволяет начать терапию на самых ранних стадиях развития ДПН.
Типичная ДПН имеет определенный фенотип: 1) невропатическая симптоматика всегда дистальна и симметрична; 2) поражение формируется в первую очередь в ногах, руки поражаются значительно позже; 3) страдают в первую очередь чувствительные волокна, двигательные волокна начинают вовлекаться позже; 4) первоначально выявляется нарушение поверхностной чувствительности (тонкие волокна), нарушение проприоцепции (толстые волокна) возникает позже; 5) ДПН всегда развивается постепенно, в течение нескольких лет, но не внезапно, не остро.
Знание фенотипа ДПН и использование его для диагностики крайне важно, так как по крайней мере 10% полиневропатий у больных с СД не являются диабетическими, а в этом случае фенотип полиневропатии, как правило, отличается от ДПН [5].
Основной характерной чертой ДПН является симметричное снижение дистальной чувствительности, преимущественно поверхностной, в ногах. Степень сенсорных нарушений может колебаться от легких до тяжелых расстройств, сопровождающихся полной потерей чувствительности.
Для безболевого варианта характерно медленное развитие, минимальная симптоматика, не носящая болевого характера, постепенное прогрессирование сенсорно-моторного дефицита. Наиболее типичными являются жалобы на онемение стоп и снижение в них чувствительности. При объективном обследовании выявляется снижение различных видов чувствительности, снижение или отсутствие сухожильных рефлексов. На более поздних стадиях болезни присоединяется мышечная слабость в дистальных отделах — больной плохо стоит и ходит на пятках.
Болевая ДПН может иметь острый или хронический вариант течения. Для хронической болевой формы ДПН характерна волнообразность течения с периодами ремиссии и ухудшения, длительность болевого синдрома, как правило, превышает 3 мес. Для невропатической боли типичен суточный ритм симптомов: усиление к вечеру и в ночные часы. Характер болевой симптоматики весьма разнообразен: жжение, острая боль, пронзающая боль, покалывание, болезненное онемение, судороги. В подавляющем большинстве случаев вместе с указанными симптомами имеется отсутствие или снижение чувствительности и рефлексов.
Типичная сенсорно-моторная или преимущественно сенсорная полиневропатия со смешанным паттерном поражения разных типов нервных волокон встречается наиболее часто и составляет более 90% всех вариантов клинического течения ДПН. Достаточно редким вариантом является острая сенсорная ДПН с поражением тонких нервных волокон, которая рассматривается как атипичная ДПН. Возможны как минимум два клинических варианта: острая болевая сенсорная полиневропатия тонких нервных волокон (синдром Элленберга, диабетическая нейропатическая кахексия) и острая болевая невропатия, индуцированная лечением сахарного диабета (ятрогенная, инсулиновые невриты). Первый вариант наиболее типичен для пациентов с СД 1-го типа, как правило, отсутствует связь с показателями гликемии, характеризуется выраженной болевой симптоматикой, типичны острые, жгучие боли, аллодиния, гиперестезия, судороги, нарушение сна из-за болей, часто имеется сопутствующая депрессия и наблюдается значительное снижение массы тела (>25%). Типично вовлечение автономной нервной системы: тахикардия покоя, ортостатическая гипотония, нарушение суточного ритма АД, судомоторная дисфункция (ночная потливость, не связанная с гипогликемией), гипер-, реже гипомоторная дисфункция желудочно-кишечного тракта (диарея, запоры), эректильная дисфункция у мужчин, сухость влагалища у женщин. В основе лежит избирательное поражение тонких нервных волокон, поэтому при электронейромиографии (ЭНМГ) не выявляется значимых патологических изменений. Данный вариант требует обязательного участия специалиста-невролога и в большинстве случаев комбинированной анальгетической терапии. Болевая симптоматика на фоне терапии обычно купируется в течение 6—12 мес и, как правило, не рецидивирует. Второй вариант, как следует из названия, провоцируется значительным снижением показателей гликемии и может развиваться как при 1-м, так и при 2-м типе СД. Клиническая картина достаточно сходна, нередко носит более устойчивый характер. Типично развитие острой болевой и автономной симптоматики в течение 8 нед с момента значимого снижения гликемии. Снижение HbA1c на 2—3% за 3 мес увеличивает риск развития тонковолоконной ДПН на 20%, а снижение HbA1c >4% за 3 мес увеличивает риск более чем на 80% [36, 37].
Тонкие волокна могут первично поражаться при всех вариантах нарушения углеводного обмена (метаболический синдром, нарушение толерантности к глюкозе, СД), что приводит к раннему снижению болевой и температурной чувствительности [38]. Кроме того, у пациентов с нарушенной толерантностью к глюкозе полиневропатия чаще ограничивается поражением только тонких нервных волокон, а у пациентов с СД имеется сочетанное поражение тонких и толстых нервных волокон, что и будет определять клиническую картину и диагностические подходы к выявлению ДПН (табл. 1) [6, 39, 40].
Таблица 1. Клиническая картина и методы диагностики поражения разных типов нервных волокон при ДПН [6, 40]
Журнал: Флебология. 2018;12(2): 117‑119
III. Склеротерапия. Флебология. 2018;12(2):117‑119.
III. Sclerotherapy. Flebologiya. 2018;12(2):117‑119. (In Russ.).
Компрессия служит важным компонентом для проведения успешного и безопасного флебосклерозирующего лечения. Вместе с тем необходимость ношения компрессионного трикотажа или бандажей вносит известные ограничения и вызывает возражения пациентов, особенно в жаркое время года.
— разработать методику и провести сравнительную оценку эффективности обычного компрессионного трикотажа и кратковременного пневматического бандажа с крио-элементами при проведении флебосклерозирующего лечения расширенных внутрикожных вен.
В открытое проспективное наблюдательное исследование были включены 50 пациенток в возрасте от 18 до 35 лет. В соответствии с дизайном исследования после выполнения стандартизированных склеротерапий ретикулярных вен и телеангиэктазов на симметричных участках нижних конечностей, на одну из них накладывали на 15 мин с давлением 50 мм рт.ст. пневматический крио-компрессионный бандаж, а на другую — надевали медицинский чулок 2-го класса (RAL стандарт), носимый пациентами в дневное время в течение 10 дней. Сравнительную эффективность и безопасность двух видов компрессии изучали на основании полноты облитерации целевых вен, частоты развития типичных нежелательных побочных явлений (экхимозы, флебиты, гиперпигментация и неоваскулогенез), а также оценки пациентом суммарного дискомфорта по 11-балльной визуальной аналоговой шкале.
Использование пневматического бандажа с крио-элементами, наложенного после выполнения склеротерапии ретикулярных вен и телеангиэктазов с давлением в 50 мм рт.ст. на 15 мин в сравнении с традиционными компрессионными чулками 2-го класса (RAL стандарт), назначаемыми на 10 дней, значимо снижает частоту развития типичных нежелательных побочных явлений после флебосклерозирующего лечения, таких как образование экхимозов, флебиты, гиперпигментация и неоваскулогенез. Значимость различий выявляется уже через 7 сут после выполнения склеротерапии и нарастает при дальнейшем динамическом наблюдении. По удобству для пациентов использование кратковременного пневматического крио-бандажа в 4 раза лучше, чем применение компрессионных чулок.
При проведении склеротерапии ретикулярных вен и телеангиэктазов кратковременная пневматическая крио-компрессия по эффективности и безопасности не уступает традиционному медицинскому трикотажу (RAL стандарт), а также позволяет значимо снизить частоту известных нежелательных побочных реакций после флебосклерозирующего лечения.
Склеротерапия является наиболее эффективным и часто применяемым методом лечения ретикулярных вен и телеангиэктазий. Однако после склеротерапии у некоторых пациентов могут появляться вторичные телеангиэктазии. Как правило, они крайне малы в диаметре. Часть из них исчезает со временем самостоятельно, часть остается без изменения, что требует активных действий в отношении них. Согласно отечественным и европейским рекомендациям, для устранения вторичных телеагиэктазий следует применять низкоконцентрированные растворы склерозантов.
— оценить возможности гипертонического раствора глюкозы как склерозанта для устранения вторичных телеангиэктазий.
Проведено пилотное исследование. 22 пациента с вторичными телеангиэктазиями были включены в исследование. Всем пациентам была выполнена склеротерапия с использованием 75% раствора глюкозы. После склеротерапии рекомендована непрерывная компрессия с применением трикотажа 2-го класса в течение суток и компрессия в дневное время в последующие 5 дней. Результат оценивали через 2 нед после склеротерапии по шкале от 0 до 5 баллов. Оценке 5 баллов соответствовало полное исчезновение телеангиэктазий (эффективность 100%), оценке 4 — исчезновение на 80%, оценке 3 — на 60%, оценке 2 — 40%, оценке 1 — 20% и оценке 0 — полное сохранение телеангиэктазий (0% исчезнувших сосудов).
У 16 (72%) из 22 пациентов отмечалось исчезновение более половины телеангиэктазий, из них у 4 пациентов при осмотре телеангиэктазии не обнаруживались вообще. У 5 человек эффект был незначительный (1—2 балла) и у одного отсутствовал совсем. Средняя оценка результата (интерквартильный размах) составила 3 балла (2—4). Не было выявлено побочных действий и осложнений склеротерапии.
Склеротерапия с использованием в качестве склерозанта 75% раствора глюкозы является эффективным и безопасным методом устранения вторичных телеангиэктазий. Для сравнения эффективности и безопасности гипертонического раствора глюкозы с детергентами необходимо проведение рандомизированного исследования.
— оценить клиническое значение нецелевой окклюзии поверхностных и глубоких вен нижних конечностей, возникающей после пенной эхосклеротерапии у пациентов с варикозной болезнью.
Проведен ретроспективный анализ медицинских записей пациентов, которым выполнялась пенная эхосклеротерапия поверхностных вен в рамках лечения варикозной болезни на базе сети медицинских клиник «MedSwiss» в период 2015—2017 гг. В соответствии с внутренним протоколом учреждения всем пациентам осуществлялось ультразвуковое ангиосканирование через 1—2 нед, 1, 3, 6 и 12 мес после склеротерапии. Все диагностические исследования выполнялись двумя оперирующими хирургами с обязательной фиксацией результатов в медицинской документации. Под нецелевой окклюзией понимали неполную компрессию любой глубокой вены и/или поверхностной вены, которая не подлежала целевой облитерации. В анализ включались пациенты, явившиеся на контрольный осмотр через 1—2 нед после манипуляции.
В анализ были включены результаты эхосклеротерапии, выполненной на 257 нижних конечностях у 196 пациентов: 139 женщин и 57 мужчин, средний возраст 44,2±12,2 года. Распределение по клиническому классу ХЗВ было следующим: С2 — 74%, С3 — 20%, С4 — 4,5%, С5 — 1,5%. Патологический процесс локализовался в системе БПВ в 85,2% случаев, в системе МПВ — в 13,2%, редко наблюдали комбинированное поражение БПВ и МПВ — 1,6%. Варикозное расширение вен левой нижней конечности регистрировали в 51,2% случаев. Вмешательства по поводу рецидива варикозной болезни составляли 6,6%. Изолированная склеротерапия была выполнена на 14% конечностей, в подавляющем большинстве наблюдений она сочеталась с ЭВЛК ствола БПВ (54,9%), МПВ (10,5%), перфорантных вен (26,1%), вены Джиакомини (3,9%) или ПДПВ (1,9%). Склеротерапия выполнялась пенной формой полидоканола в концентрациях 1% (n=3), 1,5% (n=102), 2% (n=117), 3% (n=35). Средний объем препарата на 1 сеанс составлял 7,5±2,3 мл, а среднее количество сеансов на одну конечность — 1,17±0,43.
Нецелевая окклюзия вен была выявлена на 60 конечностях (23,3%; 95% ДИ 18,6—28,8), симптомы присутствовали в 3 наблюдениях (1,2%; 95% ДИ 0,4—3,4). Чаще всего регистрировали окклюзию ствола БПВ (n=23) и мышечных вен голени (n=15). Окклюзию поверхностных вен фиксировали в 37 случаях, глубоких — в 31. Специфическое лечение было назначено двум пациентам с наличием симптомов. Через 1 мес было отслежено 91% конечностей, через 3 мес — 66%, через 6 мес — 37%, через 12 мес — 11%. Признаков прогрессирования вено-окклюзионного процесса и/или развития симптоматической легочной эмболии не наблюдали. Спустя 6 мес от момента вмешательства нецелевая окклюзия не определялась. Ультразвуковой и/или клинический рецидив заболевания был зафиксирован в 16 (6,2%) случаях (95% ДИ 3,9—9,8) без достоверных различий между конечностями, имевшими и не имевшими нецелевую окклюзию (10,0% против 5,1%; р=0,218). Клинический рецидив заболевания наблюдали в 12 (4,7%) случаях (95% ДИ 2,7—8,0) без достоверных различий по признаку нецелевой окклюзии: 6,7% против 4,1% (р=0,483).
Частота обнаружения нецелевой окклюзии поверхностных и/или глубоких вен после пенной эхосклеротерапии при активном ультразвуковом мониторинге может достигать 23,3%. Выявленная окклюзия имеет тенденцию к полному регрессу на протяжении 6 мес и не влияет на клинический исход заболевания или результаты проведенного лечения.
Склеротерапия широко распространенный классический метод устранения ретикулярных вен и телеангиэктазов (ТАЭ) на ногах. Однако гиперпигментация и телеангиэктатический мэттинг, часто возникающие как побочные эффекты в результате проведенного лечения, заставляют искать новые пути решения этой проблемы. Мы использовали сочетание инъекционной склеротерапии ретикулярных вен и транскутанного неодимового лазера для решения проблемы ретикулярного варикоза.
— оценить комбинацию двух методик лечения ретикулярного варикоза.
С июня 2016 г. по март 2017 г. мы провели 236 процедур комбинированого лечения у 108 пациенток с полной фотодокументацией до и после. Ретикулярные вены склерозировались с использованием 0,2—0,3% натрия тетрадецилсульфата, а ТАЭ обрабатывались неодимовым лазером Almalasers Harmony XL Pro с использованием пятна 6 мм, длительностью импульса 12—45 мс, уровень энергии 120—150 Дж/см. Результат оценивали через 4 нед после первичной сессии. Учитывали 3 параметра: эффективность, пигментация (дисколорация кожи), мэттинг. Каждый параметр оценивали по балльной системе. Эффективность оценивали по 5-балльной шкале, где 1 балл — до 20% успешно устраненных сосудов, 2 балла — 20—40% и т. д. до 5 баллов (80—100%), дисколорацию и мэттинг по 3-балльной (0 — отсутствие побочного эффекта, 1 балл — слабовыраженный, 2 балла — средневыраженный, 3 — сильновыраженный побочный эффект).
Ожоги и некрозы кожи не отмечены ни в одном случае. Эффективность 1 сеанса была высокой в 53% случаев, средней — в 39%, слабой — в 8%. Дисколорация кожи отмечена как слабая до 17% случаев, средняя — в 17%, выраженная — в 7,3% случаев. Мэттинг отмечен выраженный в 5% случаев, средний — в 10% и слабый — в 29,3%.
Комбинированное лечение, основанное на применении склеротерапии и транскутанного лазера высокоэффективно и безопасно. Средний балл эффективности одной сессии 3,5 балла. Выраженные побочные эффекты в виде мэттинга и гиперпигментации отмечены в 7,3 и 5% случаев соответственно, что представляется более низким, чем при обычной инъекционной склеротерапии.
В последнее время все большее количество пациентов обращаются в клинику с косметической проблемой выступающих расширенных вен на верхних конечностях. Особенно это затрагивает людей, у которых работа связана с нагрузкой на руки. В центре флебологии МИФЦ с 2015 г. для устранения вен на руках выполняется процедура микропенной склерооблитерации. Показаниями для ее выполнения служат наличие расширенных вен на руках, ухудшающих психоэмоциональный фон пациента.
— оценить результаты склеротерапии вен верхних конечностей.
С сентября 2015 г. по февраль 2018 г. в центре флебологии МИФЦ склеротерапия выполнена у 28 пациентов (у 26 женщин и 2 мужчин) — всего проведено лечение 56 верхних конечностей. Для процедуры использовалась микропенная форма лауромакрогола 400 в концентрации от 1,5 до 2,5%. Всего было выполнено от 1 до 3 сеансов склеротерапии на руках с интервалом от 3 до 7 дней, количество инъекций составило от одной до пяти за 1 сеанс.
Все пациенты отслежены в сроки от 1 мес до 1 года. Окклюзия вен произошла в 100% случаев (см. рисунок). В 1 случае развился флебит, купированный в течение 7 дней местными НПВС. Другие осложнения, побочные или аллергические реакции не отмечены.
Склеротерапия на верхних конечностях является безопасной и эффективной косметической процедурой. Показаниями для ее выполнения служат наличие расширенных вен на руках, ухудшающих психоэмоциональный фон пациента.
— улучшить результаты склеротерапии ретикулярного варикоза и телеангиэктазий нижних конечностей.
Проведено лечение 180 пациентов с ретикулярным варикозом и телеангиэктазиями нижних конечностей. Всем пациентам провели клиническое (физикальное) исследование, ультразвуковое дуплексное сканирование вен нижних конечностей.
Все пациенты были женского пола в возрасте от 18 до 49 лет. Косметические неудобства, связанные с наличием расширенных и извитых внутрикожных сосудов — ретикулярных вен и телеангиэктазий — на одной или обеих нижних конечностях, беспокоили всех больных (100%). Продолжительность заболевания составила от 1 года до 16 лет.
Пациенты были условно разделены на две группы по 90 человек. Пациентам 1-й группы была проведена микросклеротерапия ретикулярных вен и телеангиэктазов. Пациентам 2-й группы сразу же после микросклеротерапии произведена обработка зоны воздействия потоком холодного воздуха аппаратом Crio Zimmer в течение 2—3 мин. В обеих группах для микросклеротерапии использовали полидоканол в низких концентрациях — 0,5% раствор при лечении телеангиэктазий и 1% раствор при лечении ретикулярного варикоза. Склеропрепарат вводили в ретикулярные вены и телеангиэктазии в количестве 0,2—0,4 мл за одну инъекцию.
. У 12 (13,3%) больных 1-й группы была выявлена неоваскуляризация — появление постинъекционных телеангиэктазий в сроки от 1 до 4 нед после проведенного лечения. Во 2-й группе неоваскуляризация была выявлена у 6 (6,6%) пациентов. При осмотре через 1 мес гиперпигментация была отмечена у 14 (15,6%) пациентов 1-й группы и 10 (11,1%) — 2-й группы, других осложнений зафиксировано не было.
Использование микросклеротерапии высокоэффективно в лечении ретикулярного варикоза и телеангиэктазий. Применение локального охлаждения позволяет улучшить косметические результаты.
Что такое купероз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Тюлис Галины Геннадьевны, дерматолога со стажем в 27 лет.
Над статьей доктора Тюлис Галины Геннадьевны работали литературный редактор Маргарита Тихонова , научный редактор Динар Сафин и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Купероз — это заболевание кожи, которое развивается из-за хрупкости капиллярных стенок и локального нарушения кровообращения. Сопровождается нарушением цвета кожи, потерей её эластичности и появлением телеангиэктазий — сосудистых звёздочек или сеточек [1] .
Как правило, купероз не является самостоятельной болезнью. Это симптом, который сопутствует основному заболеванию.
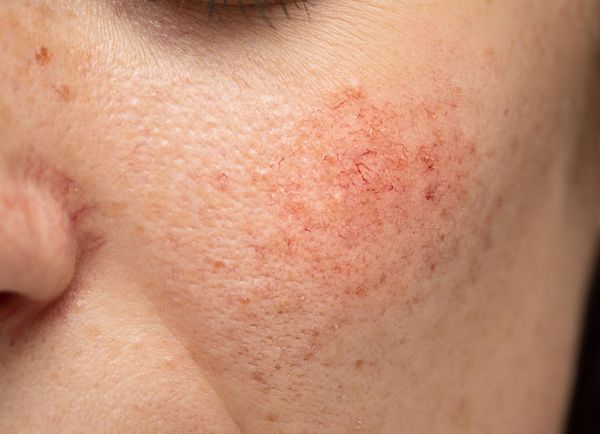
Расширение и ломкость сосудов сосудов происходят по ряду причин. Ими могут быть как внутренние, так и внешние факторы.
Внутренние факторы:
-
— основная причина развития купероза;
- физиологические гормональные изменения — в подростковом возрасте, во время беременности, климакса или при приёме гормональных контрацептивов;
- заболевания яичников, щитовидной и поджелудочной железы;
- заместительная терапия эндокринной патологии [5] ;
- сердечно-сосудистые заболевания ( артериальная гипертензия и атеросклероз );
- заболевания пищеварительной системы (гастрит, дисбактериоз кишечника , болезни печени и поджелудочной железы); и наследственные аутоиммунные заболевания (болезнь Стерджа — Вебера, синдром Луи — Бар, болезнь Рандю — Ослера).
При гормональных нарушениях обособленные частички гормонов вступают во взаимодействие с рецепторными клетками, образуя биологически активные биологические соединения. Эти соединения влияют на стенки сосудов, уменьшают их упругость и эластичность, делая их ломкими.
Во время беременности происходит серьёзная гормональная перестройка организма. Сосуды могут не выдержать такую нагрузку и расшириться. Так как такая перестройка временная, в течение 2-3 месяцев после родов сосуды обычно восстанавливаются. Но из-за развития других заболеваний (например, гипертонии) сужение сосудов после родов может и не произойти.
При наследственных аутоиммунных заболеваниях количество нитевидного белка, придающего упругость и эластичность сосудистым стенкам, уменьшается и сосуды становятся ломкими. Склеродермия сопровождается отторжением соединительной ткани. Это также сказывается на сосудах.
При розацеа поражаются сальные железы, волосяные луковицы и капилляры кожи лица. За счёт стойкого расширения сосудов и прилива крови появляются телеангиэктазии.
Внешние факторы :
- вредные привычки ( курение , злоупотребление алкоголем);
- неправильное питание (употребление большого количества кофе, шоколада, острой и горячей пищи);
- перепады температуры;
- ультрафиолетовое облучение.
Курение влияет на сосуды, разрушая баланс липидов в крови. Липиды — это жиры, которые влияют на обмен веществ у человека. Разрушенные частицы из липидного баланса оседают на сосудистых стенках, закупоривая их просвет. Сердце с возросшей нагрузкой проталкивает кровь по сосудам, в результате в сосудах с венозной и артериальной кровью образуется разное давление, что приводит к расширению капиллярной сети.
Чрезмерное употребление алкоголя также способствует скоплению жиров в сосудистых стенках, а этанол расширяет капилляры. Он снижает давление крови за счёт расслабления сосудистых стенок, тем самым эластичность сосудов теряется и они остаются расширенными.
Люди с чувствительной и светлой кожей наиболее подвержены развитию купероза, особенно под влиянием перепадов температуры и ультрафиолетового излучения. Такая кожа быстро реагирует на внешние факторы, что способствует повреждению стенок сосудов.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы купероза
Купероз может проявляться на любых участках кожи, например на ногах, спине или грудной клетке, но чаще — на лице: в области крыльев носа, лба, подбородка и щёк [9] . Это обусловлено эластичностью и небольшой толщиной кожи.
Из-за нарушения целостности сосудистой стенки образуются небольшие кровоизлияния, которые становятся заметны невооружённым глазом. Вначале появляются розово-красные или тёмно-фиолетовые сосудистые звёздочки и сеточки. Их цвет зависит от степени поражения и диаметра сосудов (от 1-2 мм до 4-5 см).
Боль не характерна, но может возникнуть чувство жжения или зуда. При расширении вен на ногах появляется мышечная слабость, тяжесть в конечностях при ходьбе.
На фоне поражения печени может появится зуд. Такой печёночный зуд возникает под влиянием желчных кислот. Они формируются из холестерина в печёночных клетках, после транспортируются вместе с током желчи в желчный пузырь и двенадцатиперстную кишку. При нарушении транспортировки желчных кислот они попадают в кровоток. Кислоты накапливаются в организме, что и приводит к зуду кожи.
При наследственных аутоиммунных заболеваниях соединительной ткани расширение капилляров сопровождается поражением сосудов и неспецифическим воспалительным процессом, который возникает под влиянием множества внешних и внутренних факторов.
Если не заняться лечением, симптомы купероза начинают прогрессировать. Капилляры значительно расширяются, кровь в них застаивается, из-за чего сосуды становятся синюшно-фиолетового цвета. На других участках кожи нарушается приток крови и выработка коллагена, кожа тускнеет, теряет эластичность, становится более дряблой.
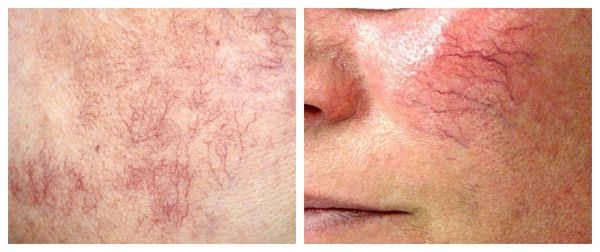
Патогенез купероза
Кожу кровоснабжают поверхностные и глубокие сосудистые сплетения: капилляры, прекапиллярные сосуды, артерии и вены. Поверхностная сосудистая сеть находится в сосочковом слое дермы, глубокая — в нижних слоях дермы и гиподерме (подкожно-жировой клетчатке). Сообщаются эти сплетения при помощи анастомозов — соединений между кровеносными сосудами [2] .
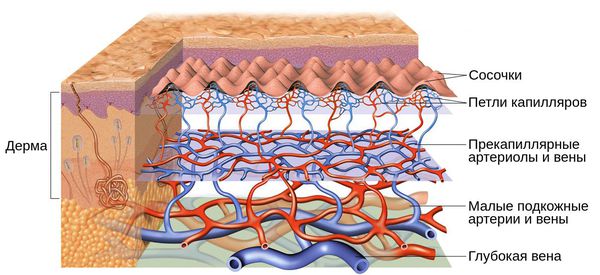
Под влиянием различных факторов образуется большое количество вазоактивных веществ, влияющих на тонус и диаметр сосудов. Среди них эндотелин, простагландины, простациклины и оксид азота [2] . Процесс сужения и процесс расширения сосудов находятся в своеобразном балансе и уравновешивают друг друга. Однако при постоянном воздействии провоцирующих факторов этот баланс нарушается и смещается в сторону расширения сосудов. Вначале развивается временный, а затем постоянный эритроз — покраснение кожи в области щёк и носа. В дальнейшем стойкий эритроз приводит к появлению телеангиэктазий. Если в среднем диаметр нормальных мелких сосудов составлял 5-10 микрон, то при куперозе они расширяются до 100 микрон — их диаметр увеличивается в 10 раз.
Телеангиэктазии могут быть единичными и множественными, локальными или распространёнными, мелкими и крупными, бледно-розовыми и синюшно-фиолетовыми. Красные тонкие сосудистые звёздочки, не выступающие над поверхностью кожи, развиваются из капилляров и артериол. Более широкие, синеватые телеангиэктазии, выступающие над поверхностью кожи, формируются из венул.
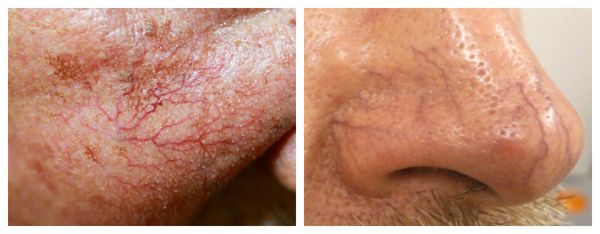
Внешний вид повреждённого капилляра может меняться: если первоначально он был тонким и красным, то затем становится синим. Это происходит из-за хронически повышенного гидростатического давления в капиллярах со стороны венозной крови. Гидростатическое давление — это явление, при котором на артериальном конце капилляра давление больше, чем на венозном. Приток крови становится больше, чем надо, и стенки венозных капилляров расширяются.

Классификация и стадии развития купероза
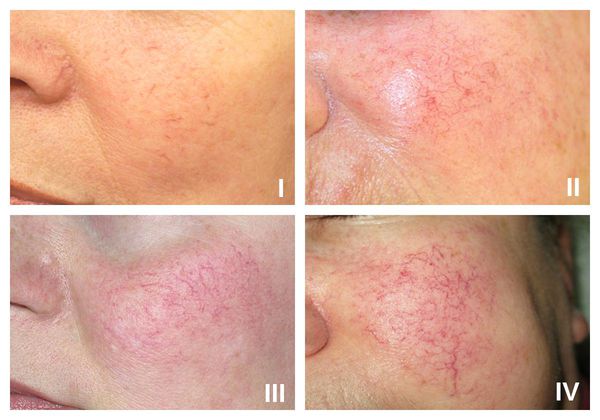
В рамках розацеа выделяют четыре стадии купероза:
- I стадия — начало болезни. Отмечается периодические ощущения "приливов". Кожа краснеет на щеках, иногда на туловище, руках и кистях [6] . На этой стадии сосуды ещё эластичны, могут полностью сократиться. Поэтому интенсивность красноты постепенно уменьшается и исчезает самостоятельно, не оставляя никаких следов. На фоне покраснения наблюдается сухость кожи и не больше 2-3 расширенных капилляров.
- II стадия. Наблюдается более стойкое покраснение в области щёк при любом прикосновении к коже лица, даже во время умывания. Появляется сосудистый рисунок в виде сосудистых звездочек, жжение, покалывание, незначительный зуд.
- III стадия. Также отмечается стойкое покраснение и сосудистая сеточка. Сосуды расширились, потеряли тонус и эластичность, не сокращаются. Усиливается сухость кожи, что приводит к развитию воспалительной реакции.
- IV стадия. В процесс вовлекаются почти все сосуды лица. Из-за спазмирования сосудов появляются бледные участки кожи.
Осложнения купероза
Единственное осложнение купероза — преждевременное старение кожи. Из-за нарушенного кровоснабжения она недополучает кислорода и питательных веществ [8] . В результате становится тусклой, дряблой, сухой, а видимые сосуды кожи вызывают эстетический дискомфорт.
Однако не стоит забывать, что купероз может быть проявлением сердечно-сосудистых, эндокринных, гастроэнтерологических или наследственных аутоиммунных заболеваний. Поэтому чтобы не допустить развития осложнений основной болезни, важно обратиться к врачу при первых признаках купероза.
Диагностика купероза
Распознать купероз по клиническим проявлениям не оставляет труда. Однако самостоятельно поставить правильный диагноз невозможно: купероз может быть проявлением начальной стадии наследственного аутоиммунного заболевания, патологии соединительной ткани и других болезней. Поэтому за помощью необходимо обратиться к врачу. Только доктор сможет установит причину купероза и подобрать правильное лечение.
При сборе анамнеза врач уточняет, какие факторы могли повлиять на развитие болезни: есть ли у пациента жалобы на щитовидную железу или яичники, были ли у него заболевания, связанные с нарушением гормонального фона [3] .
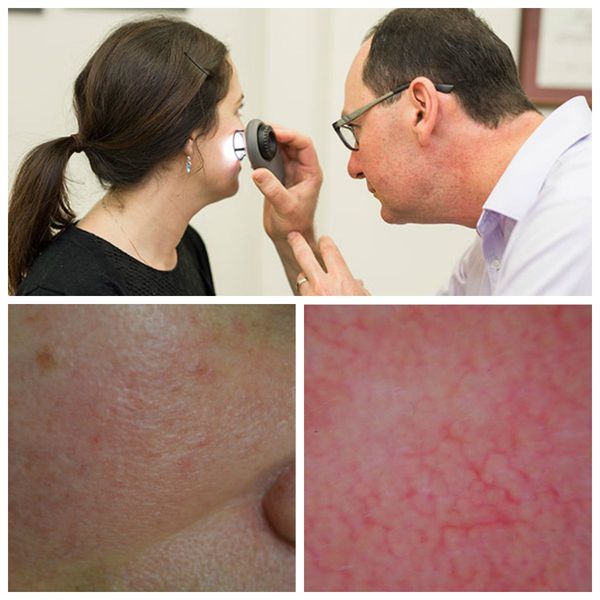
Для лучшей визуализации поражения кожи во время осмотра используют дерматоскоп. Он позволяет разглядеть тонкие паутинки расширенных сосудов, которые не видны невооружённым глазом.
Далее врач назначает необходимые лабораторные и инструментальные исследования, чтобы выявить основное заболевание, ставшее причиной развития купероза :
- общий анализ мочи (ОАМ) — делается для определения функции почек;
- общий анализ крови (ОАК) с лейкоцитарной формулой — позволяет выяснить, какие нарушения есть в организме;
- биохимический анализ крови — также позволяет выявить изменения в организме, например в пищеварительном тракте или печени;
- анализы на свободный тироксин (Т4), тиреотропный гормон (ТТГ), прогестерон, тестостерон — обнаруживает гормональные нарушения;
- УЗИ щитовидной железы;
- УЗИ органов брюшной полости.
Все эти анализы обязательны, особенно для пациентов с тонкой чувствительной кожей. Они дают полную картину и позволяют назначить правильное лечение.
Лечение купероза
Лечение купероза должно быть направлено не только на устранение косметического дефекта, но и на борьбу с основным заболеванием, которое привело к поражению капилляров. Поэтому оно может потребовать участия не только дерматолога, но и других специалистов: эндокринолога, кардиолога, гастроэнтеролога или ревматолога.
В настоящее время существует много методов, которые помогают избавиться от купероза. Только врач может назначить то, что непосредственно подойдёт пациенту.
На ранних стадиях заболевания (I и II стадии) возможно амбулаторное лечение в виде мазей с флавоноидами (например, Троксевазин ), таблеток Аскорутин , а также витаминов группы С, Р. Они укрепляют стенки сосудов и препятствуют развитию рецидива [5] .
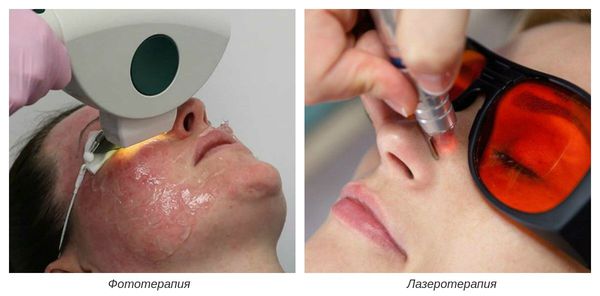
На III-IV стадиях болезни показано удаление расширенных сосудов при помощи аппаратных методов лечения. К ним относятся: электрокоагуляция, фототерапия, лазеротерапия и озонотерапия [10] .
- Электрокоагуляция — удаление повреждённых сосудов под воздействием электрического тока. Процедура безболезненная, её повторяют от 3 до 5 раз.
- Фототерапия — восстановление сосудов при помощи фотовспышек. Процедура выполняется с помощью аппарата, излучающего интенсивный импульсный свет (IPL).
- Лазеротерапия — сужение сосудов под воздействием лазерного луча [4] . Наиболее эффективным при куперозе является неодимовый лазер. Не повреждая кожу, он нагревает гемоглобин крови, тем самым как бы "запаивает" сосуд, и сосудистые звёздочки буквально исчезают.
- Озонотерапия — введение озоно-кислородной смеси в просвет повреждённого сосуда. Данная смесь обладает выраженным лечебным действием, улучшает кровообращение и ускоряет восстановление тканей.
Во время беременности лечение купероза проводят при необходимости, но только после 12-й недели, так как до 12-й недели идёт формирование плода [1] . Опасность связана с внешним и психологическим состоянием будущей мамы. Из-за постоянных стрессов понижается и без того ослабленный иммунитет. На этом фоне обостряются хронические нарушения, которые могут повлиять на формирование и развитие плода.
Беременным и кормящим противопоказана электрокоагуляция, фото- и лазеротерапия. Если во время беременности купероз возник на фоне розацеа, то не рекомендуется принимать изотретиноин и тетрациклин, так как эти препараты негативно влияют на плод [11] .
Прогноз. Профилактика
Обращая внимание на кожу, зная симптомы заболевания, можно на ранних стадиях обратиться к специалисту и вовремя устранить купероз.
Прогноз зависит от причин, вызвавших расширение и ломкость сосудов. Если развитие купероза связано с хроническими заболеваниями, особенно розацеа, лечение будет наиболее длительным. Оно требует постоянного наблюдения у специалиста. При прекращении лечения или воздействии любого фактора риска возможны периоды обострения.
Чтобы не допустить развитие купероза, необходимо придерживаться несложных правил:
- отказаться от вредных привычек;
- придерживаться правильного питания;
- пересмотреть свой образ жизни;
- правильно ухаживать за кожей;
- избегать прямых солнечных лучей;
- использовать кремы с солнцезащитным фактором;
- летом с 12:00 до 17:00 не находиться на солнце;
- зимой использовать питательные кремы, которые противостоят воздействию внешних неблагоприятных факторов [5] .
При очищении кожи лица рекомендуется использовать специальные мягкие очищающие средства, которые предохраняют кожу от обезвоживания. Пользоваться мыльными пенками и мылом не желательно, так как они разрушают липидный слой, который защищает кожу от испарения молекул воды. Также нужно отказаться от использования губки, спонжа, щёточек, кисточек, пилингов, скрабов и средств, содержащих спирт. Они будут раздражать и сушить кожу [10] .
Умываться нужно только тёплой водой. Для снятия декоративной косметики с сухой кожи желательно использовать специальные сливки или молочко. В их составе содержатся масла, которые питают и увлажняют кожу.
Крема, в которых есть ланолиновая кислота, витамины группы С, К, Е, также питают кожу и укрепляют стенки кровеносных сосудов. Перед сном можно обработать кожу успокаивающей сывороткой.
Немаловажную роль в профилактике купероза играет питание. Еда должна быть богата витаминами:
- витамин Р содержится в моркови, гречке, красном болгарском перце, спарже и петрушке;
- витамин К — в шпинате, белокочанной капусте, петрушке, спарже, брокколи, сушеных специях, водорослях и листьях одуванчика;
- витамин С — в луке, цитрусовых, чёрной смородине и квашеной капусте;
- витамин D — в молочных продуктах;
- Омега-3 — в рыбных продуктах, особенно в рыбьем жире.
Пищу желательно готовить на пару или запекать. Также рекомендуется соблюдать водный режим: выпивать 1,5-2,0 литра воды в день. Можно пить зеленый чай. Вода должна быть негазированной, так как газированная вода усиливает кислотность слизистой желудка и рефлекторное расширение сосудов лица. То же самое происходит и при употреблении острой, солёной пищи, кофе и шоколада [10] .
Читайте также:

