Антибиотики при анаэробной инфекции кожи
Обновлено: 25.04.2024
Анаэробная хирургическая инфекция. Ветеринарная анаэробная инфекция
Анаэробная хирургическая инфекция является прежде всего раневой инфекцией. Наиболее часто она развивается при случайных ушибленно-рваных, а также осколочных огнестрельных ранах. В литературе имеются указания о возможности эндогенного пути ее развития. Анаэробная инфекция может возникнуть при подкожных и особенно внутримышечных инъекциях растворов и вакцин, при несоблюдении асептики и антисептики. Если учесть, что анаэробы обнаруживаются в 95 % проб почвы и в 100 % проб навоза, то следует признать, что случайные раны животных, особенно в области конечностей, всегда загрязнены теми или иными анаэробами.
Несмотря на это раневая анаэробная хирургическая инфекция у животных развивается относительно редко, исключением является рогатый скот. У него она проявляется в виде газового отека (брадзот) и анаэробной флегмоны при разрыве пищевода.
Обширные, широко зияющие раны, обильно загрязненные почвой и навозом, редко осложняются анаэробной инфекцией, если подвергаются своевременной хирургической и антисептической обработке.
Хирургическая анаэробная инфекция проявляется в виде газообразующей или клостридиальной инфекции, чаще вызываемой Cl. perfringens, Cl. oedematicus, Cl. oedematis maligni, Cl. hystoliticus, и в виде гнилостной инфекции, чаще вызываемой факультативными анаэробами В. coli, В. putrificus, B. proteus vulgaris.
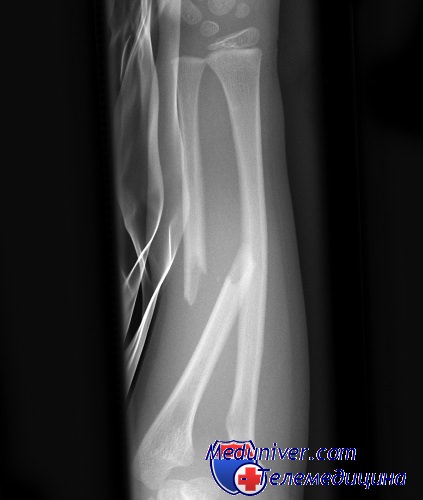
Развитию инфекции способствует ряд условий: колотые и иные раны с узким входным отверстием и наличием раздавленных, размозженных мышц, ранящих и других инородных предметов, ниш, карманов, сгустков крови; разрывы или тромбоз основных артериальных магистралей, снабжающих кровью зону повреждения; венозный застой и наличие обширных гематом; большие кровопотери; длительное оставление жгута на конечности; ослабление сердечной деятельности и другие условия, приводящие к кислородному голоданию тканей и созданию анаэробных условий в ране.
Кроме того, развитию анаэробной инфекции способствуют гипо- и авитаминозы, охлаждение, общее истощение, нервное перевозбуждение, физическое переутомление и особенно запоздалая, недостаточная и тем более непроведенная хирургическая и антимикробная обработка глубоких ушибленно-размозженных ран, открытых переломов, на которые накладывают глухие повязки.
Чем больше в ране мертвых тканей, толще мускулатура и глубже раны, тем чаще и скорее развивается инфекция при всех других равных условиях. У рогатого скота вследствие обильного выделения в рану фибрина создаются более благоприятные условия для развития анаэробной и гнилостной инфекций, чем у лошадей и собак с их серозно-экссудативным типом воспалительной реакции. Важно иметь в виду, что организм животных не выработал достаточного иммунитета по отношению к анаэробной инфекции, воспалительная же реакция при ней оказывается слабовыраженной, а при газовой гангрене и газовом отеке — подавленной.
Вследствие этого возникший инфекционный процесс бурно развивается и быстро генерализуется. Нейтральная или слегка щелочная реакция тканевой среды оказывается наиболее подходящей для развития и жизнедеятельности анаэробных микроорганизмов. Оптимум рН среды для роста В. tetani — 7,0—7,6, В. perfringens — 7,2—7,4, В. hystolyticus — 6,0—7,6, Vibrion septique — 7,6, В. oede-matiens — 7,2—7,4. Указанные микробы (кроме В. tetani) окрашиваются по Граму.
По клиническому проявлению хирургическую анаэробную инфекцию подразделяют на газовый абсцесс, газовую гангрену, анаэробную газовую флегмону, злокачественный и газовый отеки, а также столбняк и некробактериоз.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Для цитирования: Белоусова Т.А., Каюмова Л.Н., Горячкина М.В. Системные антибиотики в терапии бактериальных инфекций кожи и мягких тканей: фокус на макролиды. РМЖ. 2011;21:1317.
Эпидемиология Бактериальные инфекции кожи, вызывающие ее гнойное воспаление, были выделены в группу инфекционных дерматозов французским ученым H. Leloir в 1891 г. под названием пиодермиты (pyon – гной, derma – кожа). За рубежом пиодермии обычно относят к обширной группе инфекций кожи и мягких тканей (ИКМТ), включающей, помимо инфекций кожи и ее придаточных образований, инфекции подкожно–жировой клетчатки и нижележащих тканей.
Литература
1. Jones M.E., Karlowsky J.A., Draghi D.C, Thornsberry C., Sahm D.F., Nathwani D. Epidemiology and antibiotic susceptibility of bacteria causing skin and soft tissue infections in the USA and Europe: a guide to appropriate antimicrobial treatment. Int J Antimicrob Agent 2003; 22:406–19.
2. Н.Н. Мурашкин, М.Н. Глузмина, Л.С. Галустян. Гнойничковые поражения кожи в практике детского дерматолога: свежий взгляд на старую проблему. РЖКВБ: Научно–практический журнал, 2008, №4, с. 67–71.
3. Белькова Ю.А. Пиодермии в амбулаторной практике. Болезни и возбудители. Клиническая микробиология и антимикробная химиотерапия: № 3, том 7, с. 255–270, 2005.
4. Т.А. Белоусова, М.В. Горячкина. Бактериальные инфекции кожи: проблема выбора оптимального антибиотика. РМЖ 2005, том 13, №16, с. 1086–1089.
5. Таха Т.В., Нажмутдинова Д.К. Рациональный выбор антибиотикотерапии при пиодермиях. РМЖ 2008, том 16, №8, с. 552–555.
6. Новоселов В.С., Плиева Л.Р. Пиодермии. РМЖ 2004, том 12, №5, с. 327–335.
7. Масюкова С.А., Гладько В.В., Устинов М.В., Владимирова Е.В., Тарасенко Г.Н., Сорокина Е.В. Бактериальные инфекции кожи и их значение в клинической практике дерматолога. Consilium medicum 2004, том 6, №3, с. 180–185.
8. T. File. Diagnosis and antimicrobial therapy of skin and soft tissue infections. Ohio, USA. Клиническая микробиология и антимикробная химиотерапия: № 2, том 5, с. 119–125, 2003
9. Шляпников С.А., Федорова В.В. Использование макролидов при хирургичесаких инфекциях кожи и мягких тканей. МРЖ,2004.–т.12,№4,с204–207
10. Гучев И.А., Сидоренко С.В, Французов В.Н. Рациональная антимикробная химиотерапия инфекций кожи и мягких тканей. Антибиотики и химиотерапия. 2003, т.48, 10, с.25–31
11. Parsad D., Pandhi R., Dogras S. A guide to selection and appropriate use ofmacrolides in skin infection Am J Clin Dermatol 2003; 4:389–97
12. Яковлев С.В., .Ухтин С.А. Азитромицин: основные свойства, оптимизация режимов применения на основе фармакокинетических и параметров. Антибиотики и химиотерапия. 2003 т. 48, №2. – с. 22–27
13. Туровский А.Б,.Колбанова И.Г Макролиды в лечении инфекций дыхательных путей с позиций ЛОР–врача: «за» и «против» Consilium medicum, 2010г.,№4, том.12, с.11–14.
14. Прохорович Е.А. Азитромицин. От клинической фармакологии к клинической практике. РМЖ 2006, том 14, №7, с. 567–572
15. Бердникова Н.Г. Актуальные аспекты применения азитромицина (Азитрал) в терапии внебольничных пневмоний у взрослых. РМЖ 2006, том 14, №22, с. 1625–1628.
16. Хрянин А.А., Решетников О.В. Макролиды в лечении хламидийной инфекции у беременных (эффективность, безопасность, экономичность). РМЖ 2008, том 16, №1, с. 23–27.
17. Серов В.Н., Дубницкая Л.В., Тютюнник В.Л. Воспалительные заболевания органов малого таза: диагностические критерии и принципы лечения. РМЖ 2011, том 19, №1, с. 46–50.
18. Талашова С.В. Некоторые аспекты применения антибактериальных препаратов в педиатрии на примере макролидов. РМЖ 2009, том 17, №7, с. 464–466
19. Мазанкова Л.Н., Ильина Н.О. Место азалидов в педиатрической практике. РМЖ 2008, том 16, №3, с. 121–125.
20. Соловьев А.М., Поздняков О.Л., Терещенко А.В. Почему азитромицин считается препаратом выбора для лечения урогенитальной хламидийной инфекции. РМЖ 2006, том 14, №15, с. 1160–1164.
21. Гуров А.В., Изотова Г.Н., Юшкина М.А. Возможности применения препарата Азитрал в терапии гнойно–воспалительных заболеваний ЛОР–органов. РМЖ 2011, том 19, №6, с. 405.
22. Klani R. Double–blind, double–dummy comparison of azithromycin and cephalexin in the treatmen of skin and skin structure infection. Eur.J. Clin. Microbiol. Infect.Dis. 1999,Oct. 10 (10) – p.880–84
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
В статье приводится краткое описание анаэробной инфекции, профилактика которой должна осуществляться на всех этапах оказания медицинской помощи, учитывая ее опасность и значимость в повседневной клинической практике.

Анаэробная инфекция – это крайне опасный для жизни и здоровья патологический процесс, причинами которого становятся развитие анаэробной микрофлоры в мягких тканях организма.
Особенностями данного вида инфекции является то, что активизация размножения микроорганизмов наступает лишь при попадании их в среду без доступа кислорода.
Такие условия могут формироваться при попадании микробов в ткани при любом виде ранения.
Потенциально любая рана, проникающая в подкожно-жировую клетчатку может привести к развитию этого вида инфекции. Однако наиболее часто причинами развития данного вида инфекции являются размозженные, огнестрельные, колотые ранения, ожоги и обморожения. При создании благоприятных условий скорость развития инфекции становится настолько быстрой, что без немедленной хирургической помощи состояние больного ухудшается в считанные часы и в большинстве случаев приводит к летальному исходу. Развивающаяся в тканях микрофлора оказывает агрессивное разрушительное воздействие на ткани вызывая их гибель (некробиоз), а также начинает вырабатывать токсины, быстро всасывающиеся в кровь и нарушающие обменные процессы во всех органах и тканях (сердце, легкие, печень, почки) и тем самым замыкая порочный круг развития патологического процесса. Даже при своевременно начатом лечении летальность колеблется в пределах 30-50%. Анаэробные микроорганизмы присутствуют в почве, а так же входят в состав нормальной микрофлоры толстой кишки и вызывают патологический процесс при попадании в рану извне, в момент ранения. Однако отсутствия загрязнения раны почвой, как содержащей большое количество данного вида микроорганизмов носит условный характер, так как спорообразующие микроорганизмы могут присутствовать на коже у здоровых людей не вызывая никаких патологических процессов. Попадание анаэробов в ткани может происходить при оперативных вмешательствах, инвазивных манипуляциях (пункциях, биопсии, экстракции зуба и др.) при нарушении асептики, перфорации внутренних органов, открытых травмах, ранениях, ожогах, укусах животных, синдроме длительного сдавления, криминальных абортах .
Анаэробная инфекция может возникнуть у пациентов любого возраста.
Анаэробные микроорганизмы делятся на облигатные и факультативные: развитие и размножение облигатных анаэробов осуществляется в бескислородной среде; факультативные анаэробы способны выживать как в отсутствии, так и в присутствии кислорода.
Облигатные возбудители анаэробной инфекции делятся на две группы: клостридии и неспорообразующие анаэробы (бактероиды, вейллонеллы, пропионибактерии, пептострептококки, фузобактерии и др.). К факультативным анаэробными бактериями принадлежат кишечная палочка, шигеллы, иерсинии, стрептококки, стафилококки и др.
Симптомы анаэробной инфекции. Независимо от вида возбудителя и локализации очага анаэробной инфекции, различным клиническим формам свойственны некоторые общие черты. В большинстве случаев анаэробная инфекция имеет острое начало и характеризуется сочетанием местных и общих симптомов. Инкубационный период может составлять от нескольких часов до нескольких суток (в среднем около 3-х дней).
Типичным для анаэробной инфекции служит быстрое нарастание симптомов общей интоксикации и позднее проявляющимися местными признаками воспаления вплоть до некробиоза мягких тканей. Резкое, быстрое ухудшение общего состояния больного обычно наступает еще до возникновения местных симптомов. Проявлением эндогенной интоксикации служит высокая лихорадка с ознобами, либо гипотония, выраженная слабость, тошнота, головная боль, заторможенность. Характерны артериальная гипотония, редкое, поверхностное дыхание, учащенный пульс, могут быть замечены синюшность лица, мраморный рисунок на коже, бледность кожных покровов. В зоне развития анаэробной инфекции зачастую возникает интенсивная боль не стихающая даже после приема лекарственных препаратов – при этом в первые часы местных симптомов в данной зоне может быть не замечено. Позднее может появиться грозный симптом – крепитация («хруст снега», при ощупывании пораженной области). Может быть отмечено появление зловонного, сладковатого запаха из раны с геморрагическим окрашиванием, иногда можно заметить выделение пузырьков газа. На развитие гнилостного воспаления также указывает внешний вид раны, окрашивание тканей в серо-зеленый или серо-коричневый цвет, иногда появляются струпы черного цвета.
Течение анаэробной инфекции может быть молниеносным (в течение 1 суток с момента операции или травмы), острым (в течение 3-4 суток), подострым (более 4 суток). Анаэробная инфекция часто сопровождается развитием полиорганной недостаточности (почечной, печеночной, сердечно-легочной), инфекционно-токсического шока, тяжелого сепсиса, являющихся причиной летального исхода.
Первичная диагностика основывается на клинических признаках. В верификации возбудителя ведущая роль принадлежит бактериологическому посеву отделяемого раны или содержимого абсцесса. Наряду с клиническими и лабораторными исследования, выполняется рентгенография, при которой обнаруживается скопление газа в пораженных тканях или полостях.
Лечение. Комплексный подход к лечению анаэробной инфекции включает проведение радикальной хирургической обработки (т.е. удаление всех явно нежизнеспособных тканей и выполнение так называемых «лампасных» разрезов на коже во всей области поражения), интенсивной дезинтоксикационной и антибактериальной терапии. Хирургический этап должен быть выполнен как можно раньше – от этого зависит жизнь больного.
Особенности течения анаэробной инфекции нередко требуют проведения повторных операций, вскрытия формирующихся гнойных карманов, обработки ран ультразвуком и лазером, озонотерапии и т.д. При обширной деструкции тканей может быть показана ампутация конечности. Важнейшими составляющими лечения анаэробной инфекции являются интенсивная инфузионная терапия и антибиотикотерапия препаратами широкого спектра действия, зачастую назначается комплекс из трех антибактериальных препаратов. В рамках комплексного лечения анаэробной инфекции находят свое применение гипербарическая оксигенация, ультрафиолетовое облучение крови, методы экстракорпоральной детоксикации. При необходимости пациенту вводится антитоксическая противогангренозная сыворотка.
В случае выявления случая анаэробной инфекции в лечебном учреждении, последнее закрывается на карантин с обязательной генеральной дезинфекцией всех помещений с последующим контролем сотрудниками санитарно-эпидемиологической службы.
По спектру активности антимикробные препараты делятся на: антибактериальные, антигрибковые и антипротозойные. Кроме того, все антимикробные средства делят на препараты узкого и широкого спектра действия.
К препаратам узкого спектра действия преимущественно на грамположительные микроорганизмы относятся, например, природные пенициллины, макролиды, линкомицин, фузидин, оксациллин, ванкомицин, цефалоспорины I поколения. К препаратам узкого спектра действия преимущественно на грамотрицательные палочки относятся полимиксины и монобактамы. К препаратам широкого спектра действия относятся тетрациклины, левомицетин, аминогликозиды, большинство полусинтетических пенициллинов, цефалоспорины начиная со 2 поколения, карбопенемы, фторхинолоны. Узкий спектр имеют антигрибковые препараты нистатин и леворин (только против кандиды), а широкий – клотримазол, миконазол, амфотерицин В.
По типу взаимодействия с микробной клеткой антимикробные препараты делятся на:
· бактерицидные – необратимо нарушают функции микробной клетки либо ее целостность, вызывая немедленную гибель микроорганизма, применяются при тяжелых инфекциях и у ослабленных больных,
· бактериостатические – обратимо блокируют репликацию или деление клетки, применяются при нетяжелых инфекциях у неослабленных больных.
По кислотоустойчивости антимикробные препараты классифицируются на:
· кислотоустойчивые – могут применяться перорально, например, феноксиметилпенициллин,
· кислотонеустойчивые – предназначены только для парентерального применения, например, бензилпенициллин.
В настоящее время используются следующие основные группы антимикробных препаратов для системного применения.
¨ Лактамные антибиотики
Лактамные антибиотики (табл. 9.2) из всех антимикробных препаратов наименее токсичны, так как, нарушая синтез клеточной стенки бактерий, не имеют мишени в организме человека. Их применение при наличии чувствительности к ним возбудителей является предпочтительным. Наиболее широкий спектр действия среди лактамных антибиотиков имеют карбапенемы, они используются как препараты резерва – только при инфекциях, резистентных к пенициллинам и цефалоспоринам, а также при госпитальных и полимикробных инфекциях.
¨ Антибиотики других групп
Антибиотики других групп (табл. 9.3) имеют различные механизмы действия. Бактериостатические препараты нарушают этапы синтеза белка на рибосомах, бактерицидные – нарушают либо целостность цитоплазматической мембраны, либо процесс синтеза ДНК и РНК. В любом случае они имеют мишень в организме человека, поэтому по сравнению с лактамными препаратами более токсичны, и должны использоваться только при невозможности применения последних.
¨ Синтетические антибактериальные препараты
Синтетические антибактериальные препараты (табл. 9.4) также имеют различные механизмы действия: ингибирование ДНК-гиразы, нарушение включения ПАБК в ДГФК и т.д. Также рекомендуются к применению при невозможности использования лактамных антибиотиков.
¨ Побочные эффекты антимикробных препаратов,
их профилактика и лечение
Антимикробные препараты обладают целым рядом разнообразных побочных эффектов, некоторые из которых могут привести к тяжелым осложнениям и даже к летальному исходу.
Аллергические реакции
Аллергические реакции могут иметь место при применении любого антимикробного препарата. Могут развиться аллергический дерматит, бронхоспазм, ринит, артрит, отек Квинке, анафилактический шок, васкулит, нефрит, волчаночноподобный синдром. Чаще всего они наблюдаются при применении пенициллинов и сульфаниламидов. У некоторых пациентов развивается перекрестная аллергия на пенициллины и цефалоспорины. Зачастую отмечаются аллергии на ванкомицин и сульфаниламиды. Очень редко дают аллергические реакции аминогликозиды и левомицетин.
Профилактике способствует тщательный сбор аллергологического анамнеза. Если пациент не может указать, на какие именно антибактериальные препараты в у него наблюдались аллергические реакции, перед введением антибиотиков необходимо выполнение проб. Развитие аллергии независимо от тяжести реакции требует немедленной отмены вызвавшего ее препарата. В последующем введение даже сходных по химической структуре антибиотиков (например, цефалоспоринов при аллергии на пенициллин) допускается только в случаях крайней необходимости. Лечение инфекции должно быть продолжено препаратами других групп. При тяжелых аллергических реакциях требуется внутривенное введение преднизолона и симпатомиметиков, инфузионная терапия. В нетяжелых случаях назначаются антигистаминные препараты.
Раздражающее действие на путях введения
При пероральном применении раздражающее действие может выражаться в диспепсических явлениях, при внутривенном введении – в развитии флебитов. Тромбофлебиты чаще всего вызывают цефалоспорины и гликопептиды.
Суперинфекция, в том числе дисбактериоз
Вероятность дисбактериоза зависит от широты спектра действия препарата. Наиболее часто возникающий кандидомикоз развивается при применении препаратов узкого спектра через неделю, при применении препаратов широкого спектра – уже от одной таблетки. Однако цефалоспорины относительно редко дают грибковую суперинфекцию. На 1 месте по частоте и тяжести вызываемого дисбактериоза находится линкомицин. Нарушения флоры при его применении могут принять характер псевдомембранозного колита – тяжелого заболевания кишечника, вызываемого клостридиями, сопровождающегося диареей, дегидратацией, электролитными нарушениями, и в отдельных случаях осложняющегося перфорацией толстой кишки. Гликопептиды тоже могут вызвать псевдомембранозный колит. Часто вызывают дисбактериоз тетрациклины, фторхинолоны, левомицетин.
Дисбактериоз требует отмены применявшегося препарата и длительного лечения эубиотиками после предварительной антимикробной терапии, которая проводится по результатам чувствительности микроорганизма, вызвавшего воспалительный процесс в кишечнике. Применяемые для лечения дисбактериоза антибиотики не должны оказывать влияния на нормальную кишечную аутофлору – бифидо- и лактобактерии. Однако при лечении псевдомембранозного колита используется метронидазол или, как альтернатива, ванкомицин. Необходима также коррекция водно-электролитных нарушений.
Нарушение толерантности к алкоголю - свойственно всем лактамным антибиотикам, метронидазолу, левомицетину. Проявляется появлением при одновременном употреблении алкоголя тошноты, рвоты, головокружения, тремора, потливости и падения артериального давления. Пациенты должны быть предупреждены о недопустимости приема алкоголя на весь период лечения антимикробным препаратом.
Органоспецифичные побочные эффекты для различных групп препаратов:
· Поражение системы крови и кроветворения – присущи левомицетину, реже линкосомидам, цефалоспоринам 1 поколения, сульфаниламидам, производным нитрофурана, фторхинолонам, гликопептидам. Проявляется апластической анемией, лейкопенией, тромбицитопенией. Необходима отмена препарата, в тяжелых случаях заместительная терапия. Геморрагический синдром может развиться при применении цефалоспоринов 2-3 поколения, нарушающих всасывание витамина К в кишечнике, антисинегнойных пенициллинов, нарушающих функции тромбоцитов, метронидазола, вытесняющего кумариновые антикоагулянты из связей с альбумином. Для лечения и профилактики используются препараты витамина К.
· Поражение печени – присущи тетрациклинам, которые блокируют ферментную систему гепатоцитов, а также оксациллину, азтреонаму, линкозаминам и сульфаниламидам. Холестаз и холестатический гепатит могут вызвать макролиды, цефтриаксон. Клиническими проявлениями служит повышение печеночных ферментов и билирубина в сыворотке крови. При необходимости применения гепатотоксических антимикробных средств более недели необходим лабораторный контроль перечисленных показателей. В случае повышения АСТ, АЛТ, билирубина, щелочной фосфатазы или глутамилтранспептидазы лечение должно быть продолжено препаратами других групп.
· Поражение костей и зубов характерны для тетрациклинов, растущих хрящей – для фторхинолонов.
· Поражение почек присуще аминогликозидам и полимиксинам, которые нарушают функции канальцев, сульфаниламидам, вызывающим кристаллурию, цефалоспоринам поколения, вызывающим альбуминурию, и ванкомицину. Предрасполагающими факторами являются старческий возраст, заболевания почек, гиповолемия и гипотензия. Поэтому при лечении данными препаратами необходима предварительная коррекция гиповолемии, контроль диуреза, подбор доз с учетом функции почек и массы ткла, Курс лечения должен быть коротким.
· Миокардит – побочный эффект левомицетина.
· Диспепсия, не являющаяся следствием дисбактериоза, характерна при применении макролидов, которые обладают прокинетическими свойствами.
· Различные поражения ЦНС развиваются от многих антимикробных препаратов. Наблюдаются:
- психозы при лечении левомицетином,
- парезы и периферические параличи при применении аминогликозидов и полимиксинов за счет их курареподобного действия (поэтому их нельзя применять одновременно с миорелаксантами),
- головная боль и центральная рвота при использовании сульфаниламидов и нитрофуранов,
- судороги и галлюцинации при использовании аминопенициллинов и цефалоспоринов в высоких дозах, являющиеся результатом антагонизма этих препаратов с ГАМК,
- судороги при применении имипенема,
- возбуждение при использовании фторхинолонов,
- менингизм при лечении тетрациклинами из-за увеличения ими продукции ликвора,
- нарушения зрения при лечении азтреонамом и левомицетином,
- периферическая нейропатия при применении изониазида, метронидазола, левомицетина.
· Поражение слуха и вестибулярные расстройства – побочный эффект аминогликозидов, более свойственный 1 поколению. Так как данный эффект связан с накоплением препаратов, длительность их применения не должна превышать 7 дней. Дополнительными факторами риска являются старческий возраст, почечная недостаточность и одновременное применение петлевых диуретиков. Обратимые изменения слуха вызывает ванкомицин. При появлении жалоб на снижение слуха, головокружение, тошноту, неустойчивость при ходьбе необходима замена антибиотика на препараты других групп.
· Поражения кожи в виде дерматита характерны для левомицетина. Тетрациклины и фторхинолоны вызывают фотосенсибилизацию. При лечении этими препаратами не назначаются физиотерапевтические процедуры, и следует избегать нахождения на солнце.
· Гипофункцию щитовидной железы вызывают сульфаниламиды.
· Тератогенность присуща тетрациклинам, фторхинолонам, сульфаниламидам.
· Возможен паралич дыхательной мускулатуры при быстром внутривенном введении линкомицина и кардиодепрессия при быстром внутривенном введении тетрациклинов.
· Электролитные нарушения вызывают антисинегнойные пенициллины. Особо опасно развитие гипокалиемии при наличии заболеваний сердечно-сосудистой системы. При назначении данных препаратов необходим контроль ЭКГ и электролитов крови. При лечении используют инфузионно-корригирующую терапию и диуретики.
Микробиологическая диагностика
Эффективность микробиологической диагностики, абсолютно необходимой для рационального подбора антимикробной терапии, зависит от соблюдения правил забора, транспортировки и хранения исследуемого материала. Правила забора биологического материала включают:
- взятие материала из области, максимально приближенной к очагу инфекции,
- предотвращение контаминации другой микрофлорой.
Транспортировка материала должна с одной стороны обеспечить жизнеспособность бактерий, а с другой - предотвратить их размножение. Желательно, чтобы материал хранился до начала исследования при комнатной температуре и не более 2 часов. В настоящее время для забора и транспортировки материала используются специальные плотно закрывающиеся стерильные контейнеры и транспортные среды.
В не меньшей степени эффективность микробиологической диагностики зависит от грамотной интерпретации результатов. Считается, что выделение патогенных микроорганизмов даже в малых количествах всегда позволяет отнести их к истинным возбудителям заболевания. Условно патогенный микроорганизм считают возбудителем, если он выделяется из стерильных в норме сред организма или в большом количестве из сред, не характерных для его обитания. В противном случае он является представителем нормальной аутофлоры либо контаминирует исследуемый материал в процессе забора или исследования. Выделение малопатогенных бактерий из нехарактерных для их обитания областей в умеренных количествах свидетельствует о транслокации микроорганизмов, однако не позволяет отнести их к истинным возбудителям заболевания.
Гораздо сложнее бывает интерпретировать результаты микробиологического исследования при высевании нескольких видов микроорганизмов. В таких случаях ориентируются на количественное соотношение потенциальных возбудителей. Чаще значимыми в этиологии данного заболевания бывают 1-2 из них. Следует иметь в виду, что вероятность равной этиологической значимости более чем 3 различных видов микроорганизмов незначительна.
В основе лабораторных тестов на выработку грамотрицательными микроорганизмами БЛРС лежит чувствительность БЛРС к ингибиторам бета-лактамаз, таким как клавулановая кислота, сульбактам и тазобактам. При этом, если микроорганизм семейства энтеробактерий оказывается резистентен к цефалоспоринам 3 поколения, а при добавлении к этим препаратам ингибиторов бета-лактамаз демонстрирует чувствительность, то данный штамм идентифицируется как БЛРС-продуцирующий.
Антибиотикотерапия должна быть направлена только на истинный возбудитель инфекции! Однако в большинстве стационаров микробиологические лаборатории не могут установить этиологию инфекции и чувствительность возбудителей к антимикробным препаратам в день поступления больного, поэтому неизбежным является первичное эмпирическое назначение антибиотиков. При этом учитываются особенности этиологии инфекций различных локализаций, характерные для данного лечебного учреждения. В связи с чем необходимы регулярные микробиологические исследования структуры инфекционных заболеваний и чувствительности их возбудителей к антибактериальным препаратам в каждом стационаре. Анализ результатов такого микробиологического мониторинга необходимо проводить ежемесячно.
Неспорообразующие анаэробы формируют основную массу нормальной микрофлоры организма человека. Например, в кишечнике их численность превосходит таковую всех остальных бактерий примерно в 103. Кроме того, анаэробы присутствуют на слизистой оболочке половых органов и ротоглотки, а также на поверхности кожи.
Анаэробный сепсис
Возбудители анаэробного сепсиса. Возбудитель тяжёлых анаэробных инфекций — Bacteroides fragilis. Наличие бета-лактамазы делает этот микроорганизм устойчивым к действию пенициллина. Кроме того, он вырабатывает протеазу, ДНКазу, гепариназу и нейраминидазу. Возбудитель обладает антифагоцитарной капсулой и угнетает процесс фагоцитоза факультативных микроорганизмов, что в свою очередь приводит к развитию микст-инфекций.
Чаще всего Bacteroides fragilis становится причиной инфекционных осложнений после хирургических вмешательств на органах брюшной полости и малого таза, а также входит в состав микрофлоры, выделяемой при абсцессах мозга, печени и лёгкого.
В ротовой полости обычно обнаруживают Prevotella melaninogenicus и фузобактерии. Они вызывают гингивит, абсцессы в полости рта, воспаление придаточных пазух носа, абсцессы мозга и лёгкого, некротизирующую пневмонию. Наряду с Borrelia vincentii они участвуют в развитии анаэробного целлюлита, ангины Симановского—Плаута-Венсана (язвенно-плёнчатая ангина) и некоторых язвенных заболеваний, например язвенно-некротического стоматита (ангины Людвига).
Peptococcus и Peptostreptococcus — анаэробные грамположигельные кокки, часто выделяемые из образцов тканей человека. Они обычно участвуют в развитии микст-инфекций (стоматологического сепсиса, абсцессов мозга и лёгкого, инфекции мягких тканей, раневых инфекций). Некротизирующий фасцит считают результатом микст-инфекции с участием анаэробных кокков, факультативных стрептококков и, возможно, Staphylococcus aureus. Заболевание быстро прогрессирует и приводит к септицемии и смерти больного.
В редких случаях причиной хронических абсцессов на фоне стоматологического сепсиса, абсцесса лёгкого, перфораций стенки кишечника и инфекций, вызванных длительным нахождением внутриматочных спиралей в полости матки, становятся актиномицетоподобные бактерии. Для их эрадикации назначают длительный курс лечения пенициллином.
Патогенез анаэробного сепсиса. Инфекции, вызванные анаэробными микроорганизмами, в большинстве случаев носят эндогенный характер. Они возникают при попадании представителей нормальной микрофлоры в стерильные среды организма (например, при перфорации толстой кишки). Условия, необходимые для роста анаэробов, могут возникнуть вследствие ишемии (при ущемлении грыжи). Кроме того, факультативные анаэробы самостоятельно создают себе необходимые условия посредством определённых реакций метаболизма (например, в глубоких язвах кожи, внутрибрюшных инфекциях).
При развитии анаэробной инфекции рост микроорганизмов стимулируют выделяемые ими протеолитические ферменты и токсичные продукты метаболизма. Кроме того, интоксикация организма факторами воспаления (например, активными формами кислорода) приводит к усилению повреждения тканей в очаге воспаления и способствует дальнейшему распространению инфекции. При отсутствии лечения анаэробный сепсис быстро прогрессирует, развивается септикопиемия и наступает смерть пациента.
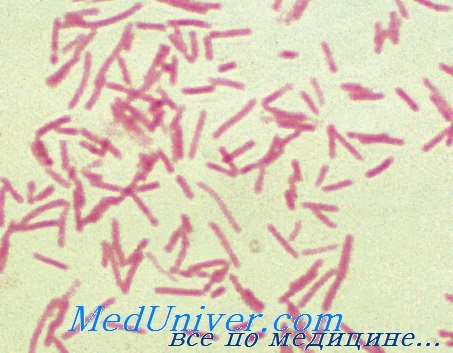
Причина анаэробного сепсиса - Bacteroides fragilis
Клиническая значимость анаэробного сепсиса
Генерализованный внутрибрюшной сепсис может стать следствием спонтанной перфорации стенки кишечника или повреждения её во время хирургической операции и приводит к формированию абсцесса (абдоминального, печёночного и др.).
В возникновении сепсиса половых путей у женщин ключевую роль играют неспорообразующие анаэробы. Заболевание вторично и развивается на фоне септического аборта, осложнений после кесарева сечения или вследствие разложения плодных оболочек и напрямую связано с воспалительными заболеваниями органов малого таза. Дисбаланс анаэробной микрофлоры влагалища может спровоцировать развитие неспецифического вагиноза.
Очень часто анаэробы участвуют в формировании полимикробного абсцесса печени, поражении желчевыводящих систем и развитии сепсиса.
Анаэробные инфекции могут возникать на фоне аспирационной пневмонии, связанной с обструкцией дыхательных путей инородным телом или карциномой. При этом часто отмечают образование абсцесса лёгкого.
Абсцесс мозга как осложнение гнойного синусита и хронического среднего отита может развиться вследствие анаэробной инфекции. Кроме того, возбудители могут размножаться в хронических кожных язвах нижних конечностей у пожилых пациентов. Fusobacterium ulcerans вызывают развитие менее распространённых тропических язв.
Лабораторная диагностика анаэробного сепсиса
Анаэробные бактерии достаточно требовательны к условиям культивирования. Кислород губителен для них. При невозможности быстрого посева исследуемого материала (сразу после отбора проб) его необходимо доставлять в лабораторию в специальных анаэробных контейнерах. Для анализа лучше отбирать пробы гноя (обычный мазок быстро высыхает). Посев материала осуществляют на обогащенные жидкие питательные среды (бульон Робертсона и др.) и среды, содержащие кровь, некоторые содержат антибиотики для подавления роста аэробных бактерий.
Чашки с посевами необходимо инкубировать в строгих анаэробных условиях.
Идентификация возбудителей основана на исследовании культуральных, биохимических и морфологических свойств (мазок окрашивают по Граму) возбудителя, а также на изучении продуктов его метаболизма с помощью газожидкостной хроматографии.
Чувствительность анаэробов к антибиотикам
Практически все анаэробы чувствительны к действию метронидазола, но в последнее время отмечают появление резистентных штаммов. Другие эффективные препараты — меропенем, пиперациллин + тазобактам, клиндамицин, хлорамфеникол, пенициллин и эритромицин. Важно отметить, что для эрадикации Bacteroides fragilis (микроорганизма, часто выделяемого при абдоминальном сепсисе) не используют пенициллин и эритромицин.
Лечение анаэробного сепсиса
Эффективность лечения анаэробных инфекций зависит от успешности проведения хирургической операции и назначения полноценной антимикробной терапии. Хирургическое вмешательство проводят для ушивания перфораций, резекции гангренозных грыж, иссечения некротических тканей при язвах, дренирования абсцесса и лечения сопутствующих заболеваний. В качестве антимикробного препарата чаще всего применяют метронидазол.
Профилактика анаэробного сепсиса. Тщательная подготовка к операции и назначение соответствующих антибиотиков (эффективных против анаэробов) помогают снизить риск возникновения анаэробных инфекций вследствие хирургического вмешательства.
Видео патофизиология сепсиса
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Вернуться в раздел "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

