Можно ли заводить ребенка при герпесе
Обновлено: 17.05.2024
Л.А.МАРЧЕНКО, доктор медицинских наук, ведущий научный сотрудник отделения гинекологической эндокринологии. Герпетическая инфекция нередко является причиной гибели зародыша. Ее последствия могут привести к возникновению у плода пороков развития.
Вагинальные инфекции относятся к разряду наиболее часто встречающихся заболеваний нижнего отдела полового тракта. Патологические выделения из влагалища являются симптомом более 20 заболеваний, поэтому первоначально правильно установленный этиологический диагноз во многом не только определяет успех лечения, но и является гарантом отсроченных осложнений.
В последние годы наряду с общеизвестными микроорганизмами, вызывающими специфические и неспецифические инфекционные заболевания половых путей, все чаще диагностируются поражения, обусловленные вирусной инвазией гениталий, среди которых, несомненно, важная роль принадлежит вирусу простого герпеса (ВПГ).
Различают два типа ВПГ. Большинство вирусов составляет 2-ю, антигенную группу - ВПГ-2, которые преимущественно вызывают генитальную патологию, ВПМ вызывают экстрагенитальные поражения.
Пути передачи. Эпидемиология
Генитальный герпес (ГГ) относится к заболеваниям, передающимся половым путем (ЗППП).
Заражение может происходить в случае, когда у партнера, являющегося источником инфекции, на половых органах имеются типичные герпетические высыпания (рецидив заболевания) или, что особенно важно, когда он выделяет вирус, не имея при этом клинических симптомов заболевания (атипичная форма, или бессимптомное вирусоносительство).
Инфицирование возможно также при орогенитальных контактах. Бытовой путь переноса инфекции встречается крайне редко и полностью исключается, если секрет, содержащий вирус, высыхает.
Генитальный герпес может вызываться вирусом и 1-го и 2-го типа.
Известно, что степень распространенности ВПГ-2 инфекции зависит от пола обследуемых, числа их сексуальных партнеров, возраста, низкого образовательного уровня и этнической принадлежности. Исследования в 10 развитых странах показали, что серопозитивными на ВПГ-2 являются 107 млн. человек, при этом частота инфицирования в США составляет от 22 до 33%, в Европе - от 7 до 24%, в странах Индокитая - до 6%. Ситуация с инфицированием ГГ в России остается во многом крайне неясной, так как, хотя ГГ и отнесен в группу ЗППП, учет заболеваемости ведется плохо. Согласно проведенным в 1994 г. эпидемиологическим исследованиям на примере закрытой популяции в Москве, частота инфицирования генитальным герпесом составляет 19,7%. Выявлено два ее возрастных пика - 16-24 года и 35-40 лет. Женщины в 1,7 раза чаще инфицируются ВПГ-2, чем мужчины, подобных половых различий в инфицировании экстрагенитальным герпесом не выявлено.
Многие исследователи считают, что истинная ситуация в мире в отношении роста заболеваемости ГГ в достаточной мере не контролируется в связи со значительным процентом его асимптомных форм. Частота последних составляет 40-74%.
Нередко психосоциальные последствия ГГ бывают более выраженными и значимыми, чем физические страдания, связанные с частыми обострениями заболевания. ГГ, безусловно, влияет на качество жизни пациентов, т.к. уже с момента обращения к врачу перед ними возникает ряд психологических и медицинских проблем, среди которых ведущая роль принадлежит следующим: страх обнаружения вируса, депрессия; влияние на сексуальную и интимную жизнь; снижение социальной активности и изменение образа жизни; отношение к ГГ, как к болезни, передающейся половым путем; страх заразиться или быть зараженным; страх быть отвергнутым обществом; боязнь быть неизлеченным и т.д.
Клиника. Диагностические критерии
По особенностям клинических проявлений инфекции ГГ разделяют на типичный и атипичный.
Инкубационный период в среднем составляет 3-9 дней, в течение которых экспрессия вируса минимальна.
Острый период заболевания при типичной форме инфекции характеризуется обширными эрозивно-язвенными высыпаниями на слизистой больших и малых половых губ, промежности, влагалища, шейки матки. Ему всегда предшествует продромальный период, сопровождающийся субъективными ощущениями в виде боли, зуда, жжения, парестезий в области гениталий, а также общей симптоматикой - недомогание, озноб, лихорадка и т.д. При этом в 13-35% случаев наблюдается асептический менингит с тошнотой, рвотой, онемением затылка, головной болью. Все эти симптомы самостоятельно проходят с появлением высыпаний, в 10-15% отмечается фарингостоматит.
Довольно часто при первичном эпизоде заболевания отмечается поражение мочевой системы, проявляющееся от незначительной дизурии до стойкой задержки мочеиспускания, обусловленной отеком и резкой болезненностью в области уретры в результате обширных герпетических язв или вовлечения в воспалительный процесс слизистой оболочки мочевого пузыря и уретры.
Для ГГ характерна фиксированность очагов высыпания. В зависимости от локализации последних выделяют следующие стадии поражения:
I - наружные гениталии;
II - влагалище и шейка матки;
III - матка и область придатков.
Однако подобная стадийность весьма условна. После первичного эпизода заболевания под влиянием провоцирующих факторов периодически возникают рецидивы инфекции.
Анализ провоцирующих факторов показал, что наиболее часто обострение возникает на фоне стресса (78%); переутомления (56%); менструации (50%), перенесенной простуды (24%), в то время как ультрафиолетовое облучение, физические нагрузки и употребление алкоголя встречаются, соответственно, в 12, 10 и 6% случаев.
При ГГ рецидивы возникают в 50-75% случаев, что значительно выше показателей обострения при экстрагенитальной инфекции. Это объясняется особенностями антигенной структуры вируса 2-го типа.
Частота рецидивов у многих пациентов с годами снижается. Однако довольно часто после длительной ремиссии возникает период учащения рецидивов.
В зависимости от частоты обострений выделяют три степени тяжести ГГ:
тяжелое течение - ремиссии от нескольких дней до 6 недель;
средней тяжести - ремиссии от 2 до 3 месяцев;
легкое - ремиссии не менее 4 месяцев.
Клиническая картина рецидивов хронической генитальной герпетической инфекции разнообразна. В 50-85% случаев ей сопутствует продромальный период в виде чувства жжения, зуда, болезненности в очаге поражения. В 25% случаев выявляется болевой синдром - боль иррадиирует в ногу, пах, ягодицу. В 10% случаев появляются лимфаденит, общее недомогание, озноб.
В 70% случаев во время рецидива визуализируются микроскопические везикулезно-язвенные очаги, при рецидиве не обнаруживаются какие-либо патологические изменения, и обострение бывает трудно диагностировать без дополнительных лабораторных методов исследования. Рецидив протекает, как правило, легко, продолжительность высыпаний не превышает 3-5 дней, после чего слизистые или кожные покровы полностью эпителизируются.
Диссеминация ГГ наблюдается крайне редко, только в случаях тяжелой сопутствующей инфекции либо у больных с выраженным наследственным или приобретенным иммунодефицитом.
Диагностическим критерием наличия ГГ во многом являются местные проявления заболевания. Однако при атипичных формах отсутствует манифестный признак инфекции - сгруппированные везикулы, наполненные серозной жидкостью, трансформирующиеся в эрозии и язвы, что в значительной степени затрудняет постановку диагноза. Отдует особо подчеркнуть, часто подобный тип течения ГГ характерен в значительном проценте случаев с самого начала заболевания, поэтому первичный эпизод инфекции ретроспективно выявить бывает крайне трудно.
В настоящее время в 40-75% случаев ГГ протекает атипично - без появления характерных герпетических высыпаний, включая первичный эпизод заболевания.
На основании многолетних наблюдений и соотношения жалоб с данными вирусологических исследований нами были разработаны клинические критерии, позволяющие в большинстве случаев подтвердить герпетическую природу заболевания при атипичных формах инфекции. Ведущими среди них являются стойкий зуд и жжение вульвы и влагалища; кольпиты, не поддающиеся традиционной антибактериальной терапии; рецидивирующие эрозии и лейкоплакии шейки матки; привычное невынашивание беременности; стойкий вегетативный тазовый ганглионеврит (см. рис.).
СЕМИОТИКА АТИПИЧНОЙ ФОРМЫ ГЕНИТАЛЬНОГО ГЕРПЕСА
Значение этих критериев чрезвычайно важно для выявления групп инфицированных. Необходимо информирование больных о часто встречающихся атипичных симптомах заболевания в связи с возможностью бессимптомной передачи инфекции. Согласно данным отдельных исследователей, только 20% инфицированных ВПГ имеют диагностированный симптоматический герпес, 60% - нераспознанный симптоматический ГГ (атипичную форму) и 20% - бессимптомный герпес.
К четвертому, относительно редко встречающемуся варианту течения инфекции относят бессимптомный герпес, или вирусоносительство, при котором нет никаких клинических проявлений инфекции, однако в образцах слизи из цервикального канала или в мазках-отпечатках с половых органов выявляется вирус герпеса.
Знание этих вариантов течения инфекции важно для разработки тактики ведения беременных, страдающих ГГ.
Существует три основных механизма инфицирования плода ВПГ-2:
- вирусы из влагалища и шейки матки могут проникать к плодному яйцу восходящим путем или эмбрион может быть инфицирован во время имплантации инфицированной спермой;
- трансплацентарный переход вирусов к плоду при наличии их в крови беременных;
- заражение плода при прохождении через инфицированные родовые пути.
Последствиями герпетической инфекции являются гибель зародыша, пороки развития (микроцефалия, хориоретинит, дисплазия сетчатки, микрофтальмия, помутнение хрусталика, пороки сердца, гепатоспленомегалия, поражение отдельных органов и систем).
При ведении пациенток с генитальным герпесом врачу необходимо ставить перед собой следующие цели:
- купирование симптомов;
- проведение профилактики последствии инфекции и ее передачи половому партнеру и новорожденному.
Риск внутриутробного заражения плода ВПГ определяется совокупностью факторов - вариантом клинического течения ГГ (первичный эпизод заболевания или рецидив), особенностями клинической картины (типичное, атипичное или бессимптомное течение инфекции), продолжительностью контакта плода с инфицированными родовыми путями матери и стадией герпетических высыпаний.
При совпадении первичного эпизода заболевания ГГ с I или III триместром беременности в 40-50% случаев наблюдается либо мертворождение, либо рождение ребенка с врожденным поражением мозга (микроцефалия и другие аномалии). Поэтому, согласно рекомендациям ВОЗ, при первичном эпизоде заболевания, особенно в случае первичной инфекции в I триместре, целесообразно беременность прервать.
При рецидивирующем герпесе риск инфицирования плода составляет всего О-8%, что объясняется пассивной передачей материнских антител, более низкими титрами вируса и более коротким периодом его воздействия. В этих случаях беременность следует сохранить.
Наибольшую значимость в плане возможного инфицирования плода имеют атипично протекающие формы хронической ге-нитальной герпетической инфекции. В 70% случаев дети с неонатальным герпесом рождаются именно от матерей с атипичными или бессимптомными формами ГГ, при том, что частота бессимптомного носительства ВПГ-2 составляет в различных популяциях 0,5-8%. Смертность новорожденных от неонатального герпеса в этой группе составляет 50-70%; из выживших новорожденных здоровыми остаются только 15%.
Таким образом, становятся понятны социальная значимость для нашей страны проблемы генитальной герпетической инфекции и ее неблагоприятный вклад в заболеваемость и перинатальные потери.
Для установления нормального контакта между врачом и пациентом необходимо:
- неосуждение со стороны врача;
- вовлечение пациента в управление своей болезнью;
- возможность больного получить лучшее из доступного на текущий момент лечение.
Принципы современной терапии
К базисному виду терапии относится прежде всего комплекс противовирусного лечения - длительная блокада репродукции вируса современными химиопрепаратами, на фоне которых следует проводить стимуляцию неспецифической и специфической резистентности организма. Необходимо подчеркнуть, что лечение всегда целесообразно подбирать индивидуально и в каждом конкретном случае выбор медикаментозного комплекса определяется клинической формой инфекции, фазой заболевания (рецидив или ремиссия), иммунологическим состоянием пациента, предшествующим лечением и его эффективностью, наличием сопутствующих заболеваний (особое внимание необходимо уделять аллергоанамнезу).
Идеальный противовирусный препарат должен обладать селективным и специфическим механизмом действия, не быть токсичным (мутагенным, тератогенным, канцерогенным), не иметь побочных эффектов, не вызывать резистентность. Препарат должен характеризоваться хорошей биодоступностью, не взаимодействовать с другими лекарствами и иметь удобный режим дозирования.
Наиболее безопасным вариантом химиотерапии оказалось создание синтетических аналогов какого-либо структурного компонента (нуклеозид) герпес-вирусной ДНК, который избирательно фосфорилируется не клеткой, а вирусспецифическим ферментом - тимидинкиназой.
К наиболее широко используемым в мировой клинической практике аномальным нуклеозидам относятся ацикловир (зовиракс, виролекс), валацикловир (валтрекс), фамцикловир (пенцикловир), ганцикловир и т.д. К аналогам пирофосфата относится триаптен. К препаратам с другим механизмом действия (специфические ингибиторы) - бонафтон, алпизарин, флакозид, хелипин, флореналь.
Чаще всего для лечения генитального герпеса используют ацикловир (АЦ), обладающий высокой степенью сродства и селективности в отношении герпес-вирусов.
Ацикловир проникает преимущественно в зараженные ВПГ клетки, однако в неизмененном виде инертен и малотоксичен, прежде чем стать активным, он должен фосфорилироваться.
Существует две методики лечения рецидивирующей герпетической инфекции АЦ: эпизодическое лечение каждого обострения и продолжительная супрессивная терапия с целью предотвращения рецидивов. Выбор режима терапии определяется клиническим вариантом инфекции (первичный эпизод или рецидив) и степенью ее тяжести, а также проблемой передачи инфекции в случае, если один из партнеров серонегативен, и при планировании беременности.
В последние годы в России в качестве химиопрепарата широко использовался алпизарин. Проведенное сравнительное исследование лечебного и профилактического эффекта алпизарина и зовиракса при тяжелом течении ГГ показало, что прием зовиракса в режиме супрессивной терапии по 800 мг в сутки способствовал стойкой ремиссии у 73% больных, в то время как прием алпизарина вызывал подобный эффект только в 19% случаев. Профилактический эффект зовиракса более чем в 5 раз превосходит эффект алпизарина по восстановлению качества жизни больных.
Однако биодоступность перорально вводимого ацикловира составляет всего 15-21 %, поэтому в течение последних 10 лет с целью повышения его эффективности разрабатывались различные аминокислотные эфиры ацикловира.
Всего было синтезировано более 18 аминокислотных эфиров. Валацикловир (L-валиловый эфир) показал биодоступность, равную 63%. В отличие от ацикловира валацикловир (валтреке) под влиянием фермента валацикловиргидролазы хорошо всасывается в кишечнике и быстро метаболизируется в печени, полностью превращаясь в ацикловир. Фармакокинетика и токсические свойства валацикловира идентичны таковым для ацикловира.
В клинической практике (особенно при лечении привычного невынашивания беременности) нередко возникает необходимость одновременно проводить профилактику как генитального герпеса, так и ЦМВ-инфекции. Использование в этих случаях валтрекса в значительной степени облегчает задачу врача, так как наиболее специфичный для ЦМВ-инфекции химиопрепарат ганцикловир оказывает выраженный гепатотоксический эффект и вызывает гипоплазию костного мозга.
Более высокие концентрации ацикловира в плазме как конечного продукта введения валацикловира позволяют также использовать его в случаях инфицирования больных резистентными штаммами герпес-вируса. Поддержание высоких уровней ацикловира в плазме при лечении валацикловиром позволяет уменьшить кратность приема препарата и способствует лучшему его усвоению.
В режиме эпизодической терапии валтрекс следует назначать по 500 мг 2 раза в день в течение 5 дней. Для профилактики рецидивов инфекции - по 100 мг один раз в сутки в течение 4-6 месяцев. За безопасностью применения ацикловира и его аналогов наблюдают с 1982 года. Подобная программа принята и для валацикловира. Наиболее частыми побочными эффектами являются головная боль, тошнота, диарея. Однако они не выражены.
Высокой биодоступностью (77%) обладает и фамцикловир (диацетил-6 - дезоксипроизводное пенцикловира). Пенцикловир имеет сходный, но не аналогичный ацикловиру спектр действия, включающий вирус ветряной оспы, ВПГ-1, ВПГ-2, а также вирус гепатита В. Фамцикловир превращается в пенцикловир при всасывании и пассаже через печень, последний активируется вирусной тимидинкиназой. Фамцикловир хорошо переносится, однако в дозе в 50 мг раз выше, чем терапевтическая повышает риск развития аденокарциномы груди у мышей.
Однако ни ацикловир, ни другие противовирусные агенты - фамцикловир, валацикловир - не предотвращают ни перехода вируса в латентное состояние, ни возникновения рецидивов после их отмены, ни передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции в плане полного излечения. Поэтому на протяжении последних 20 лет ученые изыскивают методы непосредственного воздействия на иммунную систему больных ГГ с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса. Одним из перспективных подходов профилактики и лечения герпес-вирусных заболеваний являются применение препаратов иммуноглобулинов человека и вакцинотерапия.
Наличие герпеса сильно влияет на зачатие как у мужчин, так и у женщин.
ВПГ очень часто передается при помощи половых контактов.
Среди вирусных инфекций ВПГ одна из самых распространенных.
Женщина становится беременной от мужчины, у которого бессимптомный герпес, всего лишь на пять процентов реже, чем от здорового мужчины.
Но женщине, у которой обнаружили вирус простого герпеса, забеременеть в два раза сложнее, чем герпес-негативной женщине.
По статистике, каждый девятый из десяти человек во всем мире инфицирован герпесом.

Инфицированность уменьшаться не будет, она ежегодно только растет.
Герпес во время зачатия
Герпес очень негативно влияет на зачатие.
Если герпес возник во время беременности, то за беременной всё время нужно наблюдать, чтобы не допустить заражения плода.
Лучше не проводить естественные роды, а сделать кесарево сечение, чтобы не допустить вертикального заражения во время родов.
Именно так чаще всего заражается герпесом ребенок.
Зачатие при герпесе на губах
При банальном герпесе на губах первого типа тоже можно заразиться и зачать ребенка.
У герпеса первого типа четыре стадии проявлений.
Первая стадия развития этого герпеса проявляется зудом и дискомфортом на губах, в носу или в других областях лица, при общем ухудшении самочувствия и повышенной температуре.
На второй стадии возникает воспаление на лице или на губах, характеризующееся припухлостью и болезненностью зоны поражения на губах, в частности, и на лице, вообще.
Образуются пузырьки, заполненные жидкостью серозного характера.
Спустя некоторое время эти пузырьки лопаются, и из них выходит серозный секрет, в котором содержится много ВПЧ.
На этой стадии человек очень заразен в бытовом плане при поцелуях.
Образуется изъязвленная раневая поверхность.
На четвёртой стадии изъязвления покрываются струпьями (корочками), они кровят и болезненны при дотрагивании.
Так что существует опасность заразится банальным герпесом, даже во время зачатия ребенка, особенно на третьей стадии его развития.
Генитальный герпес и зачатие
Не менее опасен для будущего ребенка и генитальный герпес ВПГ-2.
Необходимо всячески укреплять иммунную систему, чтобы ослабить проявления вирусной инфекции.
Это касается любого вируса, как лабиального, так и генитального.
Так как от герпеса нельзя на сегодняшний момент избавиться полностью, необходимо максимально повысить эффективность иммунной системы для борьбы с вирусом.
Поскольку ВПГ представляет немалую опасность для будущего ребенка.
Про это нужно помнить всегда и планировать зачатие во время хорошей работы иммунной системы и ремиссии вируса.
Влияние герпеса на сперматозоиды, сперму, секрет простаты
Герпес оказывает очень негативное воздействие на репродуктивные органы мужчины и может привести к мужскому бесплодию.
Проводились специальные эксперименты, которые показали, что герпесвирусная инфекция негативно влияет на сперматозоиды, сперму и секрет простаты.

Такие исследования позволяют не только сделать теоретические выводы.
Но, и зная о негативном влиянии вируса герпеса на репродуктивные органы мужчины, можно продуктивно их лечить с помощью противовирусной терапии и пить иммуномодуляторы.
Влияние герпеса на зачатие детей у женщин
Герпес очень негативно влияет и на женский организм.
Что нужно делать женщине во время беременности?
Во-первых, провести анализы, чтобы выяснить, если ли антитела в организме беременной.
Дело в том, что плацентарный барьер не всегда срабатывает.
Это даст информацию об инфицированности герпесом в прошлом и состоянии иммунной системы на сегодняшний момент.
Если антител в крови нет или их еще очень мало, а вирус активно действует, это представляет огромную опасность для правильного развития ребенка.
Если инфицирования не было, то нужно исключить любую возможность заразиться.
А если беременная женщина уже заражена вирусом герпеса, то нужно повышать статус иммунной системы и не допускать обострения заболевания и всяческих осложнений.
Особенно опасно заражение в третьем триместре беременности.
У ребенка может поражаться мозг или он вообще может родиться мертвым.
При бессимптомном протекании заболевания беременная женщина зачастую даже не знает свой диагноз, потому что не сделала анализ и, естественно, не лечится.
Если обостряется герпес за три-четыре недели до родов, то можно заразить ребенка вертикальным путём.
В таком случае проводится кесарево сечение.
Если мать была заражена до беременности, то у нее в крови много антител и риски для плода минимальные.
Если обострение уже есть, то нужно хорошенько пролечиться.
При наличии генитального герпеса до беременности необходимо делать УЗИ, чтобы контролировать правильность развития ребенка.
Некоторая патология в развитии плода видна только при достижении определенных сроков и этапах развития ребенка в матке.
Проводить лечение нужно только у специалиста, самолечения нельзя допускать.
Это очень плачевно может закончиться.
Какие типы герпеса влияют на зачатие
ВПГ-1 и ВПГ-2 представляют опасность и влияют на зачатие ребенка.
По статистике, не только женщины виноваты в бесплодии.
Иногда, в 25-30% случаев, в бесплодии виноваты мужчины.
И герпес здесь играет не последнюю роль.
Но даже экстракорпоральное оплодотворение у вирус-позитивных женщин под действием герпеса чаще бывает неудовлетворительным и отрицательным.
Носительницам вируса простого герпеса забеременеть намного проблематичней, чем не зараженным вирусной инфекцией женщинам.
Влияет ли герпес зостер на зачатие
У вируса зостер очень большая степень заразности, до девяноста процентов.
Влияет он негативно и на зачатие.
Симптоматика заражения этим вирусом такова, что в первую очередь поражаются чувствительные нервы.
На коже, по их ходу, чаще в грудной области, образуются нечеткие высыпания, в виде розовых пятен три-пять сантиметров в диаметре.
На месте пятен спустя сутки формируются болезненные везикулы.
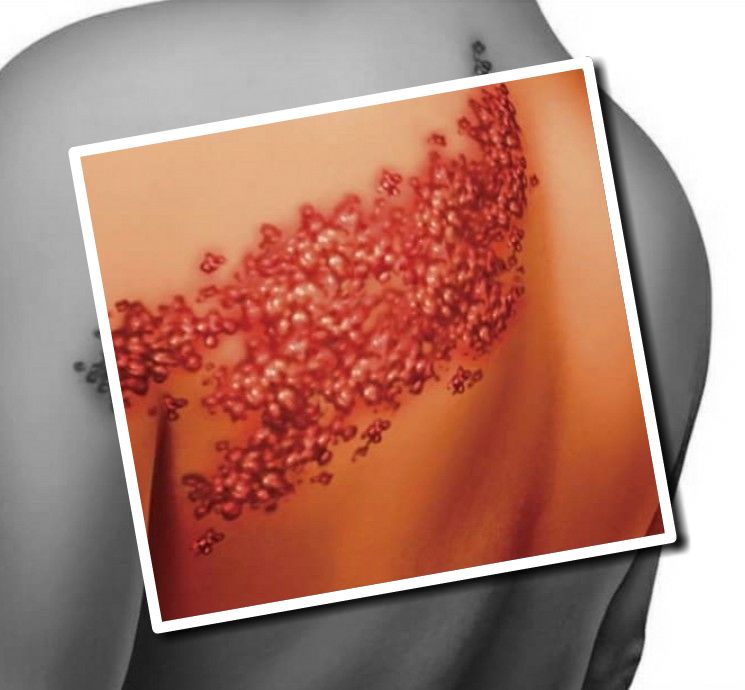
У взрослых возникший опоясывающий лишай, вызванный вирусом зостер, грозит развитием энцефалита и пневмонии.
У детей вирус зостер проявляется ветрянкой, которая, по мнению многих исследователей, приводит к рецидивированию во взрослом состоянии в виде опоясывающего лишая.
Зачатие и инкубационный период герпеса
Заражение вирусом простого герпеса может произойти во время инкубационного периода тем более, что вирус себя еще никак не проявил, и человек даже не знает, что инфицирован.
В этот период он может зачать ребенка.
Наличие у него вируса не исключает возможности заразить и партнера, поскольку он уже заразен, как и при клинических проявлениях герпетической инфекции.
Зачатие при герпесе и ВИЧ-инфекции
Зачатие при герпесе у ВИЧ-инфицированных тоже может быть затруднено.
Хотя наличие гематоплацентарного барьера не позволяет плоду заразиться ВИЧ-инфекцией от матери.
Если плацента не повреждена, то вполне возможно сохранение здоровья ребенка.
С тридцать второй недели беременности через плаценту в кровяное русло младенца поступают материнские антитела против ВИЧ-инфекции.
Но они не защищают организм.
Их титр только учитывают, если ребенок родится инфицированным ВИЧ.
Профилактика заражения герпесом плода при зачатии
Зачатие - необходимый этап для зарождения новой жизни.
От того, насколько оно будет правильным, зависит здоровье будущего ребенка.
Для того чтобы снизить риски заражения герпесом, так как от него нельзя избавиться полностью, нужно максимально повысить иммунную защиту у матери и отца будущего ребенка.
Необходимо, чтобы герпес себя никак не проявлял, и у матери и отца было только носительство, без явно выраженных признаков герпеса.
При таком течении герпес позволяет не заражать малыша.
Медикаментозная профилактика при зачатии на фоне герпеса
При ВПГ-1 можно заразиться при оральных половых контактах и даже поцелуях.
От больного с генитальным герпесом проще всего заразиться при обычных генитальных сексуальных контактах.
Профилактика таких заражений заключена в отказе от поцелуев и половых сношений с такими инфицированными людьми.
Профилактическими методами считают использование натуральных биодобавок для повышения качества иммунной защиты.
Принципы такой профилактики и терапии лежат в разумном сочетании местных воздействий и общих принципов, чтобы повысить иммунную защиту.
Такими лекарствами считаются препараты ацикловира.

Также жидкие экстракты брусники, клюквы и можжевельника, масло чёрного тмина, полынь, чабрец и чеснок.
Лекарственные препараты и побочные эффекты от них, влияющие на зачатие
Более тридцати препаратов оказывают тератогенное действие и приводят к патологиям в развитии плода, а значит, могут повлиять и на процесс зачатия.
Особенно опасны антибиотики.
На фоне их применения зачатие рекомендуется отложить до периода, когда антибиотикотерапия закончится, тем более, если лечение антибиотиками длительное.
Приём таких препаратов приводит к эмбриолетальному действию, к порокам и аномалиям на этапах внутриутробного развития и просто к токсическому эффекту.
Только врач решает, какие препараты можно применять, а от приема каких лучше воздержаться.
Осложнение герпеса, влияющие на зачатие
От герпеса у людей со слабой иммунной системой могут быть всевозможные осложнения.
Одним из осложнений считают наличие ВИЧ-инфекции, конечно, она влияет даже на желание зачать ребенка.
И хоть герпес не влияет на репродуктивные органы, если больной герпесом человек болеет в придачу менингоэнцефалитом, эзофагитом, гепатитом или пневмонией, то это не приносит ему желания зачать ребенка.
Зачем вакцина от герпеса при зачатии
Вакцина от герпеса помогает не заболеть герпесом.

Есть определенные правила ее применения.
Если применять вакцину конкретно при зачатии, то она не даст должного эффекта.
Вакцину нужно применять по схеме.
Это должен рассказать лечащий врач.
У какого врача консультироваться по поводу зачатия на фоне герпеса
Обычно лечением больных с герпесом занимаются дерматовенерологи, гинекологи, урологи, иммунологи или инфекционисты.
В зависимости от пола больного герпесом и его состояния.
Они и проконсультируют по всем вопросам, связанным с герпесом, в том числе расскажут и про зачатие при герпетической инфекции в организме.
Ведут приём врачи в специализированных лечебных учреждениях или отделениях.
Вообще, герпес не самый благоприятный фон для зачатия новой жизни, но иногда приходиться идти на этот шаг.
Ведь не зачинать же ребенка от здорового, но чужого мужчины?
Эффективность уколов и таблеток от герпеса при зачатии
Эффективность зачатия определяется тем, насколько активно организм борется с герпетической инфекцией.
Для усиления иммунной защиты проводят серию инъекций альфа-интерферонами.

Инъекции подкожные по три миллиона международных единиц, по три раза на неделю, в течение шести недель.
Затем в течение восьми недель еще два укола в неделю.
Это позволит создать благоприятный климат для эффективной борьбы с герпесом.
Также применяются противовирусные препараты, лечатся ацикловиром или валацикловиром, фоскарнетом, фамцикловиром или бривудином.
Механизм действия у них схожий.
Также повышают иммунную защиту бета-интерферонами.
При герпесе эффективны и иммуноглобулины.
Также лечатся индуктором интерферона – циклофероном.
Проводят лечение инъекциями по два с половиной грамма в количестве десяти инъекций.
Для диагностики и лечения герпеса обращайтесь к автору этой статьи – дерматовенерологу в Москве с многолетним опытом работы.
Вирусы, относящиеся к семейству герпесвирусов, очень широко распространены в природе. Они могут вызывать заболевания различных видов диких и домашних животных. В настоящее время известно более 100 герпесвирусов, 8 из них выделены от человека. Герпесвирусы способны пожизненно персистировать в организме человека и вызывать заболевания с многообразными клиническими проявлениями. Внешне сходство герпесвирусов настолько велико, что под электронным микроскопом их практически невозможно различить. Индивидуальность «родственников» начинает проявляться только тогда, когда дело доходит до антигенных свойств вирионных белков и степени гомологии ДНК. Характерной чертой, помогающей электронно-микроскопическому распознаванию вируса, является наличие большой оболочки, хотя в препаратах также могут присутствовать и безоболочные вирусы.
Герпесвирусы человека и основные клинические формы инфекций
Вирус простого герпеса (ВПГ) 1 и 2 типов
ВПГ проникает в организм человека через повреждённые кожные покровы и слизистые оболочки. В первой фазе патогенеза вирус внедряется в клетки эпителия (слизистой полости рта, глотки или половых органов), где происходит его размножение.На слизистых и коже появляются характерные для герпетической инфекции папулы и везикулы.
Во второй фазе патогенеза ВПГ проникает в чувствительные нервные окончания и по центростремительным нервным волокнам в паравертебральные ганглии. В ядрах нейронов происходит репликация вируса. По эфферентным нервным волокнам вирус вновь достигает кожи и слизистых оболочек, где распространяется с появлением новых высыпаний.
В третьей фазе патогенеза (2-4 недели после заражения) при нормальном иммунном ответе происходит разрешение первичного заболевания и элиминация ВПГ из тканей и органов. Однако в паравертебральных ганглиях возбудитель в латентном состоянии сохраняется в течение всей жизни человека.
В четвертой фазе патогенеза происходит реактивация размножения ВПГ и его перемещение по нервным волокнам к месту первичного вхождения (воротам инфекции) с рецидивом специфического инфекционно-воспалительного процесса и возможной диссеминацией инфекции.
Генитальный герпес (ГГ)
Вирус простого герпеса персистирует у мужчин в мочеполовом тракте, а у женщин - в канале шейки матки, влагалище и уретре. Лица с бессимптомным течением заболевания являются резервуаром инфекции. Заражение генитальным герпесом происходит, в основном, при половом контакте. В период вирусемии у беременных женщин заражение плода происходит гематогенным путем, во время родов - контактным. По клинико-морфологическим проявлениям генитальный герпес подразделяется на 4 типа.
- Первый клинический эпизод первичного генитального герпеса - истинное проявление первичной герпетической инфекции. На половых органах развиваются отёк, гиперемия, затем появляются везикулярные высыпания, как правило, обильные. Везикулы быстро лопаются, образуя эрозивные, эрозивно-язвенные поверхности. Всё это сопровождается чувством жжения, зудом, мокнутием, болезненностью.
- Первичный клинический эпизод при существующей герпетической инфекции характеризуется первичным клиническим проявлением на фоне серопозитивности к вирусу простого герпеса. Вся симптоматика при этом менее выражена, чем при первом типе.
- Рецидивирующий генитальный герпес. Реактивация герпесвирусов происходит обычно в первые несколько месяцев после первичного эпизода заболевания. Проявления рецидивирующего генитального герпеса могут быть различными: от бессимптомного выделения вирусов или лёгких симптомов до очень болезненных сливных изъязвлений с четкими границами.
- Атипичный герпес встречается примерно в 20% всех случаев генитального герпеса и характеризуется тем, что специфические проявления герпетической инфекции скрыты симптоматикой сопутствующих местных инфекционных заболеваний (чаще всего кандидоза).
Неонатальный герпес
Наиболее часто (85%) инфицирование новорожденного происходит интранатально (при прохождении родового канала), независимо от того, имеются в данный момент очаги повреждения в области шейки матки и вульвы или нет (при бессимптомном выделении вируса). Возможно и постнатальное инфицирование новорожденного при наличии герпетических проявлений у матери и медперсонала, при использовании для ухода за новорожденными инфицированного инструментария. Трансплацентарное поражение плода ВПГ может привести к прерыванию беременности, врождённые пороки встречаются редко. Инфицированные дети часто рождаются недоношенными, с малым весом. Бессимптомная инфекция ВПГ, часто встречающаяся у более старших детей, редко наблюдается у новорожденных. Неонатальный герпес проявляются в трёх клинических формах:
1. Локальная, с повреждением кожи и слизистых.
2. Локальная форма с поражением ЦНС.
3. Диссеминированная форма герпетической инфекции с поражением ЦНС, печени, легких, надпочечников, ДВС-синдромом.
При герпетической инфекции в результате вирусемии в процесс могут вовлекаться несколько органов одновременно. Возможно развитие герпетического эзофагита, пневмонита, гепатита, Поражение периферической нервной системы может протекать в виде ганглионита, ганглионеврита, радикулоневрита, полинейропатии. Поражение центральной нервной системы при герпетической инфекции наиболее часто протекает в виде энцефалита или менингоэнцефалита.
Лабораторная диагностика: вирусологические методы обнаружения и идентификации вирусов простого герпеса; методы выявления антигенов вирусов простого герпеса - иммунофлюоресцентный и иммуноферментный анализ; полимеразная цепная реакция (ПЦР); цитоморфологические методы; выявление антител с помощью ИФА; методы оценки иммунного статуса. Материал для исследования берется в зависимости от локализации поражений (содержимое везикул, соскоб клеток, спинномозговая жидкость, аспират из бронхов, биоптат, кровь.
Лечение: противогерпетические препараты.
Вирус varicella-zoster
Уже из самого названия возбудителя можно догадаться, что он вызывает два типа поражений - ветряную оспу (varicella) и опоясывающий лишай (zoster). Основные пути передачи вируса - воздушно-капельный и контактный (через отделяемое везикул). Дети могут заболеть ветряной оспой при тесном контакте с больным опоясывающим лишаем.
Ветряная оспа. Вирус попадает в дыхательные пути, где происходит его репликация; иногда вирус инвазирует лимфатические узлы, вызывая первичную вирусемию. Клинически проявляется как острое инфекционное заболевание, сопровождающееся лихорадкой и пятнисто-везикулярной сыпью на коже и слизистых оболочках. Первично проявляется в виде мелкой пятнистой сыпи, трансформирующейся затем в папулёзную и везикулярную; характерен ложный полиморфизм сыпи. В период реконвалесценции пузырьки подсыхают с образованием корочек и заживлением без образования дефектов.
Диагностика: выделение культуральным методом, микроскопия (клетки Цанка), серологические методы (определение антител к вирусным белкам).
Лечение: при ветряной оспе в большинстве случаев симптоматическое, при опоясывающем лишае - противогерпетические препараты.
Профилактика. Разработана живая вакцина против ветряной оспы, рекомендованная для введения детям старше 1 годa.
Вирус Эпштейн-Барр (ВЭБ)
Эпидемиология. Единственный резервуар инфекции - человек. Основной путь передачи - воздушно-капельный, реже трансмиссивный или половой.
В раннем возрасте инфекцию сопровождают стёртые проявления, либо она бывает вообще бессимптомной; первичное инфицирование в подростковом или более старшем возрасте может вызвать заболевание, известное как инфекционный мононуклеоз. Патогенез инфекционного мононуклеоза включает репликацию вируса в верхних отделах дыхательных путей и ассоциированной лимфоидной ткани с развитием местных воспалительных реакций и лихорадочного состояния. Возбудитель индуцирует появление популяции реактивных Т-клеток (атипичные лимфоциты), а также поликлональную активацию В-клеток и их дифференцировку в плазмоциты, секретирующие гетерофильные AT с низким аффинитетом к вирусу, но реагирующие с различными субстратами, включая эритроциты различных животных. При этом геном вируса может сохраняться в В-лимфоцитах в латентной форме. Значительно реже выявляют хроническую персистенцию вируса, известную как реактивированная хроническая ВЭБ-инфекция. Состояние представлено множеством форм и встречается достаточно редко; среди них чаще наблюдают синдром хронического мононуклеоза (характерны жалобы на постоянную слабость при наличии или отсутствии каких-либо изменений лабораторных показателей). Хроническая активная ВЭБ инфекция обычна для пациентов с иммунодефицитами (наиболее часто со СПИДом и реципиентов трансплантатов). Наиболее часто проявляется прогрессирующим лимфопролиферативным заболеванием либо лимфомами ЦНС. Способность возбудителя вызывать злокачественную трансформацию клеток даёт основание предполагать участие вируса (как коканцерогена) в развитии болезней злокачественного роста, таких как африканские формы лимфомы Беркетта, карцинома носоглотки у мужчин некоторых этнических групп Южного Китая, а также саркома Капоши у пациентов со СПИДом.
Механизмы развития злокачественных трансформаций, индуцированных ВЭБ, связаны со способностью инфицировать В-лимфоциты и нарушать их дальнейшую дифференцировку; при этом часть вирусного генома экспрессируется в инфицированных лимфобластах.
Диагностика: обнаружение атипичных мононуклеаров в крови, серологические методы, ПЦР.
Лечение: при инфекционном мононуклеозе, как правило, симптоматическое; вирус чувствителен к ряду противогерпетических препаратов.
Цитомегаловирусная (ЦМВ) инфекция
Вирус проникает в организм через слюну при поцелуях и через секреты гениталий при половых контактах, через грудное молоко и при использовании нестерильного шприца, при трансплантации органов и переливании донорской крови, при использовании донорской спермы и яйцеклеток. Предполагают, что главным хранилищем вирусов являются мононуклеарные фагоциты - моноциты и макрофаги, а так же эпителиоциты слюнных желез и почечных канальцев, гепатоциты и некоторые другие клетки.
Заражение цитомегаловирусом может произойти ещё в период внутриутробного развития плода. Необходимым условием заражения плода является вирусемия беременных. Если плод заразился этим вирусом в утробе матери, то это будет врождённая цитомегаловирусная инфекция. У таких детей может быть желтуха, увеличиваются печень и селезёнка, могут быть тяжёлые врождённые пороки, иногда несовместимые с жизнью. Инфекция может протекать и бессимптомно, но у 5-25% таких детей в последующие несколько лет может наблюдаться снижение слуха, нарушения психики, могут появиться аномалии глаз. Если ребёнок заражается во время или через небольшой промежуток времени после рождения, то он плохо прибавляет в весе, у него может развиться гепатит, анемия, появится сыпь.
В подростковом возрасте цитомегаловирусная инфекция может проявить себя в виде мононуклеоза. При этом заболевании поднимается температура, появляются боли в мышцах, развивается быстрая утомляемость. У людей с иммунодефицитом инфекция протекает обычно тяжело.
Цитомегаловирусная инфекция является частым спутником СПИДа. При этом поражаются многие внутренние органы, что может закончиться смертью больного. Основные симптомы: лихорадка, недомогание, отсутствие аппетита, боли в мышцах, кашель. При поражении тонкого кишечника могут возникать язвы, которые, в свою очередь могут кровоточить или перфорировать (в стенке желудка или кишечника появится сквозное отверстие). Ретинит (поражение сетчатки глаза), вызванный цитомегаловирусом, может привести к слепоте. У человека с нормальным иммунитетом цитомегаловирусная инфекция никак себя не проявляет и может не давать о себе знать всю жизнь. После пересадки органов и костного мозга активная цитомегаловирусная инфекция обычно развивается в первые четыре месяца после операции и очень часто является причиной заболеваний, и даже смерти реципиентов. Источником инфекции может стать реактивация собственного ЦМВ или повторное заражение реципиента через донорские органы, переливание крови и ее компонентов. Существует предположение, что ЦМВ-инфекция играет определённую роль в патогенезе острых и хронических реакций трансплантата против хозяина.
Диагностика: выделение вируса из мочи (тропен к ткани почек), микроскопия (клетки в виде «глаза совы»), серологические методы, ПЦР.
Лечение: современные противогерпетические препараты - ациклические нуклеозиды - обладают высокой специфичностью и неплохо себя зарекомендовали в лечении цитомегаловирусных инфекций. В последние годы обнаружены штаммы ЦМВ, имеющие двойную устойчивость к ганцикловиру и фоскарнету.
Вирус герпеса 6 типа (ВГ-6)
Клинические проявления инфекции ВГ-6:
а) В-клеточная лимфома. В 80-90% случаев В-клеточных лимфом в трансформированных клетках выделяют интегрированные фрагменты ДНК, гомологичные геному вируса, что даёт основания рассматривать его как возможный этиологический агент.
б) Розеола детская (внезапная), или ложная краснуха - острая вирусная инфекция детей младшего возраста, вызванная ВГ-6; характерны внезапный подъём температуры, лихорадка (иногда с судорогами) и критическое разрешение через несколько дней с появлением пятнисто-папулёзной сыпи.в)
в) Синдром хронической усталости. Относительно недавно выделен в самостоятельную нозологическую единицу; основание для установления этиологической роли ВГ-6 - выявление специфических антител в сыворотке пациентов. Однако это положение остаётся предметом дискуссии, т.к. эти антитела можно выявить у 90% здоровых лиц.
Диагностика: выделение на культуре клеток, иммунологические методы, микроскопия.
Лечение: лечение симптоматическое, получены данные об эффективности ганцикловира.
Вирус герпеса 7 типа (ВГ-7)
Свойства вируса: растет медленно, лишь на CD4 лимфоцитах человека, которые имеют клеточные рецепторы к этому вирусу. Вирус определяется в периферической крови и слюне. Очень часто у людей с вирусом герпеса 7 типа выделяют вирус герпеса 6 типа.
Вызывает заболевания: является возможной причиной синдрома хронической усталости (Chronic Fatigue Syndrome, CFS). Полагают, что вирус герпеса человека 7 типа может быть причиной лимфопролиферативных заболеваний.
Проявления заболевания: синдром хронической усталости можно заподозрить по совокупности ряда признаков: беспричинная слабость, повышенная плаксивость; высокая утомляемость; повышенный уровень тревожности; депрессии; нарушение сна (фазы засыпания). На утро чувство разбитости; температура 36,9-37,3 гр. Цельсия в течение 6 месяцев; беспричинное увеличение лимфоузлов - лимфоаденопатия.
Диагностика: полимеразная цепная реакция (ПЦР), иммуноферментный анализ (ИФА); иммунограмма, на которой можно отметить: снижение NK (естественные киллеры), увеличение CD8 лимфоцитов, ЦИК, IgG; анализ личности больного (симуляция).
Лечение: симптоматическое. Проводится невропатологом или психиатром. Заключается в противовирусной терапии и лечении, направленном на укрепление иммунитета.
Профилактика: не разработана.
Вирус герпеса 8 типа (ВГ-8, HHV8)
ДНК этого вируса постоянно обнаруживается в ткани СПИД-ассоциируемой саркомы Капоши, в то время как в нормальной ткани соседних участков не выявляется. Было установлено, что HHV8 связан со всеми типами саркомы Капоши, включая эндемическую у африканцев, классическую у пожилых людей средиземноморья и трансплантат-связанную. Показано, что за 3-10 лет развитию саркомы Капоши предшествует инфекция, вызванная HHV8. С помощью ПЦР одни авторы вирус обнаруживали в семенной жидкости и сперме, хотя другие этого не подтвердили. HHV8 был выявлен в эндотелиальных клетках, циркулирующих CD20 + лимфоцитах (В-клетки), носовом секрете, бронхоальвеолярной леважной жидкости у больных с легочной локализацией саркомы Капоши.
Клиника. Классическая форма проявляется в виде локализованных узлов коричнево-красного - синюшно-красного цвета с локализацией преимущественно на коже нижних конечностей. Выделяют следующие стадии заболевания: кожные проявления, локализованное торпидное течение (классическое), кожные проявления, локализованное агрессивное течение с увеличением или без увеличения лимфатических узлов (африканский локализованный агрессивный вариант), генерализованные кожные проявления и/или поражение лимфатических узлов (африканская лимфаденопатия и эндемический вариант), висцеральные проявления (эпидемический вариант).
Лечение. Сегодня имеется достаточно много химиопрепаратов, рекомендуемых для лечения саркомы Капоши у больных СПИДом, хотя эффект от терапии не всегда удовлетворителен, применяются так же хирургическое и лучевое лечение.
Для цитирования: Тютюнник В.Л., Зайдиева З.С., Алиева С.А. Подготовка и планирование беременности при герпетической инфекции. РМЖ. 2005;1:28.
В настоящее время во многих странах мира, в том числе и в России, отмечен рост инфекций, передаваемых половым путем, которые прочно занимают ведущее место в структуре акушерско–гинекологической заболеваемости. Чаще всего половая инфекция бывает обусловлена несколькими патогенными факторами – вирусами, микробами, грибами, простейшими, которые вызывают похожие по клиническому течению, но различные по патогенезу и методам лечения заболевания.
Среди вирусных поражений урогенитального тракта женщин наиболее распространены герпетическая, цитомегало– и папилломавирусная инфекции, в связи с чем Европейским региональным бюро ВОЗ они внесены в группу болезней, которые определяют будущее инфекционной патологии.
В возникновении герпетических заболеваний половых органов основная роль принадлежит вирусу простого герпеса, единственным резервуаром которого являются зараженные им люди, которые распространяют его среди населения. Попав в организм человека, вирус простого герпеса сохраняется в нем на протяжении всей жизни, периодически вызывая заболевания различной степени тяжести.
Учитывая, что генитальный герпес относится к пожизненно персистирующим инфекциям, существует несколько видов клинических проявлений. Рецидивы заболевания наступают в результате периодически возникающего иммунодефицита у практически здоровых людей под влиянием провоцирующих факторов. Рецидивирующий характер генитальный герпес приобретает у трети инфицированных людей. Заражение вирусом простого герпеса возможно не только в острой стадии заболевания, но и в стадии глубокой ремиссии.
Генитальный герпес относится к заболеваниям, передаваемых половым путем (в 99,9% случаев). Аутоинокуляция может наблюдаться в тех случаях, когда больной сам переносит вирус из очага инфекции на незараженные части тела. Вертикальный путь передачи возможен в случае трансплацентарного инфицирования плода. Возбудителю этой инфекции отводится определенная роль в этиологии спонтанных абортов и преждевременных родов, а также в нарушении эмбриогенеза и врожденной патологии новорожденных и др., что считается результатом внутриутробной вирусной инфекции.
Знание принципов отбора пациентов, нуждающихся в углубленном обследовании с целью верификации диагноза генитального герпеса, позволяет в значительной мере повысить эффективность профилактических мероприятий, направленных на предупреждение осложненного течения беременности, а также внутриутробной инфекции.
Работы, посвященные вопросам подготовки к беременности женщин с хронической рецидивирующей герпетической инфекцией, крайне малочисленны и направлены, как правило, на коррекцию отдельных звеньев патологического состояния.
Исходя из вышеизложенного, важнейшим и неотъемлемым этапом является правильная предгравидарная подготовка этих женщин. Поэтому проведение мероприятий по борьбе с инфекцией необходимо начинать до наступления беременности.
Общеизвестно, что лечение герпетической инфекции должно быть своевременным, этиотропным и комплексным. При выявлении генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисных видов терапии (комплекс противовирусного лечения), так и лечение сопутствующих герпесу заболеваний.
Основными задачами противогерпетической терапии являются:
• уменьшение клинических проявлений инфекции;
• предупреждение рецидивов;
• предупреждение передачи инфекции половому партнеру или новорожденному.
Стратегия лечения больных с рецидивирующим герпесом определяется рядом факторов: частотой рецидивов и тяжестью клинических симптомов (на основании субъективной оценки больного), состоянием иммунной системы, психосоциальными особенностями, наличием риска передачи инфекции половому партнеру или новорожденному, а также экономическими аспектами терапии. В настоящее время существует два варианта терапии генитального герпеса с использованием аналогов нуклеазидов: эпизодическая и превентивная (супрессивная) терапия.
Накопленный нами опыт подготовки к беременности женщин с генитальным герпесом показывает, что одним из современных и самых эффективных противовирусных препаратов является Алпизарин – противовирусное средство, получаемое из травы копеечника. Препарат активен в отношении ДНК–содержащих вирусов (Herpes simplex I и II типа, Varicella zoster, в меньшей степени – цитомегаловируса и вируса иммунодефицита человека). Алпизарин ингибирует репродукцию вируса простого герпеса на ранних этапах его развития, подавляет бактериальную нуклеазу без выраженного ингибирующего действия на вирусную нейраминидазу, оказывает умеренное бактериостатическое действие в отношении грамположительных и грамотрицательных бактерий, простейших и микобактерий туберкулеза. Препарат обладает иммуностимулирующим действием в отношении клеточного и гуморального иммунитета, индуцирует продукцию g–интерферона в клетках крови.
Абсорбция Алпизарина – высокая, время наступления Cmax – 1–3 ч, препарат хорошо проникает в органы и ткани печени, почек, сердца, селезенки; через 12 ч обнаруживается в небольшом количестве в тканях мозга, выводится почками и через желудочно–кишечный тракт.
Показаниями к применению препарата являются: инфекции кожи и слизистых оболочек, вызванные вирусами Herpes simplex и Varicella zoster.
Алпизарин назначают внутрь (независимо от приема пищи) по 0,1–0,2 г 3–4 раза в сутки в течение 5–10 дней. Одновременно назначают местные аппликации 5% мази на кожу и 2% мази – на слизистые оболочки. Мазь наносят на пораженные участки кожи без повязки 2–6 раз в сутки. Терапевтическое действие более выражено при его использовании в ранние сроки заболевания. Длительность лечения – 10–30 дней. При рецидиве курс повторяют. При острых и рецидивирующих формах простого герпеса экстрагенитальной локализации при единичных высыпаниях мазь наносят на очаг поражения 2–3 раза в день в течение 3–5 сут. В случае распространенных высыпаний, а также при наличии лихорадки, лимфаденопатии назначают одновременно внутрь и в виде мази в течение 5–14 дней. При генитальном герпесе 2% мазь наносят на пораженные участки 4–6 раз в день в течение 7–10 сут, при рецидивирующем течении заболевания – дополнительно внутрь в течение 5–14 сут. Для профилактики рецидивов простого герпеса назначают пероральный курс через 1 мес после окончания лечения и затем в межрецидивные периоды курсами по 10–14 дней.
Эпизодическая терапия подразумевает пероральный прием препаратов в момент обострения инфекции. Такой метод терапии показан больным с редкими, клинически невыраженными обострениями и при наличии четко определяемого продромального синдрома, во время которого следует начинать прием препаратов. Применение во время рецидива генитального герпеса Алпизарина по 0,2 г 4 раза в сутки в течение 5 дней значительно уменьшает болевые ощущения и дискомфорт в зоне поражения, сокращает время заживления герпетических высыпаний на 1–2 дня и период вирусовыделения.
Супрессивная терапия показана больным с редкими, но тяжелыми рецидивами, в дискордантных по генитальному герпесу парах с целью профилактики передачи инфекции, при наличии выраженных психосоциальных и психосексуальных реакций на рецидивы, а также при значительном влиянии инфекции на качество жизни больного. Препараты применяют ежедневно в непрерывном режиме в течение длительного времени. При проведении превентивной (супрессивной) терапии Алпизарин назначают по 0,2 г 4 раза в сутки.
Важным условием правильной подготовки к беременности является нормализация иммунного и интерферонового статуса больной. Поэтому на фоне блокады репликации вируса перспективным направлением профилактики и лечения герпетической инфекции является стимуляция неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
Так как наличие очагов хронической инфекции сопровождается нарушением процессов энергетики и метаболизма на клеточном, тканевом и органном уровнях, предгравидарная подготовка должна обязательно включать метаболическую терапию. С этой целью назначают комплекс препаратов, стимулирующих биоэнергетические процессы в клетках и тканях – метаболическую терапию, состоящую из 2–х комплексов лечения:
I комплекс (с 8–9–го дня по 13–14–й день менструального цикла):
1. Кокарбоксилаза по 0,1 г 1 раз внутримышечно или бенфотиамин по 0,01 г 3 раза в сут.
2. Рибофлавин мононуклеотид по 1–2 (0,005–0,01 г) табл. 3 раза в сут. или 1 мл внутримышечно 1 раз в сут.
3. Пантетонат кальция по 1 табл. 3 раза в сут. или 20% раствор 2 мл внутримышечно 1 раз в сут.
4. Липоевая кислота по 1 (0,025 г) табл. 3 раза в сут. или 0,5% раствор 4 мл внутримышечно 1 раз в сут.
5. a–токоферола ацетат по 1–2 (0,05–0,1 г) капсуле 3 раза в сут. или 1 мл внутримышечно.
II комплекс (с 15–го дня по 22–й день менструального цикла):
1. Рибоксин по 0,2 г 3 раза в сут.
2. Пиридоксин по 1 (0,02 г) табл. 3 раза в сут.
3. Фолиевая кислота по 1 (0,001 г) табл. 3 раза в сут.
4. Оротат калия по 1 (0,5 г) табл. 3 раза в сут.
5. a–токоферола ацетат по 1–2 (0,05–0,1 г) капсуле 3 раза в сут. или 1 мл внутримышечно.
Метаболическую терапию назначают в течение 3 месяцев подряд до наступления беременности.
Иммуно– и интерферонокорригирующую и антибактериальную терапию целесообразно проводить на фоне приема энзимопрепаратов. Основанием для применения системной энзимотерапии является ее иммуномодулирующий и противовоспалительный эффект, способность ограничивать проявления аутоиммунных процессов, нормализация микроциркуляции. Кроме того, применение ферментативного комплекса способствует более глубокому проникновению антибиотиков в очаг воспаления.
При проведении вышеизложенной терапии возможно одновременное или последовательное использование пассивной иммунизации специфическими противогерпетическими иммуноглобулинами в титре 1:320 или 1:640. Пациентам с острыми проявлениями генитального герпеса специфический противогерпетический иммуноглобулин назначали по 2 дозы с интервалом в 3–4 дня на курс 5 внутримышечных инъекций.
Для профилактики рецидивов герпетической инфекции может также применяться вакцинотерапия. В настоящее время все существующие вакцины подразделяются на живые, инактивированные (цельновирусные и субъединичные) и рекомбинантные. Теоретической предпосылкой для использования вакцинотерапии при генитальном герпесе явилось предположение о возможности усиления специфического противогерпетического иммунитета на фоне повторного введения вирусного антигена. Вакцина представляет собой выращенный на культуре клеток куриного эмбриона и инактивированный формалином вирус простого герпеса 1–го и 2–го антигенного типа. Важной методологической особенностью использования вакцины является ее применение с целью профилактики рецидивов заболевания только в периоде затухания острых его явлений, что позволяет получить стойкий противорецидивный эффект. Поэтому вакцину следует назначать сразу после курса химиопрепаратов и иммуноглобулинов.
Помимо лечения герпетической инфекции, показано проведение дополнительной терапии. Лечение скрыто протекающего хронического воспалительного процесса в эндометрии (вирусно–бактериальной этиологии) должно проводиться на фоне базисной терапии и быть этиотропным и патогенетически обоснованным. Учитывая превалирование анаэробно–аэробных ассоциаций, а также мико– уреаплазменной и хламидийной инфекций, показано использование антибиотиков широкого спектра действия.
Таким образом, планирование и подготовка к беременности возможны только при стойкой и длительной (более 6 месяцев) ремиссии герпетической инфекции, а также после устранения нарушений в репродуктивной системе с учетом основных факторов прерывания беременности. Проведение ранней диагностики, профилактики и лечения инфекционной патологии репродуктивной системы женщин до наступления беременности, предгравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, тяжелые формы неонатальной инфекции, перинатальную заболеваемость и смертность.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

