Гистология при базалиоме кожи
Обновлено: 23.05.2024
Базальноклеточная карцинома — это наиболее распространенная форма рака кожи среди жителей России. По различным статистическим сведениям на ее долю приходится до 75% всех эпителиальных немеланомных новообразований кожи.
Чаще всего базалиома кожи имеет наружную локализацию, в частности — область лица и волосистой части головы, что обусловлено рядом факторов, способствующих ее развитию.
На первом месте среди них выступает повреждающее действие инсоляции на открытые участки тела. В зоне риска оказываются любители позагорать в солярии.
При наличии генетической предрасположенности — светлой коже с многочисленными родинками — солнечное облучение является травмирующим фактором, который провоцирует клетки на самообновление. Частое повреждение клеток вызывает потерю контроля организма над процессами восстановления, что в свою очередь является начальным этапом онкопроцесса.
Кожные инфекции, хронические дерматозы, иммунодефицит различного происхождения также способствуют развитию базалиом.
Особенностью данного заболевания является редкая частота метастазирования, но при этом инвазивный рост с разрушением окружающих тканей определяет агрессивность течения.
Базалиома — начальная стадия
Для начальной стадии базалиомы характерна разнообразная клиническая картина. Различают следующие формы базально-клеточного рака кожи (виды):
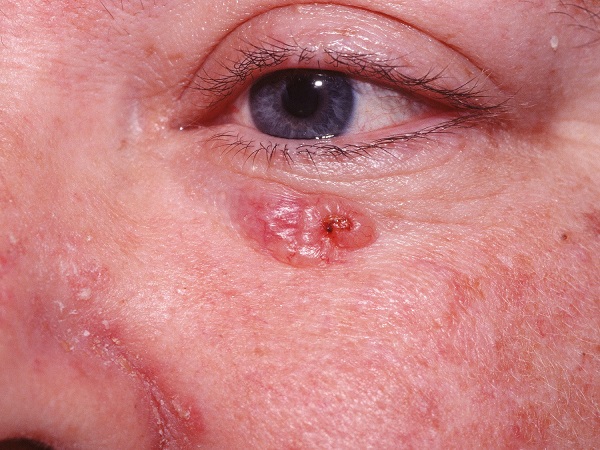
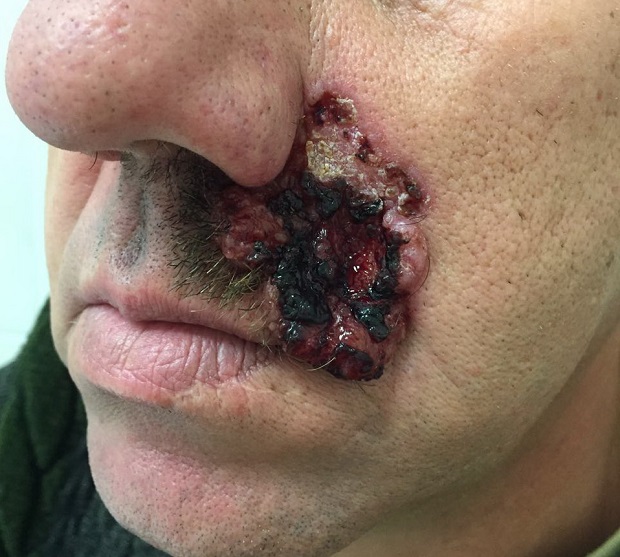
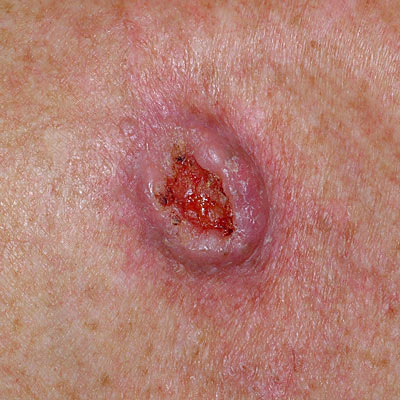
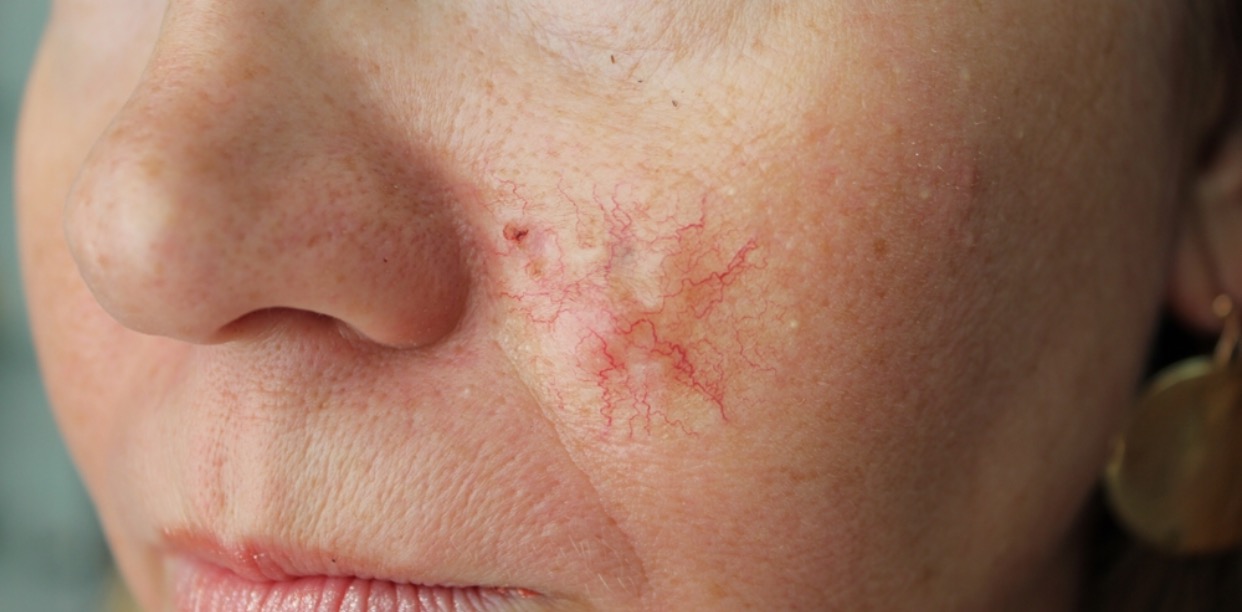
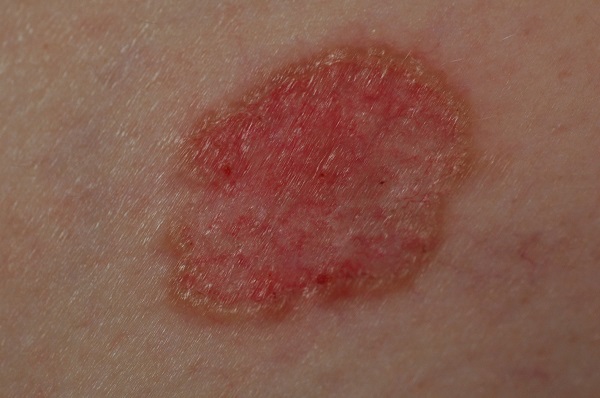
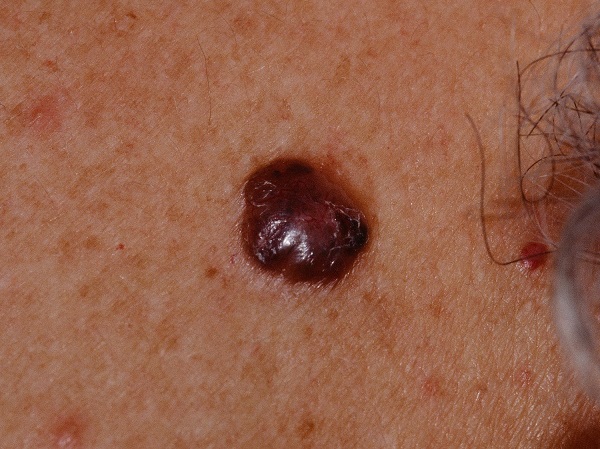
Несмотря на наличие кожного дефекта, пациенты с начальной стадией опухоли базалиомы из-за боязни услышать страшный диагноз «онкология» надолго откладывают свой визит к врачу. Именно от того, насколько своевременно начнется лечение заболевания рак кожи, зависит прогноз выживаемости и продолжительность жизни пациента с базалиомой.
Часто злокачественные опухоли кожи, в том числе базалиома, появляются на месте существующей на коже родинки, которая много лет никак не беспокоила человека. Если родинка была травмирована и изменилась, следует обраться к дерматологу. Бывает, что родинки начинают меняться без каких-то видимых причин: расти, терять волосяной покров, изменять цвет, зудеть и т.п.
К настораживающим симптомам также следует отнести язвы в области кожи и слизистой рта. Они могут привести к злокачественной опухоли в области рта или на слизистой оболочке губ.
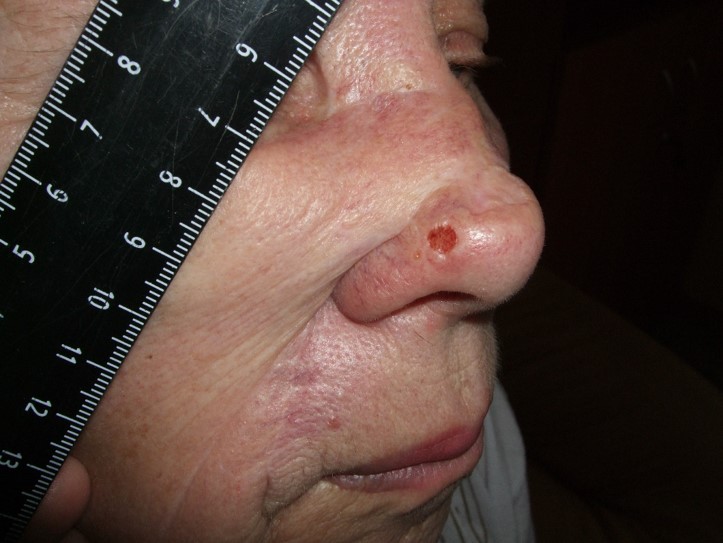
Как выглядит базалиома до и после лечения можно увидеть на фото:
До
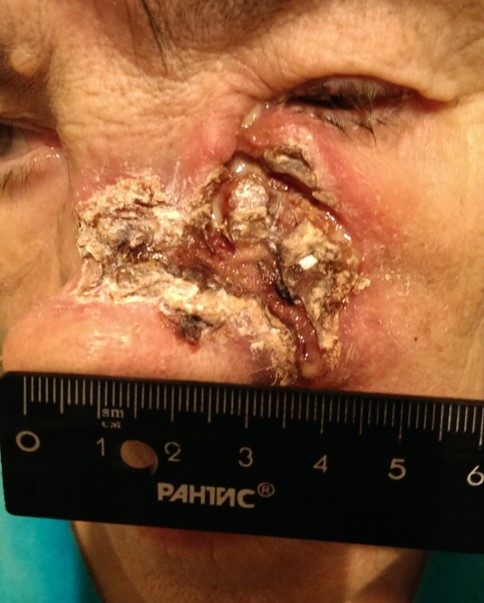
После
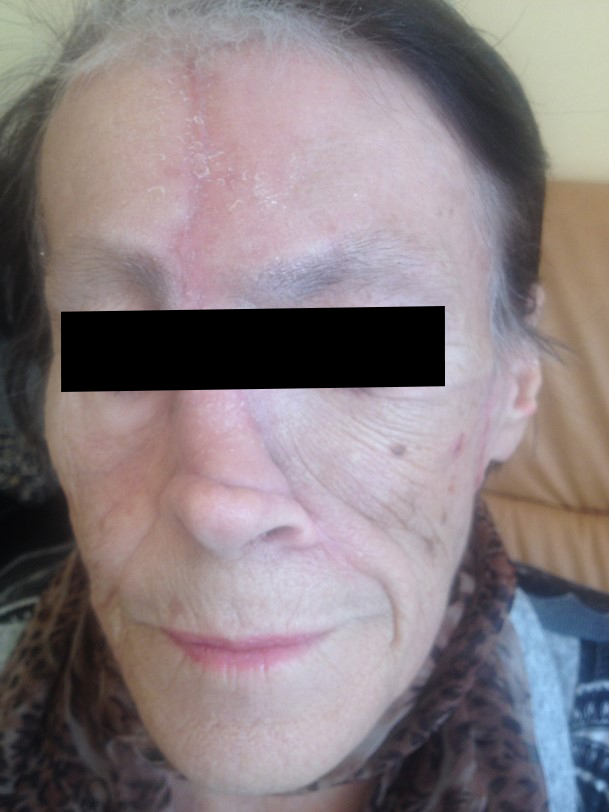
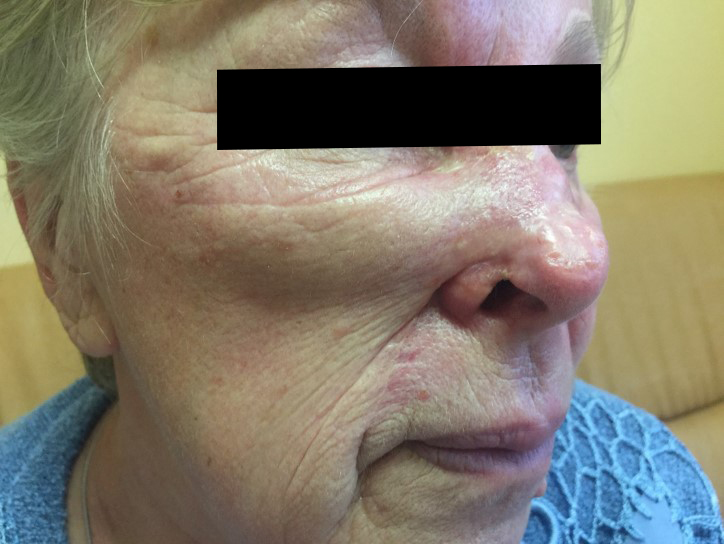
До
После
До
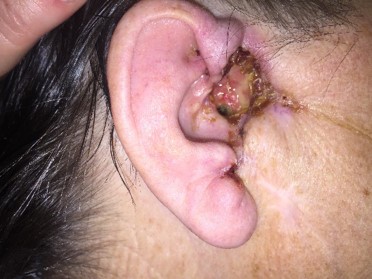
После
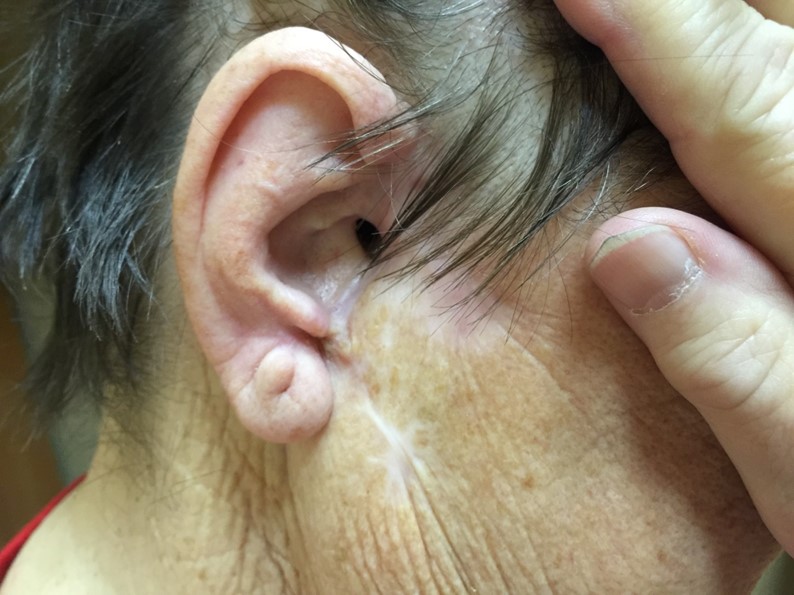
Базалиома – диагностика
После осмотра, проведенного врачом-дерматологом с помощью специального прибора — дерматоскопа, может быть заподозрена злокачественная природа опухоли.
Постановка диагноза — базальноклеточная карцинома — возможна только после морфологической верификации. На первом этапе это цитологическое исследование соскоба с поверхности новообразования на наличие атипичных клеток. Безусловным диагностическим мероприятием является биопсия, позволяющая сделать гистологическое заключение с учетом структуры ткани.
Методы лечения базалиомы кожи
Современная медицина владеет достаточно широким спектром лечебных пособий по борьбе с наиболее распространенной формой рака кожи. Тактика ведения пациента подразумевает грамотный выбор способа лечения. На сегодняшний день существуют следующие методики:
- хирургическое иссечение
- близкофокусная рентгенотерапия
- фотодинамическая терапия
- лазерная терапия
- криотерапия
- медикаментозная терапия.
В отделении опухолей головы и шеи НИИ онкологии им. Н.Н. Петрова пациентам с базалиомой кожи лица успешно делают реконструктивно-пластические операции. Выполняется и криодеструкцию базалиом под УЗ-контролем.
Криодеструкция актуальна для:
- поверхностных поражений;
- опухолей с локализацией в сложных анатомических зонах области лица;
- ослабленных пациентов с тяжелой сопутствующей патологией;
- соблюдения косметических требований.
Разные виды криодеструкции – струйная, аппликационная, пункционная – позволяют максимально индивидуализировать лечение. Накопленный опыт отделения позволяет судить об очень низком проценте рецидивов заболевания. Процедура криодеструкции заключается в местной анестезии, взятии биопсийного материала и троекратном холодовом воздействии сверхнизкой температуры с последующим оттаиванием.
Продолжительность каждого воздействия определяется распространенностью опухолевого процесса и глубиной инвазии. На месте зоны раневого дефекта формируется крионекроз, заживление происходит под струпом. Данная методика относится к хирургическим вмешательствам, поэтому подготовка к ней и послеоперационный период требуют контроля со стороны врача и ответственного выполнения всех предписаний пациентом. По окончанию периода заживления на месте криовоздействия остается эластичная рубцовая ткань удовлетворительных косметических свойств.
Продолжаются разработки новых методов лечения. Одним из достижений молекулярной онкологии является расшифровка мутаций генов Hedgehog-сигналинга, наблюдаемых в большинстве случаев базальноклеточной карциномы. Данное открытие дало толчок по внедрению в клиническую практику новых таргетных препаратов для системного лечения, что особенно актуально для пациентов с метастазами.
Таким образом, онконастороженность, профилактические меры, своевременное обращение пациентов за медицинской помощью, качественная диагностика и грамотный подход к лечению в совокупности могут обеспечить радикальный контроль над базальноклеточным раком кожи.


Авторская публикация:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Первый МГМУ им. И.М. Сеченова
Поликлиника №1 НМХЦ им. И.Н. Пирогова
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия
Российская медицинская академия последипломного образования, Москва
Российская медицинская академия последипломного образования, Москва
Первый МГМУ им. И.М. Сеченова
Первый МГМУ им. И.М. Сеченова
Методы диагностики базально-клеточного рака кожи
Журнал: Клиническая дерматология и венерология. 2012;10(2): 24‑27
Юрченко А.И., Индилова Н.И., Потекаев Н.Н., Червонная Л.В., Ткаченко С.Б., Колобяков А.А., Кузьмина Т.С. Методы диагностики базально-клеточного рака кожи. Клиническая дерматология и венерология. 2012;10(2):24‑27.
Iurchenko AI, Indilova NI, Potekaev NN, Chervonnaia LV, Tkachenko SB, Kolobiakov AA, Kuz'mina TS. Methods of diagnostics of basal cell skin cancer. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(2):24‑27. (In Russ.).
Первый МГМУ им. И.М. Сеченова
Представлены данные об эпидемиологии, классификации, клинико-патоморфологических особенностях базально-клеточного рака кожи. Рассмотрены современные методы его диагностики, в частности, неинвазивные, к которым относится лазерная конфокальная сканирующая микроскопия.
Первый МГМУ им. И.М. Сеченова
Поликлиника №1 НМХЦ им. И.Н. Пирогова
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия
Российская медицинская академия последипломного образования, Москва
Российская медицинская академия последипломного образования, Москва
Первый МГМУ им. И.М. Сеченова
Первый МГМУ им. И.М. Сеченова
Базалиома (синонимы: базально-клеточный рак — БКР, базально-клеточная эпителиома, карциноид кожи, базально-клеточная карцинома, кориум-карцинома, ulcus rodens) является самым распространенным злокачественным образованием кожи. Заболеваемость базалиомами высока во всем мире. Отмечается отчетливая тенденция к росту числа больных, темп которой соответствует общему росту заболеваемости злокачественными опухолями.
В Австралии рак кожи диагностируется у 40 человек на 100 тыс. населения, в Европе и США — у 12—14, в России — у 25—27. По данным зарубежных авторов, базалиома наблюдается в 69—78% эпителиальных опухолей кожи. По данным отечественных источников (Госкомстат РФ, Московский НИИ косметологии МЗ РФ), базалиомы составляют 15,3% всех эпителиальных новообразований кожи.
Классическая диагностика базально-клеточного рака кожи (БКРК) включает гистологический метод, являющийся «золотым стандартом» диагностики базалиомы, и цитологию мазков, позволяющие верифицировать диагноз на основании обнаружения специфических патоморфологических признаков.
Биопсия опухоли при раке кожи обязательна, она позволяет установить гистологический тип опухоли и уменьшить число диагностических ошибок. Ее можно выполнять до проведения терапии, на амбулаторном этапе обследования больного и во время лечения, например при криодеструкции опухоли. Материал для гистологического исследования обычно берут из уплотненного края опухолевой язвы на границе с неизмененной тканью. Характерной гистологической структурой базалиомы является клеточный комплекс, состоящий из мелких, так называемых базалиоидных, интенсивно окрашенных клеток. Их ядра компактные, имеют округлую или овальную форму, гиперхромны при окрашивании гематоксилином, структура хроматина и ядрышки обычно незаметны, цитоплазма скудная и, как правило, базофильная. По периферии клеточных комплексов отмечается зона радиально расположенных более крупных клеток высокой призматической формы с овальными или слегка вытянутыми ядрами, так называемый частокол, или палисад, наличие которого является одним из главных гистологических признаков базалиомы. Опухолевые клетки не имеют межклеточных мостиков, чем и отличаются от клеток базального слоя нормального эпидермиса. В базалиомах нередко встречаются митозы, обычно правильные. Клеточно-волокнистая соединительнотканная строма опухоли формирует пучковые структуры, содержит мукоидную субстанцию, окрашивающуюся метахроматично толуидиновым синим, в ней часто видны инфильтраты из лимфоцитов и плазматических клеток. Между эпителиальными опухолевыми комплексами и стромой часто выявляются щели (характерный признак БКРК), которые многие авторы расценивают как артефакт фиксации, хотя не отрицается вероятность воздействия избыточной секреции гиалуронидазы.
Гистологическая картина БКР характеризуется чрезвычайным многообразием структур. В опухолях часто обнаруживаются признаки разной клеточной дифференцировки, наличие зернистости или пигмента, что явилось причиной появления множества гистологических классификаций.
В нашей стране пользуются классификацией, предложенной А.П. Апатенко. Автором были выделены следующие группы базалиом:
1. Недифференцированные или малодифференцированные базалиомы:
А) недифференцированная базалиома преимущественно солидного строения (иногда с наличием едва уловимой железистой или пилоидной дифференцировки);
Б) пигментированная базалиома;
В) поверхностная мультицентрическая базалиома.
2. Дифференцированные базалиомы:
А) с железистой дифференцировкой (аденоидная);
Б) с пилоидной дифференцировкой (трихобазалиома);
В) с сальной дифференцировкой;
Г) с плоскоэпителиальной (эпидермоидной) дифференцировкой;
Д) сложного строения (с наличием разных типов дифференцировки).
3. Особые формы базалиом:
А) склеродермоподобная (или «морфеа»);
Б) базалиома типа фиброэпителиальной опухоли Пинкуса;
В) базалиома, возникшая в стенке эпидермальной кисты.
Разделение базалиом на недифференцированные и дифференцированные формы, а дифференцированных — на отдельные морфологические варианты в соответствии с типом дифференцировки носит в известной мере условный характер. «Чистые» морфологические варианты встречаются достаточно редко. Как правило, в каждой опухоли в том или ином количестве обнаруживаются недифференцированные и дифференцированные структуры, а также различные их сочетания.
Из более поздних классификаций следует упомянуть две. Классификация, предложенная Т. Wade и А. Ackerman, в которой авторы выделяют 26 самостоятельных гистологических вариантов базалиомы, не объединяя их в какие-либо группы, что облегчает дифференциальную диагностику БКР, отражает все их возможное разнообразие. В 1991 г. L. Lowe и R. Rapini разработали классификацию, основанную главным образом на морфологических признаках, имеющих прогностическое значение. Следует иметь в виду, что в настоящее время в морфологической диагностике применяется широкий спектр иммуногистохимических маркеров, позволяющих уточнить индивидуальный прогноз опухоли (в частности, маркеры пролиферации — Ki-67, PCNA, ген-супрессор малигнизации Р53 и ряд других).

Частота встречаемости разных типов базалиом, по данным отделения патоморфологии МОНИКИ им. М.Ф. Владимирского, представлена в таблице (данные 1997 г.).
Цитологическое исследование позволяет быстро, в амбулаторных условиях морфологически верифицировать рак кожи. Оно легко выполнимо, безболезненно, не вызывает осложнений и имеет высокую точность (88—90%). Как правило, делают соскобы с поверхности опухоли с помощью скальпеля и тонким слоем наносят материал на обезжиренное предметное стекло. Перед тем как взять материал, с поверхности опухоли удаляют некротические ткани. При отсутствии изъязвления эпидермиса можно выполнить пункцию опухоли с аспирацией ткани и нанести ее на предметное стекло. Отрицательные данные однократного цитологического исследования опухоли при клиническом подозрении на рак кожи не должны служить причиной отказа от дальнейших исследований. Так, заживление узелково-язвенной формы БКР часто может проходить нормальным эпидермисом, тогда как в глубине очага сохраняются атипичные клетки.
Основным недостатком гистологического и цитологического методов является отсроченность получения результатов.
В настоящее время появляются новые методики диагностики, позволяющие с максимально возможной вероятностью верифицировать диагноз базалиомы.
Необходимо признать, что верификация клинического диагноза с помощью классического гистологического метода в некоторых случаях бывает очень сложной и субъективной. Решение этой проблемы лежит в привлечении дополнительного высокодостоверного, объективного исследования — компьютерной плоидометрии. Этот метод основан на определении количественных показателей ДНК в пересчете на плоидность в ядрах так называемых базалиоидных клеток исследуемых новообразований.
Известно, что нарушение созревания клеток при дисплазии и при злокачественной их трансформации связано с количественными изменениями ДНК и характеризуются полиплоидией и анеуплоидией, что приводит к выраженному увеличению количества ДНК в ядрах опухолевых клеток. Следовательно, по этому показателю можно судить о нарушении созревания клеток, их анаплазии, что можно считать критерием биологических особенностей опухолевых клеток.
Согласно закону Г.Г. Автандилова (2006), первое удвоение содержания ДНК в ядрах опухолевых клеток свидетельствует о предраковых изменениях, а второе — о возникновении злокачественной опухоли.
Компьютерная плоидометрия позволяет получать данные количественного содержания ДНК в плоидометрическом выражении в базалиоидных клетках и может использоваться для уточнения дифференциальной диагностики.
Компьютерное микроспектрофотометрическое исследование срезов проводится на анализаторе изображений. Компьютерный анализатор Имаджер-медиа, отличительной особенностью которого являются унификация алгоритма распознавания изображений, обнаружение и классификация объектов по яркости и геометрическим параметрам, позволяет проводить качественную дифференциальную диагностику. Метод Г.Г. Автандилова по сравнительной микроспектрофотометрии в плоидометрическом выражении позволяет объективизировать дифференциальную диагностику БКР.
На серийных парафиновых срезах, окрашенных по методике Фейльгена (без окрашивания фона), исследуют поля зрения препарата при увеличении микроскопа в 400. Изучают клетки в типичных участках: с нормальным гистологическим строением, с признаками гиперплазии, легкой, умеренной и тяжелой степеней дисплазий, а также участки БКР.
По средней интегральной яркости лимфоцитов, присутствующих в исследованных срезах, получают значение «тканевого стандарта плоидности», соответствующее двойному набору хромосом. Данные о плоидности интерфазных ядер изучаемых опухолей рассчитывают путем деления средних показателей интегральной яркости этих клеток на полученный стандарт.
В отличие от непосредственных измерений целых ядер клеток в цитологических мазках, при изучении одинаковых по толщине и окраске гистологических срезов, получают косвенную информацию о средних значениях содержания ДНК в ядрах клеток по выборкам целых ядер и их фрагментов, используя специальную математическую обработку результатов измерений ядер клеток ростковых зон новообразований.
Далее проводят микроспектрофотометрическое исследование ядер базалиоидных клеток путем автоматического деления интегральной яркости ядер исследуемых клеток на интегральную яркость, соответствующую единице плоидности. Толщина препарата, условия освещения и пороги яркости измеряемых объектов сохраняют одинаковыми для всех измерений.
На экран монитора компьютера и на печать выводятся результаты измерений: площадь оптического сечения ядер клеток (в пикселях), их плоидность (в единицах «с») значения лимитов показателей, средние арифметические: простые (М) и Мвзвешенные (Мвзв – «ИНДНК» — «индекс накопления ДНК»), среднеквадратические отклонения (σ) и ошибки выборок (m), а также гистограммы распределения показателей плоидности выделенных ядер клеток. В зависимости от плоидности ядра клеток и количество клеток (столбики на гистограммах) представляют разными псевдоцветами. Гистограммы распределения клеток по плоидности их ядер характеризуют клеточный состав на разных стадиях развития новообразований. Эквивалентом пролиферативной активности клеток считают среднее количество синтезированной в ядрах ДНК, превышающее значения диплоидного уровня.
При постановке гистоплоидометрического диагноза руководствуются требованиями патента РФ на изобретение №224099 от 10.08.04 «Способ дифференциальной диагностики стадий канцерогенеза» и положения закономерности ступенчатой стадийности развития новообразований (Диплом на открытие №300 РФ, от 27.01.06).
Дифференциальные диагностические плоидометрические показатели позволяют объективно распознавать БКР, что имеет большое практическое значение при диагностике и выборе адекватного метода лечения. Эти показатели носят стабильный характер и в значительной степени повышают точность гистологических заключений, обоснованность и адекватность лечебных мероприятий.
Перспективными являются неинвазивные методы диагностики, которые используют как для скрининговых исследований, так и для наблюдения после проведенного лечения. Развитие современной дерматологии позволяет также усовершенствовать классические методы диагностики с помощью компьютерных технологий, что значительно повышает эффективность диагностических мероприятий.
Наиболее интересным и перспективным среди неинвазивных методов является лазерная конфокальная сканирующая микроскопия (ЛКСМ), которая позволяет получить изображение кожи с разрешением, приближенным к традиционной световой микроскопии. С помощью ЛКСМ проводится послойное изучение горизонтальных плоскостей ткани до 5 мкм с возможностью оценивать толщину и архитектонику каждого слоя кожи, анализа их клеточного состава, площади распространения и степени инвазии опухолевого конгломерата до верхних уровней сетчатого слоя дермы.
Конфокальная лазерная микроскопия является перспективным методом диагностики БКРК, широко применяемым зарубежными коллегами. Чувствительность и специфичность этого метода при диагностике БКРК составляет 93 и 98% соответственно.
БКРК имеет определенные критерии ЛКСМ, коррелирующие с основными гистологическими признаками данной нозологии. Наиболее важный и постоянный признак БКРК — наличие удлиненных мономорфных ядер клеток, которые являются характерным признаком так называемых атипичных базалиоидных клеток, отличающихся от окружающих клеток большим размером. Помимо размеров, характерным также является расположение удлиненных ядер относительно друг друга. Они поляризованы вдоль одной оси, т.е. всегда располагаются параллельно друг другу, образуя так называемый палисадник. Также постоянным признаком является присутствие округлых клеток, соответствующее инфильтрации воспалительными клетками перитуморальной стромы.
Критерии ЛКСМ БКРК имеют четкую корреляцию с дерматоскопическими и гистологическими критериями, что также позволяет определить этот метод диагностики для оптимального скрининга данной опухоли кожи и помощи в ходе дифференциального диагностирования в затруднительных клинических случаях. Конфокальная микроскопия является также безопасным методом, с помощью которого можно проводить многократные исследования с целью наблюдения за пациентами после удаления опухоли для выявления раннего рецидива.
БКР имеет сравнительно медленный рост, при своевременном и адекватном лечении редко рецидивирует и не метастазирует. Однако распространенные, запущенные опухоли с глубокой инвазией и деструкцией тканей имеют злокачественное течение и способны метастазировать, при этом прогноз значительно ухудшается. Своевременное выявление характерных признаков этого новообразования с помощью классических и новых методик диагностики, позволяющих с максимально возможной точностью верифицировать диагноз, а также проведение профилактического лечебного воздействия позволяют избежать негативных последствий.
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Отделение восстановительной хирургии и челюстно-лицевой хирургии и лаборатория радиоизотопной диагностики Российского научного центра хирургии им. акад. Б.В. Петровского ФАНО, Москва, Россия
Отделение нейрохирургии Российского научного центра хирургии им. акад. Б.В. Петровского
Отделение нейрохирургии Российского научного центра хирургии им. акад. Б.В. Петровского
Гигантская базалиома кожи головы с интракраниальным ростом
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(7): 88‑92
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Отделение восстановительной хирургии и челюстно-лицевой хирургии и лаборатория радиоизотопной диагностики Российского научного центра хирургии им. акад. Б.В. Петровского ФАНО, Москва, Россия
Отделение нейрохирургии Российского научного центра хирургии им. акад. Б.В. Петровского
Отделение нейрохирургии Российского научного центра хирургии им. акад. Б.В. Петровского
Базально-клеточный рак (базалиома) является наиболее распространенной злокачественной эпителиальной опухолью кожи. Опухоль состоит из атипичных базальных клеток, характеризуется местно-деструирующим ростом и редким метастазированием. Возникновение опухоли связывают с инсоляцией, воздействием канцерогенов, ионизирующего излучения. Преимущественно опухоль локализуется на открытых участках тела — у 80—98% больных на коже головы и шеи. Выделяют поверхностную, нодулярную, пигментную, склеродермоподобную формы и фиброэпителиому Пинкуса. Крайне редко встречается гигантская разновидность базалиомы, диаметр которой в соответствии с регистром Американского онкологического общества превышает 5 см. Ее доля среди всех базалиом составляет 0,3—1,5% [2, 3].
Гигантские базалиомы образуются в результате многолетнего течения заболевания (10—30 лет). Быстрый рост опухоли описывается крайне редко. Метастазирование более характерно для гигантских базалиом и отмечается менее чем в 0,1% наблюдений [5].
Морфологически гигантские базалиомы нередко представлены агрессивным (инфильтративным, морфеаподобным, микроузловым) типом строения и характеризуются выраженной степенью клеточной атипии. Дифференциальная диагностика чаще проводится с плоскоклеточным и метатипическим раком [12].
Применяются следующие способы лечения при базалиомах: лучевой, хирургический, комбинированный, лекарственный, криогенный, лазерный. При лечении в целом прогноз благоприятный. Полному излечению поддаются 90% больных, в случае локальных форм — почти 100%. При запущенных язвенных формах возможен интракраниальный рост, что значительно ухудшает прогноз заболевания и требует сложного хирургического лечения, которое заключается в тотальном удалении опухоли с пластикой оболочки головного мозга, черепа и кожи [4, 6, 11].
Приводим собственное наблюдение.
Больная Я., 69 лет, страдает базалиомой правой височной области с 2000 г. Постоянно лечилась у онколога по месту жительства, неоднократно проходила курсы лучевой терапии. Несмотря на адекватное консервативное лечение, заболевание медленно прогрессировало. При гистологическом исследовании соскоба базалиомы 01.11.13 выявлена картина базально-клеточного рака. При поступлении состояние больной удовлетворительное, значимых соматических и неврологических нарушений не выявлено. Длительно страдает гипертонической болезнью.
Локально в правой лобно-теменно-височно-затылочной области имеется обширная изъязвленная поверхность мягких тканей, обильно гранулирующая, местами кровоточащая с признаками инфицирования и гнойным налетом. Дерма в этой зоне отсутствует. В лобной области видна оголенная лобная кость. Вокруг образования кожа истончена и гипотрофична после неоднократных курсов лучевой терапии (рис. 1).

Рис. 1. Вид больной спереди (а) и сбоку (б) перед операцией.
При КТ головного мозга 27.11 выявлено злокачественное образование кожи головы справа с деструкцией подлежащих костных структур.
По данным МРТ головного мозга с контрастным усилением 19.12, имеется сочетанная заместительная гидроцефалия. Определяется деструкция лобной кости справа. Отмечаются масс-эффект правой лобной доли и прорастание опухолью оболочки головного мозга (рис. 2).

Рис. 2. Магнитно-резонансные томограммы головного мозга в режиме T1 перед операцией.
30.01.14 больной выполнена многоэтапная операция: микрохирургическое тотальное удаление проращенных опухолью мягких тканей в правой лобно-теменно-височно-затылочной области, резекция участков лобной, теменной и височной костей справа, иссечение твердой мозговой оболочки лобной области справа с пластикой дефекта мембраной Dura Patch «Codman», пластика костного дефекта двумя титановыми пластинами; срединная лапаротомия, забор большого сальника и его трансплантация на рану волосистой части головы с формированием артериального и венозного микроанастомозов; аутодермопластика. Длительность операции 12 ч 30 мин, кровопотеря около 500 мл.
Бригадой микрохирургов предварительно выделены правые наружная сонная артерия и наружная яремная вена, сосуды подготовлены к формированию микроанастомоза (рис. 3).

Рис. 3. Начальный этап операции.
Нейрохирургами произведено тотальное удаление проращенных опухолью мягких тканей головы, костей черепа и твердой мозговой оболочки, выполнена пластика дефекта твердой мозговой оболочки мембраной Dura Patch «Codman», произведена пластика костного дефекта двумя титановыми пластинами (рис. 4).

Рис. 4. Нейрохирургические этапы операции.
Для закрытия столь значительного дефекта мягких тканей головы требовался комплекс тканей, соответствовавший ему по размерам и локализации. Более того, лоскутом требовалось надежно укрыть металлические пластины, использованные для краниопластики. В подобных непростых клинических ситуациях, когда необходимо укрыть значительные по размерам и сложные по форме и характеру раневые поверхности, большой сальник становится незаменимым. Трансплантат хорошо моделируется практически на любой поверхности, достаточно тонок, по мнению H. Buncke (1982), представляет собой источник практически неограниченного кровоснабжения и может быть использован в качестве «живого дерна» для реваскуляризации других тканей [7—9].
Кровоснабжение сальника осуществляется ветвями правой и левой желудочно-сальниковых артерий. Правая желудочно-сальниковая артерия диаметром 1,5—3 мм является ветвью желудочно-двенадцатиперстной артерии и проходит по большой кривизне желудка, где анастомозирует с левой желудоч-но-сальниковой артерией диаметром 1—2 мм, отходящей от селезеночной артерии. Оба желудочно-сальниковых сосуда образуют сосудистую дугу, от которой идут короткие ветви к большой кривизне желудка и ветви к большому сальнику [1, 10].
Через верхнесрединную лапаротомию после стандартной ревизии органов брюшной полости большой сальник выводили в рану. Будущий трансплантат оценивали визуально, обращали внимание на анатомическое строение, выраженность жировой клетчатки, пальпаторно определяли пульсацию артерий сальника, аркад. Проводили мобилизацию сальника от поперечной ободочной кишки и желудка. Левую желудочно-сальниковую артерию выделяли дистальнее отхождения левой сальниковой артерии, правую — до передней верхней ветви поджелудочно-двенадцатиперстной артерии. Пересекали левую желудочно-сальниковую артерию и вену, по возможности ближе к селезенке (рис. 5). Лапаротомную рану послойно ушивали. Трансплантат укладывали на раневую поверхность, его края фиксировали по периметру раны. Далее под операционным микроскопом формировали микрососудистые анастомозы по типу конец в конец либо конец в бок. После пуска кровотока трансплантат закрывали перфорированным кожным лоскутом (рис. 6). Суммарно период тепловой ишемии лоскута составил около 60 мин.

Рис. 5. Мобилизованный аутотрансплантат большого сальника.

Рис. 6. Этапы операции.
В раннем послеоперационном периоде больная получала антибактериальную, инфузионную, вазотропную, симптоматическую терапию. Контроль жизнеспособности трансплантата осуществляли с помощью «слепого допплера», регистрирующего акустические сигналы пульсовой волны артерии питающей ножки и визуально на перевязках. На 3-и сутки после операции у больной появилась «лобная» симптоматика, развилось нарушение сознания до уровня оглушения. На основании данных КТ головного мозга диагностирован геморрагический инсульт (как осложнение гипертонической болезни на фоне антикоагулянтной терапии) с формированием внутримозговых гематом в лобных долях и кровоизлиянием во все желудочки. Экстренно совместно с микрохирургами выполнена операция — удаление внутримозговой гематомы правой лобной доли. 05.02 в состоянии больной наметилась положительная динамика. По данным КТ головного мозга, признаков рецидива гематомы нет, отмечаются регресс дислокации головного мозга, уменьшение объема вентрикулярных кровоизлияний (рис. 7). При контрольной МСКТ с контрастированием визуализировалась сосудистая ножка трансплантата и артериальная сеть сальника (рис. 8). Несмотря на выполнение повторной операции удаления внутричерепной гематомы, сопряженной с отслаиванием аутотрансплантата и временным удалением титановых пластин, инфекционно-воспалительных осложнений не было. Отмечено приживление аутодерматомного лоскута по всей поверхности (рис. 9).

Рис. 7. Компьютерые томограммы головного мозга на 3-и сутки после операции (а) и после удаления внутримозговой гематомы (в) и этап удаления внутримозговой гематомы правой лобной доли (б).

Рис. 8. Мультиспиральная компьютерная томограмма головы и шеи с контрастированием в режиме 3D-реконструкции.

Рис. 9. Вид раны через 2 мес после операции.
Особенностями приведенного клинического наблюдения являлись длительное существование опухоли, неэффективность консервативного лечения, значительные размеры дефекта кожи головы с вовлечением в опухолевый процесс костей свода черепа и твердой мозговой оболочки, сложность пластики обширного дефекта кожи головы.
Большой сальник является аутотрансплантатом, позволяющим закрывать значительные по площади дефекты кожи головы, имеющие сложное пространственное строение поверхности, и добиваться хорошего косметического и функционального результата.
1. Тяжелая сопутствующая патология.
2. Иммунодефицитное состояние.
Интерферонотерапия характеризуется местным или системным применением иммуномодулирующих препаратов. Применяют рекомбинантные интерфероны — альфа-2β-реаферон, виферон (Россия), интрон, А (США), местный иммунотропный препарат крем имиквимод. После проведения интерферонотерапии отмечается регресс большинства опухолей [1, 7]. Однако метод характеризует ряд побочных эффектов: общая слабость, энцефалопатия, анорексия, психомоторные нарушения, транзиторная лейкопения, тромбоцитопения, тошнота, нарушение вкуса, диарея. Широкое применение крема имиквимод ограничено возникновением таких побочных эффектов, как выраженная воспалительная реакция, невозможность использования на чувствительных участках кожи, системные побочные реакции. Также к недостаткам интерферонотерапии относят высокую стоимость проводимой терапии и относительно низкую степень излеченности [7].
Показания к интерферонотерапии
1. Отказ пациентов от хирургического лечения.
2. Язвенная форма.
3. Поверхностная форма.
4. Нодулярная форма.
5. Наличие неоперабельных крупных БКРК.
Ингибиторы Hedgehog сигналинга. С мутациями генов сигнального пути Hedgehog ассоциировано большинство случаев БКРК [28]. В 2012 г. FDA (Food and Drug Administration, Управление по контролю за продуктами и лекарствами, США) был одобрен препарат висмодеглиб для лечения распространенного БКРК у взрослых пациентов. Препарат обладает низкой токсичностью и избирательным механизмом действия [29]. Наиболее частыми нежелательными явлениями при приеме висмодеглиба бывают мышечные спазмы, алопеция, изменение вкусовых ощущений, потеря массы тела, усталость, тошнота, рвота, диарея, констипационный синдром, артралгии, гипонатриемия, тератогенный эффект.
Показания к применению ингибитора Hedgehog сигналинга — препарата висмодегиб
1. Метастатический БКРК.
2. Рецидивирующий БКРК.
3. Местно-распространенный БКРК у пациентов, не подлежащих хирургическому или лучевому лечению.
Фотодинамическая терапия (ФДТ) представляет собой эффективный и неинвазивный метод лечения БКРК с отличными косметическими результатами, основанный на селективном фотодинамическом повреждении опухолевых клеток в ходе фотохимических реакций. Основным компонентом фотодинамической реакции является фотосенсибилизатор (ФС) — вещество, повышающее чувствительность тканей к свету. ФС бывают системными и местными [34]. К системным ФС 1-го поколения относят производные гематопорфирина: фотофрин (США), фотогем (Россия), фотосан (Германия), и характеризующиеся низким коэффициентом накопления в опухолевых клетках и фототоксичностью. Более перспективными считаются ФС 2-го поколения: фотодитазин (Россия), фотолон (Белоруссия), радахлорин (Россия), фоскан (Германия), аминолевулиновая кислота (АЛК) (Норвегия). Однако при использовании всех системных ФС развивается серьезный побочный эффект в виде длительной фотосенсибилизации всего кожного покрова, которого в свою очередь не наблюдается при использовании местных ФС [30, 32]. Синтез липофильных эфиров АЛК позволяет увеличить селективность ФС и его пенетрацию при проведении ФДТ [32, 33]. Одним из наиболее эффективных и современных местных фотосенсибилизаторов является метиламинолевулиновая кислота (МАЛК), которая выпускается в виде крема метвикс («Галдерма», Швейцария). Фотодинамическая терапия с метиламинолевулиновой кислотой (МАЛК-ФДТ) по сравнению с криодеструкцией и хирургическим иссечением характеризуется достижением более приемлемого косметического результата. В качестве источника света при МАЛК-ФДТ используют лампу, излучающую холодный видимый свет в красном спектре. Дозы световой энергии при ФДТ различных форм БКРК делятся на минимальные, средние и максимальные, которые в свою очередь зависят от размера и локализации очага. Применение МАЛК приводит к селективному увеличению количества порфиринов (сенсибилизаторы) в опухолевых клетках, в результате чего последние становятся чувствительными к свету. А в здоровых клетках, напротив, содержание фотоактивных порфиринов незначительное. При воздействии на опухолевые клетки красным светом происходит активация фотоактивных порфиринов. После активации светом в присутствии кислорода в результате взаимодействия с проактивными порфиринами нетоксичный триплетный кислород переходит в более активное состояние, образуя так называемый «синглетный» кислород, обладающий выраженным цитотоксичным действием, что приводит к селективному разрушению опухолевых клеток. Эффективность фотодинамической терапии при БКРК обеспечивается за счет трех механизмов: повреждения сосудов опухоли, цитотоксичности фотохимической реакции и за счет формирования иммунного ответа вокруг опухоли [30, 34]. Эффективность ФДТ зависит от формы БКРК, ее размеров, от вида используемого ФС и составляет 73—95%. Цитотоксический эффект зависит от концентрации ФС и глубины проникновения света в опухолевую ткань [33, 35].
МАЛК-ФДТ является современным и эффективным методом лечения БКРК и обладает рядом существенных преимуществ: селективностью поражения исключительно опухолевых клеток, органосохраняющим эффектом, возможностью удаления очагов в труднодоступных местах, возможностью многократного применения, косметически более приемлемым эффектом, отсутствием тяжелых местных и системных осложнений, возможностью проведения лечения пожилым людям и больным с тяжелой сопутствующей патологией, возможностью проведения процедуры в амбулаторных условиях. Кроме того, во время одного лечебного сеанса можно проводить обработку нескольких очагов поражения [33—35].
В России среди всех злокачественных опухолей рак кожи по частоте встречаемости занимает третье место (после рака желудка и легких) и составляет около 11–28 %.
Плоскоклеточный рак кожи (далее ПКРК) – злокачественная опухоль, развивающаяся из кератиноцитов и способная вырабатывать кератин, часто возникает на фоне предраковых заболеваний кожи. ПКРК – второй в структуре заболеваемости рак кожи (рисунок 1) после базальноклеткочного рака (базалиомы).

Невозможно установить единственную причину возникновения опухолей кожи, однако наиболее важным фактором является длительное облучение солнечными лучами ультрафиолетового спектра. Кожный покров двух разных людей не одинаково восприимчив к воздействию ультрафиолетового излучения типа В (длина волны 290–320 нм) и типа А (320–400 нм), что определяется шестью фототипами кожи (рисунок 2). Первый и второй фототипы отличаются наибольшей вероятностью возникновения солнечного ожога, а пятый и шестой – наименьшей.
Следует отметить такие факторы риска, как врожденный или приобретенный иммунодефицит (что связано не только с таким заболеванием, как ВИЧ, но и с необходимостью принимать препараты, снижающие иммунитет, например, после трансплантации органов), контакт с мышьяком и ионизирующей радиацией. ПКРК является наиболее частой опухолью, которая развивается на фоне предсуществующего рубца или длительно незаживающей раны, язвы. Описан ряд наследственных синдромов, в рамках которых возможно возникновение плоскоклеточного рака кожи: альбинизм, пигментная ксеродерма.
Предраковые состояния и условия
У человека могут быть предшественники рака (предраковые состояния), которые при стечении определенных неблагоприятных факторов иногда могут озлокачествляться: актинический кератоз, кожный рог, трофические язвы, кератоакантома. Редко рак кожи развивается de novo (на «пустом месте»).
Так, к примеру, актинический (старческий) кератоз возникает чаще у мужчин старше 50 лет, на открытых участках тела. В своем развитии происходят изменения от розового пятна неправильной формы с гладкой поверхностью до очерченного скопления ороговевших чешуек желто-коричневого цвета. Отличить актинический кератоз от инвазивной формы плоскоклеточного рака кожи невозможно без данных патоморфологического или цитологического исследования, т.е. исследования кусочка ткани под микроскопом.
В отличие от предраковых состояний имеются предраковые условия («облигатный предрак»), который практически всегда подвергается злокачественной трансформации. К нему относятся следующие заболевания: пигментная ксеродерма, болезнь Боуэна, болезнь Педжета, эритроплазия Кейра.
Например, в основе пигментной ксеродермы – повышенная чувствительность кожи к ультрафиолетовому излучению, связанная с аутосомно-рециссивным типом наследования. Первые симптомы появляются в еще детском возрасте: красные, слегка воспалительные пятна, на месте которых впоследствии образуются очаги пигментации. Превращение в рак происходит в 100 % случаев.
Клиническая картина заболевания
Плоскоклеточный рак кожи чаще всего формируется на участках кожи, подверженной постоянному УФ-излучению: в 70–80 % случаев поражается поверхность головы и шеи, в 8 % случаев тыльная поверхность кистей и предплечий. ПКРК у мужчин развивается чаще, чем у женщин.
Заподозрить плоскоклеточный рак можно, обнаружив опухоль или язву кожных покровов, которые быстро увеличиваются в размерах. При присоединении воспалительного компонента вследствие инфицирования возникают боли. Выделяют 3 формы ПКРК: язва, узел, бляшка.
Язвенная форма (рисунок 3) характеризуется резко приподнятыми краями, окружающими язву в виде валика. Края язвы придают ей вид кратера, серозно-кровянистый экссудат засыхает в виде корочек. От новообразования исходит неприятный запах.

Раковый узел (рисунок 4) по внешнему виду напоминает цветную капусту или гриб на широком основании, коричневого или ярко-красного цвета, поверхность которых может быть покрыта трещинами или язвами.

Раковая опухоль в виде бляшки (рисунок 5) плотной консистенции с мелкобугристой поверхностью, красного цвета, кровоточит, быстро распространяется в подлежащие поверхности.

Диагностика
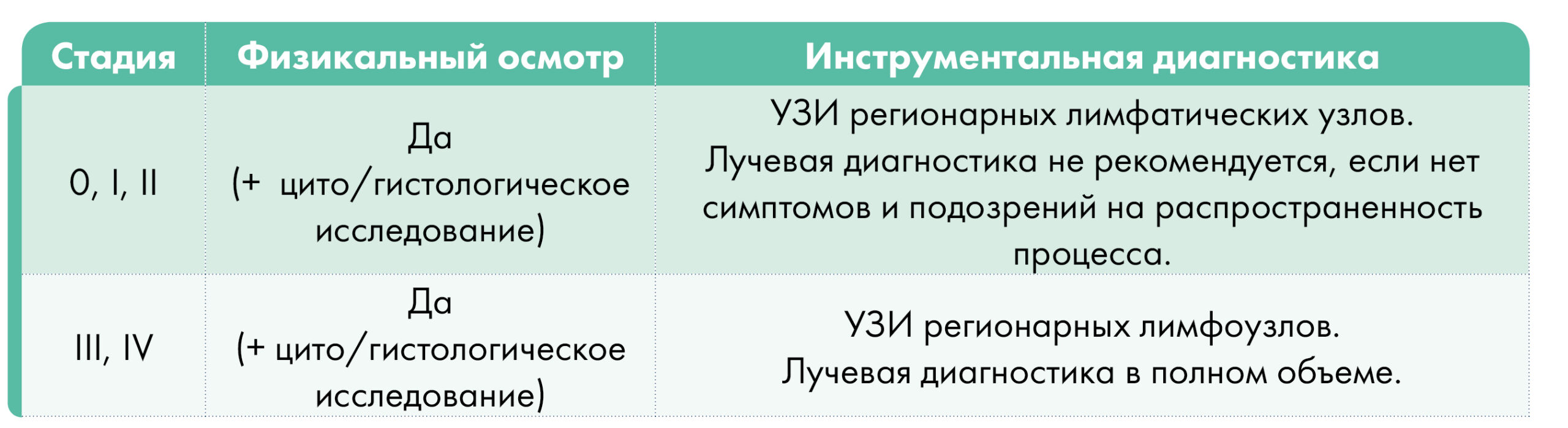
Поскольку диагноз ПКРК должен подтверждаться исследованием кусочка пораженной ткани под микроскопом, то крайне важно заключение врача-патологоанатома.
План обследования в зависимости от стадии заболевания:
Лечение
При локальных стадиях заболевания (I-II стадия) предпочтение отдается хирургическим методам лечения. В случае противопоказаний к хирургическому лечению рекомендованы:
— фотодинамическая терапия (ФДТ);
Лечение плоскоклеточного рака кожи с метастазами в регионарные лимфоузлы (III стадия) заключается в удалении регионарных (близкорасположенных) лимфоузлов с последующей лучевой терапии.
Решение о проведении лечения больных метастатическим и нерезектабельным раком кожи (III нерезектабельная и IV стадия) принимается совместно хирургом, химиотерапевтом и радиотерапевтом.
Рекомендации по первичной профилактике опухолей кожи:
Главной целью первичной профилактики является предотвращение солнечного ожога кожи. Для этого следуйте приведенным ниже рекомендациям:
- Необходимость защиты от ультрафиолетового излучения определяется уровнем УФ-индекса в этот день. Для его ежедневного мониторирования можно воспользоваться данными мобильного приложения, а также сайтами о прогнозе погоды. При УФ-индексе более 2 необходима защита от солнца (см.Таблицу ниже).

- На современном рынке представлены средства, защищающие как от УФ-лучей типа А, так и типа В. Для описания степени защиты используются индексы. Для ультрафиолетовых лучей типа A – PPD (Persistent Pigment Darkening), для лучей типа В – SPF (Sun Protecting Factor). Лицам с I или II фототипом можно дать универсальный совет использовать кремы с SPF 30–50+ и максимальным PPD 42.
- Загорать рекомендуется в утреннее время (до 11–12 часов) и вечернее время (после 15–16 часов).
- Не пользоваться лампами для искусственного загара.
Мерами профилактики рака кожи также являются: защита рубцов от механических травм; строгое соблюдение мер личной гигиены при работе со смазочными материалами и веществами, содержащими канцерогены; лечение язв.
Осмотр кожи
Осмотр кожи рекомендуется не реже 1 раза в 3–6 месяцев с использованием зеркал: панорамного и ручного.
Особое внимание следует уделять пятнам размером более 4 мм, имеющим асимметрию формы, неровные края, двухцветную окраску (часто наблюдаются различные оттенки коричневого). Стоит обращать внимание и на их изменения с течением времени: родинка может стать толще, увеличиться в размерах, изменить рельеф. Иногда часть пятна начинает бледнеть и исчезать.
Если вы заметили пигментные пятна, подходящие под данное описание, то обратитесь к дерматологу или онкологу. Не всегда данные признаки говорят об озлокачествлении, однако точный ответ на этот вопрос может дать лишь врач, выполнив осмотр и необходимые исследования.
- Министерство здравоохранения Российской Федерации. Клинические рекомендации: «Плоскоклеточный рак кожи» (протокол от 20.12.2019г. №10/2-3-4). М.: 2020. — 89с.
- Давыдов, М. И. Онкология : учебник / М. И. Давыдов, Ш. Х. Ганцев [и др. ]. — Москва : ГЭОТАР Медиа, 2020. — 920 с. : ил. — 920 с.
- Пустынский И.Н., Кропотов М.А., Ткачев С.И., Пачес А.И., Алиева С.Б., Ягубов А.С., Бажутова Г.А., Сланина С.В. и др. Лечение больных плоскоклеточным раком кожи головы и шеи. Российский онкологический журнал. 2013г.
- Ганцев, Ш. Х. Рак кожи. Меланома / Ганцев Ш. Х. , Кзыргалин Ш. Р. , Тимин К. Е. — Москва : ГЭОТАР-Медиа, 2020. — 160 с. (Серия «Онкология»).
- Снарская Е.С. Фотоканцерогенез и профилактика рака кожи. Российский журнал кожных и венерических болезней.2012г. — 10-13 с.
- Министерство здравоохранения Российской Федерации. Клинические рекомендации: «Рак кожи базальноклеточный и плоскоклеточный». М.: 2018. — 35с.
- Рак кожи. Меланома. Клиника, диагностика, Лечение. Методическое пособие для врачей/сост.: организационно-методический отдел ГУЗ ОКОД. — Ульяновск: 2020г. -27с.

Авторская публикация:
Червяк Мария Викторовна,
ординатор НМИЦ онкологии им. Н.Н. Петрова

Под научной редакцией:
Нажмудинов Рустам Асульдинович,
к.м.н., врач-онколог отделения опухолей головы и шеи НМИЦ онкологии им. Н.Н. Петрова
Читайте также:

