Если удалили щитовидную железу обязательно будет витилиго
Обновлено: 17.05.2024
ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России
Анализ осложнений после различных оперативных вмешательств на щитовидной железе
Журнал: Эндоскопическая хирургия. 2014;20(6): 33‑37
ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России
Осложнения в послеоперационном периоде у больных с заболеваниями щитовидной и околощитовидной желез встречаются довольно часто и зависят от объема хирургического вмешательства. Для профилактики основных часто встречающихся послеоперационных осложнений необходимо знать топографоанатомические варианты расположения возвратных гортанных нервов, околощитовидных желез и терминальной части грудного лимфатического протока. Применение эндоскопической видеоассистированной тиреоидэктомии или паратиреоидэктомии сопровождается небольшим количеством осложнений и показано пациентам, у которых есть склонность к образованию келоидных рубцов и молодым пациенткам.
ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России
Осложнения после хирургических вмешательств встречаются в 2—10% случаев. При операциях на щитовидной железе (ЩЖ) нередко возникают осложнения, связанные с повреждением щитовидных артерий (0,3—5%), возвратных гортанных нервов (0,3—13,5%) и околощитовидных желез — ОЩЖ (3,5—34,2%), что обусловлено исключительной вариабельностью топографии данных анатомических структур [1—5].
Наиболее частым специфическим осложнением операций на ЩЖ является поражение возвратных гортанных нервов, проявляющееся нарушениями фонации и/или дыхания, а травма верхнего гортанного нерва вызывает анестезию надгортанника, поэтому пища, особенно жидкая, попадает в гортань и больной «поперхивается». И так как все проходит в течение 2—3 дней, обычно это редко рассматривают как осложнение [6—8].
Еще Н.И. Русанова (1969) отмечала, что когда учитывали только «выраженные нарушения фонации и дыхания», повреждение возвратных гортанных нервов было отмечено у 4,4% из 1230 оперированных. Когда же у 100 больных после операции произвели ларингоскопию, поражение нервов было установлено у 18%, т. е. в 4 раза чаще.
Это осложнение, как и всякое другое, находится в прямой зависимости от тяжести и объема вмешательства, а также от методики и техники операции. Все же можно утверждать, что колебания частоты повреждений от 0,1 до 5% связаны с недостаточно скрупулезным учетом всех субъективных изменений фонации и дыхания после операции, а также с отсутствием ларингологического контроля за состоянием голосовых связок [9—11].
Другие авторы считают, что тиреоидэктомия, даже выполненная опытным хирургом, чревата серьезными осложнениями и повреждение возвратного нерва происходит в 5,2—15%, а гипопаратиреоз вследствие удаления или травмы ЩЖ развивается в 2,5—20,1% случаев [2, 12—14].
Согласно результатам рандомизированных исследований, проведенных МНИОИ им. П.А. Герцена совместно с несколькими онкологическими диспансерами, после тиреодэктомии по поводу рака ЩЖ I и II стадии выживают без рецидивов и метастазов 5 лет и более 94,1% больных, при выполнении гемиструмэктомии с перешейком в аналогичной группе больных — 93,4%. Это означает, что у больных имеется достаточно благоприятный прогноз и осложнения после хирургических вмешательств могут существенно снизить качество жизни.
Результаты
Конечно, заканчивая операцию, хирург должен тщательно осмотреть рану и убедиться в отсутствии кровотечения, иначе в ближайшем послеоперационном периоде можно столкнуться с кровотечением или с образованием гематомы. Клинически это в отсутствие адекватного оттока (недостаточный дренаж) вызывает деформацию передней поверхности шеи, а также ухудшение дыхания больного, что требует срочного хирургического вмешательства в виде ревизии раны.
К стандартным осложнениям можно отнести свищи в зоне операции, как правило лигатурные (рис. 1), в очень редких случаях — наружные трахеальные свищи как результат слишком сильной коагуляции трахеи.

Рис. 1. Лигатурный свищ в зоне послеоперационной раны.
Известно, что голосовые связки могут быть парализованы в состоянии разведения в стороны, при повреждении возвратного гортанного нерва они располагаются по средней линии — тогда происходит обтурация просвета гортани. Поэтому при наличии такого осложнения необходима срочная трахеотомия по жизненным показаниям. Обычно это делается сразу после операции при выходе больного из наркоза и удалении эндотрахеальной трубки. Так как ЩЖ удалена, то наложение трахеостомы не вызывает трудностей (рис. 2).

Рис. 2. Больной после тиреоидэктомии с наложенной в экстренном порядке трахеостомой.
Решение данной проблемы при стойком двустороннем параличе возвратного нерва заключается в выполнении реконструктивной операции (аритеноидэктомия с латерофиксацией), чтобы избавить больного от трахеотомической трубки.
Односторонний паралич суживает просвет гортани наполовину, клинически проявляясь одышкой при физической нагрузке. Голосовая функция при этом страдает незначительно, но это чрезвычайно важно людям с определенными профессиями: дикторам, певцам и т. д. Достоверно определить, поврежден ли возвратный нерв, можно только при визуальном осмотре гортани при помощи ларингоскопии (рис. 3).

Рис. 3. Парез правой половины гортани (ларингоскопия).
Отметим, что при временном парезе возвратного нерва (в результате травмы или нарушения кровоснабжения) после 2—3 нед лечения голосовая функция полностью восстанавливается.
Возвращаясь к истории вопроса, отметим, что С.А. Ярославцев (1975) констатировал 11 поражений возвратного нерва (7,7%) на 143 операции по поводу рецидивного зоба. В клинике Мейо частота поражений возвратного нерва при рецидивном зобе составляет 6% [4]. Huber (1960) на 1634 операции при рецидивном зобе наблюдал поражения гортанных нервов в 16% при первом рецидиве и в 62% при четвертом рецидиве. Scheicher (1962), сообщивший о 2870 операциях при рецидивном зобе, обнаружил поражение возвратного нерва у 20% больных.
В наших наблюдениях за последний год при выполнении стандартных операций у 2,28% больных после хирургического вмешательства отмечено нарушение фонации или дыхания. Из этих 70 больных у 18 был рак, потребовавший тиреоидэктомии, и у 3 больных тиреоидит Риделя II стадии (2 тиреоидэктомии, 1 субтотальная резекция ЩЖ). У 1 пациентки голос восстановился полностью, а у 2 фонация значительно улучшилась за счет смещения здоровой связки в сторону парализованной. У всех остальных больных голос восстановился в сроки от 1—2 нед до 2—4 мес.
Относительно лечения тиреоидита Риделя все авторы сходятся во мнении необходимости хирургического вмешательства, но по поводу объема операции имеются разногласия. Известно, что Ридель наблюдал излечение после иссечения небольшого участка железы. О подобном феномене писали и другие хирурги [1, 14].
Этими же проблемами объясняется то, что при хроническом аутоиммунном тиреоидите с выраженной компрессией ряд авторов рекомендуют производить иссечение перешейка железы с подшиванием с той и другой стороны к плоскости разреза претрахеальных мышц [9, 15]. Такая минимальная операция полностью устраняет сдавление трахеи и дает материал для гистологического подтверждения диагноза.
Мы также наблюдали рецидивный диффузный токсический ретровисцеральный зоб и узловой зоб с явлениями периструмита, при котором до операции подозревали рак, в связи с чем удалили всю боковую долю. Изменения голоса наступили через 2—3 дня после операции, и в эти же сроки установлен парез голосовой связки. По-видимому, у этих больных имелся послеоперационный отек нерва.
Следует указать, что изредка в нашей практике встречались случаи, когда фонация или дыхание во время операции изменялись на короткое время, а затем наступало полное восстановление голоса и дыхания.
На следующий день после операции предъявляли жалобы на «поперхивание» 3,5% наблюдаемых больных. С их слов, пища, особенно жидкая, попадала в гортань — «не в то горло». Это состояние нами расценивалось как поражение чувствительных волокон верхнего гортанного нерва. Для подтверждения собственных предположений мы просили больного проглотить воду при наклоне головы в сторону, противоположную той, на которой предполагалось поражение нерва, глотание происходило нормально. Но если больной наклонял голову в сторону, где имелось поражение данного нерва, «поперхивание» было особенно заметно и мучительно. Радовало только то, что все нарушения акта глотания купировались в течение 3 дней.
Вторая важная проблема после операций на ЩЖ — нарушение работоспособности ОЩЖ. Грубые нарушения функции ОЩЖ во время операции проявляются клинически хорошо известной симптоматикой (онемение губ, покалывания кончиков пальцев, судороги). Субклинический гипопаратиреоз можно выявить только лабораторными методами (определение концентрации кальция). Следует различать временный и стойкий гипопаратиреоз, их частота, по данным литературы, существенно разнится — 2,4 и 15% соответственно. Важно вовремя начать адекватное лечение, поскольку в его отсутствие возможны летальные исходы. Для купирования острого приступа судорог внутривенно медленно вводят 10—20 мл (в тяжелых случаях — 40—50 мл и более) 10% раствора кальция хлорида или глюконата. Для предупреждения приступа внутримышечно вводят раствор кальция глюконата, тахистин, витамин D2.
Более редкие осложнения часто встречаются при более расширенных операциях, как правило, у больных раком Щ.Ж. Это пневмоторакс, пересечение пищевода, повреждение крупных нервов и магистральных сосудов шеи; особо следует отметить лимфорею при повреждении грудного лимфатического протока в терминальной его части (рис. 4), что происходит из-за плохой визуализации последнего или отсутствия у оперирующих хирургов данных о топографоанатомических вариантах его расположения.
Еще одно из осложнений послеоперационного периода — тиреотоксический шок. Мы считаем, что стойкое устранение тиреотоксикоза до хирургического вмешательства служит гарантией от послеоперационного тиреотоксического криза. Консервативная терапия обычно осуществляется мерказолилом в дозе 60 мг/сут от 1 до 3 мес с контролем уровня тиреоидных гормонов.
Следует отметить, что в наших наблюдениях при повторных операциях на ЩЖ число осложнений возросло в 10 раз, что связано со спаечным процессом в зоне вмешательства.
При злокачественных опухолях ЩЖ химиотерапия имеет значение лишь при лимфосаркоме, обычно в сочетании с лучевым воздействием. Гормонотерапия с применением высоких доз тиреоидных препаратов может быть использована для замедления роста нерезектабельных злокачественных опухолей ЩЖ.
С целью уточнения послеоперационных осложнений нами проанализирован операционный материал на основании 1009 операций на ЩЖ за 10 лет наблюдения. Патология Щ.Ж., по поводу которой произведены различного рода вмешательства, показаны в табл. 1.

Таблица 1. Распределение больных по полу и патологии (n=1009)
Основной патологией были многоузловой зоб и рак Щ.Ж. Осложнения послеоперационного периода разделены в зависимости от объема оперативного вмешательства (табл. 2).

Таблица 2. Количество послеоперационных осложнений в зависимости от объема операции
В целом при тиреоидэктомии констатировано 68 (9,98%) осложнений (с лимфодиссекцией — 8 (27,5%)), при субтотальной резекции— 13 (12,5%), после гемитиреоидэктомии — 9 (3,88%) и при резекции ЩЖ осложнений не выявлено.
Таким образом, основными осложнениями следует считать повреждение возвратных гортанных нервов и ОЩЖ, а также грудного лимфатического протока; кроме того, возможно, требуется более тщательное исследование на анатомическом материале, что позволит получить благоприятные результаты лечения у больных, оперированных на ЩЖ.
Эндовидеохирургическое лечение. С 2013 по 2014 г. на основании 19 выполненных нами операций на ЩЖ и ОЩЖ при помощи эндовидеохирургической техники мы получили следующие результаты.
У 12 больных имелись заболевания ЩЖ (у 3 — онкопатология) и у 7 — заболевания ОЩЖ. Показаниями к тиреоидэктомии были узловой зоб диаметром до 3,0 см с ростом узла, при этом объем узла менее 20 мл; объем доли ЩЖ
Показаниями к паратиреоидэктомии служили первичный гиперпаратиреоз — 5 случаев и третичный гиперпаратиреоз — 2 случая.
Всего прооперированы 17 женщин и 2 мужчин. Средняя продолжительность вмешательств составила 95 (65—115) мин при геми- или тиреоидэктомии и 70 (55—90) мин при удалении аденомы ОЩЖ. Все разрезы были ≤3 см, при этом отсутствовали разрезы на передней поверхности шеи (рис. 5).

Рис. 5. Пациентка после окончания операции.
Один пациент подвергся расширению разреза до 4 см в связи с недооценкой размеров железы для извлечения последней. В 18 случаях был достигнут ожидаемый эффект от оперативного вмешательства. В 1 случае результат операции (по поводу первичного гиперпаратиреоза) рассматривали как неудовлетворительный, поскольку в послеоперационном периоде не наблюдалось снижения уровня паратгормона и морфологическое исследование показало, что во время операции была удалена гипертрофированная ОЩЖ, а не аденома. Поскольку во всех случаях вмешательства выполнялись прецизионно, дренирования раны не требовалось.
Интраоперационно после пересечения нижней щитовидной артерии удалось визуализировать возвратный гортанный нерв по анатомическим ориентирам: трахеопищеводная борозда, бугорок Zuckerkandle, связка Berry, ОЩЖ, нижний рог щитовидного хряща. В послеоперационном периоде проводился мониторинг оперированных пациентов с помощью оценки клинически приходящих изменений голоса и путем определения гормонов ОЩЖ. Средняя длительность пребывания больных в стационаре в послеоперационном периоде составила 2 дня. Осложнений в области послеоперационных ран, парезов голосовых связок и прочих мы не наблюдали. Мы не считали подкожную эмфизему осложнением, так как это являлось следствием технологического процесса.
Вывод
Осложнения в послеоперационном периоде у больных с заболеваниями ЩЖ и ОЩЖ встречаются довольно часто и зависят от объема хирургического вмешательства. Для профилактики основных часто встречающихся послеоперационных осложнений необходимо знать топографоанатомические варианты расположения возвратных гортанных нервов, ОЩЖ и терминальной части грудного лимфатического протока.
Применение эндоскопической видеоассистированной тиреоидэктомии и паратиреоидэктомии показано пациентам, у которых есть склонность к образованию келоидных рубцов, и молодым пациенткам. При хирургическом лечении первичного гиперпаратиреоза необходимо интраоперационное морфологическое подтверждение адекватности оперативного пособия во всех случаях, в том числе при доказанном до операции доброкачественном характере заболевания.
Что такое аутоиммунный тиреоидит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сивова А. А., эндокринолога со стажем в 13 лет.
Над статьей доктора Сивова А. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Хронический аутоиммунный (лимфоматозный) тиреоидит (ХАИТ) — хроническое заболевание щитовидной железы аутоиммунного происхождения, было описано Х. Хасимото в 1912 г. Заболевание чаще наблюдается у женщин и наиболее часто диагностируется среди известных патологий щитовидной железы. Аутоиммунный тиреоидит выявляется у одной из 10-30 взрослых женщин. [1]
Рассматриваемое заболевание аутоиммунной природы, и для него обязательно присутствие антител. Впервые опубликовали данные об обнаружении антител к ткани щитовидной железы в сыворотке у пациентов с аутоиммунным тиреоидитом в 1956 году. Впоследствии выяснилось, что аутоиммунный тиреоидит подразумевает наличие антител к тиреоглобулину, второму коллоидному антигену и тиреопероксидазе (микросомальному антигену).
Провоцирующие факторы
Сегодня принято считать, что апоптоз, то есть программируемая гибель фолликулярных клеток щитовидной железы — одна из главных причин аутоиммунного тиреоидита и других патологий щитовидной железы. [2] Предполагается, что запуску апоптоза способствуют вирусы и генетические нарушения.
Чем опасен тиреоидит во время беременности
Аутоиммунный тиреоидит у женщины никак не отражается на возможности забеременеть и родить здорового ребёнка при условии, что у пациентки нормальный уровень гормонов — тиреотропный гормон (ТТГ) до 2,5 мЕд/л, в том числе в первом триместре беременности.
При гормональном нарушении возможны следующие осложнения:
-
;
- выкидыш;
- преждевременные роды;
- проблемы со сном;
- поздний токсикоз; ;
- кровотечения после родов;
- гипоксия плода;
- неонатальный тиреотоксикоз.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы аутоиммунного тиреоидита
Изначально, на протяжении некоторого времени, больные не высказывают никаких жалоб. Постепенно с течением времени регистрируют медленное развитие клинической картины снижения функции щитовидной железы, вместе с тем в части ситуаций будет отмечаться прогрессирующее уменьшение размеров железы или же наоборот ее увеличение. [3]
Клинические проявления при хроническом аутоиммунном тиреоидите начинают появляться с нарушением функции щитовидной железы, но в части ситуаций симптомов может и не быть. Все симптомы аутоиммунного тиреоидита щитовидной железы неспецифические, т. е. могут быть при многообразных заболеваниях. Но несмотря на это, все же обозначим клинические проявления, имея которые следует обратиться к эндокринологу для обследования.

Патогенез аутоиммунного тиреоидита
Эндогенный (внутренний) критерий наследования аутоиммунных заболеваний взаимосвязан с клонами Т-лимфоцитов.
- Чтобы произошло развитие хронического заболевания с учетом имеющейся наследственной предрасположенности, нужно влияние экзогенных факторов (вирусных и любых других инфекций, фармпрепаратов), которые способствуют активации Т-лимфоцитов, те впоследствии активируют В-лимфоциты, запуская цепную реакцию.
- Далее Т-клетки, кооперируясь с антитиреоидными антителами, воздействуют на эпителиальные клетки фолликулов, содействуя их деструкции, вследствие чего снижается численность правильно функционирующих структурных единиц щитовидной железы. [1][4]
Количество антитиреоидных антител при этом заболевании непосредственно отражает выраженность аутоиммунного процесса и иногда имеет склонность уменьшаться по мере увеличения продолжительности заболевания. Только присутствия антитиреоидных антител недостаточно, чтобы травмировать структурные элементы щитовидной железы.
Для реализации токсических свойств имеющимся антителам необходимо вступить во взаимодействие с Т-лимфоцитами, которые чувствительны к антигенам щитовидной железы при ХАИТ, чего не бывает при наличии обычного зоба или если патология щитовидной железы не выявлена.
В норме все клетки имеют иммунологическую нечувствительность к другим клеткам собственного организма, которая приобретается во время внутриутробного развития (еще до рождения), во время взаимодействия зрелых лимфоцитов со своими антигенами. Любые нарушения в данном взаимодействии и синтез особых клонов Т-лимфоцитов, которые вступают во взаимодействие со своими же антигенами, и могут стать той причиной, которая приводит к нарушению иммунологической нечувствительности и впоследствии привести к формированию любых аутоиммунных патологий, включая и ХАИТ.
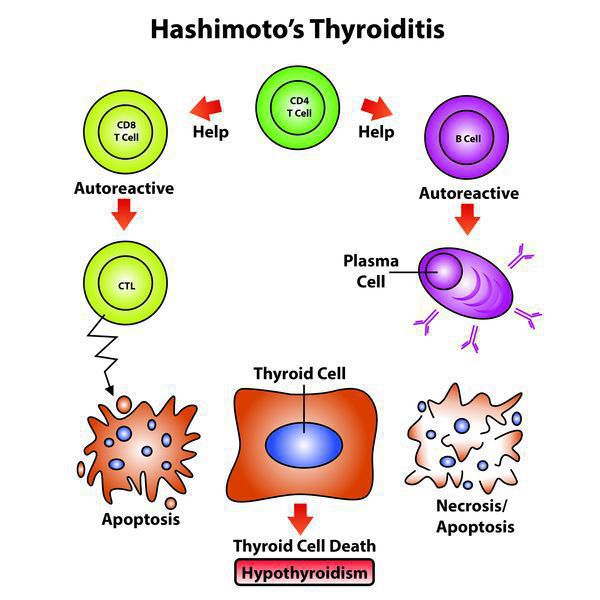
Классификация и стадии развития аутоиммунного тиреоидита
Формы ХАИТ с учетом объема железы и данных клиники:
- Гипертрофическая (тиреоидит Хасимото). Наиболее распространена. Щитовидная железа отличается плотностью, увеличена до II или III степени. Функция железы чаще не изменена, однако в большинстве ситуаций регистрируют тиреотоксикоз или гипотиреоз. Встречается у 15-20% больных.
- Атрофическая. Щитовидная железа в норме или незначительно увеличена, а на момент осмотра может быть даже уменьшена. Функционально — гипотиреоз. Встречается у 80-85% пациентов.
Еще одна классификация аутоиммунного тиреоидита щитовидной железы: [2]
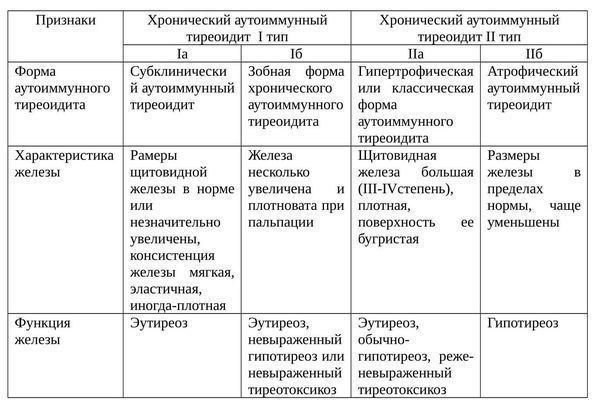
Фазы ХАИТ с учетом клинической картины заболевания:
- Эутиреоидная. Бессимптомное продолжительное (иногда пожизненное) течение, без изменений в функции щитовидной железы.
- Субклиническая. Если заболевание прогрессирует, то поскольку происходит деструкция клеток щитовидной железы и уменьшается уровень тиреоидных гормонов, повышается синтез тиреотропного гормона (ТТГ), который в свою очередь чрезмерно стимулирует щитовидную железу, благодаря чему организм поддерживает на нормальном уровне секрецию Т4.
- Фаза тиреотоксикоза. Поскольку заболевание продолжает развиваться, в кровь высвобождаются имеющиеся тиреоидные гормоны и формируется тиреотоксикоз. Не считая этого, в кровь попадают разрушенные части внутренних структур фолликулярных клеток, в результате образуются антитела к клеткам щитовидной железы. Когда при прогрессирующей деструкции щитовидной железы концентрация гормонопродуцирующих клеток снижается ниже допустимого предела, концентрация в крови Т4 стремительно уменьшается, развивается стадия явного гипотиреоза.
- Фаза гипотиреоза. Продолжается приблизительно в течение года, чаще всего после этого происходит восстановление функции щитовидной железы. Иногда гипотиреоидная фаза продолжается всю жизнь.
ХАИТ преимущественно протекает только с одной фазой заболевания. [5]
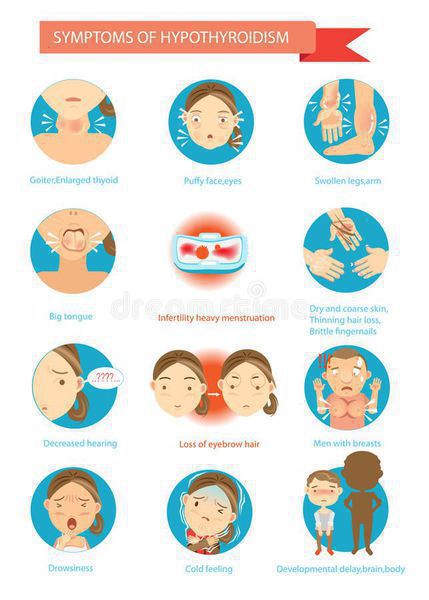
Осложнения аутоиммунного тиреоидита
ХАИТ — условно безопасное заболевание, не приводящее к осложнениям только при условии сохранения необходимой концентрации гормонов в крови, т. е. эутиреоидного состояния. И, соответственно, тогда никаких осложнений не развивается. Но при наступлении гипотиреоза могут наблюдаться осложнения. При отсутствии лечения гипотиреоза могут возникать осложнения: нарушение репродуктивной функции, выраженное снижение памяти, вплоть до слабоумия, анемия, но самое грозное и тяжелое осложнение гипотиреоза — гипотиреоидная или мексидематозная кома — возникает при резкой недостаточности гормонов щитовидной железы. [5] [6]
Диагностика аутоиммунного тиреоидита
Диагностика ХАИТ состоит из нескольких пунктов. Для определения данного заболевания у больного необходим минимум один большой критерий, если таких критериев не обнаружено, то диагноз лишь вероятен. [1]
Большие диагностические критерии:
- первичный гипотиреоз (причем возможен как манифестный, так и устойчивый субклинический);
- присутствие антител к ткани щитовидной железы;
- ультразвуковые критерии аутоиммунной патологии.
Пальпация щитовидной железы
Какие анализы нужны, чтобы определить АИТ
Для установления аутоиммунного тиреоидита необходимо сдать кровь на тиреотропный гормон ( ТТГ), тироксин свободный (Т4 свободный) и антитела к тиреопероксидазе (ТПО). Если антитела к ТПО повышены, но ТТГ в пределах нормы, то диагноз АИТ носит вероятный характер.
Нужно заметить, что при обнаружении у больного гипотиреоза манифестного или стабильного субклинического, диагностирование аутоиммунного тиреоидита важно для установления причины уменьшения функции железы, но несмотря на это постановка диагноза никак не меняет терапевтических методов. Лечение заключается в употреблении заместительной гормональной терапии препаратами тиреоидных гормонов.
Использование пункционной биопсии щитовидной железы не показано для установления хронического аутоиммунного тиреоидита. Ее необходимо проводить, только если имеются узлы щитовидной железы, более 1 см в диаметре.
Важно отметить, что нет надобности контролировать в течение болезни количество имеющихся антител к щитовидной железе, потому что данная процедура не имеет диагностической роли для анализа прогрессирования аутоиммунного тиреоидита. [7]
Лечение аутоиммунного тиреоидита
Терапия аутоиммунного тиреоидита щитовидной железы неспецифическая. При формировании фазы тиреотоксикоза достаточно применения симптоматической терапии. При формировании гипотиреоза главным вариантом медикаментозной терапии является назначение тиреоидных гормонов. Сейчас в аптечной сети РФ возможно приобрести только таблетки Левотироксина натрия (L-тироксин и Эутирокс). Применение таблетированных препаратов тиреоидных гормонов нивелирует клинику гипотиреоза и при гипертрофической форме аутоиммунного тиреоидита вызывает уменьшение объема щитовидной железы до допустимых значений.
В случае обнаружения у пациента манифестного гипотиреоза (повышение уровня тиреотропного гормона и снижение концентрации Т4 свободного) необходимо использование в лечении левотироксина натрия в средней дозе 1,6 – 1,8 мкг/кг массы тела пациента. Показателем правильности назначенного лечения будет являться уверенное удержание в пределах референсных значений тиреотропного гормона в крови больного.
Когда у больного диагностирован субклинический гипотиреоз (увеличена концентрация ТТГ в совокупности с неизмененной концентрацией Т4 свободного), необходимо:
- Спустя 3–6 месяцев вторично провести гормональное обследование для доказательства наличия изменения функции щитовидной железы;
- Когда в течение беременности у пациентки обнаружено увеличение уровня тиреотропного гормона, даже при сохраненной концентрации Т4 свободного, назначить левотироксин натрия в полной расчетной заместительной дозе сразу же;
- Лечение левотироксином натрия нужно при постоянном субклиническом гипотиреозе (увеличение концентрации тиреотропного гормона в крови свыше 10 мЕд/л, и еще в ситуациях не менее двукратного определения концентрации тиреотропного гормона между 5 – 10 мЕд/л), но если этим больным более 55 лет и у них имеются сердечно-сосудистые патологии, лечение левотироксином натрия назначается только при отличной переносимости лекарства и при отсутствии сведений о декомпенсации данных болезней на фоне приема тироксина;
- Показатель достаточности лечения субклинического гипотиреоза представляет собой стабильное удержание уровня ТТГ в пределах референсных значений в крови.
Если у женщин перед планированием беременности, выявлены антитела к ткани щитовидной железы и/или ультразвуковые признаки аутоиммунного тиреоидита, нужно определить гормональную функцию щитовидной железы (концентрацию тиреотропного гормона и концентрацию Т4 свободного) и обязательно определять уровень гормонов в каждом триместре беременности. [8]
Если поставлен диагноз аутоиммунный тиреоидит, но не выявляются изменения в работе щитовидной железы, применение препаратов левотироксина натрия не показано. [9] Оно возможно иногда в исключительных ситуациях внушительного увеличения объема щитовидной железы, спровоцированного аутоиммунным тиреоидитом, при этом решение принимается по каждому пациенту индивидуально. [10]
Физиологическое количество калия йодита (приблизительно 200 мкг/сутки) не могут спровоцировать формирование гипотиреоза и не осуществляют негативного воздействия на функцию щитовидной железы при ранее развившемся гипотиреозе, вызванном аутоиммунным тиреоидитом.
Питание при аутоиммунном тиреоидите
Продуктов, которые влияют на течение аутоиммунного тиреоидита, не существует. Глютен или лактоза не имеют отношения к гипотиреозу на фоне АИТ. Поэтому рекомендации по питанию для людей с аутоиммунным тиреоидитом такие же, как и для всех остальных: разнообразное сбалансированное питание с достаточным употреблением воды.
Существуют ли народные способы лечения
Аутоиммунный тиреоидит лечат только медицинскими препаратами, которые назначает эндокринолог. Отсутствие адекватной терапии может грозить опасными осложнениями: нарушением репродуктивной функции, выраженным снижением памяти (вплоть до слабоумия), анемией и комой, которая возникает при резкой недостаточности гормонов щитовидной железы.
Прогноз. Профилактика
Хронический аутоиммунный тиреоидит прогрессирует обычно крайне медленно, с развитием гипотиреоидного состояния спустя несколько лет. В отдельных ситуациях состояние и трудоспособность сохраняются в течение 15-18 лет, даже с учетом непродолжительных обострений. В фазе обострения тиреоидита регистрируются симптомы невыраженного либо гипотиреоза, либо тиреотоксикоза.
Сегодня методов профилактики хронического аутоиммунного тиреоидита не найдено.
Что такое тиреотоксикоз (гипертиреоз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., эндокринолога со стажем в 28 лет.
Над статьей доктора Курашова О. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Тиреотоксикоз (гипертиреоз) — гиперметаболический процесс, вызванный избытком тиреоидных гормонов в организме и их токсическим воздействием на различные органы и ткани. Клинически характеризуется увеличением щитовидной железы и поражением других систем и органов. [3] [5] [11]
Первые описания этой патологии были найдены в работах персидского врача Джурджани, созданных в 1100 году. [5] [11]
Данный синдром встречается как у женщин (до 2%), так и у мужчин (до 0,2%). Чаще он возникает у людей в возрасте 20-45 лет.
Причины тиреотоксикоза
Причин возникновения тиреотоксикоза множество. К основным относятся:
- повышение продукции гормонов щитовидной железой вследствие различных заболеваний (диффузно-токсический, узловой зоб и другие);
- избыточный приём препаратов, содержащих гормоны щитовидной железы (нарушение назначенной схемы лечения гипертиреоза).
Факторы риска
Провоцирующим фактором синдрома является дополнительное количество йода, поступающее в организм при самостоятельном использовании йодных добавок.
Состояние тиреотоксикоза при диффузно-токсическом зобе является аутоиммунным заболеванием. Обычно оно развивается в результате избыточной выработки антител к рецептору тиреотропного гормона (ТТГ), производимого гипофизом.
Возникновение тиреотоксического состояния возможно при возникновении функциональной автономии уже существующего узла щитовидной железы — одно- и многоузлового зоба. Это заболевание развивается достаточно долго, в основном у людей, старше 45 лет. Так, в отсутствие воздействия ТТГ — основного физиологического стимулятора [7] [8] — узлы синтезируют количество тиреогормонов, превышающее потребность организма. [5] [6] [11]
Тиреотоксикоз при беременности
Во время беременности потребность организма женщины в тиреоидных гормонах возрастает на 30–50 %, поэтому изменение работы щитовидной железы происходит уже с первых недель беременности. Вследствие этого у 2 % беременных развивается гестационный гипертиреоз. Беременным рекомендуется вовремя обратиться к лечащему врачу, провести диагностику и подобрать необходимое индивидуальное лечение.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы тиреотоксикоза (гипертиреоза)
При опросе пациентов с подозрением на повышенную функцию щитовидной железы выявляются:
- непредсказуемая возбудимость, эмоциональная неустойчивость, беспричинная плаксивость;
- беспокойство и нарушение концентрации внимания, возникающее при нахождении в обществе;
- ежедневное нарушение сна;
- суетливость при выполнении любой работы;
- слабость во время ходьбы;
- повышенная потливость диффузного характера, не зависящая от физического или эмоционального напряжения, ощущение «жара»;
- периодические сердцебиения;
- дрожь в теле и нарастающая потеря веса (наблюдаются редко).
Эмоциональные расстройства сочетаются с двигательно-волевыми: появляется необходимость в постоянном движении и хореоподобные подёргивания. Причём тремор конечностей и тела - типичный симптом тиреотоксикоза. [2] [3] [5] [11]
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Современный взгляд на проблему лечения витилиго
Журнал: Клиническая дерматология и венерология. 2012;10(2): 118‑123
Усовецкий И.А., Шарова Н.М., Короткий Н.Г. Современный взгляд на проблему лечения витилиго. Клиническая дерматология и венерология. 2012;10(2):118‑123.
Usovetskiĭ IA, Sharova NM, Korotkiĭ NG. The current view of the problem of vitiligo therapy. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(2):118‑123. (In Russ.).
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Представлены результаты собственных исследований, посвященных особенностям клинического течения разных форм витилиго, некоторым патогенетическим аспектам развития данного заболевания и оценке клинической эффективности комплексной терапии сегментарной и несегментарной формы витилиго.
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Витилиго характеризуется внезапным возникновением депигментированных пятен вследствие нарушения секреторной функции меланоцитов или их гибели, развивается у лиц с генетической предрасположенностью, сопровождается выраженными дисрегуляторными изменениями клеточно-опосредованных реакций иммунной системы, вегетативного дисбаланса с преобладанием симпатического тонуса и серьезной социальной дезадаптацией, обусловленной личностными особенностями и внешними социальными факторами.
Витилиго является распространенным дерматозом. В мире число больных с данным заболеванием превышает 1% всего населения. В 70% случаев заболевание начинается в возрасте 10—25 лет, дети младше 10 лет, в том числе новорожденные и грудного возраста, составляют приблизительно 25% всех больных витилиго [1]. Витилиго может возникнуть в любом возрасте, длиться неопределенно долго, самопроизвольное восстановление нормальной окраски кожи наблюдается редко.
Причины появления депигментированных очагов не известны. Недостаточно понятно, в результате каких нарушений резко прекращается синтез меланина и погибают меланоциты. Разные эндогенные и экзогенные факторы могут оказывать прямое и опосредованное повреждающее действие на меланоциты.
Среди внешних факторов наибольшее значение придают инфекционным и токсическим агентам, чрезмерному ультрафиолетовому облучению, стрессам. На протяжении многих десятилетий витилиго связывали с аутоиммунным тиреоидитом, ревматоидным артритом, красной волчанкой, атопическим дерматитом, заболеваниями печени инфекционного или токсического генеза, глистной инвазией и рядом врожденных синдромов [2]. Однако частота встречаемости витилиго у этих больных не выше, чем в популяции в целом. Ряд авторов [3, 4], подводя итоги многолетним исследованиям, считают, что больные витилиго в большинстве случаев не имеют никаких тяжелых или хронических сопутствующих заболеваний, а терапия выявленных у 28% больных функциональных расстройств органов пищеварения, вегетососудистой дистонии не оказывала влияния на результат репигментации.
Многие исследователи считают [5, 6], что витилиго является серьезным косметическим дефектом, возникает у лиц с генетической предрасположенностью и в у большинстве случаев, перенесших эмоциональные расстройства. Лишь у 4—7% больных витилиго сочетается с аутоиммунным тиреоидитом.
В современных генетических исследованиях продемонстрирована связь возникновения витилиго с разными аспектами наследования. Среди спорадических случаев витилиго в европейской популяции средний возраст возникновения заболевания составляет 24,2 года, тогда как в семьях с множественными случаями заболевания средний возраст составляет 21,5 года (статистически достоверные различия) [7]. Более раннее начало заболевания в «семейных» случаях и риск заболевания у отдаленных родственников является типичной характеристикой полигенного заболевания. Около 20% больных витилиго имеют не менее одного кровного родственника с подобным заболеванием. Формально-генетический сегрегационный анализ витилиго определяет существование многих локусов, нарушения в которых формируют предрасположенность к витилиго. Однако не обнаружены ключевые гены, ответственные за манифестацию, прогрессирующее течение или предрасположенность к данному заболеванию.
При витилиго обнаружено снижение антиоксидантного потенциала, приводящего к активному повреждающему воздействию на меланоциты свободных радикалов и накоплению продуктов перекисного окисления липидов [8, 9]. Позднее выяснилось, что свободные радикалы оказывают повреждающее действие на разные клетки, участвующие в воспалительных реакциях разного типа, и нарушения антиоксидантной защиты не являются основными механизмами депигментации при витилиго.
Теория нарушений иммунных механизмов регуляции является наиболее обоснованной. При длительном течении и распространенном патологическом процессе наблюдаются изменения в субпопуляционном составе Т-лимфоцитов. Одновременно с этим, особенно на начальных стадиях заболевания, повышаются уровни активационных рецепторов лимфоцитов, отражающие степень активации иммунокомпетентных клеток [10]. В настоящее время большинство исследователей полагают, что ведущая роль в развитии аутоиммунных заболеваний принадлежит клеточно-опосредованным реакциям, при которых наблюдается выраженный дисбаланс цитокинов. При витилиго выявляется снижение активности регуляторных Т-лимфоцитов, что подтверждается уменьшением количества трансформирующего фактора роста-β (TGF-β) и интерлейкина-10 (ИЛ-10) в сыворотке крови больных [11].
Лечение витилиго является сложнейшей задачей. Так как причины его возникновения неизвестны, в большинстве случаев заболевание развивается на фоне полного физического благополучия. Предлагается применять в основном топические стероиды и/или иммуномодуляторы при площади поражения до 20%, а также длительную фототерапию [12, 13]. В комплексную терапию включают ферментные препараты, гепатопротекторы, витамины и микроэлементы (цинк, медь) [14, 15]. В ряде рекомендаций содержатся сведения о применении седативных и антидепрессивных средств.
Цель настоящего исследования — изучение клинических особенностей течения витилиго и эффективности комплексной терапии, включающей иммуномодулирующий компонент — тимоген и наружно 1% пимекролимус, и коррекцию аффективных расстройств у больных разными формами витилиго с использованием препарата антидепрессивного действия агомелатин.
Материал и методы
Все больные разными формами витилиго были полностью обследованы (проведены клинические анализы крови и мочи, биохимический анализ крови, ультразвуковое исследование органов брюшной полости и щитовидной железы, гормоны щитовидной железы Т3, Т4, тиреотропный гормон — ТТГ и антитела к тиреоидной пероксидазе — АТ-ТПО по показаниям, консультация невропатолога по показаниям, консультация психиатра, иммунологические исследования — популяционный и субпопуляционный состав лимфоцитов, уровень провоспалительных и регуляторных цитокинов).
Результаты
Под нашим наблюдением с 2006 по 2011 г. находились 84 больных витилиго (46 женщин, 38 мужчин) в возрасте от 18 до 56 лет.

Давность заболевания варьировала от 6 мес до 30 лет, средняя продолжительность составила 6,5±4,8 года. Среди вероятных причин развития витилиго большинство больных называли перенесенный стресс (39 пациентов, 46%). Витилиго возникло после оперативных вмешательств у 3 (3,5%) пациентов, после травм — у 4 (4,5%). По мнению 4 (5%) женщин, впервые депигментированные пятна появились у них после родов, в период лактации, причем 1 пациентка отмечала, что после 2- и 3-х родов увеличивалась площадь поражения и появлялись свежие очаги. У 14 (17%) больных заболевание возникло после воздействия длительного ультрафиолетового излучения, 20 (24%) пациентов не могли связать появление депигментированных пятен с какими-либо значимыми причинами (рис. 1). Рисунок 1. Вероятные причины развития витилиго. У 21 больного среди ближайших родственников имелись проявления витилиго разной давности и степени распространенности, у 2 из них, помимо поражений кожи были обесцвечены участки волос.
При обследовании больных витилиго обнаружено, что наиболее часто (у 48 больных, 57,1%) встречаются дискинезия желчевыводящих путей и желчекаменная болезнь, хронический холецистит, жировой гепатоз. Гастрит обнаружен у 16 (19%) больных. В процессе обследования патология щитовидной железы (аутоиммунный тиреоидит, диффузный токсический зоб, кисты щитовидной железы) выявлена или подтверждена у 13 (15,4%) больных витилиго. Только у 4 больных из 13 с патологией щитовидной железы были обнаружены АТ-ТПО, что подтверждало диагноз аутоиммунный тиреоидит.

Гинекологические заболевания (дисфункциональные нарушения менструального цикла, миома) обнаружены у 5 (5,9%) женщин. У 10 (11,9%) больных подтверждена гипертоническая болезнь I—II степени, у 1 (1,2%) выявлен сахарный диабет 2-го типа, у 3 (3,5%) обнаружено алиментарное ожирение II—III степени. Достоверных отклонений от нормальных значений в клинических анализах крови не обнаружено. Тяжелых хронических заболеваний или декомпенсированных состояний у больных витилиго не выявлено (табл. 1).
Мы наблюдали за больными с разными формами витилиго (табл. 2). Среди них 7 (8,3%) больных имели сегментарную форму с площадью поражения 2% (рис. 2). Рисунок 2. Сегментарная форма витилиго. Вульгарная форма наблюдалась у 44 (52,3%) больных. В этих случаях площадь поражения составляла 3—70% площади кожного покрова (рис. 3, а, б). Рисунок 3. Пациентка (а) и пациент (б) с вульгарной формой витилиго. Отдельную группу составили больные с акрофациальной формой (31 человек, 36,9%) с депигментированными очагами на лице и конечностях (рис. 4, а—в). Рисунок 4. Акрофациальная форма витилиго (а—в). У 10 (11,9%) пациентов при клиническом обследовании обнаружены невусы Сеттона (рис. 5). Рисунок 5. Невусы Сеттона.
Витилиго является серьезной психологической проблемой [16, 17]. При исследовании уровня тревожности методом Спилбергера—Ханина низкий уровень реактивной тревожности наблюдается у 52 (61,9%) больных, а у 32 (38,1%) — умеренно выраженная реактивная тревожность. У 55 (77,4%) больных витилиго отмечен высокий уровень личностной тревожности, причем он не зависел ни от площади поражения, ни от давности заболевания. Наличие депрессивных расстройств подтверждены с помощью госпитальной шкалы Гамильтона (средний показатель 13,9±2,4 балла) и шкалы Бека (средний показатель 22,4±2,8 балла). У большинства обследованных выявлялись депрессивные расстройства невротического уровня, характеризующиеся подавленностью настроения, нарушением сна, тревожными и астеническими проявлениями.
Таким образом, в ходе обследования каких-либо тяжелых сопутствующих заболеваний не выявлено. По данным литературы, аффективные и вегетативные нарушения наблюдаются практически у всех больных витилиго и требуют адекватной коррекции.
При иммунологическом исследовании, проведенном 25 больным витилиго, обнаружены достоверные отклонения от контрольных значений в субпопуляционном составе Т-лимфоцитов и дисбаланс провоспалительных цитокинов (табл. 3; рис. 6). Рисунок 6. Содержание цитокинов в сыворотке больных витилиго. Примечание. ИЛ-2, ИЛ-8, ФНО-α, ИФН-γ, ИЛ-10 в пг/мл; TGFβ, в нг/мл. Так, содержание CD8+ в крови больных витилиго было достоверно выше, чем у здоровых, иммунорегуляторный индекс (ИРИ) также имел достоверные отличия от контрольных значений. В сыворотке крови больных витилиго обнаружено повышенное содержание ИЛ-2, ИЛ-6, ИЛ-8 и фактора некроза опухоли-α (ФНО-α), интерферона-γ (ИФН-γ) на фоне низкого уровня регуляторных цитокинов TGF-β и ИЛ-10 по сравнению с контролем.
Комплексное лечение больных проводили с учетом клинических особенностей витилиго, в том числе давности, распространенности и активности патологического процесса. Использовали направленную иммуномодулирующую терапию — тимоген (назальный спрей по 1 мл/сут в течение 20 дней) и пимекролимус (1% крем 2 раза в сутки в течение 4—6 мес). Психокорригирующую терапию проводили агомелатином, который является агонистом мелатонина (МТ1- и МТ2-рецепторов) и антагонистом 5НТ2с. Агомелатин больные витилиго принимали по 25 мг/сут 1 раз в день не менее 6 нед. После консультации психиатра 5 больным с умеренно выраженными признаками депрессии агомелатин был назначен в суточной дозе 50 мг на 12—24 нед.
Мы провели комплексное лечение 57 больным разными формами витилиго (3 пациента — с сегментарной формой, 25 — с акрофациальной, 29 — вульгарной).
У всех больных с сегментарной формой витилиго 100% репигментация наблюдалась через 4 мес после начала терапии.
У больных акрофациальной формой полная клиническая ремиссия отмечена в 16 (64%) случаях через 5 мес терапии. Значительное улучшение со 100% репигментацией большинства очагов и уменьшением площади очагов депигментации более чем на 60% имелось у 7 пациентов. Незначительная эффективность отмечена у 2 больных, причем полностью восстановилась нормальная окраска кожи в периорбитальных и периоральной областях, на тыльной поверхности кистей и в области фаланг площадь депигментированных очагов практически не изменилась, частично (до 40%) уменьшилась площадь очагов в области голеностопных суставов.
Положительные изменения после проведенной комплексной терапии наблюдались у всех больных вульгарной формой витилиго. Клиническая ремиссия отмечалась у 20 из 29 больных данной группы.
В течение первых 3 мес терапии (12 нед) у этих пациентов началась активная репигментация очагов, площадь которых сокращалась на 30—60%. К концу 6-го месяца цвет кожи восстановился полностью.

У 6 больных наблюдалось сокращение площади депигментированных очагов на 50—70% за счет полной репигментации отдельных очагов и частичного восстановления нормального цвета кожи отдельных участков. У 3 пациентов отмечались незначительные позитивные изменения, которые выражались в восстановлении пигментации свежих, небольших по площади участков (не более 2 см 2 ), сглаживании границ по периферии очагов депигментации (табл. 4).
Все больные хорошо переносили лечение, побочных эффектов, осложнений, отказов от терапии не было. В процессе терапии удалось изменить отношение пациентов к своему заболеванию, оценить позитивные изменения в процессе лечения. На фоне активной репигментации очагов нормализовались иммунологические показатели и произошла редукция признаков депрессивных расстройств.
Таким образом, полученные нами результаты свидетельствуют о возможности обоснованного эффективного и безопасного лечения витилиго.
Число больных с заболеваниями щитовидной железы неуклонно растет, что связано с воздействием неблагоприятных факторов внешней среды, природным йододефицитом, а также с повышением разрешающей способности ультразвуковой аппаратуры [1, 4, 10, 12, 14].
Объем оперативного вмешательства при узловой трансформации щитовидной железы является предметом продолжающихся дискуссий [5]. Многие авторы предлагают выполнять органосохраняющие вмешательства для профилактики послеоперационного гипотиреоза [2, 6, 8]. Другие исследователи являются сторонниками радикальных операций. Они указывают на высокую частоту рецидивов после органосберегающих операций и отмечают, что, несмотря на локальность проявлений, коллоидный пролиферирующий зоб является заболеванием всего органа [7, 13, 18]. В отношении небольших доброкачественных узлов щитовидной железы предпочтительна тактика динамического наблюдения, поскольку применение препаратов L-тироксина признано отечественными и зарубежными авторами неэффективным [5, 15, 17]. В то же время для лечения узловых образований щитовидной железы все чаще используют малоинвазивные методики [1, 3, 9, 11, 16].
Материал и методы
Нами прослежены отдаленные результаты хирургического лечения заболеваний щитовидной железы у 462 больных в сроки от 1 года до 15 лет. Возраст больных варьировал от 22 до 82 лет (средний возраст 54,0±1,0 год). 39,6% больных были старше 60 лет. Среди обследованных мужчин было 38 (8,2%), женщин - 424 (91,8%).
Спектр оперативных вмешательств был следующим: гемитиреоидэктомия произведена 68 (14,8%) больным, субтотальная резекция щитовидной железы - 70 (15,2%), предельно субтотальная резекция щитовидной железы в объеме удаления одной доли с резекцией или субтотальной резекцией другой - 98 (21,2%), тиреоидэктомия - 100 (21,6%) больным. Лазерная деструкция узловых образований щитовидной железы выполнена 69 (14,9%), склеротерапия - 57 (12,3%) больным.
Показаниями к хирургическому лечению явились аденомы щитовидной железы (19,5%), узловой коллоидный зоб (71%), смешанный и диффузный токсический зоб (9,5%). Повторные операции по поводу рецидива выполняли в 26 (5,6%) наблюдениях.
С 2000 по 2010 г. частота аденом щитовидной железы возросла в 2,3 раза на фоне уменьшения частоты узлового коллоидного зоба (в 1,6 раза). В то же время объем хирургического пособия характеризовался увеличением количества тиреоидэктомии (в 3 раза) при снижении удельного веса субтотальной резекции щитовидной железы с 56,1 до 7,7%.
Показаниями к малоинвазивному лечению явились наличие единичного доброкачественного узла щитовидной железы, значимо увеличивающегося в размерах при динамическом наблюдении, а также отказ больного от оперативного лечения. Склеротерапию этанолом проводили при наличии кисты или узла с кистозной дегенерацией. Для лечения солидных узлов использовали интерстициальную лазерную фотокоагуляцию. Доброкачественность образований щитовидной железы подтверждали данными предварительного цитологического исследования материала, полученного при тонкоигольной аспирационной биопсии под контролем ультразвукового исследования.
Лазерная деструкция узлов щитовидной железы выполнена 69 больным. Средний объем узлов составил 1,80±0,22 мл. Интерстициальную лазерную коагуляцию проводили диодным лазером ЛАМИ в импульсно-периодическом режиме. Мощность лазерного излучения составляла от 3,5 до 5,0 Вт, в среднем 4,18±0,05 Вт. Экспозиция облучения колебалась от 1 до 10 мин в зависимости от размера узла, интенсивности интранодулярного кровотока и динамики ультразвуковых изменений в узле. Для достижения положительного результата лечения 9 больным выполнено по 2 сеанса, двум - 3 сеанса, одному - 4 сеанса.
Склеротерапия узловых образований щитовидной железы проведена в 57 наблюдениях. Средний объем узлов составил 2,79±0,65 мл. У 44 (77,0%) больных был выявлен узел с кистозной дегенерацией, у 13 (23,0%) - киста. В качестве склерозанта использовали 96% раствор этанола в количестве 50% исходного объема образования при кистах и 30% - при узлах. 7 пациентам проведена повторная склеротерапия, в одном наблюдении - 3 процедуры.
Результаты и обсуждение
При оценке ближайших результатов хирургического лечения установлено, что в раннем послеоперационном периоде частота постоянного пареза голосовых связок не зависит от объема хирургического вмешательства и при первичных операциях составляет 0,9%, при повторных - 7,7%. Постоянный гипопаратиреоз выявлен в 0,9% наблюдений после первичных операций и в 3,8% наблюдений - после повторных. После склеротерапии и интерстициальной лазерной фотокоагуляции осложнений не наблюдали.
Одним из критериев степени эффективности хирургического пособия является объем неизмененной железистой ткани и ее изменения в отдаленном послеоперационном периоде. Эти изменения определяются объемом первичного оперативного пособия, возрастом больных и величиной рецидивного узла.

В частности, объем тиреоидного остатка после гемитиреоидэктомии и субтотальной резекции щитовидной железы в период от 3 до 10 лет значимо не различался и составил соответственно 5,97±0,58 и 4,99±0,66 мл. Существенно меньше был тиреоидный остаток после предельно субтотальной резекции щитовидной железы - 2,3±0,28 мл (табл. 1).
Как свидетельствуют приведенные данные, после всех операций происходит постепенное увеличение объема остаточной ткани железы. В среднем объем остаточной ткани значительно увеличился через 10 и более лет после операции (в 6,2 раза).
С возрастом способность тиреоидного остатка к регенерации снижалась. Объем остаточной ткани щитовидной железы у больных моложе 60 лет составил 3,86±0,29 мл, у наблюдаемых старше 60 лет - 2,36±0,35 мл (р<0,05).
Из 236 больных, перенесших органосохраняющие операции, рецидив в тиреоидном остатке был выявлен у 93 (39,4%). Формирование рецидива в основном происходило через 5-10 лет после операции. По данным углубленных исследований, рецидив узлов диаметром до 1 см отмечен в 62,3% наблюдений, от 1 до 3 см - в 28%, более 3 см - в 9,7% наблюдений.

При изучении частоты рецидивов в зависимости от характера хирургического вмешательства установлено, что после гемитиреоидэктомии она достигает 45,6%, после субтотальной резекции щитовидной железы - 58,6%, после предельно субтотальной резекции щитовидной железы - 21,4% (табл. 2).
Узлы диаметром до 1 см чаще всего наблюдались после гемитиреоидэктомии и предельно субтотальной резекции щитовидной железы, крупные узлы (более 3 см) - после субтотальной резекции щитовидной железы. По-видимому, через 5 лет после операции у таких больных целесообразно в обязательном порядке проводить мониторинг ультразвукового исследования с целью выявления возможного узлообразования.

Крупные узлы (диаметром 1-3 см и более 3 см) обнаруживали в тиреоидном остатке через 10 и более лет после операции (табл. 3).
Через 10 и более лет после операции развитие узлов с компрессионным синдромом имело место после субтотальной резекции щитовидной железы у 27% больных. Это еще раз подтверждает необходимость патронажа таких больных как хирургами, так и эндокринологами.
Чем старше пациент, тем больше частота узлообразования в тиреоидном остатке. Подобные изменения выявлены у 31,0% больных в возрасте до 60 лет и у 49,1% больных старше 60 лет (р<0,05).
Положительный эффект склеротерапии отмечен в 89,5% наблюдений. Средняя степень редукции узлового образования составила 49,7±5,6%. Объем узлов уменьшился с 2,79±0,65 до 1,41±0,38 мл. Эффективность склеротерапии при кистах была значительно выше, чем при узлах с кистозной дегенерацией (78,1±5,6 и 44,4±6,3% соответственно). Наиболее значительно сократились в размерах узлы с исходным объемом от 1,0 до 3,0 мл (68,4±10,4%). Самую выраженную динамику наблюдали в течение первых 3 мес после процедуры (55,0±5,7% исходного).
После применения интерстициальной лазерной фотокоагуляции уменьшение размеров узла наблюдали у всех пациентов. Объем узлов уменьшился с 1,80±0,22 до 0,92±0,14 мл. Средняя степень редукции составила 55,5±3,0%. В группе больных с небольшими узлами (до 1,0 мл) она была наибольшей и составила 60,3±4,4%. Наиболее значительно узлы сокращались в объеме в течение первого месяца после процедуры (на 42,5±5,8%).
Таким образом, проведенные исследования свидетельствуют о высокой степени индивидуальности при выборе объема операции. Согласно полученным результатам, при сохранении неизмененной железистой ткани предпочтительно выполнение гемитиреоидэктомии и предельно субтотальной резекции щитовидной железы. При наличии соответствующих показаний операцией выбора могут быть малоинвазивные технологии.
Читайте также:

