Что такое полярность эпителиальных тканей
Обновлено: 17.05.2024
Полярность клеток - фундаментальная характеристика многих типов клеток . Эпителиальные клетки являются одним из примеров типа поляризованных клеток, отличающихся отдельными «апикальными», «боковыми» и «базальными» доменами плазматической мембраны . Эпителиальные клетки соединяются друг с другом через свои боковые мембраны, образуя эпителиальные пласты , выстилающие полости и поверхности по всему телу животного. Каждый домен плазматической мембраны имеет особый белковый состав, придающий им особые свойства и позволяющий направленный транспорт молекул через эпителиальный лист. Как эпителиальные клетки генерируют и поддерживают полярность, остается неясным, но было обнаружено, что определенные молекулы играют ключевую роль.
На апикальной мембране расположены различные молекулы, но только несколько ключевых молекул действуют как детерминанты, которые необходимы для поддержания идентичности апикальной мембраны и, таким образом, эпителиальной полярности. Этими молекулами являются белки Cdc42 , атипичная протеинкиназа C (aPKC), Par6 , Par3 / Bazooka / ASIP. [1] Крошки, «Звездная пыль» и белок на плотных контактах (PATJ). Эти молекулы, по-видимому, образуют два различных комплекса: комплекс aPKC-Par3-Par6 «aPKC» (или «Par»), который также взаимодействует с Cdc42; и комплекс Crumbs-Stardust-PATJ "Crumbs". Из этих двух комплексов комплекс aPKC является наиболее важным для эпителиальной полярности, он необходим даже тогда, когда комплекс Crumbs не является. Crumbs - единственный трансмембранный белок в этом списке, а комплекс Crumbs служит апикальным сигналом для поддержания апикального комплекса aPKC во время сложных изменений клеточной формы. [ необходима цитата ]
СОДЕРЖАНИЕ
В контексте почечной канальцевой физиологии, термин базолатеральная мембрана или серозные мембраны относятся к клеточной мембране , которая ориентирована в стороне от просвета каналец, в то время как термин просветной мембраны или апикальная мембрана относится к клеточной мембране , которая ориентирована в стороне просвета . Основная функция этой базолатеральной мембраны - поглощать продукты метаболизма в эпителиальную клетку для вывода в просвет, где они выводятся из организма в виде мочи. . Вторичная роль базолатеральной мембраны состоит в том, чтобы позволить рециркуляцию желательных субстратов, таких как глюкоза , которые были извлечены из просвета канальца для секретирования в интерстициальные жидкости . [2]
Базальные и боковые мембраны имеют общие детерминанты, белки LLGL1 , DLG1 и SCRIB . Все эти три белка локализуются в базолатеральном домене и важны для базолатеральной идентичности и эпителиальной полярности.
Как поляризуются эпителиальные клетки, до сих пор не совсем понятно. Были предложены некоторые ключевые принципы для поддержания полярности, но механизмы, лежащие в основе этих принципов, еще предстоит обнаружить.
Первый принцип - положительная обратная связь . В компьютерных моделях молекула, которая может быть либо ассоциированной с мембраной, либо цитоплазматической, может поляризоваться, когда ее ассоциация с мембраной является предметом положительной обратной связи: такая мембранная локализация происходит наиболее сильно там, где молекула уже наиболее высококонцентрирована. В аналогичных моделях исследователи показали, что эпителиальные клетки могут самостоятельно собираться в богатый набор устойчивых биологических форм. [3] У дрожжей saccharomyces cerevisiae есть генетические доказательства того, что Cdc42 подвержен положительной обратной связи такого рода и может спонтанно поляризоваться даже в отсутствие внешнего сигнала. У плодовой мухи Drosophila melanogaster , Cdc42 рекрутируется комплексом aPKC и затем способствует апикальной локализации комплекса aPKC в вероятной петле положительной обратной связи. Т.о., в отсутствие Cdc42 или комплекса aPKC апикальные детерминанты не могут поддерживаться на апикальной мембране и, следовательно, апикальная идентичность и полярность теряются.
Второй принцип - это разделение детерминант полярности. Четкое различие между апикальными и базо-латеральными доменами поддерживается с помощью активного механизма, предотвращающего смешивание. Природа этого механизма неизвестна, но явно зависит от детерминант полярности. В отсутствие комплекса aPKC базо-латеральные детерминанты распространяются на бывший апикальный домен. Напротив, в отсутствие любого из Lgl, Dlg или Scrib, апикальные детерминанты распространяются на бывший базо-латеральный домен. Таким образом, эти две детерминанты ведут себя так, как будто они взаимно отталкивают друг друга.
Третий принцип - направленный экзоцитоз . Белки апикальной мембраны транспортируются от Гольджи к апикальной, а не базо-латеральной мембране, потому что апикальные детерминанты служат для идентификации правильного места назначения для доставки везикул . Родственный механизм, вероятно, действует для базо-латеральных мембран.
Четвертый принцип - модификация липидов. Компонент липидного бислоя, фосфатидилинозитолфосфат (PIP), может фосфорилироваться с образованием PIP 2 и PIP 3 . В некоторых эпителиальных клетках PIP 2 локализуется апикально, тогда как PIP 3 локализуется базолатерально. По крайней мере, в одной культивируемой клеточной линии, клетке MDCK, эта система необходима для эпителиальной полярности. Связь между этой системой и детерминантами полярности в тканях животных остается неясной.
Поскольку базальная и боковая мембраны имеют одни и те же детерминанты, другой механизм должен различать эти два домена. Форма ячейки и контакты обеспечивают вероятный механизм. Боковые мембраны являются местом контакта между эпителиальными клетками, тогда как базальные мембраны соединяют эпителиальные клетки с базальной мембраной , внеклеточным матричным слоем, который лежит вдоль базальной поверхности эпителия. Некоторые молекулы, такие как интегрины , специфически локализуются на базальной мембране и образуют связи с внеклеточным матриксом.
Эпителиальные клетки бывают разных форм, которые связаны с их функцией в развитии или физиологией. Как эпителиальные клетки принимают определенные формы, плохо изучено, но это должно включать пространственный контроль актинового цитоскелета , который является центральным для формы клеток во всех растительных клетках.
Все эпителиальные клетки экспрессируют молекулу трансмембранной адгезии E-cadherin , кадгерин, который локализуется наиболее заметно на стыке между апикальной и латеральной мембранами. Внеклеточные домены молекул E-кадгерина из соседних клеток связываются друг с другом посредством гомотипического взаимодействия. Внутриклеточные домены молекул E-кадгерина связываются с актиновым цитоскелетом через адаптерные белки альфа-катенин и бета-катенин . [4] Таким образом, E-кадгерин образует слипчивые соединения. которые соединяют актиновые цитоскелеты соседних клеток. Адгезивные соединения являются первичными силовыми соединениями между эпителиальными клетками и фундаментально важны для поддержания формы эпителиальных клеток и для динамических изменений формы во время развития ткани. Как E-cadherin локализуется на границе между апикальной и латеральной мембранами, неизвестно, но поляризованные мембраны важны для поддержания E-cadherin на стыках спаек.
Сортировка белка в поляризованных клетках эпителия
• В поляризованных клетках плазматическая мембрана состоит из отдельных доменов со специфическими наборами белков, и поэтому в этих клетках происходит дополнительная сортировка белков
• В зависимости от типа клеток, сортировка белков поверхности в поляризованных клетках может происходить в транс-Гольджи сети, эндосомах или в одном из доменов плазматической мембраны
• Процесс сортировки белков в поляризованных клетках происходит при участии специальных адаптерных комплексов, а также, вероятно, липидных рафтов (микродоменов) и лектинов
Плазматические мембраны большинства клеток многоклеточных организмов состоят из множества отдельных доменов, расположенных в непрерывном липидном бислое и различающихся между собой по биохимическим, структурным и функциональным характеристикам. Такие клетки считаются «поляризованными». Наиболее типичными примерами таких клеток являются эпителиальные клетки и нейроны.
Эпителиальные клетки выстилают все полости тела (например, кишечник, почки, воздухоносные пути) и, таким образом, обладают двумя поверхностями. Апикальный домен обращен в люмен органа, а базолатеральный граничит с кровью или с примыкающими клетками.
В эпителиальных клетках, специализированных на поглощении питательных веществ (например, клетки эпителия кишечника), на плазматической мембране апикального домена существуют небольшие выросты, которые называются микроворсинки. Они увеличивают общую поверхность клетки, что способствует увеличению поглощения ею питательных веществ.
Апикальная плазматическая мембрана в таких клетках обогащена мембранными белками, которые способствуют захвату клеткой таких питательных компонентов, как аминокислоты, сахара и другие молекулы. Также мембрана богата уникальными гликолипидами.
Напротив, базолатеральный домен содержит большинство мембранных белков (например, ЛНП-рецептор и ЭФР-рецептор) и липидов, находящихся в плазматической мембране неполяризованных клеток. Наряду с этим, переносчики, находящиеся в базолатеральном домене, транспортируют питательные компоненты из клетки в плазму крови.
Межклеточные контактные комплексы, состоящие из плотных контактов, адгезивных контактов и десмосом, разграничивают апикальные и базолатеральные домены. Одна из функций этих комплексов состоит в том, чтобы предотвратить возможность латеральной диффузии компонентов апикальной мембраны в базолатеральный домен, и наоборот.
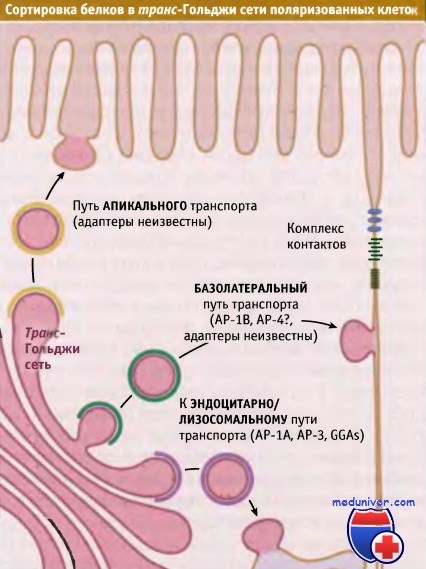
Три типа сортировки, происходящего в транс-Гольджи сети поляризованных клеток эпителия.
Белки сортируются для эндоцитоза и для транспорта через апикальную и базолатеральную мембраны.
Для каждого пути используются свои адаптерные комплексы.
Поэтому липиды и белки должны направляться в соответствующий домен. Транспорт по секреторному механизму и по пути эндоцитоза носит поляризованный характер. Это обеспечивает движение компонентов апикальной и базолатеральной мембран в соответствующих направлениях. Транспорт в базолатеральный домен происходит под действием адресных сигналов, отличающихся от сигналов для апикального транспорта.
В зависимости от того, предназначены вновь образованные мембранные белки для апикальной или базолатеральной поверхности, в транс-Гольджи сети они сортируются по разным типам везикул. Для многих типов поляризованных эпителиальных клеток процесс базолатерального транспорта исследован хорошо. В цитоплазматических доменах большинства базолатеральных белков присутствуют сигналы, содержащие остаток тирозина или два остатка лейцина.
Эти остатки узнаются адаптерными комплексами таким же образом, как это происходит для белков, которые транспортируются по механизму эндоцитоза или направляются в лизосомы. Последовательности, содержащие и иногда не содержащие остатки тирозина, узнаются в транс-Гольджи сети с участием АР-1В, специфичной для эпителиальных клеток изоформы клатринового адаптерного комплекса АР-1. АР-1В связывается с клатрином, образуя транспортную везикулу, ориентированную в базолатеральном направлении. Этот комплекс отличается от широко распространенного комплекса АР-1А только структурой μ-цепи. Субъединицы μ1А и μ1В обладают на 80% одинаковой структурой, однако связывают разные типы сигналов. Причина этих различий не установлена.
Цитоплазматические домены белков, предназначенных для апикальной плазматической мембраны, не содержат специфических сигналов. Вместо этого в домене люмена они содержат критические N- или О-сахарные остатки или имеют особый тип мембранного якорного домена, обеспечивающего их включение в апикально направляющиеся транспортные везикулы. Одним из примеров такого мембранного якоря является GPI, который добавляется к некоторым белкам в эндоплазматическом ретикулуме. Такие везикулы, транспортируемые в апикальном направлении, часто содержат уникальный липидный микродомен, называемый липидный рафт, который накапливает специфические белки, обеспечивая, таким образом, их селективное включение в апикальные везикулы.
Вероятно, этот же механизм в определенной степени позволяет разделять липиды, так что сложные гликолипиды, обнаруженные на апикальной, но не на базолатеральной поверхности эпителиальных клеток, также селективно включаются в эти везикулы.
Для некоторых мембранных белков, в которых отсутствует информация об адресе и которые транспортируются из транс-Гольджи сети и в апикальных, и базолатеральных везикулах, существует третий тип поляризованного адресования. Однако после попадания в плазматическую мембрану эти белки еще могут стать поляризованными. Это происходит в процессе домен-специфического удержания, при котором мембранный белок взаимодействует с предварительно поляризованным цитоскелетом.
Последний содержит белки, которые собираются на мембранных доменах в ответ, например, на такие сигналы, как прикрепление к другой клетке. Часто такой тип цитоскелета собирается в области межклеточных контактов, что обеспечивает асимметричность накопления мембранных белков. Мембранные белки, которые взаимодействуют с таким цитоскелетом, стабилизируются в соответствующем мембранном домене. Однако мембранные белки, попавшие в домен, который не обладает подходящим цитоскелетом, интернализируются путем эндоцитоза, деградируют в лизосомах, или рециклируют.
В последнем случае они получают еще одну возможность попасть в домен с соответствующим цитоскелетом.
Сортировка апикальных и базолатеральных белков также осуществляется в эндосомах. Поскольку эндоцитоз происходит как с апикальной, так и с базолатеральной поверхности эпителиальных клеток, интернализованные белки за счет рециклирования должны вернуться в те домены, из которых они вышли. Очевидно, ранние эндосомы могут вести себя как транс-Гольджи сеть, сортируя апикальные и базолатеральные белки в определенные везикулы рециклирования, которые направляются или к апикальной, или к базолатеральной мембране.
Фактически при сортировке по признаку поляризации в эндосомах используются те же сигналы, что и в транс-Гольджи сети. Чтобы при продолжающемся эндоцитозе эпителиальные клетки могли поддерживать полярность плазматической мембраны, необходимо поляризованное рециклирование содержимого эндосом. Фактически в эндосомах, и в частности, в рециклирующих эндосомах, может происходить биосинтетическая сортировка. Таким образом, в качестве промежуточных звеньев, на пути от транс-Гольджи сети к базолатеральной плазматической мембране, могут использоваться рециклирующие эндосомы. Это, вероятно, объясняет, почему оба пути используют один и тот же набор сигналов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Плотные контакты представляют собой разновидность контактного комплекса, который образуется между соседними эпителиальными или эндотелиальными клетками
• Плотные контакты регулируют транспорт частиц между эпителиальными клетками
• Плотные контакты сохраняют полярность эпителиальных клеток, выполняя функцию «загородки», которая предотвращает миграцию белков плазматической мембраны между апикальной и базальной областью
Межклеточные контакты играют критическую роль в образовании многоклеточных организмов и в обеспечении их жизнеспособности. Вдоль латеральных поверхностей примыкающих друг к другу клеток эпителия и эндотелия могут образоваться три различных типа контактных комплексов. У позвоночных это плотные контакты, адгезивные контакты и десмосомы. У беспозвоночных вместо плотного контакта часто возникает септированный контакт. Взаимное положение контактов схематически представлено на рисунке ниже.
Они поддерживают существование обособленных специализированных областей у многоклеточных организмов и регулируют между ними транспорт молекул. Они также предохраняют клетки от химических и физических повреждений. Мы рассмотрим каждый тип межклеточных взаимодействий, начиная с плотного контакта.
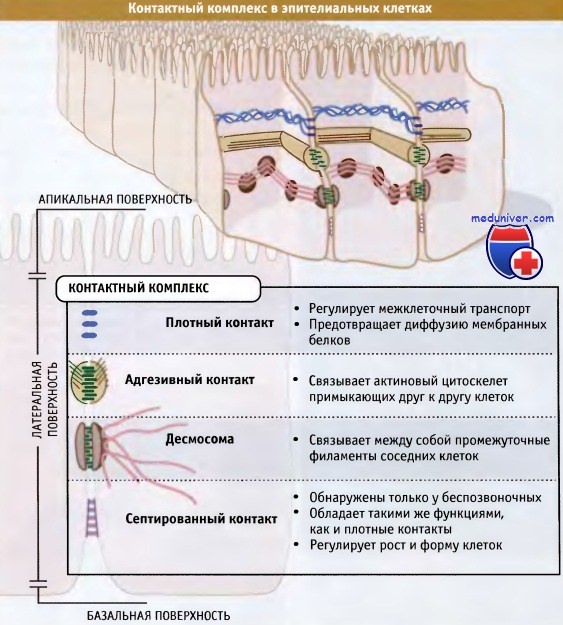
Контактный комплекс подразделяется, по меньшей мере, на три вида межклеточных контактов.
Они обеспечивают эпителиальной клетке возможность поддерживать свою структуру и функционировать в качестве селективного транспортного барьера.
Септированные контакты обнаружены только у беспозвоночных, где они часто присутствуют вместо плотных контактов.
Как видно на рисунке ниже, на фотографии ультратонкого среза клеток в трансмиссионном электронном микроскопе плотные контакты видны в виде групп небольших контактов (иногда называемых «поцелуями»). Эти контакты существуют между латеральными мембранами соседних клеток, расположенными напротив. Белки на цитоплазматической стороне мембраны, примыкающей к этим контактам, имеют вид электронно-плотных «облаков». На сколах замороженных суспензий клеток видна другая картина, которая показывает распределение белка в двух липидных монослоях, разделенных в середине плазматической мембраны.
При этом плотные контакты имеют вид переплетенной сети тонких фибрилл (или нитей), если белки остаются встроенными в мембрану, или же выглядят как сеть углублений, если в процессе скола произошла потеря белков.
Плотные контакты имеют сложный молекулярный состав. В зоне этих контактов обнаружено более 24 белков. Среди них идентифицировано три типа трансмембранных белков: клаудины, окклюдины и контактные адгезивные молекулы (JAM). Клаудины являются основными белками фибриллярных структур плотного контакта. Упомянутые выше поры образуются при организации внеклеточных доменов клаудинов в петли, формирующие селективные каналы в фибриллах.
У млекопитающих идентифицировано по меньшей мере 24 клаудиновых белка, и различные их комбинации формируют каналы, обладающие различной проницаемостью по отношению к ионам. Трансфекция клаудиновых генов в клетки, которые в норме их не экспрессируют, приводит к формированию плотных контактов. Окклюдины латерально сополимеризуются с клаудинами вдоль фибрилл плотного контакта, в латеральном направлении, однако их точная функция неизвестна.
Три трансмембранных белка прочно связаны с девятью или более структурными белками, включая актин. Они также способны к эпизодическому связыванию более двенадцати сигнальных белков. Это позволяет предполагать, что плотные контакты играют дополнительную роль в качестве присутствующих на клеточной поверхности организаторов сигнала, подобно тому как это имеет место для фокального адгезивного комплекса на базальной поверхности клеток.
Многие другие белки зоны плотного контакта, например ZO-1, по своей первичной структуре относятся к семейству мембраносвязанных гуанилаткиназ (MAGUK). Эти белки содержат три домена, расположенные в характерном порядке. Благодаря этим доменам они связываются со многими типами белковых мишеней, включая сигнальные белки и элементы актинового цитоскелета. Некоторые из белков зоны плотного контакта содержат также домен PDZ, который дает им возможность связываться между собой. В модельных экспериментах in vitro с использованием интактных и усеченных форм этих белков продемонстрирована возможность образования в зоне контакта их различных комбинаций.
Плотные контакты играют две важные роли. Во-первых, они представляют собой молекулярные структуры, регулирующие параклеточный транспорт (транспорт материалов, происходящий в пространстве между клетками) в эпителиальных и эндотелиальных слоях. (Ранее считалось, что они функционируют в качестве барьеров, блокирующих (предотвращающих) этот транспорт, и, поэтому, контактные зоны назывались zonula occludens.) Этим плотные контакты напоминают «молекулярный фильтр», через который пропускаются молекулы клеточного окружения при прохождении ими границ эпителия и эндотелия.
Однако не все фильтры одинаковы, поскольку для каждого вида ткани необходим фильтр, способный удалять определенный набор молекул. Например, для ткани почек не обязательно удалять дымовые частицы. Фактически диапазон размеров частиц, проходящих через плотные контакты за счет свободной диффузии, варьирует между 4 и 40 А, в зависимости от типа ткани.
Физические барьеры для транспорта ионов и других растворимых компонентов имеют различную природу: ионы проходят мгновенно, а другим растворимым компонентам для прохождения через плотный контакт необходимы минуты или даже часы. Каким образом это осуществляется? Недавно предложенная модель постулирует, что барьер проницаемости в плотном контакте создается за счет слоев пор, несущих селективные заряды и образующих сетчатую структуру, состоящую из хрупких нитевидных структур. Ионы способны проходить через эти поры, однако для прохождения других растворимых компонентов должна нарушиться целостность нитей.
По мере разрыва и воссоединения нитей компонент постепенно продвигается через барьер контакта, как показано на рисунке ниже.
Вторая роль плотных контактов состоит в том, что в структурном и функциональном отношении они делят плазматическую мембрану поляризованных клеток на два домена. Апикальная (от греч. слова apex — вершина) поверхность представляет собой часть плазматической мембраны, которая ориентирована по направлению к полости или к пространству с одной стороны слоя эпителия. Базальная (или нижняя) поверхность представляет собой область с противоположной стороны, которая находится в контакте с внеклеточным матриксом.
Латеральные поверхности формируют «стороны» между этими двумя областями. Плотные контакты полностью окружают клетки эпителия и эндотелия вдоль латеральной поверхности по границе апикальной и латеральной зон. Тем самым клетка подразделяется на две области: апикальный и базолатеральный домены. Эти домены разграничивают поверхность клетки на область «вершины» и область «основания», играющие различную роль в контроле трансклеточного перемещения метаболитов. Хотя мембранные белки могут диффундировать в плоскости каждого домена, они не мигрируют от одного домена к другому через плотные контакты.
В этом смысле плотные контакты как бы играют роль «изгороди», благодаря которой поддерживается уникальный молекулярный состав в пределах каждого из двух мембранных доменов.
Хотя молекулярные механизмы этого диффузионного барьера исследованы еще недостаточно, идентифицированы два отдельных макромолекулярных комплекса, играющие важную роль в формировании и поддержке полярного распределения белков плазматической мембраны в клетках эпителия и эндотелия. Изменения экспрессии любого из этих белков приводят к утрате клеткой полярности. Эти комплексы обнаружены в плотных контактах и непосредственно связаны с белками, входящими в состав сетчатых структур, о которых шла речь выше.
Электронная микрофотография клеточного препарата, приготовленного методом замораживания-скалывания.
Видна фибриллярная сеть, образующая плотный контакт.
На фотографии, выполненной с помощью трансмиссионного электронного микроскопа (на вставке),
показана связь между мембранами, существующая в плотном контакте. В плотных контактах клетки удерживаются вместе окклюдином, клаудином и контактными адгезивными молекулами. Модель, описывающая процессы быстрого и медленного транспорта растворимых веществ через плотный контакт.
Быстрый транспорт некоторых ионов происходит через ионные каналы, встроенные в фибриллярные структуры контакта.
Медленный транспорт веществ, которые не могут проходить через каналы, осуществляется при возникновении в фибриллах разрывов,
через которые происходит их транспорт. Поскольку существует много фибриллярных слоев, этот процесс транспорта включает несколько стадий.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Влияние продуктов питания на полярность эпителия кишечника
Деятельность клеток скелетных мышц не зависит от полярности клеток. Например, мышечные клетки получают сигналы о поступлении глюкозы от любой точки цитоплазматической мембраны, и, насколько можно в настоящее время предполагать, изменения в экспрессии генов не зависят от места попадания глюкозы в клетку. Клетки в составе эпителия различаются по своей полярности. Это разделение между апикальной (граничащей с содержимым кишки в случае кишечного эпителия) и базолатеральной частями является существенным для активности эпителия. Данное свойство клеток хорошо изучено относительно переноса нутриентов через эпителий кишки. Существуют различия в переносе через апикальную и базолатеральную мембраны ионов, молекул малого размера и макромолекул.
Именно полярность эпителия определяет направление движения этих субстанций через эпителий (внутрь клетки или наружу из нее). Данное свойство следует учитывать также и при обсуждении других функций эпителиальной клетки. Полярность особенно важна при исследовании взаимодействия нутриентов и генов в кишечном эпителии. Полярность эпителиальных клеток характеризует два важнейших механизма, посредством которых нутриенты (и другие компоненты содержимого кишки) оказывают влияние на гены:
(1) прямое воздействие содержимого кишки на энтероциты;
(2) непрямое воздействие, осуществляемое через гормоны, фактор роста и цитокины.
Более того, кишечный эпителий выступает в роли барьера между организмом и внешней средой, которую в данном случае представляет содержимое кишки. Этот барьер не является полностью непроницаемым, поскольку кишечник выборочно «позволяет» макромолекулам проходить через него. Кроме того, происходит активная абсорбция нутриентов. Постепенно стало понятно, что энтероцит выступает в роли иммунной клетки. Он имеет рецепторы для продуктов деятельности бактериальных клеток, а также участвует в экспрессии разнообразных молекул на своей поверхности, имеющей иммуноглобулиновые домены. Эпителиальная клетка также экспрессирует белки, которые могут взаимодействовать с иммуноцитами в кишечнике. К этим белкам относят такие поверхностные молекулы, как молекулы главного комплекса гистосовместимости (ГКГС) класса II и те цитокины, которые высвобождаются из эпителия, например хемокины или интерлейкин (IL) 6.
Перечисленные сигнальные белки дают возможность эпителиальной клетке играть ведущую роль в процессах, происходящих в кишечнике. Исследовательская группа выдвинула гипотезу, что изменения содержимого кишечника регулируют экспрессию эпителиальной клеткой сигнальных молекул. Это означает, что изменения содержимого кишечника в результате вариаций в диете оказывают влияние через эпителий кишечника на другие его структуры, особенно на иммунную систему его слизистой оболочки. Существуют два компонента сигнального пути, связывающие питание и бактерии, находящиеся в просвете кишки, с иммунной системой слизистой оболочки:
(1) афферентный путь, включающий механизмы, посредством которых изменение кишечного содержимого влияет на экспрессию генов в кишечном эпителии;
(2) эфферентный путь, представляющий собой действие белков, экспрессированных эпителиальной клеткой, действующей как компонент иммунной системы кишечника. В настоящее время существуют доказательства функционирования обоих путей.
Современная наука позволяет изучить изменения, происходящие с молекулами в эпителии кишки в ответ на изменения в диете (афферентный путь). В качестве экспериментальной модели может выступить экспрессия молекул ГКГС класса II в эпителии мыши, которая только что перестала получать грудное молоко. Молекулы ГКГС класса II ответственны за презентацию антигена, их экспрессия на эпителии кишечника мышей отмечается после их отлучения от груди, поэтому возможен перевод мышей на привычную для них пищу (корм для мышей) или определенного состава жидкую смесь (энтеральное питание) для изучения разницы между двумя видами питания. Эпителиальные клетки мыши исследовали в разные моменты времени после прекращения кормления ее грудным молоком. При этом изучали экспрессию молекул ГКГС класса II и инвариантную цепь, которая также подвергается экспрессии.
Воздействие энтерального питания (Vivonex) значительно отличалось от такового при кормлении мышей обычным для них кормом.
В норме корм для мышей индуцирует экспрессию генов сигнальных молекул между 20 и 30 днями жизни, в то время как энтеральное питание за этот же период не приводит к экспрессии генов в кишечном эпителии. В настоящее время доказано, что регуляторный нуклеарный белок (трансактиватор класса II, СIIТА) является необходимым и достаточным условием для экспрессии молекул ГКГС класса II.
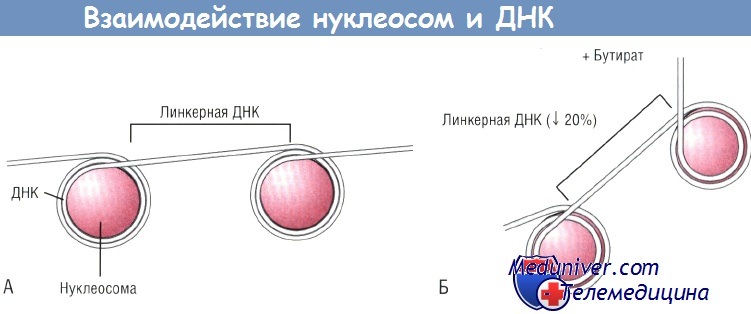
(А) ДНК делает два полных оборота вокруг нуклеосом, состоящих из неацетилированных гистонов.
(Б) При бутират-индуцированном ацетилировании нуклеосомы раширяются, при этом уменьшается количество оборотов ДНК вокруг нуклеосом до 1,8 и сокращается длина связующего их участка ДНК (линкерной ДНК).
В результате ДНК не может линейно следовать от нуклеосомы к нуклеосоме, поворачивается под углом после каждой нуклеосомы, что ведет к нарушению совокупности нуклеосом. ДНК — дезоксирибонуклеиновая кислота.
Были проведены эксперименты с целью изучить, действительно ли влияние питания опосредовано трансактиватором класса II. У мышей были выявлены три изоформы СИТА. Интересно, что нормальная комплексная диета повышала экспрессию молекул ГКГС класса II посредством СIIТА IV. Кроме регуляции молекул ГКГС класса II посредством диеты отмечалась еще и медленная, зависимая от времени регуляция посредством СIIТАIII. Данные эксперименты показывают, что изменения в диете соответствуют определенным изменениям молекулярных взаимосвязей между содержимым кишечника и механизмом сигнальной трансдукции в эпителиальной клетке.
Бактериальная ферментация тех углеводов, которые не абсорбировались в кишечнике, приводит к продукции короткоцепочечных жирных кислот (КЦЖК). Это означает, что уровень бутирата отражает изменения в популяции бактерий и в тех субстратах, которые доступны для метаболизма бактерий. Уровень бутирата сильно зависит от внешних воздействий. Например, у новорожденных детей отмечают очень низкие уровни бутирата как в тонкой, так и в толстой кишке; уровень бутирата в организме ребенка достигает уровня взрослого к 2-летнему возрасту. Интересно, что в течение первых 6 мес жизни уровни бутирата намного выше у детей, находящихся на искусственном вскармливании, чем у детей, получающих грудное молоко.
Следовательно, уровень бутирата отражает те изменения, которые происходят в содержимом кишечника. Было высказано предположение, что концентрация бутирата может изменять активность сигнала в эпителиальной клетке. Исходя из этой гипотезы было исследовано воздействие бутирата на IL-8 и экспрессию моноцитарного хемотаксического протеина 1 (МСР-1). Увеличение концентрации бутирата повышало секрецию IL-8 при одновременном снижении экспрессии МСР-1. Эти эффекты были обнаружены в популяциях неактивных эпителиальных клеток, но наибольшие изменения были характерны для клеток, стимулированных такими провоспалительными агентами, как липополисахариды (ЛПС) или IL-1b.
Известно, что бутират изменяет ацетилирование гистонов. Нуклеосома состоит из соленоида гистонов, вокруг которого дважды «обернута» ДНК. Бутират повышает ацетилирование гистона, тем самым снижая его компактность. В результате ДНК не может «обернуться» вокруг большой нуклеосомы полным оборотом, а нуклеосома теряет способность упаковываться в плотную структуру. Это «обнажает» ДНК и делает ее более подверженной действию факторов транскрипции. Было высказано предположение, что таким образом бутират изменяет экспрессию хемокинов. Для проверки данной гипотезы был использован фунгицид трихостатин A (TSA), в 700 раз более мощный индуктор ацетилирования гистонов по сравнению с бутиратом.
Если бы действие бутирата на секрецию хемокина было обусловлено повышением ацетилирования гистонов, то можно было бы ожидать подобного эффекта и от TSA. Опыты с TSA показали, что TSA повышал секрецию IL-8 и снижал секрецию МСР-1. В нижней части рисунка продемонстрировано, что и TSA, и бутират повышали ацетилирование гистона-4. Неацетилированные гистоны быстрее продвигались через гель и образовывали одну полоску («ступеньку»), в то время как ацетилированные гистоны образовывали «лестницу» в зависимости от степени ацетилирования. Гистон-4 имеет 4 ацетилированных остатка лизина. Таким образом, ацетилирование гистонов будет отражено в образовании «лестницы» из 5 «ступенек». Это можно увидеть при действии бутирата или TSA. Верхняя часть рисунка показывает, что TSA дает такой же эффект, как и бутират. TSA повышает секрецию IL-8 и снижает секрецию МСР-1. Более того, степень увеличения IL-8 меняется в зависимости от степени ацетилирования гистонов. Эффект бутирата на ацетилирование гистонов обратим.
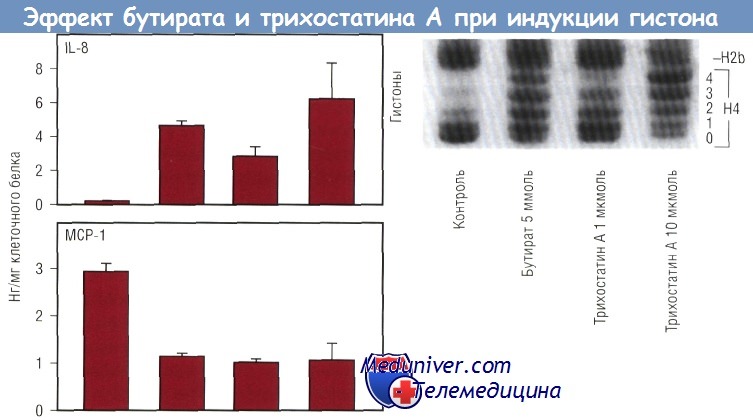
Ацетилирование и секреция хемокина клетками Сасо-2. Как бутират, так и трихостатин А увеличивали ацетилирование гистонов. Одновременно увеличивалась секреция IL-8 и уменьшалась продукция МСР-1 в клетках Сасо-2, стимулированных IL-1.
Трихостатин А, специфический ингибитор гистондеацетилазы, действовал так же, как и бутират, когда поступал в концентрациях, приводящих к сравнимому изменению ацетилирования гистона.
На диаграмме представлены стандартные отклонения трех различных ячеек для каждого вещества, отражающие результаты трех экспериментов. IL — интерлейкин; МСР — моноцитарный хемотаксический протеин.
После прекращения действия бутирата ацетилирование гистонов возвращается к норме и отмечается такое же действие IL-1b на секрецию IL-8 и секрецию МСР-1, как до эксперимента. КЦЖК с различной длиной цепи оказывают дифференцированное влияние на ацетилирование гистонов. Бутират является наиболее действенной КЦЖК, индуцирующей ацетилирование гистонов, в то время как от кислот с большей или меньшей углеводной цепью наблюдаются менее выраженные эффекты. Данное влияние на ацетилирование гистонов обусловлено действием на экспрессию IL-8 и МСР-1. Из всех использованных в опыте КЦЖК именно бутират вызывает наибольшее увеличение секреции IL-8 и наиболее выраженное уменьшение секреции МСР-1.
Итак, эти опыты показывают, что бутират изменяет экспрессию хемокинов в эпителиальной клетке. КЦЖК изменяют экспрессию посредством ацетилирования гистонов. Данные эксперименты, однако, не исключают возможность того, что дополнительное действие бутирата может быть опосредовано промоторными системами. Действительно, недавно проведенные исследования показали, что бутират снижает экспрессию связывающего инсулиноподобный фактор роста белка (IGFBP) 3, посредством ацетилирования протеина, ингибирующего связывание ДНК. В дальнейшем необходимо исследовать взаимосвязь между хромосомной регуляцией, продемонстрированной в приведенном эксперименте, и регуляцией, обусловленной промотором, как для бутирата, так и для других молекул содержимого кишечника.
Доказательство действия экспрессии генов эпителиальных клеток на иммунную систему слизистой оболочки (эфферентного пути) основано на возможности селективного изменения экспрессии генов в эпителиальной клетке кишечника посредством трансгенных технологий. В качестве модели для демонстрации управления иммунной системой слизистой оболочки эпителием была использована экспрессия хемокинов в эпителии. Хемокин IL-8, который у человека отвечает за мобилизацию нейтрофилов, был первым из идентифицированных хемотаксических цитокинов. Однако IL-8 у мышей не экспрессирован. Для изучения действия хемокинов на иммунную систему слизистой оболочки была разработана система, с помощью которой макрофагальный воспалительный белок 2, имеющий эффект, практически подобный эффекту IL-8 у человека, был присоединен к промотору FABPI (белок кишечника, связывающий жирную кислоту).
Промотор активен только в эпителиальных клетках тонкой кишки и проксимального отдела толстой кишки. Была разработана специальная «конструкция», где промотор FABPI и макрофагальный воспалительный белок 2 комплементарной ДНК (кДНК) были присоединены к интрону и полиадениловому «хвосту». Эта «конструкция» была внедрена в яйцеклетку мыши. Было выявлено, что эпителий первой генерации экспрессирует макрофагальный воспалительный белок 2 мРНК. Анализы показали воздействие этой «конструкции» на мобилизацию как нейтрофилов, так и лимфоцитов. У трансгенной мыши отмечали повышенную мобилизацию нейтрофилов в собственной пластинке слизистой оболочки кишечника и в эпителиальных клетках. Эффект хемокина был отмечен только в тех клетках, где промотор FABPI был активен. В тонкой кишке, где промотор FABPI активен, мобилизация нейтрофилов, выражающаяся активностью миелопероксидазы (на единицу массы кишки), была значительно выше у трансгенных мышей. В проксимальной кишке, где промотор FABPI также активен, отмечали увеличение нейтрофильной инфильтрации.
Однако в дистальном отделе толстой кишки, где промотор FABPI неактивен, подобных эффектов отмечено не было. Кроме того, в печени и селезенке трансгенных мышей не выявляли увеличения инфильтрации больше, чем у нормальных мышей (в этих органах промотор FABPI неактивен). На первый взгляд, эти данные свидетельствуют о том, что эпителиальная клетка может посредством высвобождения хемокинов изменять иммунную функцию слизистой оболочки в кишечнике in vivo.
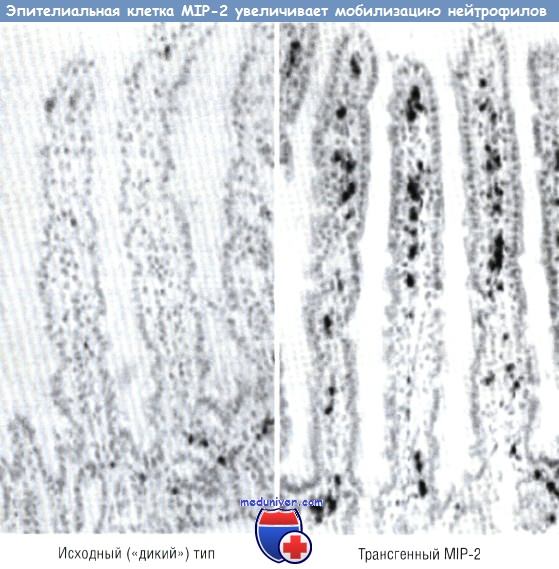
У трансгенной мыши MIP-2 экспрессирует эпителий кишечника, используя эпителий-специфический промотор. Нейтрофилы были локализованы с помощью миелопероксидазы.
MIP — макрофагальный воспалительный белок
Дальнейший анализ иммунной системы показал, что в тонкой кишке помимо инфильтрации нейтрофилов была отмечена повышенная инфильтрация лимфоцитов. Их количество в собственной пластинке слизистой оболочки было увеличено. Также было отмечено удвоение числа лимфоцитов в эпителиальном слое слизистой оболочки кишки. Исследование рецепторов, расположенных на поверхности лимфоцитов, локализованных в эпителии, показало, что лимфоциты экспрессировали CXCR2, который является рецептором, отвечающим за трансдукцию активности макрофагального воспалительного белка 2. Таким образом, эксперименты показывают, что изменение экспрессии только одного хемокина в эпителии влияет на функцию как лимфоцитов, так и нейтрофилов.
Однако изменения содержимого кишечника могут оказывать воздействие на многие хемокины. Кроме того, вероятен эффект воздействия на иммунную систему и других цитокинов. Становится понятно, что изменения экспрессии генов в эпителии оказывают большое влияние на остальные составляющие иммунной системы слизистой оболочки.
Существует гипотеза, что эти сигнальные процессы важны не только для понимания физиологии здорового организма, но и для лечения заболеваний. Например, начальным этапом терапии детей с болезнью Крона в Великобритании является лечебное питание. Несмотря на то что известны многие механизмы, посредством которых энтеральное питание проявляет свои лечебные свойства, есть мнение, что еще одним методом может быть радикальная смена содержимого кишечника до такой степени, что изменятся сигналы, идущие от эпителия кишечника к иммунному компоненту слизистой оболочки, в результате снизится экспрессия воспаления при болезни Крона. Этим методом можно достигать уменьшения активности воспалительного процесса при данной патологии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Полярность клеток - фундаментальная характеристика многих типов клеток . Эпителиальные клетки являются одним из примеров типа поляризованных клеток, отличающихся отдельными «апикальными», «боковыми» и «базальными» доменами плазматической мембраны . Эпителиальные клетки соединяются друг с другом через свои боковые мембраны, образуя эпителиальные пласты , выстилающие полости и поверхности по всему телу животного. Каждый домен плазматической мембраны имеет особый белковый состав, придающий им особые свойства и позволяющий направленный транспорт молекул через эпителиальный лист. Как эпителиальные клетки генерируют и поддерживают полярность, остается неясным, но было обнаружено, что определенные молекулы играют ключевую роль.
На апикальной мембране расположены различные молекулы, но только несколько ключевых молекул действуют как детерминанты, которые необходимы для поддержания идентичности апикальной мембраны и, таким образом, эпителиальной полярности. Этими молекулами являются белки Cdc42 , атипичная протеинкиназа C (aPKC), Par6 , Par3 / Bazooka / ASIP. [1] Крошки, «Звездная пыль» и белок на плотных контактах (PATJ). Эти молекулы, по-видимому, образуют два различных комплекса: комплекс aPKC-Par3-Par6 «aPKC» (или «Par»), который также взаимодействует с Cdc42; и комплекс Crumbs-Stardust-PATJ "Crumbs". Из этих двух комплексов комплекс aPKC является наиболее важным для эпителиальной полярности, он необходим, даже если комплекс Crumbs не является. Crumbs - единственный трансмембранный белок в этом списке, а комплекс Crumbs служит апикальным сигналом, позволяющим поддерживать апикальный комплекс aPKC во время сложных изменений клеточной формы. [ необходима цитата ]
СОДЕРЖАНИЕ
В контексте почечной канальцевой физиологии, термин базолатеральная мембрана или серозные мембраны относятся к клеточной мембране , которая ориентирована в стороне от просвета каналец, в то время как термин просветной мембраны или апикальная мембрана относится к клеточной мембране , которая ориентирована в стороне просвета . Основная функция этой базолатеральной мембраны состоит в том, чтобы поглощать продукты метаболизма в эпителиальную клетку для вывода в просвет, где они выводятся из организма в виде мочи. . Вторичная роль базолатеральной мембраны состоит в том, чтобы позволить рециркуляцию желательных субстратов, таких как глюкоза , которые были извлечены из просвета канальца для секретирования в интерстициальные жидкости . [2]
Базальные и боковые мембраны имеют общие детерминанты, белки LLGL1 , DLG1 и SCRIB . Все эти три белка локализуются в базолатеральном домене и важны для базолатеральной идентичности и эпителиальной полярности.
Как поляризуются эпителиальные клетки, до сих пор не совсем понятно. Были предложены некоторые ключевые принципы для поддержания полярности, но механизмы, лежащие в основе этих принципов, еще предстоит обнаружить.
Первый принцип - положительная обратная связь . В компьютерных моделях молекула, которая может быть либо ассоциированной с мембраной, либо цитоплазматической, может поляризоваться, когда ее ассоциация с мембраной является предметом положительной обратной связи: такая мембранная локализация происходит наиболее сильно там, где молекула уже наиболее высококонцентрирована. В аналогичных моделях исследователи показали, что эпителиальные клетки могут самостоятельно собираться в богатый набор устойчивых биологических форм. [3] У дрожжей saccharomyces cerevisiae есть генетические доказательства того, что Cdc42 подвержен положительной обратной связи такого рода и может спонтанно поляризоваться даже в отсутствие внешнего сигнала. У плодовой мухи Drosophila melanogaster , Cdc42 рекрутируется комплексом aPKC и затем способствует апикальной локализации комплекса aPKC в вероятной петле положительной обратной связи. Т.о., в отсутствие Cdc42 или комплекса aPKC апикальные детерминанты не могут поддерживаться на апикальной мембране и, следовательно, апикальная идентичность и полярность теряются.
Второй принцип - это разделение детерминант полярности. Четкое различие между апикальными и базо-латеральными доменами поддерживается с помощью активного механизма, предотвращающего смешивание. Природа этого механизма неизвестна, но явно зависит от детерминант полярности. В отсутствие комплекса aPKC базо-латеральные детерминанты распространяются на бывший апикальный домен. Напротив, в отсутствие любого из Lgl, Dlg или Scrib, апикальные детерминанты распространяются на бывший базо-латеральный домен. Таким образом, эти две детерминанты ведут себя так, как будто они взаимно отталкивают друг друга.
Третий принцип - направленный экзоцитоз . Белки апикальной мембраны транспортируются от Гольджи к апикальной, а не базо-латеральной мембране, потому что апикальные детерминанты служат для идентификации правильного места назначения для доставки везикул . Родственный механизм, вероятно, действует для базо-латеральных мембран.
Четвертый принцип - модификация липидов. Компонент липидного бислоя, фосфатидилинозитолфосфат (PIP), может фосфорилироваться с образованием PIP 2 и PIP 3 . В некоторых эпителиальных клетках PIP 2 локализуется апикально, тогда как PIP 3 локализуется базолатерально. По крайней мере, в одной культивируемой клеточной линии, клетке MDCK, эта система необходима для эпителиальной полярности. Связь между этой системой и детерминантами полярности в тканях животных остается неясной.
Поскольку базальная и боковая мембраны имеют одни и те же детерминанты, другой механизм должен различать эти два домена. Форма ячейки и контакты обеспечивают вероятный механизм. Боковые мембраны являются местом контакта между эпителиальными клетками, тогда как базальные мембраны соединяют эпителиальные клетки с базальной мембраной , внеклеточным матричным слоем, который лежит вдоль базальной поверхности эпителия. Некоторые молекулы, такие как интегрины , специфически локализуются на базальной мембране и образуют связи с внеклеточным матриксом.
Эпителиальные клетки бывают разных форм, которые связаны с их функцией в развитии или физиологией. Как эпителиальные клетки принимают определенные формы, плохо изучено, но это должно включать пространственный контроль актинового цитоскелета , который является центральным для формы клеток во всех растительных клетках.
Все эпителиальные клетки экспрессируют молекулу трансмембранной адгезии E-cadherin , кадгерин, который локализуется наиболее заметно на стыке между апикальной и латеральной мембранами. Внеклеточные домены молекул E-кадгерина из соседних клеток связываются друг с другом посредством гомотипического взаимодействия. Внутриклеточные домены молекул E-кадгерина связываются с актиновым цитоскелетом через адаптерные белки альфа-катенин и бета-катенин . [4] Таким образом, E-кадгерин образует слипчивые соединения. которые соединяют актиновые цитоскелеты соседних клеток. Адгезивные соединения являются первичными силовыми соединениями между эпителиальными клетками и принципиально важны для поддержания формы эпителиальных клеток и для динамических изменений формы во время развития ткани. Как E-cadherin локализуется на границе между апикальной и латеральной мембранами, неизвестно, но поляризованные мембраны важны для поддержания E-cadherin на стыках спаек.
Читайте также:

