Что такое инверсные акне
Обновлено: 22.05.2024
ИПК ФМБА России;
КВД №9 Москвы
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы, 119071, Москва, Российская Федерация
Инновационные технологии в управлении рецидивирующими формами акне
Журнал: Клиническая дерматология и венерология. 2014;12(4): 64‑67
Сирмайс Н.С., Лямина Н.П. Инновационные технологии в управлении рецидивирующими формами акне. Клиническая дерматология и венерология. 2014;12(4):64‑67.
Sirmaĭs NS, Liamina NP. Innovative technologies in management of recurrent acne. Klinicheskaya Dermatologiya i Venerologiya. 2014;12(4):64‑67. (In Russ.).
ИПК ФМБА России;
КВД №9 Москвы
Представлены результаты терапии и последующего наблюдения пациентов со среднетяжелыми и тяжелыми формами акне препаратом изотретиноин (Акнекутан*). Все они ранее проходили лечение и получали обычную форму изотретиноина, однако в течение года развивался рецидив заболевания. В данном исследовании показано, что при правильном подходе и адекватно набранной кумулятивной курсовой дозе препарата Акнекутан (110-120 мг/кг) возможно достичь выраженный и стойкий клинический результат. Препарат Акнекутан показал высокую эффективность и противорецидивную активность при лечении среднетяжелых и тяжелых форм акне, даже в случаях рецидива заболевания после ранее проведенной терапии обычной формой изотретиноина. Тем не менее по результатам проведенного анализа, авторы не рекомендуют использовать схемы низких доз лекарственного препарата у молодых пациентов с поражением кожи спины и груди. Подчеркивается возможность применения правильно подобранной суточной дозы лекарственного препарата до достижения ее общей кумулятивной дозы у пациентов с соматической патологией и тяжелой степенью поражения акне и инверсными акне. Летнее время при использовании увлажняющих и солнцезащитных средств не ограничивает продолжение терапии.
ИПК ФМБА России;
КВД №9 Москвы
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы, 119071, Москва, Российская Федерация
Акне (Acne vulgaris) - хроническое воспалительное генетически обусловленное заболевание сальных желез со сложным патогенезом развития, характеризующееся появлением на участках кожи, богатых сальными железами (лицо, верхняя часть спины, грудь и плечи), комедонов, папул, пустул, реже - кист, которые нередко оставляют после разрешения рубцы [1] и послевоспалительные пятна. Эти проявления вызывают у пациентов психологический дискомфорт и иногда приводят к депрессивным состояниям 4. Патогенез акне связан с гиперкератозом и нарушением процесса нормального отшелушивания кератиноцитов устья сальных желез, ведущий к закупорке фолликула, повышенной активностью микроорганизмов и увеличением продукции кожного сала и изменением его качественного состава. Данный дерматоз - один из наиболее часто встречаемых среди лиц молодого возраста от 13 до 25 лет. С его проявлениями сталкиваются, по данным разных авторов [5], 65-95% молодых людей с пиком заболеваемости в 14–17 лет у женщин и 16–20 лет у мужчин. В последнее время многие врачи отмечают появление так называемых поздних акне, появляющихся у женщин, как правило, после 23 лет и имеющих в патогенезе гормональный фактор (гиперандрогения) [6]. Заболевание имеет длительное рецидивирующее течение с некоторым улучшением в летнее время и более сильными обострениями в осенне-зимнее время.
Распространенность, длительный и рецидивирующий характер течения, а также риск возникновения постакне (рубцовых изменений, дисхромий) и психоэмоциональных нарушений не только при тяжелом течении угревой болезни, но и при более легких степенях, направляет врачей на раннее начало терапии и поиск новых схем и подходов к лечению [7]. В соответствии с тяжестью заболевания существуют различные методы лечения с использованием как топических, так и системных препаратов. В системной терапии часто применяют антибиотики и ретиноиды.
Изотретиноин применяется с 1982 г. и является дериватом витамина А, который действует через RAR- и RXR-ретиноидные ядерные рецепторы различных изоформ, поэтому относится к семейству суперстероидов. Изотретиноин влияет на процессы дифференцировки и кератинизации клеток эпидермиса, в том числе и сальных желез, подавляет выработку кожного сала, оказывая выраженный себостатический эффект, изменяет состав липидов кожи, а также участвует в обновлении клеток кожи [8]. Кроме того, он оказывает выраженный противовоспалительный и иммуномодулирующий эффект за счет ингибирования медиаторов воспаления - лейкотриенов [9]. Несмотря на доказано высокую эффективность пероральных ретиноидов, применение их в нашей стране ограничено, что связано не только с противопоказаниями, но и с высокой стоимостью лечения, боязнью тератогенного действия препаратов, возможных побочных явлений, влияния на биохимический профиль, а также недостоверной информации в сети интернет. С появлением в 2010 г. на российском рынке изотретиноина, полученного благодаря новой инновационной технологии LIDOSE (SMB Technology SA, Бельгия), - Акнекутан («Ядран» Галенский лабораторий, Хорватия) - лечение стало более доступным и шире применяется врачами.
Акнекутан представляет собой новую лекарственную форму изотретиноина (технология LIDOSE), которая позволяет увеличить усвояемость изотретиноина в пищеварительном тракте и, как результат увеличить биодоступность изотретиноина в составе Акнекутана на 20% по сравнению с обычными формами изотретиноина [18]. Это делает возможным уменьшение как суточной, так и курсовой дозы лекарственного вещества на 20% при терапии Акнекутаном относительно обычных форм изотретиноина. Акнекутан выпускают в капсулах 8 и 16 мг, которые биоэквивалентны капсулам 10 и 20 мг обычной формы изотретиноина.
Использование технологии LIDOSE позволяет также уменьшить зависимость усвоения изотретиноина от пищи. Дополнительные жирорастворимые компоненты обеспечивают усвоение изотретиноина в составе Акнекутана на 70% даже при условии приема препарата без пищи, что позволяет быть уверенным в эффективности средства даже при неполном соблюдении пациентом правил его приема.
Общепринятой является суточная доза изотретиноина 0,5-1,0 мг на 1 кг массы тела в день после еды, что соответствует 0,4-0,8 мг/кг Акнекутана. Лечение продолжают до набора курсовой кумулятивной дозы 120-150 мг/кг изотретиноина [10, 11] или 100-120 мг/кг Акнекутана. Известно, что все нежелательные реакции являются дозозависимыми, и для их предотвращения в последнее время все чаще применяют терапию изотретиноином со снижением суточной и курсовой доз препарата 13.
Развитие рецидивов после курса лечения изотретиноином при стандартных суточных и кумулятивных дозах, по данным литературы [10, 14, 15], составляет от 5 до 10% и зависит преимущественно от тяжести и распространенности процесса, а также от возраста пациента. Также было показано, что чем моложе пациент, тем больше вероятность обострения акне. Однако в последнее время отмечают рост количества рецидивов, и, по разным данным, их количество доходит до 39–41%, что, по нашим наблюдениям, связано с назначением ставших популярными схем низких доз, применением терапии ретиноидами без набора курсовой дозы, необоснованным уменьшением курсовой кумулятивной дозы, а также прерывистыми методами терапии (прекращение приема препарата в летнее время, во время отпуска и т.д.).
Цель данной работы - оценить клиническую эффективность препарата Акнекутан при лечении акне среднего и тяжелого течения в группе пациентов, ранее получавших лечение системным изотретиноином в обычной форме, с возникновением рецидива заболевания в течение 1-2 года после проведенной терапии, а также выявление основных причин, приводивших к развитию рецидива акне, после проведенного курса терапии системным изотретиноином.
Материал и методы

Нами были обследованы 72 человека с рецидивами акне после ранее проведенного лечения обычной формой изотретиноина (роаккутана) в 2011 г. Из нашего наблюдения были исключены 13 пациентов по тем или иным факторам. Критерии исключения и различные группы факторов, влияющих на появление рецидива, указаны на рисунке. Рисунок 1. Критерии исключения и группы факторов, влияющих на появление рецидива акне. Хотелось бы отметить, что схемы низких доз не применимы при тяжелых степенях акне, так как в последующем практически всегда приводят к рецидивам [16]. Кроме того, на схемы низких доз плохо реагируют молодые люди с поражением спины и груди [17].
Рецидивы после терапии не столь выраженные по сравнению с первичным процессом, но в наших наблюдениях мы рассматривали только акне средней и тяжелой степеней поражения. Тяжесть определялась по количеству и характеру высыпаний:
- при легкой степени поражения на коже имеются немногочисленные открытые и закрытые комедоны (до 10 папул и/или пустул), которые крайне редко приводят к постакне;
- средняя степень акне - количество комедонов увеличивается до 25, папул и пустул - до 40, появляются узлы - до 5. После разрешения воспалительных элементов на коже часто остаются атрофические рубцы, послевоспалительная гиперпигментация, а иногда застойные пятна;
- при тяжелой степени поражения на коже лица, груди, спины располагаются множественные комедоны, папулопустулезные элементы, узлы и кисты, исходом которых всегда являются рубцовые деформации.
Пациенты получали стандартную терапию с расчетом общей курсовой кумулятивной дозы: так, при средней степени тяжести она должна была составить 110 мг Акнекутана на 1 кг массы тела, при тяжелой - 120 мг на 1 кг массы тела.
Для наружного использования больным рекомендовали использовать увлажняющие средства серии барьедерм и ксемоз.
Все пациенты выполняли положенный график осмотров (1 раз в месяц), а также соблюдали рекомендованные суточные дозы и правила набора общей кумулятивной дозы препарата Акнекутан.
Пациентам проводили исследование биохимического профиля до, после 1 и 3 мес терапии. После двух биохимических анализов крови, результаты которых не показали изменений, дополнительно исследования не проводили в связи с отсутствием динамики в последующие месяцы. Также до начала терапии пациентам проведен общий анализ крови и мочи. Надо отметить, что клинически значимых отклонений от нормы в процессе лечения ни у одного из пациентов выявлено не было.
Все пациенты нашей выборки получили рекомендованную курсовую дозу препарата, что соответствовало дозе Акнекутана 110-120 мг/кг массы тела в зависимости от степени тяжести поражения. Всем больным с тяжелой стадией поражения акне рекомендована кумулятивная доза Акнекутана 120 мг/кг массы тела; со средней степенью тяжести - 110 мг/кг массы тела.
При оценке эффективности использованы следующие критерии:
1) клиническая ремиссия и значительное улучшение - полное отсутствие всех признаков заболевания или уменьшение выраженности клинических проявлений более чем на 85%;
2) улучшение - уменьшение симптомов на 50-85%;
3) незначительное улучшение - уменьшение симптомов менее чем на 50%;
4) без эффекта - отсутствие улучшения.
Клиническая ремиссия и значительное улучшение состояния было достигнуто у всех 59 (100%) пациентов. Период наблюдения после проведенного лечения составил 12 мес - за этот срок рецидива заболевания в наблюдаемой группе пациентов, пролеченных изотретиноином LIDOSE не наблюдали.
Выводы
Акнекутан показал свою высокую эффективность и антирецидивную активность в лечении акне среднетяжелой и тяжелой степени даже в условиях рецидива заболевания после ранее проведенной терапии обычной формой изотретиноина. Стойкая ремиссия была достигнута в 100% случаев, также после проведенной терапии стандартными дозами Акнекутана в течение года не наблюдали рецидива ни у одного из пациентов.
По результатам проведенного анализа не рекомендовано использовать схемы низких доз у молодых пациентов с поражением спины и груди, при тяжелом течении заболевания, инверсных акне; не следует уменьшать суточную дозировку при нормальной переносимости у пациентов с соматическими заболеваниями или снижать общую кумулятивную дозу. Кроме того, учитывая клинический опыт ведения пациентов, в летнее время ограничивать или прерывать терапию препаратом Акнекутан не следует.
Инверсное акне является одной из наиболее актуальных проблем в практике врачей дерматовенерологов и косметологов. Разнообразие этиологических факторов, рост распространенности данного заболевания среди пациентов молодого возраста ставят перед врачами задачу своевременной диагностики, назначение адекватной терапии и профилактики осложнений. В статье подробно изучены этиология, роль предрасполагающих факторов риска, патогенез, клиника инверсного акне, а также современные методы лечения.
Ключевые слова
Статья
Инверсное акне. Современные методы лечения
Научный руководитель: к.м.н., доцент Моррисон А.В.
ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава РФ
Кафедра дерматовенерологии и косметологии
Цель работы: указать этиологию, патогенетические механизмы, клинику и современные методы лечения тяжело протекающих форм акне.
В настоящее время акне все чаще встречается в работе врача дерматовенеролога и косметолога, и представляют актуальную проблему.
Инверсное акне (ИА) (hidradenitis suppurativa) – это тяжелое хроническое иммуноопосредованное заболевание кожи, поражающее апокриновые потовые железы, сопровождающееся вторичным воспалением и негативно сказывающееся на качестве жизни больного.
Акне является одним из самых распространенных дерматозов в мире. Чаще страдают люди в возрасте от 12 до 24 лет 85%, реже от 25 до 34 лет 8%, крайне редко от 35 до 45 лет 3%. У подростков встречаемость акне среди мальчиков и девочек практически одинаковая, в то время как в дальнейшем женщины болеют чаще, чем мужчины.
В классификации акне выделяют такие формы как: камедональные, папуло-пустулезные и узловатые, а также степени тяжести: легкую, среднюю и тяжелую.
Современная классификация инверсионного акне включает 3 стадии по Hurley:
I ст.- Формирование одиночного или множественных абсцессов без свищей и рубцов;
II ст.- Рецидивирующие абсцессы с формированием свищей и рубцов, одиночные или множественные поражения на расстоянии друг от друга;
III ст.- Диффузное или близкое к диффузному распространение воспаления или множественные сообщающиеся свищевые ходы и абсцессы.
Говоря о причинах развития ИА, можно выделить генетическую предрасположенность и формирование аберрантного иммунитета. Группы генов, отвечающих за развитие акне: ген рецепторов андрогенов (AR), ген CYP17. На основании генетического анализа было доказано, что заболевание имеет наследственный характер, передаваясь по аутосомно-доминантному типу и мутации в генах, вследствие чего создается белок, известный как γ-секретаза. Также в развитии заболевания имеют значение факторы внешней среды: ультрафиолетовое излучение, различные косметические средства, травматизация и стрессовый фактор. Нельзя не сказать о влиянии вредных привычек (курение, алкоголизм) и несоблюдение рационального питания, которые играют немаловажную роль в возникновении заболевания.
В патогенезе развития ИА решающее значение отводится окклюзии фолликулов при инфундибулярном гиперкератозе. Фолликулярная окклюзия – провоцирующий фактор развития вторичной инфекции. Провоспалительный цитокин фактор некроза опухоли I (ФНО-I) играет ключевую роль в развитии хронического воспалительного процесса: поврежденные клетки сальной железы инициируют формирование абсцесса. ФНО-I и другие провоспалительные цитокины провоцируют изменения, вызывающие образование и пролиферацию эпителизированных свищевых ходов, образование «биопленки» из бактерий, находящихся в поврежденных клетках и свищевых ходах, обеспечивают хронизацию воспаления и риск распространения воспаления и развития обострений заболевания. Таким образом, апокриновые потовые железы вовлекаются в процесс вторично.
Заболевание начинается с возникновения болезненных бугристых инфильтратов, которые открываются на поверхность кожи фистулезными ходами. Содержание воспалительных очагов гнойное или геморрагически-гнойное. Формируются свищи с последующим образованием втянутых рубцов.
Дифференциальную диагностику проводят со стафилококковыми инфекциями, простым абсцессом, венерической лимфогранулемой, болезнью Крона, актиномикозом, скрофулодермой.
Лечение ИА зависит от степени тяжести и течения патологического процесса. Оно заключается в нацеливании на формирование «биопленки». На данный момент не существует единой универсальной схемы терапии для каждого больного. При легком течении, без глубоких воспалительных поражений, пациенты могут лечиться амбулаторно. В таких случаях назначаются антибактериальные препараты чаще из группы линкозамидов и тетрациклинов, применение тёплых компрессов, тщательное соблюдение правил гигиены и ношение свободной одежды. Как правило, важным моментом в терапии является отказ от вредных привычек и нормализация массы тела.
С умеренной и тяжелой степенью тяжести или стадией Hurley II назначают системные ретиноиды (изотретиноин) с предшествующим назначением антибиотиков широкого спектра действия коротким курсом, противовоспалительные препараты, глюкокортикостероиды, ингибиторы альфа-фактора некроза опухолей (при необходимости). Если состояние пациента не улучшается, то рекомендуется применение нового препарата адалимумаба (торговое название «Хумира»), как вариант лечения первой линии у пациентов с умеренно-тяжелым течением. Дозировка адалимумаба составляет 160 мг в неделю подкожно, а затем 40 мг в неделю. Если не отмечается положительной динамики со стороны кожного процесса, то терапию следует продолжать до тех пор, пока отмечаются поражения. Если пациент не проявляет ответ, то необходимо рассмотреть терапию второго или третьего ряда, включающую антисептические препараты, внутриклеточные глюкокортикостероиды, иммунодепрессанты (инфликсимаб). Отсутствие улучшения от проводимой терапии после 12 недель лечения говорит о необходимости рассмотреть другие методы лечения, вплоть до хирургического.
Вывод. В связи с тем, что распространенность инверсионного акне в практикующей деятельности врача дерматовенеролога и косметолога с каждым годом возрастает, проблема сохраняет свою актуальность. Важно вовремя выявить данную патологию, правильно поставить диагноз и немедленно начать комплексное лечение, учитывающее всё разнообразие факторов, спровоцировавших появление заболевания у конкретного пациента. Только своевременно начатая терапия исключит возможные тяжелые последствия заболевания и улучшит качество жизни больного.
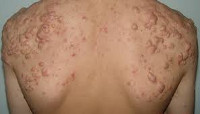
Инверсные угри — клиническая форма акне, при которой угревая сыпь сопровождается вторичным воспалительным процессом в апокриновых потовых железах с возникновением и вскрытием подкожных инфильтратов в подмышечных впадинах, в области пупка и промежности, вокруг сосков. Заболевание протекает хронически с частыми рецидивами. В лечении инверсных угрей ведущую роль имеет адекватная антибиотикотерапия, включающая системный прием антибиотиков внутрь и их наружное применение.
Общие сведения
Инверсионные угри встречаются только после периода полового созревания, так как именно в этом возрасте начинают функционировать апокриновые железы. Первоначально воспаление возникает в волосяных фолликулах и этот процесс ничем не отличается от механизма возникновения вульгарных угрей. После увеличения воспалительного инфильтрата и разрыва стенки волосяного фолликула происходит вторичное инфицирование апокриновых потовых желез. Часто инверсионные угри появляются на фоне тяжелой формы акне. Их развитию способствуют ожирение, зуд или постоянное трение одежды в местах локализации апокриновых желез.

Проявления инверсных угрей
Заболевание проявляется образованием под кожей в области подмышечной впадины, промежности, около пупка или вокруг сосков молочных желез множественных инфильтратов. Они выглядят как небольшие бугорки на коже, при ощупывании которых выявляются болезненные уплотнения. После некоторого увеличения в размерах и созревания инфильтраты вскрываются. Из них на поверхность кожи выходит гнойное или гнойно-кровянистое отделяемое. Затем происходит заживление с образованием на месте инфильтрата втянутого рубца. Рубцевание одних инверсных угрей, как правило, сопровождается появлением новых и расширением области поражения кожи.
Инверсные угри характеризуются постоянно рецидивирующим хроническим течением и могут считаться одной из разновидностей хронической пиодермии.
Лечение инверсных угрей
Терапия инверсных угрей — это достаточно длительный процесс, занимающий порой несколько месяцев. Основу лечения составляет антибиотикотерапия. Местно дважды в сутки применяются мази с антибиотиками: тетрациклиновая, эритромициновая, линкомициновая, лосьон с клиндамицином. Параллельно проводят терапию, направленную на предупреждение закупорки волосяных фолликулов и улучшение кислородного питания тканей. Так эффективной схемой лечения инверсных угрей считается комбинация эритромициновой мази и бензоилпероксида.
Местное лечение сочетают с курсовым приемом антибиотиков внутрь. С этой целью может применяться доксициклин, сульфаметоксазол+триметоприм, клиндамицин, тетрациклин, эритромицин и др. Для более точного подбора антибиотика производят посев отделяемого угрей и определяют чувствительность высеянной микрофлоры к антибиотикам. В лечении инверсных угрей также используют синтетические ретиноиды, а у женщин — гормональную терапию: этинилэстрадиол, ципротерон и др. В остром воспалительном периоде противопоказаны механические и тепловые способы лечения: пилинг, массаж, горячие ванны и т. п.
Важное значение в лечении и профилактике последующих рецидивов инверсных угрей имеет не только личная гигиена, но и правильный уход за кожей. Подбор очищающих гелей, косметических средств и профилактических кремов для поддерживающей терапии следует проводить совместно с лечащим дерматологом или дерматокосметологом.
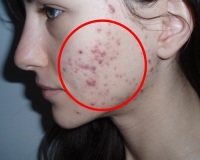
Юношеские угри возникают у большинства подростков в возрасте 12-18 лет. Они развиваются из-за повышенного салоотделения и фолликулярного гиперкератоза, а провоцируются гормональными изменениями пубертата и отягощенной наследственностью. Количество высыпаний варьирует от нескольких небольших акне до множественных кистозных элементов. Диагностика проводится с помощью клинического обследования, бактериологических и гормональных анализов. Лечение угревой сыпи у подростков включает местные средства (антибиотики, ретиноиды, азелаиновая кислота), системные препараты, правильную уходовую косметику и аппаратные методы.
МКБ-10
Общие сведения
Юношеские акне («вульгарные угри») — самая распространенная кожная проблема, которая встречается у 90% подростков. У девочек они возникают в среднем после 12 лет, у мальчиков — в 14-15 лет, что коррелирует со сроками начала полового созревания. Клинические формы, при которых требуется серьезное лечение, составляют до 15%. Угри детского возраста выявляются намного реже — около 7 случаев на 10 тыс. населения. Гнойничковая сыпь на коже доставляет психологический дискомфорт, в тяжелых случаях она становится причиной полной изоляции от сверстников и общества.

Причины
Подростковые угри — полиэтиологическая проблема, но пусковым фактором в современной дерматологии считаются гормональные перестройки пубертатного периода. В это время в крови стремительно возрастает уровень андрогенов (тестостерона и дигидротестостерона), стимулирующих работу сальных желез тела. Помимо эндокринных причин, провоцировать угревую сыпь могут следующие факторы:
- Наследственность. Вероятность появления акне у подростка при наличии отягощенного семейного анамнеза составляет 50-70% и больше. Это обусловлено неблагоприятной комбинаций генных аллелей, которые регулируют развитие и функциональную активность сальных желез. Имеет значение ядерный R-фактор, определяющий генетическую предрасположенность.
- Бактерии. При застое кожного жира активизируются условно патогенные формы микроорганизмов: пропионобактерии, эпидермальные стафилококки, микрококки. Их количество стремительно увеличивается, что клинически проявляется воспалением комедонов, формирование крупных угрей. Реже причиной болезни становятся грибы Candida и Pytirosporum ovale.
- Стрессы. Во время стрессовой ситуации усиленно вырабатываются гормоны надпочечников, которые воздействуют на гормонозависимые сальные железы. Они действуют подобно андрогенам — активизируют выработку кожного сала и нарушают его химический состав, чем провоцируют размножение патогенной микрофлоры.
- Неправильный уход за кожей. Самостоятельное лечение юношеских угрей с применением жестких средств для умывания и спиртовых болтушек еще больше нарушает микрофлору и липидный барьер кожного покрова. Кожа становится пересушенной и чувствительной, но на ней продолжают появляться воспалительные элементы.
Патогенез
В механизме формирования юношеских угрей наибольшая значимость придается 2 факторам: гиперандрогенемии и генетической предрасположенности. Они вызывают увеличение размеров и усиленное функционирование сальных желез, которое сопровождается фолликулярным гиперкератозом. Как следствие протоки желез закупориваются, изменяется рН и биохимический состав секрета, создаются благоприятные условия для размножения бактерий.
Если закупорка произошла в наружной части выводного протока, появляются открытые комедоны (черные точки). При гиперкератозе глубокой части канала в нем накапливаются избыточные сальные и роговые массы, и образуется закрытый комедон. Активное размножение микроорганизмов в сальных железах приводит к воспалению. На коже появляются воспалительные элементы — папулы, пустулы, узлы.
Большую роль в развитии угревой сыпи имеют пропионовые бактерии. Они выделяют хемоаттрактанты, которые повышают приток лейкоцитов и провоспалительных биомолекул в очаг воспаления. Микроорганизмы усиливают синтез интерлейкинов, способствуют выработке специфических антител. Установлено, что P. acnes резистентны к разрушению фагоцитами, поэтому вызванные ими угри умеют торпидное течение.
Классификация
Наиболее удобной для определения клинической формы и постановки диагноза признана классификация Дж. Плевига и А. Клигмана (G. Plewig, A. Kligman), предложенная в 1993 году. Авторы предложили делить угревую болезнь на акне детского возраста и юношеские угри. Последние, в свою очередь, по морфологическим характеристикам бывают комедональные, папулопустулезные, конглобатные и инверсные. Реже встречаются молниеносные и механические формы. По степени тяжести угревая сыпь бывает:
- Легкая. У подростка одновременно выявляется не более 10 комедонов и небольших папулопустулезных элементов. Сыпь покрывает только один участок тела, чаще всего возникает на лице. Лечение проходит успешно, рубцы практически не остаются.
- Умеренная. На коже присутствует до 25 пустул и до 20 комедонов, при этом поражение затрагивает 2 и более анатомические зоны (лицо, грудь, спина). На фоне заболевания у ребенка начинаются психосоциальные проблемы.
- Тяжелая. Характеризуется многочисленными комедонами и папулопустулезными угрями, лечение которых затруднено, а после разрешения зачастую остаются рубцы. Появляются индуративные и конглобатные элементы.
Симптомы юношеских угрей
Небольшие открытые комедоны имеют вид черных точек размером до 1 мм, которые располагаются в основном в Т-зоне лица, могут быть в верхней части спины и груди. Закрытые комедоны — мелкие белые узелки, которые не болят при надавливании и не воспаляются, но создают эстетический дискомфорт и эффект негладкой кожи. При присоединении воспаления кожа вокруг элементов краснеет и отекает, в их центре формируется белая точка — гнойник.
При слиянии глубоко расположенных юношеских элементов акне образуются узловатокистозные угри. Внешне они выглядят как багрово-красные узлы, при прикосновениях сильно болят. Гнойные полости могут вскрываться, в таком случае на месте элемента остается рана, после заживления которой виден рубец. При молниеносной форме юношеских угрей гнойники быстро изъязвляются, оставляя после себя длительно незаживающие раны. При инверсных угрях воспаление поражает потовые железы.
Осложнения
Крупные воспалительные элементы оставляют заметные рубцы и багровые следы постакне, которые не проходят самостоятельно и могут исчезнуть только после аппаратного воздействия. Серьезные рубцовые осложнения наблюдаются после самостоятельного выдавливания гнойных элементов, что сопровождается травмами кожи и распространением инфекции по всему лицу. Юношеские угри сочетаются с пигментацией, экскориациями.
Крупные гнойники в области носогубного треугольника опасны риском вовлечения в инфекционный процесс мозговых сосудов. В течении умеренной и тяжелой формы юношеских угрей неизбежно наступают психологические проблемы — снижение самооценки, повышенная тревожность, фобические расстройства. У части подростков вследствие длительного существования акне и рубцов развиваются депрессии и социальная дезадаптация.
Диагностика
Клиническое обследование подростка проводит детский дерматолог. Он оценивает состояние кожи, определяет тип и количество угрей, выявляет осложнения — рубцы, пигментацию. Врач детально собирает анамнез заболевания и жизни ребенка, интересуется наследственностью. К диагностике могут подключаться эндокринолог, аллерголог-иммунолог, психолог и другие специалисты. Чтобы выявить причины юношеских угрей, назначаются:
- Бактериологический посев. Для диагностики берут отделяемое из гнойных элементов или соскоб кожи. Лаборанты определяют состав микрофлоры эпидермиса, идентифицируют потенциально патогенные микроорганизмы. Чтобы подобрать лечение, выполняют тест на чувствительность бактерий к антибиотикам.
- Гормональный профиль. При рецидивирующей угревой сыпи, протекающей в тяжелой форме, врача интересуют уровни гормонов половых желез, надпочечников, гипофиза и гипоталамуса. У девочек-подростков кровь на исследование берут в разные дни месяца, чтобы оценить прирост андрогенов во второй фазе менструального цикла.
Лечение
Учитывая разнообразие этиологических факторов и лекарственную устойчивость бактерий, лечение патологии представляет собой сложную задачу. Выбор терапевтических методов зависит от тяжести, клинического варианта юношеских акне, наличия осложнений и психологического состояния подростка. На Всемирном конгрессе по дерматологии разработаны основные принципы патогенетического лечения:
- Уменьшение салоотделения. Для нормализации работы кожных желез детям с легкими формами болезни наносят в виде кремов местные ретиноиды, а при тяжелых вариантах течения рекомендованы системные ретиноиды. При необходимости используют гормональные препараты — антиандрогены, эстрогены.
- Купирование воспаления. С этой целью назначают азелаиновую кислоту, местные антибактериальные мази и примочки. Распространенные и глубокие юношеские угри — показание к подбору системных антибиотиков.
- Удаление комедонов. Для растворения рогового слоя и уменьшения скоплений кожного сала применяются средства с бензилпероксидом, салициловой кислотой, адапаленом. Высокую эффективность показывают кислотные пилинги. При неэффективности консервативных методов могут проводить комедоноэкстракцию.
Научно-обоснованные доказательства связи питания и юношеский угрей отсутствуют, поэтому соблюдение диеты не относится к рутинным методам. Однако у некоторых подростков лечение было более эффективным при ограничении молочных продуктов и сладостей. Детям, страдающим ожирением, подбирают гипокалорийный рацион, чтобы снизить вес и благодаря этому нормализовать гормональный фон.
Важное место отводится косметическим уходовым средствам. Они не лечат угревую сыпь, но подготавливают кожные покровы к нанесению лекарств, нормализуют салоотделение и ороговение. Для рутинного ухода подросткам подбирают очищающие гели и лосьоны, тоники с успокаивающими и антибактериальными компонентами, кремы для увлажнения и питания кожи.
Комплексное лечение включает аппаратные и физиотерапевтические методы. Хороший эффект дает фототерапия и озонотерапия юношеских угрей, при глубоких кистозных акне помогает точечное лазерное воздействие. После стихания острой фазы для разрешения рубцов проводится мезотерапия, срединные кислотные пилинги, дермабразия.
Прогноз и профилактика
Первичная профилактика болезни затруднена, поскольку гормональные изменения неизбежны в подростковом возрасте. Чтобы уменьшить риск тяжелых форм юношеских угрей, необходимо подбирать правильные средства по уходу за кожей, ни в коем случае не выдавливать прыщи и черные точки. Подросткам с жирной кожей и склонностью к обильным высыпаниям обязательно нужна консультация дерматолога.
1. Системный подход к лечению угревой болезни. М.С. Линник, Я.Р. Вовк // Современные научные исследования и разработки. — 2016
2. Современные подходы и средства лечения угревой болезни. Л.А. Болотная // Дерматовенерология. Косметология. Сексопатология. — 2008
3. Электроимпульсная терапия в комплексном лечении больных с юношескими угрями. М.Ю. Герасименко, Н.Н. Лазаренко, Д.Ю. Бутенко. — 2008
ГБУЗ Москвы «Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы», Москва, Россия, 119071
Первый МГМУ им. И.М. Сеченова
Инверсные акне: абсцедирующий и подрывающий фолликулит и перифолликулит Гоффмана
Журнал: Клиническая дерматология и венерология. 2018;17(4): 110‑113
ГБУЗ Москвы «Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы», Москва, Россия, 119071
Абсцедирующий и подрывающий фолликулит и перифолликулит Гоффмана (АППГ) является одной из патологий, относящихся к инверсным акне. Отсутствие верного диагноза и неадекватная терапия АППГ приводит к эстетическим и психологическим нарушениям у пациентов. В статье представлены современные данные о патогенезе и клинике АППГ. Описана типичная трихологическая и гистологическая картины данной патологии. Зачастую диагноз основывается на результатах этих исследований. Также в работе освещены принятые за рубежом методы лечения от медикаментозной терапии до хирургических процедур. Наиболее эффективным методом лечения в настоящее время можно считать применение системных ретиноидов, в частности изотретиноина. Приведены данные собственных наблюдений, подтверждающих клиническую эффективность применения изотретиноина, созданного по технологии LIDOSE, в терапии АППГ. Значимые результаты достигаются уже через 3—4 мес. Описанная в статье схема терапии подразумевает обязательное достижение курсовой кумулятивной дозы изотретиноина (100 мг/кг для изотретиноина LIDOSE), что возможно только при длительном лечении. Ввиду этого для эффективной терапии АППГ важна не только правильная диагностика заболевания, но также и психологическая подготовка пациента к тому, что выздоровление в данном случае — относительно долгий процесс. Важен также подбор адекватной терапии, увеличивающей приверженность пациентов назначенному лечению.
ГБУЗ Москвы «Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы», Москва, Россия, 119071
Первый МГМУ им. И.М. Сеченова
Инверсные акне представляют собой хроническое рецидивирующее воспалительное заболевание апокриновых потовых и сальных желез, сопровождающееся синдромом окклюзии волосяных фолликулов. Данная патология характеризуется длительными и частыми рецидивами и плохо поддается терапии. Инверсные акне включают суппуративный (рецидивирующий) гидраденит, абсцедирующий и подрывающий фолликулит и перифолликулит волосистой части головы Гоффмана (АППГ), декальвирующий фолликулит [1].
АППГ — воспалительное рецидивирующее заболевание кожи волосистой части головы, реже паховой, перианальной и подмышечной областей, характеризующееся образованием абсцессов с последующей рубцовой атрофией. E. Hoffman (1868—1959) дал клиническое описание этого заболевания в 1907 г., но только в 50-х гг. XX века было доказано, что АППГ представляют собой лишь одну из форм акне [2]. АППГ может развиваться самостоятельно или в триаде с гидраденитом и конглобатными акне. Заболевание чаще встречается у молодых мужчин в возрасте 20—40 лет [3].
Отсутствие верного диагноза и неадекватная терапия АППГ приводит к необратимой рубцовой алопеции с масштабными эстетическими поражениями, что негативно сказывается на психологическом состоянии пациента и его окружении.
В настоящее время в патогенезе инверсных акне и в частности абсцедирующего подрывающего фолликулита, большое значение придают микробиоте кожи и иммунным нарушениям. Причина АППГ до конца не известна. Патофизиологические изменения в коже при этом заболевании связывают с фолликулярной окклюзией, расширением и разрывом фолликулярного канала, что инициирует воспалительную реакцию. В дальнейшем происходит выход содержимого фолликула (погибшие корнеоциты, бактерии, жирные кислоты, волосы) в дерму, образование воспалительного перифолликулярного инфильтрата, присоединение вторичной инфекции, формирование абсцесса и фистульных ходов, образование гранулемы, инкапсулирование очага, рубцевание [3, 4].
Клиническая картина представлена болезненными, воспалительными, абсцедирующими, желтовато-белого цвета флюктуирующими и длительно персистирующими узлами, образующими извилистые тяжи-валики, которые спонтанно или при сдавливании «подрываются». Из многочисленных фистулезных отверстий и сообщающихся ходов выделяется гнойно-геморрагическая жидкость. В конечном итоге разрастается грубоволокнистая соединительная ткань, формируются атрофические или келоидоподобные рубцы, что приводит к необратимой рубцовой алопеции. Кроме воспалительных узлов, также образуются упругоэластической консистенции невоспалительные шаровидные узлы (кисты). Течение заболевания длительное, но иногда процесс спонтанно разрешается с образованием рубцов, в том числе келоидных.
Диагностика АППГ основана на клинической картине, трихологическом, а при необходимости — гистологическом исследовании.
Методом трихоскопии можно обнаружить характерные признаки: 3D («трехмерные») желтые точки в области дистрофичных волос, желтые аморфные области, белые точки с ореолами, молочно-красные области, не имеющие фолликулярных отверстий [5].
Гистологически дермоэпидермальный переход представляет собой умеренный воспалительный инфильтрат, преимущественно лимфомоноцитарный, перифолликулярно располагаются многоядерные клетки, гранулемы, макрофаги. Часть волос имеет перифолликулярный фиброз с зонами разрушения волосистого фолликула и заменой его грануляционной тканью [6].
В настоящее время, по данным зарубежных авторов [7, 8], к более эффективным методам лечения относят пероральный прием цинка в низкой дозе, изотретиноина, миноциклина, сульфамидных препаратов, тетрациклина, преднизолона, дапсона; местно — применение клиндамицина, изотретиноина, CО2-лазеров; хирургическое вмешательство. К новым методам относят применение блокаторов фактора некроза опухолей, хинолонов, макролидных антибиотиков, рифампина, алитретиноина, метронидазола и сульфата цинка в высокой дозе (135—220 мг). Изотретиноин, по-видимому, дает наибольшие шансы на ремиссию, но количество отчетов по этому вопросу незначительно, графики дозирования варьируются, а длительность периода наблюдения невелика.
В своей практике мы отдаем предпочтение изотретиноину, произведенному по технологии LIDOSE (Акнекутан * ), в связи с тем, что в данном случае за счет дополнительных компонентов в препарате (гелюцир, спан) увеличивается биодоступность изотретиноина на 20%. Это позволяет сократить суточные и курсовые дозировки изотретиноина при сохранении терапевтической эффективности препарата. Уменьшение дозировки положительно сказывается на переносимости препарата. Для данной формы изотретиноина рекомендуемыми суточными дозами являются 0,4—0,8 мг/кг, тогда как для изотретиноина в обычной форме выпуска — 0,5—1 мг/кг. Использование технологии LIDOSE позволяет также уменьшить зависимость усвоения изотретиноина от пищи. Дополнительные жирорастворимые компоненты обеспечивают усвоение изотретиноина в составе Акнекутана на 70% даже при приеме препарата без пищи, что позволяет быть более уверенным в эффективности терапии даже при условии низкой приверженности пациентов рекомендациям по применению препарата [9].
За период 2014—2017 гг. к нам обратились 8 пациентов в возрасте от 28 лет до 61 года с диагнозом АППГ, подтвержденным гистологически. Изначально пациенты обращались к трихологам в течение нескольких лет. В качестве терапии получали антибиотики длительными курсами, иммуномодулирующую терапию с незначительным улучшением. Для лечения этих пациентов мы применяли системные ретиноиды (Акнекутан) по следующей схеме: 0,4 мг/кг/сут (в зависимости от массы тела пациентов начальная доза составляла в среднем 32 мг/сут) в течение 3—4 мес с последующим снижением суточной дозы до достижения кумулятивной дозы в 100 мг/кг. При наблюдении за пациентами в течение года после окончания терапии рецидива заболевания не отмечено.
Учитывая увеличение частоты данной патологии приводим историю болезни.
Пациент Б., 28 лет, обратился с жалобами на высыпания на коже волосистой части головы в теменной и затылочной области, сопровождающиеся субъективным дискомфортом.
Считает себя больным на протяжении 3 лет, с момента появления высыпаний. Неоднократно получал системную антибиотикотерапию, аутогемотерапию, проводилась хирургическая санация очагов поражения — эффект от лечения был непродолжительным. Процесс приобрел непрерывно рецидивирующий характер с усугубляющейся степенью тяжести клинических проявлений.

Status localis: поражение локализовано на коже волосистой части головы, преимущественно в теменной и затылочной области. Процесс представлен связанными с волосяными фолликулами папулами красного цвета диаметром до 0,6 см, полушаровидной и конической формы, местами пустулами, полушаровидными узлами с округлыми очертаниями диаметром до 1—1,5 см, кожа над ними розовая, гладкая, натянутая. Консистенция узлов мягкая, тестообразная. При сдавливании из некоторых отверстий, расположенных на поверхности узлов и прикрытых желтыми корочками, выделяется гной. Субъективно отмечается незначительное жжение в местах высыпаний, при пальпации узлов — легкая болезненность (рис. 1). Рис. 1. Пациент Б. до лечения.
При гистологическом исследовании в эпидермисе над фолликулом обнаружены признаки акантоза, гиперкератоза и паракератоза, в дерме — участки некроза, периваскулярные лимфогистиоцитарные инфильтраты. Фолликулы многочисленные, некоторые атрофичны, остальные имеют обычное строение. Гистологическая картина соответствует АППГ.
Пациенту был назначен Акнекутан (изотретиноин LIDOSE) в дозе 0,4 мг/кг/сут (первоначальная суточная доза составила 40 мг) с постепенным снижением до достижения кумулятивной дозы в 100 мг/кг, которая была достигнута за 9 мес. За время курса терапии из нежелательных явлений отмечалась сухость кожных покровов только в первые 2 мес приема препарата, которая нивелировалась назначением местных увлажняющих средств.
Через 3 мес терапии отдельные крупные узлы разрешились, уменьшилась интенсивность окраски, было отмечено уплощение остальных элементов, а также снижение (вплоть до исчезновения) субъективных ощущений (жжение, покалывание, зуд) в местах высыпаний (рис. 2). Рис. 2. Пациент Б. через 2 мес терапии. Через 6 мес высыпания полностью регрессировали, оставив рубцовые изменения кожи на месте крупных патологических элементов. В пределах очагов поражения частично возобновился рост волос (рис. 3). Рис. 3. Пациент Б. через 6 мес терапии.
Рост обращаемости с данным заболеванием заставляет обратить внимание на необходимость гистологического подтверждения в случаях папулопустулезных высыпаний на коже волосистой части головы, поскольку назначение несоответствующей терапии приводит к усугублению процесса, рубцовой атрофии и тяжелому психологическому дискомфорту у пациентов.
Применение в терапии АППГ системных ретиноидов, и в частности изотретиноина, соответствует принятым во всем мире методам и демонстрирует высокую эффективность за счет быстрого регресса высыпаний и отсутствия рецидива в длительной перспективе.
Сбор материала — Л.Р. Сакания
Описание клинического случая — Д.Р. Мильдзихова.
Написание и редактирование текста — И.М. Корсунская
Авторы заявляют об отсутствии конфликта интересов.
Collecting and interpreting the data — L.R. Sakaniya
Description of the clinical case — D.R. Mildzihova
Drafting and revising the manuscript — I.M. Korsunskaya
The authors declare no conflict of interest.
Сведения об авторах
Читайте также:

