Что делать при ожоге пищевода лучевой терапией
Обновлено: 22.05.2024
Лучевые повреждения слизистых оболочек развиваются при лучевой терапии рака полостных органов и проявляются радиоэпителиитом. Радиоэпителиит клинически выявляется через 1 — 2 недели от начала лучевой терапии и характеризуется болезненностью, выраженным отеком, гиперемией слизистой с последующим расплавлением эпителия. Лишенная эпителия слизистая оболочка покрывается налетом. Эпителизация начинается спустя несколько дней, по окончании которой слизистая оболочка оказывается истонченной и менее влажной вследствие атрофии слизистых желез. Радиоэпителиит, заканчивающийся полным восстановлением слизистых оболочек, принято рассматривать как допустимую реакцию на облучение. Лучевые повреждения слизистых оболочек полости рта наблюдаются при лучевой терапии рака языка, слизистой щеки, дна полости рта, миндалин, носоглотки, гортани, метастазов в подчелюстные лимфатические узлы. Профилактикой радиоэпителиита является санация полости рта перед лучевой терапией, а во время лечения — отодвигание слизистой оболочки щеки и языка от зубов специальными протезами и продолжающаяся санация полости рта — механическое очищение от остатков пищи, сгустков фибрина и промывание раствором риванола, новокаина, перманганата калия и др. При радиоэпителиите гортани применяют ингаляции масляными растворами, антибиотиками. Выраженный радиоэпителиит служит одним из показателей необходимости прервать или закончить лучевую терапию.
Эзофагит развивается при лучевой терапии больных раком пищевода, легких или органов средостения. Клинически эзофагит проявляется болями при глотании и иногда самостоятельными болями. При легких степенях эзофагита лучевая терапия может быть продолжена, при более резких симптомах облучение следует прервать. Для лечения применяют внутрь винилин и раствор новокаина перед едой, метилурацил по 0,5 г 3 раза в день.
Лучевые повреждения слизистой оболочки и подлежащих тканей мочевого пузыря (лучевой цистит) наблюдаются при лучевой терапии опухолей мочевого пузыря, рака шейки матки и реже рака прямой кишки. Легкие формы лучевого цистита проявляются умеренной дизурией (учащенным и болезненным мочеиспусканием). Тяжелые формы (резкая дизурия, гематурия), проявляющиеся радио-эпителиитом или язвой, имеют длительное, нередко рецидивирующее течение. В поздние сроки может развиваться атрофия слизистой оболочки, а также фиброз со сморщиванием мочевого пузыря. Реже при лучевой терапии опухолей мочевого пузыря, матки, прямой кишки развиваются опухолевидные образования — псевдорак. Профилактикой лучевых повреждений мочевого пузыря является правильный выбор условий облучения и борьба с инфекцией. При лечении легких форм лучевых циститов достаточно применения мочегонных и дезинфицирующих средств. Лечение тяжелых форм длительное — до 1— 2 лет, не всегда успешное. Наиболее эффективным является: 1) введение в мочевой пузырь витаминизированного рыбьего жира по 20 мл попеременно с 2% раствором новокаина в течение 20—30 дней; 2) предпузырная и пресакральная новокаиновая блокада 0,25% раствором новокаина (80—100 мл) 3—5 раз с интервалом в 7—8 дней; 3) преднизолон внутрь по 15 мг ежедневно, 1—2мес; 4) метилурацил по 1 г внутрь 4 раза в день и введение в мочевой пузырь 50— 70 мл 0,8% водного раствора метилурацила 1 раз в день. При безуспешной терапии прибегают к тотальной эктомии мочевого пузыря.
Лучевые повреждения прямой кишки (лучевой ректит) могут возникать при лучевой терапии опухолей прямой кишки и рака смежных органов, главным образом рака шейки матки. Первые симптомы выявляются к концу курса лучевой терапии и выражаются появлением тенезмов, чувства давления и болей перед дефекацией; стул становится частым, в испражнениях появляются слизь и кровь. В более тяжелых случаях боли приобретают схваткообразный характер и иррадиируют в промежность . Присоединяются ректальные кровотечения. При ректоскопии в легких случаях обнаруживаются равномерная гиперемия и отек слизистой оболочки прямой кишки, позднее — отторжение эпителия. Эпителизация и исчезновение клинических симптомов наступают в течение ближайших недель. Ректит при лучевой терапии рака шейки матки требует перерыва в лечении.
Язвенный ректит характеризуется длительным течением, частыми обострениями процесса. У больных наблюдается частый стул с кровью и слизью, сменяющийся запорами, мучительными тенезмами, истощающими больных. Часто наблюдаются и ректальные кровотечения. При ректоскопии обнаруживаются гиперемия и отек слизистой оболочки, явления радиоэпителиита и на месте наибольшего лучевого воздействия — изъязвления. При лучевой терапии рака шейки матки язва локализуется на передней стенке кишки на уровне зева шейки матки. Окружающий язву инфильтрат вовлекает заднюю стенку влагалища. На месте язвы в этих случаях нередко возникают ректовагинальные свищи. Язвенный ректит в некоторых случаях сопровождается обширным склерозом парарекислотальной клетчатки и лимфостазом вследствие нарушения крово- и лимфообращения; при этом инфильтрированная параректальная клетчатка фиксирует и сдавливает прямую кишку, уменьшая ее просвет.
Заживление всех форм язвенного ректита протекает длительно, нередко сопровождается частичной или полной обтурацией прямой кишки, требующей колостомии. Лечение заключается в систематических парасакральных новокаиновых блокадах (0,25% раствор новокаина — 150 мл, пенициллин 100 000—200 000 ЕД) и инъекциях 5% раствора витамина В1— 2 мл, применении масляных клизм или клизм с пелоидином, настоем ромашки, а также из 30% раствора хлорофилло-каротиновой пасты. Эффективны свечи с метилурацилом (метилурацил 0,2—0,4 г, масло какао 1,5 г 2—4 раза в день). При лучевых сигмоидитах рекомендуются микроклизмы из 20—30 мл крахмального клейстера вместе с 0,2—0,4 г метилурацила. При катаральных ректитах лечение продолжается 10—12 дней, при язвенных — от 15—20 дней до 1,5—2 мес. Во время лечения из диеты исключается черный хлеб, продукты, содержащие большое количество клетчатки.
Индивидуальный подход
Профессиональные решения
Современные технологии
Мои специализации
- Хирургическая онкология
- Реконструктивная урология
- Онкогинекология
- Лечение гипергидроза
- Лечение блашинг-синдрома
- Эстетическая гинекология
- Бариатрическая хирургия
Контакты






Права на сайт и контент принадлежат Костюку Игорю Петровичу © 2006 - 2022
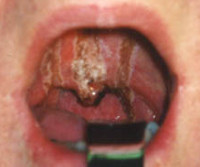
Ожог глотки – это повреждение слизистой оболочки глотки, вызванное высокой температурой, химическими веществами, реже электричеством или ионизирующим излучением. Сопровождается колющей или жгучей болью в области шеи, усиливающейся при глотании, дисфагией, гиперсаливацией, нарушением вкуса, кашлем, интоксикационным синдромом. Диагностика основывается на анамнестических данных, результатах физикального осмотра, фарингоскопии, ларингоскопии и лабораторных анализов. Лечение включает дезинтоксикационную, противошоковую и симптоматическую медикаментозную терапию.
Общие сведения
Ожоги глотки выявляются довольно часто. Наиболее распространенными являются химический и термический варианты – свыше 92% от общего количества поражений. Самый часто встречающийся в странах СНГ этиологический фактор – уксусная кислота, которая вызывает более 90% химических повреждений глотки. У детей ожоги чаще всего провоцируются перманганатом калия. Более 70% от всех случаев составляют поражения I-II степени. Изолированная форма наблюдается у порядка 35-50% больных. Заболевание статистически чаще диагностируется у мужчин молодого и среднего возраста. Суммарный показатель смертности колеблется в пределах 10-26% от общего числа пострадавших.

Причины ожога глотки
Основная причина повреждений – ошибочное или сознательное проглатывание раскаленных либо токсичных предметов или жидкостей. Этиология имеет непосредственное влияние на клиническую симптоматику и проводимое лечение. С учетом этого выделяют следующие варианты ожогов:
- Термические. Развиваются при приеме горячей пищи или кипящих жидкостей. Реже наблюдаются при воздействии раскаленного воздуха, горючего газа или пара. Повреждение глотки часто сочетается с ожогами слизистых оболочек рта и пищевода.
- Химические. Возникают на фоне употребления кислот или щелочей. Чаще всего причиной поражения становится прием уксусной кислоты, нашатырного спирта, каустической соды, перманганата калия и бытовых чистящих средств. Характеризуются более тяжелым, чем при термическом воздействии, повреждением слизистого шара и подлежащих тканей.
В редких случаях встречаются электрические и лучевые ожоги, развивающиеся в результате воздействия на область шеи электрического тока или источника ионизирующего излучения. Обычно выступают в роли осложнений или сопутствующих нозологий при других поражениях – электротравме, лучевой болезни и т. д.
Патогенез
Вне зависимости от степени тяжести ожог глотки последовательно проходит 3 стадии: альтеративно-деструктивную, репаративную и регенерационную. Различные этиологические варианты нозологии имеют свои патогенетические особенности. Повреждения, вызванные высокой температурой и кислотами, оказывают местное прижигающее действие по типу коагуляционного некроза. Это обусловлено нарушением целостности клеточных мембран на фоне растворения липидов – их основной структурной единицы. Контакт с агрессивными щелочами приводит к колликвационному некрозу, который формируется в результате образования водорастворимого альбумината – вещества, транспортирующего щелочь к здоровым тканям и вызывающего более глубокие поражения.
При выраженных ожогах патологический процесс распространяется не только на слизистую оболочку, но и на подслизистый и мышечный слой. Происходит резорбция химического вещества, что может приводить к гемолизу эритроцитов, токсической коагулопатии и ДВС-синдрому. Стадии репарации и регенерации характеризуются отторжением омертвевшей ткани, восстановлением нормальной слизистой оболочки или образованием рубца. При тяжелых ожогах полноценного выздоровления зачастую не происходит – возникают предпосылки к развитию стеноза гортани или воспалительных заболеваний.
Классификация
Основываясь на глубине поражения тканей, выраженности клинической картины, ожидаемой длительности и возможных результатах лечения выделяют три степени ожогов глотки:
- I (легкая) степень. Характеризуется поражением только поверхностного слоя эпителия глотки. Поврежденные ткани отторгаются на 3-5 сутки, оставляя оголенной нормальную слизистую оболочку. Общее состояние больного не нарушается.
- II (средняя) степень. Включает в себя сочетание интоксикационного синдрома и поражения глотки до уровня слизистого шара. Отторжение отмерших тканей происходит к концу первой недели, после чего остаются быстро заживающие поверхностные эрозии. На месте ожога формируется рубец.
- III (тяжелая) степень. Проявляется повреждением всего слоя слизистой оболочки и нижерасположенных тканей на различную глубину, тяжелой интоксикацией. Струп отторгается через 13-15 дней, оставляя после себя глубокие эрозии, продолжительность заживления которых может колебаться от 7 дней до нескольких месяцев. Образовавшиеся рубцы часто вызывают клинически значимое сужение просвета глотки.
В зависимости от распространения процесса на другие органы и структуры различают следующие формы ожога глотки:
- Изолированные или локальные. При этом варианте патологические реакции ограничивается полостью глотки.
- Комбинированные. Сопровождаются вовлечением других отделов пищеварительного тракта, чаще всего – пищевода и желудка. Реже происходит поражение гортани.
Симптомы ожога глотки
Выраженность симптоматики зависит от тяжести патологического процесса и вовлечения других органов ЖКТ. Обычно пострадавший пытается выплюнуть проглоченную жидкость, это предотвращает поражение пищевода и желудка, но обеспечивает дополнительные повреждения слизистой оболочки рта, губ, языка. Из-за этого на них формируется плотный струп, цвет которого зависит от свойств этиологического фактора. При термических и химических ожогах, вызванных уксусной кислотой и щелочами, струп белый, азотной кислотой – желтый, серной либо хлористоводородной кислотой – черный или темно-бурый.
Основная жалоба пациента при любом этиопатогенетическом варианте ожога глотки – боль жгучего и/или колющего характера в верхней трети шеи, иногда иррадиирующая в нижнюю часть шеи. При комбинированной форме болевые ощущения также возникают за грудиной и в эпигастрии, часто сочетаются с рвотой, которая при II-III степени поражения имеет вид «кофейной гущи». Отмечается повышенное слюноотделение, кашель, нарушение вкуса. Еще один характерный симптом – затруднение глотания. При I степени нарушается проходимость только твердой пищи, при II степени твердая еда не проходит вовсе, а жидкая – с сильной болью. III степень проявляется невозможностью проглотить даже жидкость. Выраженные ожоги сопровождаются тяжелым интоксикационным синдромом – повышением температуры тела до 39,0-40,0 °C, ознобом, головокружением, общим недомоганием и слабостью.
Осложнения
Основное осложнение ожога глотки – деформация просвета органа и развитие стеноза, что характерно для тяжелых поражений. У детей даже при I и II степени могут возникать массивные реактивные процессы в виде отека гортани и глотки с выделением большого количества мокроты. Зачастую такие состояния приводят к значительному нарушению проходимости ЛОР-органов и выраженной дыхательной недостаточности. В зоне сформировавшихся рубцов создаются благоприятные условия для развития воспаления, повышается вероятность возникновения хронического фарингита, абсцессов или флегмон шеи. При вовлечении в патологический процесс пищевода отмечается риск перфорации, медиастинита, периэзофагита и образования пищеводно-трахеального свища. Тяжелые химические повреждения нередко сопровождаются резорбцией токсических веществ в системный кровоток и поражением внутренних органов, чаще всего – головного мозга, печени и почек.
Диагностика
Постановка диагноза обычно не вызывает особых трудностей. Основная цель отоларинголога или хирурга – правильное определение степени тяжести и формы патологии, что необходимо для выбора соответствующей тактики лечения. С этой целью проводится:
- Сбор анамнеза и жалоб. Играет ведущую роль в диагностике. Важно установить этиологический фактор, его концентрацию или температуру, размеры или объемы, длительность контакта со слизистой оболочкой. Также выясняются присутствующие субъективные симптомы и динамика их развития.
- Физикальный осмотр. В первую очередь производится оценка работы сердечно-сосудистой и дыхательной системы, поскольку при тяжелом интоксикационном синдроме наблюдается тахипноэ, тахикардия, падение артериального давления. При ожогах уксусной кислотой, бытовой химией или аммиаком в выдыхаемом воздухе ощущается специфический запах.
- Фарингоскопия и непрямая ларингоскопия. Ожог I ст. сопровождается гиперемией слизистой оболочки, слабовыраженным отеком. Аналогичные изменения могут возникать на внешней поверхности надгортанника, в межчерпаловидном пространстве и грушевидных синусах. При II ст. выявляются язвы, налет бело-серого цвета, реже – ожоговые пузыри с серозной жидкостью. III ст. проявляется участками глубокого некроза, распространяющегося в подлежащие ткани.
- Лабораторные исследования. При легких ожогах изменения в ОАК отсутствуют. При II-III ст. наблюдается лейкоцитоз 9-18х10 9 г/л и сдвиг лейкоцитарной формулы влево. В биохимическом анализе крови может повышаться уровень креатинина, мочевины, АлАТ, АсАТ, калия, билирубина.
- Цитология. Состав мазка-отпечатка при I ст. характеризуется наличием небольшого количества фагоцитов и бактериальной флоры. При II ст. присутствует большое количество микроорганизмов, клеток с признаками дегенерации, иногда – с элементами вакуолизации. III ст. дополняет признаки II ст. наличием распада ядерных клеток.
- Фиброэзофагогастроскопия (ФЭГС). Процедура проводится не ранее 10 дня после ожога. Используется для определения сопутствующего поражения пищевода и/или желудка, развития рубцового стеноза. При повреждении на стенках органов возникают такие же изменения, как в глотке.
Лечение ожога глотки
Лечебные мероприятия осуществляются в максимально короткие сроки. Ведущую роль играет медикаментозная терапия. Комбинация препаратов зависит от формы, степени тяжести и этиологии. При ожогах глотки применяется:
- Дезинтоксикационная терапия. Играет важнейшую роль при химических ожогах, заключается в нейтрализации ядовитого вещества антидотом на протяжении первых 6 часов. При необходимости проводится внутривенная инфузия плазмозаменителей, ощелачивание крови и форсированный диурез. При комбинированных формах выполняется зондовое промывание желудка холодной водой.
- Патогенетическое и симптоматическое лечение. Подразумевает нормализацию АД и реологических свойств крови, устранение болевого синдрома, профилактику бактериальных осложнений. Назначаются антибиотики широкого спектра действия, прямые антикоагулянты, ненаркотические и наркотические анальгетики, спазмолитики, кортикостероиды, холинолитики, растворы коллоидов и кристаллоидов, препараты крови.
- Медикаментозное дестенозирование. Показано при распространении патологического процесса на гортань, развитии выраженного отека и асфиксии. Выполняется с использованием антигистаминных препаратов, хлорида кальция и преднизолона. При неэффективности требуется трахеостомия.
- Пластика гортани. Необходима при выраженном стенозе. Предполагает иссечение рубцовой ткани, мобилизацию небных дужек, мягкого неба, временную имплантацию трубчатого протеза с целью рекалибровки просвета гортани.
Прогноз и профилактика
Прогноз при ожоге глотки зависит от этиологии, степени тяжести, адекватности и своевременности оказания медицинской помощи. Несвоевременно или неправильно оказанная медицинская помощи при тяжелых комбинированных ожогах приводит к летальному исходу. Длительность терапии может колебаться от 3-5 суток до 2 и более недель. При полноценном лечении повреждений I-II ст. обычно наблюдается полное выздоровление, при III ст. – формирование рубцового стеноза. Специфические превентивные меры не разработаны. Профилактика сводится к предотвращению проглатывания химических веществ, бытовых средств и кипящих жидкостей, вдыхания раскаленного дыма и пара.
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов, как следствие воздействия ионизирующего излучения в суммарной очаговой дозе 60—70 Гр., проявляются в виде хронических эпителиитов и дерматитов, с прогрессированием их в лучевые язвы кожи, лучевые проктиты, циститы и т. п. В патогенезе таких повреждений, наряду с нарушением микроциркуляции, ведущее значение играет прямое воздействие излучения на клетки и подавление репаративных процессов. В дальнейшем на передний план выходят присоединение инфекции поврежденных тканей и усугубление негативных процессов заживления поврежденных тканей [1]. Вот почему в комплекс медикаментозных средств при лечении местных лучевых повреждений включаются вещества, воздействие которых направлено на улучшение тканевой микроциркуляции, повышение репараторных процессов и подавление инфекционного процесса. Для лечения местных лучевых повреждений апробированы практически все известные медикаментозные средства, удовлетворяющие перечисленным требованиям. Низкая терапевтическая эффективность имеющихся средств явилась основанием для поиска новых методов лечения. В отделении лечения лучевых повреждений МРНЦ РАМН ежегодно проходит лечение значительное число больных с лучевыми язвами конечностей и других областей тела, лучевыми повреждениями кишечника, мочевого пузыря и др. Основным компонентом местного лечения является препарат димексид (диметилсульфоксид, или ДМСО), применяющийся в виде перевязок раствора 5—10% или мази 10%. Это базовое лечение, назначаемое с учетом конкретных особенностей каждого больного, может дополняться назначением других антисептиков (диоксидин, хлоргексидин и др.), протеолитических ферментов, средств, стимулирующих репараторные процессы (куриозин, витаминизированные масла и др.). Разработанные схемы местного и общего лечения позволяют добиться благоприятных результатов у 57% пациентов [1, 2].
С сентября 2002 г. мы исследовали терапевтическую эффективность препарата гепон для лечения больных местными лучевыми повреждениями (см. таблицу 1).
Лучевые язвы у больных развились после лучевой терапии злокачественных опухолей (рак кожи — 16 пациентов, рак молочной железы — шесть, саркомы — четыре). Суммарная очаговая доза (СОД) составляла 45—70 Гр. Лучевые проктиты явились следствием лучевой терапии рака шейки и тела матки (13), рака мочевого пузыря (3) и прямой кишки (2). Лучевые циститы также наблюдались после лучевой терапии рака шейки и тела матки (13) и рака мочевого пузыря (4). Пневмофиброз — это следствие лучевой терапии лимфогранулематоза (6) и рака молочной железы (5 больных).
При лечении лучевых язв гепон применялся на первом этапе (7—10 дней) в виде орошения язвы раствором. Гепон (0,002) растворяли перед употреблением в 5 мл стерильного физиологического раствора. Орошение полученным раствором 0,04% гепона производилось ежедневно. На втором этапе, по мере развития грануляции, применялась мазь 0,04% (10—18 дней). Результаты лечения лучевых язв гепоном сопоставлялись с динамикой течения раневого процесса у более 800 больных, которым терапию проводили с принятыми в отделении методами лечения, состоящими в местном применении раствора 10% димексида (аппликации или электрофорез), электрофореза протеолитических ферментов и гепарина, использовании мазей левомиколя, ируксола, куриозина и эплана.
Эффективность применения гепона оценивалась клинически по состоянию раневой поверхности (уменьшение экссудации, скорости развития грануляций и скорости эпителизации язвы по Л. Н. Поповой (см. таблицу 2)), исчисляемой по формуле:
В оценке динамики заживления информативным оказалось изучение микрофлоры лучевых язв и чувствительности ее к антибиотикам. До применения гепона в раневом отделяемом у 67,5% посевов была установлена моноинфекция, преимущественно ассоциации стафилококка, а у 16,3% определялись и другие микробы (Escherichia coli, грамотрицательные ассоциации микробов и Candida). После 12–15-дневного применения гепона в 18,9% случаев выявлялась стерильность либо определялись сапрофиты (27%), характерные для нормальной кожи. По сравнению с исходным уровнем, 10 7-8 микробов на грамм ткани, к концу лечения гепоном обсемененность сокращалась до 10 2-3 , значительно повышалась чувствительность флоры к антибиотикам. Все вышеуказанное свидетельствует о несомненной эффективности проведенного лечения.
Положительный терапевтический эффект использования гепона мы склонны связывать в первую очередь с благоприятным его действием на микрофлору, что способствовало снижению воспалительного процесса и его негативных последствий (отек окружающих тканей, нарушение микроциркуляции и т. п.). Кроме того, важным аспектом действия гепона является его иммуномоделирующее действие, проявляющееся в активизации секреторного иммуноглобулина, снижении уровня противовоспалительных цитокинов, активизации a-интерферона, снижении адгезивной функции клеток и их апоптоза, прекращении вирусной репликации и повышении резистентности организма к бактериальной флоре.
В настоящее время, когда ранозаживляющее действие гепона доказано, лечение больных лучевыми язвами начинается с применения гепона, а затем дополняется, по показаниям, другими лекарственными средствами. Лечение лучевых ректитов (18 больных) и лучевых циститов (17 больных) проводилось в виде ежедневных двукратных микроклизм или инстилляций водного раствора 0,04% в течение 12—18 дней. Результаты применения гепона также сравнивались с результатами «традиционного» лечения, практиковавшегося в отделении в течение последних 25—30 лет (микроклизмы димексида 5—10%, эмульсии синтозона, витаминизированных масел и т. п.). Внутриполостное введение гепона уменьшало интенсивность болей и геморрагий и сокращало продолжительность лечения с 28—36 до 15—23 дней. Применение гепона активировало показатели иммунитета и у этой группы больных.
Таким образом, иммуномодулятор гепон в лечении больных с местными лучевыми повреждениями (лучевые язвы, лучевые ректиты и циститы) проявил себя как эффективное медикаментозное средство, способствующее быстрому снижению выраженности воспалительного процесса в поврежденных облучением тканях и ускорению репараторных процессов в них.
Литература
М. С. Бардычев, доктор медицинских наук, профессор
Медицинский радиологический научный центр РАМН (г. Обнинск)
Мукозит — объединяющий термин для воспалительных (эритематозных и эрозивно-язвенных) поражений слизистой рта, глотки, пищевода и в целом желудочно-кишечного тракта (ЖКТ) в результате противоопухолевого лечения [1]. Мукозит существенно повышает расходы на лечение, так как увеличивает продолжительность госпитализации, потребность в нутритивной поддержке и медикаментах [2]. Он может привести к летальному исходу: косвенно — в результате тяжелой нутритивной недостаточности и ее осложнений, либо непосредственно — вследствие сепсиса.
Тяжелый мукозит, особенно при поздно начатом лечении, приводит к вторичному инфицированию, болевому синдрому, психоэмоциональным проблемам, анорексии, невозможности энтерального питания. Разрушение естественного слизистого барьера создает повышенный риск инфекции, как локальной, так и системной [3].
Мукозит чаще всего развивается на 7–10 день от начала химиотерапии, продолжаясь на фоне нейтропении до 2–3 недель. Инфекции, связанные с мукозитом, часто обусловлены бактериальной флорой ротовой полости (грамположительной) и кишечника (грамотрицательной и анаэробной), грибами рода Candida и герпес-вирусами [4].
Мукозит: определение, частота и последствия
Оральный мукозит — часто регистрируемое и потенциально опасное осложнение противоопухолевой терапии. Воспаление и изъязвление слизистой оболочки ротовой полости снижают способность к глотанию, приему пищи и питью, что приводит к анорексии и потере веса. Гастроинтестинальный мукозит может развиваться в ответ на системную химиотерапию или лучевую терапию и сопровождается такими симптомами, как понос, вздутие живота, недержание кала и боли в животе.
Данное терминологическое разделение мукозита на оральный или гастроинтестинальный в зависимости от его локализации длительно сохранялось в англоязычной литературе. Однако, по мере развития клинических рекомендаций по лечению мукозита, стало преобладать мнение об искусственности этого деления, так как ЖКТ — единая структура в эмбриологическом и функциональном отношении. Мукозит может встречаться на любом уровне ЖКТ, но с различными клиническими проявлениями, что обусловлено специфической структурой и функцией слизистой различных его отделов [5]. Впоследствии появилась новая терминология. «Алиментарный мукозит» стал предпочтительным термином, описывающим воспаление слизистой вследствие противоопухолевой терапии, в любой точке ЖКТ, от ротовой полости до ануса.
Получение корректных и сопоставимых данных об истинной частоте и распространенности мукозита является непростой исследовательской задачей. Это обусловлено существующим разнообразием групп пациентов (вид опухоли, ее локализация, стадия) и методов лечения (трансплантация, химиотерапия, лучевая терапия, комбинированные режимы). Только недавно мукозит стал самостоятельным объектом клинических исследований. Кроме того, методика оценки тяжести мукозита редко является стандартизованной, что мешает судить о качестве полученных данных [2, 6].
Частота выявления мукозита у пациентов с опухолями головы и шеи, получающих лучевую терапию, и у больных после трансплантации гемопоэтических стволовых клеток (ТГСК) варьирует от 85% до 100% и от 75% до 100% соответственно [3, 7]. Таким образом, хотя только 4% всех описанных мукозитов наблюдались у пациентов, перенесших трансплантацию [8], частота мукозита в данной группе больных может достигать 100%.
Вследствие существенных клинических последствий орального мукозита, его экономическое бремя также является значительным. Данные из США свидетельствуют об удвоении затрат на пациентов, перенесших противоопухолевую терапию, у которых развился мукозит, по сравнению с теми пациентами, у которых данное воспаление отсутствовало [9]. Специфические затраты при мукозите включают в себя: 1) отсроченное или прерванное лечение (в 35% химиотерапия у пациентов отсрочена и прекращена у 30%); 2) энтеральное питание (87% пациентов, получивших ТГСК, нуждаются в зондовом питании); 3) назначение медикаментов, включая антибиотикотерапию и опиоидные аналгетики (в последних нуждаются до 80% пациентов ТГСК); и, наконец, 4) удлинение сроков госпитализации (у больных с солидными опухолями, получающими миелосупрессивную терапию, возникновение мукозита удвоило количество дней госпитализации за один цикл) [2, 9].
Клиническая оценка мукозита
Как в научных исследованиях, так и в терапевтической практике оценочные шкалы мукозита должны быть объективными, комплексными, воспроизводимыми и стандартными. К сожалению, ни одна шкала не отвечает всем названным критериям и не принята единодушно всеми профессиональными сообществами онкологов. Тем не менее, их широкое использование в онкологии позволяет провести ретроспективное сравнение токсичности между различными исследованиями.
Клинические рекомендации по профилактике и лечению мукозита
Первые клинические рекомендации [6] по ведению алиментарного мукозита были изданы в 2004 году и основывались на обзоре результатов исследований 14 рабочих групп. В данных рекомендациях подчеркивалась нехватка качественных научных публикаций по проблеме мукозита, соответствующих требованиям доказательной медицины. В целом эти рекомендации более фокусировались на рутинном уходе за больными, чем на препаратах с доказанной эффективностью. Тем не менее, среди них был рекомендован цитопротектор амифостин (Этиол) для профилактики эзофагита у пациентов, получающих лучевую терапию при немелкоклеточном раке легкого. Никакие специальные виды нутритивной поддержки не были включены в указанный документ. Однако из 205 источников, использованных при его составлении, четыре публикации касались супплементации глютамином [10–13].
Обновленные клинические рекомендации были изданы в 2007 году [14]. Основные изменения касались: рекомендаций к применению фактора роста кератиноцитов-1 (KGF-1), Kepivance для профилактики орального мукозита у пациентов ТГСК и рекомендаций против системного (парентерального) использования глютамина [15].
Эти клинические рекомендации представляют собой большой шаг вперед в разработке проблемы мукозита. Однако только очень небольшое количество практикующих врачей слышали об этих клинических рекомендациях и лишь неутешительно низкий процент врачей стал их использовать в своей практике. Таким образом, на первый план в будущем выдвигаются обучающие программы для профессионалов по ведению алиментарного мукозита [8, 16].
Общепризнанными принципами профилактики мукозита являются: соблюдение оральной гигиены, санация кариозных зубов и проявлений периодонтита перед началом химиотерапии. Стандартные профилактические правила ухода за полостью рта включают чистку зубов специальной мягкой щеткой или даже тампоном (при агранулоцитозе), частые полоскания раствором пищевой соды, антисептиками и противомикробными препаратами. Важно не использовать в питании раздражающие продукты (кислые, горькие, соленые) и пищу, агрессивную термически и механически (леденцы, семечки, сухарики, мелкие косточки). Лечение мукозита также включает регулярное полоскание полости рта для удаления зубного налета и поддержания влажности слизистой. Для снятия боли могут использоваться анальгезирующие препараты (лидокаин и др.), при выраженной боли необходимы системные аналгетики, включая опиоиды. Лечение вторичных инфекций (бактериальных, грибковых, вирусных), осложняющих мукозит, проводится по общим принципам лечения инфекций у иммунокомпрометированных больных [4]. В отличие от вышеперечисленных терапевтических положений, клиническое питание и нутритивная поддержка больных, страдающих мукозитом, разработаны в гораздо меньшей степени.
Мукозит: роль нутритивной поддержки
Нутритивная поддержка пациентов со злокачественными опухолями тазовой области, получавших лучевую терапию. У пациентов со злокачественными опухолями области таза, получающих лучевую терапию и химиотерапию, тяжелая нутритивная недостаточность встречается нечасто, однако острый гастроинтестинальный мукозит является типичной проблемой. В недавнем обзоре результатов нутритивной поддержки пациентов, получавших лучевую терапию на область таза (n = 2?646), делается заключение о том, что диеты с низким содержанием жира, среднецепочечные триглицериды (Medium Chain Triglycerides, MCTs), пробиотики и элементные диеты заслуживают дальнейшего изучения [17]. Основной причиной ограничения блюд обычного рациона и даже полимерных питательных смесей для клинического питания больных с гастроинтестинальным мукозитом является недостаточность ферментативного гидролиза в тонкой кишке. Так называемые элементные диеты, содержащие основные питательные вещества в виде гидролизатов и мономерных продуктов, традиционно используемые при мальабсорбции самого различного генеза, все шире применяются при гастроинтестинальных мукозитах у онкологических больных. Результаты первоначальных исследований вкусовой привлекательности и переносимости данных продуктов [18, 19] были впечатляющими [19], хотя число пациентов, употреблявших элементную диету на фоне лечения, снизилось с 92% в первую неделю до 46% в пятую неделю [19].
Новые компоненты питания при лучевой и химиотерапии:глютамин и TGF-бета
Оба названных компонента направлены на снижение активности воспалительного процесса, составляющего патогенетическую сущность алиментарного мукозита. Роль глютамина в профилактике токсичности, вызванной химиолучевой терапией, продолжает изучаться [20]. Глютамин — условно незаменимая аминокислота со многими биологическими функциями. Помимо его роли в регуляции внутриклеточного редокс-потенциала (предшественник глютатиона), глютамин способен сократить выработку провоспалительных цитокинов и снизить интенсивность связанного с ними апоптоза. Цитотоксическая химиотерапия увеличивает потребность клеток в глютамине. В таблице суммируются недавние исследования перорального приема глютамина для профилактики мукозита при лечении различных онкологических заболеваний [10, 11, 21–29].
Более новый компонент клинического питания при мукозите — трансформирующий фактор роста бета-2 (Transforming Growth Factor beta-2, TGF-beta-2). Его натуральным источником является молочный белок казеин. TGF-бета (существующий в трех изоформах) может быть классифицирован и как цитокин, и как фактор роста. Он вовлечен в регуляцию множества процессов, включая контроль клеточного цикла и процесс репарации [30]. Питательные смеси, содержащие казеин и богатые TGF-бета, показали свою эффективность в индукции ремиссии при болезни Крона [31], возможно, за счет прямого противовоспалительного эффекта в отношении слизистой кишечника [32]. В исследованиях на животных рацион, обогащенный TGF-бета, был продемонстрирован как протективный в отношении воспаления тонкого кишечника [33, 34]. Уникальной питательной смесью для клинического питания больных с алиментарным мукозитом является сухая полимерная безглютеновая и безлактозная смесь Модулен IBD, cодержащая терапевтические концентрации TGF-бета. Технология изготовления смеси для энтерального клинического питания Модулен IBD позволила сохранить в ее составе этот естественный противовоспалительный фактор роста, содержащийся в непастеризованном женском и коровьем молоке. Терапевтическая эффективность TGF-бета в профилактике и лечении мукозита еще не полностью оценена в клинической практике. Научный поиск в этой области начат относительно недавно, однако в число стандартных показаний к применению питательной смеси с противовоспалительным эффектом Модулен IBD уже включена профилактика и/или оказание дополнительного лечебного эффекта при поражениях слизистых, вызванных противоопухолевой терапией (мукозитах).
Нутритивная поддержка при ТГСК у пациентов с высоким риском мукозита
Традиционно парентеральное питание было основным предметом исследований в этой области. Однако в последние годы интерес к данному виду нутритивной поддержки снизился из-за его значительных недостатков, включая риск инфекций, связанных с центральным венозным катетером, увеличением длительности госпитализации, а также финансовых затрат. Однако, несмотря на это, при мукозите IV степени по шкале ВОЗ парентеральное питание остается единственным средством нутритивной поддержки пациента и, таким образом, продолжает играть важную роль для предотвращения нутритивной недостаточности [35].
Наряду с этим, имеются исследования, доказывающие, что энтеральное питание является безопасным и эффективным методом питания после аллогенной трансплантации [36], хотя необходимы дальнейшие рандомизированные исследования в этой области. Возможно, ключевым моментом в использовании энтерального питания является выбор времени введения пищевого зонда и начала питания [37], так как после развития алиментарного мукозита установка пищевого зонда трудно переносима и неоправданно травматична. Другой возможный подход к расширению объема энтерального питания — это использование назоеюнального зонда с целью прекращения рвоты, вызванной питанием элементными смесями [38]. ЃЎ
По вопросам литературы обращайтесь в редакцию.
Е. В. Полевиченко, доктор медицинских наук, профессор
ГОУ ВПО «Ростовский государственный медицинский университет», Ростов-на-Дону
Эзофагит - заболевание пищевода, сопровождающееся воспалением его слизистой оболочки вследствие различных причин.
Примечание 1
В данную подрубрику включены:
1. Абсцесс пищевода.
2. Эзофагит:
- неуточненный;
- лекарственный, по сути - химический без ожога;
Следует использовать дополнительные коды V01-Y98 "Внешние причины заболеваемости и смертности", если это необходимо для определения причины эзофагита.
Примечание 2. Приведенные в данной подрубрике описания отдельных форм и этиологий эзофагита выполнены для общего представления о данном заболевании.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
При классификации эзофагита выделяют следующие виды заболевания:
А. Клинические формы эзофагита
1. Острый эзофагит – воспаление стенки пищевода, проявляющееся болями, наиболее выраженными при прохождении пищи. В основной массе случаев он протекает в сочетании с болезнями желудка (ГЭРБ) или регургитацией и поражает обычно нижнюю часть пищевода. Возникновению заболевания способствуют нарушения питания, ожоги, химические вещества, обширная инфекция, полигиповитаминоз. Продолжительность острого эзофагита - до 3 месяцев.
2. Хронический эзофагит – хроническое воспаление стенки пищевода. Заболевание может развиться при недостаточно вылеченном остром эзофагите или как первично-хронический процесс. Хронический эзофагит может также возникать при длительном приеме слишком грубой или острой пищи, крепких алкогольных напитков. Течение хронического эзофагита характеризуется периодическими обострениями и ремиссиями. При позднем начале лечения и неуклонно прогрессирующем эзофагите, могут образовываться рубцовые изменения пищевода.
По выраженности поражения стенки хронический эзофагит делят на 4 степени согласно классификации Савари и Миллера (классификация эндоскопических признаков хронического эзофагита):
- I - гиперемия без эрозивных дефектов в дистальных отделах;
- II - разрозненные мелкие эрозивные дефекты слизистой;
- III - эрозии слизистой сливаются друг с другом;
- IV - язвенное поражение слизистой, стеноз.
3. Особые формы:
3.1 Идиопатический язвенный (ульцерозный) эзофагит (имеет некоторые общие морфологические черты с неспецифическим язвенным колитом) см. K22.1 Язва пищевода.
3.2 Неспецифический регионарный стенозирующий эзофагит (гранулематоз пищевода) - особая форма хронического эзофагита, для которой характерны трансмуральное неспецифическое гранулематозное воспаление пищевода, утолщение его стенки и почти полная облитерация просвета. Поражение пищевода при этом напоминает болезнь Крона, но в отличие от последней, в клеточном составе гранулёмы отсутствуют эозинофилы и гигантские клетки. Этиология заболевания неизвестна. Заболевание развивается преимущественно у молодых лиц (до 25-30 лет) одинаково часто у женщин и мужчин. Начало заболевания постепенное.
Б. Морфологические формы эзофагита:
1. Катаральная (отечная) форма характеризуется гиперемией и отечностью слизистой оболочки пищевода, является наиболее распространенной формой эзофагита.
2. Эрозивная форма наиболее часто развивается при острых инфекционных болезнях и действии на стенку пищевода раздражающих веществ.
3. Геморрагическая форма развивается при некоторых инфекционных и вирусных болезнях (например, при сыпном эпидемическом тифе, гриппе).
4. Псевдомембранозная форма наблюдается при дифтерии, скарлатине, при данной форме фибринозный экссудат не спаян с подлежащими тканями.
5. Эксфолиативная форма наблюдается при дифтерии, скарлатине, при этой форме фибринозный экссудат прочно связан с подлежащими тканями.
6. Некротическая форма встречается при тяжелом течении таких инфекционных болезней, как корь, скарлатина, брюшной тиф и др., а также при кандидозе, агранулоцитозе , сопровождается образованием глубоких язв (см. K23.8* Поражения пищевода при других болезнях, классифицированных в других рубриках).
7. Флегмонозная форма образуется в результате внедрения в стенку пищевода инфицированного инородного тела (T18.1 Инородное тело в пищеводе) или инфекции. Процесс склонен к абсцедированию и может распространиться вдоль пищевода и в сторону средостения .
В. Этиологические формы эзофагита:
1. Поражения при ГЭРБ (наиболее частая причина) - см. Гастроэзофагеальный рефлюкс с эзофагитом (K21.0).
2. Алиментарый эзофагит - возникает вследствие злоупотребления чрезмерно горячей и острой пищей, крепкими спиртными напитками.
3. Профессиональный эзофагит - возникает в результате воздействия вредной среды (пары концентрированных кислот и едких щелочей, соли тяжелых металлов и др. во время исполнения профессиональных обязанностей).
7. Инфекционные эзофагиты (вирусные грибковые, бактериальные).
8. Поражения при приеме некоторых лекарств.
9. Радиационные (в дозе поглощенного облучения >30 Грей).
Г. По локализации процесса
По локализации и распространенности воспалительного процесса различают дистальный, проксимальный и тотальный эзофагит.
Этиология и патогенез
Основные причины
Желудочно-пищеводный рефлюкс является основной причиной возникновения эзофагита. Он приводит к повреждению слизистой пищевода вследствие воздействия кислотно-пептического фактора. Эзофагит, вызванный рефлюксом, называется рефлюкс-эзофагитом (см. "Гастроэзофагеальный рефлюкс с эзофагитом" - K21.0).
Эзофагит может быть вызван химическим ожогом щелочью или кислотой, растворителем (бензин, ацетон), сильным окислителем типа перманганата калия. Такой эзофагит обычно регистрируется у детей в результате случайной пробы, также наблюдается у взрослых после попытки суицида с применением щелочи, кислоты, растворителя или окислителя ("Химический ожог пищевода" - T28.6).
Эзофагит часто встречается у алкоголиков, в качестве повреждающего фактора выступает спирт.
Возможно развитие эзофагита как профессионального заболевания (при контакте с парами различных повреждающих веществ).
Физическое повреждение пищевода вследствие лучевой терапии, введения зонда ("Инородное тело в пищеводе" - T18.1) также может быть причиной эзофагита.
- лекарственной терапией (в 90% случаев антибиотики из группы тетрациклинов, НПВС, хинидина, фосамакса, эмперониума бромида. Важными факторами являются химическая природа лекарства, его растворимость, время контакта с слизистой оболочкой, размер, форма и покрытие таблетки, малое количество воды при глотании таблетки, существующие изменения пищевода (например, стриктуры, ахалазия);
- ингаляционным наркозом (видимо связан с рефлюксом или раздражающим действием паров анестетиков);
- аллергической патологией (с 2007 года эозинофильный эзофагит выделен в отдельное заболевание, связанное с аллергической реакцией по типу атопии, сезонными обострениями, семейной предрасположенностью. Предположительно 6 основных продуктов связаны с большинством случаев обострения - пшеница, молоко, яйца, рыба / морепродукты, бобовые / арахис, соя);
Морфологические варианты острого эзофагита:
1. Язвенный процесс характерен для поражения пищевода вирусами группы герпеса, отмечается и при туберкулезе.
3. Мембранозный эзофагит возникает при ожогах пищевода и тяжелых инфекционных заболеваниях. Пленки отторгаются болезненно, оставляя рубцовые изменения.
4. Некротический эзофагит развивается в случае поражений пищевода при сепсисе, кандидамикозе, лучевой терапии, на фоне лечения болезней крови цитостатиками. Эндоскопически выявляются некроз и изъязвления слизистой оболочки пищевода; исходом воспалительного процесса являются рубцовые образования.
5. Септический эзофагит встречается при гнойном воспалении стрептококковой этиологии, ранениях пищевода инородными телами.
Эпидемиология
Признак распространенности: Редко
Частота случаев инфекционного эзофагита, наблюдаемого у иммунокомпрометированных лиц высока, у лиц без поражения иммунитета является казуистикой или следствием другой патологии (травмы, туберкулез и т.д.).
Аллергический (эозинофильный) эзофагит регистрируется в с распространенностью 45-55 случаев на 100 000 населения в развитых странах.
Факторы и группы риска
- погрешности питания;
- употребление недостаточного количества воды при проглатывании таблеток;
- прием некоторых лекарственных препаратов;
- прием алкоголя;
- курение;
- семейная (генетическая) предрасположенность к аллергии;
- недостаточность иммунитета;
- вредная профессиональная среда.
Клиническая картина
Клинические критерии диагностики
боль при глотании, дисфагия, одинофагия, кровавая рвота, рвота кофейной гущей, мелена, саливация, боль за грудиной, боль в эпигастрии, изжога, регургитация
Cимптомы, течение
Симптомы эзофагита: затруднения и/или болезненные ощущения при глотании, изжога, боли во рту, ощущение чего-то застрявшего в горле, тошнота, рвота.
При остром эзофагите возможно повышение температуры тела, наблюдается общее недомогание, возникают неприятные ощущения по ходу пищевода во время продвижения пищи, может беспокоить жжение, иногда резкая боль в пищеводе. Больные могут жаловаться на боль в области шеи, отрыжку, нарушенное глотание, слюнотечение.
Примечание
В зависимости от этиологии эзофагита, могут появляться дополнительные признаки, связанные с непосредственной причиной заболевания. Например, пузырьковая сыпь при герпесе, молочница слизистой рта, связь с приемом определенной пищи, сезонные обострения, ассоциированная патология (астма) и прочие.
Радиационный эзофагит может возникнуть спустя значительное время после лучевой нагрузки.
Эозинофильный эзофагит не имеет четкой клинической картины и может не распознаваться длительное время.
Любые пациенты с клиникой хронического рефлюкс-эзофагита, резистентные к проводимой антирефлюксной терапии, должны рассматриваться как пациенты с вероятными редкими причинами эзофагита (все причины кроме ГЭРБ Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) - хроническое рецидивирующее заболевание, обусловленное спонтанным, регулярно повторяющимся забросом в пищевод желудочного и/или дуоденального содержимого, что приводит к поражению нижнего отдела пищевода. Часто сопровождается развитием воспаления слизистой дистального отдела пищевода - рефлюкс-эзофагитом, и/или формированием пептической язвы и пептической стриктуры пищевода, пищеводно-желудочных кровотечений и других осложнений
Подробно ).
Диагностика
Лабораторная диагностика
Обязательные исследования:
- общий анализ крови с определением ретикулоцитов, тромбоцитов;
- общий анализ мочи.
Дополнительные исследования: биохимический анализ крови (общий белок, альбумин, С-реактивный белок, сиаловые кислоты, глюкоза, АлАТ, АсАТ, билирубин, амилаза, ЩФ, мочевина, креатинин, электролиты).
Дифференциальный диагноз
Дифференциальный диагноз при эзофагите проводится в первую очередь с ГЭРБ (отсутствие эффекта от антирефлюксной терапии).
Также необходима дифференциальная диагностика с врожденными мембранами пищевода, стриктурами пищевода, неврогенной анорексией, поражениями пищевода при склеродермии, опухолями пищевода, термическими, химическими, лучевыми поражениями и т.д.
При первичном эозинофильном гастроэнтерите (Аллергический и алиментарный гастроэнтерит и колит - K52.2), наряду с эозинофильной инфильтрацией слизистой желудка и тонкой кишки, также возможны подобные изменения и в пищеводе. Помочь дифференцировать эозинофильный эзофагит от первичного эозинофильного гастроэнтерита могут отрицательные по эозинофильной инфильтрации образцы биопсии из желудка, двенадцатиперстной и толстой кишки.
Инфекционный эзофагит имеет, как правило, признаки инфекции другой локализации и сочетается с иммунодефицитом.
Читайте также:

