Аорто легочный свищ что это такое
Обновлено: 17.05.2024
Российский университет дружбы народов, Москва, Россия, Кафедра госпитальной хирургии с курсом детской хирургии на базе НУЗ «Центральная клиническая больница №2 им. Н.А. Семашко ОАО «РЖД», Москва, Россия
кафедра сердечно-сосудистой хирургии Российского университета дружбы народов, Москва, Россия
ГАУЗ Московской области «Центральная городская клиническая больница Реутова», кафедра сердечно-сосудистой хирургии Российского университета дружбы народов, Москва, Россия, клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Кафедра госпитальной хирургии РУДН, Москва;
НУЗ ЦКБ №2 им. Н.А. Семашко ОАО "РЖД", Москва
Особенности лечения коронарно-сердечных фистул
Журнал: Кардиология и сердечно-сосудистая хирургия. 2019;12(1): 70‑73
Российский университет дружбы народов, Москва, Россия, Кафедра госпитальной хирургии с курсом детской хирургии на базе НУЗ «Центральная клиническая больница №2 им. Н.А. Семашко ОАО «РЖД», Москва, Россия
Описываются особенности диагностики и лечения редкой врожденной патологии — коронарно-сердечных фистул. Представлены клинические примеры больных с высоко- и низкошунтируемыми фистулами.
Российский университет дружбы народов, Москва, Россия, Кафедра госпитальной хирургии с курсом детской хирургии на базе НУЗ «Центральная клиническая больница №2 им. Н.А. Семашко ОАО «РЖД», Москва, Россия
кафедра сердечно-сосудистой хирургии Российского университета дружбы народов, Москва, Россия
ГАУЗ Московской области «Центральная городская клиническая больница Реутова», кафедра сердечно-сосудистой хирургии Российского университета дружбы народов, Москва, Россия, клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Кафедра госпитальной хирургии РУДН, Москва;
НУЗ ЦКБ №2 им. Н.А. Семашко ОАО "РЖД", Москва
КСФ могут происходить как из левой, так и из правой коронарных артерий, однако большинство врожденных КСФ (40—60%) возникают в системе правой коронарной артерии. Дренирование фистул в большинстве случаев осуществляется в правый желудочек (50%), правое предсердие (24%), легочную артерию, коронарный синус, левый желудочек (2%). В 1980 г. H. Bankl разделил КСФ на артериовенозные (коронарная артерия — КА — анастомозирует с правыми отделами сердца) и артерио-артериальные (КА анастомозирует с левыми отделами сердца).
В настоящее время не существует четких критериев, позволяющих разделить коронарные фистулы на малые, средние и большие. Некоторые авторы [1] считают малыми фистулы меньше 1 мм, большими считаются фистулы, размер которых превышает 3 мм. В литературе встречаются различные определения «малых» и «больших» фистул, основанные на клинических проявлениях. Так, малые КСФ обычно не проявляются клинически и являются случайной находкой при проведении коронарной ангиографии. Напротив, большие коронарные фистулы проявляются выраженной, но не специфической клинической картиной: стенокардия, нарушения ритма сердца, признаки застойной сердечной недостаточности, эндокардит.
Ввиду того, что КСФ относятся к патологии сосудистой системы, к ним можно применить классификацию G. Forbes и соавт., в которой систематизированы врожденные сосудистые мальформации (ВСМ) на основе гемодинамических параметров и данных рентгеноконтрастной ангиографии. В зависимости от волюметрических характеристик кровотока ВСМ разделяли на высокошунтируемые и низкошунтируемые. Высокошунтируемые ВСМ соответствовали макрофистулезным формам, тогда как низкошунтируемые — микрофистулезным формам.
Помимо размеров коронарной фистулы, важными гемодинамическими характеристиками являются давление и резистентность принимающей камеры и потенциальное развитие ишемии.
Малые КСФ могут протекать без симптомов и не вызывать нарушений функции сердца. Однако с возрастом частота осложнений увеличивается. Это связано с постепенной дилатацией фистулы и развитием синдрома коронарного «обкрадывания». К осложнениям КСФ также можно отнести тромбоз фистулы и эмболию, которые встречаются довольно редко, инфаркт миокарда (как в зоне, расположенной дистальнее фистулы, так и во всем бассейне данной коронарной артерии), сердечную недостаточность, инфекционный эндокардит, аневризмы фистул, разрыв папиллярных мышц. Спонтанное закрытие крупных коронарно-сердечных фистул наблюдается редко.
Основным методом диагностики КСФ является коронарография. Она дает возможность оценить гемодинамику КСФ, обеспечивает четкую визуализацию аномального сосуда, что является определяющим в выборе тактики лечения. Необходимо оценить количество фистул, характер питающего фистулу сосуда или сосудов, места дренирования, количество миокарда, который может пострадать при развитии ишемии, и гемодинамическое значение шунта. Риск сохранения фистулы должен быть соотнесен с риском ее окклюзии.
Компьютерная томография дает представление о взаимоотношении КСФ с полостями сердца, детально показывает дистальные отделы коронарных артерий и их боковых ветвей.
Пациент З., 59 лет, поступил в стационар с жалобами на одышку при подъеме на 2-й этаж, ощущение сердцебиения. Ухудшение состояния отмечает в течение последних 14 дней. Из анамнеза: перебои в работе сердца впервые возникли в 2010 г., в поликлинику не обращался. В 2012 г. во время работы развился приступ удушья, после которого больной обратился в поликлинику по месту жительства и в течение года наблюдался амбулаторно у терапевта и кардиолога. Диагноз по записям в амбулаторной карте: ИБС, мерцательная аритмия, гипертоническая болезнь II ст.
Отклонения со стороны лабораторных данных: в общем анализе крови отмечается незначительный лимфоцитоз, при биохимическом исследовании крови фиксируется незначительное повышение общего билирубина за счет фракции конъюгированного билирубина, что может говорить о нарушении функции печени.
По данным ЭхоКГ: дилатация полостей предсердий, ствола легочной артерии. Умеренная гипертрофия миокарда левого желудочка (ЛЖ). Систолическая функция ЛЖ не нарушена, фракция выброса 70%. Начальный кальциноз створок аортального клапана. Гемодинамически незначимая митральная и трикуспидальная регургитация, обусловленная деформацией клапанного кольца. Признаки легочной гипертензии.
ЭКГ: фибрилляция предсердий с частотой сокращения желудочков (ЧСЖ) до 100—130 уд/мин, признаки увеличения ЛЖ.
По данным коронарной ангиографии (КАГ): правый тип коронарного кровоснабжения. Ствол левой коронарной артерии расположен типично, проходим, контуры ровные; передняя нисходящая, огибающая и правая коронарные артерии типично расположены, проходимы, контуры ровные. Однако на серии ангиограмм визуализируется сеть плексиформных фистул дистальных третей ветви тупого края (ВТК) и диагональной ветви (ДВ), дренирующихся в ЛЖ (артерио-артериальные фистулы).
Терапевтическое лечение включало бисопролол 5 мг 2 раза в день и эналаприл 5 мг 2 раза в день, динамическое наблюдение. Данная терапия направлена на контроль ЧСЖ при фибрилляции предсердий и контроль артериального давления. На фоне проводимого лечения ощущения сердцебиения не возникало.

В первом клиническом случае источниками фистулы являются крупная диагональная ветвь и ветвь тупого края. Как видно на ангиограмме (рис. 1), Рис. 1. Низкошунтируемая коронарно-сердечная фистула. плексиформная сосудистая сеть располагается по внутреннему контуру левого желудочка, однако, судя по скорости сброса крови в левый желудочек, фистула является низкошунтируемой, поэтому мы не можем говорить о развитии нарушений ритма (ФП) вследствие фистулы. По данным литературы [4], небольшие бессимптомные фистулы совместимы с обычным образом жизни и не требуют хирургической коррекции. В данном случае на фоне подобранной медикаментозной терапии жалобы не рецидивировали, но пациент находится под наблюдением кардиолога. Рекомендованы эхокардиографическое обследование и коронарная ангиография ежегодно.
Пациент Х., 63 лет, поступил в стационар с жалобами на эпизоды неритмичного сердцебиения, приступы одышки, боли за грудиной на фоне физической нагрузки, купирующиеся приемом нитроглицерина, слабость, повышенную утомляемость.
Из анамнеза известно, что в течение длительного времени страдает гипертонической болезнью с максимальным подъемом АД до 170/100 мм рт.ст.
При аускультации тоны сердца приглушены, ритмичны, ЧСС 80 уд/мин, АД 110/80 мм рт.ст., печень несколько увеличена (размеры по Курлову 11/9/8 см).
На ЭКГ: ритм синусовый, ЧСС 72 уд/мин, электрическая ось сердца (ЭОС) отклонена влево.
В общем анализе крови все показатели в пределах нормы, в биохимическом исследовании крови отмечаются незначительное снижение общего белка и повышение холестерина.
По данным ЭхоКГ: расширение аорты на уровне синусов Вальсальвы. Дегенеративные изменения стенок аорты, створок аортального и митрального клапанов. Дилатация полостей обоих предсердий и правого желудочка. Систолическая функция сохранена. Нарушение диастолической функции миокарда по I типу. Пролапс митрального клапана 1-й степени с признаками регургитации 1—2-й стадии. Легочная и трикуспидальная регургитация 1—2-й стадии, аортальная регургитация 1-й степени. Признаки начальной легочной гипертензии (СДЛА 33 мм рт.ст.).
По данным КАГ: правый тип коронарного кровоснабжения. Ствол левой коронарной артерии типично расположен, проходим, короткий; передняя нисходящая, огибающая и правая коронарные артерии типично расположены, проходимы, контуры ровные. На серии ангиограмм визуализируется обширная плексиформная сеть артерио-артериальных фистул из бассейнов правой и левой коронарных артерий (ВТК и ДВ-1).
Лечение: лозартан 12,5 мг/сут утром, ивабрадин 5 мг 2 раза в день, ацетилсалициловая кислота 100 мг/сут, хирургическая коррекция КСФ.

В данном клиническом случае источником фистул являются правая и левая коронарные артерии, однако сброс из передней нисходящей артерии был более выраженным. На ангиограмме (рис. 2) Рис. 2. Высокошунтируемая коронарно-сердечная фистула. видна выраженная обширная плексиформная сосудистая сеть, расположенная по всей длине левого желудочка. Исходя из интенсивности окрашивания, можно назвать такую фистулу высокошунтируемой и, следовательно, приступы стенокардии и ощущение перебоев ритма можно считать проявлениями синдрома обкрадывания. Развитие этого синдрома связано со снижением коронарного кровотока дистальнее отхождения фистулы, что приводит к ишемии миокарда в бассейне данной артерии. По данным нагрузочных тестов, элевация сегмента ST возникает по передней стенке ЛЖ, что соответствует теории ишемии этой зоны из-за коронарной фистулы. Кроме того, у пациента имеются признаки хронической сердечной недостаточности (отеки, увеличение размеров печени), что говорит о патологическом течении процесса. Наличие таких фистул само по себе увеличивает риск развития инфаркта миокарда [3]. Это связано с постепенным обкрадыванием коронарного кровотока дистальнее фистулы, вследствие гипоперфузии. Для компенсации тканевой гипоксии дистальных отделов миокарда артерия постепенно расширяется. Со временем это может привести к формированию аневризм, изъязвлениям и разрывам интимы, медиальной дегенерации, атеросклеротическому поражению, кальцификации, обструкции боковых ветвей и редко — к разрыву.
Выраженная клиническая симптоматика и тяжелый прогноз требуют срочного хирургического вмешательства. В литературе описаны следующие способы хирургической коррекции крупных КСФ: эмболизация окклюдерами, спиральная эмболизация, перевязка, ушивание. К сожалению, данные способы хирургической коррекции не подходят для мелких, но обширных коронарных фистул, так как невозможно перекрыть основной источник фистулы, не вызывая ишемии обширного участка миокарда. Так, эмболизация окклюдером невозможна, так как нет ни одного крупного источника фистулы, она сформирована мелкой, но обширной сетью. Спиральная эмболизация мелких фистул возможна, однако риск спровоцировать ишемию обширного участка миокарда достаточно велик. Более того, в зависимости от количества ветвей на эмболизацию фистулы может потребоваться более 5 микроспиралей. Спиртовая эмболизация также может вызвать обширную ишемию миокарда, поэтому эти методы лучше не использовать в данном случае. Перевязка или ушивание фистул также не могут рассматриваться, так как обширная сосудистая сеть расположена в толще миокарда на большом протяжении.
В литературе очень мало информации по ведению и лечению мелких плексиформных фистул с гемодинамически значимым сбросом крови. В нашем случае медикаментозная терапия представлена ивабрадином и лозартаном. Ивабрадин — блокатор if-каналов, снижает потребность миокарда в кислороде, используется для профилактики приступов стенокардии, лозартан – антагонист рецепторов ангиотензина II типа, снижает давление в малом круге кровообращения, уменьшает постнагрузку и обладает диуретическим эффектом. Для профилактики тромбообразования назначена ацетилсалициловая кислота. На фоне терапии ангинозные приступы не рецидивировали, отеки и одышка исчезли, однако данному пациенту показана хирургическая коррекция с целью полной окклюзии фистулы, поэтому необходимо продолжать поиск оптимальной хирургической тактики.
Коронарная фистула — это один из вариантов коронарных аномалий впадения, при котором происходит дренирование крови из венечного сосуда в сердечные камеры или крупные сосуды. В раннем возрасте состояние проявляется потливостью, медленным набором веса, синюшностью кожных покровов. У взрослых при сосудистой аномалии возникают признаки сердечной недостаточности. Основные методы диагностики — ЭхоКГ, селективная коронарография и МСКТ, также применяется ЭКГ и рентгенография грудной клетки. Радикальное лечение порока предполагает транскатетерную окклюзию коронарной фистулы или хирургическую коррекцию аномалии.
МКБ-10
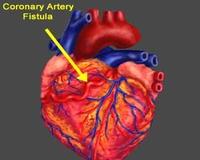

Общие сведения

Причины
Другая теория образования фистул указывает на пороки развития дистальных сегментов коронарных артерий. При этом вместо нормальных сосудов, которые питают сердечную мышцу, появляются аномальные шунты между венечными сосудами и полостями желудочков. Этиологическим фактором коронарной сосудистой аномалии служат различные варианты обструкции кровотока — например, при атрезии легочной артерии.
Патогенез
Основной патофизиологический механизм заболевания — развитие синдрома обкрадывания в участках миокарда, которые расположены дистальнее фистулы. В пораженном венечном сосуде постепенно снижается кровоток и диастолическое давление, что обусловлено сбросом большей части крови в полость с более низким давлением. Чтобы компенсировать это состояние, диаметр коронарной артерии увеличивается, а ее устье расширяется.
С течением времени венечный сосуд дилатируется до такой степени, что становится неспособным обеспечить адекватное кровоснабжение сердечной мышцы. Дистальные отделы миокарда страдают от ишемии сначала при физической нагрузке, а затем при повседневной активности и в покое. В артериях коронарной сети появляются дегенеративные изменения, изъязвление и точечные разрывы интимы.
Классификация
В клинической кардиологии существует множество классификаций коронарной аномалии впадения. Все фистулы подразделяются на 2 группы:
Клиническое значение имеет тип дренирования фистулы, обуславливающий тяжесть симптоматики. Кардиолог и кардиохирург Ганс Банкл (Австрия) выделяет 2 типа фистул:
- Артериовенозные соустья. Такие коронарные аномалии составляют около 90%, в основном являются врожденными. Происходит анастомозирование коронарной артерии с правыми отделами сердца, коронарным синусом либо легочным стволом.
- Артерио-артериальные фистулы. Данный тип порока включает анастомозы сосудов, питающих миокард, с левым предсердием или желудочком. Наблюдается у 10% больных.
Более 50% мальформаций образуются в правой венечной артерии, 46% — в левой, 4% составляют билатеральные фистулы в обоих коронарных сосудах. Также выделяют одиночные и множественные патологические сосудистые анастомозы. По диаметру сформировавшегося шунта различают малые коронарные фистулы с размером устья менее 2 мм и большие, которые имеют входное отверстие больше 2 мм.
Симптомы коронарной фистулы
Большинство малых венечных аномалий протекает бессимптомно. При большой коронарной фистуле у детей грудного возраста отмечаются приступы повышенной нервной возбудимости, потливость. У младенцев после 2-3 месяцев жизни наблюдается быстрая утомляемость при кормлении, плохая прибавка в весе. При крике кожные покровы вокруг рта приобретают синюшный оттенок. Иногда слышно свистящее дыхание во сне.
У пациентов взрослого возраста постепенно нарастают симптомы сердечной недостаточности. Одними из первых признаков становятся одышка и сердцебиение, которые возникают при физических нагрузках. Характерны постоянная слабость, снижение работоспособности. Больные замечают отеки ног, которые усиливаются к вечеру. Иногда беспокоит боль в прекардиальной области, которая напоминает приступ стенокардии.
Осложнения
Маленькие фистулы редко дают осложнения, но со временем они дилатируются, что повышает риск формирования аневризмы коронарного сосуда. Большие недиагностированные шунты связаны с повышенным риском внезапной сердечной смерти у молодых людей в возрасте 20-35 лет. Частота осложнений увеличивается с возрастом. У 80-90% больных постепенно развивается хроническая ишемия миокарда, которая при отсутствии лечения приводит к ишемической кардиомиопатии.
Опасным осложнением является разрыв аневризматического расширения фистулы, который сопровождается гемоперикардом и сердечной тампонадой. Хроническая перегрузка сердца объемом крови вызывает застойную сердечную недостаточность. Коронарные фистулы у 20-30% пациентов служат предрасполагающим фактором для раннего начала атеросклероза венечных артерий. Иногда возникает инфаркт миокарда вследствие тромбоза фистулы.
Диагностика
Обследованием детей занимается педиатр совместно с детским кардиологом, взрослым больным требуется консультация терапевта-кардиолога. При малых аномалиях отсутствуют объективные симптомы заболевания. При больших фистулах выявляются патологические сердечные шумы, приглушенность тонов. Для подтверждения порока развития используют инструментальные исследования:
- Эхокардиография. УЗИ сердца — «золотой стандарт» диагностики, который показывает дилатацию пораженной коронарной артерии и наличие патологического шунта. Для измерения объемного кровотока через фистулу проводят картирование.
- Электрокардиография. Специфические изменения отмечаются при анастомозах большого диаметра. На перегрузку левого предсердия и желудочка указывает двугорбый зубец Р, отклонение электрической оси сердца влево. Изредка на кардиограмме регистрируются признаки ишемии миокарда.
- КТ. Мультиспиральная компьютерная томография (МСКТ) — лучший неинвазивный метод для трехмерной реконструкции сердца и питающих его сосудов. В ходе исследования обнаруживаются даже дистально расположенные коронарные фистулы.
- Коронарография. Селективная коронарная ангиография с контрастным веществом позволяет осмотреть ход венечного сосуда, степень его расширения и диаметр фистулы. Для оценки характера кровотока дополнительно проводится катетеризация сердца.

КТ-коронарография. А - коронарная фистула, исходящая из правой коронарной артерии (RCA), заканчивающаяся в коронарном синусе (CS). В - объемная трехмерная реконструкция изображения, демонстрирующая свищевой сосуд, соединенный с коронарным синусом.
Лечение коронарной фистулы
Консервативная терапия
Пациентам с фистулами малого размера без клинических проявлений рекомендован диспансерный учет. При появлении симптомов коронарной недостаточности во время физической активности показано симптоматическое лечение. С учетом ведущих клинических симптомов назначают несколько групп препаратов: диуретики, бета-адреноблокаторы, вазодилататоры и др.
Хирургическое лечение
Оперативное вмешательство — метод радикального лечения коронарной фистулы с устьем более 2,0 мм, а также при расширении венечного сосуда более 5,0 мм. При выборе оптимальной хирургической методики учитывают число фистульных отверстий, степень гемодинамических нарушений и локализацию коронарной аномалии. Основные виды оперативных вмешательств:
Прогноз и профилактика
Качество жизни больных с малыми фистулами коронарных артерий не нарушается, риск осложнений минимальный. После успешной хирургической коррекции больших шунтов прогноз также благоприятный. Учитывая врожденный характер заболевания, меры первичной профилактики не разработаны. Для предупреждения осложнений требуется диспансерное наблюдение пациентов со случайно обнаруженными бессимптомными сосудистыми аномалиями.
1. Коронарные фистулы/ В.М. Субботин, Ю.М. Белозеров, Л.В. Брегель // Российский вестник перинатологии и педиатрии. – 2015.
2. Опыт лечения врожденных коронарно-сердечных фистул в сочетании с нарушениями ритма сердца/ Л.А. Бокерия, О.Л. Бокерия, М.Б. Биниашвили и соавт.// Анналы аритмологии. – 2013.
3. Эхокардиографическая диагностика коронарных фистул у детей с шумами над областью сердца/ Н.Ф. Прийман, Д.О. Иванов, Ю.В. Петренко// Вопросы практической педиатрии. – 2015.
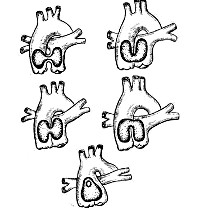
Общие сведения
Дефект аортолегочной перегородки (аортолегочное окно, аортопульмональный септальный дефект, аортолегочный свищ или фенестрация) обусловлен наличием отверстия, посредством которого аорта и ствол легочной артерии сообщаются между собой. Дефект аортолегочной перегородки – редкая аномалия, составляющая в кардиологии 0,2−0,3% случаев всех врожденных пороков сердца.

Причины дефекта аортолегочной перегородки
Аотролегочное окно является следствием нарушения эмбриогенеза, в результате которого не формируется полноценная аортолегочная перегородка. Разделение эмбрионального артериального ствола на аорту и легочный ствол происходит между 6-7 неделями внутриутробного развития плода. Нарушение этого процесса приводит к возникновению дефекта аортолегочной перегородки.
Причины развития дефекта аортолегочной перегородки аналогичны таковым при формировании других врожденных пороков сердца. Факторами, нарушающими формирование сердца плода на ранних этапах внутриутробного развития, могут выступать инфекции беременной (краснуха, ветряная оспа, герпес, грипп, сифилис и др.), прием алкоголя и токсичных лекарственных препаратов, соматические заболевания матери (сахарный диабет), патологическое течение беременности (угроза самопроизвольного прерывания, сильные токсикозы), наследственность, ионизирующее излучение и пр.
Особенности гемодинамики при дефекте аортолегочной перегородки
При дефекте аортолегочной перегородки кровь под большим давлением поступает из восходящей аорты в легочную артерию. Выраженный артериовенозный (лево-правый) сброс рано приводит к развитию легочной гипертензии, которая присутствует у большинства больных с дефектом аортолегочной перегородки. Когда сопротивление в малом и большом круге кровообращения выравнивается, возникает перекрестный, а затем и веноартериальный (право-левый) сброс крови, что сопровождается развитием цианоза.
Классификация дефекта аортолегочной перегородки
С учетом критериев локализации, формы отверстия и его отношения к легочным артериям различают следующие анатомические типы дефекта аортолегочной перегородки (В. И. Бураковский и соавт., НЦССХ им. А. Н. Бакулева):
I тип – дефект имеет форму протока с хорошо выраженными полюсами; расположен в середине аортолегочной перегородки в удалении от синусов Вальсальвы. Левая и правая легочные артерии отходят дистальнее аортолегочного дефекта.
II тип – дефект имеет форму окна; расположен в проксимальной (нижней) части аортолегочной перегородки над синусами Вальсальвы. Аортолегочная перегородка частично сформирвоана в своей дистальной части; ветви легочной артерии отходят нормально, дистальнее дефекта.
III тип - дефект имеет форму окна; расположен в дистальной (верхней) части аортолегочной перегородки в удалении от синусов Вальсальвы. Аортолегочная перегородка частично сформирвоана в своей проксимальной части. Ветви легочной артерии отходят в зоне вершины дефекта.
IV тип – дефект имеет форму окна; расположен в дистальной (верхней) части аортолегочной перегородки, на уровне отхождения правой ветви легочного ствола. При данном типе дефекта аортолегочной перегородки аорта сообщается как с правой легочной артерией, так и с общим легочным стволом.
V тип – полное отсутствие аортолегочной перегородки, однако клапаны аорты и легочной артерии сформированы и разобщены. Легочные артерии отходят от общего магистрального сосуда, берущего начало от основания сердца.
Симптомы дефекта аортолегочной перегородки
У детей первых месяцев жизни ранним симптомом дефекта аортолегочной перегородки служит одышка по типу тахипноэ. Характерно отставание в физическом развитии, быстрая утомляемость, частые ОРВИ, повторные пневмонии.
На стадии преимущественного артериовенозного сброса кожные покровы физиологической окраски или несколько бледные. Небольшой цианоз может появляться при крике, плаче, явлениях сердечной и дыхательной недостаточности. При развитии перекрестного и веноартериального сброса крови цианоз кожи и видимых слизистых становится выраженным и постоянным. У 70% пациентов с дефектом аортолегочной перегородки обнаруживается деформация грудной клетки по типу «сердечного горба», формирование которого связано с увеличением правого желудочка, работающего в режиме гиперфункции.
При дефекте аортолегочной перегородки небольшого диаметра и у детей длительное время сохраняется удовлетворительное состояние. При больших дефектах рано развивается легочная гипертензия. Продолжительность жизни больных с дефектом аортолегочной перегородки зависит от размеров отверстия и составляет от нескольких месяцев до 30-40 лет (в среднем - 14 лет).
Диагностика дефекта аортолегочной перегородки
При осмотре пациентов с дефектом аортолегочной перегородки отмечается отставание в массе и росте, выпячивание грудной клетки в виде сердечного горба. Перкуторно выявляется расширение границ сердечной тупости в обе стороны; при аускультации выслушивается систолический шум с диастолическим компонентом, изменение сердечных тонов; пальпаторно определяется систолическое дрожание во II-III межреберье.
С помощью фонокардиографии зафиксируется аускультативная картина, изложенная выше. Электрокардиография выявляет признаки перегрузки правых отделов сердца, гипертрофию обоих желудочков, отклонение ЭОС вправо. Рентгенологическая картина при дефекте аортолегочной перегородки типична: увеличение тени сердца, расширение тени аорты и легочной артерии, усиление легочного рисунка в ранний период заболевания и его обеднение при развитии легочной гипертензии. С помощью эхокардиографии обнаруживается дефект в аортолегочной перегородке, устанавливается расположение окна, его размеры, исключаются сопутствующие пороки сердца.
Путем зондирования полостей сердца определяется выраженность легочной гипертензии, величина сброса крови, исследуется степень насыщения крови кислородом в легочной артерии. Диагностическим признаком дефекта аортолегочной перегородки является возможность проведения катетера из легочной артерии через отверстие в начальные отделы восходящей аорты. При выполнении аортографии видно попадание контрастного вещества из восходящей аорты в ствол легочной артерии. Дифференциальная диагностика при дефекте аортолегочной перегородки проводится с ДМЖП, общим артериальным стволом, открытым артериальным протоком.
Лечение дефекта аортолегочной перегородки
Поскольку спонтанное закрытие дефекта аортолегочной перегородки невозможно, единственным способом лечения врожденного порока сердца является кардиохирургическая операция. При большом дефекте аортолегочной перегородки операция выполняется в ранние сроки - до 1 года.
Закрытие аортолегочного окна производится путем ушивания или пластики дефекта с помощью заплаты доступами через просвет аорты или легочной артерии, либо с обеих сторон. Операция выполняется в условиях ИК, гипотермии и фармакохолодовой кардиоплегии.
При дефекте аортолегочной перегородки I типа производится перевязка протока. Невозможность выполнения радикальной операции при легочной гипертензии диктует необходимость выполнения двухэтапного вмешательства: 1 - сужение легочного ствола или легочной артерии; 2 - снятие суживающей манжетки и радикальная операция.
Интраоперационная летальность составляет 3%; послеоперационная достигает 15-20%.
Прогноз при дефекте аортолегочной перегородки
Большие размеры дефекта аортолегочной перегородки обусловливают злокачественное течение порока: 25-30% пациентов погибают в течение первого полугода жизни. Причинами смерти пациентов с дефектом аортолегочной перегородки обычно служат сердечная недостаточность, разрыв аневризмы легочной артерии в полость перикарда, тампонада сердца (гемоперикард), тромбоэмболии, бактериальный эндокардит.
У выживших больных отсутствие хирургического лечения приводит к развитию необратимых изменений в легких, делающих невозможным хирургическое лечение в более поздние сроки. В литературе встречаются единичные указания на больных с дефектом аортолегочной перегородки, доживших до 35−40 лет.
МКБ-10
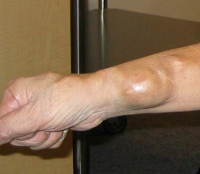
Общие сведения
Артериовенозная фистула представляет собой прямое соустье артерии с веной, пропускающее кровь, минуя капилляры. Это достаточно редкое заболевание – частота патологических почечных шунтов не превышает 1 случая на 1000 человек, спинальные фистулы встречаются еще реже (1 на 100 тыс.). Однако среди сосудистых мальформаций мозга на долю фистульных образований приходится 60–80%, распространенность периферических вариантов достигает 20%. Патологические соустья бедренной артерии составляют 12–30%, сонной и подключичной – до 25% от общего числа подобных дефектов. Женщины страдают артериовенозными дисплазиями в 2–3 раза чаще мужчин.

Причины
Возникновение фистул опосредовано повреждением артериальной и венозной стенок под воздействием внешних или внутренних факторов. Наряду со структурными дефектами и заболеваниями, все большую роль в этиологии артериовенозных шунтов приобретают ятрогенные факторы. В сосудистой хирургии выделяют следующие группы причин:
- Врожденные аномалии. Большинство врожденных мальформаций являются результатом нарушений эмбриогенеза между 4 и 10 неделями гестации. Предполагается влияние внутриутробных инфекций, интоксикаций, артериальной гипертензии у матери и приема некоторых лекарств во время беременности.
- Наследственные заболевания. Трансформация мелких сосудов в артериовенозные шунты и аневризмы наблюдается при наследственной патологии – болезни Рандю-Ослера-Вебера (семейной геморрагической телеангиэктазии), синдроме «голубого пузырчатого невуса». Прослеживается связь с генными мутациями, нарушающими нормальный ангиогенез (PTEN, RASA 1).
- Хроническая патология. Отмечена связь пульмональных фистул с хроническими легочными инфекциями и паразитарными инвазиями (туберкулезом, шистосомозом, актиномикозом), метастазами рака щитовидной железы. Патология встречается при циррозе печени и врожденных пороках сердца.
- Механические травмы. Появление многих приобретенных дефектов связывают с механическим повреждением вены и артерии, расположенных рядом и плотно прилегающих друг к другу. Так обычно происходит при колющих, огнестрельных, реже - тупых ранениях, переломах основания черепа и длинных трубчатых костей со смещением отломков.
- Инвазивные вмешательства. Вероятность появления патологических соустий увеличивается при катетеризации сосудов (трансфеморальной аорто- и коронарографии, чрескожной чреспеченочной холангиографии), биопсии паренхиматозных органов (печени, почек). С подобной проблемой сталкиваются после эндопротезирования коленных суставов, операций на межпозвонковых дисках, нефростомии.
- Хирургические манипуляции. Искусственно созданное соустье между артериальным руслом и венозной системой необходимо при терминальной почечной недостаточности для облегчения процедуры гемодиализа. По сравнению с остальными видами сосудистого доступа, артифициальное соединение имеет более высокую долгосрочную проходимость с хорошей скоростью потока и низким риском осложнений.
В этиопатогенезе фистульных аномалий немаловажная роль отводится эрозиям и спонтанным разрывам артериальных аневризм в близлежащие вены. Значимыми и независимыми факторами риска патологических соустий являются прием антикоагулянтов (гепарина, варфарина), артериальная гипертензия, женский пол.
Патогенез
Точный патогенез артериовенозных мальформаций первичного характера неизвестен. В концевых артериальных петлях может возникнуть аномалия, приводящая к расширению тонкостенных капиллярных мешочков. По иным предположениям, дисплазии становятся результатом неполной резорбции сосудистых перегородок, разделяющих артериальное и венозное сплетение во внутриутробном периоде развития плода. Предполагается, что небольшие фистулы возникают при нарушении формирования капилляров.
Травматическим шунтам предшествует образование аневризмы и гематомы. Сращение сосудов происходит по типу заживления раны первичным натяжением. Кровь, вылившаяся в окружающие ткани и частично рассосавшаяся, организуется с формированием трубчатого хода, сообщающего артерию с веной. Стенки патологического шунта укрепляют гладкомышечные, соединительнотканные элементы и эндотелий, проникающие со стороны поврежденных ветвей. Постоянный кровоток через свищевой ход предотвращает его заращение.
Шунтирование крови по патологическим соустьям провоцирует обкрадывание тканей, расположенных дистальнее. При изменении давления и характеристик кровотока по обе стороны дефекта возникают турбулентные потоки, создающие условия для дальнейшего повреждения сосудистой стенки и дегенеративных процессов. В периферических тканях наблюдаются явления артериальной ишемии и венозной гипертензии, компенсаторно развивается сеть коллатералей. Крупные свищи провоцируют увеличение объема циркулирующей крови, нарушение сердечной деятельности, венозную недостаточность.
Классификация
Артериовенозные фистулы входят в структуру сосудистых мальформаций. На изолированную форму (прямое соединение) приходится 11% случаев, а смешанный шунт (с наличием клубка измененных ветвей) характерен для 53% пациентов. В клинической ангиологии такие соустья классифицируются на основании следующих критериев:
- По происхождению. Первичные фистулы имеют врожденный характер, вторичные являются приобретенными. Последние разделяются на травматические, ятрогенные и спонтанные. Врожденные всегда возникают изолированно, без связи с другими факторами. Травматические фистулы на верхних и нижних конечностях встречаются одинаково часто (20%), доля внутригрудных и внутрибрюшных составляет около 4%.
- По локализации. Исходя из расположения, различают центральные (церебральные, спинальные) и периферические шунты (легочные, коронарные, почечные, печеночные, подкожные). В зоне головы и шеи встречаются экстрацеребральные (дуральные, каротидно-кавернозные соустья), интрацеребральные (пиальные), экстракраниальные (магистральных сосудов шеи), эктра-интракраниальные (артерио-югулярные) образования.
- По распространенности. Аномальные соединения между артериями и венами бывают ограниченными и диффузными, единичными и множественными. Распространенные формы имеют четкую генетическую обусловленность и могут входить в клиническую структуру синдромов Кобба, Клиппеля-Треноне, Паркса-Вебера.
- По размеру. Градация артериовенозных фистул по величине дефекта является одним из определяющих критериев, влияющих на выбор лечебной тактики. Учитывая диаметр вены, выделяют несколько разновидностей аномальных соустий: малые (от 1 до 3 мм), средние (3–6 мм), крупные (более 6 мм).
Существует ангиографическая классификация фистул, применимая к подкожным образованиям, расположенным в области туловища и конечностей. Рассматривая морфологию шунта, выделяют три типа поражения: I – артериовенозный, II - артериоловенозный, III – артериоловенулярный.
Симптомы артериовенозной фистулы
Характер симптоматики определяется локализацией шунтов и их размерами. Небольшие образования на конечностях, в легких, почках и головном мозге обычно протекают бессимптомно и бывают случайной диагностической находкой. Врожденная патология проявляется еще в раннем детстве или в более старшем возрасте. Клиническая картина посттравматических свищей развивается сразу после повреждения либо спустя несколько недель, месяцев.
Подкожный сосудистый свищ заметен по расширению вены, пальпаторной и визуальной пульсации, локальной отечности. Врожденные процессы зачастую сопровождаются изменением кожной окраски на красно-багровую. Над фистульным образованием локальная температура повышена, в дистальных отделах наблюдаются признаки ишемии: похолодание, бледность, сухость кожи. При аускультации над пульсирующей аномалией выслушивается систолический и диастолический шум. Если сильно прижать образование пальцем, то происходит замедление частоты сердечных сокращений (феномен Бранхама-Николадони).
Значительный сброс крови из артериального в венозное русло при больших свищах ведет к возникновению признаков гиперкинетического кровотока: тахикардии, увеличения систолического и пульсового давления, снижения толерантности к физическим нагрузкам. Каротидно-кавернозные свищи могут проявляться пульсирующим экзофтальмом, односторонним покраснением склеры и конъюнктивы, двоением в глазах, снижением остроты зрения, шумом в ушах. Церебральные мальформации провоцируют развитие судорожного синдрома, головных болей, явлений неврологического дефицита (речевых нарушений, мышечной слабости, координаторных и чувствительных расстройств, снижения памяти и внимания).
Начальные симптомы спинальных образований неспецифичны, включают трудности при подъеме по лестнице, нарушение походки, сегментарные сенсорные расстройства (парестезии, гипо-, анестезию), корешковые боли в конечностях. Неврологические симптомы постепенно прогрессируют и имеют восходящий характер. На поздних стадиях наблюдаются нарушения мочеиспускания, дефекации, эрекции. Иногда заболевание имеет острое начало и прогрессирующие развитие с промежуточными ремиссиями.
Осложнения
Длительно существующие сосудистые шунты сопровождаются повышением давления в отводящих венах, что провоцирует их варикозное расширение с тромбозом и трофическими нарушениями. Сброс большого объема крови мимо капилляров приводит к перегрузке сердца, кардиомегалии, развитию хронической циркуляторной недостаточности и эндокардита. Серьезные последствия фистул связаны с их разрывом и возникающим внутренним кровотечением.
Очаг в веществе головного мозга осложняется геморрагическим инсультом с развитием стойкого неврологических расстройств и инвалидизацией пациента. Почечные аномалии сопровождаются внутрибрюшным и забрюшинным кровотечением, а разрыв магистральных стволов может иметь самые неблагоприятные последствия, вплоть до летального исхода.
Диагностика
Распознавание врожденных и приобретенных артериовенозных свищей в большинстве случаев осуществляется средствами инструментальной диагностики. Клиническими методами можно выявить лишь периферическую аномалию (на туловище, конечностях) или по совокупности симптомов заподозрить ее присутствие в каком-либо органе. Точную визуализацию сосудистого образования обеспечивают следующие диагностические процедуры:
Диагностическая программа составляется сосудистым хирургом или более узкими специалистами. В дополнение к описанным исследованиям, назначают КТ или МРТ головы, позвоночника, внутренних органов. Учитывая локализацию патологии, может потребоваться консультация нейрохирурга, пульмонолога, уролога и других врачей. К общей патологии, с которой следует дифференцировать артериовенозную фистулу, относят схожие мальформации (капиллярные, плексиформные), сосудистые аневризмы, гемангиомы, варикозную болезнь.
Лечение артериовенозной фистулы
Целью лечения является закрытие патологического соустья с сохранением проходимости основных сосудов. В основу положен принцип изоляции и разрушения аномальной связи артериального русла с венозным. Выбор оптимальной тактики проводится с учетом локализации, размера и типа соустья, динамики кровотока, особенностей дистальных участков. На практике применяют несколько способов коррекции дефекта:
Аномальные шунты небольших размеров, не являющиеся гемодинамически значимыми, подлежат наблюдению. Являясь косметическим дефектом, они могут удаляться лазерной коагуляцией. Крупные подкожные свищи требуют открытого хирургического доступа с реконструкцией сосудов. При доброкачественных фистулах назначают консервативную терапию (компрессионный трикотаж, нестероидные противовоспалительные средства, ангиопротекторы). Есть данные об успешном медикаментозном лечении врожденных артериовенозных дисплазий ингибиторами металлопротеиназ и некоторыми иммунодепрессантами.
Прогноз и профилактика
Известны случаи спонтанного регресса первичных артериовенозных фистул. При длительно сохраняющихся шунтах риск разрыва и сердечной декомпенсации делает прогноз неблагоприятным. Но после радикальной коррекции удается полностью избавиться от сосудистого дефекта, нормализовав гемодинамику и восстановив функцию пораженной области. Меры профилактики приобретенных соустий включают предупреждение травматизма, соблюдение техники выполнения инвазивных вмешательств, своевременное лечение хронических заболеваний. Риск врожденных мальформаций можно снизить при исключении негативного влияния на плод в период беременности.
1. Современные концепции лечения артериовенозных ангиодисплазий (мальформаций). Согласительный документ/ Покровский А.В. и др.// Ангиология и сосудистая хирургия - 2015 - №29.
2. Клинические рекомендации по диагностике и лечению артериовенозных мальформаций центральной нервной системы/ Парфенов В.Е., Свистов Д.В., Элиава Ш.Ш., Яковлев С.Б., Тиссен Т.П., Иванов А.Ю.,Иванов П.И. - 2014.
3. Рентгенэндоваскулярные методы диагностики и лечения цереброваскулярной патологии: Автореферат диссертации/ Боломатов Н.В. - 2014.
4. Артериовенозные фистулы головы и шеи. Клиника, ангиоархитектоника, эндоваскулярное лечение: Автореферат диссертации/ Яковлев С.Б. - 2008.
Порок чаще встречается в изолированном виде, в более редких случаях сочетается с другими врожденными пороками сердца (дефект межжелудочковой перегородки, вторичный дефект межпредсердной перегородки, перерыв дуги аорты, коарктация аорты, стеноз легочной артерии и др.).

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Типы дефекта аортолегочной перегородки (Meisner и соавторы):
1. Дефект находится на 10-20 мм выше полулунных клапанов легочной артерии, ветви которой располагаются нормально, дистальнее дефекта (наиболее частый вариант).
2. Дефект очень большой и доходит до дуги аорты, ветви легочной артерии отходят от вершины дефекта.
3. Дефект средних размеров, оба сосуда разделены ближе к бифуркации легочной артерии.
4. Аортолегочная перегородка отсутствует, ветви легочной артерии отходят от задней стенки общего сосуда (встречается очень редко).
Этиология и патогенез
Эпидемиология
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
- наличие детей с врожденными пороками сердца (ВПС);
- наличие ВПС у отца или ближайших родственников;
- наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
одышка по типу тахипноэ, отставание в физическом развитии, частые респираторные заболевания, сердечная недостаточность
Cимптомы, течение
Диагностика
2. Рентгенологическая картина достаточно характерна. Сердце, как правило, имеет большие размеры в результате увеличения обоих желудочков и гипертрофии левого предсердия. Расширена сосудистая тень, образованная аортой и значительно расширенной легочной артерией.
В начальном периоде заболевания легочный рисунок усилен. В дальнейшем, по мере развития легочной гипертензии, он меняется.
При резко выраженной легочной гипертензии отмечается характерная ствол и его магистральные ветви резко расширены, а по периферии легочных полей виден прозрачный легочный рисунок (легочный рисунок обеднен).
5. Ангиография. Хорошо выполненная аортография позволяет установить расположение дефекта, его размеры. В случае недостаточности аортального клапана наблюдается регургитация Регургитация - перемещение содержимого полого органа в направлении, противоположном физиологическому в результате сокращения его мышц.
контрастированной крови в левый желудочек.
6. Фонокардиография: регистрируется систолический шум различной интенсивности с пиком в первой половине или в середине систолы, иногда ему сопутствует диастолический шум с максимумом во II-III межреберье.
При значительном лево-правом сбросе на верхушке определяется мезодиастолический шум (относительный стеноз митрального клапана). II тон над легочной артерией усилен, слабо расщеплен или единый (при высокой легочной гипертензии).
При дефекте аортолегочной перегородки наблюдается расщепление II тона, в отличие от общего артериального ствола, при котором II тон всегда единый.
Лабораторная диагностика
Лабораторные исследования проводятся в предоперационном периоде с анализом газового и электролитного составов крови. Если ребенок длительно получал диуретики и сердечные гликозиды, необходимо исключить гипокалиемию.
Дифференциальный диагноз
Осуществляется дифференциальная диагностика дефекта аортолегочной перегородки с дефектом межжелудочковой перегородки, открытым артериальным протоком, общим артериальным стволом.
Лечение
Медицинская коррекция дефекта аортолегочной перегородки осуществляется в течение нескольких дней или недель, чтобы позволить избирательно запланировать метод хирургического вмешательства.
Хирургическая операция необходима для предотвращения развития легочной сосудистой обструктивной болезни, поскольку аортолегочное окно не закрывается спонтанно. Для обеспечения симптоматической пользы, перед хирургической коррекцией обычно назначаются дигоксин и мочегонные средства.
Прогноз
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
- своевременное выявление порока;
- обеспечение надлежащего ухода за ребенком с ВПС;
- определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Профилактика осложнений ВПС определяется характером осложнений.
Грозным осложнением ВПС является инфекционный эндокардит Инфекционный эндокардит - это инфекционное полипозно-язвенное воспаление эндокарда, сопровождающееся образованием вегетаций на клапанах или подклапанных структурах, их деструкцией, нарушением функции и формированием недостаточности клапана
Подробно , который может осложнить любой вид порока и может появиться уже в дошкольном возрасте.
Рекомендуется ограничить назначение антибиотикопрофилактики инфекционного эндокардита группам пациентов с наибольшей вероятностью развития инфекционного эндокардита:
1. Пациенты после протезирования клапана сердца.
2. Инфекционный эндoкардит в анамнезе.
3. Пациенты со следующими врожденными пороками:
- "синие" пороки, без предшествующей хирургической коррекции или с остаточными дефектами, паллиативными шунтами или кондуитами;
- пороки после хирургической коррекции с применением искусственных материалов до 6 месяцев (до тех пор, пока не произошла эндотелизация);
- если после операции на сердце или чрескожной коррекции есть остаточный дефект в месте имплантации искусственного материала или устройства.
Читайте также:

