Заражение крови при микозах
Обновлено: 22.04.2024
Сепсис является серьезной растущей проблемой здравоохранения и представляет собой тяжелое инфекционное заболевание человека, развивающееся как системная воспалительная реакция при попадании в кровь инфекционных агентов. Согласно экспертной оценке, сепсис случается чаще, чем сердечные и онкологические заболевания, каждую минуту в мире от септической инфекции погибают 14 человек, ежегодная летальность в связи с сепсисом больше, чем от рака простаты, молочной железы и ВИЧ вместе взятых.
22 мая с.г. в рамках XVI Международного конгресса по антимикробной терапии состоялась пресс–встреча, посвященная вопросам диагностики и терапии септических состояний. Модератором ее был Роман Сергеевич Козлов, д.м.н., проф., директор НИИ антимикробной химиотерапии ГБОУ ВПО «Смоленская государственная медицинская академия» Министерства здравоохранения Российской Федерации.
В своем выступлении заведующий отделением реанимации и анестезиологии ожогового центра Института хирургии им. А.В. Вишневского, эксперт Российского сепсис–форума, к.м.н. Владимир Витальевич Кулабухов отметил:
— Известно, что сепсис занимает одно из первых мест среди причин смертности во всем мире. Сепсис уносит жизнь в основном молодого населения. А чем старше пациент, тем выше риск умереть от этой болезни. Проблема, которой активно занимается весь мир, в нашей стране, к сожалению, не имеет должного понимания со стороны как населения, так и органов власти.
Когда мы говорим о диагностике сепсиса, то отмечаем, что есть много разных вариантов диагностики. Один из них — микробиологическая диагностика. Ее задачи:
- идентифицировать микроорганизмы в исследуемом материале;
- определить их видовую принадлежность, морфологические, биохимические, токсигенные и антигенные свойства;
- установить чувствительность выделенных микроорганизмов к антимикробным препаратам, чтобы начать правильную и своевременную терапию.
Для получения качественных результатов исследования, что очень важно для выживания пациента, необходимо наличие квалифицированного персонала, владеющего тонкостями современного оборудования; качественный расходный материал; уменьшение времени анализа; совместное обсуждение результатов; локальный мониторинг и прогнозирование резистентности.
Одним из важных методов является определение наличия микроорганизмов в крови, или бактериемии — присутствия инфектанта в системном кровотоке как одного из возможных, но не обязательных признаков сепсиса. Отсутствие бактериемии не должно влиять на постановку диагноза «сепсис» при наличии других признаков. Даже при соблюдении техники забора крови частота положительных результатов составляет около 45%.
Существует целая линейка способов, средств и методов для определения наличия этих микроорганизмов в крови, что является не обязательным подтверждением сепсиса, но крайне необходимым для разумного назначения антибактериальной терапии.
Есть прямая связь между задержкой введения антибиотика и летальностью пациента. Если не ввести антибиотик пациенту с тяжелой формой септического шока, через сутки он умрет. Каждый час задержки введения лекарства увеличивает летальность примерно на 8% — настолько важна правильная, четкая и ранняя диагностика и соответственно введение препаратов! Если скоррегировать антибиотик и ввести правильный чуть позже, ситуация не сильно изменится. Первый час крайне важен!
Что касается гемокультуры, то очень актуально, как выстроен этот процесс. Повторю, оборудование должно быть качественным и доступным во всех стационарах, потому что простое применение анализаторов или перемещение их в реанимацию, а не в лабораторию, уменьшает сроки получения результата примерно на сутки и в целом улучшает ситуацию.
Современные клинические и практические рекомендации от 2012 г. показывают, что забор крови нужно проводить до назначения антибиотиков (если это не задерживает введение антибиотиков). По истечении часа врач должен взять кровь и ввести антибиотик. В 30 регионах работают сепсис–школы, в них были опрошены 1500 врачей, из них 1200 — реаниматологи. На основании обработанных данных можно сказать, что в России происходит следующее: в течение первого часа только 17% врачей реально берут кровь на посев, а в основном — в течение трех часов и более. Результаты микробиологических исследований с определением чувствительности врачи обычно получают на 4–7–е сутки. Хотя есть технологии, позволяющие сделать это в течение суток. Печально, что всего 30% лабораторий выдают результат с количественными данными, с так называемыми минимальными подавляющими концентрациями, что абсолютно необходимо сейчас для выбора правильной, соответствующей терапии.
Упор надо делать не только на правильный, качественный препарат, не только на адекватное финансирование здравоохранения, но и на правильное распределение этого финансирования, прежде всего, на строительство современных лабораторий. Эти деньги сэкономят средства в целом, а главное — жизни. Ранняя диагностика — один из путей, который может нам помочь в нашей деятельности.
Еще одна беда, появившаяся относительно недавно, но нарастающая — это грибковые инфекции, занимающие третье место среди причин сепсиса. Около 50% лабораторий определяют грибы не по видам, а по факту наличия. Таковы сегодняшние реалии в России.
Мои потребности как клинициста в том, чтобы была возможность получать качественные результаты, а для этого необходимо сдвинуть психологию, сознание и, следовательно, финансирование в сторону диагностики. Мы понимаем, что отсутствие принципиально новых антибиотиков в ближайшие годы, в условиях нарастающей резистентности (устойчивости) к антибиотикам, оставит нам очень небогатый выбор для наших действий.
Владимир Александрович Руднов, д.м.н., проф., зав. кафедрой анестезиологии и реаниматологии Уральской государственной медицинской академии, эксперт Российского сепсис–форума, продолжил тему:
— Два года назад произошло событие, придавшее новый ракурс проблеме сепсиса. По инициативе известного немецкого профессора Конрада Рейхарта было предложено проведение сепсис–дня. Старт был дан в сентябре 2012 г. Масштаб проблемы и ее последствия требуют придания некого нового социального резонанса. Проведение этого сепсис–дня несет знания о сепсисе населению. С помощью деятельности масс–медиа, импровизированных демонстраций и шествий выяснено, что число пациентов с сепсисом увеличивается каждый год на 13%. Каждый год погибает от сепсиса больше 10 тыс. человек в мире. Плюс 10 тыс. человек — каждый последующий год. Совершенно очевидно, что те затраты, которые несет Минздрав, во многом связаны с затратами на диагностику и лечение сепсиса. Тем не менее мы видим, что эти затраты не совсем адекватны проблеме.
В США только от одной из клинических форм сепсиса умирает примерно столько же, сколько от СПИДа, рака предстательной и молочной желез вместе взятых.
Стало очевидно, что сепсисом болеют все — и животные, и растения, и земноводные, и насекомые, и млекопитающие, к которым относится человек… Микроорганизмы раньше пришли на планету, и всем новым формам жизни всегда приходилось взаимодействовать с ними.
Для меня как клинициста, понятно, что это огромная глобальная проблема, от которой невозможно избавиться, просто посыпав дустом микробы. Она требует интеграции самых разных специалистов, начиная с представителей фундаментальных наук до практиков—клиницистов.
Исследования самого последнего времени показали, что в плане терапии сепсиса есть некий комплекс методов, объединяющий несложные рекомендации. Оно показало, что мир пришел к улучшению результатов лечения сепсиса.
Существует проблема с постдипломным образованием во всех специальностях здравоохранения. Каждые пять лет врач должен проходить усовершенствования. Знания меняются стремительно. Институт, возглавляемый Р.С. Козловым, проводит в год по три заседания МАКМАХ (общественная некоммерческая организация, занимающаяся исследовательской и образовательной деятельностью в области клинической микробиологии и антимикробной химиотерапии. — Прим. ред.), а также различные семинары, школы в крупных городах страны, обсуждая современные клинические рекомендации и ведя диалог с врачами. Создан центр лабораторной диагностики, где есть различные машины, например, микробиологические анализаторы, и департамент здравоохранения оплачивает из своего бюджета эти исследования. Получается, что все реанимационные отделения могут заказывать для себя бесплатно. Подчеркну также, что надо вкладываться в диагностику и обучение специалистов. Мало накупить железа, надо еще научиться на нем работать.
Р.С. Козлов подчеркнул, что все медицинские проблемы необходимо решать, плотно взаимодействуя с зарубежными коллегами, особенно с теми, кто имеет положительные наработки в проблеме сепсиса. На встрече с докладом «Практические сложности в диагностике сепсиса» выступил директор по научным вопросам, Becton Dickinson Diagnostics профессор Патрик Мюррей:
— Сепсис является частью прогрессирующего заболевания, которое начинается с системной воспалительной реакции в ответ на инфекцию. Диагноз основывается на клинических параметрах:
Синдром системной воспалительной реакции (ССВР):
- лихорадка (> 38 °C) или гипотермия ( < 36 °C);
- увеличение частоты сердечных сокращений (> 90 уд/мин);
- увеличение частоты дыхания (> 20 уд/мин);
- увеличение (> 12 000) или снижение ( < 4000) количества лейкоцитов.
Сепсис = Инфекция + ССВР.
Тяжелый сепсис = Сепсис + дисфункция органов. Септический шок = Тяжелый сепсис + острое нарушение кровообращения.
Распространенность сепсиса велика. В мире около 27 млн случаев сепсиса в год. 8 млн умерших в год — 1 смерть каждые 4 сек. В США 816 000 пациентов были госпитализированы с сепсисом в 2010 г. Количество госпитализаций пациентов с сепсисом увеличилось в 2 раза в период с 2000 по 2010 г., в то время как общее число госпитализаций осталось прежним.
Септицемия — одна из самых дорогих причин госпитализации — в сумме расходы составляют 15,4 млрд долл. Уровень смертности пациентов, госпитализированных с сепсисом, в 8 раз выше, чем пациентов с другими патологиями.
Микроорганизм, вызывающий сепсис, выявляется с помощью гемокультивирования. Больше чем у половины пациентов с диагнозом септицемии возбудитель не был идентифицирован до выписки из больницы. К моменту подтверждения диагноза сепсиса пациент уже получает эмпирическую терапию антибиотиками. Если диагноз не подтвержден результатами гемокультивирования, пациент продолжает получать эмпирическую терапию. Неэффективная эмпирическая терапия значительно повышает уровень смертности.
Говоря об эмпирической терапии сепсиса, вызванного грамотрицательными бактериями, следует отметить, что было проведено рестроспективное исследование 760 пациентов с тяжелым сепсисом или септическим шоком. 68,7% случаев — это адекватная эмпирическая антибиотикотерапия. Средняя продолжительность нахождения в стационаре — 9 дней. Летальность — 36%.
31,3% случаев — это неадекватная эмпирическая антибиотикотерапия. Средняя продолжительность нахождения в стационаре 11 дней. Летальность — 52%.
Неэффективная терапия повышает риск заболеваемости и смертности, а также увеличивает затраты на лечение. Использование без необходимости антибиотиков широкого спектра действия приводит к развитию антибиотикорезистенстности микроорганизмов и нарушает нормальное функционирование микробиома человека.
Точный тест для диагностики сепсиса — гемокультивирование. Положительный результат гемокультивирования адекватен переходу от эмпирической терапии к направленной, что влечет за собой повышение качества лечения пациента и сокращение расходов ЛПУ.
Передовой опыт гемокультивирования выявляет, что у большинства пациентов с сепсисом результат гемокультивирования является ложно–отрицательным. В большинстве случаев к этому приводят два фактора — неадекватный объем крови, взятой для гемокультивирования, и снижение роста бактерий и грибов, подавляемого принимаемыми антибиотиками.
Рекомендации CLSI, ASM Cumitech, Общества инфекционных болезней, Общества неотложной медицины следующие:
- всегда набирайте кровь в два флакона на одну гемокультуру;
- никогда не набирайте только один комплект флаконов.
Поскольку большинство пациентов уже получают антибиотики в тот момент, когда у них берут кровь, то наиболее эффективный способ для высевания бактерий и грибов в этом случае — использовать среды с сорбентом для инактивации антибиотиков.
Рекомендации по оптимальному использованию гемокультивирования таковы. Гемокультивирование — самый важный тест из тех, что проводятся в микробиологической лаборатории и единственный тест для точной диагностики сепсиса и сопутствующих синдромов. Когда проводится исследование, процедура должна быть выполнена правильно:
- взять 20 мл крови на гемокультуру у взрослых пациентов и соответственно меньший объем у детей;
- использовать аэробный и анаэробный флакон для каждой гемокультуры;
- получить 2–3 гемокультуры в течение 24 час;
- использовать среды с сорбентом.
- наша цель как профессионалов в сфере здравоохранения — обеспечивать оптимальные результаты лечения пациентов;
- быстрая и точная диагностика сепсиса может напрямую влиять на результаты лечения пациентов, снижая заболеваемость и смертность;
- соблюдение основных рекомендаций по гемокультивированию, таких как взятие правильного объема крови и использование правильных сред, приведет нас к успеху;
- микробиологи, клиницисты и общество должны настаивать на том, чтобы максимальные усилия были приложены для снижения влияния сепсиса на здоровье населения.
Участники встречи подняли вопрос о необходимости создания рабочей группы по разработке современных российских рекомендаций диагностики сепсиса в соответствии с международными стандартами — CLSI и German Sepsis Society. Было подчеркнуто также, что бесконтрольная продажа антибиотиков в аптеках пагубна. Выписка рецептов на эти лекарства — абсолютно эксклюзивная прерогатива терапевта.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
Первичный гнойно-воспалительный очаг может возникать прямо у места входных ворот или во внутренних органах. В норме иммунные клетки организма быстро очищают кровь от чужеродных агентов. Но при ослабленном иммунитете инфекционный процесс распространяется и генерализуется, формируются вторичные септические очаги. Бактерии, «путешествуя» по крово- и лимфотоку, активно производят токсины, что приводит к интоксикации и может стать причиной инфекционно-токсического (септического) шока.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Диагностика сепсиса
Для постановки диагноза «сепсис» необходимо наличие установленного или предполагаемого очага инфекционного процесса и два или более признака синдрома системной воспалительной реакции.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Онихомикоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Онихомикоз – это грибковое поражение ногтя, при котором наблюдается изменение его цвета, толщины и отделение от ногтевого ложа. Онихомикоз - часто встречающееся заболевание ногтевого аппарата (не менее 50% всех заболеваний ногтей), которым болеет около 5,5% людей во всем мире. Взрослые болеют чаще, чем дети, поскольку распространенность онихомикозов увеличивается с возрастом (поражение ногтевых пластинок грибком встречается почти у 50% лиц старше 70 лет).
Причины возникновения онихомикоза
Онихомикоз могут вызывать грибы-дерматофиты, дрожжевые грибы и плесневые грибы-недерматофиты.
Дерматофиты становятся причиной заболевания в 60-70% случаев, при этом до 50% приходится на Тrichophyton rubrum. Плесневые грибы-недерматофиты вызывают около 20% всех онихомикозов, а дрожжевые грибы, в том числе Candida spp., - 10-20%.
Достаточно часто обнаруживается ассоциированное поражение грибами и бактериями, а также одновременное инфицирование ногтевой пластинки двумя и более грибами.
Развитию онихомикоза способствуют травмы опорно-двигательного аппарата, нарушение кровоснабжения конечностей (например, вследствие сердечной недостаточности, облитерирующего эндартериита или варикозного расширения вен), сахарный диабет, ожирение, плоскостопие, деформация стоп, курение, псориаз, иммунодефициты. К другим предрасполагающим факторам относят ношение тесной обуви, повышенную потливость, травмы ногтей. Высокий риск приобрести грибок есть у тех, кто участвует в спортивных мероприятиях, посещает общественные бани и бассейны, проживает с родственниками, у которых диагностирован грибок, или у тех, кто уже болел онихомикозом ранее.
Ногти на ногах поражаются чаще, чем на руках, что, вероятно, связано с их более медленным ростом, худшим кровоснабжением и с тем, что ношение тесной обуви создает среду, благоприятную для размножения грибка.
Заражение патогенными грибками может происходить при непосредственном контакте с больным онихомикозом, а также через обувь, одежду, предметы обихода (коврики в ванной, мочалки, маникюрные принадлежности и др.). В условиях повышенной влажности (в бассейнах, банях, душевых) грибы длительное время сохраняются и размножаются, особенно на неокрашенных деревянных поверхностях.
При заражении возбудитель проникает в ногтевую пластинку, ложе, матрикс и проксимальный валик ногтя. Ноготь не обладает эффективным клеточным иммунитетом, поэтому очень восприимчив к инфекции. Грибы производят ферменты, разрушающие ногтевую пластину, что облегчает их проникновение вглубь.
Частые очаги онихомикоза - подошвы и межпальцевые промежутки. Обычно грибы поражают ногтевую пластинку, начиная со свободного края, таким образом основные патологические процессы протекают не в самой пластинке, а под ней - в ложе ногтя.
Классификация онихомикоза
Различают нормотрофический, гипертрофический и онихолитический (атрофический) онихомикоз.
При нормотрофической форме пораженный ноготь сохраняет свою толщину и блеск, но меняет цвет.
При гипертрофической форме помимо изменения цвета наблюдается нарастающий подногтевой гиперкератоз. Ноготь теряет блеск, становится тусклым, утолщается и деформируется вплоть до образования онихогрифоза (утолщения и искривления ногтя наподобие когтя мифической птицы грифона), частично разрушается, особенно с боков, нередко пациенты испытывают боль при ходьбе.
Для онихолитической формы характерна тусклая буровато-серая окраска пораженной части ногтя, ее атрофия и отторжение от ложа - обнаженный участок покрыт рыхлыми гиперкератотическими наслоениями; в то же время проксимальная часть ногтя долго остается без существенных изменений.
Кроме того, применяют классификацию, основанную на локализации поражения ногтя: выделяют дистальный онихомикоз (с поражением ногтя у свободного края), латеральный (с поражением боковых сторон), проксимальный (с поражением заднего валика) и тотальный (с поражением всего ногтя).
Симптомы онихомикоза
Основное проявление онихомикоза – изменение цвета ногтевой пластинки: она белеет или становится желто-коричневой, может приобретать фиолетовый, зеленоватый или черный цвет. К другим клиническим проявлениям относят утолщение и зуд кожи в области ногтевых валиков (подногтевой гиперкератоз), отслоение ногтя от ногтевого ложа (онихолизис) и утолщение ногтевой пластинки (онихауксис). Для грибкового поражения ногтя характерен такой признак как дерматофитома - продольная полоса желтовато-белого или коричневатого цвета, локализующаяся в глубине ногтевой пластинки.
Ногти пальцев ног поражаются в 7-10 раз чаще, чем рук, причем чаще всего поражаются большие пальцы. Как правило, грибок одновременно присутствует на нескольких ногтях, нередко у больных онихомикозом выявляется также микоз стоп.
Диагностика онихомикоза
Диагностика онихомикоза основывается на данных клинической картины и результатах лабораторных исследований.
-
Проведение микроскопического исследования пораженных ногтевых пластинок.
Исследование используется в диагностике грибковых заболеваний кожи и ногтей. Особенности инфекции. Грибковые заболевания (микозы) кожи и ногтей – заразные заболевания, передающиеся от человека к человеку. Передача инфекции может произойти при непосредственном контакте с активным о.

Инфекционное заболевание сепсис является очень опасным для человека. В прошлом оно заканчивалось летальным исходом в 80% случаев. Сегодня благодаря достижениям современной медицины этот показатель уменьшился, но продолжает оставаться достаточно высоким и составляет 30-40%.
Что представляет собой сепсис
Что такое сепсис простыми словами? Сепсис («гниение» в переводе с греч.) – это общее инфекционное заражение организма, распространение инфекции при котором происходит кровотоком. Заболевание поражает не отдельный орган, а весь организм.
Часто сепсис становится продолжением развития различных местных воспалений, например, фурункула, флегмоны, абсцесса, менингита, вызываемого менингококковой инфекцией, которая также может привести к развитию менингококкового сепсиса.
Пациенты, больные сепсисом, как правило, имеют иммунитет, ослабленный первичным воспалительным процессом. Именно на фоне сниженных защитных функций организма повышается риск развития сепсиса, как вторичного воспалительного процесса.
Классификация
Классификация сепсиса проводится по нескольким критериям:
По темпам развития:
- молниеносный – стремительное развитие с возможностью летального исхода в течение 1-2 суток;
- острый – продолжительность развития до 4 недель;
- подострый – продолжительность развития инфекции сепсиса 3-4 месяца;
- рецидивирующий – характерно чередование обострений и затуханий заболевания, продолжительность до полугода;
- хронический – продолжительность более года.
Формы сепсиса у взрослых вторичного типа по зоне локализации первичного очага:
- тонзиллогенный – развивается на фоне ангин, которые были вызваны стафилококками и стрептококками;
- акушерско-гинекологический – риск развития на фоне осложнений после аборта или родов;
- хирургический сепсис – занесение инфекции в кровь из послеоперационной раны;
- плевро-легочный – первичным очагом являются гнойные заболевания легких;
- уросепсис – очагами становятся органы мочеиспускательной системы;
- одонтогенный – связан с заболеваниями, развивающимися в зубочелюстной системе;
- кожный – гнойные заболевания кожи, а также глубокие повреждения кожных покровов (ожоги, инфицированные раны и т.д.);
- отогенный – развивается на фоне заболеваний уха (гнойный средний отит, например);
- риногенный – развивается на фоне распространения инфекций в организме из носовой полости;
- перитонеальный – локализация первичных очагов в органах брюшной полости.
Отдельно следует выделить неонатальный сепсис – системное инфекционное заболевание у новорожденных первых 28 дней жизни. Источником становится образование гнойного процесса в тканях и сосудах пуповины.
Симптомы и признаки сепсиса
Признаки и симптомы сепсиса у взрослых могут быть достаточно обширными и разнообразными. К общим признакам сепсиса относятся:
- повышенная температура тела;
- появление сильного озноба;
- образование местных гнойников;
- обильное потоотделение;
- бледность кожи и усталый, отрешенный вид;
- психоэмоциональные изменения – состояние эйфории или наоборот полная апатия и пассивность;
- гиперемированность лица.
При сепсисе можно наблюдать петехиальные кровоизлияния, которые образовываются на поверхности голеней и предплечий и имеют вид пятен или полос.
По симптомам сепсиса специалисты различают следующие формы:
- синдром системной воспалительной реакции;
- сепсис;
- тяжелый сепсис;
- септический шок.
Причины развития сепсиса
Главное условие развития гнойного сепсиса – попадание в организм пациента возбудителей инфекции (вирусов, грибков, бактерий). Иммунная система начинает активную борьбу с возбудителями, следствием чего и становится воспалительный процесс в организме – происходит массовое инфицирование гнилостными продуктами, образовавшимися в результате разрушения патогенных микроорганизмов. Ослабление иммунной системы приводит к тому, что она не справляется с задачей своевременной локализации патогенных организмов. Они попадают в кровотоки, в результате чего сепсис в крови разносится по всему организму, поражая все органы и системы.
Причины развития сепсиса кроются в создании в организме пациента ряда благоприятных условий:
- появление первичного источника инфекции;
- распространение патогенных возбудителей с потоками крови по всему организму;
- формирование вторичных очагов, которые также становятся источниками распространения инфекции по всему организму;
- развитие воспалительного процесса, как ответ иммунной системы на проникновении инфекции;
- ослабление иммунной системы и, как следствие, её неспособность локализовать инфекцию.
Факторы риска
Дополнительно факторами, которые увеличивают риск развития сепсиса, являются:
- расстройства и нарушения функционирования иммунной системы;
- неправильный подбор при лечении инфекций антибактериальных препаратов;
- несоблюдение правил асептики и антисептики при проведении оперативных вмешательств и при обработке гнойных ран.
Осложнения
Осложнения сепсиса могут быть очень серьезными.
- Септический шок – происходит нарушение функционирования всех органов и систем, нарушается кровоток и обмен веществ. Особая группа риска среди пациентов – люди с ослабленным иммунитетом и пожилые лица. Статистика летального исхода при данном осложнении достигает 50%.
- Тромбофлебит – происходит воспаление венозных стенок, которое сопровождается образованием тромбов. Пациент может испытывать при этом болевые ощущения в зонах поражения вен, на кожных покровах отмечается покраснение и появляется отек конечностей.
- Тромбоэмболия легочной артерии – в большинстве случаев развивается в качестве осложнения на фоне тромбофлебита. Происходит отрыв части тромба и попадание его по токам к крови сначала в сердце, а далее в легочные сосуды. Достигнув мелкого сосуда, тромб способен перекрыть его. Симптоматика может выражаться одышкой, посинением кончиков пальцев, губ и носа, появлением сильной боли в грудной клетке и за грудиной, снижением артериального давления, потерей сознания, обмороками и даже впадением в кому.
- Тромбоэмболия сосудов головного мозга – также одно из осложнений тромбофлебита, при котором часть тромба попадает в головной мозг. Для данного осложнения характерен отрыв тромба в ночное время. Тромбоэмболия данного типа сопровождается состоянием оглушенности и нарушением сознания у пациента, отмечается нарушение движений и чувствительности рефлексов, потеря ориентации во времени и пространстве. Симптоматика в некоторой степени напоминает менингит.
- Кровотечения – результатом поражения сосудов в различных органах могут открываться очаги кровотечения. У пациента появляется характерная бледность, слабость.
- Снижение массы тела – по статистике каждый пациент, страдающий этим заболеванием, теряет около 20% массы своего тела.
Когда следует обратиться к врачу
При появлении любых признаков или симптомов сепсиса рекомендуется обратиться к специалистам для консультации. В зависимости от формы и клиники сепсиса заболевание может лечиться в интенсивной терапии, инфекционном или терапевтическом стационаре, отделении реанимации. В АО «Медицина» (клиника академика Ройтберга) в центре Москвы вы найдете всех необходимых врачей.
Диагностика сепсиса
Диагностика сепсиса проводится с использованием целого ряда клинических и лабораторных методов исследования. Специалист назначает анализы при сепсисе и аппаратные исследования:
- общий анализ крови для определения общей картины по течению воспалительного процесса;
- посев крови (может выполняться многократно) позволяет учесть для лечения сепсиса жизненный цикл патогенных возбудителей;
- бакпосев из гнойного очага;
- выделение ДНК патогенного возбудителя методом ПРЦ;
- аппаратные исследования с целью выявления первичных очагов воспаления – УЗИ, рентген, МРТ, компьютерная томография и др.
Лечение сепсиса
Лечение сепсиса назначается в соответствии с установленным диагнозом и распространяется на первичный источник инфицирования. Важным фактором для выбора интенсивных методов терапии является присутствие риска летального исхода.
Основные методы лечения:
- внутривенное введение максимально возможных доз антибиотиков (учитывается чувствительность и индивидуальные особенности организма пациента);
- интенсивная терапия, направленная против токсикоза;
- стимулирование иммунной системы пациента, восстановление её функций.
Ключевым является устранение инфекции из первичных очагов. Антибиотики могут дополняться гормональной терапией. В некоторых случаях может требоваться вливания плазмы крови, глюкозы и глобулина.
Для пациента создаются условия изоляции и покоя. В качестве дополнительной терапии назначается специальная диета. В критических случаях питание пациента осуществляется внутривенно.
При наличии вторичных гнойных очагов для лечения сепсиса применяется хирургическое вмешательство – удаление гноя и промывание очагов специальными растворами, вскрытие абсцессов, хирургическое иссечение пораженных тканей вместе с прилегающими здоровыми.
Профилактика сепсиса
Главным методом профилактики сепсиса – является своевременное и правильное лечение инфекций, ставших причиной развития первичных очагов.
Второй важный момент – строгое соблюдение асептических и антисептических правил проведения любых медицинских операций.
Использование антибактериальных средств должно быть грамотным. Вирусы, грибы и микробы имеют свойство приспосабливаться. Неоправданное применение сильных антибиотиков ведет к тому, что инфекции адаптируются, становятся умней и бороться с ними становится сложней. Самолечение следует исключить принципиально. Лучшее решение – обращение к специалисту.
Как записаться к специалисту
Для записи на прием в АО «Медицина» (клиника академика Ройтберга) доступны следующие способы:
Все исследования проводятся на современном оборудовании, в максимально сжатые сроки. При назначении лечения врачи всегда применяют индивидуальный подход, позволяющий победить болезнь максимально щадящим способом для организма. Помните, что чем раньше вы обратитесь к врачу, тем более простым и коротким будет лечение.
На сайте клинике можно ознакомиться с информацией о стоимости предоставляемых услуг. Звоните, если у вас остались какие-то вопросы, мы поможем вам!
Микотоксикозы – это пищевые интоксикации (реже респираторные и дермальные поражения), вызываемые микотоксинами плесневых грибков. Симптоматика зависит от вида микотоксина и способа поступления в организм. Могут возникать признаки гастроэнтерита, головные боли, психические нарушения, лейкопения, ангина, судороги, гангрена конечностей и др. Решающее диагностическое значение имеет анамнез, культуральное выделение грибка из пищи и биоматериала, результаты биопроб. При остром отравлении проводят промывание желудка и кишечника, назначают энтеросорбенты, форсированный диурез, гемосорбцию, симптоматическую терапию.
МКБ-10
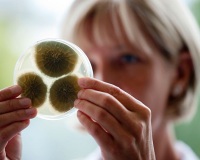


Общие сведения
Микотоксикозы – острые или хронические патологические состояния, вызванные поступлением в организм токсичных грибковых метаболитов. Загрязненность продуктов питания и животных кормов микотоксинами достигает 30%, что наносит существенный экономический ущерб сельскому хозяйству и представляет серьезную опасность для здоровья потребителей сельхозпродукции. Микотоксины обладают канцерогенным, мутагенным, эмбриотоксическим, аллергическим, иммуносупрессивным действием – все это делает проблему микотоксикозов междисциплинарной и крайне актуальной в современных условиях.

Причины микотоксикозов
Пути и источники заражения
Заболевания вызываются экзометаболитами – продуктами жизнедеятельности микроскопических грибов, накапливающимися в растительных или животных продуктах и обладающими различными токсигенными свойствами. Основной путь заражения микотоксикозами – алиментарный (при употреблении зараженной пищи), значительно реже – респираторный (при вдыхании) или трансдермальный (при непосредственном контакте).
Источниками микотоксинов чаще выступают зерновые (пшеница, рис, ячмень, кукуруза), бобовые (горох, фасоль, нут), масличные культуры (подсолнечник, кунжут), орехи (лесной, грецкий, арахис). Они поражаются грибками при недостаточной агротехнической и химической обработке почв, нарушении технологии сбора урожая и правил его хранения (высокая влажность, отсутствие аэрации). Кроме этого, микотоксины также могут поступать в организм человека с животными продуктами: мясом птицы, яйцами, молоком.
Если зараженные растительные продукты изменяют свой внешний вид, и грибки на них могут быть обнаружены визуально, то в контаминированной микотоксинами животной продукции видимый рост плесени зачастую отсутствует. Возникновению микотоксикозов также способствует устойчивость грибковых метаболитов к воздействию химических и физических факторов: они лишь частично разрушаются при кипячении, заморозке, высушивании, использовании консервантов. Оптимальными условиями для роста грибков и токсинообразования являются отсутствие солнечного света, влажные условия, прохладная или теплая температура воздуха.
Виды грибков и токсинов
Для человека опасность представляют микотоксикозы, вызванные патогенными грибками:
- рода Fusarium (F. sporotrichioides, F. graminearum) – продуцируют свыше 40 трихотеценовых токсинов, из них основными контоминантами пищи являются Т-2 токсин, вомитоксин.
- рода Aspergillus (A. flavus, A. parasiticus) – продуцируют около 20 афлатоксинов, наиболее опасными из которых являются В1 и М1.
- рода Penicillium – вырабатывают охратоксины, самым токсичным из которых является охратоксин А.
- рода Claviceps (C. purpurea, C. paspalum) – склероции спорыньи содержат ядовитые алкалоиды клавиновой группы (агроклавин, сетоклавин, элимоклавином) и лизергиновой кислоты (эргоалкалоиды: эргозин, эрготамин, эргосекалин, эргокристин).
Патогенез
Абсорбция микотоксинов в основном происходит в ЖКТ (главным образом, в тонком кишечнике), в меньшей степени метаболиты поглощаются альвеолами легких, всасываются через эпителий кожи, глаз. С током крови и лимфы они разносятся по всему организму, оказывая местное и системное токсическое действие. У различных микотоксинов есть свои органы-мишени. Практически все метаболиты обладают нейротропностью, с чем связано развитие симптомов поражения ЦНС при большинстве микотоксикозов.
Афлатоксины обладают выраженным гепатотоксическим действием, вызывая жировую и белковую дистрофию печени, а в тяжелых случаях ‒ некроз гепатоцитов, пролиферацию желчных протоков. В настоящее время они отнесены к сильнейшим гепатотропным ядам с канцерогенным действием. Кроме этого, афлатоксины вызывают снижение синтеза протромбина, нарушение метаболизма витамина D и минерального обмена, угнетение иммунной системы, гонадотоксическое, эмбриотоксическое действие.
Трихотецены провоцируют развитие язвенно-некротических процессов кожи и слизистых ротовой полости, носа, желудочно-кишечного тракта. Вызывают угнетение гемопоэза (анемию, лейкопению, тромбоцитопению), иммуносупрессию. Оказывают тератогенные и мутагенные эффекты.
Охратоксины поражают в первую очередь почки. Нефротоксическое действие проявляется атрофией почечных канальцев, фиброзом клубочков, развитием токсической нефропатии. Возможны кровоизлияния в ЖКТ. Оказывают тератогенное, эмбриотоксическое, канцерогенное действие.
Основной эффект эрготоксинов спорыньи – нейротоксичный. Вызывают галлюцинации, спазм гладкой мускулатуры, сужение кровеносных сосудов, трофические нарушения.

Классификация
С учетом путей проникновения микотоксинов выделяют микотоксикозы пищевые, респираторные (пневмомикотоксикозы), кожные (дерматомикотоксикозы). В зависимости от рода грибкового патогена различают следующие группы микотоксикозов человека:
- Фузариотоксикозы (фузариозы). Вызываются грибами рода Fusarium. Включают алиментарно-токсическую алейкию, отравление «пьяным хлебом», акакабитоксикоз.
- Афлатоксикозы. Вызываются грибками рода рода Aspergillus и Penicillium. Представлены острым отравлением и хронической интоксикацией.
- Эрготизм (клавицепсотоксикоз). Вызывается микроскопическими грибками рода Claviceps. Может протекать в трех формах: гангренозной, конвульсивной и смешанной.
Симптомы микотоксикозов
Фузариотоксикозы
Алиментарная токсическая алейкия в легком варианте протекает с явлениями стоматита, гингивита, глоссита. Иногда развивается клиническая картина острого гастроэнтерита. Выздоровление наступает в течение 3-5 дней. При значительном поступлении трихотеценов в организм возникает лейкопения, переходящая в алейкию, геморрагический диатез, коагулопатии (десневые, носовые, кишечные, маточные кровотечения), некротическая ангина.
Симптомы отравления «пьяным хлебом» развиваются через 30-60 мин. после приема в пищу контаминированных зерновых продуктов. Включают в себя абдоминальные боли, рвоту, диарейный синдром. Больных беспокоит сильнейшая слабость, неуверенность походки, тяжесть в ногах. На следующий день наступает стадия, напоминающая тяжелое похмелье: головокружение, выраженная цефалгия. Хронический микотоксикоз, вызванный трихотеценами, сопровождается истощением, снижением зрения, расстройствами психики.
Случаи акакабитоксикоза спорадически отмечаются в Корее и Японии, где основным продуктом питания является рис. Клинически напоминает пищевую токсикоинфекцию с рвотой, поносом, болями в животе, ознобом, головной болью. Иногда отмечается сильное першение в горле.
Афлатоксикозы
Острый микотоксикоз развивается уже в течение 30 минут после употребления пищи, загрязненной афлатоксинами. Возникает слабость, головная боль, болезненность в правом подреберье, желудочно-кишечные расстройства. Нейротоксический синдром проявляется нарушением координации движений, парезами, судорогами. Характерен геморрагический синдром, отеки, желтуха. Хронический афлатоксикоз проявляется энтеритом, замедлением роста и развития у детей, потерей веса у взрослых, развитием цирроза печени.
Эрготизм
Конвульсивная форма отравления спорыньей («злая корча») характеризуется ломотой в теле, парестезиями, тоническими судорогами и эпилептиформными приступами. Часто в клинической картине присутствуют явления гастроэнтерита. Иногда развиваются аффективные нарушения, галлюцинации.
При гангренозной форме микотоксикоза («огонь Святого Антония») появляются жгучие боли в конечностях, на фоне которых развивается сухая гангрена. При длительном лечении мигрени препаратами эрготамина гангренозные процессы могут возникнуть в органах ЖКТ.
Осложнения
Большинство микотоксинов способны вызывать мутации в генетическом аппарате, гибель эмбриона на ранних стадиях гестации, нарушения органогенеза у плода. Все остро протекающие микотоксикозы могут закончиться летально.
Хроническая интоксикация афлатоксинами опасна развитием рака печени. Гепатоцеллюлярная карцинома, сопряженная с афлатоксикозами, в 30 раз чаще развивается у лиц, страдающих вирусными гепатитами В и С. Не исключается, что афлатоксины играют определенную роль в развитии синдрома Рейе и квашиоркора у детей. При остром отравлении крайне высок риск возникновения острой печеночный недостаточности.
При эрготизме может произойти отторжение некротизированных мягких тканей и целых сегментов конечностей по границе суставных сочленений (мутиляция). Наиболее опасными осложнениями алиментарно-токсической алейкии являются сепсис и ДВС-синдром.

Диагностика
Пациентов с подозрением на микотоксикоз ведут врачи-токсикологи или инфекционисты. Первостепенную роль для постановки этиологического диагноза играет выявление источника микотоксинов, установление культуры грибка-продуцента. Для этого используются клинико-эпидемиологические, лабораторные и инструментальные исследования:
- Клинико-эпидемиологические данные. У больного выясняют пищевой анамнез, профессиональный, бытовой контакт с грибками. Оценивают клинические проявления: жалобы, симптоматику, результаты физикального обследования, нервно-психический статус.
- Лабораторные методы. В лаборатории проводят анализы мочи, кала, рвотных масс на метаболиты токсинов, микробиологическое выделение грибка из пищевых продуктов и биоматериала. Для идентификации токсического агента также используют иммуноферментный и радиоиммунологический анализ. Для оценки состояния пациента выполняют ОАК и мочи, исследуют печеночные пробы, коагулограмму. При необходимости прибегают к проведению биопроб с микотоксинами на лабораторных животных.
- Прочие исследования. Диагностику различных этиологических форм микотоксикозов дополняют инструментальными исследованиями: фарингоскопией, нейромиографией, ЭЭГ, УЗИ внутренних органов, рентгенографией конечностей и пр.
Дифференциальная диагностика
При подозрении на микотоксикоз следует исключить патологические состояния, протекающие с признаками поражения ЖКТ и нервной системы:
- отравление бактериальными токсинами (стафилококковую токсикоинфекцию, ботулизм);
- столбняк;
- вирусные гастроэнтериты;
- отравление ядовитыми растениями;
- отравление тяжелыми металлами.
Лечение микотоксикозов
При признаках острого отравления пациента госпитализируют в отделение токсикологии. Специфическое лечение микотоксикозов отсутствует. В качестве мер экстренной помощи производят зондовое промывание желудка, дают солевые слабительные. В дальнейшем назначают энтеросорбенты, осуществляют инфузионную терапию, форсированный диурез, при тяжелой интоксикации выполняют гемосорбцию.
Симптоматическая терапия микотоксикозов направлена на профилактику инфекционных осложнений (антибиотикотерапия), поддержку функции печени (гепатопротекторы), стимуляцию кроветворения (фолиевая кислота, витамин В12, стимуляторы лейкопоэза), повышение свертываемости крови (витамин К, препараты кальция). По показаниям вводят противогангренозную сыворотку.
Прогноз и профилактика
При своевременном изъятии контаминированных продуктов из рациона и начале лечения патологические симптомы обратимы. Факторами неблагоприятного прогноза выступают высокая доза микотоксинов, присоединение септических и геморрагических осложнений, полиорганной недостаточности. Меры профилактики микотоксикозов включают соблюдение технологии уборки и условий хранения зерновых культур, тщательный контроль за состоянием продуктов питания и содержанием в них микотоксинов. Продукты с видимыми следами плесени категорически не должны употребляться в пищу.
1. Проблемы микотоксикозов в современных условиях и принципы профилактических решений/ В. С. Попов, Н. В. Самбуров, Н. В. Воробьева. – 2018.
Читайте также:

