Витамин в при фурункулах какие витамины лучше
Обновлено: 28.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Длительное заживление раны: причины, диагностика и способы лечения
Определение
Регенерация (восстановление) кожи и тканей – важный и сложный физиологический процесс. Он зависит от площади и глубины повреждения, сопутствующих заболеваний и многих других факторов.
Длительно незаживающие раны привносят существенный дискомфорт в повседневную жизнь, поскольку им сопутствуют боль, отек, истечение из раны прозрачной жидкости, крови или гноя, неприятный запах из раны, чувство распирания в поврежденной области.
Разновидности незаживающих ран
В зависимости от причины возникновения все длительно незаживающие раны можно разделить на травматические (появившиеся в результате механической травмы, ожога и т.д.) и трофические (появившиеся в результате нарушения кровообращения в пораженной области).
Возможные причины длительного заживления ран
Длительное заживление ран является симптомом многих патологических состояний, характеризующихся нарушением нормальных физиологических процессов регенерации тканей.
Факторы, влияющие на заживление ран:
- Возраст оказывает прямое влияние на процесс восстановление тканей. У детей раны заживают гораздо быстрее, чем у пожилых людей. Это связано с более активным обменом веществ в организме ребенка по сравнению с взрослыми.
- Масса тела влияет на обменные процессы в организме. Жировая ткань не нуждается в интенсивном кровообращении, поэтому увеличение ее количества в несколько раз относительно нормы (ожирение) ведет к замедлению регенерации тканей и частым осложнениям течения раневого процесса. При крайне низкой массе тела наблюдается замедление обмена веществ в организме за счет уменьшения количества энергии, следовательно, все раны заживают медленнее.
- Адекватное кровообращение в области повреждения обеспечивает ткани достаточным количеством питательных веществ и кислорода для восстановления. Недостаточный приток артериальной крови и нарушенный отток венозной крови существенно замедляют течение раневого процесса и способствуют развитию различных осложнений. Длительное сдавливание тканей при нахождении в вынужденном положении (например, у лежачих больных) приводит к развитию пролежней, которые также характеризуются продолжительным заживлением.
- Инфицирование раны нарушает процесс регенерации за счет активного размножения микроорганизмов, их воздействия на ткани и постоянной активации выраженного воспалительного процесса. Образуется большое количество гнойного экссудата, формируются участки некроза и нарастает общая интоксикация.
- От состояния иммунитета зависит адекватность воспалительной реакции и способность организма противостоять присоединению вторичной инфекции.
- Сопутствующие заболевания, такие как сахарный диабет, тяжелые инфекции, нарушения в системе кроветворения, сердечная и дыхательная недостаточность, замедляют регенерацию за счет нарушения образования и доставки необходимых веществ в область раны, а также выведения токсичных продуктов обмена из организма.
- Применение некоторых лекарственных средств и видов лечения может оказывать существенное влияние на нормальное течение процесса заживления раны. Так, бесконтрольное применение обезболивающих (нестероидных противовоспалительных препаратов) может привести к замедлению регенерации из-за подавления воспалительных процессов, которые в норме происходят в любой ране. Применение лучевой и химиотерапии также может стать причиной замедленного заживления ран, так как погибают не только опухолевые клетки, но и клетки, отвечающие за регенерацию тканей. При этом сама злокачественная опухоль забирает большое количество питательных веществ на свой рост, что негативно сказывается на всех процессах в организме.
-
Хроническая венозная недостаточность (также проявляющаяся варикозным расширением вен) - одна из самых распространенных причин длительно незаживающих ран на ногах. Нарушается венозный отток от нижних конечностей и доставка питательных веществ к тканям, нарастает гипоксия (снижение притока кислорода к тканям). Впоследствии возникают обменные нарушения в тканях и формируются длительно незаживающие трофические язвы.
Людям, страдающим хронической венозной недостаточностью, требуется постоянный тщательный уход за кожей, а при возникновении трофической язвы - профилактика увеличения раневой поверхности и ее инфицирования.
Диагностика и обследования при длительном заживлении ран
В большинстве случаев врач назначит необходимый комплекс лабораторно-инструментальных методов исследования.
-
Клинический анализ крови: общий анализ с подсчетом тромбоцитов, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов).
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний яв
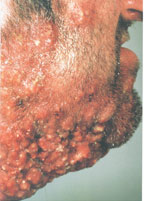
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний является хронический рецидивирующий фурункулез (ХРФ). Фурункул развивается в результате острого гнойно-некротического воспаления волосяного фолликула и окружающих его тканей. Как правило, фурункул является осложнением остеофолликулита стафилококковой этиологии. Фурункулы могут возникать как одиночно, так и множественно (так называемый фурункулез).
В случае рецидивирования фурункулеза диагностируется хронический рецидивирующий фурункулез. Как правило, он характеризуется частыми рецидивами, длительными, вялотекущими обострениями, толерантными к проводимой антибактериальной терапии. В зависимости от количества фурункулов, распространенности и выраженности воспалительного процесса ХРФ классифицируется по степени тяжести (Л. Н. Савицкая, 1987).
Тяжелая степень: диссеминированные, множественные, непрерывно рецидивирующие небольшие очаги со слабой местной воспалительной реакцией, не пальпируемыми или слегка определяющимися регионарными лимфатическими узлами. Тяжелое течение фурункулеза сопровождается симптомами общей интоксикации: слабостью, головной болью, снижением работоспособности, повышением температуры тела, потливостью.
Средняя степень тяжести — одиночные или множественные фурункулы больших размеров, протекающие с бурной воспалительной реакцией, с рецидивами от 1 до 3 раз в год. Иногда сопровождается увеличением регионарных лимфатических узлов, лимфангоитом, кратковременным повышением температуры тела и незначительными признаками интоксикации.
Легкая степень тяжести — одиночные фурункулы, сопровождающиеся умеренной воспалительной реакцией, с рецидивами от 1 до 2 раз в год, хорошо пальпируемыми регионарными лимфатическими узлами, без явлений интоксикации.
Чаще всего пациенты, страдающие фурункулезом, получают лечение у хирургов, в лучшем случае на амбулаторном этапе им проводится исследование крови на сахар, аутогемотерапия, некоторым назначают и иммуномодулирующие препараты без предварительно проведенного обследования, и в большинстве случаев они не получают положительного результата от проведенной терапии. Цель нашей статьи — поделиться опытом ведения больных с ХРФ.
Основным этиологическим фактором ХРФ считается золотистый стафилококк, который встречается, по разным данным, в 60–97% случаев. Реже ХРФ вызывается другими микроорганизмами — эпидермальным стафилококком (ранее считавшимся апатогенным), стрептококками групп А и В и другими видами бактерий. Описана вспышка заболеваемости фурункулезом нижних конечностей у 110 пациентов, являвшихся пациентами одного и того же педикюрного салона. Возбудителем данной вспышки являлся Mycobacterium fortuitium, причем этот микроорганизм был выявлен в ванночках для ног, используемых в салоне. В большинстве случаев ХРФ из гнойных очагов высеваются антибиотикорезистентные штаммы золотистого стафилококка. По данным Н. М. Калининой, St. aureus в 89,5% случаев резистентен к пенициллину и ампициллину, в 18,7% — резистентен к эритромицину и в 93% случаев чувствителен к клоксациллину, цефалексину и котримоксазолу. В последние годы отмечается достаточно широкое распространение метициллин-резистентных штаммов этого микроорганизма (до 25% пациентов). По данным зарубежной литературы, наличие на коже или на слизистой оболочке носа патогенного штамма St. aureus считается важным фактором развития заболевания.
ХРФ имеет сложный и до сих пор недостаточно изученный патогенез. Установлено, что дебют и дальнейшее рецидивирование заболевания обусловлены целым рядом эндо- и экзогенных факторов, среди которых наиболее значимыми считаются нарушение барьерной функции кожных покровов, патология ЖКТ, эндокринной и мочевыделительной систем, наличие очагов хронической инфекции различной локализации. По данным проведенных нами исследований, очаги хронической инфекции различной локализации выявляются у 75–99,7% пациентов, страдающих ХРФ. Наиболее часто встречаются очаги хронической инфекции ЛОР-органов (хронический тонзиллит, хронический гайморит, хронический фарингит), дисбактериоз кишечника с увеличением содержания кокковых форм. У больных хроническим фурункулезом патология ЖКТ (хронический гастродуоденит, эрозивный бульбит, хронический холецистит) определяется в 48–91,7% случаев. У 39,7% пациентов диагностируется патология эндокринной системы, представленная нарушениями обмена углеводов, гормонпродуцирующей функции щитовидной и половых желез. У 39,2% больных с упорно текущим фурункулезом имеется латентная сенсибилизация, у 4,2% — клинические проявления сенсибилизации к аллергенам домашней пыли, пыльцы деревьев и злаковых трав, у 11,1% — повышенная концентрация сывороточного IgE.
Таким образом, для большинства больных ХРФ характерны непрерывно рецидивирующее течение заболевания (41,3%) при тяжелой и средней тяжести течения фурункулеза (88%) и длительные обострения (от 14 до 21 дня — 39,3%). У 99,7% пациентов выявлены хронические очаги инфекции различной локализации. В 39,2% случаев определялась латентная сенсибилизация к различным аллергенам. Основным возбудителем является St. aureus.
В возникновении и развитии хронического фурункулеза, наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами, наличием сопутствующей патологии, большая роль отводится нарушениям нормального функционирования и взаимодействия различных звеньев иммунной системы. Иммунная система, призванная обеспечить биологическую индивидуальность организма и, как следствие, выполняющая защитную функцию при контакте с инфекционными, генетически чужеродными агентами, в силу разных причин может давать сбой, что ведет к нарушению защиты организма от микробов и проявляется в повышенной инфекционной заболеваемости.
Иммунная защита от бактерий-патогенов включает два взаимосвязанных компонента — врожденный (носящий преимущественно неспецифический характер) и адаптивный (характеризующийся высокой специфичностью к чужеродным антигенам) иммунитет. Возбудитель ХРФ при попадании в кожу вызывает «каскад» защитных реакций.
У 26–35% больных, страдающих хроническим фурункулезом, снижается количество В-лимфоцитов. При оценке компонентов гуморального иммунитета у больных фурункулезом выявляются различные дисиммуноглобулинемии. Наиболее часто встречаются снижение уровней IgG и IgM. Отмечено снижение аффинности иммуноглобулинов у больных ХРФ, причем выявлена корреляция между частотой встречаемости этого дефекта, стадией и тяжестью заболевания. Тяжесть нарушений лабораторных показателей коррелирует с тяжестью клинических проявлений фурункулеза.
Из вышесказанного следует, что изменения показателей иммунного статуса у больных ХРФ носят разноплановый характер: у 42,9% отмечено изменение субпопуляционного состава лимфоцитов, у 71,1% — фагоцитарного и у 59,5% — гуморального звена иммунной системы. В зависимости от выраженности изменений в показателях иммунного статуса больных ХРФ можно разделить на три группы: легкой тяжести, средней и тяжелого течения, что коррелирует с клиническим течением заболевания. При легком течении фурункулеза у большинства больных (70%) показатели иммунного статуса находятся в пределах нормы. При средней и тяжелой степени преимущественно выявляются изменения фагоцитарного и гуморального звеньев иммунной системы.
Диагностика и лечение ХРФ
Исходя из вышеуказанных патогенетических особенностей ХРФ алгоритм диагностики должен включать в себя выявление очагов хронической инфекции, диагностику сопутствующих заболеваний, оценку лабораторных параметров состояния иммунной системы (рис.).
В нашем институте был разработан план обследования больных ХРФ.
- Обязательное лабораторное исследование:
- клинический анализ крови;
- общий анализ мочи;
- биохимический анализ крови (общий белок, белковые фракции, общий билирубин, мочевина, креатинин, трансаминазы - АСТ, АЛТ);
- RW, ВИЧ;
- анализ крови на наличие гепатита В и С;
- посев содержимого фурункула на флору и чувствительность к антибиотикам;
- гликемический профиль;
- иммунологическое обследование (фагоцитарный индекс, спонтанная и индуцированная хемилюминесценция (ХЛ), индекс стимуляции (ИС) люминолзависимой хемилюминесценции ЛЗХЛ), бактерицидность нейтрофилов, иммуноглобулины A, M, G, аффинность иммуноглобулинов);
- бактериологическое исследование фекалий;
- анализ кала на яйца глистов;
- посев из зева на флору и грибы.
- Дополнительное лабораторное исследование:
- определение уровня гормонов щитовидной железы (Т3,Т4, ТТГ, АТ к ТГ);
- определение уровня половых гормонов (эстрадиол, пролактин, прогестерон);
- посев крови на стерильность трехкратно;
- посев мочи (по показаниям);
- посев желчи (по показаниям);
- определение базальной секреции;
- иммунологическое обследование (субпопуляции Т-лимфоцитов, В-лимфоциты);
- общий IgE.
- Инструментальные методы обследования:
- гастроскопия с определением базальной секреции;
- УЗИ органов брюшной полости;
- УЗИ щитовидной железы (по показаниям);
- УЗИ женских половых органов (по показаниям);
- дуоденальное зондирование;
- функции внешнего дыхания;
- ЭКГ;
- рентгенография органов грудной клетки;
- рентгенография придаточных пазух носа.
- Консультации специалистов: отоларинголога, гинеколога, эндокринолога, хирурга, уролога.
Тактика лечения больных ХРФ определяется стадией заболевания, сопутствующей патологией и иммунологическими нарушениями. В стадии обострения ХРФ требуется проведение местной терапии в виде обработки фурункулов антисептическими растворами, антибактериальными мазями, гипертоническим раствором; в случае локализации фурункулов в области головы и шеи или наличия множественных фурункулов — проведение антибактериальной терапии с учетом чувствительности возбудителя. В любой стадии заболевания необходима коррекция выявленной патологии (санация очагов хронической инфекции, лечение патологии ЖКТ, эндокринной патологии и т. д.). При выявлении у больных ХРФ латентной сенсибилизации или при наличии клинических проявлений аллергии необходимо в период поллинации добавлять к лечению антигистаминные препараты, назначать гипоаллергенную диету, проводить хирургическое вмешательство с премедикацией гормональными и антигистаминными препаратами.
В последнее время в комплексной терапии больных ХРФ все чаще используют препараты, оказывающие корригирующее действие на иммунную систему.
Разработаны показания к назначению иммуномодуляторов в зависимости от доминирующего типа нарушений иммунного статуса и степени заболевания. Так, в стадии обострения ХРФ рекомендовано применение следующих иммуномодуляторов.
- При наличии изменений фагоцитарного звена иммунитета целесообразно назначение полиоксидония по 6-12 мг внутримышечно в течение 6-12 дней.
- При снижении аффинности иммуноглобулинов - галавит 100 мг № 15 внутримышечно.
- При снижении уровня В-лимфоцитов, нарушении соотношения CD4/CD8 в сторону уменьшения показано применение миелопида по 3 мг в течение 5 дней внутримышечно.
- При снижении уровня IgG на фоне тяжелого обострения ХРФ при клинической неэффективности применения галавита используются препараты иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин).
В период ремиссии возможно назначение следующих иммуномодуляторов.
- Полиоксидоний 6-12 мг внутримышечно в течение 6-12 дней - при наличии изменений фагоцитарного звена иммунитета.
- Ликопид 10 мг в течение 10 дней перорально - при наличии дефектов образования активных форм кислорода.
- Галавит 100 мг № 15 внутримышечно - при снижении аффинности иммуноглобулинов.
Применение ликопида целесообразно также при вялотекущем, непрерывно рецидивирующем фурункулезе. При упорном рецидивировании ХРФ на фоне изменений гуморального звена иммунитета показано назначение препаратов иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин). В некоторых случаях целесообразно комбинированное применение иммуномодулирующих препаратов (например, при обострении фурункулеза возможно назначение полиоксидония, в дальнейшем, при выявлении дефекта аффинности иммуноглобулинов, добавляется галавит и т. д.).
Несмотря на значительные успехи, достигнутые в области клинической иммунологии, эффективное лечение ХРФ остается достаточно сложной задачей. В связи с этим требуется дальнейшее изучение патогенетических особенностей этого заболевания, а также разработка новых подходов к терапии ХРФ.
Неоген является синтетическим трипептидом, состоящим из L-аминокислотных остатков изолецитина, глютамина и триптофана. Неоген применялся в составе комплексной терапии, проводимой больным хроническим фурункулезом. Внутримышечные инъекции препарата неогена проводились по 1 мл 0,01% раствора 1 раз в сутки ежедневно, курс — 10 инъекций. Применение неогена в комплексной терапии больных хроническим фурункулезом на стадии ремиссии заболевания вызывает достоверную нормализацию изначально измененных иммунологических показателей (относительного и абсолютного количества лимфоцитов, относительного количества CD3 + , CD8 + , CD19 + , CD16 + -лимфоцитов, поглотительной способности моноцитов по отношению к St. aureus) и увеличение показателей спонтанной ХЛ и аффинности анти-ОАД-антител, количества HLA-DR+-лимфоцитов, а следовательно, позволяет продлить период ремиссии заболевания по сравнению с группой контроля.
Таким образом, из вышеизложенного следует, что ХРФ протекает под воздействием сложного комплекса этиологических и патогенетических факторов и его нельзя рассматривать только как местное воспаление. Больным с ХРФ необходимо проводить всестороннее обследование с целью выявления возможных очагов хронической инфекции, которые являются источником септицемии и при нарушении элиминации микробов в крови в результате снижения иммунологической реактивности организма приводят к возникновению фурункулов. Так как назначение иммунокорригирующих препаратов может вызвать обострение основного заболевания, мы считаем, что лечение больных необходимо начинать с санации выявленных очагов инфекции.
Вопрос о назначении иммунокорригирующих препаратов должен решаться индивидуально, с учетом стадии заболевания, наличия сопутствующей патологии и типа иммунологического дефекта. При выявлении у больного сенсибилизации к различным аллергенам лечение фурункулеза необходимо проводить на фоне противоаллергенной терапии.
Н. Х. Сетдикова, доктор медицинских наук
К. С. Манько
Т. В. Латышева, доктор медицинских наук, профессор
В терапии острых болей в спине происходят существенные изменения. Главным отличием является отказ от строгой иммобилизации больных и переход к быстрой активизации с помощью лечебной физкультуры. При этом одним
В терапии острых болей в спине происходят существенные изменения. Главным отличием является отказ от строгой иммобилизации больных и переход к быстрой активизации с помощью лечебной физкультуры. При этом одним из условий успешной терапии является купирование болевого синдрома, начиная с первого дня острого периода. Традиционно для этого используют простые анальгетики (Аспирин, Парацетамол), нестероидные противовоспалительные препараты (НПВП), мышечные и эпидуральные блокады. Наряду с этими подходами достаточно популярными в купировании острой боли оказались комбинированные витаминные препараты, содержащие тиамин (витамин В1), пиридоксин (витамин В6) и цианокобаламин (витамин В12).
Интерес к широкому применению комбинации витаминов группы В при болях пришел из практики. С 1950 г. во многих странах их стали рассматривать как анальгетики. Хорошо известно, что витамины группы В являются нейротропными и существенным образом влияют на процессы в нервной системе (на обмен веществ, метаболизм медиаторов, передачу возбуждения). В отечественной практике витамины группы В применяются очень широко. Клинический опыт показывает, что парентеральное использование комбинации тиамина, пиридоксина и цианокобаламина хорошо купирует боль, нормализует рефлекторные реакции, устраняет нарушения чувствительности. Поэтому при болевых синдромах врачи нередко прибегают к использованию витаминов этой группы в комбинации с другими препаратами.
Популярность витаминов группы В при острых болях в спине связана и с другими аспектами. В работе с пациентами, страдающими такими болями, нередко приходится сталкиваться с определенными трудностями. Во-первых, это различные осложнения фармакотерапии. Применение многочисленных НПВП нередко отвергается самими больными из-за побочных эффектов, главным образом со стороны ЖКТ. Во-вторых, при неэффективности какого-либо препарата приходится назначать одновременно препараты нескольких групп, что увеличивает риск побочных эффектов, а также, как правило, повышает стоимость лечения. В-третьих, у многих пациентов существуют противопоказания к проведению различных обезболивающих физиотерапевтических процедур (электротерапия, магнитотерапия, тепловые процедуры и т. д.). Часто они из-за боли не могут выйти из дома, и соответственно проведение каких-либо процедур вне дома исключается. Кроме того, не всегда удается провести необходимые мышечные или эпидуральные блокады из-за отсутствия соответствующих условий или специалистов.
Целью настоящей работы было рандомизированное открытое сравнительное исследование эффективности препарата Мильгамма, диклофенака и их комбинации в лечении острых болей в нижней части спины. Препарат Мильгамма выпускается в ампулах по 2,0 мл. Одна ампула содержит 100 мг тиамина гидрохлорида, 100 мг пиридоксина гидрохлорида, 1000 мкг цианокобаламина и 20 мг лидокаина. Отличием Мильгаммы от других витаминных препаратов является форма выпуска: в одной ампуле содержатся большие дозы витаминов В1, В6 и В12 в сочетании с местным анестетиком. Решающую роль в комбинированном применении витаминов группы В играет то, что области применения витаминов В перекрещиваются и дополняют друг друга.
В исследование было включено 60 пациентов, страдающих острыми болями в спине. Критериями включения были острые боли в спине, интенсивностью не менее 6 баллов по визуальной аналоговой шкале (ВАШ). Критериями исключения являлись: онкологические заболевания; боли в спине, обусловленные патологией органов брюшной полости и малого таза, компрессия спинного мозга. Все больные были разделены на три группы. В первую группу («М») вошли 20 пациентов, получавших в течение периода до 10 дней по 2,0 мл препарата Мильгамма, во вторую группу («Д») вошли 20 больных, принимавших в течение такого же срока диклофенак внутримышечно по 75 мг в день, третья группа («М + Д») состояла также из 20 человек, получавших ежедневно инъекции Мильгаммы (2,0 мл) и диклофенака (75 мг). Препарат диклофенак был выбран для сравнения как наиболее популярное обезболивающее средство из группы НПВП, широко применяемое в нашей стране для купирования болей в спине. Никаких других фармакологических препаратов и/или физиопроцедур пациентам всех трех групп не назначалось. Лечение проводилось в амбулаторных условиях. Максимальный срок применения препаратов был 10 дней. При полном устранении болевого синдрома ранее этого срока лечение прекращалось.
Средний возраст в группе «М» составил 42,8 ± 9,9 года, в группе «Д» — 40,0 ± 9,8, в группе «М + Д» — 43,1 ± 10 лет. В группе «М» было 40% мужчин и 60% женщин, в группе «Д» и «М + Д» соответственно 30% мужчин и 70% женщин. Таким образом, исследуемые группы были сопоставимы по возрасту и полу (р > 0,15).
В исследовании использовались клинико-неврологический анализ, нейровизуализация (МРТ, КТ, рентгенография), ВАШ для оценки интенсивности болевого синдрома (ежедневно), шкала впечатлений пациента об эффективности терапии, анализ побочных действий препаратов. Статистический анализ проводился с помощью параметрических и непараметрических методов статистики (программа Statistica 5,0).
Результаты
Болевой синдром был представлен преимущественно мышечно-тоническими нарушениями во всех группах (100% во всех группах). Радикулярные боли вследствие дискогенной компрессии отмечались: в группах «М» и «Д» — по 10%, в группе «М + Д» — в 20% случаев. При этом межпозвоночная грыжа диска на МРТ выявлена: в группе «М» — в 10% (L5-S1), в группе «Д» — в 20% (L5-S1), в группе «М + Д» — в 20% случаев (L4-L5, L5-S1). Явления остеохондроза отмечены в группе «М» в 95%, в группе «Д» — в 100%, в группе «М + Д» — в 95% случаев.
Интенсивность боли по шкале ВАШ в сравниваемых группах до лечения достоверно не отличалась. В группах «М» и «Д» было отмечено статистически достоверное снижение интенсивности боли по шкале ВАШ, начиная со второго дня терапии и последующее ее высокодостоверное уменьшение на протяжении всего курса лечения (p < 0,001). В группе «М + Д» достоверное снижение боли отмечено уже с первого дня терапии. Сравнивая в целом эффективность лечения в изучаемых группах, можно отметить значительное и последовательное уменьшение боли в течение всех дней терапии (табл. 1).
Для оценки динамики редукции болевого синдрома был проведен анализ изменений по шкале ВАШ в процентах по отношению к интенсивности боли до лечения, взятой за 100%. К 3-му дню лечения во всех группах было достигнуто клинически значимое для пациентов уменьшение боли (более чем на 30%). Следует отметить, что наибольшие изменения (уменьшение боли) в течение первых 3 дней были отмечены в группе «М + Д», однако эти отличия не достигали степени достоверности.
Среди врачей распространено мнение о том, что диклофенак более эффективен, чем Мильгамма, при очень интенсивных болях. Для проверки этой гипотезы мы сравнили эффективность лечения в трех группах у больных с исходной интенсивностью боли 8–10 баллов по шкале ВАШ. При анализе динамики регресса боли у этих больных (8–10 баллов по шкале ВАШ) наблюдалось достоверное уменьшение интенсивности боли во всех группах в течение уже первых 5 дней. Однако если оценивать степень обезболивания по дням терапии, то следует отметить положительный эффект в первый день терапии в группе «М + Д» (р < 0,05), тогда как в группах «М» и «Д» достоверное снижение боли наблюдалось только со второго дня лечения (табл. 2).
В нашей работе мы проанализировали количество больных с различной степенью регресса боли: с полным купированием — на 100%, с регрессом на 50 и 30% в зависимости от длительности терапии. Следует подчеркнуть, что уменьшение боли на 30% считается клинически значимым улучшением. На второй день терапии клинически значимое улучшение отметили 11 человек в группе «М + Д», что достоверно больше, чем в этот день в группах «М» и «Д» (р < 0,05). В группе «М + Д» было больше пациентов с полным купированием боли в течение первых 5 дней лечения. Однако можно заметить, что начиная с 4-го и 5-го дня лечения количество больных с регрессом боли более чем на 30% было примерно одинаковым в трех группах.
Больным также предлагалось самостоятельно оценить обезболивающий эффект препаратов по шкале субъективных впечатлений (табл. 3). В целом по итогам 10 дней лечения полное устранение боли отметили 45% пациентов в группе «М» и 35% пациентов в группе «Д», однако наибольшее количество больных с полным регрессом боли было в группе «М + Д» (70%). О том, что боли уменьшились незначительно, сообщили 10% больных, принимавших изолированно диклофенак или Мильгамму. В группе пациентов, получавших диклофенак, у одного человека боли сохранялись на протяжении 7 дней лечения, и пациент был госпитализирован.
На протяжении лечения у ряда больных были выявлены побочные реакции: тошнота, дискомфорт в животе, боли в желудке, диарея. Анализ побочных реакций показал, что большинство из них связаны с приемом диклофенака. Их количество было достоверно выше в группе пациентов, принимавших диклофенак (35%), несколько ниже в группе с применением двух препаратов (25%) и меньше всего в группе больных, получавших Мильгамму (5%, p < 0,05, крапивница у одного больного на 7-й день терапии). В связи с побочными эффектами от терапии отказались 20% в группе «Д» (10% после 5-й инъекции, 10% — после 7-й инъекции), 15% в группе «М + Д» (через 5 дней лечения) , 5% — в группе «М» (после 7-й инъекции). Таким образом, достоверно большее количество больных прекратило лечение из-за побочных явлений, связанных с применением диклофенака.
При нормальном и разнообразном питании витаминов в организм поступает вполне достаточно, чтобы предотвратить какой-либо витаминодефицит. С появлением синтетических витаминов человек может получить в одной дозе препарата такое количество витаминов, которое поступает с пищей в течение года. Однако в этих фармакологических дозах витамины должны рассматриваться уже как лекарственные препараты. И что очень важно — в таких дозах механизм действия часто отличается от хорошо известного физиологического воздействия «природных» витаминов [6].
Есть две группы нарушений, при которых витаминотерапия безоговорочно показана. Первая — витаминодефицитные состояния (болезнь бери-бери, подагра, алкоголизм, мальабсорбция, муковисцедоз и др.). Вторая — генетические дефекты метаболизма витаминов. При этом обе эти группы витаминодефицитных состояний служат основанием лишь для очень небольшой части всех назначений витаминных препаратов. В медицинской практике витамины группы В чаще всего назначаются как адъюванты при состояниях, не сопровождающихся дефицитом витаминов: болевые синдромы, психозы, астения, тунельные синдромы, аллопеция. Очень часто при этом достигаются хорошие результаты лечения. При этом остается неясным, в каких случаях положительный эффект связан с действием витаминов, а в каких может быть случайным или обусловленным плацебо.
Несмотря на то, что отсутствуют крупные доказательные исследования в этом плане, практика показывает, что витамины группы В в больших дозах действительно обладают анальгезирующими свойствами, а также способны усиливать обезболивающие эффекты при применении одновременно с простыми анальгетиками или НПВП. Положительные результаты были получены в лечении как мышечно-скелетной, так и нейропатической боли [9]. В частности, есть исследования, показывающие эффективность витамина В6 при тунельных синдромах. Есть указания на то, что витамины группы В усиливают анальгезию при одновременном их применении с диклофенаком при острых болях в спине, что может сократить сроки лечения и уменьшить дозировки диклофенака, снизив, таким образом, риск побочных явлений [10–13].
Полученные в нашей работе результаты подтвердили эффективность и безопасность комбинированного препарата Мильгамма в лечении острых болей в спине. Достоверное анальгетическое действие отмечается со второй инъекции препарата. Эффект Мильгаммы, препарата не относящегося к анальгетикам, оказался сопоставимым с диклофенаком — «классическим» обезболивающим средством. Это может свидетельствовать о том, что в препарате Мильгамма комбинация витаминов группы В обладает четким анальгетическим механизмом действия и не является результатом обычного традиционного физиологического воздействия этих витаминов. Нам представляется это положение очень важным, поскольку среди врачей распространено мнение, что применение витаминов группы В при острых болях — это обычная витаминотерапия, направленная на «укрепление нервной системы». С учетом новых экспериментальных данных, о которых сказано выше, можно ожидать, что в перспективе будут более детально изучены анальгетические свойства и уточнены механизмы воздействия больших доз витаминов группы В на человека.
В нашем исследовании побочные явления и осложнения во время и после окончания терапии были связаны с приемом диклофенака. В группе пациентов, принимавших этот препарат, получен высокий процент побочных явлений (35%), что, к сожалению, говорит о его недостаточно высоком уровне.
Что касается комбинированной терапии, то она оказалась эффективнее, чем монотерапия, с точки зрения динамики регресса боли. Показано более быстрое и выраженное снижение боли в первые дни терапии, что очень важно особенно при интенсивных болях. Вполне вероятно, что комбинированная терапия сокращает сроки лечения, а также позволяет обсуждать применение более низких доз НПВП при их сочетании с Мильгаммой. Комбинация Мильгаммы с диклофенаком может быть рекомендована при очень высокой интенсивности боли для быстрого ее купирования уже в первые дни лечения. При этом следует обратить внимание на то, что эффективность монотерапии Мильгаммой при интенсивных болях не уступала диклофенаку, и этот факт с учетом лучшего профиля безопасности позволяет относить препарат к универсальным как при слабых, так и при сильных болях.
Выводы
Проведенное исследование подтверждает клинический опыт высокой эффективности комбинации витаминов группы В в терапии острых болей в спине.
Монотерапия Мильгаммой острых болей в спине сопровождается достоверным снижением интенсивности болевого синдрома со второго дня и на протяжении всего курса лечения при практическом отсутствии нежелательных побочных явлений.
Мильгамма является эффективным обезболивающим средством как при умеренных, так и при болях высокой интенсивности.
Терапия острых болей в спине диклофенаком является эффективной, однако сопровождается в трети случаев нежелательными побочными явлениями, что следует учитывать при выборе лекарств.
Комбинированная терапия диклофенаком и Мильгаммой дает более выраженный обезболивающий эффект, чем монотерапия (Мильгаммой или диклофенаком); выраженный положительный эффект отмечается уже в первый день терапии, что важно учитывать при необходимости срочного купирования болевого синдрома.
Вероятно, что комбинированная терапия (НПВП + витамины группы В) позволит использовать меньшие дозы НПВП в целях предупреждения нежелательных побочных явлений. при достижении максимального обезболивания.
При длительности лечения 7–10 дней комбинированная терапия не имеет преимуществ перед монотерапией Мильгаммой или диклофенаком по конечному результату, однако монотерапия Мильгаммой отличается лучшей переносимостью и большей безопасностью.
Препарат Мильгамма в инъекциях должен рассматриваться не как компонент для лечения витаминодефицитных состояний или общеукрепляющее средство, а как активно действующее средство, с особыми, пока недостаточно изученными, но очевидными противоболевыми свойствами.
По вопросам литературы обращайтесь в редакцию.
А. Б. Данилов, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
На сервисе СпросиВрача доступна консультация аллерголог-иммунолога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!


Такие гнойные инфекции могут быть также на фоне жда, дефицита цинка, вит в2 ,Вит А, нехватки альбумина крови ( все эти показатели надо проверить)
Также на фоне очага хрон инфекции типа тонзиллита синусита . Конс лор полезна , после мазка из зева и носа с чувствительностью к антибиотикам и фагам .

Здравствуйте.
Рецидивируют фурункулы на фоне снижения иммунитета.
Проверьте общий анализ крови, витамины, микроэлементы в крови,
-кровь на сахар
-кровь на АСЛО, С-реактивный белок, ревматоидный фактор
-ИФА крови на антитела к вэб, цмв, впг, ВИЧ
-санация хронического очага инфекции(миндалины,может есть и другие) 2 раза в год. Необходимо аппаратное промывание, физиотерапия
-проверить функцию щитовидной железы (кровь на ТТГ, Т3, Т4, АНТИ-ТПО, УЗИ щитовидной железы)

Здравствуйте Карина. Признаки нехватки витаминов группы В. Рекомендую обсудить с лечащим врачом прием препарата берокка плюс на 2-3 недели.
С уважением, доктор медицинских наук, профессор. Здоровья и удачи.

Здравствуйте.В первую нужно сдать общий анализ крови,кровь на сахар,посев из зева/ носа на микрофлору и чувствительность к антибиотикам -эти анализы нужно сдать всей семье.Санация очагов инфекции( промывание лакун нёбных миндалин 2р в год) Вам так как есть хронический тонзилит.Частые рецидивы гнойных инфекций бывает на фоне сниженого иммунитета.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
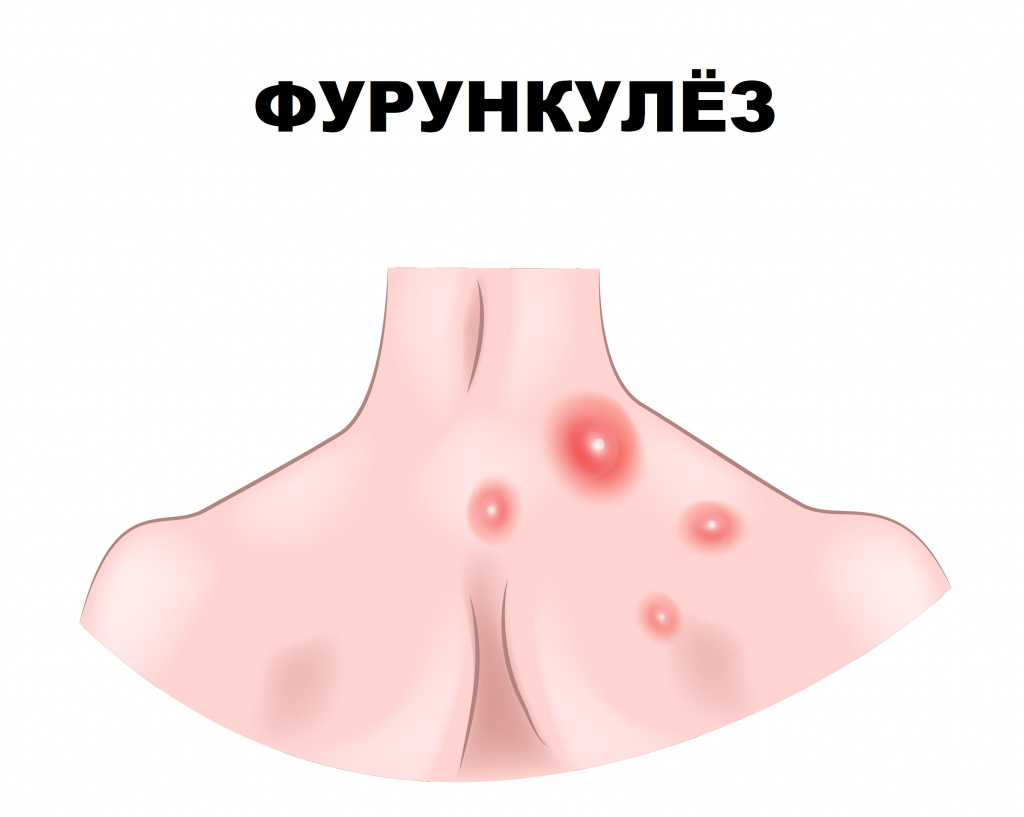
Фурункулёз: причины появления, симптомы, диагностика и способы лечения.
Определение
Фурункулез (фурункул) – острое гнойно-некротическое воспаление волосяного фолликула, сальной железы и окружающей ткани. Заболевание проявляется воспалительными элементами, которые со временем вскрываются, из них выделяется гной.
Причины появления фурункулов
Фурункулез характеризуется формированием множественных фурункулов на ограниченных участках кожи, хотя заболевание может иметь и распространенный характер. Рецидивы отмечаются на протяжении нескольких недель и даже лет.
Как правило, фурункулез возникает у людей с ослабленным иммунитетом, при гипо- и авитаминозе, несоблюдении гигиены кожи. Возбудителями фурункулов, как правило, являются стафилококки и стрептококки (S. aureus, S. haemolyticus, S. еpidermidis, β-гемолитический стрептококк). Заболевание могут вызывать и другие микроорганизмы (вульгарный протей, пневмококки, синегнойная палочка), которые в большинстве случаев выявляются в ассоциации со стафилококками и стрептококками.
Фурункулез нередко встречается у подростков и молодых людей с выраженной сенсибилизацией (повышенной чувствительностью) к возбудителям заболевания.
Описан ряд факторов, способствующих манифестации фурункулов: нарушение целостности эпидермиса (микротравмы, мацерация кожи), гипергидроз (повышенное потоотделение), смещение рН кожи в щелочную сторону, действие высоких и низких температур, ожоги, язвы. К эндогенным факторам риска развития фурункулеза относят нарушение углеводного обмена (сахарный диабет), недостаточное поступление в организм белков, хронические интоксикации, наличие очагов стафилококковой инфекции в различных органах и тканях, туберкулез, анемия, ангина, грипп, желудочно-кишечные расстройства.
Фурункул может локализоваться на любом участке кожи, за исключением ладоней и подошв, где отсутствуют волосяные фолликулы.
Наиболее опасной считается локализация фурункула на лице – в области носа и верхней губы. Здесь воспалительный процесс имеет тенденцию быстро переходить на клетчатку, где расположено разветвление передней лицевой вены. Распространение инфекции может привести к тромбозу синусов твердой мозговой оболочки головного мозга и гнойному менингиту. Летальность при этом осложнении достигает 80-100%.
Классификация фурункулеза
Острый фурункулез характеризуется формированием сразу нескольких фурункулов.
Хронический фурункулез – более длительный процесс (от нескольких недель до нескольких месяцев), когда после исчезновения одного фурункула появляются новые воспалительные элементы.
Симптомы фурункулеза
Фурункул проходит три стадии развития.
Первая стадия инфильтрации характеризуется образованием болезненного воспалительного узла диаметром 1-4 см. Кожа над фурункулом приобретает багрово-красный цвет. В местах с хорошо развитой подкожной жировой клетчаткой (ягодицы, бедра, лицо) фурункулы могут достигать еще больших размеров.
Во время второй, гнойно-некротической стадии происходит нагноение и формирование некротического стержня. Над поверхностью кожи выступает конусообразный узел, который размягчается в центре с образованием гнойника. Больных беспокоит жжение и пульсирующая боль. Значительную болезненность пациенты отмечают при локализации фурункулов на волосистой части головы, тыльной поверхности пальцев, передней поверхности голени, в наружном слуховом проходе. После вскрытия гнойника и отделения гноя с примесью крови постепенно отторгается и гнойно-некротический стержень.
Во время третьей стадии на месте фурункула образуется рубец. В зависимости от глубины воспалительного процесса рубцы могут быть или едва заметными, или выраженными.

Эволюция одного фурункула происходит в течение 7-10 дней, но когда одни фурункулы развиваются вслед за другими, болезнь затягивается на долгое время.
При фурункулезе возможно повышение температуры тела до 37,2-39°С, слабость, потеря аппетита.
Диагностика фурункулеза
Диагноз устанавливается на основании жалоб и осмотра пациента. У всех больных фурункулезом уточняются следующие вопросы:
- наличие сопутствующих заболеваний;
- принимаемые в настоящее время лекарственные препараты;
- находится ли пациент на диете.
-
клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

