Вирусный иммунодефицит при герпесе что это
Обновлено: 02.05.2024
Герпетический энцефалит. Поражение нервной системы вирусом герпеса
К вирусам герпеса относятся:
• вирус простого герпеса I и II типов,
• вирус Варицелла-Зостер,
• цитомегаловирус,
• вирус Эпштейна-Барр.
Энцефалит, вызываемый вирусом простого герпеса, — самая частая спорадическая форма острого очагового энцефалита, возбудителем которой в подавляющем большинстве случаев служит вирус простого герпеса I типа.
Вопрос о том, возникает ли заболевание в результате первичното инфицирования вирусом через обонятельную систему или реактивации латентной вирусной инфекции, персистируюшей в организме, остается открытым.
Клиническая картина характеризуется лихорадкой, головной болью, спутанностью сознания, необычным поведением, сонливостью, менингеальным синдромом, эпилептическими припадками (генерализованными, сложными парциальными), афазией, очаговыми двигательными и чувствительными нарушениями, а также верхнекватрантной гемианопсисй.
На основании клинической картины герпетический энцефалит трудноотличим от других вирусных энцефалитов или заболеваний, с которыми проводится их дифференциальная диагностика.
Изменения в ЦСЖ также соответствуют общим изменениям при вирусных энцефалитах. Диагностически важными являются КТ и особенно МРТ.
На КТ выявляются гиподенсивные очаги, а на МРТ — очаги с измененной интенсивностью сигнала в медиальной области височных долей с распространением на латеральные отделы базальных ганглиев и инсулярную кору.
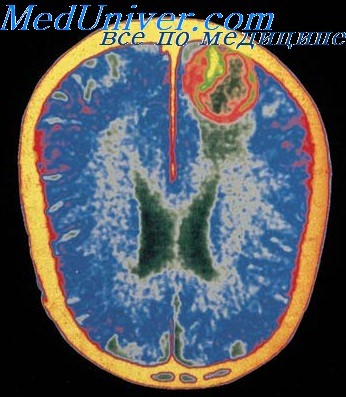
Одновременно наблюдается отек мозга, способный вызвать масс-эффект и привести к транстенториальпому вклинению. Возможны кровоизлияния в зоне воспаления. Поражение мозга в большинстве случаев резко асимметрично, поэтому дифференциальная диагностика с инсультом бывает затруднена.
Однако при инсультах практически не наблюла ется одновременного поражения зоны кровоснабжения средней (инсулярная кора, базальные ганглии) и задней (медиальные отделы височных долей) мозговых артерий. На ЭЭГ наблюдаются одно- или двусторонние периодические острые волны, регистрирующиеся каждые 2-3 секунды нал височными областями.
Серологическое исследование, выявляющее рост титра антител, не имеет значения для выбора лечения. Более раннее подтверждение диагноза можно получить с помощью ПЦР или биопсии мозга. Однако биопсия мозга редко бывает необходима лля диагностики.
Средством выбора является ацикловир (10 мг/кг в/в каждые 8 часов в течение 10 дней). С появлением ацикловира летальноегь снизилась с 60-70 до 30%. Эффективен также фоскарнет.
Вирус простого герпеса II типа вызывает генитальный герпес, но может также служить возбудителем асептического менингита, зостероподобной невропатии, вызывать задержку мочи, а у лип с иммунодефицитом — диффузный энцефалит. вирус оНоясывающего герпеса (варипелла-зостер) у детей вызывает ветряную оспу.
У взрослых может происходить реактивация вируса, приводящая к опоясывающему герпесу, что особенно часто наблюдается у пациентов с иммунодефицитом. Осложнением опоясывающего герпеса могут быть энцефалит или гранулематозный ангиит, поражающий крупные мозговые артерии. Может наблюдаться и ангиит более мелких сосудов.
Лечение состоит в применении ацикловира, валациклонира и фамцикловира, которые одинаково эффективны при заболеваниях, вызываемых вирусом варицелла-зостер.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Герпес - одно из наиболее распространенных заболеваний человека, возбудителем которого является вирус простого герпеса. В мире 90% населения заражены данным типом вируса. По данным многочисленных европейских исследований к 18 годам более 90 % жители городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, ЭпштейнБарр, герпеса человека 6 и 8го типов).
Особенность вируса простого герпеса в том, что он может скрыто находиться в организме долгое время и никак не проявлять себя. Герпес начинает активно рецидивировать, когда иммунитет человека ослаблен. Вот тогда и появляются характерные симптомы – мелкие болезненные пузырьки. Чаще всего герпес поражает кожу, глаза и наружные половые органы.
Общая информация о герпесе
Большинство людей видели у себя или у других неприятные прыщики на краю губы, которые через какое-то время покрываются корочкой. В народе этот недуг называют «простудой» или «лихорадкой». Откуда появляется это заболевание и как с ним бороться?
Установлено, что женщины в возрасте 20-35 лет являются группами риска, в которых заболеваемость генитальным герпесом составляет 135,7 случаев на 100.000 населения данного пола и возраста. В Европе среди инфекций, передающихся половым путем он, занимает второе место после трихомониаза. В США ежегодно выявляется 20.000 больных. Известно, что инфицированность вирусом в мире у подростков к 13-14 годам достигает 75%, к 35 годам почти 90%.
Как происходит заражение
Источником заражения является больной человек, у которого вирус присутствует на эпителии слизистых оболочек.
При контакте с партнёром (заражение вирусом ВПГ-2 обычно происходит при половом контакте, ВПГ-1 при оральногенитальном и половом контактах) вирус проникает через эпителий слизистой оболочки партнёра и через повреждённую кожу.
Для вируса герпеса характерна склонность к обитанию в нервных клетках. По чувствительным нервам он приникает в нервные ганглии (скопления крупных нервных клеток, отростками которых и являются нервы), где инфекция приобретает скрытое течение.
Часто рецидивирующий герпес
Программа Чек-ап "Герпес под контролем"
Стоимость услуг по прейскуранту 28330 рублей - скидка 15% = к оплате 24080 рублей.
Ваша экономия 4250 рублей!
Размножение инфекции
Размножение происходит в ядре поражённой клетки. Внедряясь в клетку, вирус герпес использует её структурные компоненты в качестве строительного материала, а также подчиняет себе синтезирующие системы клетки, "заставляя" вырабатывать вещества, необходимые для построения новых вирусов. После инфицирования клетки синтез новых вирусных белков начинается через 2 часа, а число их достигает максимума примерно через 8 ч. Наиболее быстрые темпы клонирования вирионов происходят в клетках эпителия и слизистых оболочек, крови и лимфатических тканей.
Передача вируса
Вирус передается главным образом контактным путем:
- прямой контакт (в том числе половой путь передачи),
- воздушно капельным,
- через предметы обихода и гигиены (общие полотенца, носовые платки и т.п.)
- вертикальным путями (от матери к плоду). Такое заражение может произойти во время родов (контакт с родовыми путями матери), трансплацентарно или же вирус проникает в полость матки через цервикальный канал шейки матки (восходящий путь).
Классификация вирусов
Согласно существующей международной классификации различают первичный и рецидивирующий генитальный герпес. Последний, в свою очередь, подразделяется на типичную и атипичную клинические формы и бессимптомное вирусовыделение.
Термин "генитальный герпес" возник в начале XX в. для обозначения очага поражения на коже и слизистых оболочках наружных половых органов. С развитием вирусологических методов исследования стали появляться сведения об "атипичных" формах болезни. Диагноз "атипичная форма генитального герпеса " ставится гинекологами для обозначения хронического воспалительного процесса внутренних гениталий (кольпит, вульвовагинит, эндоцервицит и т.д.) при наличии лабораторно подтвержденной герпетической природы заболевания, в отличие от "типичной" картины болезни, при которой на слизистой оболочке этих органов имеются очаги поражения с везикулезно-эрозивными элементами. Вместе с тем из этой группы выпадают герпетические поражения уретры, анальной области и ампулы прямой кишки, хотя эти органы анатомически и функционально тесно связаны с половой сферой.
Исследования, проведенные в Герпетическом Центре показали: диагностики вируса ВПГ сейчас осложняется из-за того, что в 65% случаев заболевание протекает атипично.
Как долго живет вирус?
Полностью сформированные и готовые к последующей репродукции “дочерние“ инфекционные вирионы появляются внутри инфицированной клетки через 10 ч, а их число становится максимальным через 15 ч. За все время своей жизни первичная (“материнская”) вирусная частица воспроизводит от 10 до 100 “дочерних” вирусных частиц, а в 1 мл содержимого герпетического пузырька находится от 1000 до 10 миллионов вирусных частиц. Вирионы чрезвычайно термостабильны – инактивируются (разрушаются) при 50-52 градусах в течение 30 мин, при 37,5 градусах – в течение 20ч, устойчивы при 70 град., длительно сохраняются в тканях,. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) выживает в течение 2 ч, на пластике и дереве – до 3 ч, во влажных медицинских вате и марле в течение всего времени их высыхания при комнатной температуре (до 6 ч). Уникальным биологическим свойством вирусов является пожизненное сохранение вирусов в видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения вируса) ганглиев чувствительных нервов. Наиболее активны в этом отношении вирусы простого герпеса (лабиальный и генитальный), наименее – вирус Эпштейн-Барр.
Герпесвирусы способны привести к инфицированию плода во время беременности. Беременность очень часто является физиологическим иммуносупрессивным фактором (происходит закономерное снижение иммунитета). В цервикальном канале беременных женщин значительно увеличивает риск внутриутробного инфицирования плода, а также инфицированию ребёнка в родах. Вирус наиболее распространенная у беременных инфекция, передаваемая половым путем. Поэтому перед предполагаемой беременностью будущим мамам мы рекомендуем пройти обследование на наличие вируса простого герпеса и цитомегаловирусной инфекции на слизистых половых органов, определить наличие и уровень антител к этим вирусам и при необходимости получить курс профилактического лечения.
Органы и системы организма, которые может поражать вирус простого герпеса, и заболевания которые он вызывает:
- Зрительный тракт (кератит, иридоциклит, хориоретинит, неврит зрительного нерва, флеботромбоз)
- ЛОР-органы (фарингит, «герпетическая ангина», ларингит, наружное ухо, внезапная глухота, вестибулярные расстройства)
- Органы полости рта (стоматит, гингивит)
- Кожа и слизистые оболочки ( лица, губ, генитальный герпес и пр.)
- Легкие (бронхопневмония)
- Сердечно-сосудистая система (миокардит, миокардиопатия, участие ВПГ в процессах, лежащих в основе атеросклероза)
- ЖКТ (гепатит, илео-колит, проктит)
- Женские половые органы (кольпит, внутриматочная ВПГ-инфекция: эндометрит, амнионит, хорионит, метроэндометрит, нарушения детородной функции)
- Мужские половые органы (простатит, уретрит, поражение сперматозоидов)
- ЦНС (энцефалит, симпатоганглионеврит, поражение нервных сплетений)
- Психоэмоциональная сфера (депрессия, отягощающее влияние ВПГ на течение синильной деменции и ядерной шизофрении)
- Лимфатическая система (ВПГ-лимфоаденопатия)
Памятка при заболевании
Нужно помнить, что при появлении высыпаний человек становится остро заразным. Причем могут пострадать не только окружающие, но и сам больной человек. Например, с очага на губах грязными руками вирус герпеса может быть занесен в глаза или на половые органы.
Поэтому важно соблюдать следующие правила
- Не трогайте губы, пораженные высыпаниями. Если вы к ним прикоснулись, тщательно мойте руки.
- Пользуйтесь личным полотенцем и посудой.
- Если у вас поражены губы, не выдавливайте пузырьки и не отрывайте корочки. Это может вызвать дополнительное инфицирование кожи.
- Воздержитесь от поцелуев и орально-генитальных контактов.
- Если вы пользуетесь контактными линзами, не смачивайте их слюной для увлажнения.
- Противовирусный крем на губы наносите не пальцами, а косметическими палочками.
Профилактика
Профилактика герпеса заключается, прежде всего, в укреплении иммунитета. Желательно соблюдать режим сна и отдыха, не забывать про закаливание. В период эпидемий ОРВИ и гриппа важно избегать пребывания в людных местах.
Тем, у кого часто бывают обострения герпеса, рекомендуется проверить состояние иммунитета и пройти обследование, в том числе на наличие других скрытых инфекций.
Симптомы герпеса
«Простуда на губах» возникает из-за заражения человека вирусом простого герпеса I типа (ВПГ-I). Как правило, впервые человек сталкивается с герпетической инфекцией в раннем детстве, заражаясь от больного при поцелуях или использовании общих столовых приборов. Возможно также заражение от родственников воздушно-капельным путем при чихании и кашле.
Наиболее частой формой инфекции, вызванной ВПГ-I, является герпес лица, то есть «простуда на губах». Причем при первом эпизоде ВПГ у ребенка нередко поражаются не только губы, но и кожа в области носогубного треугольника, и слизистая носа. Бывают также герпетический стоматит и герпетическая ангина. Затем вирус распространяется по нервам и навсегда «селится» в нервных ганглиях. По статистике, вирусом ВПГ-I заражены до 90-95% людей. Но проявляется эта инфекция по-разному. Более чем у 80% инфицированных вирус находится в неактивной форме и не дает о себе знать.
Однако у 17—20% людей вирус ВПГ-I периодически «просыпается» и начинает активно размножаться. Этот процесс называется рецидивом и сопровождается появлением высыпаний на лице.
К наиболее частым факторам, способным спровоцировать рецидив герпеса, относятся:
- переохлаждение;
- простуда и другие вирусные или бактериальные инфекции;
- переутомление;
- стресс;
- травма;
- менструация;
- «жесткие» диеты, гиповитаминоз и истощение;
- чрезмерное увлечение загаром.;
Вирус при этом может поражать любой участок кожи или слизистых оболочек организма. Но чаще всего при рецидиве мишенью становятся губы и слизистая носа. У некоторых герпес на лице возникает лишь изредка, являясь в основном косметическим недостатком. Но для людей с резко сниженным иммунитетом наличие в организме вируса может стать серьезной проблемой. Так, к примеру, у больных СПИДом, онкологических пациентов, людей, перенесших трансплантацию органов, обычный вирус герпеса может вызвать поражение внутренних органов.
Лечение герпеса
против вируса простого герпеса
(ВПГ) Ι и ΙΙ серотипов
Рецидивы, поражающие губы или слизистую носа, неплохо поддаются местному лечению кремом или мазью. В более тяжелых случаях врач может порекомендовать таблетки.
Необходимо помнить, что раннее начало лечения герпеса – залог успеха. Перед появлением пузырьков губы становятся очень чувствительными, возникает зуд и покалывание. И если заболевание начать лечить на стадии этих предвестников, то высыпания могут и не появиться, а выздоровление наступит в кратчайшие сроки.
На сегодня не существует лекарств, которые бы полностью уничтожали вирус герпеса в организме человека. Однако существует группа специальных противовирусных средств, эффективно подавляющих размножение ВПГ-I.
Если противовирусный крем начать использовать при уже имеющихся высыпаниях, заживление наступает быстрее, чем при лечении другими способами.
Со способностью вируса простого герпеса поражать клетки белой крови (лейкоциты, лимфоциты) связана еще одна особенность герпетической инфекции. Очень часто заболевание протекает на фоне сниженного иммунитета. Клинически иммунодефицитное состояние, сопровождающее рецидивирующий герпес проявляется чувством глубокой усталости, болезненной раздражительности, депрессии, боязни сквозняков, частых простуд, ознобов, ничем необъяснимым повышением температуры тела и, конечно, пузырьками на губах или под носом.
Клинические проявления простого герпеса у человека характеризуются многообразием и зависят от локализации очага поражения, давности заболевания, возраста больного, состояния его иммунной и нервной систем, - факторов, которые определяют тяжесть и распространенность заболевания, риск развития осложненных форм болезни.
Важную эпидемиологическую роль играют бессимптомные формы герпеса лица, особенно в свете распространения практики орогенитальных контактов. При изучении динамики выделения вируса простого герпеса из слюны при отсутствии герпетических высыпаний на лице было выявлено, что 7,4% образцов содержали вирус герпеса в слюне. Частота выделения вируса герпеса со слюной увеличивалась до 21%, если обследуемые страдали ОРВИ и достигала 17% после стоматологических процедур. В период рецидивов герпеса губ вирус выявляется в слюне в 3 раза чаще, чем вне рецидивов.
Вирусемия у женщин во время беременности при любой локализации рецидивирующего герпеса и при бессимптомных формах может явиться причиной гибели плода, мертворождения, преждевременных родов. Герпесвирусы вызывают до 30% спонтанных абортов на ранних сроках беременности и свыше 50% поздних выкидышей, занимают второе место после вируса краснухи по тератогенности (развитие уродств плода).
Часто рецидивирующий герпес
Программа Чек-ап "Герпес под контролем"
Стоимость услуг по прейскуранту 28330 рублей - скидка 15% = к оплате 24080 рублей.
Ваша экономия 4250 рублей!
В статье представлены многолетние данные об особенностях течения патологии иммунной системы у детей различных возрастных групп (от 9 месяцев до 17 лет), инфицированных 4 типом герпеса – вирусом Эпштейна-Барр (ВЭБ). Убедительно продемонстрирована непосредственная связь между наличием инфекционного агента и реализацией многообразных проявлений заболеваний – от инфекционных до неопластических. Доступно разъяснены формулировки основных терминов в иммунологии и приведен диагностический алгоритм обследования детей на ВЭБ. Проведенные клинико-иммунологические исследования наглядно демонстрируют необходимость комплексного обследования детей с функциональными нарушениями в системе иммуногенеза с обязательной оценкой уровня инфекционной (вирусной) контаминации. Анализ результатов собственных клинико-иммунологических исследований позволяет предложить алгоритм комплексного обследования детей с функциональными нарушениями в системе иммуногенеза, включив в него изучение уровня вирусной нагрузки в качестве необходимого компонента.

1. Бархатова Т.В., Сенягина Н.Е., Краснов В.В. Распространенность маркеров герпес-вирусных инфекций при патологии почек у детей // Журнал инфектологии. – 2011. – 3 (3). - C. 46-51.
2. Дидковский Н.А., Малашенкова И.К. Синдром хронической усталости // Русский медицинский журнал. - 1997. - № 12. - С. 1.
3. Змушко Е.И., Белозеров Е.С., Митин Ю.А. Клиническая иммунология : руководство для врачей. – СПБ., 2001. – 576 с.
5. Лобзин Ю.В., Белозеров Е.С., Беляева Т.В., Волжанин В.М. Вирусные болезни человека. – СПб. : СпецЛит, 2015. – 400 с.
6. Малашенкова И.К., Дидковский H.A., Сарсаниа Ж.Ш. Выявление вирусоспецифических антител при хронической Эпштейна-Барр вирусной инфекции // Пятый Конгресс РААКИ. - М., 2002. - Т. 2. - С. 90.
9. Хаитов Р.М. Вторичные иммунодефициты: клиника, диагностика, лечение // Иммунология. - 1999. - № 1. - С. 14-17.
11. Evans A.S., Niederman J.C. 1982. Epstein-Barr virus // Viral Infection of Humans, Epidemiology and Control. – 2-nd ed. / Ed. A.S. Evans. - New York : Plenum Medical Book Company, 1982. - P. 253-281.
12. Hiroshi K., Makoto M., Yumi Y. et al. Quantitative Analysis of Epstein-Barr Virus Load by Using a Real-Time PCR Assay // J. Clin. Microbiol. - 1999. - Vol. 37 (1). - P. 132-136.
13. Human Herpesviruses: Biology, Therapy, and Immunoprophylaxis / Eds A. Arvin, G. Campadelli-Fiume et al. – Cambridge : Cambridge University Press, 2007 : 1432. - P. 929-935.
Актуальность. До сегодняшнего времени сохраняются споры по вопросам этиопатогенеза герпетических инфекций и соотношения данного класса вирусных агентов к супрессии иммунной системы. В данном контексте необходимо дать несколько пояснений в отношении особенностей патогенеза инфекций семейства герпес. Цитируем Ю.В. Лобзина с соавторами [5]: «практически пожизненное сохранение герпесвирусов в организме человека объясняется способностью вирусной ДНК изменять фенотипические свойства клеток хозяина – трансформация клеток. В результате трансформации запускаются иммунопатологические реакции, направленные против организма человека и проявляющиеся вирусиндуцированной иммуносупрессией».
Вторым понятием, требующим разъяснения, является понятие вирусиндуцированной иммуносупрессии. Представление о том, что инфекция – процесс, полностью зависимый от микроорганизма, доминирует в сознании врачей. Те же важнейшие нарушения в системе иммунитета организма, которые предшествуют ей, т.е. иммунодефициты, – игнорируются. Хотя индукция и интенсивность инфекционного процесса зависят от дозы, вирулентности, пути проникновения возбудителя, однако главным является степень недостаточности естественного или приобретенного иммунитета макроорганизма. Именно недостаточность иммунитета – относительный (к данному возбудителю) или абсолютный иммунодефицит – в каждой конкретной ситуации служит определяющим фактором развития инфекции. Инфекция, как фактор индукции, способствует реализации инфекционно-индуцированного иммунодефицита. Цитируя Д.К. Новикова [7; 8], необходимо говорить об иммунодефицитных болезнях (по МКБ-10) – болезнях иммунной системы как «врожденных (внутриутробных, антенатальных – примечание автора статьи), генетических или приобретенных структурных и/или недостаточностей какого-то звена в системе иммунитета, клинически проявляющихся рецидивами инфекции, вызванной вирусами, бактериями, грибами, паразитами». Из иммунодефицитных болезней вторичные иммунодефициты встречаются гораздо чаще первичных. Обычно вторичные иммунодефициты развиваются на фоне воздействия на организм неблагоприятных факторов окружающей среды или различных инфекций.
Продолжая цитировать «первоисточники», на которые достаточно часто опираются специалисты в области иммунологии и аллергологии, необходимо отметить, что приведенные определения касаются позднего постнатального периода. Так, в учебной литературе Р.М. Хаитова [10] под вторичным иммунодефицитом (ВИД) понимают такие нарушения иммунной системы, которые развиваются в позднем постнатальном периоде или у взрослых и, как принято считать, не являются результатом какого-то генетического дефекта. Среди ВИД условно можно выделить три формы: приобретенную, индуцированную и спонтанную.
К сожалению, именно данные определения ВИД применяются во всех возрастных группах, в том числе у детей. Достаточно своеобразно трактуются и формы ВИД, особенно спонтанная – «беспричинная». Такая трактовка уводит врача-клинициста от диагностического поиска, необходимости найти причину заболевания. Вновь обращаясь к работам Р.М. Хаитова [9; 10], необходимо отметить, что автор достаточно четко дает определение индуцированным ВИД - «это такие состояния, возникновение которых связано с какой-то конкретной причиной: рентгеновское облучение, кортикостероиды, цитостатики, травмы и хирургические операции, а также нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию (диабет, заболевания почек и печени, злокачественные процессы и т.д.). Вероятно, не полностью расшифрованный перечень причин («и т.д.») не позволяет определенной категории врачей соотнести с этим «т.д.» и инфекции! Также не рекомендуется применять неопределенные понятия, такие как «иммунодефицитное состояние», «иммунологическая недостаточность», так как их нельзя диагностировать или лечить как болезнь.
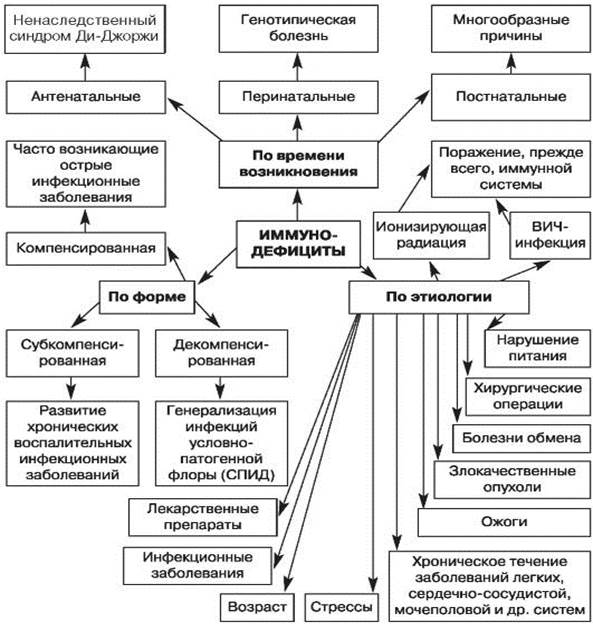
Рис. 1. Классификация вторичных иммунодефицитов по времени возникновения, этиологии, форме (по Белозерову Е.С. и др., 1992) [3]
Подводя итог в теоретической составляющей статьи – актуальности, необходимо обобщить следующее.
В педиатрии (17 лет 11 месяцев и 29 дней) в доминирующем большинстве речь идет об антенатальных и перинатальных иммунодефицитных болезнях, вторичных по отношению к анатомо-морфологическому субстрату иммунной системы – функциональных.
Таким образом, заключение врача-иммунолога должно быть сформулировано следующим образом. Антенатальная (или функциональная) иммунодефицитная болезнь, смешанного типа (или, при возможности, по отдельным звеньям, что мало вероятно), комбинированная индукция (инфекционная, гипоксическая и т.д.) с клиническими проявлениями основных синдромов – инфекционного, аллергического, аутоиммунного, неопластического и/или лимфопролиферативного.
Данные теоретические изыскания легли в основу целого цикла научно-исследовательских работ. Одно из таких исследований представлено в данной статье и посвящено исследованию иммуноиндуцирующей роли герпеса 4 типа - вируса Эпштейна-Барр у детей.
Цель: изучение особенностей клинических проявлений у детей с герпес-индуцированными формами иммунодефицитов (на примере 4 типа герпеса).
Материалы и методы. Клинико-иммунологические исследования были проведены у 320 детей в возрастном диапазоне от 9 месяцев до 17 лет. В группу исследования были также включены дети, имеющие инвалидизирующие виды патологии (детский церебральный паралич), с высоким инфекционным индексом не менее 6 раз в месяц, с неопластическими процессами, «пограничными» состояниями (лейкемоидные реакции, лимфоаденопатии). Клиническая оценка состояния здоровья детей осуществлялась в виде комплексного осмотра педиатра (номенклатура медицинских услуг). Также исследования включали в себя общелабораторные исследования - общий анализ крови, иммунологический профиль 2 уровня (реакция непрямой иммунофлюоресценции, ИФА крови), этиологические исследования (метод ИФА специфических иммуноглобулинов, ПЦР-исследования биологических субстратов – содержимое слизистых оболочек носа, зева, мочи).
Результаты собственных исследований и обсуждения. Небольшая историческая справка: двойную «фамилию» вирус получил в честь канадских ученых Мишеля Эпштейна и Эвелин Барр, так как именно им в 1964 году впервые удалось выделить его из клеток злокачественной лимфомы. Этот вирус отнесли к вирусам герпеса четвертого типа. Он имеет сложное строение и содержит ДНК. Хорошо переносит низкие температуры (до минус 70 °С) и высушивание, но быстро погибает под воздействием температуры выше 60 °С, ультрафиолетового облучения и дезинфицирующих средств. Передается вирус воздушно-капельным путем, преимущественно со слюной инфицированного человека. Возможны также гемотрансфузионный и половой пути передачи [2; 4]. Описаны случаи вертикальной передачи ВЭБ от матери плоду. Распространен вирус Эпштейна–Барр (ВЭБ) повсеместно. По статистике, в развивающихся странах и социально неблагополучных семьях большинство детей заражаются им к трем годам, а все население – к 16–18. В развитых странах такое распространение инфекции наступает чуть позже. Вирусом Эпштейна–Барр инфицировано от 80 до 100% взрослого населения любой страны. Наиболее известное и хорошо изученное заболевание, причиной которого является вирус Эпштейна–Барр – это инфекционный мононуклеоз. Ученые полагают, что этот вирус может быть причиной развития внутриутробных аномалий плода. Наряду с возбудителями токсоплазмоза, краснухи, цитомегаловирусной и герпес-инфекции первого и второго типов он входит в группу так называемых ТОRCH-инфекций. Установлено, что ВЭБ причастен к развитию аутоиммунных заболеваний, рассеянного склероза, некоторых форм гепатита, опухолей желудка, селезенки, вилочковой железы, синдрома хронической усталости и иммунной депрессии. Кроме того, он является причиной злокачественных заболеваний – лимфомы Беркитта, назофарингеальной карциномы и саркомы Капоши. Реактивация ЭБВИ (Эпштейна-Барр вирусная инфекция) и хроническое течение данной инфекции нередко развивается у пациентов со сниженной активностью иммунной системы. Наиболее характерные признаки хронической ЭБВИ – длительная субфебрильная температура тела (дольше 6 месяцев), слабость, потливость, боли в мышцах и суставах, затрудненное носовое дыхание, головокружение, нарушение сна, снижение памяти, внимания и интеллекта, эмоциональная лабильность. Как правило, эти симптомы сопровождаются увеличением лимфатических узлов, печени и селезенки. Возможно развитие пневмонии, угнетения активности костного мозга, гепатита. Исходами острой ЭБВИ, по данным И.К. Малашенкова и соавторов (2002) [6], являются выздоровление, латентная инфекция и хроническая рецидивирующая ЭБВИ. Исследованиями отечественных и зарубежных авторов установлено, что клиника хронической ЭБВИ у взрослых характеризуется наличием длительных симптомов интоксикации, лимфаденопатии, гепатоспленомегалии, тонзиллита, аденоидита, у части больных ? интерстициальной пневмонии, увеита, гепатита, патологии ЦНС и др. [2; 4; 5]. Что касается детей, то имеются лишь отдельные работы, посвященные описанию немногочисленных групп больных с хронической ЭБВИ. Кроме того, несмотря на многообразие методов лабораторной диагностики ЭБВИ (серологические методы, молекулярная гибридизация, полимеразная цепная реакция), до настоящего времени нет единства во взглядах ученых на информативность применяемых методик для определения формы и стадии инфекционного процесса.

Рис. 2. Частота распределения клинических проявлений у детей с герпесиндуцированными иммунодефицитами

Рис. 3. Иммунологические особенности (типы распределения) у детей с герпесиндуцированными иммунодефицитами
ИФА, проведенный у детей, выявил 100% контаминацию вирусом ЭБ. Определялась следующая совокупность специфических антител:
- IgM к VCA (к капсидному антигену) – выявляются в крови в первые дни и недели болезни, максимально сохраняются до 3-4 недель;
- IgG к VCA (к капсидному антигену) – появляются в крови спустя 1-2 месяца от начала болезни, затем постепенно снижаются и сохраняются на пороговом (низком уровне) пожизненно. Повышение их титра характерно для обострения хронической ЭБВИ;
- IgM к EA (к раннему антигену) – появляются в крови в первую неделю заболевания, сохраняются в течение 2-3 месяцев и исчезают. Могут сохраняться в высоких титрах длительное время (более 3-4 месяцев), тревожно в плане формирования хронической формы ЭБВИ. Появление их при хронической инфекции служит индикатором реактивации;
- IgG к ЕA (к раннему антигену) – появляются к 3-4-й неделе заболевания, становятся максимальными на 4-6-й неделе болезни, исчезают через 3-6 месяцев. Появление высоких титров повторно указывает на активацию хронической инфекции;
- IgG к NA-1 или EBNA (к нуклеарному или ядерному антигену) – являются поздними, поскольку появляются в крови через 1-3 месяца после начала заболевания. При этом острофазные антитела выявлялись (IgM к VCA и IgM к EA) у 42 детей (13,1%), у 268 (83,7%) детей титры антител (IgG VCA + IgG к NA-1 или EBNA) значительно превышали нормативные и достигали значений более 160, у 10 (3,1%) детей диагностически значимых титров выявлено не было [9; 13] (рис. 4).

Рис. 4. Серологические исследования у детей с герпесиндуцированными иммунодефицитными болезнями
Клинические, иммунологические и этиологические сопоставления выявили следующие закономерности.
У детей с грубой неврологической симптоматикой диагностировались иммуносупрессорные изменения с резким увеличением титра антител к вирусу ЭБ. Дети, часто и длительно болеющие, имели разнонаправленные изменения: от иммуносупрессорных до активационных в системы гуморального звена, цитотоксической защиты (В-лимфоциты, иммуноглобулины класса «G», CD16+ и CD25+ клетки), уровень CD95+ клеток был преимущественно снижен.
Отдельно хочется остановиться на методах ПЦР-диагностики. В литературе активно обсуждается вопрос об использовании ПЦР для исследований на инфекции семейства герпес в различных биологических субстратах. Здесь необходимо понимать, что данный метод, особенно при использовании его для исследования плазмы, имеет свои особенности – он всегда количественный! Определение качественное не имеет смысла, так как инфекция пожизненно персистирует в организме человека. Как у больных ЭБВИ, так и у носителей может быть положительная ПЦР. Поэтому для их дифференцировки проводится ПЦР-анализ с заданной чувствительностью: для носителей до 10 копий в пробе, а для активной инфекции – 100 копий в пробе. Специфичность данного метода хоть и достигает 100%, при этом не исключает ложноположительные результаты, т.к. ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов с отсутствием репликации в момент исследования [5; 9].
В результате проведенного нами исследования, ПЦР крови всегда имела отрицательный результат, даже у детей с неопластическими процессами. Распределение ПЦР-положительных результатов у детей со слизистых оболочек (ротоглотка, нос) и мочи имело следующее цифровое распределение.
Положительные реакции с 3 биологических объектов имели 36 детей (11,25%), у 62 положительные ПЦР реакции были с зева и носа – 19,38%, у 43 детей диагностировали положительный результат только с зева (13.44%), и 71 ребенок имели положительные значения ПЦР со слизистой оболочки носа (22,19%). Положительные значения только в моче имели 51 ребенок (15,94%). Остальные дети (в количестве 57) имели отрицательный результат ПЦР-исследований с биологических сред.
Дети с неопластическими процессами, длительным субфебрилитетом, лейкемоидной реакцией, лимфоаденопатией имели признаки активации хронической инфекции, резкое увеличение CD95+ клеток, положительные маркеры наличия и обострения ВЭБ в ИФА и ПЦР-исследованиях.
Таким образом, все дети имели индуцированные формы функциональной иммунодефицитной болезни, доминирующей причиной которой являлся вирус ЭБ. Проведенные предварительные клинико-иммунологические исследования наглядно демонстрируют необходимость комплексного обследования детей с функциональными нарушениями в системе иммуногенеза с обязательной оценкой уровня инфекционной (вирусной) контаминации. Выявление основных причин трактуется необходимостью применения комплексных методов лечения, в т.ч. и с применением противовирусных препаратов.
Клиника и диагностика поражений вирусом простого герпеса при иммунодефиците
Поражение лица и ротоглотки наиболее типично для реактивации герпесвирусной инфекции. Морфология герпетических высыпаний зависит от типа пораженной эпителиальной ткани. На красной кайме губ и коже лица первичными элементами являются мелкие везикулы, которые возникают последовательно, имеют тенденцию к быстрому слиянию и формированию крупного вялого пузыря. Эти элементы умеренно болезненны, типично ощущение жжения.
После отторжения некротизированного эпителия обнажаются эрозированные кровоточащие поверхности, по краям которых появляются новые мелкие везикулы, и элемент начинает расти от центральной части к периферии.
Суперинфицирование элементов часто приводит к возникновению глубоких некрозов, заживающих с формированием рубца. Поражение лица вирусом герпеса следует дифференцировать от поражения зигомицетами (Absidia, Rhisopus, Mucor) и Aspergillus, которые вызывают тяжелые некрозы тканей лица, расплавление хрящей и костей лицевого скелета с быстрым обезображиванием внешнего облика пациента.
На слизистой оболочке рта наиболее типичным является возникновение нескольких одинаковых поверхностных некротических элементов диаметром 1—3 мм, которые затем углубляются и увеличиваются в размерах, часто сливаются. В самых тяжелых случаях значительная площадь полости рта поражена крайне болезненными глубокими некрозами серого цвета с кровоточащими участками эрозий.
В прошлом, до введения всеобщей профилактики ацикловиром, у больных после ТКМ герпетические поражения ротоглотки нередко становились причиной обструкции верхних дыхательных путей, в связи с чем возникала необходимость в протективной интубации трахеи.
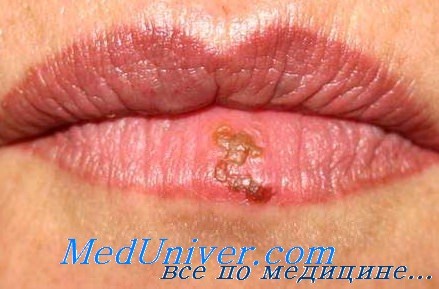
Герпетические элементы практически всегда суперинфицируются разнообразной оральной флорой: грибами рода Candida, стрептококками, фузобактериями и другими анаэробами, реже грамотрицательными бактериями, особенно стремительно в условиях нейтропении. Для практики полезно считать, что при нейтропении не бывает изолированных герпетических поражений полости рта, и стоматиты, объединяемые клиницистами под термином «герпетические», всегда являются результатом комбинированного вирусно-бактериально-грибкового поражения.
Стоматиты чаще всего возникают на фоне тяжелой нейтропении, обратное развитие претерпевают только по выходе из агранулоцитоза, полностью регрессируя через 5—12 дней после нормализации числа гранулоцитов. Заживление элементов всегда происходит от краев к центру — симптом «высыхающей лужи».
Процесс заживления глубоких некрозов часто проходит стадию отторжения фибриновых пленок с обнажением ригидных сосудов десен, что может быть чревато значительной кровопотерей, особенно у детей младшего возраста. Мы наблюдали кровотечения из язв на деснах в объеме до 400 мл в сутки. Кроме того, заживление язв нередко сопровождается обильной саливацией: потерей до 700—900 мл слюны в сутки, что может стать причиной обезвоживания у детей.
Знание закономерностей развития герпетического стоматита позволяет сделать вывод, что при нейтропении лечение его нельзя ограничивать ацикловиром: необходимо назначать препараты, активные в отношении стрептококков, анаэробов, грамотрицательной флоры и грибов. Монотерапии, отвечающей таким требованиям, не существует, поэтому при фебрильной нейтропении, сопровождающейся стоматитом, мы наряду с ацикловиром всегда используем бета-лактам с расширенным спектром антианаэробной активности (пиперациллин/тазобактам, имипенем, амоксициллин/клавуланат) либо к другим бета-лактамам добавляем метронидазол.
Часто драматического улучшения удается добиться при использовании клиндамицина или пенициллина. Кроме того, мы рекомендуем и сами всегда используем системную противогрибковую терапию.
Поражение вирусом простого герпеса пищевода
При распространении инфекции из полости ротоглотки поражается верхний сегмент пищевода. Другой путь — контаминация инфицированной герпес-вирусом слюной эрозированного (в результате желудочно-пищеводного рефлюкса или рвоты) пищевода. В этом случае поражается нижний сегмент пищевода. Клиническая картина среднего и дистального эзофагита очень типична: больные жалуются на ощущение кома за грудиной, сильное жжение и боли, которые значительно усиливаются после глотания и рвоты.
Следует отметить, что последняя локализация — одно из самых опасных проявлений герпесвирусной инфекции, поскольку именно дистальный эзофагит служит воротами для развития инвазивных бактериальных и грибковых инфекций. По морфологической картине (язвенно-некротические элементы, захватывающие все слои пищевода) отличить герпетическое поражение от цитомегаловирусного, бактериального или грибкового не представляется возможным. Без проведения биопсии установить точный микробиологический диагноз невозможно.
Если принято решение выполнить эзофагоскопию и биопсию, то для диагностики герпес-вирусного поражения необходимо получить биоптат эпителия края язвы, а для диагностики ЦМВ-поражения — ее дна. Это связано с тем, что герпес-вирус поражает эпителий, а цитомегаловирус — строму.
При герпетическом эзофагите, как и при герпетическом стоматите, особенно больным с фебрильной нейтропенией, наряду с ацикловиром всегда следует назначать антимикотик системного действия (амфотерицин В внутривенно в дозе 0,3—0,5 мг/кг в сутки, флюконазол внутривенно или внутрь, возможно вориконазол и итраконазол) и системные антибиотики, обладающие антианаэробной активностью.
Важную роль играют антацидная и антирефлюксная (ранитидин или омепразол, дофаминовые антагонисты) терапия и адекватное обезболивание наркотиками.
Поражение бронхиального дерева и легких вирусом простого герпеса
Чаще всего герпетический трахеобронхит развивается у иммунокомпрометированных больных с герпетическим эзофагитом, которые интубированы и находятся на искусственной вентиляции легких. Наблюдаются также фокальные герпетические пневмонии. Диффузные пневмонии с развитием дыхательной недостаточности, напротив, являются следствием диссеминированной герпетической инфекции у больных с глубоким дефицитом клеточного или гуморального иммунитета.
Поражение вирусом простого герпеса центральной нервной системы
Герпетический энцефалит — очень редкое проявление реактивации герпесвирусной инфекции у онкогематологических больных. Он не отличается от энцефалита у иммунокомпетентного хозяина, т. е. характеризуется энцефалитическим синдромом и признаками воспаления и некроза на компьютерных и ядерно-магнитных томограммах. Поражение спинного мозга вирусом герпеса является казуистикой. Описаны случаи восходящего поперечного миелита.
Диагностика поражений вируса простого герпеса
Известно несколько методов быстрой и специфической диагностики герпесвирусной инфекции. Классическим методом является выделение вируса, основанное на его цитопатическом действии на чувствительные культуры клеток млекопитающих. Этот метод достаточно быстрый (90 % позитивных результатов в первые 3 дня, 100% —в первые 7 дней культивирования) и весьма специфичный.
Существует более быстрый метод (комбинация иммуноферментного и культурального методов), которым выявляют наличие вирусных антигенов в чувствительной клеточной культуре, зараженной исследуемым материалом. Этот метод аналогичен описанному ранее методу shell vial для ЦМВ и позволяет получить результаты в течение суток.
Следует отметить, что, как и при ЦМВ-инфекции, серологические данные (наличие специфического IgM или повышение титра IgG) и выделение вируса простого герпеса со слюной не несут полезной оперативной информации. Особенно важно это при диагностике герпесвирусного энцефалита. Нам доводилось наблюдать неадекватную интерпретацию серологических тестов у больных с энцефалитическим синдромом и необоснованное назначение ацикловира в высоких дозах. Единственным надежным методом диагностики является проведение биопсии ткани головного мозга и вирусологического исследования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

