Вирус папилломы человека при кольпоскопии
Обновлено: 03.05.2024
Вирус папилломы человека (ВПЧ) - ДНК-содержащий вирус семейства Papillomaviridae. В это семейство входят распространенные и генетически разнообразные вирусы, инфицирующие и поражающие клетки эпителия (кожа, слизистые аногенитальной области, ротовой полости).
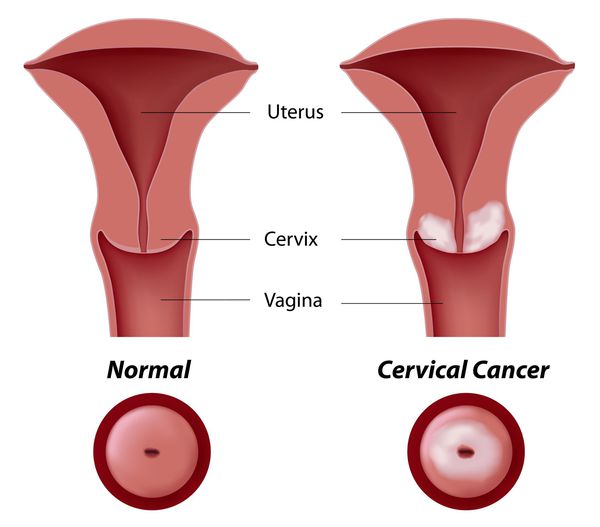
Известно более 130 генотипов ВПЧ. По клинической классификации их делят на кожные и аногенитальные типы папилломавирусов. Именно аногенитальные типы ВПЧ вызывают поражения слизистых оболочек влагалища и шейки матки. Самые безобидные из этих заболеваний - доброкачественные остроконечные кондиломы половых органов, самое опасное - рак шейки матки.
Передаются вирусы папилломы человека при половых контактах. С началом половой жизни этим вирусом заражается подавляющее большинство женщин. Следует учитывать, что риск заражения ВПЧ зависит и от количества половых партнёров и от сексуального поведения единственного партнёра (распространенность ВПЧ у мужчин примерно равна распространенности среди женщин).
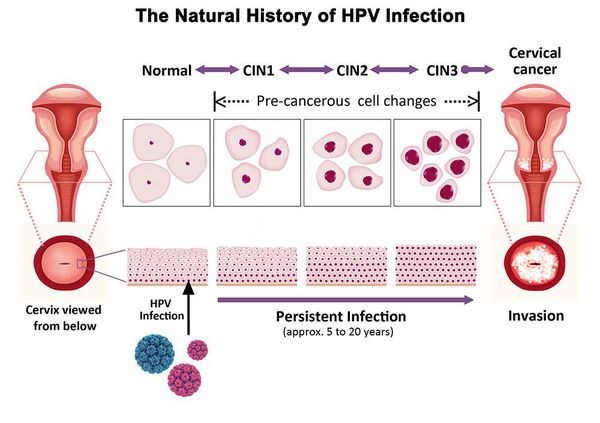
Сама по себе папилломавирусная инфекция - не заболевание. Через 6-18 месяцев у ~80% инфицированных женщин вирус уходит из организма самостоятельно, без какого-либо лечения, не вызывая болезней (спонтанная элиминация). И только у небольшого процента женщин с хронической (персистентной) инфекцией, обусловленной высокоонкогенными генотипами ВПЧ, через 10-20 лет может развиться рак шейки матки. Кажется, времени для успешной диагностики и лечения вполне достаточно, но расслабляться не стоит.
Папилломавирусная инфекция очень коварна, и связанные с нею предраковые изменения, как правило, не только не вызывают никакого беспокойства и дискомфорта, но часто и не обнаруживаются при обычном гинекологическом осмотре.
Поэтому для выявления папилломавирусной инфекции применяется ВПЧ-тест методом полимеразной цепной реакции (ПЦР). ВПЧ-тест - надежный помощник врача: обнаружение папилломавируса и определение его генотипа позволяет определить дальнейшую тактику ведения и лечения женщины.
При этом нужно учитывать, что выявление ВПЧ группы высокого канцерогенного риска у женщин не является основанием для постановки диагноза злокачественной опухоли, но служит поводом к дальнейшему обследованию, более интенсивному наблюдению и, при необходимости, лечению предраковых изменений слизистой шейки матки.
Исход ВПЧ-инфекции зависит от генотипа вируса. Все папилломавирусы подразделяются на группы по «вредности» или «онкогенности». ВПЧ-тесты методом полимеразной цепной реакции (ПЦР) позволяют выявить все распространённые и клинически значимые генотипы ВПЧ.
К группе низкого канцерогенного риска относятся 6, 11 генотипы ВПЧ: они могут быть причиной остроконечных кондилом и дисплазий легкой степени. Анализ на ВПЧ 6 и 11 генотипов применяется для дифференциальной диагностики с заболеваниями не папилломавирусной этиологии и при обследовании беременных для оценки риска развития папилломатоза гортани у новорожденных.
К раку шейки матки чаще всех приводят 16 и 18 генотипы папилломавирусов. Они, вместе с 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68 типами входят в группу высокого канцерогенного риска. При проведении анализов на вирус папилломы человека именно на эти генотипы нужно обращать особое внимание. Наиболее важен анализ ДНК ВПЧ 16 типа и 18 типа, особенно, если их концентрация («вирусная нагрузка») высока. А онкогенный потенциал 51 и 56 типов не так велик, поэтому они менее опасны, даже если в анализе на ВПЧ присутствуют в относительно большом количестве.
Сдать анализ на ВПЧ у женщин методом ПЦР (ВПЧ-тест) можно самостоятельно, без направления врача. Если ВПЧ-инфекция не выявлена (отрицательный результат ВПЧ-теста), то риск развития рака шейки матки низок. Но следует помнить - при продолжении активной половой жизни риск инфицирования ВПЧ сохраняется.
При положительном результате ВПЧ-теста, обнаружении ВПЧ высокого канцерогенного риска, необходимо сделать расширенное исследование для уточнения генотипа вируса (анализ ВПЧ – типирование) и «вирусной нагрузки» (вирус папилломы человека - количественный анализ). Затем необходимо обратиться к врачу-гинекологу для проведения кольпоскопии - осмотра шейки матки под увеличением с помощью специального прибора - кольпоскопа.
Все дополнительные анализы на вирус папилломы человека и другие исследования должны проводиться по назначению и под контролем врача.
Если поражение слизистой шейки матки выявлено на ранней стадии, предшествующей раку, то лечение более эффективно и практически не имеет побочных эффектов. Если не обнаружено никаких патологических изменений слизистой шейки матки, то и необходимости в лечении нет: вероятнее всего, организм справится с вирусом самостоятельно.
Однако через 1 год необходимо пройти повторное ВПЧ-тестирование и, если вирус все еще присутствует, снова обследоваться у врача-гинеколога.
Анализ на вирус папилломы человека (ВПЧ) методом ПЦР и цитологические исследования.
В России в систему обязательного медицинского страхования (ОМС) включено цитологическое исследование - «мазок на онкоцитологию». Нужны ли тогда ВПЧ-тесты?
Основой современных скрининговых программ раннего выявления онкологической патологии шейки матки является цитологическое исследование по Папаниколау (ПАП-тест, окраска по Папаниколау). К сожалению, далеко не во всех российских медицинских учреждениях используется эта методика, очень часто применяются другие, менее совершенные способы приготовления (окраски) цитологического мазка.
Кроме того важно знать, что цитологический метод – это не анализ на вирус папилломы человека. Цитология «не видит» сам вирус, а выявляет клетки эпителия, уже измененные под его воздействием, то есть клиническую и субклиническую формы ВПЧ-инфекции. У цитологического теста есть и весьма существенные недостатки - низкая чувствительность, субъективность трактовки и зависимость результата от качества взятия цитологического мазка.
Именно поэтому для традиционного цитологического скрининга характерно большое количество ложноотрицательных и неопределенных результатов, требующих повторных исследований.
Для уменьшения возможности ошибок цитологические тесты были усовершенствованы – внедрён метод жидкостной цитологии. Жидкостная цитология – новая технология приготовления образцов клеток из шейки матки для цитологического исследования. Преимущества данного метода - уменьшение количества неадекватных мазков, артефактов, возможность избежать загрязнения проб воспалительным экссудатом, эритроцитами, что обеспечивает высокое качество цитологических препаратов. Сегодня именно этот метод цитологического скрининга заболеваний шейки матки рекомендован ВОЗ (Всемирной Организацией Здравоохранения) в качестве «золотого стандарта» для исследований цервикальных мазков.
Согласно последним международным и отечественным рекомендациям совместное применение анализа на ВПЧ (ВПЧ-теста методом ПЦР) и цитологического исследования (ПАП-теста) является предпочтительным методом для раннего выявления онкологической патологии шейки матки у женщин старше 29 лет. Такой скрининг необходимо проходить регулярно - один раз в 3 года.
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Причины дисплазии шейки матки
Папилломавирусная инфекция (ВПЧ) — основная причина дисплазии и рака шейки матки. К болезни приводит длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
К факторам риска дисплазии шейки матки относится длительный приём контрацептивов и курение. Выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Другие факторы риска — раннее начало половой жизни, большое число и частая смена половых партнеров, употребление алкоголя, сопутствующие половые инфекции, много беременностей и родов. Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
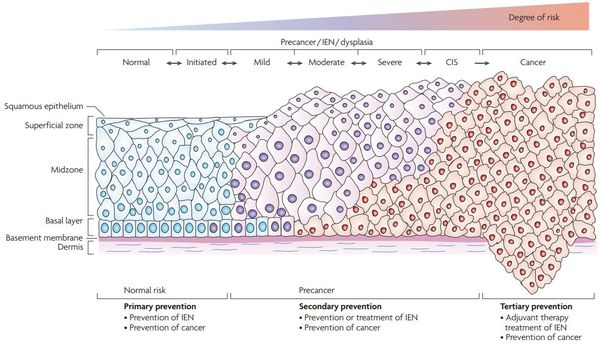
Классификация и стадии развития дисплазии шейки матки
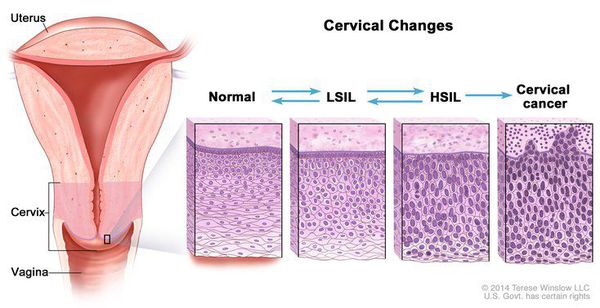
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
- нормальные мазки, без изменений клеток шейки матки (NILM, Negative for intraepithelial lesion or malignancy);
- «непонятные» мазки без определенного значения, по которым нельзя определить характер поражения, однако они при этом не являются нормой (ASC-US, Atypical Squamous Cells of Undetermined Significance) или, что хуже, ASC-H, Atypical squamous cells cannot exclude HSIL, обнаружение атипичных клеток плоского эпителия, не исключающее SIL высокой степени);
- предраки низкой (LSIL, Low Grade Squamous Intraepithelial Lesion) и высокой (HSIL, High Grade Squamous Intraepithelial Lesion) степени.
Классификация Папаниколау
- 1-й класс — нормальная цитологическая картина (отрицательный результат);
- 2-й класс — изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
- 3-й класс — единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
- 4-й класс — отдельные клетки с явными признаками озлокачествления;
- 5-й класс — много типично раковых клеток (злокачественное новообразование).
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя выделяют три степени дисплазии шейки матки:
- ЦИН 1 (дисплазия слабой степени) — признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- ЦИН 2 (дисплазия средней степени) — поражена 1/2 толщины клеточного слоя;
- ЦИН 3 (дисплазия тяжелой степени) — поражение более 2/3 клеточного слоя. [8]
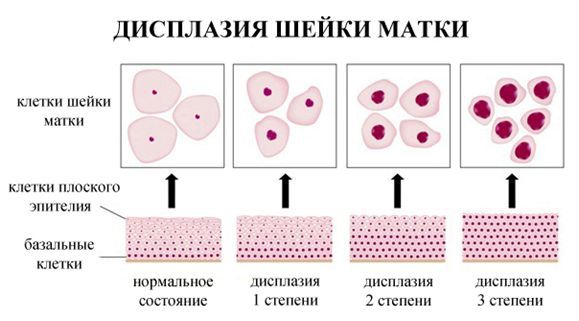
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологи- ческая система Бетесда (ТСБ) |
|---|---|---|---|
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC - US, ASC - H | |
| Класс 3 ("дискариоз") | Слабая дисплазия | CIN 1 койлоцитоз | LSIL |
| Умеренная дисплазия | CIN 2 | HSIL | |
| Тяжелая дисплазия | CIN 3 | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Осложнения дисплазии шейки матки
Последствия дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
Методы диагностики дисплазии шейки матки
В России система цервикального скрининга включает последовательность действий:
- Цитологическое исследование: РАР-тест;
- ВПЧ-тестирование: в США и странах Евросоюза ВПЧ-тест применяется для первичного скрининга рака шейки матки (РШМ). В России его использование вариативно: при первичном скрининге в сочетании с РАР-тестом, в качестве самостоятельного теста, при ведении пациенток с неясными результатами РАР-теста (ASCUS) и для наблюдения паценток после лечения HSIL;
- Кольпоскопия: показаниями к исследованию являются положительные результаты РАР-теста (класс 2-5). Метод основан на осмотре шейки матки при помощи увеличивающих оптических систем и проведения диагностических проб с растворами уксусной кислоты и йода (Люголя). С помощью кольпоскопии определяют локализацию поражения, его размер, выбирают участок для проведения биопсии, определяют тактику лечения.
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
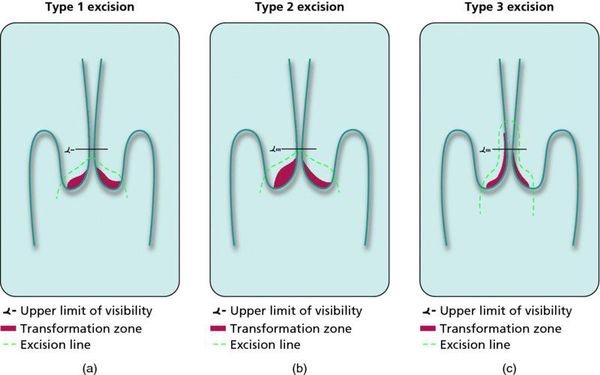
- Зона трансформации 1 типа — переходная зона видна полностью. Это самый оптимальный и прогностически «благоприятный» вариант кольпоскопического заключения.
- Зона трансформации 2 типа — переходная зона частично скрыта в канале шейки матки. Адекватно оценить такую картину сложно, так как наиболее измененные участки могут быть не видны и пропущены.
- Зона трансформации 3 типа — переходная зона находится глубоко в канале шейки матки и оценить её кольпоскопически невозможно. Кольпоскопия в этом случае считается неинформативной, поскольку глубина залегания патологического очага остается неизвестной.
- Биопсия: прицельная или расширенная биопсия (конизация) всегда должна выполняться под контролем кольпоскопии. Выбор метода биопсии зависит от типа поражения, возраста пациентки и зоны трансформации. Важной информацией, которую дает биопсия, является возможность иммуногистохимического определения маркера ранней диагностики дисплазии с высокой степенью риска озлокачествления: p16INK4a.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии.
Хирургическое лечение дисплазии
При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
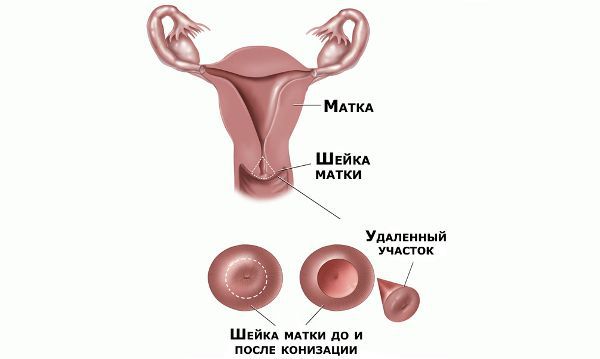
Реабилитация после хирургического лечения
В течение месяца после операции следует воздержаться от спринцеваний, половых контактов и не пользоваться тампонами. На 2–3 недели исключают тяжёлые физические нагрузки и тепловые процедуры. Незначительные сукровичные выделения, усиливающиеся иногда до менструальноподобных, в течение 10–20 дней после операции — это нормальное явление.
При реабилитации после хирургического лечения шейки матки эффективны препараты, содержащие антисептик и стимулятор регенерации эпителия.
После лечения возможен рецидив, поэтому необходимо пожизненное наблюдение: цитологический мазок через 6 и 12 месяцев после операции, затем раз в год в течение 10 лет, далее раз в 3 года.
Планировать беременность после операции на шейке матки можно не ранее, чем через 3–6 месяцев. Эти сроки будут зависеть от глубины эксцизии или конизации и длины шейки матки [9] .
Лечение дисплазии при беременности
В большинстве случаев лечение должно быть отложено на послеродовый период. При беременности на фоне дисплазии шейки матки каждые три месяца проводится кольпоскопический и цитологический контроль. При выявлении рака шейки матки пациентку консультирует онкогинеколог. Доктор подбирает тактику лечения, может потребоваться прервать беременность по онкологическим показаниям [9] .
Прогноз. Профилактика
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
- курение;
- длительное использование гормональных контрацептивов;
- многократные травматичные роды;
- ВИЧ-инфекция.
- У пациенток с ЦИН часто обнаруживают вирус простого герпеса 2 типа, цитомегаловирусную инфекцию, хламидийную урогенитальную инфекцию, бактериальный вагиноз, ассоциированный с резким снижением или отсутствием вагинальной лактофлоры, повышенным ростом во влагалище Gardnerella vaginalis и Atopobium vaginae, повышение концентрации в бакпосеве грибов рода Candida, Mycoplasma hominis.
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения", осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисовой Элины Вячеславовны, гинеколога со стажем в 35 лет.
Над статьей доктора Борисовой Элины Вячеславовны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
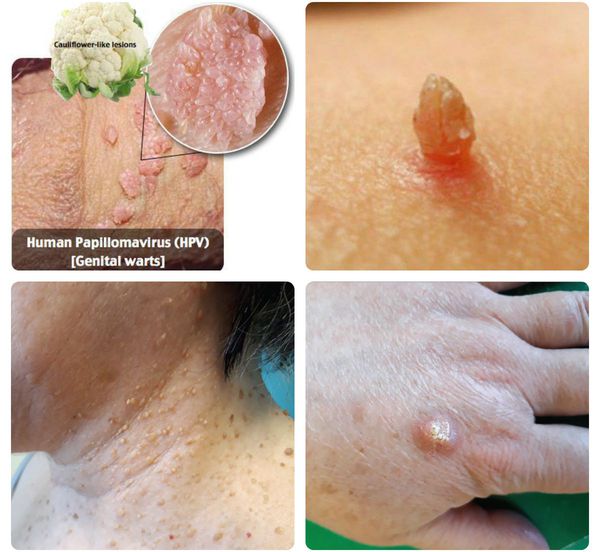
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
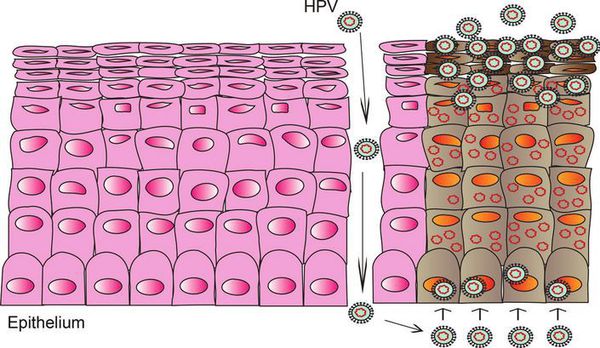
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
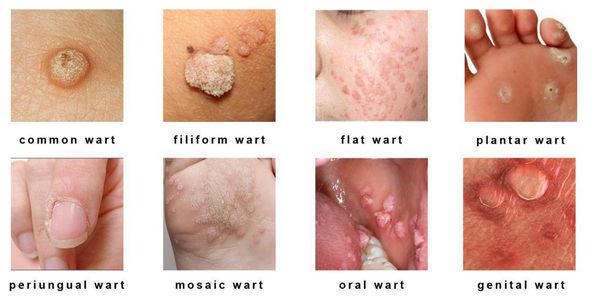
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
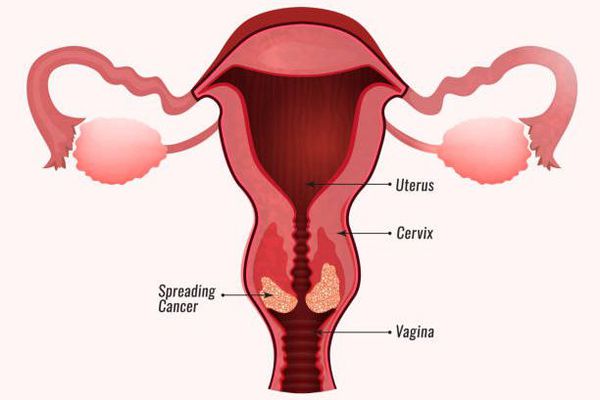
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
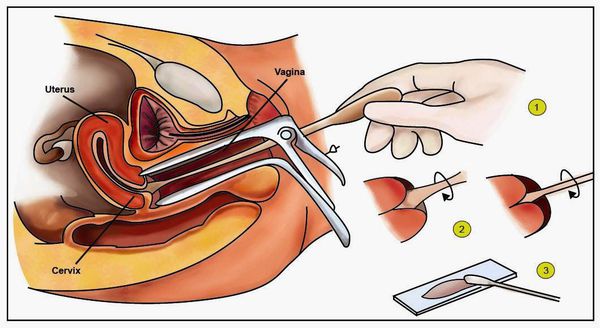
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
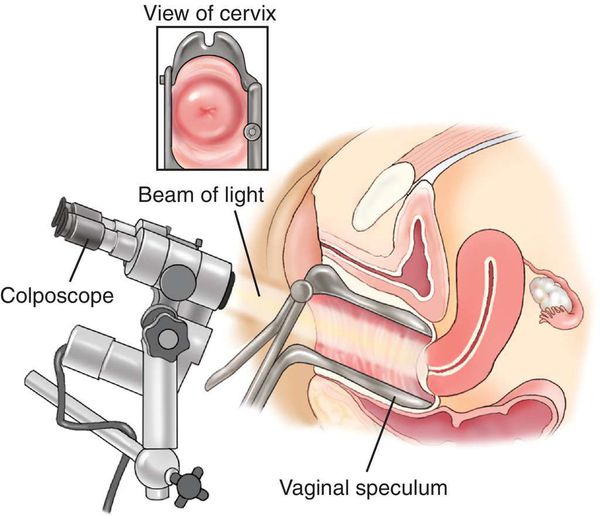
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
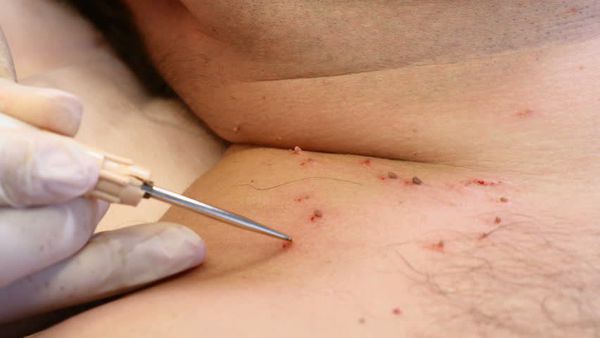
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
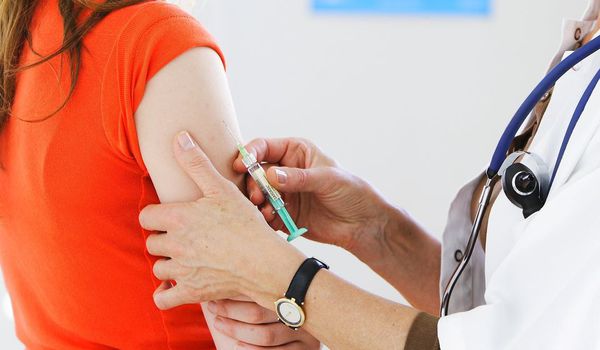
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
21.03.2018 В 2017 году ГБУ РО « Онкодиспансер» г. Таганрога приобрел цифровой кольпоскоп. Наша задача улучшить качество оказываемой медицинской помощи женщинам, которые обращаются со своими проблемами в наше учреждение. Статья посвящена ранней диагностике патологии шейки матки.

1. фоновые заболевания шейки матки – это псевдоэрозия и истинная эрозия, полипы, простая лейкоплакия, эндометриоз, эктропион, папилломы, цервициты . Для фоновых патологий характерна нормоплазия эпителиальных клеток – их правильное деление, созревание, дифференцировка, отторжение;
2. предраковые заболевание шейки матки – диспластические процессы в области влагалищной части шейки матки с высоким риском малигнизации. . В большинстве случаев предраковые процессы развиваются в области фоновых заболеваний и нередко маскируются ими, что затрудняет своевременную диагностику. Средний возраст пациенток с предраком шейки матки составляет 30-35 лет.
3. Рак шейки матки - это заболевание онкологического характера, которое является одним из самых распространенных. Этот недуг занимает 4 место по смертности среди онкозаболеваний. Ежегодно по всему миру это онкологическое заболевание обнаруживают у более полумиллиона пациенток. Самые высокие шансы заболеть этим недугом имеют женщины возрастом от 40 до 60 лет, но как показывают последние данные – сейчас возрастной порог значительно снизился. За последние годы смертность от данного недуга среди женщин возрастом от 20 до 24 лет увеличилась на 70%, а среди женщин от 30 до 34 лет уровень смертности вырос на 30%. При этом в пятой части всех диагностированных случаев данная онкология обнаруживается уже на поздних стадиях.
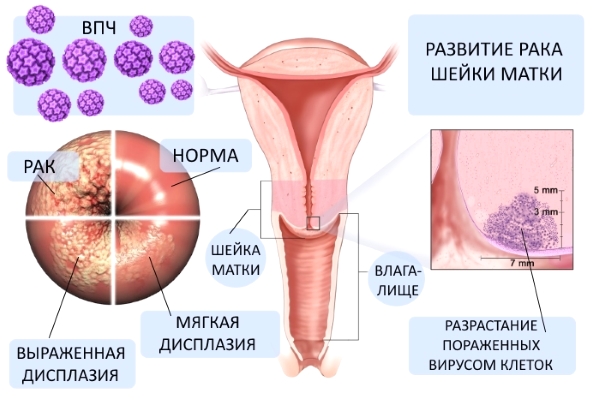
В настоящее время ключевой концепцией этиопатогенеза предраковых заболеваний шейки матки признана вирусная теория. Эпидемиологические исследования убедительно доказывают, что в развитии дисплазии ведущую роль играет папилломавирусная инфекция. В популяции женщин с тяжелой формой дисплазии шейки матки 85–95% являются ВПЧ-позитивными; у них, главным образом, обнаруживаются высокоонкогенные типы вируса — 16, 18 и 31. Возникновению предрака шейки матки способствует «содружество» ВПЧ и вируса простого герпеса II типа, хламидийной и цитомегаловирусной инфекций. Сочетание ВИЧ-инфекции и ВПЧ в разы повышает риск малигнизации.
В меньшей степени, чем вирусные агенты, на риск развития фоновой и предраковой патологии шейки матки могут влиять и другие факторы риска: курение( доказано, что женщины, выкуривающие более 20 сигарет в день в течение 20 лет, имеют пятикратное повышение риска плоскоклеточной дисплазии), длительный прием эстроген-гестагенных оральных контрацептивов, особенно с повышенным гестагенным компонентом, ранние роды, цервициты, травмы шейки матки при абортах и родах, нарушения гормональныго и иммунного гомеостаза, раннее (ранее 16 лет) начало половой жизни, частая смена половых партнеров, профессиональные вредности, отягощенный семейный анамнез.
Предраковые заболевания шейки матки, по данным кольпоцервикоскопического и гистологического исследования, делятся на несколько групп:
• Дисплазия (цервикальная интраэпителиальная неоплазия) - пролиферация атипического цервикального эпителия без изменения структуры стромального слоя и поверхностного эпителия. Включает в себя такие формы, как простая лейкоплакия, поля дисплазии, папиллярная и предопухолевая зона трансформации, предраковые полипы и кондиломы. Частота перерождения предрака шейки матки в рак колеблется в диапазоне 40-60%, зависит от вида патологии, ее локализации и длительности течения.
Различают легкую (CIN-I), умеренную (CIN-II) и тяжелую (CIN-III) дисплазию.
При дисплазии легкой степени поражаются клетки глубоких - базального и парабазального – слоев (менее 1/3 толщины многослойного эпителия); атипичные клетки отсутствуют. Дисплазию умеренной степени характеризуют изменения 1/3-2/3 толщины эпителиального пласта; атипии не наблюдается. При тяжелой дисплазии на долю гиперплазированных клеток приходится более 2/3 толщи эпителиального слоя, встречаются клетки атипичной структуры.
• Лейкоплакия с атипией – морфологически характеризуется ороговением поверхностного эпителия, пролиферацией клеток базального слоя с явлениями атипизма, лимфоидной инфильтрацией подэпителиальной соединительной ткани. В 75% случаев дает начало инвазивному раку шейки матки.
• Эритроплакия – предраковое заболевание шейки матки, протекающее с атрофией поверхностного и промежуточного слоем многослойного плоского эпителия; гиперплазией базального и парабазального слоев с наличием атипических клеток.
• Аденоматоз - атипическая гиперплазия желез эндоцервикса, напоминающая гиперплазию эндометрия. На фоне аденоматоза могут развиваться железистые формы рака.
Особенностью протекания предраковых заболеваний шейки матки является их бессимптомность или неспецифичность клинических проявлений.
Дисплазия шейки матки не имеет самостоятельных симптомов. Лишь при присоединении вторичной инфекции может развиваться клиника вагинита или цервицита (бели, жжение, контактные кровянистые выделения). При изменениях, обусловленных гормональным дисбалансом, возможны нарушения менструльного цикла по типу мено- и метроррагий. Болевые ощущения отсутствуют.
Большинство женщин с лейкоплакией шейки матки считают себя практически здоровыми, лишь незначительная часть отмечает наличие обильных белей и контактных кровянистых выделений.
Кондиломы шейки матки и аденоматозные полипы обнаруживаются, главным образом, при кольпоскопическом исследовании. При наличии в них вторичных изменений, вызванных изъязвлением, травматизацией и пр., возможно появление сукровичных выделений.
Алгоритм диагностики предраковых заболеваний шейки матки разработан детально и включает в себя серию инструментальных и лабораторных исследований, позволяющих не только установить вид предрака, но и степень дисплазии.
При визуальном осмотре влагалищной порции шейки матки с помощью зеркал гинеколог оценивает форму наружного зева, окраску слизистой, характер секрета, видимые патологические процессы. В рамках гинекологического осмотра производится забор мазков с поверхности шейки матки для онкоцитологического исследования (ПАП-тест). При выявлении подозрительных участков шейки матки следующим этапом выполняется Кольпоскопия – метод гинекологического исследования шейки матки с помощью оптического прибора – кольпоскопа. Это устройство напоминает бинокулярный микроскоп, оснащенный источником света. По необходимости врач может выбрать необходимое увеличение, как правило, от 2-х до 40-ка раз. Использование цветных фильтров при кольпоскопии позволяет оценить состояние поверхностных капилляров и сосудов.
Прибор произведен на заводе мирового уровня - "Kernel Medical", прибор очень надежен. Видеокольпоскоп KN-2200А позволяет эффективно и своевременно диагностировать заболевания наружных женских половых органов, влагалища, шейки матки. Видеокольпоскоп выводит изображение исследуемого участка на монитор компьютера, что позволяет проводить удобную диагностику, возможность сохранения результатов обследования, кроме того, это позволяет проводить обследование двумя врачами одновременно.
Во время исследования видеокольпоскоп способен увеличивать изображение исследуемой области в 10 раз, а совместно с цифровой обработкой увеличение может достигать до 264 крат. Благодаря наличию автоматической фокусировки, видеокамера самостоятельно находит положение наиболее четкого изображения при заданном увеличении, кроме того врач может вручную изменять фокусировку.
• выявление участков патологического эпителия, которые могут указывать на дисплазию или рак шейки матки;
• определение размера и локализации пораженных участков слизистой шейки матки и влагалища;
• определение целесообразности биопсии;
• выбор метода лечения выявленных заболеваний – прижигание лекарственными препаратами, электрическим током, лазером, хирургическим инструментом;
• контроль за обнаруженными очагами каждые 3-6 месяцев;
• оценка результативности лечения.
Кольпоскоп позволяет детально рассмотреть малейшие изменения слизистой оболочки влагалищной части шейки матки. В ходе процедуры гинеколог оценивает:
• цвет слизистой оболочки без окрашивания и после обработки растворами уксусной кислоты и йода;
• поверхность и рельеф слизистой оболочки (бляшки, возвышения, углубления, эрозии);
• сосудистый рисунок (наличие измененных сосудов, сосудистых петель);
• наличие и размер участков измененного эпителия;
• границы выявленных очагов (могут быть размытые или четкие);
• наличие и состояние желез (открытые, закрытые).
Процедуру можно проводить в любой день цикла, но не в период менструального кровотечения. Оптимальными считаются первые 5 дней после прекращения менструации. Далее шейка матки продуцирует большое количество слизи, которая затрудняет диагностику.
• простая или обзорная – осмотр шейки матки с помощью кольпоскопа без применения химических реактивов;
• расширенная – во время осмотра используются различные тесты с химическими веществами (уксусной кислотой и раствором йода). Позволяет обнаружить мелкие очаги атипичного эпителия невидимые при простой кольпоскопии;
• кольпомикроскопия – исследование слизистой оболочки при большом увеличении. Позволяет оценить соотношение ядра к цитоплазме и другие особенности строения клеток.
Результаты кольпоскопии выдаются сразу по окончании осмотра. Они могут быть в виде:
• схематического рисунка по типу циферблата часов – врач схематически указывает расположение и размер выявленных патологических участков;
• словесного описания выявленных изменений;
Основанием для назначения кольпоскопии могут быть:
• Результаты цитологического анализа, указывающие на дисплазию шейки матки.
• Подозрительные участки измененного эпителия на шейке матки, обнаруженные при обычном гинекологическом исследовании. В этом случае цель кольпоскопии – выявить мелкие очаги изменений, недоступные невооруженному глазу.
• Для уточнения диагноза при подозрении на некоторые заболевания шейки матки:
o цервицит; o эндометриоз; o полипы шейки матки; o кондиломы шейки матки; o подозрение на рак шейки матки.
• Диспансерное наблюдение женщин с патологиями шейки матки.
• Контроль после лечения заболеваний шейки матки.
Противопоказаниями к проведению кольпоскопии являются:
• Первые 4 недели после родов и операций на шейке матки;
• Непереносимость препаратов йода и уксусной кислоты при проведении
Кольпоскопию проводят в гинекологическом кабинете. Женщина размещается на гинекологическом кресле. Врач расширяет влагалище зеркалом, чтобы получить доступ к шейке матки. Стенки влагалища и шейку матки очищают от выделений тампоном, смоченным в физиологическом растворе.
Кольпоскоп устанавливают на расстоянии нескольких сантиметров от входа во влагалище.
Первый этап. Гинеколог осматривает шейку матки при разном увеличении для обнаружения патологических участков эпителия. На этом этапе обычная кольпоскопия заканчивается. Если есть необходимость в более тщательном исследовании слизистой, то проводят расширенную кольпоскопию, этапы которой описаны ниже.
Второй этап. Обработка 3% раствором уксусной кислоты. Тампон, смоченный раствором кислоты, оставляют во влагалище на 30-40 секунд. Затем его извлекают и продолжают исследовать слизистую под разным увеличением. Под действием уксусной кислоты измененные участки эпителия окрашиваются в белый цвет – ацетобелый эпителий. Его наличие может указывать на заражение вирусом папилломы человека либо на дисплазию. Для уточнения диагноза, возможно, потребуется провести биопсию. Образец ткани врач может взять тут же.
Третий этап. Проба Шиллера или обработка водным раствором йода. Тампоном, смоченным в растворе йода, смазывают поверхность шейки матки. Здоровая слизистая равномерно окрашивается в темно-коричневый цвет. Измененный эпителий выглядит более светлым. Не окрашиваются участки с эктопией – очагами цилиндрического эпителия. Это так называемые йод-негативные зоны. Если в ходе кольпоскопии обнаруживаются участки подозрительного эпителия, с каждого из них берется образец ткани для биопсии.расширенной кольпоскопии.
Процедура кольпоскопии не требует особой подготовки. Однако желательно избегать воздействий, которые могут привести к травмированию слизистой шейки матки.
За два дня до намеченной процедуры необходимо воздержаться:
• от половых контактов;
• использования тампонов;
• спринцеваний;
• введения вагинальных кремов или сечей без назначения врача.
Перед посещением гинеколога необходимо принять душ и провести обычный туалет наружных половых органов.
Кольпоскопия бесконтактная процедура, во время которой слизистая оболочка половых органов не травмируется. Поэтому после кольпоскопии никаких ограничений нет. В тот же день можно вернуться к обычной жизни. Разрешены физические нагрузки и половые контакты. Нет необходимости применять какие-либо медикаменты.
После расширенной кольпоскопии возможны коричневые выделения из влагалища на протяжении 1-3 дней. Это не кровь, а остатки йода. Чтобы защитить белье от загрязнения можно воспользоваться прокладкой. Если во время кольпоскопии проводили биопсию, удаляли полипы и кондиломы, то будут кровянистые выделения и небольшая боль в области влагалища и нижней части живота. В том случае на протяжении 1-3 недель придется ограничить физическую и сексуальную активность и выполнять другие предписания гинеколога.
Подход к лечению предраковых заболеваний шейки матки – дифференцированный и поэтапный. Целью терапии служит радикальное удаление патологически измененных тканей, устранение провоцирующих и сопутствующих факторов (лечение ВПЧ, иммунного и гормонального дисбаланса, воспалительных процессов). В соответствии с выявленными нарушениями назначается этиотропная противовоспалительная терапия (противовирусные, антибактериальные, иммуномодулирующие, интерферонстимулирующие, ферментные препараты). Проводится коррекция биоценоза влагалища, витаминотерапия, при необходимости – гормонотерапия.
Выбор способа хирургического лечения предраковых заболеваний шейки матки зависит от степени клеточной дисплазии. При CIN I-II, особенно у нерожавших пациенток, возможно щадящее физическое воздействие на патологические очаги: диатермокоагуляция, радиохирургическое лечение, лазерная вапоризация, криодеструкция. При CIN II-III показано радикальное хирургическое вмешательство в объеме эксцизии или конизации шейки матки, конусовидной ампутации или гистерэктомии. При полипах цервикального канала производится их удаление с раздельным выскабливанием полости матки.
После излечения предраковых заболеваний шейки матки контрольную кольпоскопию и онкоцитологию повторяют каждые 3 месяца на протяжении первого года и дважды в год в течение второго. Рецидивы редки, однако известно, что их процент выше у ВПЧ-инфицированных женщин. Профилактика предраковых заболеваний шейки матки предполагает широкий охват женского населения скрининговыми программами, вакцинацией против РШМ. Важную роль играет поведение самой женщины: использовании барьерной контрацепции при случайных контактах, отказ от курения, своевременное лечение фоновых заболеваний.
Читайте также:

