Вена в шрамах что делать
Обновлено: 27.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Шрамы, или рубцы: причины появления, при каких заболеваниях возникают, диагностика и способы лечения.
Определение
Шрам, или рубец – это видимое, пальпируемое изменение кожи, образовавшееся после заживления ран и представляющее собой грубую соединительную ткань, в которой отсутствуют волосяные фолликулы и потовые железы.
Рубец проходит несколько стадий формирования.
1-я стадия – воспаление и эпителизация. Ее продолжительность составляет от недели до 10 дней - края раны сближаются за счет образования грануляционной ткани.
Если в этот период не произошло инфицирования или повторного травмирования раны, а также если повреждение кожи не было слишком глубоким, то на месте травмы появится еле заметный шрам.
2-я стадия – формирование «молодого» рубца. Она может длиться до месяца с момента травмы. «Молодой» рубец имеет ярко-розовый цвет и легко растягивается. Начинают образовываться новые коллагеновые и эластиновые волокна.
3-я стадия – формирование «зрелого» рубца. Ее продолжительность – до трех месяцев. В это время волокна коллагена и эластина организуются в пучки, кровоснабжение рубца снижается и он становится менее ярким.
4-я стадия – окончательное созревание рубца, которое происходит примерно через год после получения травмы. Рубец становится плотным и бледным (по сравнению с окружающей кожей) – это объясняется избыточным натяжением коллагеновых волокон и очень малым количеством кровеносных сосудов в зоне рубца.
Разновидности шрамов (рубцов)
Деление рубцов происходит по признаку их соответствия уровню поверхности кожи.
Нормотрофические рубцы расположены вровень с поверхностью окружающей их кожи. Они, как правило, белесые, плоские и не выходят за края повреждения.
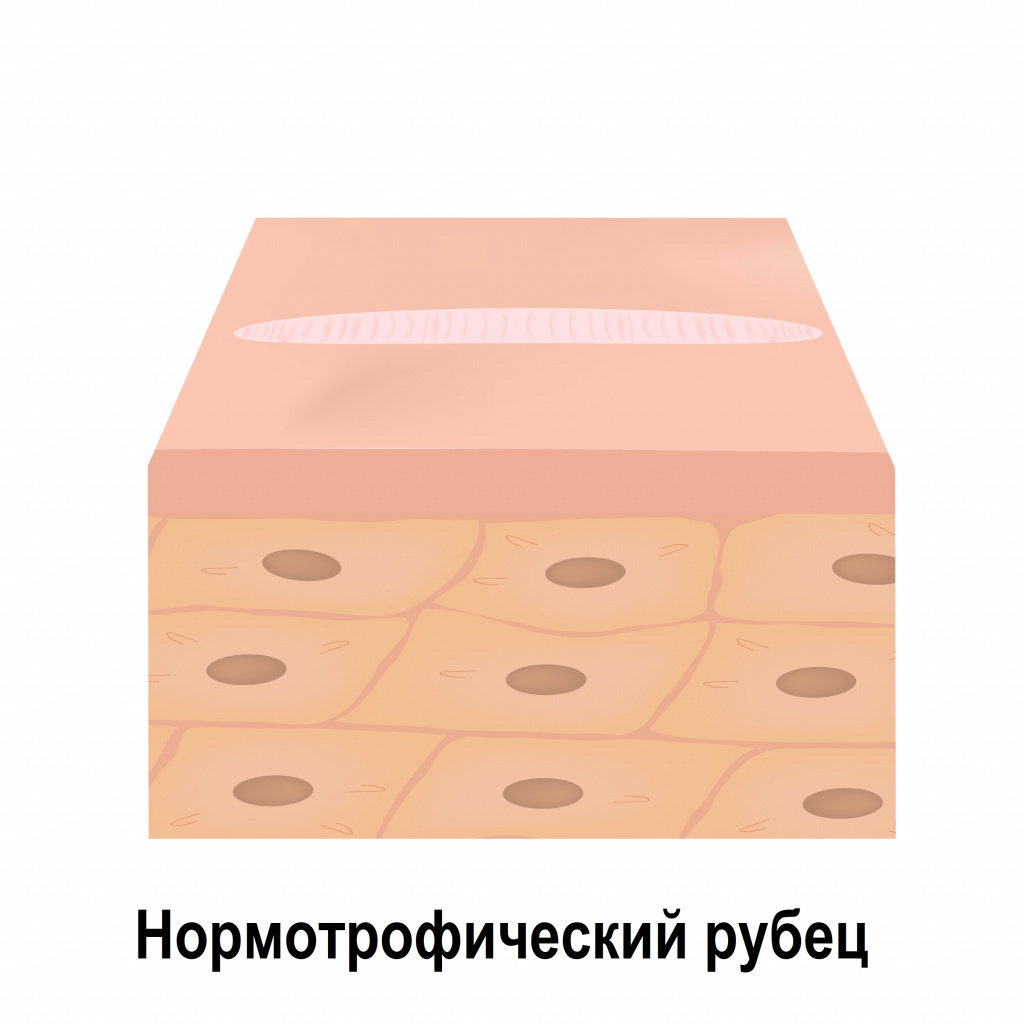
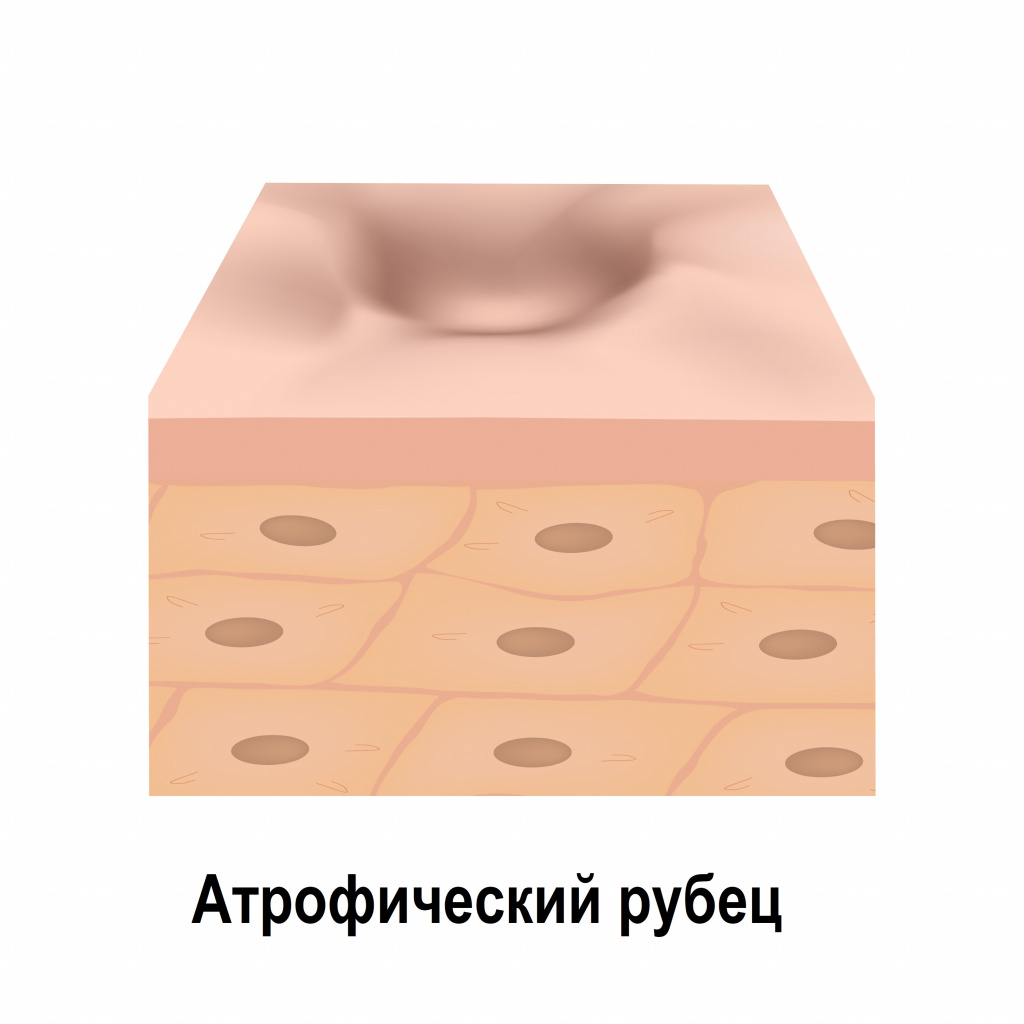
Атрофические рубцы расположены ниже уровня окружающей здоровой кожи, что объясняется недостатком в них коллагеновых и эластиновых волокон. К таким рубцовым изменениям относятся, например, стрии (растяжки), последствия ветряной оспы и рубцы постакне.
Гипертрофические рубцы выступают над поверхностью кожи, но не выходят за границы раны. Их цвет совпадает с цветом окружающей кожи или немного розовее. К гипертрофическим рубцам относятся и келоиды - рубцы, склонные к постоянному росту, который сопровождается зудом, болезненностью и жжением. Они сильно возвышаются над поверхностью кожи, выходят за границы раны, могут быть красными, бордовыми или синюшными, что объясняется их богатым кровоснабжением.
Возможные причины появления шрамов
Шрамы могут остаться на коже после любой травмы, проникающей в дермальный слой, – гнойного воспаления, глубокого разреза (в том числе после хирургического вмешательства), термического или химического ожога, воздействия радиации.
Рубцовые изменения кожи формируются после некоторых заболеваниях кожи и подкожной жировой клетчатки, например, после акне и демодекоза.
Особую группу составляют пациенты с дисплазией соединительной ткани. Патологическое рубцевания в виде гипертрофических и келоидных рубцов, стрий, широких атрофических рубцов по типу «папиросной бумаги» объясняется у них особенностью коллагенообразования.
К каким врачам обращаться при появлении шрама
Коррекцией рубцовых деформаций кожи занимаются дерматокосметологи, лазеротерапевты и хирурги.
Диагностика и обследования при появлении рубцов
Для выбора тактики лечения врач проводит осмотр рубцовой ткани, выясняет «возраст» шрама и обстоятельства, при которых была получена травма - резаные раны заживают более гладко, размозженные, рубленные и рваные заживают с худшим прогнозом.
Инструментальная диагностика требуется в тех случаях, когда необходимо определить состояние подлежащих тканей.
Исследование мягких тканей для выявления патологических изменений и диагностики новообразований.

Удаление вен может производиться полностью или частично, современная хирургия позволяет выполнять манипуляции малоинвазивными методами. В некоторых случаях врач работает через проколы, не требующие даже наложения швов. Но чаще всего в государственных медицинских учреждениях предлагают классические методы хирургического вмешательства.
Доступные методы удаления проблемных вен
Флебэктомия – хирургический способ избавления от варикозного расширения вен. Она проводится двумя методами – классическим и современным. Второй предпочтительнее для пациента, потому что:
- доступ к проблемной зоне осуществляется пункционно (посредством прокола);
- контроль за работой ведется высокоточным ультразвуковым оборудованием;
- остаются целыми лимфатические сосуды и нервы.
Очень важно, что разрезы в принципе исключаются из работы, хирург удаляет вены через небольшие проколы, а это делает риск формирования рубцов и шрамов минимальным. Классическая флебэктомия далека от эстетики – после операции на ногах остаются следы от больших разрезов, которые долго заживают, и процесс обязательно заканчивается формированием грубых рубцов. Восстановить кожу можно.
Последствия после удаления вен
Инновационный метод флебэктомии не подразумевает тяжелых осложнений. Шрамы после него малозаметные и не требуют сложных манипуляций по восстановлению кожного покрова. Классическая же операция имеет немного другое течение и может сопровождаться:
- формированием крупных гематом;
- образованием обширного отека;
- нарушением чувствительности кожных покровов;
- тромбозом глубокорасположенных вен.
Разрезы после такой операции долго заживают, может развиться истечение лимфы, вследствие чего начнут формироваться выраженные рубцы. Да, это один из негативных сценариев прохождения послеоперационного периода. От таких следов на коже избавиться довольно сложно.
Что может помочь в борьбе с глубокими рубцами
После полного восстановления человек может обратиться к косметологам для избавления от шрамов. Чаще всего применяются лазерные технологии – луч разрушает коллагеновые волокна, одновременно стимулируя выработку фибробластов (клеток-строителей, из которых состоит наша кожа). Именно они обеспечивают интенсивную выработку свежего коллагена и эластина – кожный покров обновляется, рубец разглаживается. Лазерное удаление шрамов требует 4–5 сеансов, имеет много противопоказаний и высокую стоимость.
Есть вариант избавления от последствий классической флебэктомии хирургическим путем: специалисты могут иссечь шрам и добиться разрастания новой кожи. Но проведение еще одной операции – не самая приятная перспектива. К тому же дополнительная травматизация кожи может спровоцировать рецидив, и рубец рискует из гипертрофического превратиться в келоидный. А это самый агрессивный рубец, который сложнее других поддается терапии.

Домашний уход за рубцами после удаления вен
Можно воспользоваться кремами и мазями, которые предназначены для обработки шрамов. Чаще всего врачи рекомендуют следующие препараты:
- Келофибраза – крем, который наносят на проблемное место толстым слоем 2 раза в день, длительность применения составляет в среднем 6 месяцев;
- Зерадерм ультра – мазь, в составе которой присутствует активный кислород и витамины, глубоко проникает в кожу, применяется 2 раза в день на протяжении 3 месяцев;
- Контрактубекс – гель на основе экстракта лука, может применяться для разглаживания шрамов, но против застарелых образований он бесполезен;
- Клирмин – против старых рубцов, имеет основу из натуральных компонентов, насыщен антиоксидантами, первый эффект обещают через 5–6 недель, но полный курс может длиться до 10 месяцев.
Стоит обратить внимание и на Ферменкол – гель, который принципиально отличается от других противорубцовых средств. Он не только устраняет грубые патологические рубцы, но и избавляет от гематом. Может применяться через 2–3 недели после операции, когда раны полностью затянутся. Наносить гель необходимо тонким слоем 2 раза в день на проблемное место, втирать его не нужно – средство самостоятельно впитывается максимум за 20 минут.
В отличие от других препаратов идентичного действия применение Ферменкола дает видимый эффект уже через месяц. Как результат: выравнивается рельеф, нормализуется цвет и улучшается эластичность кожи в зоне повреждения. Для усиления эффекта можно дополнительно использовать набор, предназначенный для проведения физиотерапевтической процедуры электрофорез. Из компонентов изготавливается раствор, им смачивается салфетка и прикладывается к рубцу, а затем специальным прибором оказывается воздействие. Процедура безболезненная и может выполняться в домашних условиях. Курс длится 10 дней. Гарантирован выраженный противорубцовый эффект.
Если после удаления вен сформировались рубцы, нужно как можно быстрее приступить к решению этой проблемы. Свежие шрамы легче поддаются коррекции. Подобрать необходимое средство для устранения дефектов и получить рекомендации ведущего врача Светланы Огородниковой можно в рубрике «Вопрос-Ответ». Опишите свою проблему, приложите фотографию. В течение 2–3 дней вы получите бесплатную профессиональную консультацию.
Помните, гель Ферменкол позволит за короткий срок сделать последствия флебэктомии менее выраженными, вернуть телу прежнюю красоту и не допустить развитие комплексов по поводу собственного внешнего вида.
Восстановление после химиотерапии должно быть не полностью самопроизвольным, растянутым на месяцы процессом с неизвестными результатами. В любом случае через некоторое время неприятности лекарственного противоопухолевого лечения существенно уменьшатся, но восстановление пойдет быстрее и успешнее только под контролем врача, а лучше команды специалистов, отлично разбирающихся во всех аспектах реабилитации онкологических пациентов.
Причины появления синяков
Синяк или гематома у онкологических больных встречаются часто, потому что химиотерапия связана с внедрением в организм посредством разрушения кожных покровов — внутривенными введениями лекарств, что не всегда удается без кровоизлияния в кожу и клетчатку вокруг сосуда. Противоопухолевые лекарства изменяют состав крови, в частности численность тромбоцитов, увеличивая кровоточивость, а также впятеро повышают вероятность образования тромбов, тогда как хронически существующая варикозная болезнь увеличивает тромбообразование всего лишь вдвое.
Злокачественная опухоль меняет реологические свойства крови, приводя к образованию тромбов. У каждого пятого пациента ещё до операции выявляют скрытый тромбоз. При раке кишечника и поджелудочной железы обильное образование тромбов может быть первым признаком злокачественного заболевания. Химиотерапия, как и метастатическая стадия любой опухоли, увеличивает вероятность тромбоза в среднем в пять раз. В организме онкологического больного одновременно сосуществуют два процесса — избыточная кровоточивость и повышенная свертываемость.
Факторы риска тромбозов у онкобольных как у всех «обычных» людей: большой вес и возраст «после 40», хронические болезни сосудов и сердца, сахарный диабет, гипертония и конечно варикозная трансформация вен нижних конечностей.
К этим стандартным причинам у онкологического пациента примешиваются специфические, то есть инициируемые злокачественной опухолью и усугубляемые необходимым лечением:
- сдавливание опухолевым конгломератом кровеносных и лимфатических сосудов;
- лимфостаз после удаления подмышечных лимфоузлов, в результате облучения или удаления клетчатки малого таза с лимфоузлами, а также блок метастатическим паховыми узами оттока лимфы из ноги;
- длительный приём гормональных препаратов;
- стимуляция красного ростка кроветворения эритропоэтинами;
- постоянно установленный для частых вливаний лекарств венозный катетер;
- вынужденное из-за слабости ограничение подвижности;
- операции и облучение, а также побочные эффекты химиотерапии на сосуды и форменные элементы крови.
Для инициации тромба внутри сосуда больному раком достаточно всего трёх поводов и не обязательно сразу всех:
- повреждение внутренней оболочки сосуда, что для обычно для внутривенной химиотерапии;
- застой крови, что называют «нарушением кровообращения», в том числе в результате опухолевого конгломерата;
- избыточная свертываемость вместе с нарушением формирования сгустков.
Симптомы воспаления вен после химиотерапии
Большинство химиопрепаратов применяется только в растворе, не в таблетках, что объясняется нестойкостью лекарственных молекул к желудочному соку и сильнейшим раздражающим действием цитостатика на слизистые оболочки желудочно-кишечного тракта. При непосредственном контакте цитостатика с венозной стенкой происходит его проникновение в клетки эндотелия с изменением структуры ДНК. Произошедшая химическая реакция направляет эндотелиальную клетку к воспалительным изменениям либо к смерти — апоптозу. Повреждение усугубляется травмой стенки вены инъекционной иглой или катетером.
Воспаление венозной стенки — флебит, к которому быстро подключаются факторы риска образования тромбов, и в поврежденной химиотерапией вене развивается тромбофлебит.
Флебит проявляется болью, причём в процессе введения цитостатика боль может быть очень интенсивной, и не только в месте инъекции, но по всей руке, когда больной как будто ощущает движение лекарства по сосудистой сети, так и говорят, что «вена горит». Боль может быть краткой, а может остаться на несколько дней и даже неделю, зависит это не только от выраженности ожога эндотелия, но и личностных особенностей больного по восприятию болевых ощущений.
Боль при прохождении лекарства приводит к спастическому сокращению вены, в ответ на которое расширяются впадающие в неё мелкие венки, на внутренней поверхности руки появляется сеточка из расширенных синих сосудиков на фоне побледневшей из-за спазма артериол кожи.
Воспаленную вену можно прощупать, она как тяж плотная из-за местной отечности тканей. Когда в просвете сосуда возникнет тромб, его тоже можно будет нащупать и увидеть при УЗ- дуплексном сканировании.
Со временем воспаление пройдет, уплотнение сосуда может остаться, кожа над ним может потемнеть. Внутренний просвет сосуда после нескольких химиотерапевтических ожогов уменьшится вплоть до закрытия — облитерации. За время течения флебита откроются и расширятся подходящие к больной вене мелкие сосудики — коллатерали, но останется вероятность небольшой отечности руки ниже места венозного повреждения.
Основные методы лечения вен
После внедрения цитостатика внутрь клеток остается только ждать завершения побочного процесса и помогать восстановлению.

Патофизиология лекарственного токсического флебита мало изучена, клинических исследований по проблеме не проводилось, все рекомендации базируются только на личном опыте медицинского персонала. В каждом случае и после каждого введения необходимо консультироваться с лечащим врачом, знающим особенности локального взаимодействия цитостатика и спектр местных побочных реакций.
Для купирования болевого синдрома и уменьшения воспаления лучше всего подходят НПВС — нестероидные противовоспалительные средства, но не доказано преимуществ какого-либо одного препарата, лучше опираться на «житейские» предпочтения пациента, потому что и чувствительность к боли разная, и обезболивающий эффект тоже индивидуален.
При высоком риске легочной тромбоэмболии пациенту назначается специальная — «разжижающая кровь» терапия, как правило, длительная — никак не менее недели и при регулярном контроле свертываемости.
Можно использовать мази с гепарином для втирания в зону поврежденного сосуда. Любимый пациентами гель Гепатромбин™ состоит из гепарина и преднизолона, последний имеет противовоспалительное действие, препарат официально не сертифицирован для использования при периферическом флебите и тромбофлебите.
Хорошая репутация у мази Троксевазин™ (троксерутин), одновременно уменьшающей воспаление и отечность тканей, изменяющей реологические свойства крови в сторону разжижения, но меньше, чем это присуще гепарину. Тем не менее, исследования показали, что препарат способен растворять микротромбы.
Гель Индовазин™ представляет смесь троксерутина и НПВС индометацина, поэтому уменьшает выраженность боли и делает всё, что присуще Троксевазину™. Нецелесообразно сочетать обе мази, поскольку спектр действий комбинированного препарата больше, но с Индовазином™ вполне можно чередовать нанесение Гепатромбина™. Всасывание мазей микроскопическое, они не подменяют собой принимаемые внутрь НПВС и антикоагулянты, но помогают перенести неприятные последствия лечения.

Как восстанавливаются вены после капельниц: полезные процедуры
Местное раздражение слизистой, выстилающей внутреннюю стенку вены, пытаются уменьшить большим разведением и медленным введением в капельницах, буквально часами. Не все цитостатики выдерживают большое разведение и долгое введение, некоторые теряют свои свойства, поэтому их вводят болюсно — шприцем. В этом случае сразу же после химиопрепарата вену «моют» физиологическим раствором, стараясь уменьшить её повреждение.
Обязательно до введения и в процессе капельницы неоднократно проверяется проходимость сосуда и возможность экстравазации — распространение цитостатика в клетчатке при микроскопических разрывах сосудистой стенки.
Рекомендуется не делать химиотерапию в одну и ту же вену, лучше чередовать руки, давая сосуду больший срок на восстановление своей слизистой оболочки. Профилактическое использование мазей с гепарином или троксерутином до химиотерапии лишено патоморфологических оснований, то есть бесполезно.
При планировании многомесячной химиотерапии целесообразно подумать об установке венозного порта, срок его службы, как минимум, пятилетка. Устройство полностью исключает такой побочный эффект как лекарственный флебит, но от тромбозов спасает только приём антикоагулянтов.
Профилактика осложнений
Многие цитостатики повреждают вены, особенно усердны в инициации химических флебитов агрессивные цисплатин, антрациклины и винкаалкалоиды, а также сравнительно «мягкие» гемцитабин с фторурацилом. По действию на ткани антрациклины с винкаалкалоидами отнесены к кожно-нарывным, цисплатин всего лишь к раздражающим, а гемцитабин точно не кожно-нарывной. Тем не менее любой химиопрепарат, а тем более комбинация цитостатиков, способны повредить вену, поэтому во время внутривенного введения персонал должен строго исполнять инструкцию по длительности и способу инъекции.
Помогают восстановлению физиотерапевтические процедуры и акупунктура, фототерапия и инфракрасное облучение, стимуляция магнитным полем.
В нашей Клинике каждому больному проводится определённая и ориентированная на особенности организма и сопротивляемость тканей программа сопровождения химиотерапии и восстановления после лечения.
Постинъекционный флебит – это воспаление венозной стенки, возникающее как осложнение инъекционного введения препаратов. Патология характеризуется болезненной локальной реакцией с гиперемией, отечностью, утолщением пораженного сосуда, создает опасность инфицирования, эмболии легочной артерии и других осложнений. Заболевание выявляют на основании клинического обследования, подтвержденного методами лабораторно-инструментальной диагностики (анализом крови на D-димер, УЗДС вен и флебографией). Лечебная программа включает общие рекомендации, консервативную терапию и хирургическую коррекцию (традиционные и эндоваскулярные техники).
МКБ-10
Общие сведения
Флебит является распространенным локальным осложнением инфузионной терапии, осуществляемой с использованием внутривенных катетеров. По различным оценкам, частота патологии у пациентов стационаров колеблется от 2,3 до 67%. Существенное расхождение в показателях заболеваемости, вероятно, связано с недостаточной идентификацией и регистрацией новых случаев. По причине инфузий развивается 70–80% тромботических состояний в венах верхней конечности. Патология встречается у 5,8% потребителей инъекционных наркотиков, составляя 25% всех сосудистых осложнений. Распространенность тромбофлебитов увеличивается с возрастом – половина случаев приходится на людей старше 60 лет. Женщины страдают вдвое чаще мужчин.

Причины
Возникновение постинъекционного флебита обусловлено внутривенными манипуляциями, инициирующими эндотелиальное повреждение. Воспалительный процесс с поражением поверхностных или глубоких вен запускается под влиянием нескольких причин:
- Механические. Движение постороннего предмета (иглы, катетера) становится источником трения и повреждает эндотелий сосуда. Особенно часто это происходит при использовании широких инъекционных игл, некачественной их фиксации (проксимальной, дистальной), введении рядом с венозными клапанами или суставами. Риск флебита увеличивают повторная катетеризация, частые инъекции (25–30 раз в неделю), длительное нахождение канюли (2 суток и более).
- Химические. На частоту развития патологии существенное влияние оказывают pH (менее 5,0) и осмолярность (более 450 мОсмоль/л) вводимых веществ. Повышенный риск наблюдается при вливании антибиотиков (бета-лактамов, ванкомицина, амфотерицина B), гипертонических растворов (глюкозы, кальция хлорида), химиопрепаратов. Повреждающее действие оказывают бензодиазепины, барбитураты, вазопрессорные амины и другие медикаменты.
- Инфекционные. Хотя воспаление обычно носит асептический характер, нарушение правил и техники инъекционного введения лекарств способствует проникновению инфекционных агентов, поддерживающих и усугубляющих его течение. Отмечено, что катетеры из поливинилхлорида и полиэтилена более подвержены контаминации условно-патогенной микрофлорой (стафилококками, дрожжеподобными грибами).
В дополнение к перечисленному, высокая заболеваемость флебитом связана с постановкой и обслуживанием венозных систем слабо подготовленным персоналом. К патологическим изменениям приводят инвазивные лечебно-диагностические процедуры, проводимые с использованием катетеров (ангиография, флебография, эндоваскулярные вмешательства). Отдельной причиной тромбофлебита выступает внутривенное ведение наркотических веществ.
В число факторов риска постинъекционного осложнения входят пожилой возраст, тромботические состояния в анамнезе, курение. Флебит возникает на фоне приема гормональных контрацептивов, при дефектах коагуляции, онкологических процессах и другой патологии (ожирении, сахарном диабете, ВИЧ-инфекции).
Патогенез
Развитие постинъекционного флебита опосредовано повреждением эндотелия, физико-химическими изменениями крови (венозным стазом, усилением коагуляции), влиянием микроорганизмов. Заболевание начинается с нейрорефлекторных реакций в ответ на чрезмерную механическую и химическую агрессию. Инъекции и вводимые растворы раздражают чувствительные нервные окончания в венозной стенке, провоцируя длительный сосудистый спазм.
Инициирующая травма вызывает воспалительный ответ (с участием простагландинов, лейкотриенов), который приводит к немедленной адгезии тромбоцитов в очаге повреждения. Дальнейшая агрегация кровяных пластинок опосредуется тромбоксаном А2 и тромбином. Так или иначе, в воспаленной вене образуется сначала небольшой кровяной сгусток, направленный на устранение повреждения. Но при высоком риске тромбозов он увеличивается в размерах, приводя к гемодинамическим нарушениям.
Классификация
Постинъекционный флебит относится к ятрогенным заболеваниям. Это вторичное состояние, возникающее в ранее неизмененных венах поверхностного или глубокого русла. Учитывая локализацию воспалительного процесса в сосудистой стенке, клиническая флебология различает несколько форм патологии:
- Эндофлебит. Развивается при поражении внутреннего слоя вены (интимы). Это наиболее частый вариант воспаления, ассоциированного с инъекционным введением лекарств или эндоваскулярными вмешательствами.
- Перифлебит. Проникновение инфузионных растворов в паравазальную клетчатку ведет к химическому повреждению и воспалению наружной оболочки сосуда. Обычно возникает при введении раздражающих лекарств, наркотиков.
- Панфлебит. Наиболее тяжелая разновидность патологического процесса. Характеризуется вовлечением всех слоев венозной стенки, часто осложняет течение эндо- или перифлебита.
Исходя из этиологии, различают механический, химический, инфекционный флебит. Среди пациентов, получавших инфузионную терапию, чаще всего наблюдается поражение кистевой, кубитальной зоны, а у лиц, страдающих внутривенной формой наркомании, обычно выявляют поверхностный тромбофлебит нижних конечностей.
Симптомы постинъекционного флебита
Клиническая картина флебита кисти и локтевой ямки развивается непосредственно после введения медикаментов, сопровождаясь достаточно типичной симптоматикой. Повреждение сосудистой стенки и проникновение лекарственного вещества в мягкие ткани проявляется резкой болезненностью в месте инъекции, которая распространятся по ходу вены и ограничивает двигательную функцию конечности. Общее самочувствие практически не нарушено, иногда бывает субфебрильная лихорадка.
В проекции воспаленного сосуда наблюдаются полоса гиперемии с локальным повышением температуры, увеличиваются регионарные лимфоузлы. О тромбировании свидетельствует плотный болезненный шнуровидный тяж, выявляемый при пальпации. Острый период продолжается в течение 3 недель с момента появления клинических признаков, длительность подострого тромбофлебита составляет от 21 суток до месяца. Постоянная травматизация сосуда у инъекционных наркоманов становится причиной рецидивирующего тромбофлебита и облитерации венозного просвета. Тогда в местах введения психоактивных веществ определяется плотный спаянный с тканями линейный инфильтрат, кожа над которым утолщается, становится пигментированной и синюшной.
Тромбофлебит подключичной вены развивается постепенно, на протяжении 1–2 недель. Он начинается у пациентов еще в стационаре, но с учетом интенсивной терапии, проводимой по поводу основного заболевания, часто носит латентный характер. Во время осмотра заметны отек мягких тканей и расширение подкожных вен, распространяющиеся на всю верхнюю конечность. Болевой синдром варьируется от незначительного, усиливающегося при движениях, до интенсивного. Воспаление глубоких сосудистых сегментов протекает по типу пристеночного флеботромбоза.
Осложнения
Осложнения постинъекционного флебита в поверхностном русле достаточно редки. У ослабленных лиц заболевание принимает гнойный характер с абсцедированием и септическим состоянием. Хронический процесс при длительном анамнезе внутривенной наркомании сопровождается глубокими и длительно не заживающими трофическими язвами, склонными к инфицированию и кровотечению. Катетер-ассоциированные флеботромбозы центральных вен осложняются потерей доступа, невозможностью дальнейшей инфузии медикаментов, посттромбофлебитическим синдромом (до 13% пациентов). 5–8% случаев сопряжено с развитием клинически выраженных вариантов ТЭЛА, у 36% пациентов осложнение протекает субклинически.
Диагностика
Выявление поверхностного постинъекционного флебита обычно не вызывает затруднений и осуществляется при врачебном обследовании без необходимости в дополнительных тестах. Инфузионный флеботромбоз, наряду с оценкой клинических данных, нуждается в лабораторно-инструментальном подтверждении с помощью следующих методов:
- Анализ крови на уровеньD-димера. Исследование полезно при низком или среднем клиническом риске тромбоза для уточнения коагуляционных изменений. Однако D-димер не позволяет отличить патологический процесс в поверхностных и глубоких сегментах. Обладая высокой чувствительностью, тест имеет низкую специфичность, поэтому в ряде случаев может давать ложные результаты.
- Ультразвуковое ангиосканирование вен. Рекомендуется для подтверждения диагноза и исключения флеботромбоза. УЗДС позволяет оценить состояние внутренней стенки сосуда и характер венозной гемодинамики. Методика имеет много преимуществ, включая хорошую чувствительность и специфичность, низкий риск из-за отсутствия лучевой нагрузки или воздействия контрастных веществ, высокую доступность.
- Контрастная флебография пораженных зон. В случаях, когда ультрасонография дает отрицательный результат при высокой вероятности патологии, в качестве «золотого стандарта» могут использовать контрастную флебографию. Исследование показано при воспалении глубоких вен, ассоциировано с рентгеновским облучением и введением контраста.
В диагностически сложных случаях для улучшения визуализации используют компьютерную или магнитно-резонансную ангиографию. Пациенты с тромбофлебитом нуждаются в помощи специалиста-флеболога. Дифференциальная диагностика постинфузионных тромбофлебитов осуществляется с лимфангоитами, панникулитом, целлюлитом, узловой эритемой.
Лечение постъинъекционного флебита
Лечебная тактика определяется характером процесса, его распространенностью и тяжестью, остротой симптоматики, наличием осложнений и сопутствующих состояний. Легкому поверхностному флебиту свойственно самостоятельное исчезновение после извлечения канюли. В остальных случаях необходимо активное лечение:
- Общие мероприятия. Начальные действия при любом флебите заключаются в прекращении инфузии и удалении катетера (или его замене новым, если пациент гемодинамически нестабилен). Пораженной конечности рекомендуют придать возвышенное положение с целью улучшения оттока крови и уменьшения воспалительной реакции. К воспаленному участку прикладывают холод.
- Медикаментозная коррекция. Направлена на предупреждение распространения процесса на глубокие сегменты, ослабление воспаления, улучшение кровотока и купирование болевого синдрома. Используют антикоагулянты, нестероидные противовоспалительные средства, ангиопротекторы. На пораженную область накладывают повязки с гепариновой мазью и НПВС, после стихания острых явлений – согревающие компрессы.
- Хирургические методы. Оперативное лечение необходимо при гнойном тромбофлебите. Оно включает флебэктомию, некрэктомию, постановку дренажа и наложение первичных швов на рану (параллельно с антибиотикотерапией). Эндоваскулярные технологии (тромбэктомия, селективный тромболизис, установка кава-фильтра) находят применение в ситуациях с флеботромбозами.
В комплексной коррекции постинъекционного флебита используют физиотерапевтические методы – электрофорез с трипсин-гепариновым комплексом, гальванизацию, свето- и лазеротерапию. Пациентам рекомендуют придерживаться активного режима, что позволит избежать венозного застоя.
Прогноз и профилактика
Поверхностный постинъекционный тромбофлебит успешно разрешается после удаления внутривенных систем. Опасность катетер-ассоциированных флеботромбозов заключается в риске легочной эмболии и прочих неблагоприятных последствий. Но своевременность и полнота терапии делают прогноз благоприятным для большинства пациентов. Профилактические рекомендации включают правильный выбор, соблюдение техники установки и обслуживания катетеров, коррекцию факторов риска. Использовать системные антикоагулянты с превентивной целью не рекомендуют, если нет других показаний для их назначения. Снизить вероятность тромботической окклюзии можно путем промывания катетеров гепарином.
1. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений// Флебология. - 2010 - №4(2).
2. Эпидемиология и профилактика постинъекционных осложнений: Автореферат диссертации/ Чернова О. Э.— 2006.
3. Структура постинъекционных осложнений у больных наркоманией в хирургическом стационаре/ Сажин А.В. и др.// Российский медицинский журнал. – 2012 - № 4.
Гипертрофический рубец – это избыточное разрастание фиброзной соединительной ткани при патологическом заживлении кожной раны. Косметический дефект образуется при обширных поражениях кожи с неровными краями, врожденной предрасположенности, неадекватной хирургической помощи и чрезмерном натяжении тканей. Рубец выступает на несколько миллиметров над кожей, имеет багровый или розовый цвет, по форме и размерам соответствует ране. Диагностика проводится путем осмотра, в сомнительных ситуациях назначается патоморфологическое исследование. Коррекцию гипертрофических шрамов выполняют инъекциями, методами крио- и лазерной деструкции, пластической хирургии.
МКБ-10


Общие сведения
Физиологическая регенерация должна завершаться образованием нормотрофического рубца, который не выступает над уровнем кожи и со временем становится почти незаметным. Однако у многих пациентов наблюдаются нарушения регенераторных процессов, поэтому гипертрофические рубцы – серьезная проблема для всех направлений современной хирургии. Видимый эстетический недостаток и сложности в коррекции объясняют высокую актуальность гипертрофических шрамов, требуют от врачей разработки новых методов их эффективной маскировки и удаления.

Причины
Характер рубцевания и внешний вид зажившей раны во многом определяется этиологией кожного повреждения. По причинам появления рубцы бывают посттравматические, послеоперационные, образовавшиеся на месте патологических кожных элементов или вследствие лучевой терапии. Формированию патологического гипертрофического шрама на месте раны способствуют следующие факторы:
- Характер повреждения. Патологические рубцы чаще возникают при рваных, разможженных и укушенных ранах, когда травматизация кожи не соответствует линиям Лангера. Предрасполагающим фактором является заживление вторичным натяжением, нагноение и воспаление места травмы.
- Избыточное натяжение тканей. Такая ситуация встречается при ушивании и пластической коррекции рубца без пересадки кожи, когда собственные ткани пациента стягиваются для закрытия дефекта. В месте натяжения нарушается образование структурной соединительной ткани, возникают гипертрофические явления.
- Опасная локализация. Патологические рубцы в основном образуются по передней поверхности шеи, в области мочки уха. Это объясняется различными механическими свойствами кожи на разных участках тела, что оказывает значимую роль на процессы регенерации.
- Склонность к патологическому рубцеванию. Доказаны генетические и иммунные варианты предрасположенности к образованию гипертрофических и келоидных рубцов. У таких пациентов патологические шрамы образуются даже при отсутствии других провоцирующих факторов.
Патогенез
Классическое заживление раны длится до 1 года, завершается образованием рубца. В первые 10 суток наблюдается острое воспаление, которое в последующий месяц приводит к активному фибринолизу и образованию рыхлой соединительной ткани. На протяжении 2-3 месяцев после кожного повреждения ткани уплотняются, образуется прочный шрам. Окончательная перестройка рубца происходит 4-12 месяцев, именно в этот период появляются гипертрофические изменения.
При гипертрофическом процессе незрелая соединительная ткань располагается в субэпидермальном слое. Патоморфологически она представлена тонкими пучками коллагена, отдельными эластиновыми волокнами, избыточным количеством внеклеточного матрикса. Наблюдается большое число плазматических клеток, однако гигантские фибробласты отсутствуют. Сверху образование покрыто ровным слоем эпидермиса.

Классификация
Гипертрофический рубец – один из классических вариантов шрамов, согласно клинико-морфологической систематизации. В практической дерматологии используются и другие виды классификации, чтобы наиболее точно описать особенности кожной регенерации и подобрать методы коррекции патологических случаев. Существует несколько критериев систематизации рубцовых изменений:
- По возрасту: незрелые (до 3 месяцев), умеренно зрелые (3-12 месяцев), зрелые (старше 1 года).
- По конфигурации: линейные, дугообразные, зигзагообразные, звездчатые и другие варианты неправильной формы.
- По цвету: розовые, багрово-красные, цианотичные, белесоватые, пигментированные.
- По размеру: малые (до 1 см), средние (1-2 см), крупные (до 4,5 см), обширные (более 4,5 см).
Симптомы гипертрофического рубца
Такой тип шрама начинает расти спустя 3-4 недели после травмы, его увеличение в размерах продолжается в среднем 5-6 месяцев. Гипертрофический рубец имеет красноватый или синюшный оттенок, по размеру и форме соответствует границам раны, возвышается над поверхностью здоровой кожи не более чем на 4 мм. Со временем образование приобретает светло-розовый или телесный оттенок, спустя 12-18 месяцев возможна его частичная спонтанная регрессия.
Поверхность гипертрофического рубца неровная с выступающими участками, кожа над ним матовая. Его контуры четко очерчены, однако края плавно переходят на окружающие кожные покровы и постепенно сливаются с ними. В местах постоянного трения шрам покрывается ороговевшими наслоениями и небольшими язвами. При этом пациента беспокоит болезненность, сильный зуд, мокнутие или выделение сукровицы.
Осложнения
Гипертрофические рубцы не угрожают жизни и здоровью человека. Их основной проблемой является косметический дефект, особенно при локализации на лице и открытых участках тела. Крупные и заметные шрамы сказываются на психологическом состоянии пациентов, вызывают проблемы с социализацией, становятся препятствием для построения отношений с противоположным полом.
Неприятные последствия наблюдаются при расположении рубца в месте постоянной травматизации. Вследствие механического трения на его возвышающейся поверхности возникают раны и язвы, которые могут инфицироваться с развитием вторичных бактериальных осложнений. Также возникают явления гиперкератоза, которые усугубляют неэстетичный вид рубцовой ткани.
Диагностика
При образовании гипертрофических рубцов показано обследование у врача-дерматолога и хирурга. В большинстве ситуаций диагноз устанавливают на основании физикального осмотра: определяются внешние характеристики шрама, условия его появления, наличие субъективной симптоматики. При согласии пациента проводится фотографирование пораженной области тела для отслеживания динамики изменений. Дополнительные методы диагностики:
- УЗИ мягких тканей. Сонография назначается, чтобы оценить толщину и глубину залегания рубцовой ткани, исследовать характер и полноту заживления раны, исключить осложнения.
- Патоморфологическое исследование. Для изучения структуры гипертрофического рубца проводится световая и электронная микроскопия, микроскопическая морфометрия. Исследования необходимы при трудностях дифференцировки разных видов шрамов, необходимости исключить другие кожные патологии.
Дифференциальная диагностика
В клинической практике необходимо отличать гипертрофические и келоидные рубцы, которые имеют большое внешнее сходство и патоморфологические признаки. На келоидный тип шрама указывает распространение соединительной ткани за пределы повреждения, продолжающийся рост в течение многих месяцев и даже лет, интенсивные субъективные ощущения (зуд, жжение, болезненность). Патоморфологически келоид характеризуется атипичными гигантскими фибробластами.

Лечение гипертрофического рубца
Консервативная терапия
Не существует общепринятого протокола коррекции патологической рубцовой ткани. Программа лечения подбирается индивидуально для каждого пациента, основываясь на клинических особенностях, локализации, давности образования и других характеристиках гипертрофического рубца. Небольшие образования удается скорректировать нехирургическими методиками, самые эффективные из которых:
- Локальная компрессионная терапия. Давящие силиконовые пластины и эластичные бинты замедляют разрастание рубцовых тканей, способствуют образованию шрамов нормотрофического типа.
- Инъекции кортикостероидов. При маленьких свежих шрамах гормоны угнетают чрезмерное образование фибробластов и коллагена, замедляют темпы роста соединительной ткани. Уколы глюкокортикоидов проводятся, пока рубец не сравняется по высоте с поверхностью кожи.
- Физиотерапия. Для сокращения объема соединительнотканных волокон применяются фибринолитические ферменты (лидаза, коллагеназа), которые вводятся методами электрофореза и ультрафонофореза.
- Криодеструкция. Для неинвазивного удаления гипертрофического рубца применяется жидкий азот, который наносится на очаг поражения, замораживает патологические ткани и разрушает их. Для достижения хорошего косметического эффекта проводится несколько сеансов.
- Лазерная шлифовка. Коррекция гипертрофических разрастаний выполняется абляционными лазерами, которые удаляют неструктурную соединительную ткань и сглаживают контуры шрама. В основном применяется фракционный метод лазерной шлифовки, который отличается коротким периодом реабилитации.
Хирургическое лечение
Оперативная коррекция рубцовых тканей показана при неэффективности лекарственных и малоинвазивных методов лечения. Хирургическое вмешательство направлено на иссечение патологических разрастаний соединительной ткани, ликвидацию чрезмерного натяжения кожи. Вторичные раневые дефекты закрываются с помощью местных или перемещенных кожных лоскутов, дермотензии с применением тканевых эспандеров.
Прогноз и профилактика
Небольшие по размеру гипертрофические рубцы успешно корректируются инъекционными, аппаратными или хирургическими методиками. При крупных шрамах и генетической склонности к патологической регенерации прогноз менее благоприятный: комплексная терапия уменьшает размеры и бугристость рубца, однако достичь нормотрофии и полностью скрыть дефект зачастую не удается.
Профилактика патологического рубцевания заключается в своевременной и квалифицированной помощи хирургов при серьезных травмах, адекватной иммобилизации в раннем периоде заживления, соблюдении этапности хирургического лечения. При обширных повреждениях кожного покрова с самого начала лечения требуется консультация пластического хирурга для выбора оптимального метода закрытия дефектов, чтобы минимизировать формирование шрамов.
3. Лечение гипертрофических и келоидных рубцов/ Г.Э. Карапетян// Фундаментальные исследования. – 2013. – №3.
4. Применение ферментов при лечении больных с гипертрофическими рубцами/ Б.А. Парамонов, И.И. Турковский, С.В. Бондарев// Вестник хирургии. – 2007.
Читайте также:

