Вакуумная терапия при ожогах
Обновлено: 26.04.2024
ОЖОГ (combustio) - специфическое повреждение тканей и органов, вызванное воздействием термической, химической, электрической или лучевой энергии.
Этиология. По физической природе термические агенты можно разделить на твердые, жидкие и газообразные. По виду взаимодействия с тканями пострадавшего выделяют контактные поражения (при непосредственном взаимодействии с тканями пострадавшего: пламя, горячие жидкости и т. д. ) и дистантные (без непосредственного контакта: ультрафиолетовое, инфракрасное, тепловое излучение) поражения.
Патогенез местных изменений при ожогах кожи.
Температурный оптимум для активности многих биологически важных ферментов соответствует 36-37˚С, интервал температур от 37 до 41˚С для кожи является приемлемым, дальнейшее нагревание приводит к повреждению клеток. Продолжительность существования тканевой гипертермии многократно превосходит время действия самого термического агента.
При воздействии высоких температур на поверхности тела образуются ожоги различных степеней. При перегревании тканей свыше 520С коагуляционное свертывание белков невосстановимо. Последствия ожогов зависят от размеров и глубины повреждения тканей.
Различают 3 концентрические зоны поражения при глубоких ожогах в зависимости от степени нарушения кровообращения. Центральная область раны, наиболее тесно соприкасающаяся с источником тепла, носит название зоны коагуляции. Вокруг нее располагается зона паранекроза, названная Jackson D (1953) зоной стаза (ишемическая средняя зона) и эритемная периферическая зона. При микроскопии визуализируется сосудистый тромбоз в средней и периферической зонах.
Интенсивность нагревания тканей (глубина поражения) зависит от физических характеристик термического агента (низкотемпературные, высокотемпературные), способа теплопередачи (проведение, конвекция, испарение), теплозащитных свойств одежды. Объем поражения кожи зависит не только от фактической температуры, но и от времени ее воздействия, которое удлиняется за счет того, что кожа обладает достаточно высокой теплоемкостью и теплопроводностью. Степень тканевой гипертермии прямо пропорциональна продолжительности нагревания. Краткосрочное воздействие даже очень высоких температур может не приводить к развитию ожогов. Чем выше степень перегрева тканей, тем быстрее происходит гибель клеток.
Классификация. В настоящее время в нашей стране используется классификация, принятая на XXVII Всесоюзном съезде хирургов. Выделяют следующие степени поражения (рис. 20. 1):
1 степень - поверхностный эпидермальный ожог
2 степень - ожог верхнего слоя кожи
3 степень - коагуляция и некроз всего сосочкового слоя или более глубоких слоев кожи.
3А степень - некроз эпителия распространяется на глубину эпителиального слоя до герминативного, но захватывает последний не полностью, а лишь на верхушках сосочков, сохраняются придатки кожи.
3Б степень - некроз распространяется на глубину всего эпителиального слоя и дермы.
4 степень - поражение глубжележащих тканей (подкожной клетчатки, фасций, мышц, сухожилий и костей).
За рубежом широко распространена классификация, выделяющая четыре степени поражения:
- первая степень – соответствует первой степени отечественной классификации;
- вторая поверхностная степень – соответствует II степени отечественной классификации;
- вторая глубокая степень – соответствует IIIа степени;
- третья степень – соответствует IIIб степени;
- четвертая степень – соответствует IV степени.
Клиническая картина.
Для ожоговых повреждений в зависимости от глубины (степени поражения) характерна различные местные клинические проявления (табл. 20. 1).
Ожог 1 степени характеризуются разлитой краснотой, отечностью и выраженной болезненностью кожи, местным повышением ее температуры. Термический агент за счет раздражения сосудистых нервов вызывает интенсивное расширение сосудов. Через несколько дней все проявления проходят, оставляя коричневую пигментацию кожи. Типичным примером ожога 1 степени является ожог солнечными лучами.
При ожоге 2 степени на различной глубине в толще эпидермального слоя образуются пузыри, наполненные прозрачной серозной жидкостью. Содержимым таких пузырей является бесклеточная серозная жидкость с высоким содержанием в ней белков. Заживление происходит за счет регенерации эпителия.
При ожоге 3а степени кожа местами покрыта пузырями, пятнистая, пятна бледного или темного оттенка, иногда даже черные. Нежизнеспособные ткани образуют струп, который отторгается от живых тканей с образованием демаркационной линии. Если в зоне ожога явно выражен отек, то можно рассчитывать на островковую эпителизацию и заживление без пересадки кожи. На месте ожога остаются нежные рубцы.
При ожогах 3б степени кожа поражается на всю толщину с вовлечением поверхностных слоев подкожной клетчатки. Кожа бледно-серого цвета, пятниста, чувствительность ее снижена или отсутствует. При заживлении на месте поражения образуются грубые рубцы.
Для ожогов 4 степени характерно глубокое поражение тканей, нередко их обугливание. Ткани превращаются в почерневшие ломкие массы. Самостоятельное заживление этих ожогов невозможно.
Тяжесть общего состояния больных главным образом зависит от площади обожженной поверхности и степени ожога, выраженность которых в конечном итоге и определяют прогноз заболевания. В первые дни тяжесть течения зависит в основном от площади обожженной поверхности. Глубина поражения сказывается главным образом на дальнейшем течении болезни.
Диагностика
При диагностике глубины поражения необходимо учитывать комплекс данных полученных при сборе анамнеза, осмотре пострадавшего и при проведении диагностических проб.
Анамнез позволяет установить вид и продолжительность воздействия повреждающего агента, факторы изменяющие интенсивность теплового воздействия, наличие сопутствующей патологии.
При осмотре оценивается изменение цвета эпидермиса и дермы, наличие и распространенность отека, наличие пузырей и характер их содержимого, наличие признаков нарушения кровообращения, наличие некроза тканей и его вид.
При физикальном обследование определяется состояние болевой чувствительности: уколы иглой, эпиляционный тест (выдергивание волосков), тесты с красителями.
Определение площади ожога.
Одной из важных составляющих диагноза при термической травме является определение площади поражения. Наиболее удобным является определение площади пораженной поверхности по Уоллесу (A. Wallace 1951г. ) – «правило девяток»: голова и шея - 9%, рука - 9%, нога - 18%, туловище сзади и спереди по 18%, промежность, гениталии - 1% (рис 20. 2).
Другим распространенным способом является «правило ладони». Согласно исследованиям J. Grazer (1997г. ) площадь ладони взрослого человека составляет 0, 78% от общей площади поверхности тела.
Местное лечение ожогов.
В качестве первой помощи при ожогах необходимо немедленно прекратить воздействие поражающего фактора, обеспечить доступ свежего воздуха охладить обожженные участки тела (холодная проточная вода, криопакеты «Comprigel» «Articare» и т. д. ), при обширных повреждениях ввести обезболивающие препараты (анальгин, морфин, омнопон, промедол, морадол), наложить на пораженные поверхности стерильные повязки. Следует отметить, что ключевым моментом оказания первой помощи является быстрое проведение охлаждения обожженной поверхности, правильное проведение которой снижает глубину (степень) ожога на единицу. Адекватно проведенная первая помощь на месте происшествия позволяет снизить риск ожоговой болезни и уменьшить количество осложнений.
Поверхностные ожоги не большой площади адекватно лечатся амбулаторно, поскольку в большинстве случаев, не требуют хирургического лечения. Местно применяются различные мазевые повязки, которые обладают местно охлаждающим действием, защищают раневую поверхность, стимулируют заживление, препятствуют присоединению вторичной инфекции. Наиболее часто используются мази-спреи «Олазоль», «Пантенол».
В последние годы при лечении пограничных ожогов IIIA степени и глубоких ожогов IIIБ-IV степени широко используются различные раневые покрытия, в течение многих лет успешно используется перфорированная свиная кожа - ксенокожа. Последняя помещается на ожоговые раны, обеспечивая их покой и защиту от инфекции, не препятствуя очищению ран и одновременному применению для местного лечения других препаратов.
В настоящее время существует два основных пути подготовки глубоких ожоговых ран к аутодермопластике (табл. 20. 3. ): химическая некрэктомия с отсроченной аутодермопластикой и хирургическая некрэктомия с одномоментной или отсроченной аутодермопластикой. Тактика местного лечения с использованием химической некрэктомии вполне оправдана при обширных глубоких ожогах более 40 % поверхности тела при условии крайне тяжелого общего состояния больных. Особенно при лечении больных пожилого и старческого возраста, у которых тяжелая сопутствующая патология делает оперативные вмешательства в ранние сроки невозможными.
В этих случаях с первых суток после травмы местное лечение должно быть направлено на быстрое формирование сухого ожогового струпа, профилактику инфицирования и углубления ожоговых ран. С этой целью применяют ватно-марлевые повязки с мазями на водорастворимой основе. Это способствует уменьшению потери жидкости с ожоговой поверхности, согреванию больного, формированию сухого струпа, не требует ежедневных перевязок.
В последующие дни формирование сухого ожогового струпа достигается применением влажно-высыхающих повязок. Оптимальными препаратами в этот период также являются 1 % растворы йодопирона или йодовидона, обеспечивающие высушивание струпа и обладающие широким спектром антимикробного и противогрибкового действия. Возможно также использование ватно-марлевых повязок с мазями на водорастворимой основе. Применение мази на жировой основе противопоказано.
Значительно ускоряет формирование сухого струпа лечение больного в условиях абактериальной среды. В этом случае используется открытый метод лечения с обработкой ожоговых ран два-три раза в день 1 % раствором йодопирона, йодовидона или препаратом "Наксол" и применением абактериальных изоляторов или кровати "Клинитрон". Способствует высушиванию струпа инфракрасное облучение ран. Образование сухого струпа уменьшает потери белка с ожоговой поверхности, способствует уменьшению интоксикации, улучшению общего состояния больного.
При глубоких циркулярных ожогах конечностей, когда высок риск сдавления и ишемии глубжележащих тканей формирующимся ожоговым струпом при циркулярных ожогах грудной клетки, ограничивающих еe экскурсию, в ближайшие дни после травмы показано выполнение некротомии.
После образования сухого "мумифицированного" струпа производится химическая некрэктомия с использованием 40 % салициловой мази. Толщина слоя мази должна составлять 1-2 мм. Одновременно применяется не более 200 граммов мази в связи с опасностью отравления салицилатами, уровень которых в крови может превысить допустимую норму. Через 48 часов ожоговый струп бескровно отделяется от подлежащих тканей. С учетом указанного обстоятельства химическую некрэктомию одномоментно можно осуществить на площади до 10-15% поверхности тела.
После очищения ожоговой поверхности от некроза для подготовки раны к аутодермопластике целесообразно применение мазей на водорастворимой основе, содержащих антибактериальные препараты, возможно и чередование с антисептическими растворами. Положительное влияние на раневой процесс оказывают ультрафиолетовое облучение, монохроматический красный свет лазера, низкочастотный ультразвук.
Если площадь глубоких ожогов пострадавших превышает 10-15 % поверхности тела целесообразно в это же время выполнить следующую, этапную химическую некрэктомию и подготовить гранулирующие раны к одномоментной аутодермопластике на площади до 20 % поверхности тела. Выполнение такой операции возможно только с использованием расщепленного перфорированного сетчатого кожного аутолоскута, позволяющего увеличить площадь трансплантата в соотношении 1: 2, 1: 4, 1: 6 и более.
В последние годы все большее число сторонников находит метод хирургического иссечения некротических тканей. Ведущим методом лечения является ранняя хирургическая некрэктомия ожоговых ран - радикальное иссечение всех пораженных тканей до развития воспаления и инфицирования с последующей одномоментной аутодерматопластикой кожных дефектов. Операция выполняется до 5-7 суток с момента травмы непосредственно по выведению больного из шока.
В структуре хирургических методов лечения так же применяются: раннее хирургическое очищение ожоговых ран - заведомо нерадикальное иссечение основного массива некроза с целью уменьшения интоксикации, отсроченная хирургическая некрэктомия - радикальное иссечение всех пораженных тканей при развившемся воспалении и инфицировании (выполняется на 5-14 сутки с момента травмы), поздняя хирургическая обработка раны (в т. ч. хирургическая обработка гранулирующей раны), ампутации и дезартикуляции конечностей и их сегментов.
При ожогах III степени хирургическая некрэктомия производится тангенциально (послойно) специальным инструментом (дерматом, нож Гамби) до появления мелкоточечного кровотечения из непораженного ожогом слоя кожи. При ожогах IV степени хирургическаяи некрэктомия выполняется чаще до фасции скальпелем или электроножом с последующим тщательным гемостазом. Ранняя хирургическая некрэктомия (тангенциальная или фасциальная) с одномоментной аутодермопластикой позволяет при глубоких ожогах IIIБ-IV степени восстановить целостность кожных покровов уже через 3-4 недели после травмы на площади до 20 % поверхности тела.
Следует отметить, что использование современных принципов и методов лечения тяжелой ожоговой травмы, включающих раннюю хирургическую некрэктомию с одновременной последующей аутодерматопластикой (непосредственно после выведения больного из состояния шока), позволяет у большинства пациентов избежать развития всех дальнейших периодов ожоговой болезни, либо уменьшить тяжесть ее проявлений и последствий.
В настоящее время разработан и применяется новый метод активного хирургического лечения обожженных с использованием культивированных аллофибробластов. Суть метода заключается в применении для пластического закрытия ожоговых ран искусственно выращенных в лабораторных условиях аллофибробластов - клеток соединительной ткани, определяющих активность процессов регенерации, в т. ч. эпителизации. Они могут быть получены из кожи донора или трупного материала, при культивировании неприхотливы и полностью утрачивают антигенспецифичность.
Метод предусматривает трансплантацию культивированных фибробластов на обширные ожоговые раны IIIA степени, донорские раны в т. ч. длительно не заживающие, или комбинированную аутодермопластику с использованием культуры фибробластов и сетчатых кожных аутолоскутов, перфорированных в соотношении 1: 6 и 1: 8 при глубоких ожогах IIIБ-IV степени. Операции предшествует выполнение химической или хирургической некрэктомии.
Источник: Н.А.Кузнецов в соавт. Основы клинической хирургии. Практическое руководство. Издание 2-е, переработанное и дополненное. - М.:ГЭОТАР-Медиа, 2009.
Для цитирования: Оболенский В.Н., Семенистый А.Ю., Никитин В.Г., Сычев Д.В. Вакуум–терапия в лечении ран и раневой инфекции. РМЖ. 2010;17:1064.
Одним из самых новых методов, используемых в лечении как острых, так и хронических ран является местное использование вакуумных повязок – метод Vacuum–assisted closure (VAC® therapy), принцип Topical negative pressure (TNP) (рис. 1).
Местно используемые вакуумные повязки в самом общем виде состоят из гидрофильной полиуретановой (PU) губки с размером пор от 400 до 2000 микрометров, прозрачного адгезивного покрытия, неспадающейся дренажной трубки и источника вакуума с емкостью для сбора жидкости. В определенных случаях может быть использована поливиниловая (PVA) губка с размером пор 700–1500 микрометров, встречаются упоминания о PVA–губке с размером пор 60–270 микрометров. Специальная вакуумная аппаратура имеет внешнее контрольное устройство, поддерживающее широкий диапазон значений отрицательного давления и способно обеспечить режим постоянного и прерывистого вакуумного воздействия на рану [1,2]. При плоских поверхностных дефектах для повышения надежности герметичности системы можно наносить по периметру раны пасту Стомагезив (или ее аналог). Используется отрицательное давление от –50 до –200 мм рт. ст., оптимальным считается уровень отрицательного давления в ране –125 мм рт.ст.
Также применяется сочетание дренажно–промывной и вакуум–систем – вакуум–промывная терапия (Vacuum Instillation Therapy), когда дополнительно к описанной VAC–системе подводится приточный дренаж (рис. 2).
В случаях выраженно инфицированных ран, в гнойных полостях, при остеомиелите промывание проводится растворами антисептиков и растворами, содержащими антибиотики; при выраженной контактной болезненности раны используются анестетики; с целью создания влажной среды в асептических ранах – раствор Рингера. Следует обратить внимание, что раствор перекиси водорода не рекомендован для использования при вакуум–промывной терапии, т.к. Н2О2 может повреждать ткани, вызывать газовую эмболию, а кроме того, разрушает структуру PU–губки [2].
Вакуум–терапия улучшает течение всех стадий раневого процесса: уменьшает локальный отек, как результат – способствует усилению местного кровообращения, снижает уровень микробной обсемененности раны, вызывает деформацию раневого ложа и уменьшение раневой полости, приводя к ускорению заживления раны. Также вакуум–терапия снижает выраженность раневой экссудации, способствуя поддержанию влажной раневой среды, необходимой для нормального заживления раны. Все эти эффекты способствуют увеличению интенсивности клеточной пролиферации, усиливают синтез в ране основного вещества соединительной ткани и протеинов [3].
Эффекты вакуум–терапии:
1. Активное удаление избыточного раневого отделяемого, в том числе веществ, замедляющих заживление раны (например, матриксные металлопротеиназы и продукты их распада).
2. Сохранение влажной раневой среды, стимулирующей ангиогенез, усиливающей фибринолиз и способствующей функционированию факторов роста.
3. Ускорение снижения бактериальной обсемененности тканей раны. В исследованиях DeFranzo A.J. et al. и Morykwas M. et al. было доказано, что деконтаминация раны ниже критического уровня при вакуум–терапии достигается к 4–5–м суткам против 11 суток при других методах местного лечения ран [4,5].
4. Снижение локального интерстициального отека тканей, снижение межклеточного давления, усиление местного лимфообращения и транскапиллярного транспорта, что в результате улучшает раневую среду и питание тканей и увеличивает скорость формирования грануляционной ткани, а улучшение перфузии раневого ложа дополнительно способствует деконтаминации раны.
5. Усиление местного кровообращения. В исследованиях Morykwas M. et al. было выявлено, что прирост интенсивности местного кровообращения при уровне отрицательного давления – 125 мм рт.ст. достигал примерно 400% по отношению к исходному уровню, а применение локального прерывистого вакуума в течение 5 минут на уровне – 125 мм рт.ст. с последующим отсутствием вакуумного воздействия в течение 2 минут является наиболее оптимальным режимом лечебного воздействия на рану для стимуляции местного кровообращения [5,6].
6. Деформация тканевого ложа. Стенки открытых пор губки прикрепляются к раневому ложу, в то время как внутренняя часть пор не входит в соприкосновение с раной. Таким образом, за счет локального отрицательного давления происходит растяжение и деформация ткани раневого ложа. Это вызывает деформацию клеток вакуумируемых тканей и стимулирует миграцию и пролиферацию клеток. Это похоже на процесс клеточной пролиферации, который имеет место при использовании метода дозированного тканевого растяжения в пластической хирургии, а также при использовании дистракционных костных аппаратов в травматологии, ортопедии и челюстно–лицевой хирургии. В исследованиях in vitro показано, что растяжение клеток способствует их пролиферации, в то время как нерастянутые клетки утрачивали способность к столь же интенсивному делению. Экспериментальное изучение данного эффекта позволило объяснить его особенностями строения цитоскелета и наличием косвенных связей между клеточной стенкой и ядром клеток. Эти связи в эксперименте передают механические силы растяжения с клеточной стенки к ядрам клеток, приводя к ряду событий, результатом которых является повышение выработки факторов роста, тканевых протеинов, генной экспрессии, которая индуцирует приспособительные изменения в клетках и усиливает процесс клеточной пролиферации [1,7].
7. Уменьшение площади раны. Прямое воздействие отрицательного давления на дно и края раны в условиях внешней изоляции оказывает постоянный эффект в отношении краев раны, способствуя ее стяжению. Этот эффект напрямую снижает размеры раны, независимо от интенсивности клеточной пролиферации [8]. Вакуумная терапия посредством улучшения качества грануляционной ткани повышает шансы на успех в закрытии раны местными тканями. Вследствие того, что вакуумная повязка уменьшает размеры раны, предварительное растяжение местных тканей перед пластикой может не понадобиться [1]. Наложение вакуум–повязки на пересаженный расщепленный кожный лоскут улучшает адаптацию лоскута к раневой поверхности, позволяет удалять избыточный раневой экссудат, стимулирует ангиогенез и предохраняет пересаженный лоскут от смещения. Для применения метода вакуумной терапии после осуществления свободной кожной пластики и укрытия вакуумной повязкой кожных лоскутов рекомендуется использование уровня отрицательного давления от –50 до –75 мм рт.ст. вместо часто используемых –125 мм рт.ст. Часто рекомендуется дополнительное использование неадгезивного барьера (или повязки) между губкой и кожными лоскутами, чтобы избежать врастания здоровой сформированной ткани в структуру губки и случайного повреждения кожных лоскутов при смене повязки. Повязка бессменно остается на ране, по меньшей мере, 4 суток [9].
8. Раневая гипоксия. Прямое воздействие вакуума на раневое ложе приводит к локальному снижению парциального давления кислорода в ране, однако это стимулирует формирование новых сосудов и дальнейшее улучшение качества грануляционной ткани [10]. Тем самым в итоге обеспечивается усиление тканевой оксигенации.
9. Сокращение затрат. Вакуум–повязки накладываются бессменно на длительный срок (в среднем от 3 до 7 суток), что позволяет даже в первую фазу раневого процесса обходиться без перевязок, экономя перевязочные средства, препараты местного действия, а также силы и время медицинского персонала.
10. Профилактика внутрибольничных инфекций. Длительное отсутствие перевязок у стационарного больного, а значит, и контакта раны с инструментом и воздухом лечебного учреждения, руками медицинского персонала снижает риск контаминации раневой поверхности госпитальными штаммами микроорганизмов.
11. Усиление эффекта медикаментозного лечения. В условиях усиления местного крово– и лимфообращения и транскапиллярного транспорта, улучшения перфузии раневого ложа повышается и концентрация в тканях раны вводимых парентерально и перорально лекарственных средств, что также повышает общую эффективность лечения.
В литературе упоминается применение вакуум–терапии при самой различной патологии: при острой травме, различных ранах, ожогах и отморожениях, остеомиелите, некротизирующем фасциите, пролежнях, гнойных ранах и трофических язвах, диабетической стопе, лимфостазе, в челюстно–лицевой, спинальной, торакальной, пластической и реконструктивной хирургии, в педиатрии, а также при перитоните, кишечных свищах и абдоминальной травме, несостоятельности кишечных анастомозов и сопутствующих им абсцессах малого таза [2,11–14].
Наш опыт применения вакуум–терапии основывается на результатах лечения более чем 100 больных с хирургической и травматологической патологией. Существуют VAC–системы фирмы «KСI», США, которые, однако, не представлены на рынке России. Нами используются оригинальные аналогичные модификации: повязка состоит из подведенной к ране через контрапертуру дренажной трубки с дополнительными сечениями для лучшего оттока из раны, поролоновой губки, которая укладывается в рану двумя слоями, чтобы покрыть всю поверхность раны, причем дренаж располагается между слоями поролона (другой вариант – один слой губки на рану с подведением дренажа к его поверхности с помощью эластичного плоского переходника); далее выполняется закрытие раны пленкой для операционного поля фирмы «3М»; дренажная трубка подсоединяется к медицинскому отсосу В–40А (Беларусь) для активной аспирации в режиме non stop. Данный отсос работает практически бесшумно; позволяет установить уровень отрицательного давления от 25 до 200 мм рт.ст. (8 градаций).
В некоторых случаях при большом объеме раневой полости губка укладывается в несколько слоев до ее заполнения. При наличии узкого и длинного раневого канала или глубокой полости с узким входом губка оборачивается и фиксируется вокруг дренажа. При наличии в травматической ране кости с поврежденной или некротизированной надкостницей последняя до губки укрывается гидрогелевым перевязочным материалом (например, Hydrosorb, Гелепран или Cica–Care). При наложении вакуум–ассистированной лапаростомы, когда дном раны являются петли кишечника, под губку укладывается, например, повязка Atrauman Ag.
Мы не нашли в литературе упоминаний о применении VAC–терапии при отдельных видах патологии, которая удачно пролечена с помощью вакуум–ассистированных повязок и вакуум–инстилляционной терапии в нашей клинике. К примеру: инфицированный некротический панкреатит в стадии развития флегмоны забрюшинного и паракольного пространства, забрюшинной флегмоны малого таза (3 пациента); множественные кишечные свищи, открытые в гнойно–некротическую рану передней брюшной стенки (3 случая); распространенный актиномикоз поясничной области, забрюшинного и паранефрального пространства (1 больная); обширное нагноение после пластики вентральной грыжи проленовой сеткой (2 пациента); гнойные осложнения эндокоррекции сколиоза (5 случаев); причем в двух последних примерах все инородные тела (сетки, эндокорректоры) были сохранены, а воспалительный процесс купирован.
Что касается вакуум–промывной терапии, на наш взгляд, целесообразнее, когда приточный дренаж дополнительно к описанной VAC–системе подводится непосредственно к раневому ложу (на дно раны). Применяемые нами растворы антисептиков или гипербарически оксигенизированные растворы антисептиков в такой модификации вакуум–повязки омывают ткани раневого ложа, все слои губки и лишь затем аспирируются (рис. 3).
Суммируя указанные в одобренном FDA (Управление США по применению пищевых и лечебных, в т.ч. лекарственных, средств) руководстве по вакуумной терапии (VAC® therapy Guidelines), литературные данные и наш собственный опыт, можно определить следующие общие показания и противопоказания к применению метода:
• Показания – раны стопы при сахарном диабете; пролежни; хронические трофические язвы различной этиологии; острые и травматические раны, первично и вторично открытые переломы, в том числе с наличием в ране металлоконструкций; осложненные хирургические раны, в том числе лапаростомы, вскрытые обширные и глубокие флегмоны забрюшинного пространства и малого таза, открытые в рану кишечные свищи; скальпированные и ожоговые раны, кожная пластика местными тканями и свободными кожными лоскутами.
• Противопоказания – малигнизация ран, несанированные очаги остеомиелита, кровотечение в ране, некротические раны и раны, представленные рубцовой тканью, кишечные и требующие обследования гнойные свищи, раны, частью которых являются стенки внутренних органов или сосуды (однако в некоторых случаях, например, при наложении вакуум–ассистированной лапаростомы, когда дном раны являются петли кишечника последние можно предохранить наложением под губку неадгезивного барьера – повязка Atrauman Ag или другое). Кроме того, противопоказанием могут быть и неадекватность или наличие психического заболевания у пациента.
• Нежелательные явления – болевой синдром, избыточнее врастание грануляций в гидрофильную губку, кровоточивость тканей при смене вакуумной повязки, пересыхание и некротизация раны при разгерметизации повязки, а в ряде случаев и реинфицирование раны и/или развитие перифокальной рожи.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Для цитирования: Логинов Л.П. Современные принципы местного лечения термических ожогов. РМЖ. 2001;3:123.
НИИ скорой помощи имени Н.В. Склифосовского
О громный накопленный в мире опыт местного лечения больных с ожогами, изучение обширной литературы, посвященной ожоговой патологии (Т.Я. Арьев, 1971; Н.И. Атясов, 1972; В. Рудовский и соавт., 1980; М.И. Кузин и соавт., 1982; Б.С. Вихриев, В.М. Бурмистров, 1986), позволяет в настоящее время сформулировать некоторые неоспоримые постулаты.
• Местное лечение поверхностных ожогов I-II степени, даже обширных, не представляет серьезных трудностей. Они при лечении любыми средствами заживают в течение 7-12 дней.
• Cубдермальные ожоги IIIА степени нуждаются в более длительной консервативной терапии, которое не исключает возможности применения хирургического лечения у ограниченного числа больных. Подобные ожоги заживают в сроки от 3 до 6 нед.
• Глубокие ожоги IIIБ - IV cтепени нуждаются в хирургическом лечении.
• Местное консервативное лечение глубоких ожогов является лишь вспомогательным, оно преследует цель в кратчайшие сроки подготовить ожоговую рану к свободной пересадке кожи - заключительному этапу по восстановлению утраченного кожного покрова.
Исходя из вышеизложенного, представляется целесообразным поделиться нашим многолетним опытом местного лечения глубоких ожогов. В настоящей работе приведена лишь небольшая часть средств для местного лечения ожогов, которые применялись наиболее часто. Весь перечень подобных препаратов весьма велик и вряд ли целесообразно их перечислять.
На догоспитальном этапе при наличии ограниченных ожогов лучшей первичной повязкой является сухая асептическая повязка, при обширных ожогах для этих целей используют стандартные контурные повязки или стерильные простыни. Первичная повязка не должна содержать жиры и масла в связи с возникающими впоследствии трудностями при туалете ран, а также красители, т.к. они могут затруднить распознавание глубины поражения. Самым действенным мероприятием на догоспитальном этапе является криообработка ожоговых поверхностей. Это достигается обливанием пораженного участка в течение 10-15 мин холодной водой или использованием для этих целей льда, снега в чистом целлофановом пакете или готового криопакета. Криообработка прекращает действие термического агента на ткани пострадавшего и способствует благоприятному течению ожогов в последующем.
При поступлении в ожоговый центр пострадавшим выполняют первичную обработку ожоговых ран, характер и объем которой зависит от площади и глубины ожогового поражения. При наличии ограниченных поверхностных ожогов (не более 20% поверхности тела) без признаков ожогового шока обычно выполняют тщательный туалет ожоговых ран, заключающийся в удалении десквамированного эпидермиса, инородных тел, пузырей, в обильном промывании антисептическими растворами и наложении мазевой повязки. Если имеются обширные ожоги кожи, сопровождающиеся шоком, первичную обработку при поступлении не выполняют. Больного заворачивают в стерильную простыню, а отсроченный первичный туалет производят после стабилизации общего состояния. Глубокие ожоги обрабатывают так же, как и поверхностные, с той лишь разницей, что накладывается повязка с антисептическими растворами.
Нередко уже при поступлении может возникнуть необходимость в срочном оперативном вмешательстве. Подобная ситуация возникает при наличии циркулярных ожогов шеи, конечностей или грудной клетки. В этих случаях скальпелем без дополнительного обезболивания делают продольное рассечение струпа (некротомия) до жизнеспособных кровоточащих тканей. Такая простая манипуляция приводит к улучшению кровоснабжения пораженных участков, предупреждает углубление ожогового поражения, а при ожогах грудной клетки в значительной степени улучшает дыхательные экскурсии.
Местное лечение глубоких ожогов имеет свои конкретные задачи в разных фазах течения раневого процесса. Вскоре после получения ожога в период острого воспаления и нагноения лечение направлено на борьбу с раневой инфекцией и должно способствовать ускоренному отторжению некротических тканей. Для этого проводят частые (вплоть до ежедневных) перевязки с растворами йодсодержащих препаратов (йодопирон, йодовидон, повидон-йод и др.), хлоргексидина, диоксидина, фурацилина, повиаргола, лавасепта, плевасепта и т.п. Для борьбы с инфекцией в настоящее время хорошо себя зарекомендовал современный отечественный антисептик мирамистин, который применяется в 0,01% концентрации (С.В. Смирнов, Л.П. Логинов, 2000). В первой фазе раневого процесса при наличии влажных струпов или в период активного механического удаления их, используются углеродные перевязочные материалы. Эти материалы обладают хорошей сорбционной способностью, что приводит к уменьшению гнойного отделяемого, подсушиванию струпов и, как следствие, значительному уменьшению интоксикации организма. В конце данной фазы раневого процесса для борьбы с инфекцией также используют мази на водорастворимой основе (левомеколь, диоксиколь, сильвацин и др.).
С целью отторжения омертвевших тканей используются протеолитические ферменты животного происхождения (трипсин, хемотрипсин, панкреатин), бактериальные ферменты (стрептокиназа, коллагеназа, террилитин и др.), растительные ферменты (папаин и др.). Следует учитывать тот факт, что ферменты не действуют на плотный ожоговый струп. Поэтому применение ферментов наиболее показано в процессе механического удаления некрозов либо при наличии влажных струпов.
Кератолитические средства (молочная, салициловая, карболовая кислоты, мочевина) в нашей практике находят ограниченное применение, поскольку они усиливают местный воспалительный процесс в ране, вызывающий усиление интоксикации. Эти средства используются нами лишь при ограниченных ожогах у пострадавших, не подлежащих оперативному лечению по тем или иным причинам (отказ от операции, тяжелая сопутствующая патология).
При консервативном лечении глубоких ожогов самопроизвольное отторжение нежизнеспособных тканей можно ожидать лишь через 4-6 нед после травмы. Такие длительные сроки подготовки ожоговых ран к свободной пересадке кожи - конечному этапу хирургического лечения обожженных - непозволительны, так как за это время состояние больных может ухудшиться за счет присоединения осложнений, и выполнение операции у многих из них становится проблематичным. Поэтому мы, как и комбустиологи всего мира, стремимся выполнить закрытие ран аутотрансплантатами в максимально короткие сроки. Это достигается хирургическими методами лечения: некротомией, некрэктомией и свободной пересадкой кожи. Идеальным методом хирургического лечения глубоких ожогов является радикальное иссечение нежизнеспособных тканей с одномоментной кожной пластикой образовавшегося дефекта в первые 2-3 дня после получения ожогов. Однако трудность диагностики глубины поражения, травматичность самой операции, отсутствие уверенности в полном удалении мертвых тканей приводят к тому, что ее возможно выполнять лишь у ограниченного числа обожженных с площадью глубокого ожога не более 10% поверхности тела.
Для удаления остатков нежизнеспособных тканей используются частые (вплоть до ежедневных) перевязки с антисептическими растворами, ферментами, антибиотиками. В дальнейшем при начинающемся росте грануляционной ткани переходют на мазевые повязки (2% фурацилиновая мазь, левомеколь, диоксиколь и др.). Хорошо себя зарекомендовала мазь Лавендула, содержащая антисептик мирамистин и фермент бактериального происхождения ультрализин. Мирамистин хорошо подавляет грамотрицательную и грамположительную микрофлору, а ультрализин способствует протеолизу и удалению оставшихся мертвых тканей.
В этот же период применяются различные мази на трикотажной сетчатой основе. Среди них заслуживают внимания однослойные мазевые повязки с 5% диоксидиновой мазью. Обычно после 2-3 перевязок мы могли отметить уменьшение гнойного отделяемого, активизацию роста грануляционной ткани, снижение микробной обсемененности ожоговых ран. Важным преимуществом данной повязки является также то, что она легко и безболезненно удаляется с поверхности раны на очередной перевязке.
В этой же фазе раневого процесса (регенерация) с используются препараты, стимулирующие рост грануляций: салфетки с гиалуроновой кислотой, бальзамические повязки и т.п. Не потеряла своего значения ксенотрансплантация свиной кожи для временного покрытия обширных ожоговых поверхностей с целью защиты их от внутрибольничной инфекции и уменьшения потерь белков, электролито и, жидкостей.
Показателем готовности раны к закрытию ее аутотрансплантатами считается наличие ярко-красного грануляционного покрова с необильным гнойным отделяемым с выраженной каймой краевой эпителизации, отсутствие остатков нежизнеспособных тканей.
Обязательным условием для выполнения операции свободной пересадки кожи является отсутствие гипопротеинемии (общий белок не менее 60 г/л), гипоальбуминемии (белковый коэффициент не менее 1), анемии (гемоглобин не ниже 90 г/л). Временным противопоказанием к операции считается наличие в ране b-гемолитического стрептококка. К удалению грануляций перед аутодермопластикой мы прибегаем крайне редко, так как почти всегда удается добиться хорошего состояния последних и есть надежда на хорошее приживление трансплантатов.
Ожоговые раны на площади до 15-20% поверхности тела обычно закрываем в один этап, более обширные ожоговые раны нуждаются в 2-3-, а иногда и в 4-5-этапных операциях. Срезание кожных лоскутов выполняем дерматомами с ручным или электрическим приводом под общим обезболиванием. Проблема дефицита донорских ресурсов при этом решается с помощью сетчатых аутодермотрансплантатов с коэффициентом растяжения от 1:2 до 1:6. Повторное срезание кожных лоскутов с зажившего донорского участка также позволяет решать проблему дефицита донорских ресурсов. Быстрой эпителизации донорских ран способствует наложение после операции однослойных мазевых повязок с 5% диоксидиновой мазью: при толщине срезанных трансплантатов 0,3 мм донорские раны эпителизировались за 10-12 дней. Закрытие всех ожоговых ран аутотрансплантатами производим за 2-2,5 месяца с момента ожогового поражения.
В послеоперационном периоде местное лечение также не утратило своей значимости. Речь идет о больных, у которых имеет место частичное расплавление кожных лоскутов и образование между ними множества гранулирующих ран. В данной ситуации полезными оказываются различные губчатые покрытия (коласпон, дигиспон, биотравм, гешиспон и др.), которые способны не только реально стимулировать репаративные процессы, но и обладают противовоспалительным действием. К сожалению, в настоящее время многие из них в связи с тяжелой экономической ситуацией в стране не выпускаются отечественной промышленностью. Для борьбы с избыточными грануляциями применяем мази с гидрокортизоном.
Описанное выше хирургическое лечение обширных глубоких ожогов укладывается в понятие “активная хирургическая тактика”, сформулированное 40 лет назад Н.И. Атясовым. В процессе оперативного лечения обожженных не потеряли своего значения и физические методы воздействия на раневой процесс (УВЧ, УФО, лазеротерапия, кровати “Клинитрон”, потолки с инфракрасным излучением и т.п.). Местное лечение обширных глубоких ожогов проводится на фоне интенсивной инфузионно-трансфузионной терапии, позволяющей поддерживать показатели гомеостаза в пределах нормальных значений.
Первый опыт применения для закрытия ран после глубоких ожогов эпидермальных кератиноцитов, выращенных вне организма больного, показал его перспективность в решении проблемы дефицита донорских ресурсов (А.В.Васильев и соавт., 1994). Теоретически этот метод предполагает создание безграничных донорских ресурсов, т.к. из маленького кусочка кожи выращиваются эпителиальные пласты, превышающие площадь этой кожи в 100 и более раз. Однако трудоемкость, сложность и большая стоимость выращивания кератиноцитов не позволяют в настоящее время внедрить этот метод в практическую медицину.
Активная хирургическая тактика позволила улучшить результаты лечения тяжело обожженных, расширить границы выживаемости при крайне тяжелых ожогах, сохранять жизнь некоторым больным с глубокими ожогами на площади 50 - 60% и более поверхности тела.
1. Т.Я. Арьев. Ожоги и отморожения. “Медицина”, 1971.
2. Н.И. Атясов. Система активного хирургического лечения тяжело обожженных. Г., 1972.
3. В. Рудовский и соавт. Теория и практика лечения ожогов М., “Медицина”, 1980.
4. М.И. Кузин и соавт. Ожоговая болезнь. М., “Медицина”, 1982.
5. Б.С. Вихриев, В.М. Бурмистров. Ожоги. Л., “Медицина”, 1986.
6. С.В. Смирнов, Л.П. Логинов. Результаты лечения ожоговых ран с использованием отечественного антисептика мирамистина. В мат. симпоз. “Мирамистин - новый отечественный антисептик широкого спектра действия”. М., 2000, с.17
7. А.В. Васильев и соавт. Применение выращенных эпителиальных пластов для лечения обожженных. Травматология и ортопедия, 1994; 4: 34-9.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
В Московском ожоговом центре НИИ скорой помощи им. Н.В. Склифосовского (руководитель – профессор С.В. Смирнов) накоплен значительный опыт лечения обожженных. Ежегодно около тысячи пострадавших госпитализируется, еще двум тысячам оказывается квалифицированная амбулаторная помощь.
Ожоговая травма является самой тяжелой из всех видов травматизма, вызывая множественные и длительные нарушения гомеостаза, приводящие к дисфункции органов и систем. Основными задачами лечения обожженных является сохранение жизни пациентов и восстановление целостности кожного покрова. Начиная со стадии шока и до стадии реконвалесценции, больной нуждается в интенсивном комплексном лечении, включающем инфузионно–трансфузионную терапию, коррекцию катаболических процессов и иммунодепрессии, профилактику инфекционных осложнений и генерализации инфекции. Эти проблемы требуют специального обсуждения, но они тесно связаны с вопросами местного лечения ожоговых ран, являющихся важнейшим источником инфекционных осложнений, прежде всего пневмонии и сепсиса, которые наиболее часто приводят к летальным исходам.
При поверхностных ожогах II степени (эпидермальных), IIIА степени (субдермальных) и IIIБ степени (дермальных) восстановление кожных покровов и хороший функциональный результат в первую очередь зависят от своевременно начатого и патогенетически обоснованного лечения. Лечебные мероприятия включают:
• восстановление микроциркуляции для сохранения тканей паранекротической зоны;
• защиту от инфицирования и подавление роста микрофлоры;
• возможно раннее иссечение некротических тканей;
• стимуляцию процессов регенерации (эпителизации или развития грануляционной ткани);
• при дермальных ожогах оперативное восстановление кожного покрова.
Для лечения ожоговых ран в амбулаторных и стационарных условиях методом выбора является повязочный метод. При этом повязка в известной мере предохраняет ожоговую раневую поверхность от инфицирования, удерживает на ране лекарственные препараты, способна всасывать раневое отделяемое. Выбор лекарственных средств определяется глубиной ожога, стадией течения раневого процесса, характером инфицированности раны.
Каждая лекарственная форма (мази, растворы) имеет свои показания к применению. По воздействию на раневой процесс при ожогах монокомпонентные препараты можно разделить на следующие группы:
• противомикробного действия, содержащие антибиотики, антисептики, сульфаниламиды (мази линкомициновая, тетрациклиновая, синтомициновая, фурацилиновая, диоксидиновая, дермазин и т.д.; растворы хлоргексидина, фурацилина, йодопирона, борной кислоты, калия перманганата, натрия гипохлорита);
• противовоспалительного действия, содержащие гормональные препараты (мази фторокорт, локакортен, преднизолон и др.);
• протеолитического и кератолитического действия (салициловая мазь, профезим, ируксол и др.);
• стимулирующие регенерацию (мази метилурациловая, солкосерил);
• местные обезболивающие средства (тримекаин, лидокаин).
Важнейшим звеном местного лечения является воздействие на микрофлору. Ожоговая рана нуждается в антибактериальной терапии с момента возникновения до полного ее закрытия, поскольку колонизация микроорганизмами с развитием гнойного воспаления приводит к тяжелой интоксикации, препятствует заживлению эпидермальных и субдермальных ожогов, ведет к углублению ожоговых ран, лизису и отторжению аутодермотрансплантатов, служит источником генерализации инфекции.
По данным лаборатории бактериологии, эпидемиологии и антибиотикотерапии НИИ СП им. Н.В. Склифосовского (рук. – д.м.н. Д.Д. Меньшиков), отделяемое ожоговых ран наиболее часто содержит стафилококки (почти в 75% случаев), несколько реже – синегнойную палочку (около 50%) и значительно реже другие микроорганизмы (рис. 1). Формирование в ранах ассоциаций микроорганизмов, обладающих различной чувствительностью или резистентностью к антибактериальным препаратам, значительно затрудняет выбор лекарственных средств для местного лечения ожоговых ран.
Рис. 1. Микроорганизмы, высеваемые из ожоговых ран
При решении вопроса о применении той или иной мази учитывается не только чувствительность микрофлоры к антимикробному препарату, но и характер мазевой основы. Мази на жировой основе (фурацилиновая, Вишневского) не обладают осмотической активностью, не способны дренировать рану, а напротив, создают так называемый «парниковый эффект». Наложение повязок с мазями на жировой основе показано в воспалительно–регенераторной и регенераторной фазах течения раневого процесса, когда нет обильного гнойного отделяемого и необходимо защитить эпителизирующуюся или гранулирующую раневую поверхность. Исключение составляют ожоги кистей, когда «парниковый эффект» необходим для сохранения и защиты от высыхания тканей паранекротической зоны и близко расположенных движущихся структур пальцев и тыла кисти. Этот «парниковый эффект» можно подкрепить наложением на повязку целофанового пакета.
Ошибочным является наложение повязок на жировой основе в дегенеративной, дегенеративно–воспалительной и воспалительной фазах течения при обильном раневом отделяемом. Это приводит к нарушению оттока, вызывает усиление всех признаков интоксикации, ухудшает общее состояние больного.
Мази на эмульсионной основе (линименты синтомицина и стрептоцида, кремы дермазин, фламазин и др.) содержат значительное количество воды и не обладают сорбционной способностью. Их целесообразно применять при ожогах II степени во всех фазах течения раневого процесса, при ожогах IIIА степени – в регенераторной фазе. Суммируя вышеизложенное, приводим алгоритм местного лечения ожогов (табл. 1).
Консервативный повязочный метод лечения при ожогах II– IIIА степени является основным, при этом сроки эпителизации составляют в среднем 14–21 сут. При ожогах IIIБ степени повязочный метод является вспомогательным, обеспечивая подготовку к оперативному лечению – некрэктомии и аутодермопластике. В этих случаях сроки лечения и восстановления кожного покрова зависят от общей площади поражения и площади глубоких ожогов и, как правило, превышают 30 сут.
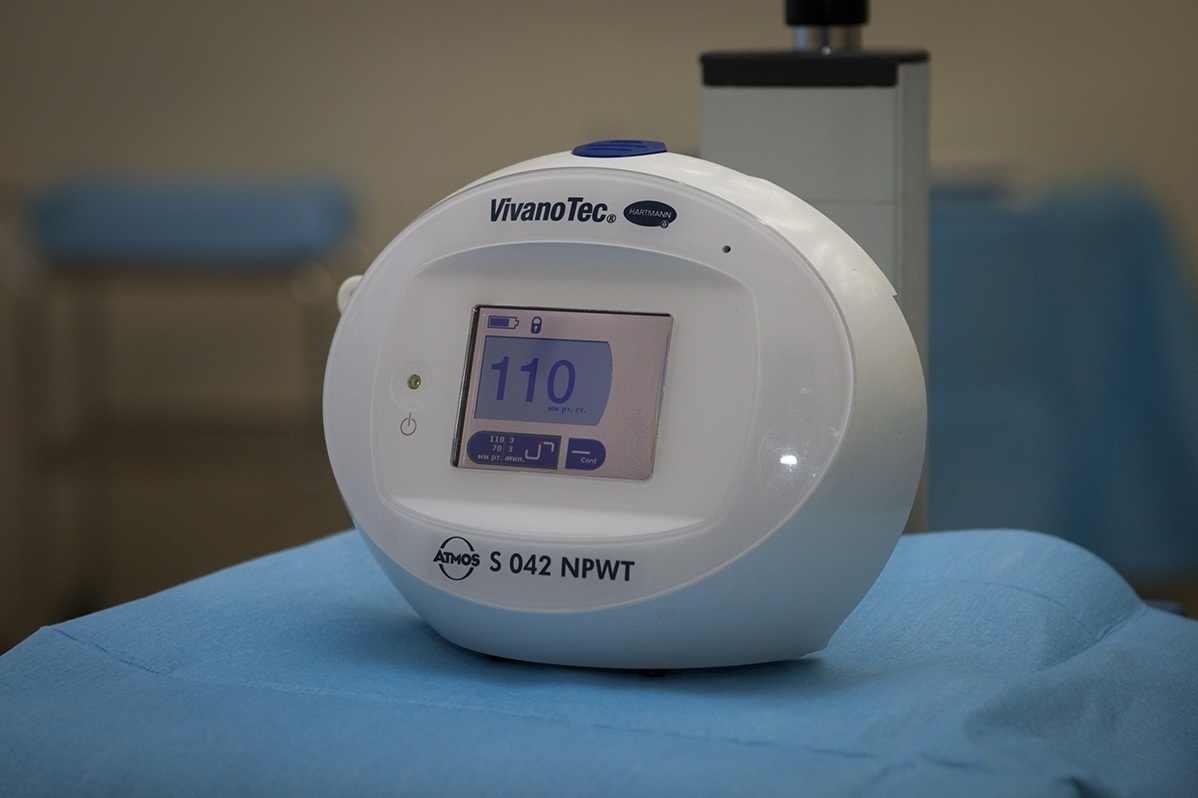
Вакуумная терапия ран (NPWT - Negative pressure wound treatment) — инновационный подход в лечении ран местным отрицательным давлением. Используемый нами, аппарат для вакуумной терапии ран VivanoTec (Atmos, Германия) вырабатывает контролируемое отрицательное давление постоянной величины, применяемое на раневую поверхность.
Лечение отрицательным давлением – это современная методика лечения ран, которая приводит к ускорению заживления ран и позволяет успешно лечить раны, оптимизируя течение раневого процесса. Вакуумная терапия ран имеет широкий диапазон показаний к применению - это острые и хронические раны, пролежни, диабетические / нейропатические язвы, венозные и артериальные язвы, язвы при васкулитах, расхождение послеоперационных швов, открытые раны брюшной полости и грудной клетки, ожоги, фиксация кожных трансплантатов при аутодермопластике.

21-24 ноября 2016 г. на базе ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава РФ, состоялся 3-ий Международный Конгресс «Раны и раневые инфекции».

21 октября 2016 года в г. Казани состоялась VIІI Всероссийская научно-практическая конференция с международным участием «Актуальные вопросы диагностики.

10-11 ноября 2016 года на базе ГБУЗ «Научно-исследовательский институт - Краевая клиническая больница № 1 им. проф. С.В. Очаповского» Министерства здравоохранения.

16-17 мая 2016 года в г. Москве состоялась Международная научно-практическая конференция «Реконструктивные и пластические операции в хирургии ран у детей.

Врачи-хирурги отделения гнойной хирургии приняли участие в мастер-классе «Метод лечения ран отрицательным давлением. Показания и противопоказания. Общие.
Читайте также:

