Тербинафин или итраконазол при лишае
Обновлено: 01.05.2024
В последние десятилетия отмечается значительный рост грибковых заболеваний. Это связано со многими факторами и, в частности, с широким применением в медицинской практике антибиотиков широкого спектра действия, иммунодепрессантов и других групп ЛС.
В связи с тенденцией к росту грибковых заболеваний (как поверхностных, так и тяжелых висцеральных микозов, ассоциированных с ВИЧ-инфекцией, онкогематологическими заболеваниями), развитием устойчивости возбудителей к имеющимся ЛС, выявлением видов грибов, ранее считавшихся непатогенными (в настоящее время потенциальными возбудителями микозов считаются около 400 видов грибов), возросла потребность в эффективных противогрибковых средствах.
Противогрибковые средства (антимикотики) — лекарственные средства, обладающие фунгицидным или фунгистатическим действием и применяемые для профилактики и лечения микозов.
Для лечения грибковых заболеваний используют ряд лекарственных средств, различных по происхождению (природные или синтетические), спектру и механизму действия, противогрибковому эффекту (фунгицидный или фунгистатический), показаниям к применению (местные или системные инфекции), способам назначения (внутрь, парентерально, наружно).
Существует несколько классификаций лекарственных средств, относящихся к группе антимикотиков: по химической структуре, механизму действия, спектру активности, фармакокинетике, переносимости, особенностям клинического применения и др.
В соответствии с химическим строением противогрибковые средства классифицируют следующим образом:
1. Полиеновые антибиотики: нистатин, леворин, натамицин, амфотерицин В, микогептин.
2. Производные имидазола: миконазол, кетоконазол, изоконазол, клотримазол, эконазол, бифоназол, оксиконазол.
3. Производные триазола: флуконазол, итраконазол, вориконазол.
4. Аллиламины (производные N-метилнафталина): тербинафин, нафтифин.
5. Эхинокандины: каспофунгин.
6. Препараты других групп: гризеофульвин, аморолфин, циклопирокс, флуцитозин.
Подразделение противогрибковых препаратов по основным показаниям к применению представлено в классификации Д.А. Харкевича (2006 г.):
I. Средства, применяемые при лечении заболеваний, вызванных патогенными грибами:
1. При системных или глубоких микозах (кокцидиоидомикоз, паракокцидиомикоз, гистоплазмоз, криптококкоз, бластомикоз):
- антибиотики (амфотерицин В, микогептин);
- производные имидазола (миконазол, кетоконазол);
- производные триазола (итраконазол, флуконазол).
2. При эпидермомикозах (дерматомикозах):
- производные N-метилнафталина (тербинафин);
- производные нитрофенола (хлорнитрофенол);
- препараты йода (раствор йода спиртовой, калия йодид).
II. Средства, применяемые при лечении заболеваний, вызванных условно-патогенными грибами (например при кандидамикозе):
- антибиотики (нистатин, леворин, амфотерицин В);
- производные имидазола (миконазол, клотримазол);
- бис-четвертичные аммониевые соли (деквалиния хлорид).
В клинической практике противогрибковые средства делят на 3 основные группы:
1. Препараты для лечения глубоких (системных) микозов.
2. Препараты для лечения эпидермофитий и трихофитий.
3. Препараты для лечения кандидозов.
Выбор ЛС при терапии микозов зависит от вида возбудителя и его чувствительности к ЛС (необходимо назначение ЛС с соответствующим спектром действия), особенностей фармакокинетики ЛС, токсичности препарата, клинического состояния пациента и др.
Грибковые заболевания известны очень давно, еще со времен античности. Однако возбудители дерматомикозов, кандидоза были выявлены только в середине XIX в., к началу XX в. были описаны возбудители многих висцеральных микозов. До появления в медицинской практике антимикотиков для лечения микозов использовали антисептики и калия йодид.
Полиеновые антибиотики — антимикотики природного происхождения, продуцируемые Streptomyces nodosum (амфотерицин В), Actinomyces levoris Krass (леворин), актиномицетом Streptoverticillium mycoheptinicum (микогептин), актиомицетом Streptomyces noursei (нистатин).
Механизм действия полиеновых антибиотиков достаточно изучен. Эти ЛС прочно связываются с эргостеролом клеточной мембраны грибов, нарушают ее целостность, что приводит к потере клеточных макромолекул и ионов и к лизису клетки.
Полиены имеют самый широкий спектр противогрибковой активности in vitro среди антимикотиков. Амфотерицин В при системном применении активен в отношении большинства дрожжеподобных, мицелиальных и диморфных грибов. При местном применении полиены (нистатин, натамицин, леворин) действуют преимущественно на Candida spp. Полиены активны в отношении некоторых простейших — трихомонад (натамицин), лейшманий и амеб (амфотерицин В). Малочувствительны к амфотерицину В возбудители зигомикоза. К полиенам устойчивы дерматомицеты (род Trichophyton, Microsporum и Epidermophyton), Pseudoallescheria boydi и др.Нистатин (крем, супп. ваг. и рект., табл.), леворин (табл., мазь, гран.д/р-ра для приема внутрь) и натамицин (крем, супп. ваг., табл.) применяют и местно, и внутрь при кандидозе, в т.ч. кандидозе кожи, слизистой оболочки ЖКТ, генитальном кандидозе; амфотерицин В (пор. д/инф., табл., мазь) используется преимущественно для лечения тяжелых системных микозов и является пока единственным полиеновым антибиотиком для в/в введения.
Все полиены практически не всасываются из ЖКТ при приеме внутрь, и с поверхности неповрежденной кожи и слизистых оболочек при местном применении.
Общими побочными системными эффектами полиенов при приеме внутрь являются: тошнота, рвота, диарея, боль в животе, а также аллергические реакции; при местном использовании — раздражение и ощущение жжения кожи.
В 80-е годы был разработан ряд новых ЛС на основе амфотерицина В — липид-ассоциированные формы амфотерицина В (липосомальный амфотерицин В — амбизом, липидный комплекс амфотерицина В — абелсет, коллоидная дисперсия амфотерицина В — амфоцил), которые в настоящее время внедряются в клиническую практику. Их отличает существенное снижение токсичности при сохранении противогрибкового действия амфотерицина В.
Липосомальный амфотерицин В (лиоф. пор. д/инф.) — современная лекарственная форма амфотерицина В, инкапсулированного в липосомы (везикулы, формирующиеся при диспергировании в воде фосфолипидов), отличается лучшей переносимостью.
Липосомы, находясь в крови, долгое время остаются интактными; высвобождение активного вещества происходит только при контакте с клетками гриба при попадании в ткани, пораженные грибковой инфекцией, при этом липосомы обеспечивают интактность ЛС по отношению к нормальным тканям.
В отличие от обычного амфотерицина В, липосомальный амфотерицин В создает более высокие концентрации в крови, чем обычный амфотерицин В, практически не проникает в ткань почек (менее нефротоксичен), обладает более выраженными кумулятивными свойствами, период полувыведения в среднем составляет 4–6 дней, при длительном использовании возможно увеличение до 49 дней. Нежелательные реакции (анемия, лихорадка, озноб, гипотензия), по сравнению со стандартным препаратом, возникают реже.
Показаниями к применению липосомального амфотерицина В являются тяжелые формы системных микозов у пациентов с почечной недостаточностью, при неэффективности стандартного препарата, при его нефротоксичности или некупируемых премедикацией выраженных реакциях на в/в инфузию.
Азолы (производные имидазола и триазола) — наиболее многочисленная группа синтетических противогрибковых средств.
Эта группа включает:
- азолы для системного применения — кетоконазол (капс., табл.), флуконазол (капс., табл., р-р в/в), итраконазол (капс., р-р для приема внутрь); вориконазол (табл., р-р в/в);
- азолы для местного применения — бифоназол, изоконазол, клотримазол, миконазол, оксиконазол, эконазол, кетоконазол (крем, мазь, супп. ваг., шампунь).
Первый из предложенных азолов системного действия — кетоконазол — в настоящее время из клинической практики вытесняют триазолы — итраконазол и флуконазол. Кетоконазол практически утратил свое значение ввиду высокой токсичности (гепатотоксичность) и используется преимущественно местно.
Противогрибковое действие азолов, как и полиеновых антибиотиков, обусловлено нарушением целостности мембраны клетки гриба, но механизм действия иной: азолы нарушают синтез эргостерола — основного структурного компонента клеточной мембраны грибов. Эффект связан с ингибированием цитохром P450-зависимых ферментов, в т.ч. 14-альфа-деметилазы (катализирует реакцию превращения ланостерола в эргостерол), что приводит к нарушению синтеза эргостерола клеточной мембраны грибов.
Азолы имеют широкий спектр противогрибкового действия, оказывают преимущественно фунгистатический эффект. Азолы для системного применения активны в отношении большинства возбудителей поверхностных и инвазивных микозов, в т.ч. Candida albicans, Cryptococcus neoformans, Coccidioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis, Paraccoccidioides brasiliensis. Обычно к азолам резистентны Candida glabrata, Candida krucei, Aspergillus spp., Fusarium spp. и зигомицеты (класс Zygomycetes). Препараты для местного применения при создании высоких концентраций в месте действия могут действовать фунгицидно в отношении некоторых грибов.
Азолы для системного применения (кетоконазол, флуконазол, итраконазол, вориконазол) хорошо всасываются при приеме внутрь. Биодоступность кетоконазола и итраконазола может значительно варьировать в зависимости от уровня кислотности в желудке и приема пищи, тогда как абсорбция флуконазола не зависит ни от pH в желудке, ни от приема пищи.
Флуконазол и вориконазол применяют внутрь и в/в, кетоконазол и итраконазол — только внутрь. Фармакокинетика вориконазола, в отличие от других системных азолов, является нелинейной — при повышении дозы в 2 раза AUC увеличивается в 4 раза.
Флуконазол, кетоконазол, итраконазол и вориконазол распределяются в большинство тканей, органов и биологических жидкостей организма, создавая в них высокие концентрации. Итраконазол может накапливаться в коже и ногтевых пластинках, где его концентрации в несколько раз превышают плазменные. Итраконазол практически не проникает в слюну, внутриглазную и спинно-мозговую жидкость. Кетоконазол плохо проходит через ГЭБ и определяется в спинно-мозговой жидкости лишь в небольших количествах. Флуконазол хорошо проходит через ГЭБ (уровень его в ликворе может достигать 50–90% от уровня в плазме) и гематоофтальмический барьер.
Системные азолы отличаются длительностью периода полувыведения: T1/2 кетоконазола — около 8 ч, итраконазола и флуконазола — около 30 ч (20–50 ч). Все системные азолы (кроме флуконазола) метаболизируются в печени и выводятся преимущественно через ЖКТ. Флуконазол отличается от других антифунгальных средств тем, что выводится через почки (преимущественно в неизмененном виде — 80–90%).
Наиболее частые побочные эффекты азолов системного применения включают: боль в животе, тошноту, рвоту, диарею, головную боль, повышение активности трансаминаз, гематологические реакции (тромбоцитопения, агранулоцитоз), аллергические реакции — кожная сыпь и др.
Азолы для местного применения (клотримазол, миконазол и др.) плохо абсорбируются при приеме внутрь, в связи с чем используются для местного лечения. Эти ЛС создают высокие концентрации в эпидермисе и нижележащих слоях кожи. Наиболее длительный период полувыведения из кожи отмечается у бифоназола (19–32 ч).
Поскольку азолы ингибируют окислительные ферменты системы цитохрома Р450 (кетоконазол > итраконазол > флуконазол), эти ЛС могут изменять метаболизм других лекарств и синтез эндогенных соединений (стероиды, гормоны, простагландины, липиды и др.).
Аллиламины — синтетические ЛС. Оказывают преимущественно фунгицидное действие. В отличие от азолов, блокируют более ранние стадии синтеза эргостерола. Механизм действия обусловлен ингибированием фермента скваленэпоксидазы, катализирующей вместе со скваленциклазой превращение сквалена в ланостерол. Это приводит к дефициту эргостерина и к внутриклеточному накоплению сквалена, что вызывает гибель гриба. Аллиламины обладают широким спектром активности, однако клиническое значение имеет только их действие на возбудителей дерматомикозов, в связи с чем основными показаниями к назначению аллиламинов являются дерматомикозы. Тербинафин применяют местно (крем, гель, мазь, спрей) и внутрь (табл.), нафтифин — только местно (крем, р-р наружн.).
Каспофунгин применяется только парентерально, т.к. биодоступность при пероральном приеме составляет не более 1%. После в/в инфузии высокие концентрации наблюдаются в плазме, легких, печени, селезенке, кишечнике.
Применяют каспофунгин для лечения кандидоза пищевода, инвазивных кандидозов (в т.ч. кандидемии у пациентов с нейтропенией) и инвазивного аспергиллеза при неэффективности или непереносимости других видов терапии (амфотерицин В, амфотерицин В на липидных носителях и/или итраконазол).
ЛС других групп. К противогрибковым препаратам других групп относятся средства для системного (гризеофульвин, флуцитозин) и местного применения (аморолфин, циклопирокс).
Гризеофульвин — одно из первых противогрибковых средств природного происхождения — антибиотик, продуцируемый плесневым грибом Penicillium nigricans (griseofulvum). Гризеофульвин до сих пор остается одним из основных средств лечения дерматомикозов, применяется внутрь и местно.
Аморолфин — синтетический антимикотик широкого спектра действия для местного использования (в виде лака для ногтей).
Циклопирокс — синтетическое ЛС для местного применения.
В настоящее время в стадии разработки находятся антимикотики, являющиеся представителями уже известных групп противогрибковых средств, а также относящиеся к новым классам соединений: коринекандин, фузакандин, сордарины, циспентацин, азоксибациллин.
Литература
Антимикробные и противогрибковые лекарственные средства/ Под ред. Ю.В. Немытина.- М.: Ремедиум, 2002.- С. 57-59.
Базисная и клиническая фармакология/ Под ред. Б.Г. Катцунга; пер. с англ. под ред. Э.Э. Звартау: в 2 т.- М.-СПб.: Бином-Невский диалект, 1998.- Т. 2.- С. 290-297, 555-559.
Виноградов В.М., Каткова Е.Б., Мухин Е.А. Фармакология с рецептурой/ Под ред. В.М. Виноградова.- 4-е изд, испр.- СПб.: СпецЛит, 2006.- С. 221-232.
Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология: Учебник для мед.вузов.- 3-е изд., испр. и доп.- СПб.: СпецЛит, 2002.- С. 491-511.
Климко Н.Н., Веселов А.В. Новые препараты для лечения инвазивных микозов// Клиническая микробиология и антимикробная терапия.- 2003.- Т. 5.- № 4.- С. 342-353.
Клиническая фармакология по Гудману и Гилману/ Под общей редакцией А.Г. Гилмана. Пер. с англ.- М.: Практика, 2006.- с 996-1010.
Машковский М.Д. Лекарства XX века.- М.: Новая Волна, 1998.- С. 159-161, 250.
Машковский М.Д. Лекарственные средства: в 2 т.- 14-е изд.- М.: Новая Волна, 2000.- Т. 2.- С. 352-366.
Михайлов И.Б. Настольная книга врача по клинической фармакологии: Руководство для врачей.- СПб.: Фолиант, 2001.- с. 119-126.
Митрофанов В.С. Системные антифунгальные препараты// Проблемы медицинской микологии.- 2001. -Т.3, №2. - С.6-14.
Практическое руководство по антиинфекционной химиотерапии/ Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова.- М.: Боргес, 2002.- С. 129-144.
Рациональная фармакотерапия в стоматологии: Рук. для практикующих врачей/ Г.М. Барер, Е.В. Зорян, В.С. Агапов, В.В. Афанасьев и др.; под общ. ред. Г.М. Барера, Е.В. Зорян.- М.: Литтерра, 2006.- С. 74-78. (Рациональная фармакотерапия: Сер. руководство для практикующих врачей; Т. 11).
Рациональная фармакотерапия в офтальмологии: Рук. для практикующих врачей/ Е.А. Егоров, В.Н. Алексеев, Ю.С. Астахов и др.; под общ. ред. Е.А. Егорова.- М.: Литтерра, 2004.- С. 76-80. (Рациональная фармакотерапия: Сер. руководство для практикующих врачей; Т. 7).
Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем: Рук. для практикующих врачей/ А.А. Кубанова, В.И. Кисина, Л.А. Блатун, А.М. Вавилов и др.; под общ. ред. А.А. Кубановой, В.И. Кисиной.- М.: Литтерра, 2005.- С. 145-182. (Рациональная фармакотерапия: Сер. руководство для практикующих врачей; Т. 8).
Федеральное руководство по использованию лекарственных средств (формулярная система)/ Под ред. А.Г. Чучалина, Ю.Б. Белоусова, В.В. Яснецова.- Вып. VIII.- М.: ЭХО, 2007.- С. 705-713.
Харкевич Д.А. Фармакология: Учебник.- 9-е изд., перераб., доп. и испр.- М.: Гэотар-Медицина, 2006.- С. 653-659.
Харкевич Д.А. Фармакология: Учебник.- 9-е изд., перераб., доп. и испр.- М.: Гэотар-Медицина, 2006.- С. 653-659.
Для цитирования: Сравнение непрерывного лечения тербинафином с пульс-терапией итраконазолом при онихомикозах стоп. РМЖ. 2001;11:482.
Для системной терапии онихомикозов в настоящее время используют тербинафин (Ламизил) из группы аллиламинов, обладающий фунгицидным действием, и итраконазол (Орунгал), относящийся к триазолам и оказывающий фунгистатический эффект. Лечение тербинафином обычно проводят непрерывно в течение 12 нед, итраконазол применяют непрерывно (в те же сроки) или в течение 1 нед каждого месяца на протяжении 3–4 мес (пульс-терапия), причем пульс-терапию ряд авторов считают столь же эффективной, как и непрерывное лечение итраконазолом или тербинафином. В проспективном многоцентровом двойном слепом рандомизированном исследовании изучена эффективность и безопасность непрерывного лечения тербинафином в сравнении с пульс-терапией итраконазолом у больных онихомикозами стоп. В исследовании, проводившемся в течение 72 нед, принимали участие 35 центров 6 стран Европы. Группу изучения составили 496 больных в возрасте от 18 до 75 лет с наличием клинически и микологически подтвержденного онихомикоза стоп, вызванного дерматофитами. Больные были рандомизированы в 4 параллельные группы и получали лечение тербинафином 250 мг/сут в течение 12 (группа Т12) или 16 нед (Т16) или итраконазолом 400 мг/сут (4 капсулы по 100 мг) в течение 1 нед каждого месяца на протяжении 3 или 4 месяцев (группы И3 и И4).
Первичным критерием эффективности являлась частота микологического излечения, определяемого на основании отрицательных результатов микроскопических и культуральных исследований материала, взятого из целевых пораженных ногтей (ногтя большого пальца стопы). Частота микологического излечения оценивалась через 72 нед наблюдения. Вторичными критериями эффективности служили частота клинического излечения (100% очищение ногтя), частота полного излечения (микологического и клинического), клиническая эффективность (микологическое излечение, отрастание не менее 5 мм нового ногтя, не пораженного микозом) и общая оценка, которую давали врач и больной.
Частота микологического излечения через 72 недели составила: 75,7% и 80,8% в группах Т12 и Т16, 38,3% и 49,1% в группах И3 и И4 (см. рис.). Частота клинического излечения при любом из режимов лечения тербинафином была достоверно выше по сравнению с пульс-терапией итраконазолом (р<0,0022). На протяжении всего исследования (вплоть до 72-й недели) частота микологического и клинического излечения в обеих группах тербинафина продолжала повышаться, тогда как в группах итраконазола она не менялась.
Рис. Частота микологического излечения (в %)
Сообщили о нежелательных явлениях 236 больных (55, 61, 60 и 60 в группах Т16, Т12, И3, И4 соответственно). Характеристики нежелательных явлений для всех 4 групп достоверно не различались и не выходили за рамки известных профилей безопасности обоих препаратов.
Результаты лечения оценили как хорошие или очень хорошие 79-85% врачей и больных в группах тербинафина и лишь 44-55% - в группах итраконазола.
Проведенное исследование показало, что лечение тербинафином 250 мг/сут в течение 12 или 16 нед обеспечивает большую частоту микологического и клинического излечения по сравнению с пульс-терапией итраконазолом через 72 нед наблюдения.
Одним из возможных объяснений более высокой эффективности тербинафина в данном исследовании являются описанные в литературе различия фунгицидной и фунгистатической концентраций обоих препаратов. Тербинафин оказывает фунгицидное действие в отношении дерматофитов, и его минимальная фунгицидная концентрация (МФК) составляет примерно 0,004 мкг/мл. Итраконазол же оказывает фунгистатическое действие, и его средняя МФК в отношении дерматофитов составляет примерно 0,6 мкг/мл. При лечении тербинафином в ногте создаются концентрации препарата, в 100 раз превышающие его МФК, в то время как при применении итраконазола концентрация препарата в ногте находится лишь на границе между фунгистатической и фунгицидной концентрацией. Колебания концентраций итраконазола, наблюдаемые у разных больных, могут ухудшать результаты лечения, в то время как применение тербинафина, несмотря на значительные колебания концентраций, обеспечивает уничтожение патогенного возбудителя. Терапевтическое преимущество тербинафина более наглядно проявилось именно в данном исследовании, так как в него были включены больные, имевшие тяжелый онихомикоз с относительно большой распространенностью поражения и длительным течением заболевания.
Литература:
По материалам: E.G.V. Evans, B. Sigurgeirsson. Double blind, randomised study of continuous terbinafine compared with intermittent itraconazole in treatment of toenail onychomycosis. // British Medical Journal, 1999; 318: 1031-1035.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Авторы: Потекаев Н.Н. , Жукова О.В. 1 , Цыкин А.А. 2 , Сирмайс Н.С.
1 ГБУ «МНПЦДК ДЗМ», Москва
2 ГБУЗ «Московский научно-практический Центр дерматовенерологии и косметологии Департамента здравоохранения города Москвы»
Для цитирования: Потекаев Н.Н., Жукова О.В., Цыкин А.А., Сирмайс Н.С. Опыт успешного лечения онихомикозов итраконазолом (Итразол®). РМЖ. Медицинское обозрение. 2014;22(24):1790.
Онихомикоз – широко распространенное среди населения хроническое грибковое поражение ногтей, вызываемое патогенными грибами рода Trichophyton, Epidermophyton, дрожжеподобными грибами рода Candida, плесневыми грибами. Данное заболевание является одним из самых распространенных во всем мире. Так, по различным статистическим данным, частота онихомикоза составляет от 2 до 18,5%, а в старшей возрастной группе после 60 лет – до 50% [1–4], хотя на деле распространение зависит от социальных и климатических условий, профессии, пола, а также растет пропорционально возрасту, поэтому истинная цифра заболеваемости гораздо выше 20% [5, 6].
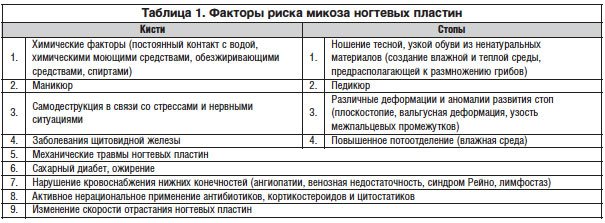
Существует достаточно много факторов риска для возникновения онихомикозов, таких как плотная и тесная обувь, занятия спортом, повышенная потливость стоп, хроническая внутрисемейная инфекция, сахарный диабет, различные деформации стопы, нарушение кровоснабжения нижних конечностей (ангиопатии, венозная недостаточность, синдром Рейно, лимфостаз) и др. [7]. Основные факторы риска указаны в таблице 1.
Первичное поражение ногтевых пластин грибами наблюдается редко, чаще онихомикозы являются одним из клинических проявлений микозов стоп или кистей.
Всех возбудителей онихомикозов принято делить на 3 основные группы:
1. Дерматомицеты. Было отмечено, что около 20 видов дерматофитов могут вызывать поражение ногтевых пластин, но в настоящее время наиболее частым возбудителем онихомикозов является красный трихофитон (T. rubrum). Так, в России дерматомицеты определяются в среднем в 75% случаев [8], в Канаде – в 87% [9], в Германии – в 65% [10]. Эти грибы обладают выраженной кератофильностью за счет протеолитических ферментов, позволяющих им проникать в кожу и ногти, а также разрушать и усваивать кератин. Поражение начинается обычно со свободного или бокового края ногтя, при этом основной микотический процесс идет в ложе ногтя. Ногтевая пластинка утолщается, имеет желтоватую окраску и зазубренный край, наблюдается подногтевое скопление роговых масс (подногтевой гиперкератоз), ногтевой валик не поражен. На кистях поражение ногтей встречается реже и представлено, как правило, онихолизисом за счет нарушения соединения ложа с пластинкой ногтя из-за утолщения рогового слоя с дистального края. Патологический процесс, постепенно распространяясь к проксимальному краю, захватывает весь ноготь полностью.
2. Дрожжеподобные грибы рода Candida. На долю кандидоза ногтей приходится около 10–15% от всех онихомикозов. Для дрожжевой онихии характерна комбинация ее с паронихией – воспаление околоногтевого валика с выделением из-под него небольшого количества гноя. Отек и утолщение валика приводят к тому, что кутикула ногтя отделяется от его дорсальной поверхности с последующим исчезновением эпонихиона. Сам ноготь при этом теряет блеск, становится желтоватым, неровным, с поперечными бороздами, чаще с проксимальной части или боковых участков. Следует отметить, что при кандидозе ногтей процесс чаще начинается с кистей, хотя в последнее время наблюдается и частое изолированное поражение Candida ногтевых пластин стоп.
3. Плесневые грибы, из которых чаще выявляются Aspergillus spp., Fusarium spp., Scytalidium spp., Acremonium spp., Scopulariopsis brevicaulis [11]. Особенностями поражения ногтей плесневыми грибами являются изменение цвета ногтевой пластины от желтого и зеленого до красного и черного, истончение и тусклость ногтей.
При анализе 231 случая в МНПЦДК ДЗМ при культуральном обследовании наблюдается несколько иная картина, и в последнее время в посевах все чаще стали высеваться дрожжевые и плесневые грибы. Данные наших наблюдений представлены на рисунке 1.
Возможно, эти данные можно связать с модным течением индустрии красоты – наращиванием ногтевых пластин, покрытием ногтей гелями, акрилом или гель-лаком Shellac, но это требует дальнейшего изучения и отслеживания.
Клинически различают три типа поражения ногтевых пластин [3, 12, 13], данная классификация разработана А.М. Ариевичем (1967 г.).
При нормотрофическом типе онихии наблюдается частичное изменение ногтевых пластинок в виде краевого поражения или полос в толще ногтя белого или желтоватого цвета (рис. 2).
При гипертрофическом типе, наблюдаемом чаще на стопах, ногтевая пластинка утолщается, легко крошится со свободного края, ломается, отмечается подногтевой гиперкератоз, могут наблюдаться белые или желтоватые полосы (рис. 3).
Атрофический тип (онихолитический) характеризуется значительным разрушением или истончением ногтевой пластинки, которая лишь частично сохраняется у ногтевого валика, ноготь становится тусклым. Часто наблюдается отхождение ногтевой пластины от ногтевого ложа (рис. 4).
В последнее время в клинической практике чаще применяют классификацию онихомикозов N. Zaias (1972 г.), в которой выделены 4 формы: дистальная (дистально-латеральная) подногтевая, поверхностная (поверхностная белая), проксимальная подногтевая, тотальная дистрофическая.
У детей онихомикоз зачастую представлен изменениями, характерными и для заболеваний ногтей негрибковой природы: так, поверхность ногтей часто шероховатая, подногтевой гиперкератоз встречается редко, форма ногтя зачастую не меняется. Наиболее часто у детей выявляется онихомикоз, вызванный Candida spp. (рис. 5).
Дифференциальный диагноз проводят с теми дерматозами, при которых в процесс могут вовлекаться ногтевые пластинки: псориаз, красный плоский лишай, экзема и др., а также с ониходистрофией, которая, по статистическим данным, встречается в 3–4 раза чаще, чем микоз ногтевых пластин [7].
Диагностика сводится к клиническим проявлениям, микроскопии и выделению культуры гриба на питательных средах (среда Сабуро). В последнее время иногда применяют ПЦР- диагностику, но широкого распространения этот метод не получил в связи со своей чувствительностью только к дерматомицетам.
Существует три основных метода терапии микоза ногтевых пластин.
Первый – местная терапия, заключается в нанесении противогрибковых средств (кремов, растворов, лаков) на поверхность ногтя и околоногтевых валиков. Этот метод исключает воздействие активного вещества на весь организм в целом и взаимодействие с другими препаратами, принимаемыми пациентами, но было отмечено, что наружные средства не всегда достигают возбудителя или дерматофитомы, полостного образования на ногте, тем самым только приостанавливая процесс, но не излечивая его.
Второй метод – системные препараты, которые принимаются пациентами согласно инструкции или указаниям врача несколько месяцев по изученным и рекомендуемым схемам. В данном случае необходимо тщательно следить за пациентами в связи с тем, что препараты могут влиять на другие органы и системы, а также может присутствовать индивидуальная непереносимость того или иного препарата с возможным развитием токсикоаллергической реакции. В то же время, системные препараты способны через кровь достигнуть матрикса ногтя, костномозгового канала пальцев, но в большинстве своем не обладают фунгицидным действием и не способны убрать дерматофитому. Первоначальное мнение о высокой токсичности препаратов для системной терапии микозов в настоящее время сменилось опытом их применения в различных ситуациях, разработкой более четких критериев ограничения терапии для различных фармакологических групп антимикотиков.
При лечении онихомикоза более стойкий терапевтический эффект достигается при применении третьего метода – комбинации удаления ногтей по любой методике (механическим путем или с применением кератолитиков), наружного лечения антимикотическими растворами, лаками, кремами и системными противогрибковыми препаратами (тербинафин, итраконазол, кетоконазол, флуконазол и др.), однако системные препараты необходимо назначать только после биохимического анализа крови.
Врачу на приеме, ориентируясь на возраст, пол пациента, тип онихомикоза, сопутствующие заболевания, а также свой опыт, необходимо подобрать курс терапии. При том, что на фармацевтическом рынке представлен огромный арсенал противогрибковых средств, оригинальные препараты не всегда финансово доступны пациентам, а ряд препаратов может быть противопоказан пожилым больным или отягощенным пациентам, и по этой причине некоторые больные и вовсе готовы отказаться от лечения. Одним из методов уменьшения затрат на лечение является использование дженериков. Для системной терапии онихомикозов чаще всего применяются тербинафин и итраконазол, которые способны накапливаться и сохраняться в ногтях, высокоэффективны и, как правило, хорошо переносятся большинством пациентов.
Ранее было установлено, что итраконазол приводит к гибели гриба посредством своего активного действия на синтез эргостерола, фосфолипидов и триглицеридов клеточной стенки грибов, что ведет к нарушению функции мембран, накоплению в грибковой клетке 14-метилированных стеринов и токсичных эндопероксидов, набуханию клеток и разрушению клеточных органелл. Поэтому препараты итраконазола заняли свою нишу среди наиболее часто рекомендуемых препаратов для лечения онихомикоза, делая максимально возможным излечение грибковой инфекции более чем у 95% пациентов.
Одним из препаратов, заслуживающих особого внимания, является препарат Итразол® (итраконазол), выпускаемый фармацевтической компанией «Вертекс». Препарат производится по стандартам GMP и по своему качеству и эффективности не уступает оригинальному препарату, в то же время отличается от последнего выгодной ценой и доступен большинству пациентов. Благодаря большой упаковке (42 капсулы) Итразол® имеет выгодную фармакоэкономическую характеристику, а также более высокие показатели комплаентности лечения онихомикоза. Итраконазол относится к синтетическим противогрибковым средствам группы триазолов, его действие обусловлено влиянием на липидосодержащие клеточные мембраны, он способен в связи с высокой кератофильностью в большом количестве накапливаться в тканях организма.
С целью изучения эффективности, переносимости и безопасности препарата Итразол® (ЗАО «Вертекс», MHH – итраконазол) в терапии онихомикозов у больных средней возрастной группы было проведено специальное исследование.
Материалы и методы
Под наблюдением находились 48 пациентов с онихомикозом стоп и кистей со множественным поражением ногтей от 5 до 14, в возрасте 35–52 лет, из них было 23 женщины и 25 мужчин (рис. 6).
Давность заболевания составляла от 7 мес. до 23 лет. У 29 пациентов наблюдался гипертрофический тип онихии, у 10 – нормотрофический, у 9 – онихолитический тип (табл. 2).
Полученные данные говорят о том, что в нашей выборке больше мужчин, чем женщин, а это указывает на популяризацию здорового образа жизни и то, что мужчины стали более бережно и тщательно следить за собой во всех аспектах, включая здоровье. Следует отметить, что, несмотря на то, что обращаемость мужчин на прием повысилась, женщины во всех возрастах приходят с меньшими поражениями и меньшим количеством пораженных ногтей. И если мужчины чаще связывают поражение ногтей со спортом, травмами и узкой обувью, то женщины все чаще стали отмечать появление изменений ногтей после посещения салонов красоты с покрытием ногтей разными гелями и лаками.
Часть пациентов (5 человек) ранее проходили лечение по поводу онихомикоза наружными и системными препаратами с хорошим эффектом, остальные обратились первично, терапии у врачей не получали, но самостоятельно большинство из них (34 человека) применяли различные средства наружной терапии без видимого улучшения (табл. 3).
В нашей выборке у всех пациентов диагноз был подтвержден как микроскопически, так и культурально. При этом материал для микроскопии и посева брался из глубоких слоев ногтя – там, где находится зона активного микотического процесса, после специальной подготовки с помощью распаривающих ванночек и герметизации тканевым пластырем за несколько дней до исследования.
Для объективности мы рассматривали три равные группы, согласно выделенным при посеве грибам – дерматомицетам, Candida spp. и плесневым грибам (табл. 4).
Перед началом терапии всем пациентам проводили комплексное обследование, которое включало общий и биохимический анализ крови, общий анализ мочи, кровь на сахар.
Параметры исключения пациентов:
– период беременности и лактации;
– возраст до 18 и старше 55 лет;
– пациенты с хроническими заболеваниями печени и почек, с серьезными соматическими заболеваниями, включая онкологию;
– пациенты, которые получали системную терапию различными антимикотиками менее полугода назад;
– изменения крови и мочи с существенными отклонениями от нормы, требующие дообследования;
– пациенты, не желающие проходить терапию препаратами, назначаемыми внутрь.
Всем пациентам вне зависимости от группы при гиперкератотическом типе онихомикоза проводили чистку аппаратным методом (скалеры, фрезы) с оставлением вентральной ногтевой пластинки либо кератолитиками (бифоназол). При других типах онихии чистка ногтевых пластин не проводилась.
Итразол® (итраконазол) назначался по схеме пульс-терапии по 2 капсулы 100 мг 2 р./сут 7 дней с последующим трехнедельным перерывом, 3–4 пульса в зависимости от степени поражения ногтевых пластин. Наружно во всех группах назначался раствор бифоназол 2 р./сут на протяжении всего лечения. Дезинфекция обуви проводилась 1 раз в неделю противогрибковым аппаратом для обработки обуви Timson.
На каждом приеме осуществлялась оценка субъективного состояния пациентов и переносимости препарата с фиксацией нежелательных явлений. С целью контроля терапии на повторных приемах проводилось измерение протяженности нарастания здоровой части ногтя с фиксацией в амбулаторных картах.
Результаты
Клинически значимых отклонений в анализах крови и мочи выявлено не было. У 5 пациентов был повышен уровень глюкозы, до этого только 1 пациенту был выставлен диагноз «сахарный диабет». Из соматических заболеваний были выявлены следующие:
– сахарный диабет – 1;
– варикозная болезнь нижних конечностей – 6;
– облитерирующий эндартериит – 1;
– гипертоническая болезнь – 3;
– стенокардия напряжения – 2;
– ревматоидный артрит – 1.
По протяженности поражения ногтей были выявлены закономерности, представленные в таблице 5.
Полученные данные говорят о том, что степень протяженности и глубины поражения ногтей зависит от возраста пациентов и о том, что, возможно, первичное заражение происходит в трудоспособном возрасте, что указывает на необходимость ранней диагностики и профилактического лечения лиц среднего возраста.
Таким образом, препарат Итразол® может быть рекомендован для широкого практического применения в связи с его высокой эффективностью, безопасностью, хорошей переносимостью и доступной стоимостью по сравнению с аналогами и оригинальным препаратом.





Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Е. И. Касихина, Е. В. Мокина*
Российская медицинская академия последипломного образования Росздрава, Медицинский центр «Медико-С», Москва* Проведен клинический анализ течения заболевания и оценка эффективности комбинированного применения препаратов «Микофлюкан» и «Экзифин» (в качестве системного и местного средства) у 132 больных онихомикозами в возрасте от 25 до 40 лет. Критерий отбора больных — неудачи предыдущего системного лечения. Этиологи ческая эффективность лечения составила 92,2 %. Применение препаратов «Микофлюкан» и «Экзифин» отличалось хорошей переносимостью (98,5 %) и минимумом побочных эффектов.
Ключевые слова: онихомикоз, микофлюкан (флуконазол), экзифин (тербинафин).
Clinical evaluation of efficacy of combination of fluconazole and terbinafine in the treatment of onychomycosis
E. I. Kasihina, E. V. Mokina The study involved 132 patients with onychomycosis aged 25—40. The examined patients received the following complex therapy: antifungal drug Micoflucan (fluconazole) in tablets аnd Ekzifin (terbinafine) in tablets and externally. The clinical efficacy of complex therapy six months thereafter was 92,2 %. Authors state that correctly administered compl ex treatment of onychomycosis is safe and does not cause serious secondary effects.
Key words: onychomycosis, micoflucan (fluconazole), Ekzifin (terbinafine).
Грибковые инфекции ногтей традиционно лидируют среди наиболее длительно существующих и контагиозных заболеваний человека. Доля онихомикозов среди всей патологии дерматологического профиля составляет от 10 до 24 %, и, следовательно, значимость такой современной проблемы, как лечение дерматофитии ногтей, трудно переоценить [5]. Сегодня в арсенале врача-миколога имеется около 10 системных и десятки топических антимикотиков [6]. Однако широкое распространение дерматофитий, а также нарастающая устойчивость возбудителей к антимикотикам диктует важность выбора оптимальной тактики лечения онихомикозов. Как известно, при лечении дерматофитии ногтей может использоваться любой из системных антимикотиков, предназначенных для приема внутрь. На практике же трудность определения этиологии онихомикоза привела к широкому использованию «пульс-терапии» итраконазолом [6]. Кроме того, назначение итраконазола без учета кислотности желудка, нарушений всасывательной способности желудочно-кишечного тракта, уровня нейтрофилов в периферической крови, применения других лекарственных средств, а также фунгистатического эффекта препарата не всегда позволяет достичь этиологической излеченности процесса. Веским аргументом в пользу приема системного препарата по непрерывной схеме служит наличие тотального и проксимального онихомикозов, при которых поражается не только ногтевая пластинка, но и эпидермис, соединительная ткань и даже костные структуры [3].
В этой связи может быть интересно использование флуконазола, отличающегося высокой всасывательной способностью в верхних отделах кишечника, биодоступностью (94 %), фунгистатическим и фунгицидным действием [5]. При пероральном приеме в тканях организма создаются высокие концентрации флуконазола. В коже препарат обнаруживается через 3 часа, а в ногтях — на 2-й неделе лечения. Гидрофильность флуконазола, находящегося в свободной форме, позволяет препарату свободно проникать в ногтевую пластинку через ложе ногтя, уменьшая, как все азолы, воспалительный процесс. В то же время при тотальной и проксимальной формах онихомикоза актуально назначение тербинафина, который медленно проникает в ногтевую пластинку, преимущественно через матрикс, и на дистальных краях ногтей обнаруживается через 8 недель.
Цель работы
Изучить клиническую эффективность комбинированной терапии онихомикоза, резистентного к предыдущему лечению, в виде системного сочетанного применения препаратов «Экзифин» (тербинафин) и «Микофлюкан» (флуконазол).
Методика исследования
Для проведения исследования применялся выборочный метод наблюдения. В исследование были включены 132 пациента в возрасте от 25 до 40 лет с лабораторно подтвержденным диагнозом «микоз ногтевых пластинок и гладкой кожи стоп». Из них мужчин было 59 (44,7 %), женщин — 73 (55,3 %). Критерием отбора явилось наличие в анамнезе указания на неэффективность ранее проводимого системного лечения по поводу диагностированного онихомикоза. Следует отметить, что неудачи предыдущей системной терапии лишают пациентов чувства веры в излечение, создают впечатление о напрасных материальных затратах и, как следствие, снижают их медицинскую активность. С учетом этих факторов средняя продолжительность течения онихомикоза в России составляет от 10 и более лет [4, 5]. Так, в нашем исследовании давность процесса от 1 года до 5 лет была у 40 (30,3 %), от 5 до 10 лет — у 58 (43,9 %), более 10 лет — у 34 (25,8 %) больных. Указали, что безуспешно занимались самолечением, 49 (37,1 %) пациентов.
Перед назначением лечения всем пациентам было проведено клинико-анамнестическое исследование и комплексное лабораторное обследование (микроскопия, полимеразная цепная реакция, посев). При культуральном исследовании определяли видовую принадлежность дерматофитных и недерматофитных грибов. В качестве методов мониторинга и контроля безопасности лечения всем пациентам проводился биохимический анализ крови — 2-кратно в динамике исследования, а также микроскопическое исследование через 3, 4, 5 и 6 месяцев от начала лечения.
Для выбора правильного подхода к лечению микотического поражения ногтей врачу приходится брать в расчет сразу несколько факторов. Выбор вида терапии определяется клинической формой заболевания, скоростью роста ногтевой пластины, распространенностью поражения. Важно учитывать выраженность подногтевого гиперкератоза и наличие дерматофитом — полостных образований, затрудняющих распределение системных и местных антимикотиков в ногте [1, 3]. Для определения схемы и продолжительности системной терапии нами был использован клинический индекс оценки тяжести онихомикоза стоп (КИОТОС) как универсальная система принятия терапевтических решений при онихомикозе. Значение индекса более 10 требует применения системной терапии, а при значениях КИОТОС от 16 и выше необходимо увеличение длительности приема антимикотиков или назначение комбинированных схем [3].
Системное лечение онихомикоза проводили в 2 этапа. На 1-м этапе пациенты получали микофлюкан (таблетированная форма) по 150 мг 1 раз в неделю с одновременным приемом экзифина (тербинафин) по 125 мг в сутки в течение месяца. На 2 этапе с 5-й недели экзифин применялся по 250 мг в сутки в течение 8 недель (при значении КИОТОС до 16) и 12 недель (при значении КИОТОС более 16). Необходимо отметить фармакологическую эквивалентность препаратов «Микофлюкан» и «Экзифин» оригинальным препаратам, доказанную исследованиями, проведенными на базе Проблемной лаборатории лекарственных средств по разработке, изучению, внедрению, производству и маркетингу РАМН. Для купирования явлений гиперкератоза, затрудняющего распределение системных антимикотиков в тканях ногтя, нами проводилось нехирургическое удаление гиперкератоза на аппарате «Gerlaсh» с последующим применением наружной формы препарата «Экзифин» в виде крема.
Статистическую обработку результатов проводили с помощью программы обработки электронных таблиц Microsoft Excel с использованием общепринятых статистических методов вычисления. Оценка достоверности результатов исследования, а также наличие связи между признаками определялись по критерию соответствия К. Пирсона ?2.
Результаты исследования и их обсуждение
Учитывая, что поражение ногтей является вторичным после инфицирования кожи, окружающей ноготь, мы проанализировали эпидемиологические факторы риска заболевания. Около трети пациентов с онихомикозом (32; 28,8 %) указывали на наличие другого больного в семье (?2 = 6,251, p Анализ сопутствующей патологии выявил наличие варикозного расширения вен нижних конечностей — у 7 (5,3 %), гипотиреоза — у 4 (3,0 %), грыжи поясничного отдела позвоночника — у 6 (4,5 %) пациентов. Указывали на наличие хронического гастрита или гастродуоденита 13 (9,8 %) больных. Пищевую аллергию в анамнезе, непереносимость антибактериальных препаратов отметили 5 (3,8 %) человек. Атопический дерматит был у 2 (1,5 %) обследованных.
Среди идентифицированных микологической лабораторией видов грибков лидирующее положение занимал T. rubrum, обнаруженный у 120 (90,9 %) пациентов, вызывающий наиболее распространенную дистальную форму онихомикоза. Как моноинфекция T. mentagrophytes var. interdigitale обнаруживался в 5 (3,8 %) случаях. Сочетание T. rubrum и T. mentagrophytes var. interdigitale было выявлено у 6 (4,5 %) больных. Сочетание T. rubrum и плесневых грибков Aspergillus spp. — у 1 (0,8 %) пациент. Полученные результаты свидетельствуют о полиэтиологичности онихомикозов, что необходимо учитывать практическому врачу. Изменение этиологической структуры заболевания отражается на трактовке клинических проявлений онихомикоза. Повсеместное распространение недерматофитных инфекций со схожими с дерматофитиями клиническими проявлениями не позволяет на современном этапе соотносить какие-либо клинические формы заболевания с определенной этиологией [6, 7]. Хотя в отечественной литературе исследователями до недавнего времени преимущественно описывались разные клинические формы и симптомы онихомикоза отдельно для каждой группы инфекций, вызываемых каким-то одним или несколькими возбудителями (руброфития ногтей, эпидермофития ногтей и т. д.).
При оценке клинической картины мы использовали классификацию онихомикозов Zaias N., выделившего поверхностную, дистально-латеральную подногтевую и проксимальную подногтевую формы [8]. Эти формы отражают особенности патогенеза заболевания, определяют прогноз и влияют на подход к терапии. Наиболее характерные проявления дистальной формы — это онихолизис, то есть видимая утрата прозрачности ногтевой пластинки из-за ее нарушенной связи с ложем, и подногтевой гиперкератоз — реактивное утолщение ногтевого ложа.
У всех больных был вовлечен в процесс ноготь I пальца с приблизительно равной частотой поражения на правой и левой стопе. Ногтевые пластины V пальцев были изменены у 92 (69,7 %) пациентов, поражения ногтей других пальцев встречались в 63 (47,7 %) случаев. Поражение ногтевых пластин кистей было у 7 (5,3 %) пациентов со стажем заболевания более 10 лет и только на правой руке. Дистальную форму онихомикоза мы наблюдали в 117 (88,6 %) случаях, причем у 27 (20,5 %) пациентов был процесс, охватывающий 1/3 длины ногтя; у 90 (68,1, %) — более 2/3 ногтя или тотальный. Преобладание умеренного гиперкератоза у 32 (24,2 %) больных или выраженного у 81 (55,8 %) расценивалось нами как тяжелое течение онихомикоза согласно индексу КИОТОС, среднее значение которого составляло от 12 до 16. Поражение кожи стоп носило преимущественно сквамозно-гиперкератотический характер и встречалось у 67(50,8 %) больных.
На контрольный осмотр через 3 месяца после окончания системной терапии (6-8 месяцев от начала лечения) явились 127 (96,2 %) пациентов. Полная нормализация внешнего вида ногтей произошла у 117 (92,2 %) человек. Незначительные проявления дистального гиперкератоза сохранялись у 10 (7,8 %) больных, им рекомендовано продолжение наружной терапии до полного регресса клинических проявлений. Данные контрольной микроскопии были отрицательными у всех обследованных пациентов. Проведенный нами анализ данных биохимических показателей (аланинамикотрансферазы, аспартатаминотрансферазы, холестерина, билирубина, щелочной фосфатазы, креатинина крови) после окончания системной терапии не выявил существенных изменений по сравнению с данными, полученными до начала лечения. Возможно, это связано с возрастом обследуемых (от 25 до 40 лет) и низким процентом сопутствующей соматической патологии.
Заключение
- Сочетанное применение микофлюкана и экзифина (в качестве системного и местного средства) для лечения онихомикозов показало высокую этиологическую и клиническую эффективность (92,2 %).
- Комплексный подход к лечению онихомикозов микофлюкана и экзифина значительно сократил сроки лечения пациентов.
- Параллельное применение микофлюкана и экзифина отличалось хорошей переносимостью (98,5 %) и минимумом побочных эффектов.
Данная схема может быть рекомендована для применения в амбулаторной практике у пациентов с онихомикозами дерматофитной этиологии, которым уже ранее проводилась противогрибковая терапия, так и пациентам с длительным стажем болезни при наличии тотальной и проксимальной формы онихомикоза.
Очевидно, что поиск путей для решения такой проблемы, как неэффективное лечение онихомикоза не может ограничиваться только удлинением курса терапии. Разработка схем адекватных комбинаций системных антимикотиков поможет решению вопроса о все чаще возникающей резистентности грибков к проводимой фармакотерапии.
Литература
- Потекаев Н. Н., Пархоменко Ю. Г., Потекаев Н. С. и др. // Вестн. дерматол. венерол. — 2000. — № 6. — С. 4—6.
- Рукавишникова В. М. Микозы стоп. Изд. 2. — М: ЭликсКом, 2003. — 332 с.
- Сергеев А. Ю. Грибковые заболевания ногтей. — М: Медицина для всех — Национальная академия микологии, 2001. — 160 с.
- Сергеев А. Ю., Иванов О. Л., Сергеев Ю. В. и др. //. Российский журнал кожных и венерических болезней. — 2002. — № 5. — С. 42—46
- Сергеев А. Ю., Сергеев Ю. В. // Consilium medicum. — 2003. — Vol. 5(3). — Р. 128—136
- Сергеев Ю. В., Шпигель Б. И., Сергеев А. Ю. Фармакотерапия микозов. — М.: Медицина для всех, 2003. — 200 с.
- Baron R., Rodney P. R., Dawber, et al. The Text Atlas of Nail Disorders. Techniquues in Investigation and Diagnosis. Third edition. — London, 2003. — Р. 343.
- Zaias N. // Archiv of Dermatology. — 1972. — № 105 (2). — Р. 263—274.
Контактная информация
Касихина Елена Игоревна — кандидат медицинских наук, доцент кафедры дерматовенерологии, микологии и косметологии терапевтического факультета ГОУ ДПО РМАПО Росздрава
Ключевые слова: оригинальные лекарственные средства, дженерики, тербинафин, Экзифин.
TERBINAFINE GENERICS IN RUSSIA: A PRACTICAL MYCOLOGIST'S OPINION
E.I. Kasikhina, N.V. Savchenko
Russian Medical Academy of Postgraduate Education, Ministry of Health and Social Development of the Russian Federation, Medico-C Medical Center, Moscow
Key words: original drugs, generics, terbinafine, Exifine.
В настоящее время фармацевтический рынок предлагает большой выбор антимикотиков. В этом изобилии нелегко разобраться даже специалисту-микологу при условии, что вся информация достойна доверия и действительно имела место в практике. Одной из частых и нередко болезненных задач, стоящих перед врачом, является выбор между оригинальным лекарственным средством и воспроизведенным препаратом (дженериком). Дженерик — лекарственный продукт, обладающий доказанной терапевтической взаимозаменяемостью с оригинальным инновационным лекарственным средством аналогичного состава, выпускаемый не разработчиком оригинального препарата и без лицензии разработчика. Облегченные правила регистрации и более низкая цена способствуют распространению дженериков на фармацевтическом рынке. В России объем продаж достигает 80%, в Канаде — 64%, в Японии — 30% [1]. В Испании более 20% препаратов, выписанных врачами разных специальностей, являются дженериками [2]. Список дженериков системных антимикотиков в России ежегодно пополняется и насчитывает десятки наименований. Фактически на отечественном фармакологическом рынке представлены аналоги каждого оригинального системного антимикотика, а перечень наименований наружных форм антимикотиков еще более широк. Сложившаяся ситуация с дженериками характерна не только для России. В странах Центральной и Восточной Европы, Юго-Восточной Азии, Индии и Китае дженерики известных противогрибковых средств — довольно распространенное явление. В США и ряде стран Западной Европы еще сохраняется господствующее положение оригинальных препаратов, но и оно сдает свои позиции [3].
Как правило, регистрация дженериков допускается на основании оценки регистрационного досье сокращенного объема и данных биоэквивалентности Воспроизведенный аналог содержит то же действующее вещество, что и оригинальный препарат, но, как правило, отличается от него вспомогательными веществами. Лекарственные препараты считаются фармацевтически эквивалентными, если содержат одни и те же активные субстанции в одинаковом количестве (допустимое отличие — не более 5%) и в одинаковой лекарственной форме, а также отвечают требованиям одних и тех же сходных стандартов. Согласно положению Всемирноорганизациздравоохранения, «два препарата считают эквивалентными, если они фармацевтически эквивалентны, имеют одинаковую биодоступность и при назначении в одинаковой дозе обеспечивают должную эффективность и безопасность». По определению FDA, фармацевтически эквивалентные лекарственные препараты содержат одинаковые ингредиенты в одинаковой лекарственной форме, предназначены для одного способа введения и являются идентичными по силе действия или концентрации активных веществ [3, 4].
В микологии данное положение должно относиться к препаратам, используемым как системно, так и наружно, так как не все пациенты микологического профиля могут получать системное лечение. Отсутствие подтверждения терапевтической эквивалентности порождает сомнения в качестве воспроизведенного препарата и может ограничить использование дженериков в ситуациях, когда врач рассчитывает на максимальную надежность и безопасность лекарственного средства. К таким ситуациям относится терапия микозов у детей и пожилых людей с отягощенным соматическим анамнезом (прежде всего эндокринной патологией). Именно в этих возрастных группах вопросы безопасности наиболее значимы, и используемый препарат должен подтвердить свою состоятельность не только в фармакологическом, но и в клиническом аспекте.
Безусловно, на окончательный выбор препарата влияют разные факторы [5]. Во-первых, оценка врачом-микологом клинической ситуации и его клинический опыт. Во-вторых, пациент имеет право на выбор оригинального препарата или дженерика, при этом выбор должен быть информированным. Поскольку информацию должен предоставлять врач, то и он должен ориентироваться на качественные сведения о препаратах. К сожалению, для большинства дженериков противогрибковых препаратов не проводилось всего комплекса исследований, которые легли в основу современных схем используемых оригинальных препаратов. Сведения о результатах исследований, которые производители указывают в информационных материалах, в подавляющем большинстве случаев относятся к оригинальному препарату. Финансовые затруднения пациента или недоступность оригинала по тем или иным причинам служат основанием для назначения дженерика. При этом следует ориентироваться на воспроизведенные аналоги, которые давно существуют на рынке или имеют свою доказательную базу эффективности и безопасности. Например, среди известных дерматологам дженериков тербинафина такой базой владеют Экзифин, термикон, фунготербин. Информация о доказанной фармацевтической эквивалентности препаратов упоминается в немногочисленных отечественных публикациях, посвященных клинической эффективности таких дженериков флуконазола, как микофлюкан и флюкостат. В-третьих, велика роль аптечного звена, нередко выступающего в качестве «первичного звена» дерматологической помощи населению, или «корректора» врачебных назначений.
Итак, фармакокинетическая эквивалентность является главным условием регистрации препарата-дженерика. Биоэквивалентные препараты имеют сходные показатели биодоступности при исследовании в одинаковых экспериментальных условиях. Исследования биоэквивалентности проводят на ограниченном контингенте здоровых добровольцев с помощью рандомизированного перекрестного метода. Данные о биоэквивалентности используемых в других странах дженериков тербинафина оригинальному препарату можно без труда получить из зарубежных научных публикаций [6—8]. В нашей стране мы сталкиваемся в основном с данными сравнительных исследований, оценивающих терапевтическую эквивалентность системных препаратов или дающих фармакоэкономическую оценку антимикотикам [9].
Для определения биоэквивалентности сравнивают так называемую площадь под фармакокинетической кривой (AUC) «концентрация—время». Препарат-дженерик считается биоэквивалентным оригинальному, если 90% средней AUC вещества входит в диапазон от 80 до 125% от средней AUC оригинального препарата [6].
Примером может служить характер фармакокинетических кривых, полученных после приема препаратов Экзифин и ламизил, который в целом сходен, причем индивидуальная вариабельность концентраций тербинафина в обоих случаях примерно одинаковая. Усредненные фармакокинетические профили тербинафина в сыворотке крови больных, принимавших препараты Экзифин и ламизил (рисунок) характеризовались сходными кривыми, причем во всех временных точках различия между соответствующими значениями концентрации не были статистически достоверными. Среднее значение максимальной концентрации тербинафина после приема испытуемого препарата и скорость ее достижения достоверно не отличались от этих параметров препарата сравнения. Площадь под кривой «концентрация-время» (AUC24h) для Экзифина была незначительно меньше, чем для ламизила. Разница в значениях среднего времени удерживания также была незначительной (в среднем 11,6 и 12,2 ч соответственно). Данное исследование биоэквивалентности препаратов Экзифин (дженерик) и ламизил (оригинальный тербинафин) выполнено открытым методом по перекрестной и рандомизированной схеме у больных с онихомикозами, обусловленными T. rubrum. Испытания препаратов проводили в соответствии с программой изучения биоэквивалентности, утвержденной Фармакологическим государственным комитетом МЗ РФ на базе Уральского научно-исследовательского института дерматовенерологии и иммунопатологии Минздрава России [10].
Пример «соответствия» фармакокинетических профилей тербинафина в сыворотке в крови больных, принимавших Экзифин (1) и ламизил (2; нг/мл).
Фармакокинетическая эквивалентность (биоэквивалентность) оценивается по данным результатов определения скорости и степени всасывания оригинального препарата и дженерика при приеме в одинаковых дозах и лекарственных формах внутрь на основании концентрации в жидкостях и тканях организма (биодоступность). Для оценки биологической эквивалентности лекарственных средств необходимо сопоставить скорость, степень всасывания и распределения лекарственных веществ в организме человека. Так, относительная степень всасывания тербинафина (относительная биодоступность — f) после приема препарата Экзифин и величина соотношения максимальных концентраций тербинафина после приема испытуемого препарата и препарата сравнения (fи f") несколько отличались от единицы (в среднем 0,91 и 0,95 соответственно), однако находились в допустимых пределах (0,90—1,15). Сравнение средних значений отношения Cmax/ AUC24h как характеристики скорости всасывания лекарственного вещества для препаратов Экзифин (0,105 ч -1 ) и ламизил (0,101 ч -1 ) показало, что различие для них статистически недостоверно при уровне значимости 5% (таблица).
Параметры биодоступности тербинафина после приема препаратов Экзифин и ламизил
| № | f′ | f″ | Cmax /AUC24h Ч -1 | |
| Экзифин | ламизил | |||
| 1 | 1,21 | 1,05 | 0,061 | 0,071 |
| 2 | 0,66 | 0,95 | 0,264 | 0,185 |
| 3 | 1,08 | 1,00 | 0,086 | 0,093 |
| 4 | 1,27 | 1,13 | 0,104 | 0,117 |
| 5 | 0,88 | 0,88 | 0,099 | 0,100 |
| 6 | 1,09 | 0,92 | 0,061 | 0,072 |
| 7 | 0,76 | 1,00 | 0,171 | 0,131 |
| 8 | 0,93 | 1,02 | 0,204 | 0,186 |
| 9 | 0,70 | 0,91 | 0,098 | 0,075 |
| 10 | 0,68 | 1,26 | 0,096 | 0,052 |
| 11 | 1,36 | 0,59 | 0,080 | 0,182 |
| 12 | 0,66 | 0,81 | 0,080 | 0,066 |
| MG | 0,91 | 0,95 | 0,105 | 0,101 |
| Интервальная оценка | 0,70—1,19 | 0,78—1,14 | 0,06—0,166 | 0,065—0,157 |
Одной из важнейших фармацевтических характеристик препарата является точность его дозирования. Для обеспечения точности (однородности) дозирования и кинетики высвобождения активной субстанции из оральных таблетированных форм желательно применять современные технологии, которые требуют материальных затрат и делают производство экономически невыгодным. Регламентирующие нормы предписывают содержание действующих веществ по однородности дозирования в пределах 85—115% от номинала. Отличия процентного содержания антимикотика и примесей могут отражаться на переносимости препаратов, а также на их клинической эффективности. Как правило, остаются неизвестными показатели распределения дженериков в органах-мишенях, в частности конкретной концентрации дженериков в ногте и продолжительности их сохранения в нем [11]. Не учитываются также сравнительные статистические данные по побочным эффектам и осложнениям при применении оригинальных антимикотиков и их воспроизведенных аналогов. Нельзя сказать, что это способствует исключительно распространению дженериков. Напротив, отсутствие подтверждения терапевтической эквивалентности порождает сомнения в качестве воспроизведенного препарата и может ограничить использование дженериков, когда врач рассчитывает на максимальную надежность и безопасность лекарственного средства. Конечно, требовать от производителей дженериков того же комплекса фармакологических и клинических исследований, который необходим для регистрации оригинального препарата, нельзя. С другой стороны, это обычное явление в странах Европы и Юго-Восточной Азии [6—8, 12]. Во Франции предложен метод спектроскопии для определения терапевтической эквивалентности дженериков топических антимикотиков с целью оценки не только проникающей способности препарата, но и контроля повреждения барьерных слоев эпидермиса [13]. Внедрение дженериков в клиническую практику не может осуществляться без проведения исследований, подтверждающих их реальное, а не номинальное соответствие эффективности и безопасности оргинальному препарату.
В «досье» старейшего в России дженерика тербинафина Экзифина (на отечественном фармакологическом рынке с 1999 г.), практический миколог может найти ответы на многие вопросы. Так, применение Экзифина у пациентов с аллергодерматозами изучали на базе ГНЦ Институт иммунологии ФМБА России, а также на кафедре кожных и венерических болезней Московского государственного медико-стоматологического университета [14, 15]. Полученные данные клинико-лабораторного исследований свидетельствуют об эффективности и безопасности Экзифина в комплексной терапии больных атопическим дерматитом с гиперчувствительностью к грибам рода Malassezia, что выражалось в быстром купировании зуда и положительной динамике индекса SCORAD. Клинические исследования по применению Экзифина при микроспории волосистой части головы проводились на базе Уральского НИИ дерматовенерологии и иммунопатологии, при этом этиологическая эффективность препарата составила 92,9%, побочные эффекты отмечались в 5,4% случаев [16]. На базе НИИ медицинской микологии им. П.Н. Кашкина ГОУ ДПО СПб МАПО изучали эффективность и безопасность Экзифина у больных онихомикозом стоп на фоне соматических заболеваний с нарушением кровообращения в нижних конечностях [17].
Таким образом, клиническая практика расставляет все препараты по своим местам. Это расширяет врачебный выбор, что в значительной степени является «шагом вперед на пути к совершенствованию противогрибковой терапии». Безусловно, воспроизведенные препараты позволяют врачам стремиться лечить всех и хорошо даже в экономически слабых странах, при этом используя самые современные дженерики дорогих оригинальных препаратов. С другой стороны, давление дженериков на рынке является одним из факторов, заставляющих компании производить оригинальные препараты и активнее внедрять новые перспективные разработки.
ЛИТЕРАТУРА
1. Герасимов В.Б., Лукьянов С.В. Еще раз к вопросу о дженериках. Фарм вестн 2004; 18: 336-339
2. Carrilo Norte J.A., Postigo Mota S. Generic drugs: we must cut pharmaceutical spending but undertaking drug quality. Rev Enferm 2012; 35: 2: 10—19.
3. Payette M, Grant-Kels J.M. Generic drugs in dermatology: part I. J Am Acad Dermatol 2012; 66: 3: 343: e1—e8.
4. FDA. Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations 20 ed. 2000.
5. Payette M, Grant-Kels J.M. Generic drugs in dermatology: part II. J Am Acad Dermatol 2012; 66:3: 353: e1—e15.
6. Koytchev R., Erenmemisoglu A., van der Meer M.J., Alpan S. Clinical relevance of bioequivalence acceptance criteria. The example of terbinafine. Arzneimittelforschung 2003; 53: 4: 289—293.
7. Almeida S., Filipe A., Vallee F. et al. Comparative bioavailability of two formulations of terbinafine. Data from a crossover, randomized, open-label bioequivalence study in healthy volunteers. Arzneimittelforschung 2004; 54: 11: 757—762.
8. Jiang X., Wang N, Zhang Z. et al. Pharmacokinetics and comparative bioavailability of two terbinafine hydrochloride formulations after single-dose administration in Chinese healthy subjects. Arzneimittelforschung 2008; 58: 7: 363—366.
9. Баткаев Э.А., Верхогляд И.В. Сравнительная фармакоэкономическая оценка применения антимикотиков группы тербинафина. Леч врач 2008; 5: 30—32.
10. Отчет о результатах исследования биоэквивалентности препаратов Экзифин (Д-р Реддис Лабораторис Лтд, Индия) и Ламизил (Новартис, Швейцария). Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии МЗ РФ. Екатеринбург 2003.
11. Скрипкин Ю.К., Кулагин В.И., Лещенко В.М. и др. Воспроизведенные противогрибковые препараты в терапии онихомикозов: проблемы соответствия оригинальным антимикотикам и возможности клинического применения. Журн дерматовенерол косметол 2003; 1: 22—28.
12. Hoharitanon S., Chaichalotornkul J., Sindhupak W.A. Comparison of efficacy between two itraconazole generic products and the innovative itraconazole in the treatment of tinea pedis. J Med Ass Thai 2005; 88: 4: 167—172.
13. Alberti I., Kalia Y.N., Naik A. et al. In vivo assessment of enhanced topical delivery of terbinafine to human stratum corneum. J Control Rel 2001; 71: 3: 319—327.
14. Феденко Е.С., Елисютина О.Г. Роль грибковой инфекции в развитии атопического дерматита и целесообразность противогрибковой терапии. Рос аллергологич журн 2006; 5: 4—13.
15. Давидова М.Э., Ольховская К.Б., Перламутров Ю.Н. Эффективность экзифина в комплексной терапии больных атопическим дерматитом. Вестн дерматол венерол 2007; 5: 60—62.
16. Малишевская Н.П., Нестеров С.Н. Современные особенности эпидемиологии, клиники и лечения микроспории. Леч врач 2004; 1: 56—58.
17. Антонов В.Б. Тербинафин в лечении онихомикоза у пациентов с соматическими заболеваниями. Леч врач 2004; 9: 76—78.
Читайте также:

