Сыпь при апластической анемии
Обновлено: 24.04.2024
Приобретённая (идиопатическая) апластическая анемия – панцитопения с гипоцеллюлярным костным мозгом в отсутствие патологической инфильтрации и повышения количества ретикулиновых волокон.
Апластическая анемия – гетерогенное заболевание. В большинстве случаев (70-80%) этиология остается неясной – идиопатическая апластическая анемия. Примерно в 15-20% наблюдаются конституциональные/врожденные варианты апластической анемии. В некоторых случаях удается установить причину апластической анемии – лекарственное воздействие (таблица 1), инфекцию и др.
Таблица 1. Препараты, использование которых может быть ассоциировано с АА.
| Группа | Препараты |
| Антибиотики | Хлорамфеникол, Сульфаниламиды, Ко-тримоксазол, Линезолид |
| Противовоспалительные препараты | Препараты золота, Пеницилламин, Индометацин, Диклофенак, Напроксен, Пироксикам, Сульфасалазин |
| Противосудоржные препараты | Карбамазепин, Фенитоин |
| Тиростатики | Тиоурацил, Карбимазол |
| Антидепрессанты | Фенотиазины |
| Гипогликемические средства | Хлорпропамид, Толбутамид |
| Противомалярийные препараты | Хлорохин |
| Другие | Аллопуринол, Тиазиды |
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| D 61.3 | Идиопатическая апластическая анемия |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г.)
Сокращения, используемые в протоколе:
полимеразная цепная реакция
Пользователи протокола: врачи общей практики, терапевты, гематологи, гинекологи.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности [1]:
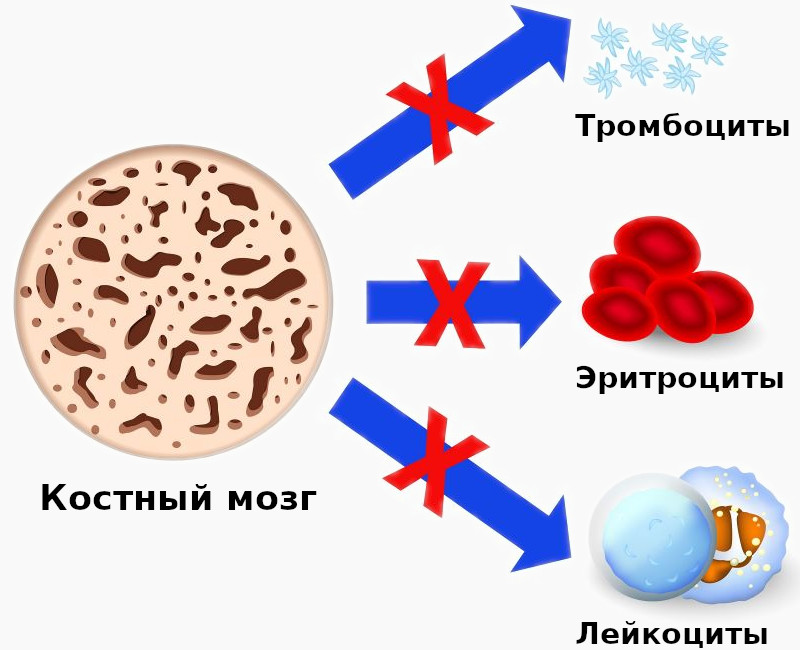
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
МКБ-10



Общие сведения
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда - только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.

Причины
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное - через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой - главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается - такие случаи относят к идиопатической форме.
Патогенез
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Классификация
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Симптомы апластической анемии
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.

Осложнения
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Диагностика
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
- Исследованиепунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.

Лечение апластической анемии
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз и профилактика
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
2. Комплексная программа диагностики апластической анемии с определением прогностически значимых патогенетических особенностей заболевания. Методические рекомендации. - 2015.
4. Апластическая анемия: современные представления о патогенезе и терапии/ Айсариева Б. К., Раймжанов А. Р., Айтбаев К.// Молодой ученый. - 2011 - №9.

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 01.09.2020
- Reading time: 5 минут чтения
Апластическая анемия — это заболевание крови, форма анемии, при которой в костном мозге недостаточно тромбоцитов (эритроцитов), эритроцитов и лейкоцитов. Это редкое заболевание, которое может возникнуть в любом возрасте. Болезнь может развиваться медленно или быстро.
Что такое апластическая анемия
Апластическая анемия — это патологическое состояние организма, при котором костный мозг перестает вырабатывать все три типа клеток крови: красные кровяные тельца (эритроциты), белые кровяные тельца (лейкоциты) и тромбоциты (тромбоциты). Это происходит, когда по какой-то причине в костном мозге уменьшается количество стволовых клеток, из которых развиваются все клетки крови.
Точнее сказать — это синдром недостаточности костного мозга, характеризующийся снижением количества эритроцитов, лейкоцитов, тромбоцитов в крови и гипоплазией костного мозга с менее чем 30% гематопоэтических клеток.

Что такое апластическая анемия
Апластическая анемия подразделяется на первичную и вторичную.
- Первичная — анемия Фанкони, врожденный склероз и семейная апластическая анемия.
- Вторичная — анемия, вызванная химическими веществами, лекарствами, вирусами.
Распространенность
Апластическая анемия — относительно редкое заболевание: заболеваемость составляет 5-10 случаев на миллион людей в год.
Симптомы апластической анемии
Больные жалуются на нарастающую слабость, утомляемость, нехватку воздуха. Возможно кровотечение, быстрее возникают синяки. У пациентов с анапластической анемией более частые инфекции, высокая температура с ознобом — серьезное состояние, требующее безотлагательного медицинского обследования и лечения.
Часто встречающиеся симптомы:
- общая слабость;
- быстрая утомляемость;
- одышка в покое и во время упражнений;
- частое сердцебиение;
- аритмичное сердцебиение;
- бледная кожа;
- кровотечение из ран;
- синяки на коже;
- кровотечение из носа ;
- десневое кровотечение;
- общие инфекции;
- высокая температура ;
- головная боль.


Этиология. Причины развития апластической анемии
Апластическая анемия возникает при повреждении костного мозга, который производит стволовые клетки крови. Производство клеток может замедляться, они могут полностью разрушаться или производиться в деформированном, дисфункциональном виде. В 65% случаях причина заболевания неясна.
Врожденные патологии . Врожденная апластическая анемия встречается редко. Наиболее частой формой врожденного заболевания является синдром Фанкони: пациенты с низким ростом, измененной пигментацией кожи, различными проблемами с почками. Генетическое тестирование в этом случае выявляет хромосомные аберрации.
Лекарства и токсины. Наиболее частой известной причиной апластической анемии является воздействие лекарств и токсинов окружающей среды.

Причина апластической анемии – воздействие лекарств
Недостаточность костного мозга, наряду с апластической анемией, часто вызвана токсинами — органическими химикатами (бензолом, толуолом, инсектицидами, нефтяными дистиллятами).
Что касается лекарств, апластическая анемия вызывается:
- антибиотиком хлорамфениколом;
- пеницилламином — используется для лечения заболеваний суставов;
- карбамазепином и фенитоином — используется для лечения эпилепсии;
- ацетазоламидом — диуретик;
- цитотоксическими препаратами, используемыми для лечения рака.
Встречаются случаи апластической анемии, развивающиеся на фоне вирусных инфекций — парвовирус B19, вирусы гепатита B и C, вирусы Эпштейна-Бар (EBV), цитомегаловирусы (CMV). Очень редко апластическая анемия возникает при беременности.
Цитотоксические препараты подавляют и убивают клетки костного мозга, но костный мозг восстанавливается довольно быстро, после прекращения их приема. Угнетает костный мозг и лучевая терапия. Иногда химиотерапией намеренно разрушают костный мозг при подготовке к трансплантации.
Течение болезни
Заболевание может развиваться очень медленно, а может возникать очень внезапно. Обычно апластическая анемия развивается незаметно и подозревается при возникновении комплекса различных симптомов. В некоторых случаях, например, при лечении рака, апластическая анемия довольно распространена и считается осложнением, в других случаях диагноз может быть отложен.
У пациента отсутствуют все клетки крови, что вызывает множество сопутствующих симптомов.
- Недостаток эритроцитов характеризуется одышкой, слабостью, утомляемостью, бледностью, головной болью, шумом в у шах.
- Недостаток тромбоцитов приводит к длительному кровотечению во время травмы или менструации, появлению синяков даже от малейших травм, покраснению глаз, спонтанному кровотечению из носа и десен.
- Отсутствие лейкоцитов характерно для частых инфекций, более трудно заживающих ран, лихорадки, иногда с ознобом.
Диагностика апластической анемии
Диагноз ставится на основании физического обследования — увеличение печени, возможные аномалии развития, изменение пигментации, быстрый рост, высокое небо, клинических симптомов, лабораторных тестов.
Важные клинические симптомы включают слабость, одышку (указывающую на возможное уменьшение количества эритроцитов), лихорадку, озноб, боль в горле (указывающую на возможную инфекцию из-за уменьшения лейкоцитов), кровотечения или синяки в различных частях тела, петехии (небольшие кровотечения) в слизистой оболочке рта (из-за уменьшения тромбоцитов). Пациент может быть бледным и иметь язвы во рту.
При осмотре глазного дна часто наблюдаются кровоизлияния в сетчатку.
При обследовании важно определить показатели крови , оценить степень истощения костного мозга и, если возможно, найти причину.
- Выявляется уменьшение количества всех клеток крови (эритроцитов (эритроцитопения), лейкоцитов (лейкоцитопения), тромбоцитов (тромбоцитопения)) – тогда состояние называется панцитопенией.
- Уменьшение количества нейтрофилов указывает на тяжесть апластической анемии: 0,5 х 10 9/ л показывают тяжелую и 0,2 х 10 9 / л – очень тяжелую апластическую анемию.
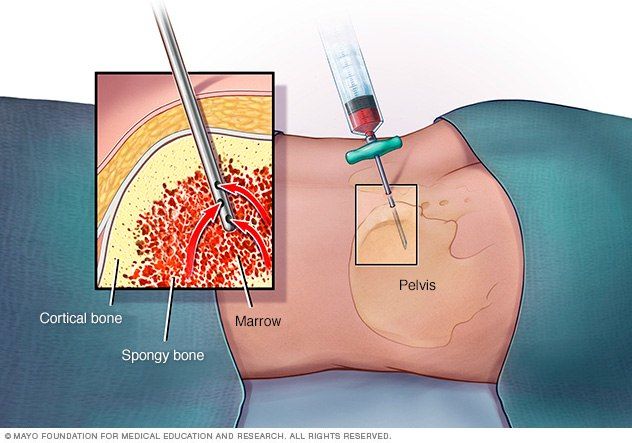
В случае заметного уменьшения количества кровяных телец требуется срочная консультация гематолога. Чтобы поставить диагноз, он выполняет аспирацию костного мозга или биопсию трепана, при которой из костного мозга берется небольшое количество клеток для более точного исследования. Это исследование помогает отличить апластическую анемию от других заболеваний крови.


Также проводится УЗИ внутренних органов. При необходимости цитогенетические исследования.
Лечение
Если возможно, следует устранить причину недостаточности костного мозга и апластической анемии. Иногда функция костного мозга восстанавливается, когда причина легкая, при только симптоматическом лечении легкой апластической анемии. Если количество клеток не очень велико, достаточно наладить питьевой режим и перейти на специальную диету.
Тяжелые и очень тяжелые формы апластической анемии представляют собой опасные для жизни состояния, требующие срочного и серьезного лечения. При температуре выше 38 o C в течение более двух часов пациента госпитализируют и лечат антибиотиками.

Лечение апластической анемии антибиотиками
Может потребоваться дополнительная инфузия тромбоцитов, когда риск кровотечения становится высоким — количество тромбоцитов падает ниже 10 x 10 9/ л. Инфузия эритроцитов назначается при тяжелых симптомах анемии.
Трансплантация костного мозга является методом выбора для лечения пациентов с тяжелой и очень тяжелой апластической анемией в возрасте до 50 лет. Пациенты старше 50 лет получают иммуносупрессивную терапию антитимоцитарным глобулином и циклоспорином.
В случае разрушения костного мозга из-за аутоиммунного процесса и невозможности трансплантации нельзя использовать иммунодепрессанты — циклоспорин, антитимоцитарный глобулин, метилпреднизолон, подавляющие атаку организма на костный мозг. Назначаются стимуляторы костного мозга — филрастин, колониестимулирующий фактор, эритропоэтин, др. Это препараты, стимулирующие костный мозг производить более специфические клетки. Лечение этими препаратами часто сочетается с иммуносупрессивной терапией.
В профилактических целях могут быть назначены антибиотики для предотвращения инфекций, поскольку сопротивляемость организма резко снижается.
В случае апластической анемии, вызванной лучевой терапией или химиотерапией для лечения рака, функция костного мозга восстанавливается после прекращения лечения.
Беременным женщинам делают переливание крови, и функция костного мозга также восстанавливается после родов, но если этого не происходит, лечение жизненно необходимо.
Осложнения
При тяжелой и очень тяжелой апластической анемии восприимчивость к различным инфекциям значительно увеличивается, и из-за низкого количества тромбоцитов возможно кровотечение. После трансплантации может возникнуть такая реакция отторжения, как сыпь, диарея, проблемы с печенью. Высокие дозы циклоспорина могут повышать артериальное давление, что приводит к почечной недостаточности.
Апластическая анемия – серьёзное нарушение формирования, развития и созревания клеток крови. Оно характеризуется угнетением кроветворной функции костного мозга, что проявляется дефицитом образования белых и красных кровяных клеток, а также тромбоцитов. Иногда наблюдается недостаток формирования только эритроцитов. Заболевание считается одним из самых тяжёлых расстройств гемопоэза и при отсутствии адекватного лечения может стать причиной летального исхода в течение нескольких месяцев. Оно в одинаковой степени поражает пациентов мужского и женского пола в возрасте от десяти до двадцати пяти лет или старше пятидесяти. Согласно медицинской статистике каждый год диагностируют два случая патологии на один миллион человек.
Апластичная анемия: этиология
Согласно происхождению, выделяют врождённую и приобретённую анемию. Первая развивается вследствие хромосомных мутаций, вторая – под воздействием химических веществ, излучения, инфекций. Специалисты считают, что угнетение кроветворения костного мозга может быть инициировано появлением в нём и в крови цитотоксических Т-лимфоцитов. Они производят ФНО (внеклеточный белок) и интерферон “y”, которые подавляюще воздействуют на ростки кроветворения. Причина запуска механизма может крыться в:
- Воздействии ионизирующего излучения или химических веществ в виде ароматических соединений, мышьяка, пестицидов;
- Попадании в организм инфекционных агентов (возбудители гепатитов “D”, “B”, цитомегаловируса, ДНК-содержащего вируса Эпштейна-Барр);
- Приёме миелотоксических препаратов при прохождении курса лечения транквилизаторами, противосудорожными, антитиреоидными и антиопухолевыми средствами;
- Развитии ряда аутоиммунных процессов (красная системная волчанка, поражение соединительной ткани – синдром Шегрена).
В 50% случаев причину развития патологии установить не удаётся. Такая форма апластической анемии называется идиопатической.
Классификация апластической анемии
| Форма патологии | Чем отличается? |
| По продолжительности течения | |
| Острая | Не более одного месяца |
| Подострая | От одного месяца до полугода |
| Хроническая | Более полугода |
| По степени тяжести при избирательной аплазии | |
| Умеренная | Гранулоцитов менее 0,0х10 9 /л, тромбоцитов менее 20,0х10 9 /л. |
| Тяжёлая | Гранулоцитов менее 0,5х10 9 /л, тромбоцитов менее 20,0х10 9 /л. согласно результатам диагностики клеточность костного мозга составляет менее трети от нормы. |
| Очень тяжёлая | Гранулоцитов более 0,5х10 9 /л, тромбоцитов более 20,0х10 9 /л. |
Апластическая анемия: симптомы
Заболевание начинается остро, оно сопровождается ощущением сильной слабости и быстрой утомляемостью. Кожные покровы больного и видимые слизистые оболочки выглядят бледными, а сам он страдает от следующих клинических проявлений:
- шум в ушах;
- появление одышки даже при несущественных усилиях;
- неприятное покалывание в области грудной клетки.
При снижении количества тромбоцитов в единице объёма крови проявляется геморрагический синдром:
- даже после незначительной компрессии или ударах кожного покрова на нём появляются синяки и кровоизлияния;
- на теле, руках и ногах можно увидеть сыпь в виде мелких точек;
- наблюдается кровоточивость дёсен;
- спонтанные кровотечения из носа;
- обильные менструации (у женщин).
Снижение количества лейкоцитов в единице объёма крови характеризуется регулярным частым развитием инфекционных заболеваний кожи и структур мочевыводящей системы, воспалительными процессами слизистой оболочки рта, воспалениями лёгких.
Врождённая форма анемии развивается у детей до десяти лет и сопровождается целым рядом других нарушений:
- недоразвитие черепа и головного мозга;
- снижение размеров и массы почек (гипоплазия);
- интенсивная окраска отдельных участков кожи – гиперпигментация;
- сильное снижение слуха и нарушения речевой функции из-за него.
Апластическая анемия: осложнения
Отсутствие лечения апластической анемии может привести к летальному исходу из-за развития таких осложнений, как:
- инфекционные заболевания;
- кровоизлияние в головной мозг;
- анемическая кома;
- сильные кровотечения.
Апластическая анемия: диагностика
Перед тем, как приступить к лечению заболевания, гематологи ЦЭЛТ проводят комплексную диагностику, направленную на точную постановку диагноза и выявление этиологического фактора. Она включает в себя:
- осмотр у гематолога;
- общий и биохимический анализы крови;
- забор образца костного мозга и его исследование – стернальная пункция.
При наличии заболевания у пациента выявляют серьёзное снижение гемоглобина, вплоть до критического уровня – 20-30 г/л, наблюдается агранулоцитоз – снижение зернистых лейкоцитов и моноцитов. Количество лимфоцитов может быть в норме или сниженным, тромбоцитов – всегда снижено, иногда их не обнаруживают вовсе. Скорость оседания эритроцитов – повышается до 4-60 мм/ч. Исследование образца костного мозга выявляет повышенное содержание жировой ткани – 90%, включающее в себя элементы стромы и лимфы, а вот гематогенные клетки имеются в очень малом количестве.
Лечение апластической анемии
Лечение идиопатической и других видов апластической анемии – очень сложная задача, требующая комплексного индивидуального подхода. При разработке тактики специалисты ЦЭЛТ учитывают результаты диагностики и показания пациента. Больного помещают в изолятор с асептическими условиями, что позволяет исключить риск развития инфекций и их осложнений. Медикаментозная терапия заключается в приёме:
- Глюкокортикоидов – при выявлении аутоиммунных механизмов и формировании антител против собственных кровяных клеток;
- Цитостатиков – при отсутствии эффекта от лечения глюкокортикоидами при аутоиммунной анемиии;
- Циклоспорина «А» – для подавления производства ФНО и интерферона “y”;
- Анаболиков – для стимулирования функции кроветворения;
- Андрогенов – для стимулирования образования красных кровяных клеток.
Всем больным апластической анемией проводят переливание эритроцитарной и/или тромбоцитарной массы, в объёмах, определяемых исходя из клинической картины и показателей периферической крови. Кроме того, пациенту могут назначить спленэктомию – хирургическое вмешательство, направленное на удаление селезёнки. Самые благоприятные прогнозы может обеспечить трансплантация костного мозга. Она заключается в пересадке донорских или собственных стволовых кроветворных клеток, предварительно изъятых из подвздошных костей путём пункции. К сожалению, процедура недоступна для широкого применения из-за сложности подбора совместимого донора. В том случае, если это невозможно, пациенту назначают паллиативную терапию с применение циклоспорина А.
В отделении гематологии нашей клиники ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Вы можете записаться к ним на приём онлайн или обратившись к нашим операторам. Специалисты высокой квалификации работают и в отделении урологии. К ним можно записаться на цистоскопию мочевого пузыря.

Апластическая анемия (АА) — это заболевание, характеризующееся панцитопенией, гипоклеточностью костного мозга при отсутствии аномальных клеток или фиброза костного мозга. Первое описание апластической анемии было получено в 1888 году Паулем Эрлихом — это была молодая беременная женщина, умершая от тяжелой анемии и нейтропении, на аутопсии было выявлено замещение межтрабекулярных пространств костного мозга жировой тканью, т. е. отсутствие гемопоэза. Термин «апластическая анемия» был введен французским гематологом А. М. Шоффаром в 1904 году и применен стохастически. Хоть АА и не является распространенным заболеванием, трагичность каждого отдельного случая и фатальные последствия вызывают к ней значительный интерес [1, 3, 4].
АА может носить как наследственный, так и приобретенный характер. Несколько редких врожденных заболеваний, включая анемию Фанкони, синдром Швахмана-Даймонда, врожденный дискератоз, первично характеризуются апластическим типом гемопоэза [2].
Известно, что некоторые препараты также могут вызывать селективные цитопении и агранулоцитоз, которые обычно обратимы и проходят после прекращения воздействия агента. Эти обратимые реакции не коррелируют с риском апластической анемии, ставя под сомнение эффективность рутинного мониторинга клинического анализа крови в качестве метода диагностики апластической анемии [1].
Исследования in vitro и данные клинических наблюдений привели к выводу, что основой для большинства случаев приобретенной апластической анемии служит атака цитотоксическими Т-лимфоцитами CD34+ клеток и стволовых клеток крови (СКК). Иммунное повреждение клеток костного мозга после лекарственной, вирусной или токсической аплазии костного мозга может быть результатом индукции неоантигенов, провоцирующих вторичную Т-опосредованную атаку на кроветворные клетки. Спонтанное или митоген-индуцированное увеличение продукции мононуклеарами интерферона-γ, IL-2 и фактора некроза опухолей-α (TNF-α) ингибирует дифференцировку гемопоэтических клеток [1]. Секреция интерферона-γ является результатом повышения регуляции транскрипционного фактора T-bet и апоптоза CD34+ клеток, частично опосредованного FAS-зависимым путем [3].
В ранних лабораторных экспериментах удаление лимфоцитов из апластического костного мозга увеличивало число колоний клеток в культуре тканей, а их внедрение в нормальный костный мозг подавляло гематопоэз in vitro. Эффекторные клетки были идентифицированы при помощи иммунофенотипирования активированных цитотоксических CD8+ Т-клеток, экспрессирующих Th1-цитокины, в частности γ-интерферон. CD8 клетки могут определяться непосредственно в крови при помощи:
- проточной цитометрии T-клеточного рецептора (TCR);
- спектрального анализа комплемент-определяющего региона (CDR2);
- секвенирование области CDR3 для установления молекулярного клона.
Также снижение количества регуляторных Т-клеток (CD4+, CD25+, FoxP3+) способствует увеличению аутореактивной популяции CD8+ CD28– Т-клеток, которая индуцирует апоптоз аутологичных гемопоэтических клеток. Т-регуляторные клетки являются компонентами иммунной системы, подавляющими иммунные реакции других клеток, а также играющими роль в предотвращении аутоиммунных реакций [2].
АА может возникать из-за метаболической или иммунологической предрасположенности (полиморфизма генов) у восприимчивых лиц. В случае фенилбутазон-ассоциированной аплазии костного мозга происходит замедление процессов окисления и клиренса соответствующего соединения, ацетанилида, по сравнению с нормальной контрольной группой, что предполагает избыточное накопление лекарственного средства как потенциального пускового механизма развития аплазии.
Для пациентов как с приобретенной, так и с наследственной апластической анемией (Фанкони, врожденный дискератоз) характерно наличие дефекта теломераз и восстановления теломер. Одной из характерных черт лейкоцитов при апластической анемии является укорочение теломер, причиной чему предполагали деплеции стволовых клеток. Однако анализ наследования в больших родословных продемонстрировал, что X-связанная форма врожденного дискератоза была вызвана мутациями в DKC1 (dyskeratosis congenita 1), идентификация мутаций в TERC (Telomerase RNA Component) у пациентов с аутосомно-доминантным наследованием помогла выявить генетическую основу укорочения теломер [3].
Центральную роль в восстановлении структуры РНК играет шаблон РНК, кодируемый TERC, при этом теломераза, представляющая собой обратную транскриптазу, кодируемую TERT (Telomerase Reverse Transcriptase), удлиняет нуклеотидную последовательность; другие белки, включая дискерин, кодируемый DKC1, связаны с восстановлением теломер. Систематические исследования ДНК выявили мутации TERC и TERT у некоторых пациентов с приобретенной апластической анемией. У членов семей, имеющих данную мутацию, несмотря на нормальные или почти нормальные показатели крови, выявили уменьшенное количество CD34-клеток, плохую скорость образования гемопоэтических колоний, повышенный уровень гемопоэтического фактора роста, гипоцеллюлярные участки в костном мозге, и, конечно, короткие теломеры. Клиническое проявление этих аномалий проявлялось позже, чем при типичном дискератозе, и не вызывало характерных физических отклонений. Некоторые из пациентов с синдромом Швахмана-Даймонда (Shwachman-Bodian-Diamond) также имеют мутации гена SBDS.
АА может сосуществовать или, по-видимому, эволюционировать вместе с другими гематологическими заболеваниями, характеризующимися пролиферацией специфических клонов клеток, такими как пароксизмальная ночная гемоглобинурия (ПНГ) или миелодиспластический синдром (МДС). Наличие небольшого количества клонов также создает проблемы при постановке диагноза апластической анемии даже при использовании таких высокочувствительных методов диагностики, как фенотипический (проточная цитометрия для ПНГ) или цитогенетический (флуоресцентная гибридизация in situ (FISH) для MDS) анализ [1, 2].
Более пятидесяти процентов пациентов с АА имеют клон ПНГ-клеток, которые обнаруживаются проточной цитометрией по отсутствию мембранных белков, связанных с якорным гликозилфосфатидилинозитолом. Мутация в гене PIG-A в стволовой клетке нарушает синтез гликозилфосфоинозитола (GPI) и, следовательно, вызывает отсутствие экспрессии GPI-связанных белков на поверхности эритроцитов потомства, лейкоцитов и тромбоцитов (CD14, CD16 и CD24 для лейкоцитов, CD55 и CD59 для эритроцитов). Большинство колоний клонов этих клеток небольшие и не приводят к клиническим проявлениям гемолиза или тромбоза, но при ПНГ может преобладать разрушение костного мозга («апластическая анемия/синдром ПНГ»). Было высказано предположение о том, что при ПНГ значительное уменьшение количества белков на клеточной поверхности позволяет «избежать» атаки и выжить существующему мутантному клону. Ассоциация клона ПНГ с HLA-DR29, по-видимому, также позволяет им избежать иммунной атаки и служит предиктором отсутствия реакции на иммуносупрессивную терапию. Тем не менее существует мало конкретных экспериментальных доказательств различия в дифференцировке типов иммунных реакций или восприимчивости клонов ПНГ по сравнению с фенотипически нормальными популяциями клеток-мишеней.
Конечным результатом иммуноопосредованного повреждения костного мозга является уменьшение образования клеток крови в костном мозге. Количество CD34+ клеток и их производных у пациентов с апластической анемией заметно снижено [2].
Клинически AA не сопровождается увеличением лимфатических узлов, печени или селезенки. Основным проявлением заболевания является панцитопения: для клинического анализа крови характерно уменьшение содержания всех форменных элементов. На ранних стадиях можно наблюдать изолированную цитопению, чаще тромбоцитопению. Может присутствовать моноцитопения, что требует дифференциального диагноза с волосатоклеточным лейкозом. АА сопровождается снижением ретикулоцитарного индекса, относительное число ретикулоцитов обычно меньше 1 % и может быть равно нулю, абсолютное число ретикулоцитов — менее 40 000 в мкл (40×10 9 /л), несмотря на высокие уровни эритропоэтина; анизоцитоз и пойкилоцитоз отсутствуют. Эти изменения в периферической крови сопровождаются гипоклеточностью костного мозга без аномальных или злокачественных клеток или фиброза. Необходимо тщательное исследование мазков крови для исключения наличия диспластических клеток. При АА может быть увеличено содержание фетального Hb: у детей это требует проведения дифференциального диагноза с миелопролиферативными миелодиспластическими синдромами, такими как ювенильный миеломоноцитарный лейкоз или другие подтипы МДС [3, 4].
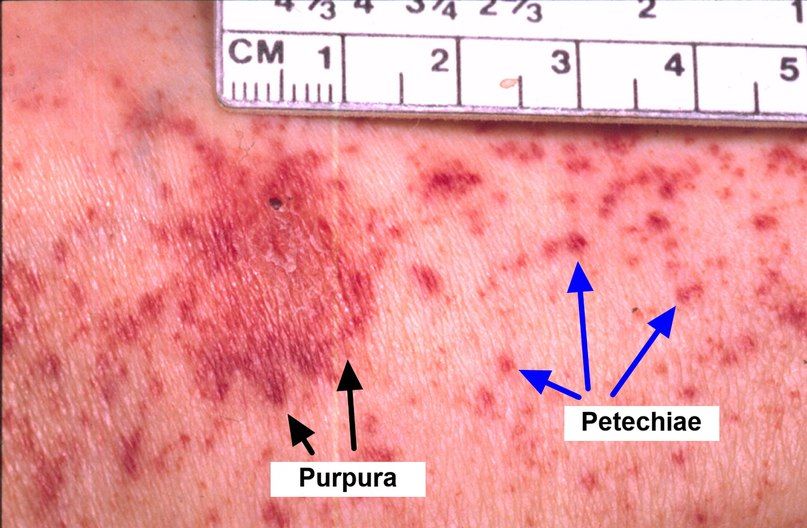
Критерии диагностики АА:
АА подразделяется на:
- Нетяжелую: отсутствие признаков тяжелой АА [4].
- Тяжелую: клеточность костного мозга < 25 % (или 25–50 % с < 30 % остаточных гемопоэтических клеток) + по меньшей мере 2 критерия из 3:
— количество нейтрофилов < 0–5×10 9 /л;
— число тромбоцитов < 20×10 9 /л;
— количество ретикулоцитов < 20×10 9 /л.
- Очень тяжелую: те же признаки, что и при тяжелой, но количество нейтрофилов < 0–2×10 9 /л;
Основным методом диагностики является проведение трепанобиопсии. Аспират костного мозга при АА обычно содержит трабекулы с пустыми, заполненными жиром межтрабекулярными пространствами и малым количеством гемопоэтических клеток. Могут присутствовать единичные лимфоциты, плазматические клетки, макрофаги и тучные клетки [1].
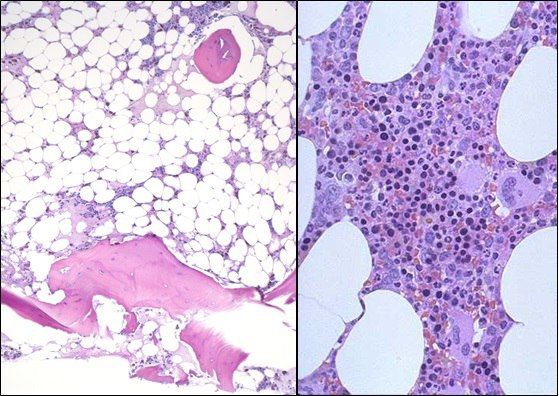
Слева — апластическая анемия, справа — норма
При выполнении цитогенетического анализа могут возникнуть трудности из-за низкой клеточности материала: для получения достаточного количества клеток может потребоваться несколько аспираций. Обнаружение клональных цитогенетических аномалий при апластической анемии является признаком наличия миелоидного заболевания. Переход к более новым методам, таким как сравнительная геномная гибридизация (CGH), позволяет обнаруживать анеуплоидии, делеции, дублирование и/или амплификации любого локуса.
Терапия проводится при помощи следующих препаратов и методов:
- Антитимоцитарный глобулин (antithymocyte globulin, ATG), получаемый путем иммунизации животных (лошади или кролика) человеческими лимфоцитами; при монотерапии ATG клиническое улучшение наблюдается в 50–60 % случаев. Обычно для улучшения результата его назначают в комбинации с циклоспорином. Также на короткий срок назначаются кортикостероиды для снижения вероятности аллергической реакции и развития сывороточной болезни (лихорадка, сыпь и суставные боли), что может произойти приблизительно через 7 дней после введения ATG.
Количество тромбоцитов должно поддерживаться на уровне выше 10×10^9/л (по возможности — выше 20–30×10 9 /л). При отсутствии ответа на ATG через 4 месяца может быть начат второй курс того же или другого препарата. В целом на комбинацию ATG и циклоспорина положительно реагирует до 80 % пациентов; - Циклоспорин показывает высокую эффективность в сочетании с ALG, но у пожилых людей иногда может использоваться и в виде монотерапии;
- Алемтузумаб (антитело против антигена CD52 лимфоцитов) показал эффективность примерно у 50 % пациентов (в небольших исследованиях), и обычно используется только при неэффективности ATG;
- Элтромбопаг (Eltrombopag) стимулирует образование тромбоцитов, а также может привести к увеличению количества эритроцитов и нейтрофилов;
- Трансплантация стволовых клеток (ТСК). Проведение аллогенной ТСК у отдельных пациентов подразумевает возможность полного выздоровления. Кондиционирование проводится с циклофосфамидом без облучения, для снижения риска неприживления трансплантата и реакции «трансплантат против хозяина» используется циклоспорин. Сравнительный анализ эффектов ТСК и иммуносупрессивной терапии у лиц с апластической анемией до сих пор остается предметом дискуссий. Как правило, ТСК применяется у пациентов с тяжелой апластической анемией в возрасте менее 35 лет и имеющимся HLA-совместимым донором. У отдельных пациентов в возрасте старше 40 лет возможно применение ТСК с использованием немиелоаблативных режимов, но в основном у пациентов старшего возраста и лиц с меньшей тяжестью заболевания в первую очередь проводится иммуносупрессия;
- Гемопоэтические факторы роста. Гранулоцитарный колониестимулирующий фактор (G-CSF) может вызывать незначительный ответ, но обычно не приводит к стойкому улучшению. Другие факторы роста не показали свою эффективность [2, 3, 4].
- Иммуносупрессивная терапия 1 линии — это сочетание лошадиного ATG и циклоспорина для пациентов с нетяжелой АА, тяжелых или очень тяжелых пациентов с АА, у которых отсутствует подходящий родственный донор, а также тяжелых или очень тяжелых пациентов с АА старше 35–50 лет. Второй курс ATG может быть проведен после отсутствия ответа на первый курс или после рецидива после первого курса. При отсутствии ответа на второй курс АА считается рефрактерной и проводится альтернативная терапия при помощи алемтузумаба, элтромбопага или ТСК.
Также необходима поддерживающая терапия при помощи гемотрансфузии. Единого целевого значения концентрации гемоглобина не существует, и оно должно быть установлен индивидуально. Для снижения риска иммунизации следует учитывать фенотип Rh и Kell. Пациентам с АА, получающим активное лечение и находящимся в стабильном состоянии, следует назначать профилактические переливания тромбоцитов, пороговая концентрация тромбоцитов составляет 10×10 9 /л. У пациентов, имеющих факторы риска кровотечения, число тромбоцитов должно составлять 20×10 9 /л. Регулярные профилактические переливания тромбоцитов не рекомендуются для стабильных пациентов с АА, не находящихся на активном лечении в данный момент. У пациентов с апластической анемией при регулярной поддержке переливания РБК будет развиваться перегрузка тканевого железа. Сывороточный ферритин остается наиболее широко используемым показателем для оценки перегрузки железом. Магнитно-резонансная томография может определять содержание железа количественно и является хорошим дополнением к лабораторным методам мониторинга [4].
Читайте также:

