Супрастин при атопическом дерматите у грудничка
Обновлено: 19.04.2024
Для цитирования: Петрова К.С., Петрова Г.А. Хлоропирамин (Супрастин) – современные аспекты применения в терапии аллергодерматозов. РМЖ. 2014;8:617.
Термин «аллергодерматозы» широко употребляется отечественными специалистами в отношении заболеваний кожи, характеризующихся аллергическими механизмами патогенеза. К этой группе заболеваний традиционно относят крапивницу, аллергический контактный дерматит, токсидермию, экзему, атопический дерматит (ранее – диффузный нейродермит, который может иметь, как сейчас становится понятным, атопическую и неатопическую природу).
Все эти заболевания характеризуются воспалительными изменениями кожи и, практически всегда, – сильным зудом. Традиционно в терапии всех вышеназванных дерматозов применялись антигистаминные препараты, эффективность которых при разных заболеваниях не была одинаковой, что сегодня служит причиной многочисленных споров относительно целесообразности использования этой группы препаратов в терапии некоторых дерматозов данной группы.
Антигистаминные препараты традиционно занимают особое место среди препаратов, используемых для лечения дерматологических процессов, и с успехом применяются практикующими врачами на протяжении многих лет. Представители антигистаминного ряда подразделяются специалистами на 2 группы (первое и второе поколение). Выделение третьего поколения антигистаминных средств, по мнению авторитетных источников, необоснованно [13, 14].
Новое поколение антигистаминных препаратов отличается пролонгированным действием, отсутствием выраженного седативного эффекта. Однако перечень медицинских показаний для применения этой группы препаратов достаточно ограничен по сравнению с препаратами первого поколения. Так, к показаниям к применению классических антигистаминных препаратов помимо ринита и крапивницы относятся также: отек Квинке, сывороточная болезнь, конъюнктивиты, контактный дерматит, экзема, атопический дерматит, аллергические процессы.
Необходимость антигистаминной терапии при различных аллергодерматозах дискутабельна и практически не обсуждается лишь при крапивнице, механизм развития которой в большинстве случаев и в большей степени обусловлен непосредственно аллергическими факторами.
Каждый четвертый–шестой человек хотя бы один раз в жизни переносит крапивницу, у 25% она имеет хроническое течение [1]. Крапивница обусловлена высвобождением медиаторов воспаления, в т. ч. гистамина, из тучных клеток. В большинстве случаев дегрануляция тучных клеток является результатом IgE-опосредованной аллергической реакции немедленного типа или иммунокомплексной аллергической реакции с образованием фрагментов комплемента С3а и С5а, вызывающих дегрануляцию тучных клеток [1]. Реже возможно прямое, псевдоаллергическое высвобождение медиаторов тучными клетками в результате действия препаратов (рентгеноконтрастных, салицилатов, препаратов бензойной кислоты, опиатов, кодеина и др.), пищевых компонентов или других веществ. В ряде случае крапивница может быть спровоцирована физическими воздействиями (механическая крапивница, крапивница давления, холодовая, тепловая, световая крапивница). При определенных обстоятельствах дегрануляция тучных клеток может быть связана с воздействием адреналина и ацетилхолина – медиаторов вегетативной нервной системы – с развитием так называемой холинергической крапивницы, характеризующейся появлением многочисленных мелких волдырей на фоне физической активности с повышенной потливостью, и адренергической крапивницы на фоне эмоционального стресса. Выделяют также аквагенную, вызванную контактом с водой, и контактную крапивницу, связанную с непосредственным воздействием на кожу высвобождающих гистамин токсинов при контакте с некоторыми растениями (крапива) или насекомыми.
Результатом высвобождения биологически активных веществ является расширение и увеличение проницаемости мелких сосудов с выходом плазмы в окружающую ткань, что клинически сопровождается отеком и формированием волдыря. Благодаря способности блокировать гистаминовые рецепторы антигистаминные препараты значительно ослабляют эффекты гистамина и устраняют или значительно ослабляют проявления практически при всех видах крапивницы, за исключением редких случаев, вызванных воздействием медиаторов тучных клеток (лейкотриенов, простагландинов, цитокинов) или аутоантителами против IgE (аутоиммунная крапивница) [1].
Традиционно под термином «антигистаминные средства» подразумевают препараты, блокирующие Н1-гистаминовые рецепторы, использующиеся для купирования аллергических реакций, в отличие от препаратов, блокирующих Н2-рецепторы, которые принято называть Н2-гистаминоблокаторами и которые используют с целью уменьшения секреции при заболеваниях ЖКТ.
Антигистаминные препараты блокируют действие гистамина на Н1-рецепторы за счет конкурентного ингибирования, но их сродство к гистаминовым рецепторам значительно ниже, чем у гистамина [3]. Они блокируют незанятые или высвобождающиеся рецепторы. Соответственно, Н1-блокаторы эффективны при аллергических реакциях немедленного типа.
Как уже было указано, антигистаминные препараты по времени создания подразделяют на препараты первого и второго поколения. Препараты второго поколения отличают высокая специфичность и сродство к Н1–рецепторам при отсутствии влияния на рецепторы к другим биологически активным веществам (холиновые и серотониновые) и минимальный седативный эффект вследствие слабой проницаемости гематоэнцефалического барьера, что, несомненно, обусловливает патогенетическую целесообразность использования антигистаминовых препаратов второго поколения в терапии различных форм крапивницы с развитием аллергической реакции немедленного типа.
Однако патогенез других так называемых аллергодерматозов имеет гораздо более сложный и не столь однозначный характер. Аллергический контактный дерматит развивается в результате гиперчувствительности замедленного типа на химические вещества, которые контактируют с кожей [3] и, вероятно, несостоятельности барьерной функции кожи. Патогенез токсидермии включает иммунные (аллергические реакции немедленного типа, цитотоксические аллергические реакции, иммунокомплексные аллергические реакции, аллергические реакции замедленного типа) и неиммунные механизмы (наследственная недостаточность ферментов, местное раздражающее действие препарата, кумуляция, идиосинкразия, комбинированное действие препарата и ультрафиолетового излучения и др.) [1].
В патогенезе экземы и атопического дерматита, а также неатопического варианта диффузного нейродермита (диффузный нейродермит взрослых без предшествующих проявлений атопии) помимо аллергических механизмов, возможно, даже большую роль в настоящее время отводят приобретенному и врожденному дефекту барьерной функции кожи [3], слабости иммунной системы (на уровне субпопуляций Т-лимфоцитов) [4] и неврологическим механизмам (вегетативная дисфункция, одним из проявлений которой является белый дермографизм, функциональные расстройства центральной нервной системы и нарушения функции рецепторного аппарата кожи), усугубляющимся интенсивным и постоянным зудом [2] и приводящим, в конечном счете, к нейроэндокринным сдвигам, нарушениям деятельности пищеварительного тракта и обменных процессов, усугубляющим болезнь. Мучительный кожный зуд, характерный для этих заболеваний, существенно снижает качество жизни пациентов, является причиной бессонницы и развития невротических расстройств.
Это объясняет недостаточную эффективность антигистаминных препаратов второго поколения при данных заболеваниях, что подтверждается и клиническим опытом. Препараты этой группы обладают недостаточным противозудным эффектом, тогда как залогом успешной терапии при атопическом дерматите, по общему мнению дерматологов, в настоящее время является именно эффективная противозудная терапия, способная быстро разорвать порочный патогенетический круг, характерный для данного заболевания «расчесы – зуд – нарастание клинических проявлений болезни» [3].
Ощущение зуда, так же как и ощущение боли, обусловлено передачей нервного импульса по латеральному спиноталамическому тракту в спинном мозге. При этом центральное восприятие чувства зуда обеспечивается первичными сенсорными корковыми структурами головного мозга, расположенными в левом полушарии, и чувство зуда возникает уже при минимальных воспалительных изменениях в эпидермисе [5]. Кроме того, при раздражении нейрорецепторов кожи посредством механического воздействия при расчесывании сигнал поступает в ЦНС и ответная реакция направлена обратно в кожу по типу аксон-рефлекса и вызывает освобождение нейропептидов, которые способствуют дегрануляции тучных клеток с выделением гистамина и других медиаторов воспаления (серотонина, ацетилхолина т. д.). Считается, что они играют значительную роль в патогенезе зуда и являются патогенными раздражителями ноцицепторов, обусловливающих появление субъективных ощущений [5]. Кроме этого, процесс альтерации тканей кожи в результате расчесов также способствует высвобождению биологически активных веществ (гистамина, серотонина, лизосомальных ферментов, кининов, простагландинов и др.), усиливающих воспаление [6], что сопровождается и усилением зуда, способствующим при длительном течении заболевания усугублению функциональных расстройств нервной системы и формированию порочного патогенетического круга «расчесы – зуд – расчесы». Имеются данные, свидетельствующие о том, что иммунодепрессия и состояние сенсибилизации у больных экземой и атопическим дерматитом (диффузным нейродермитом) развиваются на фоне функциональных нарушений ЦНС и синдрома вегетативной дистонии с преобладанием в коре головного мозга процессов застойного возбуждения, реже – торможения, ухудшающих функциональное состояние нейронов, и угнетением симпатической и возбуждением парасимпатической нервной системы с уменьшением коэффициента ахетилхолин/адреналин до 0,5–0,05 (в группе здоровых – 0,87). При этом необходимо учесть, что, поскольку именно симпатическая нервная система в нормальных условиях обеспечивает положительный иммунотропный эффект, ослабление ее тонуса сопровождается снижением иммунного ответа и развитием сенсибилизации [7]. С другой стороны, избыточная концентрация нейромедиаторов (ацетилхолин и серотонин) в условиях повышения тонуса парасимпатической нервной системы может сама по себе служить причиной так называемого неврогенного зуда [5]. Парасимпатические регуляторные влияния, кроме снижения иммунного ответа, ведут к увеличению содержания в клетках цГМФ, активирующих продукцию медиаторов аллергии, в т. ч. гистамина [7].
Антигистаминные препараты первого поколения характеризуются менее высокой специфичностью и сродством к Н1-рецепторам. Кроме гистаминовых они могут блокировать холинергические, мускариновые и серотониновые рецепторы. Препараты этой группы проникают через гематоэнцефалический барьер и связываются с Н1-рецепторами головного мозга, одновременно блокируя центральные серотониновые и ацетилхолиновые рецепторы, чем, очевидно, обусловлен их седативный эффект [3], выраженность которого отличается у разных препаратов и зависит от индивидуальных особенностей пациента, они также обладают выраженным местноанестезирующим действием. Благодаря перечисленным механизмам антигистаминные препараты первого поколения обладают выраженным противозудным эффектом не только при аллергодерматозах, но и при кожном зуде другой этиологии, не связанной с аллергическими механизмами. Седативный и противозудный эффект препаратов первого поколения наряду с антигистаминной активностью, несомненно, имеет особое значение в терапии аллергодерматозов, одним из проявлений которых является мучительный зуд, значительно усиливающийся в состоянии покоя и ночные часы. Нарушения сна и отдыха вследствие зуда ведут к угнетению эмоциональной сферы, формированию синдрома хронической усталости и усугубляют клинические проявления дерматоза.
Многие из препаратов этой группы выпускаются и в парентеральных формах, что позволяет избежать влияния патологии ЖКТ на фармакодинамические свойства препарата и получить даже при выраженных нарушениях функции ЖКТ предсказуемый и ожидаемый эффект. Центральное холинолитическое действие, противорвотный и противоукачивающий эффект некоторых препаратов этой группы, а также способность угнетать возбудимость вестибулярных рецепторов позволяют применять их при болезнях движения. Некоторые из препаратов данной группы за счет непосредственного действия на кашлевой центр в продолговатом мозге оказывают противокашлевый эффект. Благодаря воздействию на серотониновые рецепторы антигистаминные препараты первого поколения могут оказывать анальгезирующее, противосудорожное и жаропонижающее действие [1, 7]. При этом необходимо помнить о возможности усиления седативного эффекта антигистаминных препаратов первого поколения при сочетании с алкоголем и психотропными средствами и невозможности использования их в период работ, требующих сосредоточенности и внимания.
Атропиноподобные реакции, связанные с антихолинергическими свойствами препаратов, могут обусловливать в некоторых случаях сухость во рту и носоглотке, запоры, тахикардию и нарушения зрения, однако эти же свойства обеспечивают эффективность препаратов первого поколения при неаллергическом рините и атопическом дерматите без наличия реагиновых антител и вариантах крапивницы без анафилактических антител (холинергической, тепловой и др.), связанных в основном с вегетативным дисбалансом.
Следует отметить, что антигистаминные препараты первого поколения отличаются кратковременностью воздействия, в т. ч. и побочных эффектов, что при относительно быстром наступлении клинического эффекта позволяет выбрать оптимальный режим приема в течение суток.
Благодаря выраженному седативному, противозудному и холинолитическому действию в комбинации с высокой антигистаминовой активностью именно препараты первого поколения могут эффективно использоваться в комплексной патогенетической терапии аллергодерматозов (крапивницы, аллергического контактного дерматита, токсидермии, различных форм процесса, атопического дерматита и неатопического варианта диффузного нейродермита), что подтверждается повседневным, в т. ч. международным, клиническим опытом [1, 2].
Одним из наиболее распространенных, эффективных и безопасных антигистаминовых препаратов первого поколения является Супрастин (хлоропирамин) – классический антигистаминовый препарат из группы этилендиаминовых. Супрастин блокирует Н1-гистаминовые и мускариновые рецепторы, проникает через гематоэнцефалический барьер, обладает выраженным антигистаминовым, м-холиноблокирующим эффектом, умеренной периферической холиноблокирующей активностью, седативным, противорвотным и спазмолитическим действием [3]. Терапевтический эффект Супрастина развивается в течение 15–30 мин. после приема внутрь, достигает максимума в течение первого часа и продолжается минимум 3–6 ч. Препарат почти полностью всасывается в ЖКТ, хорошо распределяется в организме, интенсивно метаболизируется в печени, выводится в основном почками. У детей выведение происходит быстрее.
Официальными показаниями к назначению препарата являются: крапивница, ангионевротический отек (отек Квинке), сывороточная болезнь, сезонный и круглогодичный аллергический ринит, конъюнктивит, контактный дерматит, кожный зуд, острая и хроническая экзема, атопический дерматит, пищевая и лекарственная аллергия, аллергические реакции на укусы насекомых. Препарат может назначаться детям с 1-го мес.
При приеме внутрь может назначаться 2–3 р./сут. Может вводиться парентерально – внутримышечно, в острых тяжелых случаях внутривенно (под контролем врача), что особенно важно в лечении детей, пациентов, страдающих тяжелыми и распространенными формами аллергодерматозов, а также у пациентов, имеющих сопутствующую патологию ЖКТ.
При длительном использовании препарата необходимо помнить о возможности снижения антигистаминовой активности (2–3 нед.). При необходимости возможна комбинация Супрастина с блокаторами Н1-рецепторов второго поколения.
И, конечно, необходимо учитывать, что максимальный клинический эффект при лечении аллергодерматозов с использованием антигистаминовых препаратов первого поколения может быть достигнут только при условии комплексной терапии, учитывающей все известные механизмы патогенеза, и которая должна включать и рациональные элиминационные мероприятия, разумную диету, устранение контакта с причинными аллергенами, уменьшение воздействия неблагоприятных неспецифических факторов, адекватный режим водных процедур, оптимальную местную противовоспалительную и противозудную терапию, ни в коем случае не усугубляющую нарушения барьерной функции кожи, а также терапию, направленную на восстановление барьерной функции эпидермиса.
Личный клинический опыт свидетельствует о том, что Супрастин играет незаменимую роль в комбинированной терапии различных форм крапивницы, особенно идиопатической, холинергической и адренергической, аллергического контактного дерматита, различных форм экземы (включая наиболее распространенную нумулярную и дисгидротическую), атопического дерматита и неатопического варианта диффузного нейродемита (особенно в стадии сильного зуда, когда антигистаминные препараты второго поколения в силу избирательного действия на Н1-гистаминовые рецепторы практически не способны влиять на его интенсивность). А назначение Супрастина в амбулаторных условиях 1–2 р./сут и только в период окончания активной деятельности с высокой надежностью позволяет избежать неприятных последствий его седативного действия в период активности пациентов. При этом наличие инъекционной формы значительно увеличивает возможность использования препарата, включая случаи на фоне выраженных нарушений функции ЖКТ, способных значительно изменить фармакокинетику пероральных препаратов.
- Рекен М., Шаллер М., Заттлер Э., Бургдорф В. Атлас по дерматологии М.: Медэкспресс-информ, 2012. С. 166, 194, 196.
- Геппе Н.А. Представление о механизмах лихорадки у детей и принципах жаропонижающей терапии // РМЖ. 2003. № 1. С. 31–37.
- итцпатрик Т., Джонсон Р., Вульф К. и др. Дерматология. Атлас-справочник М.: Практика, 1999. С. 54, 322, 582.
- Европейское руководство по лечению дерматологических болезней / Под ред. А.Д. Кацамбаса, Т.М. Лотти; пер. с англ. М.: МЕДпресс-информ, 2008. С. 53–59.
- Петрова Г.А. Принципы наружной кортикостероидной терапии аллергодерматозов // Вопросы современной педиатрии. 2005. Т. 4, № 5. С. 92–95.
- Полосьянц О.Б., Силина Е.Г., Намазова Л.С. Антигистаминные препараты // Медицина неотложных состояний. 2007. № 4. С. 88–92.
- Короткий Н.Г. Современная наружная терапия дерматозов (с элементами физиотерапии) / Под ред. Н.Г. Короткого. Тверь: Губернская медицина, 2001. С. 190–191.
- Кочергин Н.Д. Атопический дерматит: современные аспекты патогенеза и терапии // Русский медицинский журнал. 2004. № 18. С. 1076.
- Кошевенко Ю.Н. Кожа человека. Т. 2. Варианты патогенного воздействия на структуру и функции кожи, причины, патофизиологические основы и возможности лечения ее болезней. М.: Медицина, 2007. 519 с.
- Общая патология кожи / Под. ред. В.Н. Мордовцева, Г.М. Цветковой. Т. 1. М.: Медицина, 1993. 278 с.
- Симптоматическое применение антигистаминных препаратов при острых респираторных заболеваниях у детей Геппе Н.А., Снегоцкая М.Н., Колосова Н.Г. и др. // Педиатрия. 2009. Т. 87/№3. С. 86–89.
- Чернух А.М., Александров П.А. Микроциркуляция. М., 1984. 239с.
- L. Laurence Brunton, John S. Lazo, Keith L. Parker. Goodman & Gilman’s The Pharmacological Basis of Therapeutics 11th Ed. N.Y., McGraw-Hill, 2006.
- Katzung B.G. Basic & Clinical Pharmacology, 11th Ed. McGraw-Hill, 2009.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Атопический дерматит (АД) является серьезной педиатрической проблемой. Это обусловлено его широкой распространенностью в детской популяции, хроническим рецидивирующим течением, существенно снижающим качество жизни больных 1. Кроме того, атопический дерматит рассматривается как начальный этап "атопического марша" - перехода от кожных проявлений атопии к респираторным (аллергическому риниту, атопической бронхиальной астме) или формированию дермато-респираторного синдрома 5.
Ранняя диагностика, своевременная комплексная терапия способна уменьшить вероятность трансформации кожных проявлений атопии в респираторные. В отечественных и зарубежных руководствах, посвященных лечению АД, антигистаминным препаратам уделяется особое внимание, как основным средствам купирования острых проявлений болезни 6. Антигистаминные препараты I поколения блокируют Н1 - холинергические и серотониновые рецепторы, обладают седативным действием. Эти фармакологические действия могут дать полезные клинические эффекты при обострении АД: быстро уменьшить мучительный зуд, нормализовать нарушенный сон, снизить гиперреактивность кожи. Кроме этого, в последние годы антигистаминные препараты II поколения, обладающие сочетанной (антигистаминной и противовоспалительной активностью), рекомендуются к использованию в качестве средств контроля или противорецидивной (базисной) терапии АД 9.
Один из таких препаратов - цетиризин, преимуществами которого является не только избирательная блокада Н1-гистаминовых рецепторов, но и угнетение выделения медиаторов поздней фазы аллергической реакции, способствующих миграции эозинофилов, нейтрофилов и базофилов в ответ на введение аллергена, снижение экспрессии молекул адгезии, подавление действия других медиаторов и индукторов секреции гистамина 14. Цетиризин не обладает холиноблокирующим действием и практически не оказывает седативного эффекта. Препарат отличается высоким профилем безопасности у детей: при продолжительном приеме (более 18 месяцев) не было отмечено изменения физиологических функций, в том числе ЭКГ, лабораторных показателей, психического состояния 14. Известно, что при систематическом применении концентрации цетиризина в коже и сыворотке становятся эквивалентными [15]. При длительном (более 110 недель) приеме не наблюдается развитие толерантности. В связи с высокой эффективностью и безопасностью препарат разрешен к применению в педиатрической практике с 6 месяцев.
Клинические исследования
Целью настоящего исследования было изучение клинической эффективности и переносимости комбинированной терапии Супрастином (хлоропирамин) и Парлазином (цетиризином) фирмы Egis (Венгрия) у детей с атопическим дерматитом.
Препараты были назначены 43 детям (19 мальчиков, 24 девочки) в возрасте 1,5-9 лет, страдающим АД легкой и средней степени тяжести с длительностью заболевания 3-5 лет. Дети находились на лечении, а затем на диспансерном наблюдении во втором аллергологическом отделении Научного центра здоровья детей РАМН (22 ребенок) и Научно-практическом центре аллергической патологии Новосибирска (21 детей). У 16 детей АД сочетался: с бронхиальной астмой легкого течения (5): аллергическим ринитом (7); с бронхиальной астмой и аллергическим ринитом (4). На момент включения пациентов в исследование сопутствующая аллергическая патология была в периоде клинической ремиссии и дети не получали никаких медикаментозных средств.
Всем больным было проведено клиническое и аллергологическое обследование, включавшее исследование биохимических показателей, ЭКГ, определение уровня общего IgE в сыворотке крови, постановку кожных скарификационных проб или определение аллергенспецифических IgE-антител в сыворотке крови. Оценка выраженности симптомов АД проводилась до начала терапии, на 3, 5, 7, 10 и 15 дни лечения и далее по потребности, но не реже 1 раза в 10 дней с использованием шкалы SCORAD [25]. Общая продолжительность наблюдения составила 4-6 месяцев.
При обследовании у большинства больных была выявлена поливалентная сенсибилизация. У детей до 4 лет преобладала повышенная чувствительность к пищевым аллергенам, у пациентов старше 4 лет - к пыльцевым и/или бытовым аллергенам. Давность обострения АД у наблюдаемых детей составила 3-9 дней, индекс SCORAD до начала лечения достигал 39,7±3,8 баллов, что свидетельствовало об обострении средней степени тяжести.
Учитывая тяжесть обострения, выраженный зуд, нарушения сна, всем пациентам на первые 4-5 дней терапии был назначен Супрастин 1 раз в день (в возрастной дозировке, в/м, на ночь) и Парлазин (2,5 мг 2 раза в сутки детям от 2 до 6 лет и 10 мг 1 раз в сутки детям старше 6 лет) на 60-120 дней, а также наружная кортикостероидная терапия (мометазона фуроат) в формах, соответствующих характеру и локализации очагов кожного воспаления.
Анализ клинических симптомов на фоне проводимого лечения (табл. 1), показал, что уже к 3 суткам состояние детей улучшилось, снизился зуд, улучшился сон, уменьшилась интенсивность гиперемии, снизилась экссудация, отек. Достоверное сокращение площади поражения (на 30-40%), выраженности объективных и субъективных симптомов более чем в 2 раза было отмечено на 5 день терапии (рТаблица 1
Динамика индекса SCORAD у наблюдаемых детей
| Показатели SCORAD | До начала терапии | 3 день лечения | 5 день лечения | 7 день лечения | 15 день лечения |
| Площадь поражения (%) | 21,2±2,1 | 15,3±2,5 | 8,9±0,7 | 6,7±0,5 | 4,8±0,3 |
| Интенсивность клинических проявлений (баллы) | 7,9±1,3 | 4,9±0,8 | 3,5±0,4 | 1,9±0,2 | 0,7±0,3 |
| Выраженность зуда (баллы) | 5,6±0,5 | 2,9±0,3 | 1,9±0,3 | 0,4±0,1 | 0,2±0,1 |
| Нарушение сна (баллы) | 4,6±0,3 | 2,3±0,2 | 1,8±0,2 | 0,3±0,1 | 0 |
| Индекс SCORAD | 39,7±3,8 | 25,4±1,8 | 16,1±0,5 | 9,3±0,3 | 5,7±0,3 |
Таким образом, максимальная длительность применения наружной кортикостероидной терапии составила 7 дней, при сохраняющихся минимальных проявлениях АД, контроль за симптомами заболевания осуществлялся только приемом Парлазина и средствами лечебной косметики. На 10 сутки лечения у 39 детей была достигнута ремиссия АД, к концу второй недели обострение было купировано у всех пациентов.
В последующем все дети в качестве средства контроля за симптомами АД продолжили прием Парлазина в возрастной дозировке в течение 60-120 дней. Помимо этого, всем родителям были даны рекомендации по соблюдению гипоаллергенного быта с устранением, по возможности, контакта с причиннозначимыми аллергенами, элиминационной диете, а также по применению средств ухода за кожей.
При длительном приеме Парлазина ни у одного ребенка не было отмечено нарушений функции сердечно-сосудистой системы (подтверждено результатами ЭКГ), побочных реакций, значимых изменений биохимических показателей, характеризующих состояние почек и печени.
Дополнительно к оценке динамики симптомов АД было изучено влияние терапии на качество жизни семьи и сотрудничество с врачом. Быстрое уменьшение кожного зуда, улучшение ночного сна больных, получающих на начальном этапе комбинированную терапию Супрастином и Парлазином и топические кортикостероидные средства, привело к улучшению их самочувствия и работоспособности и, как следствие улучшило качество жизни. Одним из положительных моментов, отмеченных родителями, стала быстрая отмена наружной кортикостероидной терапии и продолжительная монотерапия Парлазином для "закрепления" терапевтического эффекта, а так же с целью профилактики развития обострений АД.
Таким образом, активная тактика ведения детей с обострением АД, раннее назначение комбинированной терапии антигистаминными препаратами и короткого курса топического кортикостероида, позволяет не только быстро купировать симптомы заболевания, снизить дозу гормонального препарата, но и обеспечивает длительную ремиссию кожного атопического процесса. Полученные результаты свидетельствуют о возможности достижения контроля над аллергическим воспалением. Высокая эффективность, безопасность и хороший профилактический эффект позволяет рекомендовать Супрастин и Парлазин детям, страдающим АД в комбинированной терапии.
Список литературы находится в редакции
Сведения об авторах:
Татьяна Алексеевна Филатова, старший научный сотрудник аллергологического отделения №2 ГУ Научный центр здоровья детей РАМН, д-р мед. наук
Вера Афанасьевна Ревякина, руководитель аллергологического отделения №2 ГУ Научный центр здоровья детей РАМН, профессор, д-р мед. наук
Елена Геннадьевна Кондюрина, зав. кафедрой педиатрии факультета повышения квалификации и постдипломной переподготовки врачей ГОУ ВПО "Новосибирская государственная медицинская академия Росздрава", профессор, д-р мед. наук
Вера Викторовна Зеленская, ассистент кафедры педиатрии факультета повышения квалификации и постдипломной переподготовки врачей ГОУ ВПО "Новосибирская государственная медицинская академия Росздрава", д-р мед. наук
К терапевту, семейному врачу часто обращаются за помощью пациенты с острыми проявлениями аллергии. Грамотное лечение способствует быстрому купированию симптомов болезни. В дальнейшем таких пациентов следует направлять к специалисту — врачу-аллергологу
К терапевту, семейному врачу часто обращаются за помощью пациенты с острыми проявлениями аллергии. Грамотное лечение способствует быстрому купированию симптомов болезни.

В дальнейшем таких пациентов следует направлять к специалисту — врачу-аллергологу, который проведет обследование, уточнит диагноз и составит индивидуальную программу лечения. Наиболее часто препаратами первой линии в практике терапевта при обращении больных по поводу аллергических заболеваний являются антигистаминные средства.
Антигистамины применяются при классических аллергических заболеваниях, таких, как аллергический ринит, конъюнктивит пыльцевой, бытовой, эпидермальной и грибковой этиологии. Широкое применение нашла данная группа препаратов также при заболеваниях кожи, сопровождающихся зудом (острая и хроническая крапивница, атопический дерматит, контактный дерматит). Обязательно назначают антигистаминные препараты при тяжелых проявлениях аллергии: отеке Квинке, анафилактическом шоке.
Некоторые особенности действия антигистаминов позволяют расширить показания для назначения этих препаратов. Например, супрастин способен проникать через гематоэнцефалический барьер и взаимодействовать с гистаминовыми и мускариновыми рецепторами, что вызывает снижение чрезмерной активности центра чихания в продолговатом мозге и облегчает состояние больных при ОРВИ в первые дни заболевания. Препарат блокирует парасимпатическую стимуляцию назальных желез, уменьшает сосудистую дилатацию и транссудацию, что приводит к снижению экскреции назальной жидкости при простуде. Прием супрастина при респираторной инфекции рекомендован ВОЗ. Препарат можно применять с первого месяца жизни.
Аллергические заболевания широко распространены, ими болеют около 10% населения земного шара, причем наблюдаются значительные колебания этой величины — от 1 до 50 % и более в разных странах, районах, среди отдельных групп населения. Изучение глубинных механизмов аллергических болезней имеет большую социальную значимость.
На примере аллергического ринита можно увидеть, что происходит в тканях организма. Основная роль в этом процессе отводится так называемым тучным клеткам, расположенным под слизистой оболочкой носа. Под воздействием аллергена у лиц, имеющих генетическую предрасположенность, наблюдается повышенная выработка специфических веществ (антител). Антигены и антитела фиксируются на тучной клетке, содержащей до 500 гранул гистамина. Клетка активизируется и происходит выброс гистамина, который, являясь биологически активным веществом, вызывает расширение сосудов, повышение их проницаемости с образованием отека и выделением большого количества жидкости во внешнюю среду. Наблюдается также гиперсекреция слизи железами, расположенными в полости носа. Аллергия может развиваться к пыльце растений, спорам плесневых грибов, шерсти животных, домашней пыли. Соответственно, необходимо провести мероприятия по удалению аллергена из окружающей среды (например, с использованием воздухоочистителя); одновременно большинство пациентов нуждается в медикаментозной терапии, в ходе которой широко используются антигистаминные препараты.
Гистамин был синтезирован в 1907 г.
В 1909 г. его удалось извлечь из спорыньи. Серия исследований, выполненных в 20-е гг. ХХ в. дала возможность установить, что гистамин является важнейшим посредником таких аллергических проявлений, как анафилактический шок, риниты, бронхиальная астма, крапивница. У человека имеются Н1-, Н2- и Н3-гистаминовые рецепторы.
Начало изучения антигистаминов было положено в конце 1930-х гг., а еще через 10 лет они стали применяться для лечения различных заболеваний. Н1-блокаторы — препараты, традиционно применяемые при аллергических заболеваниях. В нашей стране также проводилась научно-исследовательская работа по синтезу антигистаминов, которая увенчалась успехом. В лаборатории М. Д. Машковского была создана оригинальная группа Н1-противогистаминных препаратов, не имеющих аналогов, — фенкарол (хифенадин) и бикарфен (МНН — сиквефенадин, новое торговое название гистафен). Данная группа препаратов обладает двойным механизмом действия: они не только блокируют Н1-рецепторы, но и активируют фермент диаминоксидазу (гистаминазу), снижая концентрацию гистамина в тканях.
Н2-блокаторы используются для лечения язвенной болезни, так как они угнетают секрецию соляной кислоты. В начале 1980-х гг. были открыты Н3-рецепторы, представленные преимущественно в центральной нервной системе.
Показаниями для назначения антигистаминов (Н1-блокаторов) являются сезонный и круглогодичный аллергический ринит, крапивница, аллергический конъюнктивит, зудящие дерматозы, включая атопический дерматит. Действие Н1-блокаторов обусловлено их конкурентным связыванием с гистаминовыми рецепторами. Препараты имеют различную продолжительность действия. Идеальный Н1-антагонист должен обеспечивать полное и быстрое исчезновение аллергических симптомов, сохранять эффект в течение продолжительного времени и не вызывать побочных эффектов.
Выделяют Н1-блокаторы I (см. табл. 1) и II поколения.
Н1-блокаторы I поколения быстро всасываются как при приеме внутрь, так и при инъекционном введении. Их фармакологический эффект проявляется через 30 мин. Большинство препаратов через 24 ч в неактивном виде выводится с мочой. При длительном применении развивается привыкание и возникает необходимость замены препарата. С проникновением в центральную нервную систему связано большинство побочных эффектов Н1-агонистов. Они обладают снотворным действием. Но если препараты I поколения принимать перед сном, последствия седативного действия сводятся к минимуму. Вместе с тем снотворный, противорвотный и противотревожный эффекты иногда используется в медицинских целях. Антигистаминные препараты назначаются перед операциями, для профилактики укачивания, при выраженном кожном зуде. Во время лечения необходим отказ от алкоголя, который может усилить снотворное действие. При местном применении можно наблюдать анестезирующее действие. Кроме того, большинство препаратов I поколения вызывает сухость во рту. С осторожностью их необходимо назначать при глаукоме, аденоме предстательной железы.
В целом Н1-блокаторы достаточно безопасны, и большинство из них относится к безрецептурным средствам.
Серьезные побочные эффекты в виде головокружения, сердцебиения, тошноты, рвоты, задержки мочи наблюдаются редко. У детей иногда бывают парадоксальные реакции в виде перевозбуждения (например, при приеме димедрола).
Активность Н1-блокаторов примерно одинакова, поэтому при выборе препарата ориентируются на его побочные действия, опыт применения и эффективность у данного больного. Н1-антагонисты I поколения, во всяком случае, в ближайшем будущем останутся в арсенале лекарственных средств широкого клинического применения. Это связано с накопленным 50-летним опытом применения этих средств, наличием инъекционных лекарственных средств, абсолютно необходимых для лечения острых аллергических состояний. Кроме того, следует отметить относительно низкую стоимость препаратов этой группы.
Химическая модификация первых препаратов привела к появлению новых средств, обладающих улучшенными характеристиками.
Отметим одно интересное свойство некоторых антигистаминов. Мы уже упоминали о тучной клетке, содержащей большое количество гранул гистамина. Основная масса препаратов действует только на уровне гистаминовых рецепторов, когда уже произошло повреждение самой клетки. Ряд лекарств обладает стабилизирующим защитным действием на оболочку этой клетки, в результате чего наблюдается противоаллергический эффект двойного действия. Этот механизм проявляется при применении препарата в течение нескольких месяцев, поэтому категория пациентов, страдающих хроническими аллергическими заболеваниями, нуждается в длительном приеме так называемых базисных препаратов (см. табл. 2).
Не одно десятилетие применяется в клинической практике задитен. Препарат имеет удовлетворительный клинический эффект и хороший профиль безопасности, что позволяет использовать его в детской практике. Педиатры и терапевты часто назначают задитен при хронических аллергических заболеваниях, учитывая его базисный эффект.
При появлении сонливости необходим прием препарата на ночь. Случаи прибавки в весе наблюдаются крайне редко.
При аллергическом рините, крапивнице широко используется фенистил. Кроме того, назначение фенистила в форме геля показано при местных аллергических реакциях, наблюдающихся, например, при укусе насекомых, а также зуде, беспокоящем больных с солнечными, легкими бытовыми и производственными ожогами. Препарат применяется при зуде, появляющемся при инфекционных заболеваниях, например кори, краснухе, ветряной оспе. Следует отметить, что препарат можно назначать детям с первого месяца жизни. Зуд облегчается через несколько минут, кожа успокаивается, появляется чувство прохлады. Препарат хорошо держится на коже, не пачкает одежду благодаря нежирной и прозрачной основе.
Таким образом, фенистил можно охарактеризовать как препарат, обладающий высокой антигистаминной активностью, способностью быстро и стойко облегчать симптомы аллергии, длительным противозудным действием, хорошей переносимостью. Фенистил имеет широкий спектр лекарственных форм, что обеспечивает возможность гибкого дозирования для всех групп пациентов.
С конца 1970-х гг. начался период внедрения в широкую медицинскую практику антигистаминных препаратов II поколения. Следует отметить их высокую избирательность блокады Н1-рецепторов и отсутствие взаимодействия с другими рецепторами. Противоаллергическое действие начинается через 20 мин и сохраняется достаточно продолжительное время — до 24 ч. Выпускаются эти препараты только в таблетированной форме. Их применяют 1 или 2 раза в день. Это предпочтительнее 3-разового приема антагонистов I поколения. Препараты II поколения не вызывают привыкания, а также седативного эффекта. Это безусловные достоинства новых средств. Пациенты, которые, например, водят автомобиль, и другие, нуждающиеся в том, чтобы сохранить способность воспринимать и перерабатывать информацию, безусловно, предпочитают это поколение антигистаминных препаратов (см. табл. 3).
Вместе с тем накапливается информация об этой группе препаратов, их достоинствах и недостатках.
На данный момент появился фексофенадин (торговые названия — фексадин, телфаст), фармакологически активный метаболит терфенадина. Он удачно отвечает самым высоким требованиям: высокоизбирательно блокирует Н1-рецепторы, т. е. обладает высокой афинностью к гистаминовым рецепторам, является неседативным средством, обладает высоким уровнем безопасности, не имеет, в отличие от своего предшественника терфенадина, кардиотоксичного эффекта. Препарат обладает противовоспалительным действием (подавляет эозинофилиндуцированное высвобождение медиаторов воспаления и IgE-обусловленную активацию базофилов и высвобождение гистамина). Его высокая терапевтическая активность продемонстрирована при хронической крапивнице, аллергическом риноконъюнктивальном синдроме, а в последнее время — и атопическом дерматите.
Фексофенадин применяется в дозе 120 мг при респираторной аллергии и в дозе 180 мг при кожной сыпи 1 раз в день. Он не нуждается в печеночном метаболизме, поэтому его можно применять у больных, страдающих патологией печени. Прием пищи не снижает абсорбции препарата. При длительном использовании фексофенадина нет эффекта кумуляции.
При хронической крапивнице различной этиологии с успехом применяется цетиризин (зиртек, цетрин). Но он характеризуется большей вероятностью седации, чем другие антигистаминные препараты II поколения (возможно развитие седативного эффекта приблизительно у 20% больных, получающих цетиризин в терапевтических дозах). В связи с этим препарат потенцирует действие алкоголя. Также цетиризин не рекомендуется для приема лицам, чья профессия требует особого внимания, и при вождении автомобиля. Препарат характеризуется быстрым наступлением клинического эффекта из-за незначительного метаболизма. Продолжительность действия — 24 ч. Не оказывает отрицательного влияния на сердце. Важным свойством цетиризина является его способность подавлять инфильтрацию эозинофилами — ключевыми клетками аллергического ответа поздней фазы.
При аллергодерматозах (крапивница, атопический дерматит, нейродермит, почесуха, аллергический контактный дерматит) высокоэффективен эбастин (кестин), так как благодаря своим липофильным свойствам он хорошо проникает в кожу. Кестин после приема 1 раз в сутки в течение 5 дней сохраняет свою активность в течение 3 сут, что, с одной стороны, исключает возобновление симптомов при случайном пропуске приема препарата, с другой — позволяет применять его по разработанной нами экономной интермиттирующей схеме: 5 дней приема, 3 дня перерыв, в течение 1-2 мес в период ожидаемого сезонного обострения аллергических заболеваний.
Дезлоратадин (эриус) — высокоэффективный антигистаминный препарат, обладающий высоким сродством к Н1-гистаминовым рецепторам. Доказано, что эриус не вызывает антихолинергических симптомов (сухость во рту, нарушение зрения), не влияет на психомоторную функцию (в том числе не усиливая ее нарушение при одновременном употреблении алкоголя) и не вызывает сонливость. Препарат ингибирует многие медиаторы, принимающие участие в развитии системного аллергического воспаления. Эриус широко применяется в клинической практике для лечения аллергического рино-конъюнктивального синдрома и аллергического ринита.
На сегодняшний день известно приблизительно 150 препаратов, обладающих антигистаминной активностью, но не все они нашли применение в аллергологической практике. Интересна история создания одной группы антидепрессантов. В 1950-х гг. были синтезированы препараты, обладающие антигистаминной активностью, а дальнейшие исследования показали, что для этих лекарственных средств характерна также специфическая психотропная активность. Сейчас эти препараты входят в список лекарственных средств, применяемых для лечения депрессии (амитриптилин).
Остановимся подробнее на применении Н1-блокаторов.
- Аллергический ринит хорошо поддается лечению антигистаминными препаратами. Уменьшается зуд в носу, чихание и секреция слизи, менее эффективно влияние на заложенность носа. Следует отметить более высокую эффективность препаратов на ранних стадиях заболевания, при первом появлении симптомов. При респираторной аллергии показан прием кестина 10 мг в сут, телфаста, 120 мг, или эриуса. Следует отметить, что эриус уменьшает заложенность носа. Высокой эффективностью при лечении аллергического ринита характеризуются местные интраназальные формы антигистаминных препаратов: азеластин (аллергодил), левокабастин (гистимет).
Препарат азеластин (аллергодил) является дериватом фталазинона и, как и другие антигистаминные препараты II поколения, связывает преимущественно периферические, чем центральные рецепторы. Он обладает широким спектром противоаллергического действия. Выпускается в виде назального спрея и глазных капель. Терапевтический эффект аллергодила проявляется уже в течение первых 15–20 мин после введения препарата и продолжается длительное время (от 10 до 12 ч).
Антигистаминный препарат левокабастин (гистимет) является селективным блокатором Н1-рецепторов гистамина, разработан специально для местного применения. Длительность действия гистимета сохраняется в течение 12 ч, что позволяет применять препарат 2 раза в сут.
При вазомоторном рините Н1-блокаторы I поколения менее эффективны, но благодаря М-холиноблокирующему действию они уменьшают отек и секрецию слизи.
- Острая крапивница. Н1-блокаторы быстро уменьшают высыпания и зуд. Особенно хороший результат наблюдается при острой крапивнице аллергической этиологии.
- При отеке Квинке обязательной является инъекция антигистаминного препарата (тавегила или супрастина) в комбинации с мочегонными средствами и глюкокортикоидами.
- При хронической крапивнице назначается базисная терапии антигистаминами II поколения (эбастин, цетиризин, акривастин, лоратадин).
- При токсидермии и контактном дерматите антигистаминные препараты применяются как симптоматическое средство с целью уменьшения зуда.
- При развитии сывороточной болезни и наличии крапивницы также назначаются антигистаминные препараты. Следует отметить, что они не влияют на артралгии, лихорадку и висцеральные проявления.
- При анафилактическом шоке тавегил и супрастин применяются в составе комплексной терапии после инъекции адреналина и при отсутствии резкого снижения артериального давления.
- Учитывая седативный и противотревожный эффект некоторых антигистаминов I поколения, их включают в премедикацию перед операциями и хирургическими манипуляциями. При тревоге, вегетативной гиперактивности, расстройствах сна хорошо зарекомендовал себя атаракс.
- Иногда антигистамины I поколения назначаются для профилактики укачивания.
- В комбинации с другими препаратами Н1-блокаторы применяются для предупреждения осложнений при переливании компонентов крови, проведении рентгеноконтрастного исследования.
- В предоперационный период антигистаминные препараты вместе с другими лекарствами назначаются пациентам с аллергической конституцией с целью предупреждения возникновения псевдоаллергических (либераторных) реакций и для лучшей переносимости хирургического стресса. Например, при полипотомии у больных с полипозной ринусинусопатией и сопутствующей бронхиальной астмой.
- Рассмотрим подробнее применение антигистаминов I поколения при атопическом дерматите. Следует помнить о мучительном зуде, который очень беспокоит пациентов, вследствие чего нет ни одного больного, который бы не применял данную группу препаратов. При зуде появляются расчесывания, которые могут повышать вероятность вторичного инфицирования. Зуд часто вызывает расстройства сна, нарушение адаптивных механизмов. Зуд по сути является эквивалентом боли, хотя полностью его механизм на сегодняшний день не изучен. Важен тот факт, что нервные окончания, воспринимающие зуд, содержат рецепторы, чувствительные к гистамину. Это является основанием для использования противогистаминных средств в лечении больных атопическим дерматитом.
Необходимо отметить многолетний опыт успешного применения этих средств и отсутствие альтернативных. Кроме того, антигистаминные препараты показаны при наличии сопутствующей респираторной аллергии.
Антигистаминные препараты II поколения также уменьшают кожный зуд. При исследовании фексофенадина (телфаста) показано угнетение как дневного, так и ночного зуда уже через 1 день после начала приема препарата по 60 мг 2 раза в сутки. Положительный эффект поддерживался в течение всего периода лечения. В случае сохранения кожного зуда даже в период ремиссии возможно сочетание препаратов I поколения, которые лучше принимать на ночь, со средствами последнего поколения, назначаемыми в дневное время.
При наличии аллергического заболевания очень важен совет грамотного врача, который поможет выбрать современный и безопасный антигистаминный препарат.
Ю. В. Сергеев, доктор медицинских наук, профессор
Т. П. Гусева
Институт аллергологии и клинической иммунологии, Москва
Для цитирования: Ревякина В.А. Современные аспекты терапии атопического дерматита у детей. РМЖ. 1999;11:516.
Среди аллергических заболеваний кожи у детей атопический дерматит (АД) занимает одно из ведущих мест. Распространенность этого заболевания, по данным эпидемиологических исследований, колеблется от 17-25% [1, 4]. Проблема АД чрезвычайно важна для педиатрии. Начинаясь в раннем детском возрасте, АД приобретает упорное, непрерывно-рецидивирующее течение, и наблюдается практически во всех возрастных периодах. Отмечена тенденция к формированию тяжелых, резистентных к терапии форм заболевания, снижению социальной адаптации и развитию инвалидизации ребенка [4].
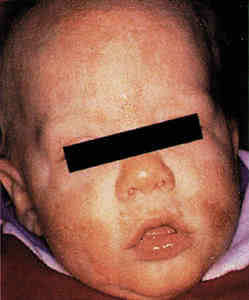
Дебют атопического дерматита.
Кожа является органом с многообразными функциями и сложными метаболическими процессами, обуславливающими связь внутренних органов с внешней средой, и выполняет важную роль в поддержании иммунного статуса организма. Согласно современным данным патогенетическую основу АД составляет аллергическое воспаление и гиперреактивность кожи, нарушающие естественную реакцию на воздействие различных внешних и внутренних факторов. Ключевую роль в механизмах развития АД играют IgE-опосредуемые реакции, обусловленные генетически детерминированной дисфункцией Т-лимфоцитов (хэлперов 2 типа) и рядом цитокинов, являющихся основными регуляторами синтеза иммуноглобулина Е [5, 6].
Развитие АД у детей тесно связано с воздействием различных аллергенов, причем у детей первых лет жизни ведущую роль играют пищевые аллергены (коровье молоко, яйцо, рыба, злаковые, овощи и фрукты оранжевой или красной окраски). С возрастом роль пищевой аллергии в развитии АД уменьшается и доминирующее значение приобретают такие ингаляционные аллергены, как домашняя пыль, пыльца растений, грибковые и эпидермальные аллергены.
Среди факторов, предрасполагающих к развитию АД у детей раннего возраста, следует отнести нарушение процессов пищеварения и всасывания из-за транзиторной ферментативной недостаточности, дискинезии билиарного и желудочно-кишечного тракта, перенесенного вирусного гепатита, нарушения микрофлоры кишечника, заражения гельминтами и простейшими (лямблиоз, энтеробиоз, описторхоз).
Современная терапия АД является патогенетической и включает проведение элиминационных мероприятий, медикаментозного лечения, наружной терапии, физиотерапии и санаторно-курортного лечения. Терапия должна быть строго индивидуальной, учитывать клиническую форму, стадию и период болезни, сопутствующие патологические состояния и осложнения.
Элиминационные мероприятия
Среди элиминационных мероприятий у детей раннего возраста ведущее место занимает исключение пищевых аллергенов с назначением специализированных диет, эффективность которых зависит от полноты выявления и исключения из рациона питания всех причинно-значимых продуктов [7]. Непременным условием является их замена равноценными по питательной ценности и калоражу пищевыми продуктами, обеспечивающими максимальное удовлетворение возрастных физиологических потребностей детей в основных пищевых веществах и энергии.
Специализированные диеты при АД обладают не только диагностическими и лечебными возможностями, но имеют определенную профилактическую направленность.
В начале обследования ребенка до получения результатов специфической диагностики используется эмпирическая диета. Она предусматривает исключение из питания подозреваемых (по данным анамнеза и клиническим проявлениям) пищевых аллергенов, а также продуктов, обладающих высокой аллергизирующей способностью (яйца, рыба, икра, морские продукты, грибы, орехи, мед, морковь, малина, клубника, черная и красная смородина, цитрусовые, шоколад, помидоры). Необходимым условием является также исключение мясных бульонов, острых и сильно соленых блюд, пряностей, маринадов, кофе, какао, консервированных продуктов. Затем устраняются из пищевого рациона вещества, выявленные в ходе специфического аллергологического обследования.
При развитии пищевой аллергии у ребенка, находящегося на естественном вскармливании, кормящей матери назначается специальная гипоаллергенная диета, предусматривающая исключение высокоаллергенных пищевых продуктов, а также продуктов, обладающих раздражающим действием на слизистую оболочку желудочно-кишечного тракта. Молочные продукты даются только в виде кисломолочных изделий, сметаны и неострого сыра. Гипоаллергенную диету кормящим матерям назначают на весь период кормления ребенка грудью [7]. Аналогичные диеты применяют у беременных женщин, страдающих аллергическими заболеваниями, особенно в течение последнего триместра беременности.
При аллергии к белкам коровьего молока назначают безмолочные диеты. У детей со слабо выраженной сенсибилизацией к этим белкам исключают цельное коровье молоко, пресные молочные смеси и творог. Таких детей переводят на такие адаптированные кисломолочные смеси, как (АГУ-1), (АГУ-2), ацидофильная смесь, (Бифилин) или гипоаллергенные смеси с частично гидролизованным белковым компонентом - (Хипп-ГА), (Хумана ГА), (Фрисопеп). У детей второго полугодия жизни можно назначать неадаптированные кисломолочные продукты - кефир, биокефир, (Биолакт), (Ацидолакт), а также продукты из сухого коровьего молока или молочных смесей, заквашенных специальными заквасками, содержащими бифидобактерии и ацидофильную палочку - (Наринэ), (Ацидофлора).
При выраженной аллергии к белкам коровьего молока (отсутствие положительной клинической динамики при использовании кисломолочных продуктов и выявленные высокие титры IgE или IgG антител к белкам коровьего молока) в качестве заменителя коровьего молока могут назначаться специализированные адаптированные смеси на основе изолята соевого белка, не содержащие молочного протеина и лактозы. К ним относятся - (Нутрилак-соя), (Хумана-СЛ), (Энфамил-соя), (Нутри-соя), (Бона-соя), (Фрисо-соя), (Хайнц-соевая смесь), (Туттели-соя).
Положительный эффект от применения соевых смесей наступает, как правило, через 3-4 нед от начала их использования и при обязательном исключении молочных, кисломолочных продуктов и творога.
При аллергии к белкам коровьего молока и сои, что наблюдается у 15-20% детей, назначают специализированные гипоаллергенные лечебные смеси, приготовленные на основе гидролизатов молочного белка с высокой степенью гидролиза - (Прегестимил), (Нутрамиген), (Алиментум, Пепти-Юниор), (Альфаре), (Пептиди-Туттели). Используют также гидролизаты белков молочной сыворотки с низкой степенью гидролиза белка - (Фрисо-пеп), (Хумна-ГА 1), (Хумана-ГА 2), (Хипп-ГА).
Элиминационные диеты не утрачивают своего значения и у детей старшего возраста. Успешное решение диетотерапии у детей старшего возраста во многом зависит от наличия специализированных продуктов, не уступающих элиминируемым [7]. Важным моментом при составлении диет у детей старшего возраста является исключение таких напитков, как газированные воды, жевательной резинки, которые нередко являются причиной обострения кожного процесса.
Среди других элиминационных мероприятий у детей с АД очень важное значение имеет уменьшение контакта с аллергенами жилищ, домашних животных, пыльцой растений.
Системная терапия
Полиорганность аллергических поражений при АД требует комплексного подхода к терапии этих детей, в связи с чем медикаментозное лечение предусматривает использование лекарственных средств, воздействующих на различные стороны патогенеза этого заболевания [8]. При назначении патогенетической и симптоматической терапии необходимо учитывать период заболевания: острый, подострый и ремиссию (см. схему).
Для купирования острых клинических проявлений АД назначают антигистаминные препараты. Они представлены группой медикаментозных средств, конкурирующих с гистамином на уровне Н1-рецепторов. Связываясь с Н1-рецепторами, эти препараты предупреждают или сводят к минимуму аллергические реакции, блокируя эффекты гистамина . К антигистаминным препаратам относятся средства первого (клемастин, хлоропирамин, ципрогептадин, диметинден, мебгидролин) и второго (терфенадин, астемизол, лоратадин, цетеризин, эбастин) поколения.
Эффективность антигистаминных препаратов первого поколения при лечении АД установлена давно. Их лечебное действие начинается быстро, в течение 15-20 мин, купируя острые проявления аллергии. Они обладают рядом побочных действий: седативным и холинергическим (сонливость, сухость слизистых оболочек, особенно в области глаз, задержка мочи, запоры, тахикардия).
Антигистаминные препараты второго поколения избирательно действуют на периферические Н1-рецепторы, обладают меньшей нейротоксичностью и седативным действием и в последние годы широко используются в терапии острого и подострого периодов АД.
В терапии АД применяются лекарственные средства, действие которых направлено на торможение секреции медиаторов аллергии - кетотифен и кромогликат натрия. Включение кетотифена в лечебный комплекс при АД уже с середины 2-й недели лечения приводит к улучшению общего состояния, аппетита, двигательной активности, уменьшению или исчезновению кожных высыпаний и ослаблению зуда. После 3-месячного применения положительный результат отмечается у большинства детей с экссудативным компонентом воспаления кожи. Длительное лечение кетотифеном - от 6 до 12 мес оправдано у детей с поливалентной аллергией и у больных с частыми обострениями болезни.
Кромогликат натрия - лекарственное средство, непосредственно и специфически воздействующее на слизистую оболочку желудочно-кишечного тракта, механизм действия которого направлен на стабилизацию мембран тучных клеток и предупреждение развития аллергических реакций на уровне слизистой оболочки пищеварительного тракта. Кромогликат натрия назначают прежде всего больным, имеющим гастроинтестинальные проявления пищевой аллергии, и тем, у которых не наблюдается положительного эффекта от проводимой диетотерапии и приема антигистаминных препаратов. Препарат используют, как правило, в подострый период заболевания и продолжают в фазе ремиссии болезни.
Интенсивный зуд, раздражительность, беспокойство, нарушение сна требуют применения препаратов, обладающих седативным эффектом. Некоторые антигистаминные (клемастин, хлоропирамин, диметинден, фенистил) и антисеротониновые (ципрогептадин) препараты обладают противозудным и седативным действием, в связи с чем они продолжают широко использоваться в терапии АД. В некоторых случаях показано применение транквилизаторов (оксазепам, диазепам) и нейролептиков (тиоридазин, хлорпромазин), антидепрессантов (имипрамин, амитриптилин), которые, снижая возбудимость и нормализуя сон, способствуют разрешению патологических изменений на коже. Однако их назначение требует строгих обоснований, учета прежде всего психического статуса больного.
Отчетливая связь между обострениями кожного процесса при АД и нарушениями функционального состояния органов пищеварения требует назначения препаратов, устраняющих гастроэнтерологические расстройства. С этой целью используют различные ферментные и желчегонные препараты, средства, нормализующие моторику желудочно-кишечного тракта. Дисбактериоз кишечника у детей первого года жизни является показанием для целенаправленного воздействия на микрофлору с селективным уничтожением патогенных бактерий и заселением кишечника недостающими представителями флоры (препаратами бифидумбактерий, лактобактерий, колибактерий). Весьма важно общее воздействие на микрофлору с целью создания таких условий в кишечнике, которые были бы неблагоприятны для нежелательных микроорганизмов и благоприятствовали заселению недостающими.
Оправдано использование в комплексной терапии АД витаминных препаратов (b-каротин, витамин А, Е, В6, аскорбиновая кислота), улучшающих межуточный обмен, способствующих повышению адаптационных возможностей организма. Однако применение комплексных поливитаминных препаратов может быть частой причиной обострений АД.
Одним из перспективных направлений терапии АД является фармакологическая коррекция нарушений иммунной системы с применением иммуномодулирующих препаратов, направленных на стимуляцию или угнетение функции клеток, участвующих в иммунном ответе.
Локальная терапия
Общую терапию АД следует проводить в сочетании с наружным лечением. Рациональное использование наружных лекарственных средств с учетом морфологии и стадии заболевания значительно повышает эффективность проводимого лечения и оказывает благоприятное влияние на регресс кожных проявлений аллергии. Используемые при этом лекарственные препараты оказывают не только местное, но и общее воздействие на организм через нервно-рецепторный аппарат, посредством всасывания их через кожу. Исчезновение или уменьшение с помощью местных лекарственных средств кожных проявлений аллергии, а также таких субъективных ощущений, как зуд, боль, жжение, положительно сказывается на общем и психоэмоциональном состоянии ребенка.
В острой стадии АД с явлениями гиперемии, отека, везикулезно-папулезных высыпаний, регионального лимфаденита следует назначать примочки из крепкого настоя чая, коры дуба, 1% раствора танина, 1-3% раствора резорцина, 1-2% водного раствора метиленовой сини, фукорцина (жидкости Кастеллани). Пиогенные высыпания целесообразно тушировать спиртовыми растворами анилиновых красок или с помощью аэрозолей с антибиотиками. На очаги поражения без явлений везикуляции и мокнутия используют кремы, пасты-мази, содержащие серу, деготь, нафталан, противозудные средства.
В настоящее время существует огромный арсенал кортикостероидных препаратов для наружной терапии АД [9, 10], различных по силе противовоспалительного действия. Среди них выделяют 4 класса препаратов (см. врезку). Несмотря на существующую (кортикофобию), местные кортикостероидные препараты продолжают занимать лидирующее положение в наружной терапии АД. В большинстве случаев их назначают тогда, когда традиционная наружная терапия не оказывает положительного эффекта.
Среди современных кортикостероидных препаратов наружного применения особого внимания заслуживают метилпреднизолона ацепонат и мометазон, обладающие выраженной активностью и высокой степенью безопасности. Данные препараты могут быть использованы у детей раннего возраста. Их применяют однократно в сутки, курс лечения составляет не более 14 дней. На современном этапе терапии АД местные кортикостероидные препараты назначают в острый период заболевания, длительностью 5-7 дней, как правило, 1 или 2 раза в сутки.
После купирования острых проявлений на коже применяют пасты или кремы на основе дегтя или нафталана. В ряде случаев для устранения кожного зуда используют мази или гели, содержащие антигистаминные средства (диметинден).
В период ремиссии заболевания применяют кремы, содержащие полиненасыщенные жирные кислоты, витамины, средства, блокирующие выделение медиаторов аллергии тучными клетками.
В комплексе лечебных мероприятий, направленных на оздоровление детей с АД, важное место принадлежит санаторно-курортному лечению. Для реабилитации детей с атопическим дерматитом показано пребывание как в санаториях местного климата, так и на морских курортах (Анапа, Сочи-Мацеста, Евпатория). У детей с хроническим течением АД, имеющих сопутствующую патологию со стороны органов пищеварения, показана реабилитация в санаториях гастроэнтерологического профиля (Пятигорск, Ессентуки, Минеральные Воды).
Залогом успешной терапии АД у детей является комплексное лечение, направленное на коррекцию различных звеньев этого заболевания, а также обеспечение систематического наблюдения у специалистов.
Литература
2. Dotterund L.K., Kvammen B., Boile R., Falk E.S. A survey of atopic diseases among school chidren in Sos-Varangar community: possible effects of subartic climate and industrial polution from Russia. Acta dermatol. Venerol. Scand. 1994; 74:124-8.
3.Neame R / Prevalence of atopic dermatitis in Leicester: a study of methodology and examination of possible ethnic variation. Br. J. of Dermatology 1995; 132: 772-7.
4. Балаболкин И.И. Современная концепция патогенеза и терапии атопического дерматита у детей. Сб. трудов Современные проблемы аллергологии, клинической иммунологии и иммунофармакологии. М., 1998; 113-9.
5. Олисова О.Ю. Значение иммунного статуса в диагностике атопического дерматита. Тез. докл. 7-го Рос. съезда дерматол. и венерол. Казань. 1996; ч.1: 57.
6. Chan S.C., Brown M.A., Willcox T.M., et al., Abnormal IL-4 gene expresion by atopic dermatitis T-lymphocytes is reflected in altered nuclear protein interactions with Il-4 transcriptional regulatory element, J.Invest. Dermatol. 1996; 106 (5): 1131-6.
7.Боровик Т.Э. Медико-биологические основы диетотерапии при пищевой непереносимости у детей раннего возраста: Автореф. дис. д-ра мед.наук. М. 1994.
8. Современные технологии реабилитации детей с аллергодерматозами (Практ. рук-во для врачей) / Под общ.ред. Л.Ф.Казначеевой. Новосибирск. 1999; 112 с.
10. Шахтмейстер И.Я., Шварц Г.Я. Новые лекарственные препараты в дерматологии. М., 1995; 5-21.
Гипоаллергенная питательная смесь на основе соевого белка:
Гипоаллергенная питательная смесь на основе соевого белка:
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

