Стволовые клетки кишечного эпителия это
Обновлено: 17.04.2024
Рак желудка (РЖ) является глобальной проблемой в здравоохранении. Несмотря на успехи в лечении, вследствие частого рецидивирования и метастазирования опухолей общий прогноз неблагоприятный [1]. Необходим поиск новых терапевтических подходов для улучшения клинических исходов РЖ. Модель раковых стволовых клеток (РСК) предложена для объяснения опухолевой гетерогенности, определяющей высокую частоту рецидивов и резистентность к системной терапии [2]. РСК идентифицированы во многих солидных злокачественных опухолях, включая РЖ. Воздействие на активное меньшинство РСК может увеличить эффективность терапии [3].
Опухолевая гетерогенность
Большинство опухолей имеет моноклональное происхождение, но к моменту обнаружения она состоит из генетически, эпигенетически и фенотипически гетерогенных клонов. Две основные концепции пытаются объяснить эту гетерогенность: гипотеза раковых стволовых клеток и модель клональной (стохастической) эволюции (рис. 1).
Модель клональной эволюции предполагает, что каждая опухолевая клетка обладает способностью инициировать образование опухоли. Прогрессия направляется редкими стохастическими событиями, происходящими во всех клетках. Клетки с мутациями, которые дают преимущество в росте, будут преобладать над остальными клетками опухоли и могут образовать новый клон, содержащий клетки различного фенотипа, имеющие различный пролиферативный потенциал [4–6].
Теория РСК, сформулированная в 1997 году [7], базируется на утверждении, что в структуре популяций опухолевых клеток существует четкая иерархия, на вершине которой находится популяция трансформированных клеток, имеющих сходные с нормальными стволовыми клетками свойства. РСК называют опухоль-инициирующими клетками (tumor-initiating cells, TIC) или опухоль-генерирующими клетками (tumor-propagating cells, TPC) [8,9]. Согласно концепции, популяция РСК:
- Составляет незначительную долю общей популяции клеток опухоли;
- Экспрессирует специфический набор поверхностных маркеров;
- Селективно поддерживает способность к онкогенезу в отличие от других популяций опухолевых клеток;
- Поддерживает рост гетерогенной массы, содержащей полный набор частично (или полностью) дифференцированных раковых клеток;
- Образует отдельный пул клеток, идентифицируемый биологическими и физико-химическими методами (по меньшей мере два пула клеток в опухоли: РСК и их производные — дифференцированные в разной степени клетки);
- Проявляет способность, подобно нормальным стволовым клеткам, к неограниченному самообновлению и дифференцировке по многим направлениям [9];
- Проявляет высокую устойчивость к стандартной терапии [2].
Рис. 1 | Модели опухолевой гетерогенности. А — эволюционная стохастическая модель; Б — иерархическая модель раковых стволовых клеток [5].
Самообновление желудочного эпителия и стволовые клетки желудка (СКЖ)
Строение слизистой оболочки желудка человека гистологически неоднородно. Принципиально отличают фундальные и антральные желудочные единицы [10]. Непрерывное клеточное обновление желудочного эпителия происходит за счет пролиферации и дифференцировки мультипотентных СКЖ, впервые обнаруженных в области перешейка желез. Эти недифференцированные клетки обладают двумя определяющими характеристиками. Во-первых, они способны длительно поддерживать свою популяцию (самообновление). Во-вторых, взрослые стволовые клетки являются источником всех клеточных линий желудочных единиц из-за асимметричных делений, ведущих к различным типам клеток-предшественников, которые пролиферируют (транзиторные амплифицирующиеся клетки) и дифференцируются в зрелые клетки (мультипотентность) [11]. В регуляции СКЖ участвуют следующие сигнальные пути: Wnt/[beta]-катенин (активация самоподдержания и ингибирование дифференцировки), киназа PI3K/Akt (рост, выживание и пролиферация клеток), трансформирующий фактор роста [beta] (TGF-[beta]) (ингибирующее влияние на пролиферацию клеток) и инсулиноподобный фактор роста 1. Ниша стволовых клеток образует сложную динамическую систему с нервной системой и сосудистым руслом [12].
Потомки стволовой клетки распространяются в двух направлениях (к просвету и к основанию железы) и образуют три основных клеточных линии с 11 типами клеток (рис. 2):
- Поверхностные (добавочные) мукоциты: прекурсоры поверхностных мукоцитов, поверхностные пре-мукоциты, зрелые поверхностные мукоциты (AAA лектин и TFF1);
- Главные клетки: прекурсоры шеечных мукоцитов, шеечные пре-мукоциты, зрелые шеечные мукоциты (GSII лектин и TFF2), предшественники зимогенных клеток и зрелые зимогенные клетки (внутренний фактор [GIF], пепсиноген, Mist1);
- Париетальные клетки: прекурсоры париетальных клеток, пре-париетальные клетки, париетальные клетки (H/K-АТФаза и VEGF).
Темпы обновления париетальных и зимогенных клеток ниже, чем остальных [13].
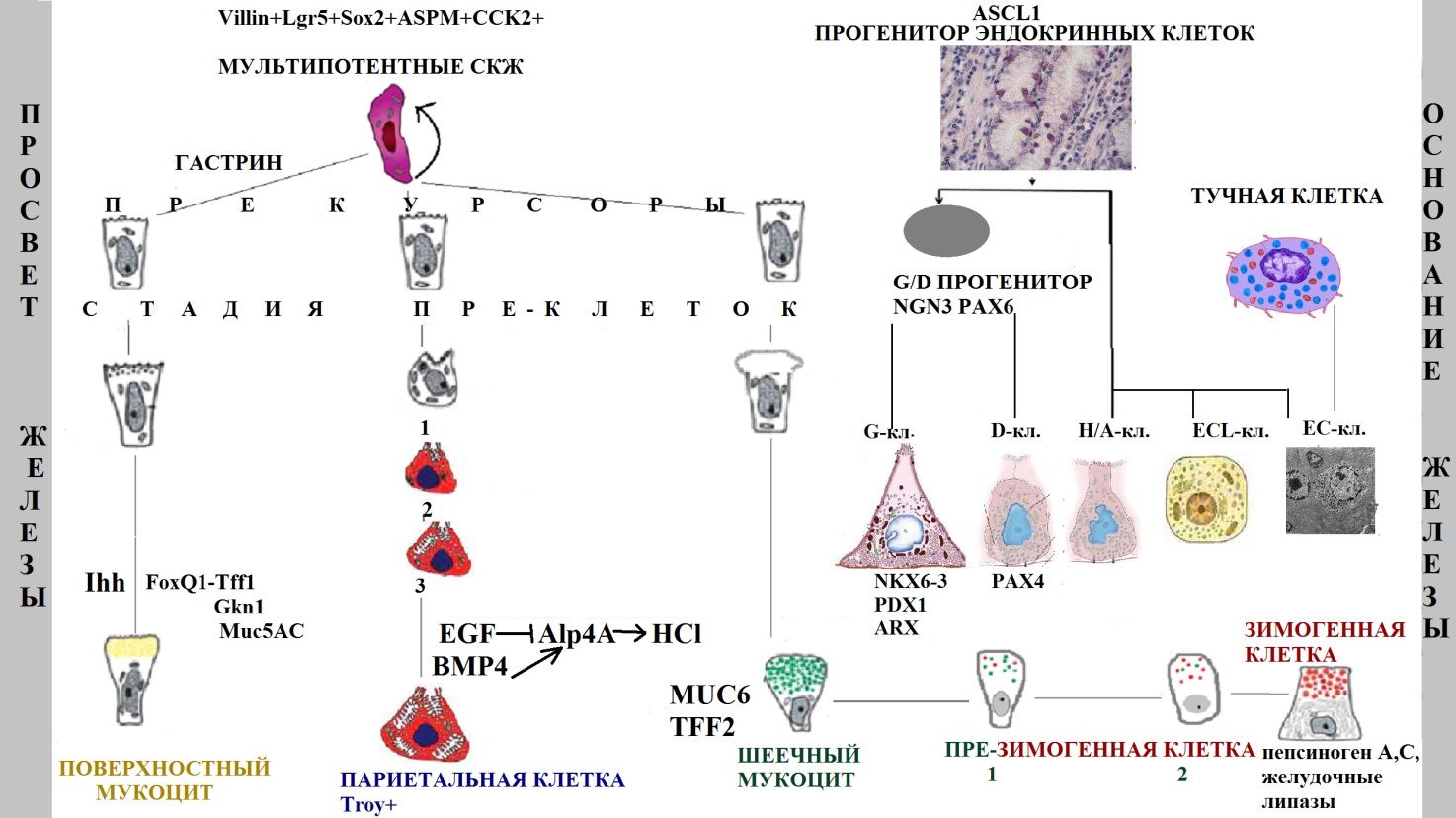
Рис. 2 | Схематическое изображение желудочной единицы человека и ее двунаправленного самообновления из мультипотентных стволовых клеток. Представлены стадии дифференцировки основных клеточных линий и некоторые из характерных секретируемых продуктов (предложена автором статьи на основе исследований [10,13,14,22]).
Также встречаются эндокринные клетки 5 основных типов: G-клетки (гастрин-продуцирующие), D-клетки (соматостатин-продуцирующие), энтерохромаффинные (EC) клетки (серотонин-продуцирующие), EC-подобные клетки (гистамин-продуцирующие) и X/A клетки (грелин-продуцирующие). В результате асимметричного деления мультипотентной СКЖ образуется эндокринный прогенитор (маркер Ascl1), под влиянием различных транскрипционных факторов подвергающийся коммитированию в определенную клеточную линию. Бипотентная клетка-предшественник D- и G-клеток экспрессирует маркеры NGN3 и PAX6. NKX6-3, PDX1 и ARX необходимые для ее дифференцировки в G-клетки, PAX4 требуется для продукции D-клеток. Интересно, что в теле желудка EC-клетки могут формироваться из неэпителиальных тучных клеток [14].
Молекулярные маркеры СКЖ обнаружены совсем недавно. Первым биомаркером стал виллин (Villin). Это специфичный для эпителиальных клеток кальций-регулируемый белок, модулирующий реорганизацию актиновых микрофиламентов. В отличие от активно пролиферирующих стволовых клеток перешейка, виллин-положительные СКЖ (V-СКЖ) находятся в состоянии покоя. Они расположены в нижней трети антральных желез [10].
Другая популяция СКЖ экспрессирует рецептор Lgr5, связывающий G-белок (Gpr49). Lgr5+ СКЖ (L-СКЖ) встречаются в основании фундальных и антральных желез в желудке эмбриона, но в постнатальном периоде ограничены антрумом. По аналогии с V-СКЖ, L-СКЖ также мультипотентны, но обладают высокой пролиферативной активностью [15]. Сосуществование активных и покоящихся стволовых клеток обнаружено в нескольких типах тканей. Считается, что активные стволовые клетки отвечают за физиологическое обновление ткани, а покоящиеся служат в качестве резерва, прежде всего, в случае травмы [16]. Особый интерес вызывает субпопуляция полностью коммитированных зимогенных клеток в основании фундальных желез, обладающих мультипотентностью. Эти клетки экспрессируют член суперсемейства рецепторов фактора некроза опухолей Troy. Troy+ клетки (Т-СКЖ) пролиферируют медленно и активируются после цитотоксического медикаментозного повреждения ткани [10].
Популяция СКЖ, экспрессирующая маркер Sox2 (S-СКЖ), рассеяна в перешейке фундальных и антральных желез, а также в их нижних частях. Они обладают мультипотентностью и имеют потенциал к самообновлению. Интересно, что S-СКЖ происходят из фетальных Sox2+ клеток-предшественников. S-СКЖ наиболее близки по характеристикам к СКЖ, первоначально обнаруженным в пролиферативной зоне перешейка [17].
Недавно была выделена новая популяция стволовых клеток (в позиции +4) в мышиной антральной железе с экспрессией рецептора к гастрину CCK2 (C-СКЖ). Они локализованы немного выше типичного расположения L-СКЖ. C-СКЖ способны подвергаться конверсии за счет гормонального триггера (обработка прогастрином, но не амидированным гастрином, приводит к переходу C-СКЖ в L-СКЖ) [18].
Важной проблемой является соотношение моноклонального происхождения желудочной единицы и факта неоднородности популяции стволовых клеток. Наиболее вероятной кажется конкурентная модель, которая предполагает достижение конкретной стволовой клеткой клонального доминирования [19]. СКЖ демонстрируют уникальную пластичность, перемещаясь в различных направлениях между стадиями мультипотентности и коммитированных прогениторов. Вероятным индуктором трансдифференцировки является Notch-сигналинг [20].
РСК в желудке
Поскольку РСК образуются из регионарных стволовых клеток [19], закономерно предположить связь СКЖ и РЖ. Для обнаружения предполагаемых маркеров РСК (табл. 1) были использованы два основных подхода. В первом использованы генетические манипуляции и трейсинг клеточных популяций РСК на мышиных моделях. Другой основан на изучении мышиных клеток из ксенотрансплантатов РЖ человека [21,22].
Таблица 1 | Обзор исследований иммуногистохимических маркеров РСК при РЖ.
Дифференциация стволовых клеток тонкой кишки - эмбриогенез, морфогенез
С момента публикации в 1974 г. фундаментального исследования, выполненного Cheng и Leblond, существует общепризнанное мнение, что крипты тонкой кишки содержат стволовые клетки, дающие начало четырем клеточным популяциям, присутствующим в эпителии тонкой кишки. Локализация пролиферирующих клеток ограничена криптами уже на ранних стадиях развития кишки.
Предполагается, что субпопуляция данных клеток образует локальное скопление, или компартмент стволовых клеток. В то же время крайне мало научных данных о ранних этапах формирования этих стволовых клеток. В исследованиях на грызунах использовали ионизирующее излучение с целью оценить регенеративные способности кишки. В результате было установлено, что стволовые клетки находятся на четыре клетки выше основания кишечной крипты, а их количество составляет от 3 до 5 в каждой из крипт.
Стволовые клетки формируют популяцию промежуточных клеток, которые, в свою очередь, после серии делений генерируют все остальные клеточные линии тонкой кишки. В исследовании Bjerknes и Cheng продемонстрировано, что кишечные крипты у мышей содержат популяцию короткоживущих клеток-предшественников (существующих в течение нескольких дней) и популяцию долгоживущих клеток-предшественников (существующих в течение нескольких месяцев), а также полипотентных стволовых клеток. В какой период эмбрионального развития возникают стволовые клетки тонкой кишки, точно не установлено.
У мышей, как и у человека, изначально поликлональные крипты становятся моноклональными. Таким образом, все образующиеся внутри крипты клетки происходят от одной стволовой клетки, причем механизмы данного феномена до настоящего времени полностью не установлены. По мере того как кишка увеличивается в размерах в процессе дальнейшего развития, возрастает количество крипт за счет их сегментации.
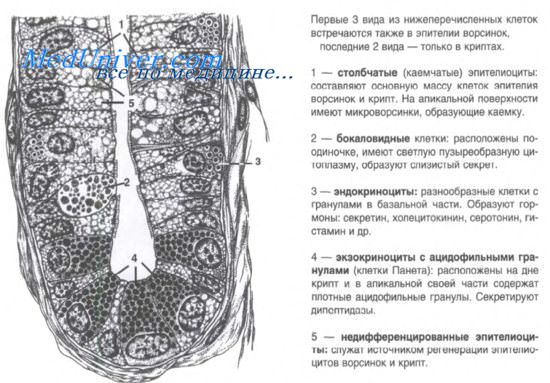
Клетки крипты тонкой кишки
По-видимому, это происходит вследствие достижения криптой определенных критических размеров, причем данный процесс имеет место и во взрослом организме, но протекает гораздо медленнее.
В течение последних лет значительный прогресс достигнут в понимании процессов регуляции функций стволовых клеток тонкой кишки и механизмов клеточной гибели. В ряде исследований предполагается, что полипотентные клетки из других тканей, в частности стромальные клетки костного мозга, могут участвовать в развитии эпителия тонкой кишки, однако при тщательном изучении установлена крайне редкая распространенность данного феномена.
Тем не менее действительно происходит ассимиляция клеток пересаженного костного мозга с популяцией фибробластов, расположенных по периферии крипт. Таким образом, существует вероятность, что трансплантированные клетки оказывают определенное влияние на клетки-предшественники или стволовые клетки кишки посредством эпителиально-мезенхимного взаимодействия.
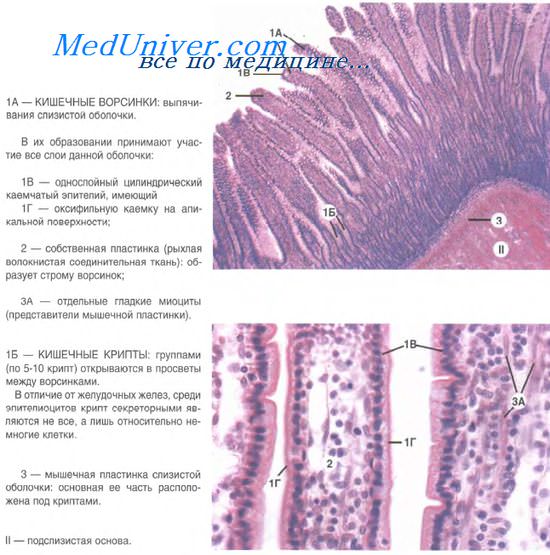
Гистология тонкой кишки
Формирование толстой кишки у плода - эмбриогенез, морфогенез
При иммуногистохимическом исследовании специфический для гладкомышечных клеток а-актин экспрессируется в мышечном слое кишки с 8 нед гестации и с 15 нед — в подслизистом слое. Столбчатые клетки эпителия толстой кишки, или столбчатые колоноциты, характеризуются наличием на апикальной поверхности микроворсин, сходных с таковыми на поверхности клеток тонкой кишки, а также большими запасами гликогена. Количество внутриклеточного гликогена, так же как и число гликогенсодержащих клеток, оцениваемое с помощью специальной PAS-окраски (окраска с использованием слабой кислоты и реактива Шиффа), прогрессивно снижается с 13 нед гестации.
В период с 30 до 36 нед гестации в толстой кишке плода обнаруживают единичные клетки, содержащие гликоген.
При возникновении злокачественной трансформации эпителия вновь происходит внутриклеточное накопление гликогена, которое является весьма характерным признаком клеточных популяций, полученных из аденокарцином толстой кишки человека.

Гистология толстой кишки
Arsenault и Menard изучали кинетику и топографию клеточной пролиферации в толстой кишке плода в период с 8 до 18 нед гестации. Клетки активно пролиферировали в многослойном эпителии.
При формировании ворсин меченые клетки присутствовали преимущественно в межворсинчатой зоне. На более поздних стадиях развития процесс пролиферации был ограничен только криптами. В эксперименте in vitro эпидермальный фактор роста, но не гидрокортизон нарушал процесс пролиферации клеток толстой кишки.
В период формирования ворсин эпителиальные клетки толстой кишки продуцируют маркеры дифференцировки, аналогичные обнаруживаемым в каемчатых энтероцитах тонкой кишки. Так, например, Lacroix и соавт. продемонстрировали, что в кишке плода в 8 нед гестации присутствует комплекс ферментов сахароза/изомальтаза.
В дальнейшем при становлении архитектоники ворсин в 11-12 нед содержание этого комплекса увеличивается 10-кратно и достигает максимума в 20-28 нед с последующим быстрым снижением к сроку родов, когда данные ферменты идентифицируются с большим трудом.
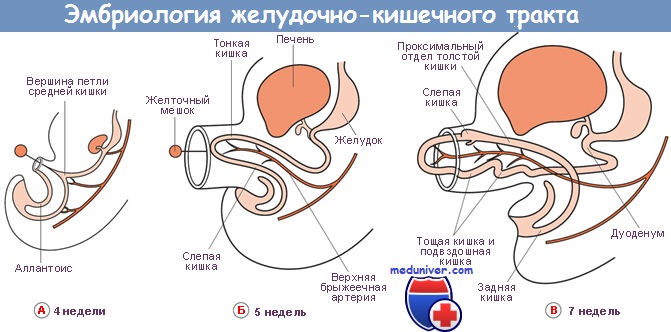
Стволовые клетки толстой кишки
Зрелые эпителиальные клетки толстой кишки постоянно замещаются за счет стволовых клеток, расположенных вблизи основания крипт толстой кишки. С этими и другими предполагаемыми стволовыми клетками ЖКТ связаны две основные проблемы — идентификация данных клеток и необходимость подтверждения, что выделенные клетки действительно являются стволовыми. В последнее время Whitehead и соавт. сообщили об определенных успехах в данном направлении: удалось разработать методику выделения и культивирования стволовых клеток толстой кишки человека.
Исследователи обнаружили, что клетки в нижних отделах крипты толстой кишки экспрессируют большое количество интегрина-b1, и впоследствии использовали данный признак с целью выделения потенциальных стволовых клеток с помощью метода проточной цитометрии.
При культивировании выделенных клеток с соблюдением ранее установленных условий данная популяция формировала большее количество колоний в сравнении с несортированным клеточным материалом. Однако выделение потенциальных стволовых клеток толстой кишки не было в дальнейшем изучено. Огромное количество регулирующих генов и растворимых факторов, контролирующих функцию стволовых клеток тонкой кишки, вероятно, оказывают подобное же влияние на стволовые клетки толстой кишки.
Например, исследование экспрессии мРНК in situ позволило установить наличие многочисленных идентичных компонентов сигнального пути WNT как в тонкой, так и в толстой кишке. Так же, как и для тонкой кишки, фактор Musashi может быть маркером стволовой клетки или клетки-предшественника в толстой кишке.
Учебное видео по развитию желудочно-кишечного тракта (эмбриогенезу)

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Микроокружение стволовых клеток тонкой кишки - ниша
Специфическое микроокружение, в котором постоянно находятся стволовые клетки, получило название «ниша». Данный термин обычно используют для определения пространственного положения стволовых клеток. Однако термин применяли и с целью обозначения других клеток, окружающих и поддерживающих функцию стволовых, а также соответствующих сигнальных механизмов. В костном мозге недавно была определена ниша гемопоэтических стволовых клеток.
Как оказалось, неподвижные гемопоэтические стволовые клетки фиксированы к остеобластам посредством N-кадгерина, одного из представителей суперсемейства молекул клеточной адгезии, обеспечивающих кальций-зависимое соединение клеток. Количество клеток, имеющих молекулы iV-кадгерина на своей поверхности, контролируется количеством гемопоэтических стволовых клеток.
В свою очередь, гемопоэтические стволовые клетки оказывают влияние на данные клетки посредством рецепторов к молекулам сигнального пути Notch. Стволовые клетки кишки являются предпочтительным объектом для исследования с того момента, как были установлены их точная локализация (в непосредственной близости от основания кишечной крипты) и регулирующее влияние сигнальных путей WNT и BMP на них.
Снижение пролиферативной активности вследствие делеции интегрина-b4 говорит об основной роли данного якорного, фиксирующего, белка в функции стволовых клеток кишечника. Влияние делеции факторов E2F4, Foxl1, Ihh и Nkx2.3 на пролиферативную активность клеток тонкой кишки свидетельствует о том, что все факторы способны регулировать процессы передачи сигналов в межклеточной кооперации со стволовыми клетками, что и представляет собой нишу стволовой клетки. В то же время механизм, посредством которого осуществляется взаимодействие указанных факторов и других, не установлен.
При отсутствии конкретного маркера трудно объяснить, каким образом в действительности регулируется уникальное местоположение стволовых клеток. Кроме того, блокирование обоих сигнальных путей — BMP и hedgehog — приводит к образованию эктопических крипт на поверхности ворсин, подвергая обоснованному сомнению концепцию постоянного фиксированного пространственного местоположения ниши стволовой клетки. Представленные данные свидетельствуют, что местоположение стволовой клетки определяется градиентом указанных ранее сигнальных факторов.
Еще многое предстоит изучить для того, чтобы идентифицировать и подробно описать стволовую клетку тонкой кишки. В будущем, вероятно, появится возможность выделения и использования стволовых клеток тонкой кишки с целью лечения, аналогично тому, как в настоящее время применяют гемопоэтические стволовые клетки. В данной связи интересны исследования, проводящиеся в настоящее время, в которых для лечения болезни Крона используют трансплантацию гемопоэтических стволовых клеток.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Разработанный в MIT метод позволяет выращивать
неограниченное количество стволовых клеток кишечника
Ученые из Массачусетского технологического института (Massachusetts Institute of Technology, MIT) и Женской больницы Бригема (Brigham and Women’s Hospital, BWH) научились выращивать неограниченные количества стволовых клеток кишечника, а затем направлять их развитие в различные зрелые типы, получая почти чистые популяции специализированных клеток. Выращенные новым методом клетки помогут фармацевтическим компаниям в разработке и тестировании новых лекарств для лечения таких заболеваний, как язвенный колит.

Стволовые клетки кишечника, выращенные в новых условиях,
экспрессирующие зеленый флуоресцентный белок. (Фото: MIT)
В тонком кишечнике, как и в большинстве других тканей организма, есть небольшой запас незрелых взрослых стволовых клеток, которые могут дифференцироваться в клетки более зрелых специализированных типов. Однако получение большого количества стволовых клеток кишечника – сложная задача, так как они остаются незрелыми только при контакте с так называемыми клетками Панета.
В статье, опубликованной в интернет-издании журнала Nature Methods (Yin et al., Niche-independent high-purity cultures of Lgr5 intestinal stem cells and their progeny), ученые сообщают о том, что им удалось заменить эффект присутствия клеток Панета действием двух низкомолекулярных соединений, поддерживающих недифференцированное состояние стволовых клеток и стимулирующих их пролиферацию. Выращенные в среде с содержанием этих молекул стволовые клетки могут оставаться незрелыми неопределенно долго, а добавляя другие молекулы, в том числе, ингибиторы и активаторы, ученые могут контролировать, какими типами клеток они, в конечном итоге, станут.
«Это открывает путь к достижению многих целей, начиная с будущего выращивания нового кишечника для пациентов с кишечными заболеваниями и заканчивая скринингом на безопасность и эффективность лекарственных препаратов. Это действительно сделано впервые», – говорит Роберт Лангер (Robert Langer), сотрудник Института интегративных исследований рака Коха (The David H. Koch Institute for Integrative Cancer Research) MIT, один из старших авторов статьи.
Внутренний слой кишечника выполняет несколько важных функций. Одни его клетки специализируются на поглощении питательных веществ из переваренной пищи; другие образуют секретирующий слизь барьер, предотвращающий проникновение в кровь вирусов и бактерий; третьи предупреждают иммунную систему о присутствии патогенов.
Этот слой, известный как эпителий кишечника, покрыт множеством крипт. В основании каждой крипты находится небольшой пул эпителиальных стволовых клеток, которые постоянно образуют специализированные клетки кишечного эпителия, живущие около пяти дней. Эти стволовые клетки могут стать любым типом клеток кишечного эпителия, но не обладают плюрипотентностью эмбриональных стволовых клеток, способных дифференцироваться в любую клетку организма.
Если ученые научатся получать большие количества стволовых клеток кишечного эпителия, их можно будет использовать для лечения желудочно-кишечных заболеваний, повреждающих эпителий. Недавние исследования на животных показали, что доставленные в кишечник стволовые клетки могут закрепляться в язвах и помогать восстановлению ткани – потенциальный способ лечения язвенного колита.
Использование стволовых клеток кишечника для получения больших популяций специализированных клеток принесло бы большую пользу и в разработке и тестировании лекарств, считают исследователи. Имея большие количества бокаловидных клеток, контролирующих иммунный ответ на белки пищи, ученые могли бы изучить пищевые аллергии; энтероэндокринные клетки, секретирующие гормоны голода, могли бы помочь в тестировании новых методов лечения ожирения.

Бокаловидные клетки (красные), дифференцированные из чистых стволовых клеток. (Фото: MIT)
«Если бы у нас были способы проведения высокопроизводительного скрининга большого количества этих очень специфических клеточных типов, мы могли бы определить новые мишени и разработать совершенно новые препараты для лечения широкого круга болезней – от воспалительных заболеваний кишечника до диабета», – говорит адъюнкт-профессор медицины Гарвардской медицинской школы (Harvard Medical School) и BWH Джеффри Карп (Jeffrey Karp), старший автор статьи.
В 2007 году Ганс Клеверс (Hans Clevers), профессор Института Хубрехта (Hubrecht Institute), Нидерланды, выявил маркер стволовых клеток кишечного эпителия – белок, Lgr5. Кроме того, доктор Клеверс, один из авторов статьи в Nature Methods, идентифицировал факторы роста, позволяющие этим стволовым клеткам размножаться и спонтанно дифференцироваться в зрелые клетки in vitro, образуя небольшие структуры, называемые органоидами, имитирующие естественную архитектуру выстилки кишечника.
В новом исследовании целью ученых было научиться получать максимально чистые популяции стволовых клеток кишечника, другими словами, выяснить, как поддерживать пролиферацию стволовых клеток, одновременно предотвращая их дифференциацию. Это нелегкая задача, потому что стволовые клетки кишечника начинают дифференцироваться, как только теряют контакт с клетками Панета.
Клетки Панета контролируют два сигнальных пути, известные как Notch и Wnt, координирующие пролиферацию клеток, особенно в период эмбрионального развития. Исследователи идентифицировали два низкомолекулярных соединения – вальпроевую кислоту (valproic acid) и CHIR-99021, – которые вместе индуцируют пролиферацию стволовых клеток и не допускают их дифференцировки.
Вырастив мышиные кишечные стволовые клетки в среде, содержащей эти две малые молекулы, исследователи получили большие кластеры, на 70-90 процентов состоящие из стволовых клеток. Получив почти чистые популяции стволовых клеток, они показали, что их можно «заставить» развиться в определенные типы клеток кишечника добавлением других факторов, влияющих на пути Wnt и Notch.
«Чтобы индуцировать дифференциацию стволовых клеток в специфические популяции зрелых клеток, мы использовали различные комбинации ингибиторов и активаторов», – объясняет ведущий автор статьи Сяолэй Инь (Xiaolei Yin), постдокторант Института Коха и BWH.

Клетки Панета (красные), дифференцированные из чистых стволовых клеток. (Фото: MIT)
Как установили исследователи, этот подход работает и на клетках желудка и толстой кишки мышей. Кроме того, малые молекулы стимулируют пролиферацию и человеческих стволовых клеток кишечника. В настоящее время ученые работают над созданием тканей кишечника для трансплантации пациентам и разработкой новых методов быстрой проверки влияния препаратов на его клетки.
Еще одна область использования этих клеток – изучение биологии, лежащей в основе уникальной способности стволовых клеток к самообновлению и дифференцировке в другие типы клеток, говорит Рамеш Шивдасани (Ramesh Shivdasani), адъюнкт-профессор медицины Гарвардской медицинской школы и Онкологического института Дана-Фарбера (Dana-Farber Cancer Institute).
«Мы очень многого не знаем о стволовых клетках», – продолжает Шивдасани, не принимавший участия в этом исследовании. «Не имея в своем распоряжении больших количеств этих клеток, очень трудно проводить какие-либо эксперименты. Они открывают путь к систематическому, точному, надежному способу изучения биологии стволовых клеток кишечника».
Читайте также:

