Стероидчувствительные дерматозы что это
Обновлено: 25.04.2024
В условиях современной действительности врачу на амбулаторном приеме в короткие сроки необходимо решать сложные задачи по точной диагностике заболеваний кожи и подбору специфической терапии. Некоторые воспалительные заболевания могут имитировать пролиферативные/опухолевые процессы, и наоборот. При этом чем реже встречается заболевание, тем больше риск ошибочного диагноза. В затруднительных случаях нередко приходится прибегать к диагностической биопсии. Не менее остро стоит вопрос о выборе лекарственных препаратов. Фармакологическая промышленность предлагает обилие лечебных и косметических средств, способствующих разрешению воспалительных процессов в коже. В статье приводится обзор современных достижений в области неинвазивной диагностики болезней кожи и обсуждаются актуальные вопросы подбора наружной терапии.
Возможности врачей-дерматологов по неинвазивной диагностике воспалительных и опухолевых заболеваний кожи существенно увеличились за счет внедрения таких методик, как дерматоскопия (эпилюминисцентная микроскопия), оптическая когерентная томография, ультразвуковое сканирование и конфокальная лазерная сканирующая микроскопия [1, 2]. Наиболее простым и доступным для практикующего специалиста является метод дерматоскопии, позволяющий оценивать изменения кожи при 10-кратном увеличении. Ценность и практическое значение дерматоскопии не только в диагностике опухолей кожи, но и в клинической дерматологии неоднократно подчеркивались профессором Ю.В. Сергеевым [3, 4]. В первую очередь осмотр пораженного участка кожи с увеличением позволяет определить структуру эпидермиса, сохранность придатков кожи (особенно волосяных фолликулов) и их функциональную активность. Не менее важным аспектом является возможность правильной оценки морфологических элементов формирующихся высыпаний, позволяющая поставить диагноз на начальном этапе заболевания, когда клиническая картина еще недостаточно выражена. Правильная интерпретация дерматоскопической картины существенно облегчает проведение различных лечебно-диагностических процедур (выявление специфических симптомов, выбор места для забора материала для цитологического или гистологического исследования и др.). Проведение фотодокументирования дерматоскопической картины высыпаний позволяет брать под тщательный контроль динамику лечебного процесса, оценивать регресс высыпаний или их резистентность к лечебным мероприятиям. Дополнительным перспективным направлением диагностики является возможность проведения телеконсультаций полученных изображений, однако этот аспект более активно развивается в отношении новообразований кожи [5]. Широкое применение дерматоскопии при различных неопухолевых дерматозах привело к формированию отдельных направлений в неинвазивной диагностике: инфламматоскопии (осмотр воспалительных заболеваний), трихоскопии (осмотр заболеваний волос и волосистой части головы), энтодерматоскопии (осмотр инфекционных заболеваний кожи) и капилляроскопии (осмотр капиллярного русла околоногтевых валиков при системных заболеваниях соединительной ткани) [6].
Для интерпретации дерматоскопической картины воспалительных заболеваний кожи предложен последовательный алгоритм, включающий:
- морфологическую оценку сосудистых структур;
- оценку распределения сосудистых структур в пределах высыпаний;
- оценку цвета определяемых структур;
- оценку сохранности волосяных фолликулов [7].
Как видно из предложенного алгоритма, основной акцент в дерматоскопической диагностике дерматозов делается на сосудистый компонент высыпаний. К сожалению, большое разнообразие морфологических типов сосудов, а также зависимость их правильного определения от степени давления контактной платы дерматоскопа на высыпания делают дерматоскопию воспалительных дерматозов менее специфичной по сравнению с осмотром новообразований кожи. Также необходимо понимать, что перечисленных характеристик может быть недостаточно для постановки диагноза и должны использоваться дополнительные, возможно более специфичные признаки.
Наиболее подробно описаны дерматоскопические проявления таких папуло-сквамозных дерматозов, как псориаз, экзема, красный плоский лишай и розовый лишай Жибера.
В некоторых случаях проведение клинической дифференциальной диагностики между этими нозологиями является затруднительной задачей и знание дерматоскопических проявлений этих заболеваний может помочь определиться с окончательным диагнозом. Отсутствие типичных дерматоскопических признаков перечисленных заболеваний может послужить поводом для проведения более углубленной диагностики, например гистологического исследования для исключения лимфопролиферативных заболеваний, нередко имеющих схожую с дерматозами клиническую картину.

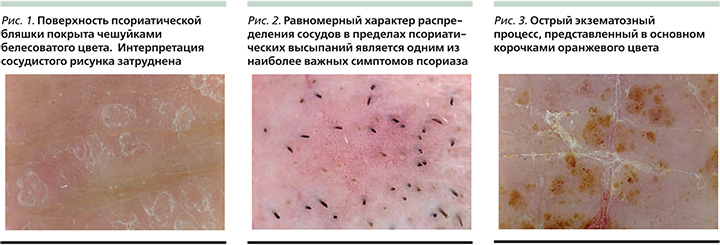
Дерматоскопическая картина псориатических высыпаний состоит из сочетания равномерно распределенных по очагу сосудистых структур и чешуек белесоватого цвета [6–10]. Для оценки сосудистого компонента требуется нанесение иммерсионной жидкости на поверхность высыпаний, учитывая выраженные гиперкератотические наслоения на поверхности папул и бляшек (рис. 1). В большинстве литературных источников преобладающий тип сосудистого рисунка указывается как точечный, однако использование техники с бóльшим увеличением позволяет однозначно трактовать сосудистый рисунок в пределах псориатических высыпаний как сосуды в виде шпильки (рис. 2). Акцент в трактовке сосудистого рисунка смещается в сторону равномерного распределения сосудов в пределах высыпаний, что является одним из наиболее специфичных дерматоскопических признаков этого заболевания. Осмотр высыпаний в процессе вы.
Роль формы топического глюкокортикостероида в достижении оптимального эффекта терапии стероидчувствительных дерматозов
Журнал: Клиническая дерматология и венерология. 2012;10(4): 82‑85
Корсунская И.М., Дворянкова Е.В. Роль формы топического глюкокортикостероида в достижении оптимального эффекта терапии стероидчувствительных дерматозов. Клиническая дерматология и венерология. 2012;10(4):82‑85.
Korsunskaia IM, Dvoriankova EV. Role of topical corticosteroid formulation in achieving the optimal effect of therapy for steroid-responsive dermatoses. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(4):82‑85. (In Russ.).
Количество дерматозов с аллергическим компонентом имеет тенденцию к увеличению в среднем на 5% в год. Большая часть пациентов страдает атопическим дерматитом, экземой, аллергическим дерматитом. Без рационального лечения, основанного на принципах доказательной медицины, эти болезни могут принимать тяжелое рецидивирующее или персистирующее течение, сопровождая человека всю жизнь. При лечении пациентов с перечисленной патологией ключевую роль играют топические кортикостероиды, следовательно, всю группу заболеваний можно назвать стероидчувствительными дерматозами. Эффективность глюкокортикостероидов для местного применения при описанных дерматозах доказана многолетней практикой и результатами многочисленных контролируемых исследований.

Эффективность применения того или иного топического стероида зависит от активности действующего вещества, а также свойств его основы: сбалансированности водной и жировой фаз и комбинации ингредиентов. Топические глюкокортикостероиды в зависимости от химической формулы обладают разной степенью активности. Галогенизированные кортикостероиды, содержащие фтор и/или хлор, обладают сильным действием, но также и повышенным риском побочных реакций. Негалогенизированные кортикостероиды, относящиеся к классу сильных, сочетают высокую эффективность с ничтожным риском нежелательных явлений (см. таблицу).
Выбор формы препарата определяется в зависимости от стадии течения заболевания и состояния кожных покровов. Максимальное число форм обеспечивает наиболее верный выбор для оптимального эффекта при любых проявлениях стероидчувствительных дерматозов.
От грамотного подбора формы и качества основы зависят скорость и величина абсорбции активного компонента. Кроме того, сама основа способна оказывать очищающий, защитный, ожиривающий, увлажняющий, подсушивающий и обезболивающий, вяжущий, бактериостатический, противозудный эффекты.
Топические кортикостероиды в России представлены в формах лосьона, геля, эмульсии, крема, мази, жирной мази.
Лосьон — смесь двух или более жидкостей, полностью растворимых одна в другой, содержат обычно этиловый спирт и глицерин. При наличии в составе лосьона растительных масел и эмульгаторов, он, по сути, является эмульсией. Лосьоны оказывают противовоспалительное действие в первую очередь на участках кожи с повышенным оволосением, на волосистой части головы. Они легко наносятся, но могут растекаться и пересушивать кожу из-за наличия спирта.
Гель (желе) — форма с жидкой дисперсной средой, в которой дисперсионные фазы образуют пространственную структурную сетку. Представляют собой студенистую массу, способную сохранять форму, обладающую упругостью, эластичностью и пластичностью. Гели с водной дисперсной средой называются гидрогелями. Гидрогели действуют преимущественно поверхностно, хорошо охлаждают кожу, уменьшают воспаление и зуд, но не проникают в глубокие слои кожи.
Крем/эмульсия — мягкие или жидкие лекарственные формы, в основе которых лежит двухфазная система, состоящая из двух несмешиваемых компонентов жира и воды. Благодаря большому содержанию жидкой фазы, которая испаряется с поверхности кожи, крем и эмульсия вызывают выраженное сужение кровеносных сосудов, обеспечивая дополнительный охлаждающий эффект. Эмульсии содержат повышенное содержание воды, что обеспечивает дополнительную мягкость основе, способствуя повышенному испарению жидкости, в том числе с мокнущих поверхностей.
Мазь — наиболее часто применяемая в дерматологии лекарственная форма, основу которой составляют жиры. Механизм действия мазей основывается на свойстве жира препятствовать испарению и уменьшать теплоотдачу. Снижение теплоотдачи обусловливает согревание участка кожи, рефлекторное расширение сосудов, т.е. усиление воспаления, и вследствие этого интенсификацию обменных процессов, что вызывает разрешение воспалительных инфильтратов.
Мази следует применять при хроническом воспалении кожи, сопровождающемся застойной гиперемией, шелушением, инфильтрацией. Для дополнительного кератопластического и рассасывающего эффектов при лихенификации и гиперкератозе необходимо окклюзионное действие, обеспечиваемое жирной мазью с отсутствием воды в основе.

При ярком остром болезненном воспалении, сопровождающемся повреждением целостности кожного покрова (везикулы, эрозии, мацерация), наиболее целесообразным и эффективным будет применение топических кортикостероидов в форме эмульсии. Эмульсии легко наносятся, особенно на поврежденную кожу, обладают подсушивающим и охлаждающим свойствами, что усиливает противовоспалительный и противоаллергический эффект основного действующего вещества — кортикостероида. Так, эмульсия Адвантан (метилпреднизолона ацепонат 0,1%) обладает указанными свойствами, а также оказывает дезинфицирующее действие, которое обеспечивают полиоксиэтилен-стеариловые спирты, и дерматопротективный эффект, обусловленный наличием в основе глицерола [6]. Эмульсию Адвантан можно использовать при острых дерматозах, сопровождающихся нарушением целостности кожного покрова, до полного излечения благодаря входящему в основу софтизану, способствующему восстановлению гидролипидной мантии кожи [7, 8] (рис. 1). Рисунок 1. Схематическое изображение яркого болезненного/острого воспаления. Эрозии, корочки, папулы, розово-красная эритема, отек. Расширенные сосуды дермы.

При остром воспалении обоснованным является применение топических кортикостероидов в виде крема. Крем Адвантан обладает выраженным противовоспалительным действием, которое, так же как и в эмульсии, потенцируется благодаря особенностям состава основы: цетостеариловый спирт способствует синтезу жиров клеточных мембран, децилолеат улучшает текстуру и пластичность препарата, смягчая поверхность кожи (рис. 2). Рисунок 2. Схематическое изображение острого/подострого воспаления. Розово-красные папулы и эритема, отек. Расширенные сосуды и единичные инфильтративные элементы в дерме.

При хроническом воспалении, когда необходимы дополнительное смягчение и увлажнение сухой кожи, требуются мазевые лекарственные формы топических кортикостероидов. Мазь Адвантан обеспечивает быстрый эффект, а также смягчающее, защитное и ранозаживляющее дествие за счет жидкого парафина и белого пчелиного воска [2, 8, 9] (рис. 3). Рисунок 3. Схематическое изображение хронического воспаления. Шелушение, синюшно-красная эритема и папулы, инфильтрация. Инфильтративные элементы и соединительнотканные волокна в дерме.

Длительное хроническое воспаление, сопровождающееся выраженным гиперкератозом, инфильтрацией, лихенизацией, требует применения топического кортикостероида, обладающего окклюзионными свойствами. Адвантан способствует быстрому сокращению воспаления, а безводная основа жирной мази смягчает кожу и восстанавливает естественный уровень увлажненности благодаря касторовому гидрогенизированному маслу, а также с помощью микрокристаллического воска создает на коже прочную защитную пленку (рис. 4). Рисунок 4. Схематическое изображение длительного хронического воспаления. Обильное шелушение, трещины, утолщенный роговой слой, синюшно-красная эритема и папулы, инфильтрация, лихенизация. Множественные инфильтративные элементы и соединительнотканные волокна в дерме.
Таким образом, особенности основ топических кортикостероидов определяют ряд важных свойств: стабильность, гипоаллергенность, увлажнение, защита и восстановление кожи. Однако некоторые ингредиенты основ могут способствовать возникновению в индивидуальных случаях непредвиденных нежелательных реакций. Так, например, диоксид титана может вызывать или усиливать гиперемию и другие проявления аллергических реакций на коже. Фосфорная кислота, особенно в высоких концентрациях, при наличии индивидуальной чувствительности может вызывать повреждения кожи. Хлорокрезол, ланолин и гидроксибензоаты являются аллергенами, способными провоцировать аллергический дерматит [3, 4, 10—12].
Верный выбор лекарственной формы топического стероида при разных клинических вариантах стероидчувствительных дерматозов обеспечивает индивидуальный подход с оптимальной эффективностью терапии.
Последнее время дерматологами часто используется термин «стероидчувствительные дерматозы» (СЧД), который подразумевает обширную группу разнообразных кожных заболеваний, при которых глюкокортикостероидные препараты обладают клинической эффективностью, часто выступают в качестве препаратов первой линии, а иногда являются единственным решением терапевтической проблемы в конкретном случае. Чаще всего кортикостероиды при СЧД применяются в виде наружных средств, однако при тяжело протекающих дерматозах необходимой становится системная стероидная терапия, являясь подчас единственной эффективной, и по показаниям может быть квалифицирована как терапия неотложных состояний.
- КЛЮЧЕВЫЕ СЛОВА: Дипроспан, дерматоз, бетаметазон
Последнее время дерматологами часто используется термин «стероидчувствительные дерматозы» (СЧД), который подразумевает обширную группу разнообразных кожных заболеваний, при которых глюкокортикостероидные препараты обладают клинической эффективностью, часто выступают в качестве препаратов первой линии, а иногда являются единственным решением терапевтической проблемы в конкретном случае. Чаще всего кортикостероиды при СЧД применяются в виде наружных средств, однако при тяжело протекающих дерматозах необходимой становится системная стероидная терапия, являясь подчас единственной эффективной, и по показаниям может быть квалифицирована как терапия неотложных состояний.
Известно, что системная глюкокортикоидная терапия обладает рядом как серьезных побочных эффектов, так и противопоказаний при наличии сопутствующих заболеваний, что может ограничивать их применение или вовсе делать его невозможным в отдельных случаях. Кроме того, схема применения оральных кортикостероидов при завершении терапии предполагает постепенное, иногда длительное снижение дозировок, что резко ухудшает комплаентность лечения. Полезной альтернативой этому представляются дюрантные препараты, среди которых заслуженной популярностью пользуется парентеральный комбинированный стероид Дипроспан, обладающий таким пролонгированным действием и свободный от ряда побочных эффектов, свойственных в частности оральным стероидам.
Дипроспан содержит 2 мг бетаметазона динатрия фосфата и 5 мг бетаметазона дипропионата. Первый компонент, будучи легкорастворимым, обеспечивает быстрое всасывание активного вещества (пиковая концентрация в крови достигается уже через несколько минут после введения препарата), и клинический эффект его проявляется в первые же часы от начала лечения. Второй компонент, обладающий более медленной абсорбцией, создает условия для пролонгированного действия комбинированного стероида в организме: на 10-й день после инъекции с мочой выводится 40% введенной дозы, а на 19-й день – 51,9%. За счет высокой дисперсности суспензии, округлости формы частиц и малой величины кристаллов солей препарата Дипроспан не оказывает повреждающего воздействия на ткани при производстве инъекции и не требует применения анестетика.
Метааналитическая оценка результатов многочисленных международных многоцентровых клинических исследований прошлых лет по изучению эффективности Дипроспана у больных аллергическими и ревматическими заболеваниями обнаруживает у него целый ряд достоинств. Так, при внутримышечном применении Дипроспана средняя продолжительность наступившего улучшения в состоянии больных составила 20 дней; общий противовоспалительный эффект в 51,5% случаев был отличный, в 37,6% – хороший и в 10,9% – умеренный. Была констатирована высокая эффективность препарата при аллергических заболеваниях, дисгидротической экземе и атопическом дерматите, не поддающихся лечению другими кортикостероидами. Кроме того, было показано, что эффективность Дипроспана заметно выше ряда других системных стероидов, в частности триамцинолона ацетонида. При этом коэффициент безопасности, представляющий собой отношение дозы, вызывающей синдром Кушинга, к дозе, обладающей противовоспалительным действием, составляет у Дипроспана 2,6. Для сравнения коэффициенты дексаметазона, триамцинолона, преднизолона и гидрокортизона были 2,3, 1,6, 1,4 и 1,3 соответственно, что с очевидностью указывает на более высокую безопасность Дипроспана по сравнению с другими кортикостероидами (1, 2).
Основными показаниями к применению Дипроспана являются острые и упорные хронические иммунозависимые состояния, требующие применения кортикостероидов вообще. Среди дерматологических заболеваний сюда относятся аллергический и атопический дерматиты, острые и распространенные экземы, псориаз, особенно эритродермический вариант, псориатический артрит, гнездная плешивость, красная волчанка, гипертрофический плоский лишай, акантолитическая пузырчатка и др. Отдельного внимания заслуживают тяжелые острые дерматологические состояния в виде обширных мокнущих и отечно-воспалительных процессов или универсальных эритродермий с выраженными общими симптомами интоксикаций, которые требуют фактически экстренных терапевтических противовоспалительных мероприятий, среди которых Дипроспан с его быстрым и мощным курирующим эффектом и становится препаратом первой линии.
Дозы Дипроспана в каждом конкретном случае зависят от выраженности воспалительных симптомов дерматоза, его тяжести и массы тела больного. Обычно применяют 1-2 мл в/м с интервалом 10-15 дней в большинстве случаев на курс 2-3 инъекции. Побочные эффекты препарата, будучи общими для всех кортикостероидов, как правило, мало выражены и могут возникать лишь при его нерациональном применении: длительная непрерывная терапия, повышенные дозы и др. Противопоказания для применения Дипроспана также идентичны другим кортикостероидам: туберкулез, остеопороз, сахарный диабет, язва желудка, инфекции кожи; не рекомендуется назначать препарат при беременности и во время лактации.
Более десяти лет назад в отечественной литературе стали появляться работы, показавших высокую эффективность Дипроспана при различных СЧД в случаях их тяжелого, затяжного течении (2).
Согласно результатам этих и других исследований, Дипроспан обладает высокой безопасностью, в том числе и в детском возрасте, он оказался весьма пригодным для применения в амбулаторной практике и признан как полезная альтернатива не только оральной стероидной терапии, но и эффективным при внутриочаговом введении (3). Кроме того, Дипроспан относится к препаратам первого выбора при острых, тяжелых и распространенных аллергодерматозах, демонстрируя свои возможности в качестве ургентной терапии (6).
Как известно, атопический дерматит (АД) встречается с частотой до 5-8% в популяции и преимущественно у детей и людей молодого работоспособного возраста.
В основе патогенеза АД лежит генетическая предрасположенность к заболеванию в виде фенотипических особенностей функционирования иммунной системы, характеризующихся гиперактивным состоянием Т-хелперов и в острых фазах заболевания с доминированием цитокинового профиля второго типа. Именно эти основные особенности патогенеза АД и объясняют эффективность иммуносупрессивной терапии как в виде наружных кортикостероидов, так и системных, применяемых в особо тяжелых случаях. Именно при островоспалительных и генерализованных формах АД и находит применение Дипроспан в виде скоропомощной этапной терапии, позволяющей быстро вывести больного из критического состояния с последующим переходом на другие виды лечения.
Как показывают наблюдения прошлых лет, Дипроспан при АД назначают в дозе 1-2 мл в/м 1 раз в 7-12 дней в зависимости от выраженности воспалительных процессов в коже и зуда. На курс лечения приходится как правило от 1 до 3 инъекций. Обычно на 2-3 день после первой инъекции значительно уменьшается зуд и заметно стихают островоспалительные явления. По данным большинства работ, практически у всех больных лечение с применением Дипроспана к концу курса приводило к значительному улучшению или клинической ремиссии и повышению качества жизни пациентов (1).
В одной из наших последних подборок под наблюдением находилось 35 больных АД в возрасте от 19 лет до 35 лет, среди которых был 21 мужчина и 14 женщин в возрасте от 20 до 32 лет. У всех больных клиническая картина АД характеризовалась особо выраженными воспалительными явлениями, распространенностью кожного процесса, сильным зудом и упорством к различным видам обычной терапии. При формировании группы наблюдения принципиальным критерием отнесения больного к такой тяжелой, распространенной форме дерматоза служил показатель Дерматологического индекса шкалы симптомов (ДИШС) не ниже 19 или не менее 70% от максимально возможного показателя ДИШС (максимум ДИШС – 27). Разовая доза для в/м введения препарата в 2,0 мл применялась у 27 больных и 1,0 мл – еще у 8 больных, имевших массу тела менее 60 кг. Количество инъекций на курс составило: 1 инъекция у 6 больных, 2 – у 23 и 3 инъекции у 6 больных. Введение препарата проводили с интервалом в 10-14 дней, в зависимости от показаний. У всех больных лечение переносилось без побочных явлений.
1. Кочергин Н.Г., Константинова В.А. Опыт применения Дипроспана при аллергодерматозах. Российский журнал кожных и венерических болезней. 1998. № 1. С. 25-27.
2. Кочергин Н.Г. Основные аспекты патогенеза, клиники и современной терапии атопического дерматита. Докт. дисс., 2001.
3. Belousova T., Tepljuk N., Kochergin N. Intralesional Betamethasone in granuloma faciale. Ann.Dermat.Venereol. juillet 2002. Cahier2. P. 1S691.
5. Kimball A.B., Gladman D., Gelfand J.M. et al. National Psoriasis Foundation clinical consensus on psoriasis comorbidities and recommendations for screening. J. Am. Acad.Drmatol. 2008. V. 58. P. 1031-1042.
6. Kochergin N.G., Belousova T.A., Novoselov B.S. Betamethasone efficacy in dermatoses. Clinical Dermatology 2000. Abstracts. Singapore. 1998. P. 141.
Представлены результаты клинического мониторирования эффективности и безопасности терапии больных атопическим дерматитом взрослых с использованием различных лекарственных форм метилпреднизолона ацепоната. Показана рациональность дифференцированного назнач
Tactics of topical therapy of patients with atopic dermatitis using various dosage forms of topical glucocorticosteroid N. V. Kungurov, M. M. Kokhan, Yu. V. Keniksfest, E. I. Stukova, N. P. Toropova
The results of clinical monitoring of the effectiveness and safety of therapy in adult patients with atopic dermatitis using various dosage forms of methylprednisolone aceponate are presented. The rationality of differentiated prescription of dosage forms of methylprednisolone aceponate in the localization of skin manifestation in the problem areas, on the skin of the torso and limbs, and according to the clinical manifestations is shown. The safety of the drug methylprednisolone aceponate in the treatment of patients with atopic dermatitis, the absence of side effects in the treatment at the specified time was confirmed.
До настоящего времени широкая распространенность атопического дерматита (АтД) фиксируется в развитых странах, в том числе и в Российской Федерации, а проблема эффективной и безопасной наружной терапии заболевания находится в фокусе внимания практических специалистов дерматовенерологов [1–3]. АтД — это мультифакториальное воспалительное заболевание кожи, возникающее, как правило, в раннем детском возрасте у лиц с наследственной предрасположенностью к атопическим заболеваниям, имеющее хроническое рецидивирующее течение, возрастные особенности локализации и морфологии очагов воспаления, характеризующееся кожным зудом и обусловленное гиперчувствительностью как к аллергенам, так и к неспецифическим раздражителям [3–5].
Актуальные подходы к терапии больных АтД определены в отечественных [4] и зарубежных [5–7] клинических рекомендациях и включают следующие основные направления:
- профилактические стратегии (элиминационные меропрятия);
- гипоаллергенная диета;
- рациональный уход за кожей (умывание и купание, увлажнение);
- топическая, наружная терапия;
- противозудная терапия (топическая и системная);
- иммуносупрессивная терапия (системные глюкокортикостероиды (ГКС), иммунодепрессанты, в том числе генно-инженерные биологические препараты);
- противоинфекционная терапия (антибиотики, антимикотики, противовирусные препараты);
- фототерапия;
- аллерген-специфическая иммунотерапия;
- образовательные программы для детей, членов их семей и для взрослых пациентов.
Крайне важным из указанных направлений ведения больных АтД признается наружная противовоспалительная терапия, «первой линией» которой остаются топические глюкокортикостероидные (ТГКС) препараты, применяемые для купирования воспалительных проявлений АтД у детей и взрослых [4, 5, 8]. Среди современных ТГКС-препаратов последнего поколения присутствует метилпреднизолона ацепонат (МПА) (Адвантан®) — негалогенизированный топический глюкокортикостероид, относящийся к классу сильных ТГКС. Доказана высокая эффективность противовоспалительного действия МПА, особые механизмы которого заключаются в активации пролекарства в очаге воспаления за счет ферментов — эстераз; высокой скорости проникновения в кожу и быстром начале действия, благодаря высокой липофильности и сродству к рецепторам клеток — эффекторов воспаления. Активность МПА в составе Адвантана определяется количеством эстераз, таким образом кожа может сама регулировать необходимое количество МПП в зависисмости от выраженности воспаления. Важным фактором является, что механизм биоактивации, равно как и данные по безопасности и эффективности молекулы были исследованы только для МПА в составе Адвантана. Добавление дополнительных компонентов к молекуле Адвантана не изучалось с точки зрения эффективности препарата. МПА имеет дальнейшее минимизированное проникновение (0,27–2,5%) в кровь и полную быструю инактивацию за счет связывания с глюкуроновой кислотой, благодаря компактности молекулы [9, 10].
Особые фармакологические свойства МПА определяют высокую степень противовоспалительного действия препарата, что сочетается с минимальными нежелательными явлениями. Проведены исследования по сравнительному анализу комплекса клинических и лабораторных данных различных ТГКС: эффективности — по балльной оценке степени вазоконстрикции, сравнительной эффективности ТГКС при АтД; а также степени выраженности нежелательных явлений — по возможному развитию атрофии кожи, влиянию на системный баланс ГКС, аллергическому потенциалу. Соотношение указанных «про» и «контра» факторов исчисляется как «терапевтический индекс» (ТИ, Therapeutic index — TI) ТГКС. Установлено, что МПА имеет один из самых высоких терапевтических индексов (TI 2,0), в сравнении с ТГКС более ранних генераций [11, 12].
В работе, представленной Европейским дерматологическим форумом и посвященной применению топических глюкокортикостероидов у беременных, подтверждаются данные об эффективности и безопасности МПА 0,1%, подчеркивается целесообразность однократного в течение суток применения наружной гормональной терапии [13]. В недавнем обзоре А. Torrelo [14] анализируются данные нескольких клинических исследований МПА 0,1% при АтД, автор обоснованно указывает, что применение МПА 0,1% у младенцев и детей демонстрирует минимальные местные или системные побочные эффекты, даже при частых обострениях процесса и нанесении препарата на обширные участки кожи.
Уникальным для МПА (препарат Адвантан) является факт наличия четырех лекарственных форм препарата, содержащих 0,1% МПА, — эмульсии, крема, мази и жирной мази. В перечисленных лекарственных формах препарата Адвантан введено различное содержание воды: в эмульсии — 67,5%, в креме — 60% («масло в воде»), в мази — 30% («вода в масле»), а жирная мазь практически не содержит воды, при этом снижение содержания воды увеличивает липофильные свойства препарата и способствует скорости проникновения в эпидермис.
Отечественный опыт использования препарата Адвантан в клинической практике значителен и свидетельствует о высокой эффективности данного ТГКС, однако тактические вопросы дифференцированного назначения различных лекарственных форм МПА 0,1%, в зависимости от клинико-морфологических особенностей кожного процесса при АтД остаются до конца неизученными [15–17].
В клинике ГБУ СО «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии» осуществлена наблюдательная программа контроля эффективности и безопасности МПА 0,1% (эмульсия, крем, мазь, жирная мазь) в терапии больных АтД.
Все пациенты (n = 25) были проинформированы о необходимости соблюдения гипоаллергенного режима и диеты, получали стандартную системную терапию в соответствии с тяжестью кожного процесса, при этом исключалось введение системных глюкокортикостероидных гормонов, иммуносупрессивных средств, других ТГКС. Лечение проводилось в стационарном и амбулаторном режимах.
Определение тяжести процесса до начала и в динамике лечения проводилось с использованием индекса EASI (Eczema area and severity index) [18]. Индекс EASI определялся по общепринятой методике, где врачом проводилась оценка заболевания по основным его проявлениям (Е — эритема; I — инфильтрация; Ех — экскориации; L — лихенификация), то есть фиксировалась интенсивность объективных симптомов АтД отдельно в 4 локализациях: верхние конечности (A), нижние конечности (B), туловище (C), голова/шея (D) с применением балльной оценки выраженности симптомов от 0 до 3 баллов. Проводилась оценка площади поражения кожи (S), которая также оценивалась по балльной системе с применением градаций: 0 — нет высыпаний; 1 балл < 10% площади кожи; 2 балла = 10–29%; 3 балла = 30–49%; 4 балла = 50–69%; 5 баллов = 70–89%; 6 баллов = 90–100% площади кожи.
Общий индекс EASI исчислялся как сумма показателей всех локализаций (табл. 1). Подсчет индекса EASI проводился до начала лечения, в процессе лечения (еженедельно) и через 4 недели после окончания терапии.
Выраженность зуда оценивалась с использованием визуально-аналоговой шкалы (ВАШ зуда) от 0 до 10 баллов, лечащими врачами фиксировалось наличие пиогенных проявлений и возникновение побочных нежелательных явлений, переносимость терапии препаратом Адвантан.
В табл. 2 приведены характеристики наблюдаемых больных с АтД.
Назначение лекарственных форм МПА 0,1% и препаратов для ухода за кожей проводилось лечащими врачами дифференцированно в зависимости от клинико-морфологического характера проявлений и при различных локализациях процесса, при этом учитывались рекомендации, отражающие базовые принципы проведения наружной терапии дерматозов [4, 5].
До начала лечения средний показатель индекса EASI в группе больных АтД составил 16,6 ± 4,8 балла, при этом локальная составляющая индекса EASI, характеризующая тяжесть процесса на нижних конечностях (В), достигала 7,1 ± 2,2 балла, а в области головы/шеи (D) — 1,7 ± 0,6 балла (рис. 2). В процессе проведения терапии общий индекс EASI снижался при пропорциональном уменьшении всех его локальных составляющих: в области верхних и нижних конечностей, туловища, головы и шеи.
К окончанию срока терапии, продолжавшейся от 7 до 28 дней, отмечалось практически полное очищение кожи от высыпаний, общий среднегрупповой индекс EASI (EASI 4) составил менее 1,0 балла. При осмотре через месяц после прекращения лечения полный регресс высыпаний сохранялся у всех пациентов с АтД, а индекс EASI 5 также был менее 1,0 балла.
Анализ динамики регресса симптомов АтД при проведении топической терапии МПА 0,1% (Адвантан), исчисляемый по отношению к исходному показателю EASI, показал, что после первой недели лечения происходило снижение выраженности симптомов заболевания во всех локализациях: в области кожи головы/шеи на 41,2%, конечностей и туловища на 34,3–40,7% от исходного (табл. 3).
Достижение состояния клинической ремиссии с регрессом индекса EASI на 75% и более от исходного наблюдалось между 2-й и 3-й неделей лечения, а при последующих осмотрах (EASI 4) и через 4 недели после окончания терапии (EASI 5) снижение выраженности проявлений АтД достигало 88,2–94,0% от исходного, то есть сохранялось полное очищение кожи во всех локализациях.
До начала терапии выраженность зуда кожи у больных АтД по данным ВАШ зуда фиксировалась от 4 до 10 баллов, в среднем по группе 8,1 ± 1,9 балла. В динамике терапии уже после 1 недели лечения среднегрупповые показатели ВАШ оценки зуда снизились до 2,5 ± 0,7 балла, в последующие недели показатель зуда не превышал 2,0–2,2 балла.
Сопоставление динамики регресса выраженности зуда и индекса EASI (рис. 3) показало, что уменьшение чувства зуда происходило раньше, чем регресс других симптомов и площади поражения кожи, после 2 недели лечения эти показатели не отличались, через 4 недели и после окончания терапии — объективные симптомы регрессировали полностью (на 94% от исходного), а зуд носил минимальный остаточный характер.
Анализ показал, что для терапии проявлений АтД в области головы и шеи более половины специалистов (56%) рекомендовали использование лекарственной формы эмульсии Адвантана, а в 40% — крема (рис. 4). При локализации высыпаний в области кожи туловища врачи назначали практически с одинаковой частотой (40% и 48%) Адвантан в форме крема и мази, эмульсию использовали реже (8%). Терапия высыпаний на коже верхних конечностей проводилась преимущественно кремом и мазью Адвантан (48% и 32%), а у 8% больных АтД врачи использовали лекарственную форму жирной мази. Большинство дерматологов (52%) назначали для терапии высыпаний в области нижних конечностей мазь Адвантан и крем (24%), 16% специалистов проводили терапию АтД в данной локализации жирной мазью Адвантан.
Лечащие врачи отмечали, что с учетом многообразия проявлений АтД у взрослых, когда в одних локализациях преобладали гиперемия, отечность, очаги мокнутия, а в других — инфильтрация различной степени выраженности, лихенификация, фиссуризация, пациентам назначались дифференцированно несколько лекарственных форм препарата Адвантан: например, на кожу лица и шеи — эмульсия, на кожу конечностей — мазь или жирная мазь.
Результаты проведенной работы, клинический опыт позволили разработать алгоритм применения эмульсии, крема, мази и жирной мази Адвантан в зависимости от характера проявлений кожного процесса (острый, хронический), локализации поражений и основных, преобладающих симптомов заболевания (рис. 5).
В процессе терапии и в течение 4 недель после ее окончания больным АтД проводился уход за кожей с использованием эмолентов, что обеспечивало восстановление липидного состава эпидермиса, комплексное увлажнение кожи.
В процессе проведения наружного лечения препаратом МПА 0,1% (Адвантан) лечащими врачами фиксировалось возникновение нежелательных явлений и побочных эффектов терапии: усиление зуда, гиперемии на начальном этапе терапии у 2 больных, появление пиогенных, вирусных осложнений у 2 пациентов. Явлений атрофии кожи, гипертрихоза, сосудистых нарушений зафиксировано не было.
Заключение
Анализ фактических данных, полученных в ходе наблюдательной программы, свидетельствует о высокой клинической эффективности препарата МПА 0,1% (Адвантан) в терапии больных АтД, характеризовавшейся достижением клинической ремиссии у больных АтД после 3 недель лечения с регрессом индекса EASI на 88,6% от исходного уровня. Практически полное очищение кожи, минимальная выраженность зуда или его отсутствие сохранялись у всех больных в течение 4 недель после окончания лечения. Значимым, определяющим дополнительную результативность лечения, является дифференцированный подход к назначению различных лекарственных форм МПА 0,1% (Адвантан), когда эмульсия и крем применяются при локализации высыпаний в проблемных зонах в условиях преобладания симптомов гиперемии, отечности; мазь — в терапии высыпаний на коже туловища и конечностей при наличии очагов воспалительной инфильтрации, жирная мазь — в случае формирования стойких поражений кожи в области нижних конечностей, присутствия плотной инфильтрации, лихенификации, гиперкератоза. Клинические наблюдения показали, что редукция чувства зуда при топическом лечении МПА 0,1% (Адвантан) предшествует регрессу объективных симптомов в первые недели терапии.
Подтверждена безопасность использования препарата МПА 0,1% (Адвантан) в терапии больных АтД, отсутствие формирования побочных эффектов при лечении в указанные сроки. Представляется обоснованным широкое использование препарата МПА 0,1% (Адвантан) для топического применения у больных АтД, при этом достаточные сроки наружного лечения, обоснованное дифференцированное назначение эмульсии, крема, мази и жирной мази, а также адекватный уход за кожей обеспечивают высокую клиническую результативность терапии и сохранение ремиссии.
Литература
- Bieber T. Atopic Dermatitis // Ann. Dermatol. 2010; 22 (2): 125–137.
- Darsow U., Wollenberg A., Simon D., Ta?¨eb A., Werfel T., Oranje A. Gelmetti C., Svensson A., Deleuran M., Calza M., Giusti F., Ring J. ETFAD⁄EADV eczema task force 2009 position paper on diagnosis and treatment of atopic dermatitis // JEADV. 2010; 24: 317–328.
- Голдсмит Л. А., Кац С. И., Джилкрест Б. А. и др. Дерматология Фицпатрика в клинической практике / Пер. с англ. под общ. ред. Потекаева Н. Н., Львова А. Н. Изд. 2-е. Издательство Панфилова, 2015. Т. 1, с. 182–200.
- Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. 5-е изд., перераб. и доп. М.: Деловой экспресс, 2016. 768 с.
- Wollenberg A., Barbarot S., Bieber T., Christen-Zaech S., Deleuran M. et al. GUIDELINES Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I // JEADV. 2018, 32: 657–682.
- Calzavara Pinton P., Cristaudo A., Foti C., Canonica G. W., Balato N. et al. Diagnosis and management of moderate to severe adult atopic dermatitis: a Consensus by the italian Society of dermatology and Venereology (SidemaSt), the Italian association of Hospital dermatologists, the Italian Society of allergy, asthma and Clinical immunology (SiaaiC), and the italian Society of allergological, environmental and occupational dermatology (SidaPa) // Giornale italiano di dermatologia e Venereologia. 2018; 153 (2): 133–145.
- Ilgen Ertam, Özlem Su, Sibel Alper, Hayriye Saricaoglu, Ayse Serap Karadag et al. The Turkish guideline for the diagnosis and management of atopic dermatitis — 2018 // Turkderm-Turk Arch Dermatol Venereology. 2018; 52: 6–23.
- Кунгуров Н. В., Кохан М. М., Кениксфест Ю. В., Гришаева Е. В., Кащеева Я. В., Куклин И. А. Оптимизация наружной терапии стероидчувствительных дерматозов // Вестн. дерматол. и венерол. 2007; 4: 45–51.
- Haria M., Balfour J. A. Methylprednisolone aceponate. A review of its pharmacological properties and therapeutic potential in the topical treatment of eczema // Clin Immunother. 1995; 3: 241–253.
- Brazzini B., Pimpinelli N. New and established topical corticosteroids in dermatology: clinical pharmacology and therapeutic use // Am J. Clin. Dermatol. 2002; 3: 47–58.
- Luger T., Loske K., Elsner P. et al. Topical skin therapy with glucocorticosteroids — therapeutic index // J Deutsch Dermatol Ges. 2004; 7: 629–634.
- Luger T. A. Balancing efficacy and safety in the management of atopic dermatitis: the role of methylprednisolone aceponate // JEADV. 2011; 25: 251–258.
- Chi C. C., Kirtschig G., Aberer, Gabbud J.-P., Lipozencic J., Karp S. et al. Updated evidence-based (S2e) European Dermatology Forum guideline on topical corticosteroids in pregnancy // JEADV. 2017; 31: 761–773.
- Torrelo A. Methylprednisolone aceponate for atopic dermatitis // Int J Dermatol. 2017; 56 (6): 691–697.
- Кохан М. М., Кениксфест Ю. В., Новиков Г. М. Эффективность сочетанного применения наружных средств терапии и увлажнения кожи у больных атопическим дерматитом // Вестн. дерматологии и венерологии. 2007; 4: 55–60.
- Волкова Е. Н., Ланге Д. А., Родина Ю. А., Тарасова М. В. Метилпреднизолона ацепонат в комплексной терапии хронических дерматозов: анализ тактических ошибок применения // Клиническая дерматология и венерология. 2010; 5: 97–102.
- Дворянкова Е. В., Корсунская И. М., Сакания Л. Р., Невозинская З. А. К вопросу о рациональном выборе топической терапии при атопическом дерматите // Consilium medicum. Дерматология, 2015; 1: 70–74.
- Hanifin J. M., Thurston M., Omoto M., Cherill R., Tofte S. J., Graeber M. The eczema area and severity index (EASI): assessment of reliability in atopic dermatitis // EASI Evaluator Group. Exp Dermatol. 2001; 10 (1): 11–18.
Н. В. Кунгуров, доктор медицинских наук, профессор
М. М. Кохан 1 , доктор медицинских наук, профессор
Ю. В. Кениксфест, доктор медицинских наук
Е. И. Стукова
Н. П. Торопова, доктор медицинских наук, профессор
ГБУ СО УрНИИДВиИ, Екатеринбург
Васкулиты кожи — группа заболеваний мультифакторной природы, при которых ведущим признаком является воспаление кровеносных сосудов дермы и подкожной клетчатки.
Васкулиты кожи — группа заболеваний мультифакторной природы, при которых ведущим признаком является воспаление кровеносных сосудов дермы и подкожной клетчатки.
Трудность в освещении этой темы заключается в том, что до настоящего времени нет общепринятой классификации и даже согласованной терминологии васкулитов. В настоящее время описано около 50 различных нозологических форм, и разобраться в этом многообразии непросто. Пестрота клинических проявлений и недостаточно изученные патогенетические механизмы привели к тому, что под разными названиями может скрываться лишь вариант основного типа поражения кожи. Также, помимо первичных васкулитов, в основе которых лежит воспалительное поражение сосудов кожи, выделяют и вторичные васкулиты (специфические и неспецифические), развивающиеся на фоне определенного инфекционного (сифилис, туберкулез и др.), токсического, паранеопластического или аутоиммунного (системная красная волчанка, дерматомиозит и др.) процесса. Возможна трансформация васкулита кожи в системный процесс с поражением внутренних органов и развитием тяжелых, иногда опасных для жизни осложнений.
Васкулиты кожи — заболевания полиэтиологические. Наиболее часто наблюдается связь с фокальной инфекцией (стрептококки, стафилококки, микобактерии туберкулеза, дрожжевые грибы, вирусы и др.). Определенное значение имеет повышенная чувствительность к ряду лекарственных веществ, в частности к антибиотикам и сульфаниламидным препаратам. Нередко, несмотря на тщательно собранный анамнез и проведенное обследование, этиологический фактор остается невыясненным. Среди факторов риска при васкулитах следует учитывать: возраст (наиболее уязвимы дети и пожилые люди), переохлаждение, чрезмерную инсоляцию, тяжелые физические и психические нагрузки, травмы, операции, заболевания печени, сахарный диабет, гипертонию. Патогенетическим механизмом развития васкулитов кожи в настоящее время считается образование циркулирующих иммунных комплексов с последующей их фиксацией в эндотелии, хотя окончательно это доказано не для всех заболеваний данной группы.
Васкулиты кожи — это неоднородная группа заболеваний, и клинические проявления их чрезвычайно разнообразны. Однако существует целый ряд общих признаков, объединяющих эти дерматозы:
1) воспалительный характер изменений кожи;
2) симметричность высыпаний;
3) склонность к отеку, кровоизлияниям и некрозу;
4) первичная локализация на нижних конечностях;
5) эволюционный полиморфизм;
6) связь с предшествующими инфекционными заболеваниями, приемом лекарств, переохлаждением, аллергическими или аутоиммунными заболеваниями, с нарушением венозного оттока;
7) острое или обостряющееся течение.
Поражения кожи при васкулитах многообразны. Это могут быть пятна, пурпура, узелки, узлы, некрозы, корки, эрозии, язвы и др., но основным клиническим дифференциальным признаком является пальпируемая пурпура (геморрагическая сыпь, возвышающаяся над поверхностью кожи и ощущаемая при пальпации).
Общепринятой классификации васкулитов не существует. Систематизируют васкулиты по разным принципам: этиологии и патогенезу, гистологической картине, остроте процесса, особенностям клинических проявлений. Большинство клиницистов пользуются преимущественно морфологическими классификациями кожных васкулитов, в основу которых обычно положены клинические изменения кожи, а также глубина расположения (и соответственно калибр) пораженных сосудов. Выделяют поверхностные (поражение сосудов дермы) и глубокие (поражение сосудов на границе кожи и подкожной клетчатки) васкулиты. К поверхностным относят: геморрагический васкулит (болезнь Шенлейна–Геноха), аллергический артериолит (полиморфный дермальный ангиит), лейкокластический геморрагический микробид Мишера–Шторка, а также хронические капилляриты (гемосидерозы): кольцевидная телеангиэктатическая пурпура Майокки и болезнь Шамберга. К глубоким: кожную форму узелкового периартериита, острые и хронические узловатые эритемы.
Геморрагический васкулит — системное заболевание, поражающее мелкие сосуды дермы и проявляющееся пальпируемой пурпурой, артралгиями, поражением желудочно-кишечного тракта (ЖКТ) и гломерулонефритом. Встречается в любом возрасте, но наибольшему риску подвергаются мальчики в возрасте от 4 до 8 лет. Развивается после инфекционного заболевания, через 10–20 дней. Острое начало заболевания, с повышением температуры и симптомами интоксикации чаще всего наблюдается в детском возрасте. Выделяют следующие формы геморрагического васкулита: кожная, кожно-суставная, кожно-почечная, абдоминально-кожная и смешанная. Течение может быть молниеносным, острым и затяжным. Длительность заболевания различна — от нескольких недель до нескольких лет.
Процесс начинается симметрично на нижних конечностях и ягодицах. Высыпания имеют папулезно-геморрагический характер, нередко с уртикарными элементами, при надавливании не исчезают. Окраска их меняется в зависимости от времени появления. Высыпания возникают волнообразно (1 раз в 6–8 дней), наиболее бурными бывают первые волны сыпи. Суставной синдром появляется либо одновременно с поражением кожи, либо через несколько часов. Чаще всего поражаются крупные суставы (коленные и голеностопные).
Одним из вариантов заболевания является так называемая некротическая пурпура, наблюдаемая при быстром течении процесса, при котором появляются некротические поражения кожи, изъязвления, геморрагические корки.
Наибольшие трудности вызывает диагностика абдоминальной формы геморрагического васкулита, так как высыпания на коже не всегда предшествуют желудочно-кишечным явлениям (рвоте, схваткообразным болям в животе, напряжению и болезненности его при пальпации, кровью в стуле).
Почечная форма проявляется нарушением деятельности почек различной степени выраженности, от кратковременной нестойкой гематурии и альбуминурии до выраженной картины острого гломерулонефрита. Это поздний симптом, он никогда не встречается до поражения кожи.
Молниеносная форма геморрагического васкулита характеризуется крайне тяжелым течением, высокой лихорадкой, распространенными высыпаниями на коже и слизистых, висцерапатиями, может закончиться смертью больного.
Диагностика заболевания базируется на типичных клинических проявлениях, в атипичных случаях проводится биопсия. При абдоминальной форме необходимо наблюдение хирурга. Рекомендуется наблюдение нефролога в течение трех месяцев после разрешения пурпуры.
Термином «аллергический артериолит» Ruiter (1948) предложил называть несколько родственных форм васкулитов, отличающихся клиническими проявлениями, но имеющих ряд общих этиологических, патогенетических и морфологических признаков.
Патогенетическими факторами болезни считают простуду, фокальные инфекции. Высыпания располагаются обычно симметрично и имеют полиморфный характер (пятна, папулы, пузырьки, пустулы, некрозы, изъязвления, телеангиэктазии, волдыри). В зависимости от преобладающих элементов выделяют три формы заболевания: геморрагический тип, полиморфно-узелковый (соответствует трехсимптомной болезни Гужеро–Дюперра) и узелково?некротический (соответствует узелково?некротическому дерматиту Вертера–Дюмлинга). При регрессе сыпи могут оставаться рубцовые атрофии и рубчики. Заболевание склонно к рецидивам. Нередко перед высыпаниями больные жалуются на недомогание, усталость, головную боль, в разгар заболевания — на боли в суставах (которые иногда припухают) и в животе. Диагностика всех типов заболевания сложна из-за отсутствия типичных, характерных симптомов. При гистологическом исследовании выявляется фибриноидное поражение сосудов мелкого калибра с образованием инфильтративных скоплений из нейтрофилов, эозинофилов, лимфоцитов, плазматических клеток и гистиоцитов.
Геморрагический лейкокластический микробид Мишера–Шторка по клиническому течению сходен с другими формами полиморфных дермальных васкулитов. Признаком, позволяющим выделить это заболевание как самостоятельное, является наличие феномена — лейкоклазии (распад ядер зернистых лейкоцитов, приводящий к образованию ядерной пыли) при гистологическом исследовании. Таким образом, геморрагический лейкокластический микробид может трактоваться как дерматоз, обусловленный хронической фокальной инфекцией (внутрикожные тесты со стрептококковым антигеном положительные), протекающий с выраженной лейкоклазией.
Хронические капилляриты (гемосидерозы), в отличие от остро протекающих пурпур, характеризуются доброкачественным течением и являются исключительно кожными заболеваниями.
Болезнь Шамберга — представляет собой лимфоцитарный капиллярит, который характеризуется наличием петехий и коричневых пурпурных пятен, возникающих чаще всего на нижних конечностях. Пациентов беспокоит исключительно как косметический дефект.
Пурпура Майокки характеризуется появлением на нижних конечностях розовых и ливидно-красных пятен (без предшествующей гиперемии, инфильтрации), медленно растущих с образование кольцевидных фигур. В центральной части пятна развивается небольшая атрофия и ахромия, выпадают пушковые волосы. Субъективные ощущения отсутствуют.
Узелковый периартериит характеризуется некротизирующим воспалением мелких и средних артерий мышечного типа с последующим образованием аневризм сосудов и поражением органов и систем. Наиболее часто встречается у мужчин среднего возраста. Из этиологических факторов важнейшими являются непереносимость лекарств (антибиотиков, сульфаниламидов), вакцинация и персистирование HbsAg в сыворотке крови. Заболевание начинается остро или постепенно с симптомов общего характера — повышения температуры тела, быстро нарастающего похудания, боли в суставах, мышцах, животе, кожных высыпаний, признаков поражения ЖКТ, сердца, периферической нервной системы. Со временем развивается полевисцеральная симптоматика. Особенно характерно для узелкового периартериита поражение почек с развитием гипертонии, которая иногда приобретает злокачественный характер с возникновением почечной недостаточности. Выделяют классическую и кожную форму заболевания. Высыпания на коже представлены узелками — одиночными или группами, плотными, подвижными, болезненными. Характерно образование узлов по ходу артерий, иногда образуют тяжи. Локализация на разгибательных поверхностях голеней и предплечий, на кистях, лице (брови, лоб, углы челюсти) и шеи. Нередко не видны на глаз, могут определяться только пальпаторно. В центре может развиваться некроз с образованием длительно незаживающих язв. Периодически язвы могут кровоточить в течение нескольких часов (симптом «кровоточащего подкожного узла»).
Иногда единственным проявлением заболевания может быть сетчатое или ветвистое ливедо (стойкие фиолетово?красные пятна), локализующиеся на дистальных отделах конечностей, преимущественно на разгибательных поверхностях или пояснице. Характерно обнаружение по ходу ливедо узелков.
Диагностика заболевания основывается на сочетании поражения ряда органов и систем с признаками значительного воспаления, с лихорадкой, изменениями прежде всего в почках, в сердце, наличии полиневрита. Специфических для этой болезни лабораторных показателей не существует. Решающее значение для диагноза имеет динамическое клиническое наблюдение за больным.
Острая узловатая эритема — это панникулит, который характеризуется наличием болезненных розовых узлов на разгибательной поверхности нижних конечностей. Сопровождается лихорадкой, недомоганием, диареей, головной болью, конъюнктивитом и кашлем. Среди взрослых узловатая эритема в 5–6 раз чаще встречается у женщин, пиковый возраст — 20–30 лет. В основе заболевания гиперчуствительность к различным антигенам (бактерии, вирусы, грибы, новообразования и заболевания соединительной ткани). Половина случаев является идиопатическими. Диагностика основывается на данных анамнеза и физического осмотра. Необходимо провести полный анализ крови, рентгенограмму легких (выявляется двусторонняя аденопатия в области корней легких), мазок из зева или быстрый тест на стрептококки.
Хроническая узловая эритема — это группа различных видов узловатых дермогиподермитов. Чаще болеют женщины 30–40 лет. На голенях возникают узлы различной величины с покрасневшей над ними кожей, без наклонности к некрозу и изъязвлению. Воспалительные явления в области высыпаний и субъективные ощущения (артралгии, миалгии) мало выражены. Клинические варианты хронической узловатой эритемы имеют свои особенности, например наклонность узлов к миграции (мигрирующая эритема Беферштедта) или асимметрия процесса (гиподермит Вилановы–Пиноля).
Тактика ведения больного васкулитом кожи
- Классифицировать заболевание (характерная клиническая картина, анамнез, гистологическое исследование).
- Поиск этиологического фактора, но в 30% случаев его установить не удается (поиск очагов хронической инфекции, микробиологические, иммунологические, аллергологические и другие исследования).
- Оценка общего состояния и определение степени активности заболевания: общий анализ крови и мочи, биохимический анализ крови, коагулограмма, иммунограмма. Степень активности васкулитов: I. Высыпания не обильные, температура тела не выше 37,5, общие явления незначительные, СОЭ не выше 25, С-реактивный белок не более ++, комплемент более 30 ед. II. Высыпания обильные (выходят за пределы голени), температура тела выше 37,5, общие явления — головная боль, слабость, симптомы интоксикации, артралгии; СОЭ выше 25, С-реактивный белок более ++, комплемент менее 30 ед., протеинурия.
- Оценка признаков системности (исследование по показаниям).
- Определение вида и режима лечения в зависимости от степени активности: I ст. — возможно лечение в амбулаторных условиях; II ст. — в стационаре. Во всех случаях обострений васкулитов кожи необходим постельный режим, так как у таких больных обычно резко выражен ортостатизм, который следует соблюдать до перехода в регрессирующую стадию. Рекомендуется диета с исключением раздражающей пищи (алкогольные напитки, острые, копченые, соленые и жареные блюда, консервы, шоколад, крепкий чай и кофе, цитрусовые).
- Этиологическое лечение. Если есть возможность устранить причинный агент (лекарство, химикаты, инфекции), то быстро следует разрешение кожных очагов и другого лечения не требуется. Но надо помнить, что при санации очагов инфекции может наблюдаться усиление сосудистого процесса.
- Патогенетическое лечение.
- Профилактические мероприятия: диспансеризация, предупреждение провоцирующих факторов (инфекции, переохлаждение, инсоляции, стрессы и др.), рациональное использование лекарственных средств, трудоустройство, лечебная физкультура, санаторно-курортное лечение.
Лечение геморрагического васкулита
- Глюкокортикостероиды (преднизалон до 1,5 мг/кг) — облегчают проявление кожно-суставного синдрома, но не укорачивают заболевание и не предотвращают поражение почек. Назначаются в тяжелых случаях и под прикрытием гепарина, т. к. повышают свертываемость крови.
- Нестероидные противовоспалительные средства (НПВС) в обычных терапевтических дозировках. Выбор конкретного препарата принципиального значения не имеет (индометацин, диклофенак, ацетилсалициловая кислота).
- Антикоагулянты и антиагреганты. Гепарин при распространенном процессе 300–400 ЕД/кг/сутки. Продолжительность курса должна составлять не менее 3–5 недель. Под контролем коагулограммы.
- Лечебный плазмаферез, когда проявления заболевания не устраняются перечисленными средствами.
- Никотиновая кислота в переносимых дозах в/в капельно.
- Не следует применять: антигистаминные препараты (возможно только в самом начале заболевания), препараты кальция, все витамины.
Лечение васкулитов кожи
1) НПВС (напроксен, диклофенак, Реопирин, индометацин и др.);
2) салицилаты;
3) препараты Са;
4) витамины Р, С, антиоксидантный комплекс;
5) сосудорасширяющие средства (ксантинола никотинат, пентоксифиллин);
6) 2% раствор йодида калия по 1 ст. л. 3 раза в день (узловатая эритема);
7) антикоагулянты и антиагреганты;
8) методы детоксикации в/в капельно;
9) глюкокортикостероиды (ГКС) по 30–35 мг/сутки в течение 8–10 дней;
10) цитостатики;
11) ультравысокочастотная терапия, диатермия, индуктотермия, ультразвук с гидрокортизоном, ультрафиолетовое облучение.
Наружное лечение. При эрозивно-язвенных высыпаниях
1) 1–2% растворы анилиновых красителей;
2) эпителизирующие мази (солкосерил);
3) мази, содержащие глюкокортикоиды, и др.;
4) примочки или мази протеолитическими ферментами (Химопсин, Ируксол);
5) апликации Димексида;
При узлах — сухое тепло.
Лечение не должно заканчиваться с исчезновением клинических проявлений заболевания. Оно продолжается до полной нормализации лабораторных показателей, а в последующие полгода-год больным проводится поддерживающее лечение
Читайте также:

