Стентирование пищевода при ожоге пищевода
Обновлено: 24.04.2024
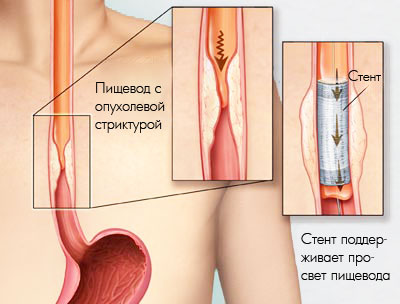
Достаточно часто при лечении доброкачественных и злокачественных поражений пищевода врач сталкивается с необходимостью выполнения стентирования. Если не провести данную операцию, то пациент не сможет нормально питаться, что неминуемо отразиться на дальнейшем прогнозе. Установка жесткого каркаса в виде стента позволяет восстановить просвет пищевода и обеспечить нормальное продвижение пищи.
Суть процедуры стентирования
Восстановление пищевода может осуществляться различными методами, но наибольшую популярность приобрело именно стентирование. Эта эндоскопическая операция зачастую носит паллиативный характер, позволяет добиться хороших результатов и является безопасной для пациента. Стент представляет собой специально изготовленную саморасправляющуюся пластиковую или металлическую конструкцию, которая обладает хорошей жесткостью. При размещении ее в просвет пищевода создается дополнительная опора для его стенок, расширяется просвет и снижается вероятность обструкции. Стентирование пищевода выполняется эндоскопическим способом, за счет чего сокращается период реабилитации и снижается вероятность развития осложнений. Кроме того, такую процедуру пациенты переносят намного лучше и поэтому охотнее соглашаются на ее проведение.
Существует несколько видов стентов. Наиболее современными считаются саморасправляющиеся металлические конструкции. Они отличаются долговечностью и надежностью. Выбор точного вида стента осуществляется исходя из особенностей каждого клинического случая.
Показания и противопоказания к стентированию пищевода
Процедура проводится в тех случаях, когда нарушается проходимость пищевода. Это состояние может быть следствием других заболеваний. Наиболее часто необходимость в проведении стентирования возникает в следующих случаях:
- Сужение просвета пищевода вследствие растущей доброкачественной или злокачественной опухоли.
- Опухоли грудной клетки и средостения, которые могут сдавливать пищевод извне.
- Неопухолевые стриктуры пищевода (в результате полученных химических, термических ожогов).
- Сужение просвета пищевода в результате других оперативных вмешательств на данном органе.
Необходимость в стентировании пищевода определяется индивидуально. Зачастую у пациентов с показаниями к данной манипуляции имеются и другие сопутствующие заболевания, которые необходимо учитывать. Вместе с тем, стентирование позволяет значительно улучшить качество жизни, поэтому список противопоказаний к процедуре минимален.

Как проводят стентирование пищевода
На подготовительном этапе назначается комплексное обследование, в которое включаются фиброгастроскопия, рентгенодиагностика, КТ, МРТ и др. Данные методы позволяют выявить показания и противопоказания к процедуре, составить план ее проведения, а также подобрать правильный стент.
Стентирование пищевода может выполняться следующими способами:
- Без применения эндоскопических инструментов под прямым рентгеноскопическим контролем.
- С применением эндоскопических инструментов под прямым рентгеноскопическим контролем.
- Эндоскопическое стентирование без рентгеноскопического контроля.
- Интраоперационная установка стента.
Наиболее популярным является эндоскопическое стентирование пищевода без рентгеноскопического контроля. Предварительно пациенту проводится реканализация, баллонная дилатация или бужирование пищевода. После этого на специальном проводнике врач вводит стент, раскрывает его и затем извлекает проводник.
Сразу же после проведения процедуры стентирования, проводится рентгеноконтрастное исследование. Это необходимо для быстрого выявления возможных осложнений вмешательства. На следующий день после процедуры показано проведение фиброэзофагоскопии.
Осложнения и реабилитация после стентирования
Как и любая другая медицинская процедура, стентирование сопровождается определенными рисками. При правильной подготовке и применении современного оборудования их можно снизить до минимума, но не исключить полностью. Наиболее распространенными осложнениями, которые развиваются в разный промежуток времени после стентирования, являются:
В редких случаях приходится удалять стент из-за выраженного болевого синдрома.
После процедуры, пациенту рекомендуется употреблять жидкую и полужидкую пищу с постепенным переходом на привычное питание. Следует ограничить прием алкоголя и курение. Для облегчения прохождения пищи по пищеводу, ее следует принимать строго в вертикальном (сидячем) положении небольшими порциями. Для профилактики развития рефлюкс-эзофагита нужно оставаться в сидячем положении не менее 2 часов после принятия пищи, а также спать с приподнятым на 30-40 градусов головным концом кровати.
Наиболее частой патологией пищевода остаются рубцовые стриктуры. Внедрение в клиническую практику стентирования пищевода с применением саморасширяющихся нитиноловых и биодеградируемых коллагеновых протезов позволило совершенно по-новому подойти к лечению послеожоговых рубцовых стриктур пищевода. За период 2005–2010 года в Пензенской областной клинической больнице находился на лечении 261 человек. Использовали методику максимально консервативного лечения. 16 пациентам с постоянно рецидивирующей стриктурой пищевода проведено временное стентирование нитиноловыми протезами. После стентирования у 75 % больных достигнута стойкая ремиссия. Разработана нейросетевая модель прогнозирования исхода ожоговой болезни пищевода. С целью профилактики и раннего лечения у 5 пациентов выполнено стентирование пищевода биодеградируемыми коллагеновыми стентами на 30–40 сутки с момента получения ожога. За период 6–8 месяцев у 5 больных (100 %) рестенозирования не наблюдали.

2. Мирошников Б.И., Королев М.П. Эндоскопическое рассечение рубцовых стриктур пищеводного анастомоза // Вестник хирургии им. И.И. Грекова. – 1989. – Т. 143, № 9. – С. 116.
3. Петровский Б.В., Ванцян Э.Н., Николаев Н.О. Заболевания оперированного пищевода // Хирургия. – 1971. – № 3. – С. 4–10.
4. Сапегина Ф.З. Оптимальные сроки баллонной дилатации при химическом ожоге пищевода (экспериментальное исследование): автореф. дис. … канд. мед. наук. – М., 2005. – 80 с.
5. Лечение послеожоговых рубцовых сужений пищевода бужированием и длительной интубацией: методич. рекомендации / Г.К. Ткаченко, М.А. Алиев, К.А. Кашкин, В.А. Потапов, Е.С. Кулубеков. – Алма-Ата, 1984. – 65 с.
6. Осложнения стентирования у больных с доброкачественными и злокачественными заболеваниями пищевода / Ф.А. Черноусов, Э.А. Годжелло, М.В. Хрусталева, А.Л. Шестаков // XI съезд хирургов Российской Федерации. 25–27 мая 2011: материалы съезда. – Волгоград, 2011. – С. 388–389.
7. Bethge N., Sommer A., von-Kleist D., Vakil N. A prospective trial of self-expanding metal stents in the palliation of malignant esophageal obstruction after failure of primary curative therapy // Gastrointest. Endosc. – 1996. – Vol. 44, № 3. – P. 283–286.
8. Guelrud M.L., Villiasmil R. Late results in patients with Schatzki ring treated by endoscopic incision of the ring // Gastrointest.Endosc. – 1987. – Vol. 33. – P. 96.
9. Repici A., Rondo G. Expandable Stents for Malignant Dysphagia // Tech. Gastrointest. Endosc. – 2008. – Vol. 10. – P. 175–183.
10. Spechler S.J. American gastroenterology association medical position statement on treatment of patients with dysphagia caused by benign disorders of the distal esophagus // Gastroenterology. – 1999. – Vol. 117. – P. 229–232.
11. Tan D.S., Mason R.C., Adam A. Minimally invasive therapy for advanced oesophageal malignancy // Clin Radiol. – 1996. – № 51. – P. 828–836.
В настоящее время химические ожоги по частоте занимают второе место среди заболеваний пищевода у взрослых, первое – у детей, и в 15–70 % случаев приводят к формированию рубцовых стриктур пищевода. Профилактика и лечение послеожоговых рубцовых стриктур на протяжении многих лет остается сложной и актуальной проблемой в хирургии [9].
Традиционно эту проблему решают в двух направлениях: консервативными мероприятиями и путем пластики пищевода с использованием собственных или синтетических материалов. Основными методами консервативного лечения являются бужирование и баллонная дилатация. Несмотря на большое количество предложенных методик бужирования и баллонной дилатации, данные манипуляции остаются высокотравматичными, у 30–40 % больных возникает рецидив стриктуры [10].
Несмотря на успехи в хирургии пищевода, летальность при его пластике остается высокой. Травматичность операций, их многоэтапность, несостоятельность швов пищеводно-кишечных анастомозов (12–54,6 % случаев) [8], развитие рубцовых сужений анастомозов (9–19,6 %) являются отрицательными моментами данного вида лечения [2].
Поиск новых методов нехирургического лечения послеожоговых рубцовых стриктур пищевода, различных методик интубации пищевода продолжается до сих пор.
Г.К. Ткаченко и соавт. (1984) устанавливали силиконовую трубку диаметром 8–14 мм по струне таким образом, чтобы верхний конец ее располагался выше стриктуры, а нижний – в желудке. Трубка была снабжена лентодержателем, который выводился через нос больного. Срок нахождения трубки в пищеводе составлял до 2,5 месяцев. Данную методику авторы применяли при ригидных стриктурах, когда многократное форсированное бужирование оказывалось безуспешным [5].
Однако методики интубации пищевода жесткими протезами не получили широкого практического применения. Протезы имели малый внутренний диаметр, эффективность их оказалась низкой вследствие их закупорки, смещений. Кроме того, эти процедуры сопровождались высокой частотой осложнений (до 36 %), в основном за счет перфораций пищевода, и значительной летальностью (2–16 %) [11].
Использование стентов у больных с послеожоговыми рубцовыми стриктурами сейчас остается дискутабельным. H.Y. Song и соавторы (2000) расценивают установку стентов в зону стриктуры как длительную дилатацию и указывают на уменьшение дисфагии в 48 % случаев с отсутствием необходимости в дальнейшем лечении. По данным других авторов данная манипуляция сопровождается тяжелыми осложнениями, общая доля которых доходит до 30 % [9].
В последнее время появились саморасширяющиеся биодеградируемые пищеводные стенты, изготовленные из монофиламентной нити полидиоксанона, широко используемой в хирургии в качестве рассасывающегося шовного материала. Несомненно, это направление является перспективным и актуальным в профилактике формирования и лечении послеожоговых рубцовых стриктур пищевода.
Хотим поделиться клиническим опытом стентирования пищевода у больных с послеожоговыми рубцовыми сужениями.
Материалы и методы исследования
За период с 2005 по 2010 года в хирургическом отделении Пензенской областной клинической больницы им. Н.Н. Бурденко находился на лечении 261 человек с послеожоговой рубцовой стриктурой пищевода. 21 пациенту выполнено временное стентирование пищевода. Возраст пациентов составил от 25 до 79 лет. Высокие стриктуры наблюдались у 3 человек (14 %), срединные – у 4 пациентов (19 %), низкие – у 9 (43 %), комбинированные – 5 (24 %).
У 8 пациентов использовали методику внешней фиксации стента для предупреждения его дислокации в дистальные отделы желудочно-кишечного тракта. Стент фиксировали к ушной раковине пациента за нить, выведенную через носовую хоану. Обязательным условием стентирования являлось применение саморасширяющихся нитиноловых конструкций, полностью покрытых, с целью предотвращения врастания их в окружающие ткани.
5 пациентам было выполнено стентирование пищевода биодеградируемыми коллагеновыми стентами на 30–40 сутки с момента получения ожога с целью раннего лечения (3) и профилактики (2) формирования послеожоговой рубцовой стриктуры. Отбор пациентов для профилактического стентирования проводили с помощью компьютерной нейросетевой модели прогнозирования рубцовых стриктур. Последняя создана на основе клинико-диагностических критериев неблагоприятного течения послеожоговых рубцовых стриктур, выявленных при ретроспективном анализе историй болезни 536 пациентов, пролеченных в отделении токсикологии с ожогами пищевода.
Результаты исследования и их обсуждение
Процедуру стентирования большинство пациентов переносили удовлетворительно, хотя она была сопряжена с известным дискомфортом. У всех больных с дисфагией на следующие сутки, у многих уже после стентирования появилась возможность приема пищи. Спустя 3–5 суток явления дисфагии полностью исчезали.
На этапе освоения методики наблюдали миграцию покрытых нитиноловых стентов в дистальные отделы желудочно-кишечного тракта у 4 пациентов (19 %). У 3 из них эндопротез дислоцировался в желудок. В 2 случаях последствия миграции ликвидированы с помощью гибкой эндоскопии. Возникли сложности при извлечении стента, имеющего сегментарное строение – при потягивании за петлю для извлечения, так как уменьшались в диаметре только проксимальная и дистальная часть конструкции, а сам стент на всем протяжении оставался в раскрытом состоянии, что создавало сложности для манипуляции в ограниченном пространстве. Как утверждает Ф.А. Черноусов и соавторы (2011), стенты с сегментарным строением имеют особенность разрушаться в местах соединения сегментов и мигрировать частями, что невозможно контролировать [6]. У 1 пациента на фоне мнимого благополучия стент мигрировал в дистальные отделы подвздошной кишки и вызвал пролежень кишки в проекции проксимального и дистального концов протеза. Выполнено оперативное вмешательстве – резекция участка подвздошной кишки со стентом.
Следует отметить, что миграции покрытых нитиноловых стентов имели место в период накопления технического опыта по стентированию, когда методику визуальной фиксации стента еще не применяли. Анализируя сроки миграции, выявили, что стенты дислоцировались на 40–60 сутки с момента установки. За этот промежуток времени стриктура полностью реканализировалась.
Экспозиция протезов в просвете пищевода в среднем составила 1,5–2 месяца. У пациентов с внешней фиксацией стента сигналом к удалению последнего являлся симптом натяжения фиксирующей нити.
В процессе дальнейшего наблюдения у всех пациентов, подвергшихся стентированию покрытыми нитиноловыми саморасширяющимися эндопротезами, наступило улучшение проходимости пищевода. После извлечения нитиноловых конструкций у 12 (75 %) больных достигнута стойкая ремиссия. Срок наблюдения составил 3 года. Явления дисфагии не отмечается. У 4 человек развился рецидив стриктуры, что явилось показанием к выполнению реконструктивной восстановительной операции.
Установленные рассасывающиеся коллагеновые стенты как с лечебной, так с профилактической целью позволили избежать стенозирования пищевода и добиться хороших результатов лечения. За период наблюдения 6–8 месяцев у всех больных рестенозирования не отмечено. Эффект каркасного действия стентов продолжался на протяжении 45–60 суток. Полная их биодеградация наступала в среднем в течение 3–4 месяцев.
Внедрение в клиническую практику щадящих методов внутрипросветного лечения послеожоговых рубцовых стриктур пищевода, безусловно, позволяет улучшить качество жизни пациентов с данной патологией. Профилактика и лечение послеожоговых рубцовых сужений методом стентирования имеет свои неоспоримые преимущества перед традиционными способами. Позволяет равномерно, дозированно и надежно дилатировать стриктуру. Однократная установка стента – более легко переносимая манипуляция для пациента, чем этапное бужирование или баллонная дилатация.
При своевременном проведении комплекса профилактических мер, основой которых является дилатационная терапия, исход в рубцовый стеноз пищевода наблюдается менее чем в 10 %, а без этого − в 73 % [3]. На основании этого считаем необходимым выявлять пациентов с прогностически неблагоприятным течением послеожоговой рубцовой стриктуры: позднее стенозирование, непрерывно рецидивирующее течение, полная облитерация пищевода. Отбор пациентов следует проводить на основании прогноза, созданного нейросетевой моделью. С целью предотвращения неблагоприятного исхода заболевания следует проводить как ранние лечебные манипуляции, так и профилактические.
С целью профилактики неблагоприятного течения заболевания и раннего лечения считаем целесообразным использование биодеградируемых стентов. Преимущества их несомненны – эффект каркасного действия протеза сохраняется до 2 месяцев, более длительный период времени дилатации в сравнении с традиционными методами, способность их к врастанию в слизистую пищевода исключает возможность миграции в дистальные отделы желудочно-кишечного тракта, нет необходимости их извлечения.
У пациентов с длительной (более 6 месяцев существования) непрерывно рецидивирующей стриктурой (рестенозирование более 3 раз в год), считаем оправданной методику временного стентирования пищевода нитиноловыми саморасширяющимися эндопротезами, осуществляемую под контролем эзофагоскопии, рентгеноскопии. Применение саморасщиряющихся нитиноловых конструкций цельноплетеного строения, полностью покрытых, позволяет создать равномерную оптимальную нагрузку по всей площади воздействия и предотвратить врастание стента в окружающие ткани.
Одним из дискуссионных остается вопрос о времени необходимой экспозиции протеза в просвете пищевода. На основании клинического опыта полагаем, что экспозиция стента до 2 месяцев надежно дилатирует стриктуру, позволяет получить выраженный и стабильный клинический эффект, предупреждает развитие поздних стриктур. На фоне длительного нахождения (более 2 месяцев) стента в просвете пищевода возникает грануляционный стеноз. По данным Ф.А. Черноусова и соавт. (2011), стентирование саморасправляющимися металлическими эндопротезами на срок от 6 до 16 месяцев сопровождается сужением просвета пищевода до 2–5 мм выше и ниже стента или его полной облитерацией, отслойкой внутреннего покрытия стента с частичным нарушением его просвета, разрастанием грануляционной ткани по краям протеза, протяженной рубцовой стриктурой нижней трети пищевода [6].
Внедрение в клиническую практику стентирования пищевода с применением саморасширяющихся нитиноловых и биодеградируемых коллагеновых протезов позволило совершенно по-новому подойти к лечению послеожоговых рубцовых стриктур пищевода. Для профилактики и раннего лечения послеожоговых рубцовых стриктур считаем необходимым осуществлять дилатацию пищевода биодеградируемыми коллагеновыми стентами на 30–40 сутки с момента получения ожога. При сформированной длительной непрерывно рецидивирующей рубцовой стриктуре целесообразно применение временного стентирования покрытыми цельноплетеными нитиноловыми конструкциями продолжительностью не более 2 месяцев, что позволяет добиться стойкой ремиссии заболевания.
Рецензенты:
Сиваконь С.В., д.м.н., профессор, заведующий кафедрой «Травматология, ортопедия и военно-экстремальная медицина», ФБГОУ ВПО «Пензенский государственный университет», Медицинский институт, г. Пенза;
Митрошин А.Н., д.м.н., профессор, заведующий кафедрой «Хирургия», ФБГОУ ВПО «Пензенский государственный университет», Медицинский институт, г. Пенза.
Климашевич А.В., Никольский В.И., Назаров В.А., Богонина О.В.
Резюме
Способ лечения постожоговых стриктур пищевода методом стентирования
Климашевич А.В., Никольский В.И., Назаров В.А., Богонина О.В.
Пензенский государственный университет медицинский институт
Резюме. Наиболее частой патологией пищевода остаются рубцовые стриктуры, а химические ожоги являются основной причиной их возникновения. Проблема выбора тактики и способа лечения рубцовых стриктур пищевода остается актуальной. За период 2005 - 2010 года в Пензенской областной клинической больнице находился на лечении 261 человек. Использовали тактику максимально консервативного лечения. У 23 больных отмечалась постоянно рецидивирующая стриктура пищевода, в связи с чем 16 пациентам выполнена методика временного стентирования. Основная проблема стентирования при доброкачественных постожоговых стриктурах – это миграция в дистальные отделы пищеварительного тракта. Срок экспозиции стента в месте стриктуры не более 2 месяцев. После выполненного стентирования у 12 (75%) больных достигнута стойкая ремиссия, у 4 человек развился рецидив стриктуры. Использование временного стентирования у больных при постоянно рецидивирующих доброкачественных стриктурах пищевода является манипуляцией альтернативной бужированию, с меньшим количеством побочных эффектов и осложнений, позволяющей получить стойкую ремиссию заболевания в 75% случаев. Считаем принципиальным использовать для этой манипуляции только полностью покрытые, цельно плетеные конструкции, с обязательной внешней фиксацией. Срок экспозиции стента не более 2 месяцев, либо извлечение по необходимости.
Ключевые слова: пищевод, стриктура, стент.
The method of treating of postburn esophageal strictures by stenting
Klimashevich A., Nikolski V., Nazarov V., Bogonina O.
Medical Institute of Penza State University
Abstract. The most frequent pathology of the esophagus is cicatricial stricture, and burns are the main cause of their occurrence. The problem of choice of tactics and a method of treating of cicatricial strictures of the esophagus remains relevant. During the period from 2005 to 2010 in Penza Regional Hospital was treated 261 patients. The tactic of the most conservative treatment was used. Constantly recurrent stricture of the esophagus was observed in 23 patients, in connection with it the method of temporary stenting was performed in 16 patients. The main problem of stenting in benign postburns strictures is a migration of the stent in the distal parts of the digestive tract. The term exposure of the stent into place of stricture less than 2 months. Sustained remission was achieved in 12 (75%) patients after stenting, and recurrence of stricture in 4 people has arisen. The using of temporary stenting in patients with permanent recurrent benign strictures of the esophagus is alternative for esophageal bougienage, with fewer side effects and complications, allowing a stable remission of the disease in 75% of cases. We believe that the principle should be used for this manipulation only fully coated, whole braided design with mandatory external fixation. The term exposure of stent is not more than 2 months, or if it is required to extract.
Key words: esophagus, stricture, the stent.
Ключевые слова
Введение
В России по-прежнему, наиболее частой патологией пищевода остаются рубцовые стриктуры, а химические ожоги являются основной причиной их возникновения. Около 87% больных с ожогами пищевода составляют люди трудоспособного и молодого возраста, причем до 55% из них получают химический ожог случайно. Проблема выбора тактики и способа лечения рубцовых стриктур пищевода до сих пор составляют одну из наиболее тяжелых и драматических страниц хирургии и продолжают быть одной из актуальных задач хирургической науки и практики [1].
Улучшить результаты лечения больных с постожоговыми рубцовыми стриктурами пищевода.
Материал и методы
За период 2005 - 2010 года в Пензенской областной клинической больнице находился на лечении 261 человек. В нашей клинике разработана тактика консервативного лечения постожоговых рубцовых стриктур, позволившая в большинстве случаев отказаться от выполнения пластики пищевода. Являемся сторонниками профилактического мягкого раннего бужирования (проглатывание крупных глотков масляных растворов) и лечебного бужирования. Из всех известных методов бужирования используем:
- Ортоградное форсированное бужирование по нити и струне направителю.
- Ретроградное форсированное бужирование пучками нитей (2).
- Ретроградное форсированное бужирование по нити и струне направителю (5).
Ортоградное форсированное бужирование выполняем полыми эластическими бужами с №22 по №40. Используем максимально безопасную методику выполнения. Пациент предварительно (в течение 2 – 4 суток), проглатывает капроновую нить №3 – 4 с дробинкой на дистальном конце, которая проходит за место стриктуры и фиксируется в желудочно-кишечном тракте. Проводник на дистальном конце имеет петлю, для нанизывания на нить. Таки образом, нить служит направляющей для металлического проводника, который проводится по ней за место стриктуры. Данная манипуляция получается максимально безопасной, предотвращая возможную перфорацию в супрастенотическом расширении, особенно, расположенное эксцентрично по отношению к просвету пищевода. По установленному проводнику проводится ортоградное форсированное бужирование полыми эластическими бужами (рис. 1). Бужирование приостанавливаем при появлении боли, выраженного сопротивления тканей и прожилок крови на буже. За одну манипуляцию, как правило, удается расширить просвет пищевода на 3 – 4 размера, после чего назначается противоотечная терапия, направленная на профилактику эзофагита и образования рубцов.
В процесс работы с бужами, мы отказались от использования продольного канала на всем протяжении, так как проведению проводника препятствует трение, возникающие в узком канале бужа. Иногда проводник застревает. В связи с этим используем не сплошной канал, а частичный, который начинается от конической части бужа и заканчивается на расстоянии 10 см, открываясь в бок.
При суб- и декомпенсированных рубцовых стриктурах, со значительным супрастенотическим расширением, выполнить обычное ортоградное бужирование бывает просто невозможно (не проходит нить, не удается завести металлический проводник, возникает опасность перфорации в супрастенотическом отделе), в таком случае используем ретроградное форсированное бужирование. Подготовка больного к ретроградному бужированию включает в себя наложение гастростомы (мы используем модификацию Кадера, Витцеля). После её формирования, при помощи эндоскопической ретроградной гастроэзофагоскопии заводим проводник за место стриктуры. Так как методика ретроградного бужирования используется чаще всего при декомпенсированной обструкции, в связи с этим мы выполняем бужирование пучками нитей с увеличением их количества, доводя диаметр до размера бужей №22 – 24. Сеансы бужирования повторяем через 3 – 5 суток.
По мере увеличения диаметра нитей переходим на ретроградное бужирование по струне направителю, которую проводим через гастростому по нити (рис. 2). Преимуществом бужирования с использованием гастростомы, является то, что металлический проводник фиксируется как проксимально, так и дистально.
Метод как антеградного, так и ретроградного бужирования, по нашему мнению, имеет ряд недостатков, к которым, прежде всего, следует отнести низкую эффективность восстановления проходимости пищевода, обусловленную кратковременностью воздействия на послеожоговую стриктуру; высокую травматичность проведения манипуляции, так как, при тракционном действии бужа на патологически измененный участок происходит дополнительное повреждение скомпрометированного участка пищевода. Многократное бужирование приводит к механической травме слизистой оболочки пищевода, что вызывает дистрофические и дегенеративные изменения в слизистой, а в последующем к дисплазии и увеличению риска малигнизации доброкачественных стриктур. К недостаткам данного способа также следует отнести этапность проведения манипуляции, что увеличивает время пребывания пациента в стационаре.
Существует категория больных с поздними сформированными стриктурами пищевода, у которых постоянно развивается рецидив заболевания, требующий поддерживающего бужирования с частотой обращения до 12 – 14 раз в год. Лечение таких больных поддерживающим бужированием нельзя признать удовлетворительным. За анализируемый период времени в нашей клинике регистрировано 23 (8,8%) таких пациентов.
В настоящее время известен альтернативный метод лечения постожоговых рубцовых стритур пищевода: «Эндоскопическое стентирование» [2]. Согласно данному способу, после предварительной максимальной дилатации стриктуры под эндоскопическим контролем по направителю в зону стеноза пищевода подводят стент на доставляющей системе в сжатом состоянии, после чего он выталкивается и расправляется в просвете пищевода. Затем направитель извлекают. Введение стента осуществляют в сроки не ранее, чем через 6 месяцев с момента получения травмы.
Нами предложено с целью восстановления проходимости пищевода использовать у больных с непрерывно рецидивирующими стриктурами методику временного стентирования покрытыми нитиноловытами стентами. Данная методика применена нами у 16 (6,1%) больных. Остальные от предложенных манипуляций отказались.
Введение стента в пищевод производится после премедикации под местной анестезией в положении больного на левом боку. После предварительно выполненной максимальной дилатации стриктуры и проведенной противоотечной терапии, под рентгенологическим контролем за место стриктуры устанавливается металлический проводник. По проводнику в проецируемое место стриктуры на доставляющем устройстве заводится покрытый нитиноловый саморасширяющийся стент, имеющий полностью покрытую конструкцию. Проксимальный конец стента устанавливаем на 2,0 – 3,0 см выше края стриктуры. Удерживая поршень в неподвижном состоянии, освобождаем стент из системы. Последний остается в месте стриктуры и в течение 3 – 5 суток расправляется.
Затем проводим фиксацию стента к ушной раковине пациента за нить, выведенную через носовую хоану. Для этого вводим назальный катетер в глотку через носовой ход. С помощью зажима захватываем катетер и выводим его через рот. Используя проволочный крючок, проводим шелковую нить, выходящую изо рта, через назальный катетер. Проводим назальный катетер в пищевод по шелковой нити до контакта с верхним концом стента, это предотвращает раздражение слизистой оболочки носовой полости и пищевода шелковой нитью. Катетер, прикрывающий шелковую нить, фиксируем к ушной раковине пациента.
Стент сохраняем в просвете пищевода 1,5 - 2 месяца. В случае миграции в дистальные отделы желудочно-кишечного тракта (реканализации стриктуры ранее указанного срока) стент удаляем по требованию. Экспозиция стента в просвете пищевода 1,5 - 2 месяца является достаточной для заживления стриктуры, достижения надежной дилатации пищевода. На фоне длительного нахождения (более 2 месяцев) стента в просвете пищевода возникает грануляционный стеноз. Также постоянное воздействие эндопротеза на стенку пищевода приводит к нарушению микроциркуляции в пораженной части органа, дегенеративным, дистрофическим изменениям в слизистой оболочке [3, 4].
При использовании нитиноловых саморасправляющихся стентов применяли исключительно полностью покрытые конструкции с целью предотвращения врастания в окружающие ткани. На этапе освоения методики часто наблюдали миграцию стента в дистальные отделы желудочно-кишечного тракта. У 3 пациентов стент опустился в желудок и был извлечен ретроградно с помощью гибкой эндоскопии. Необходимо отметить возникшие сложности при извлечении стента, имеющего сегментарное строение – при потягивании за петлю для извлечения, уменьшаются в диаметре только проксимальная и дистальная часть конструкции, а сам стент на всем протяжении остается в раскрытом состоянии, что создает сложности для манипуляции в ограниченном пространстве. Как утверждает Ф.А. Черноусов и соавт. (2010), стенты имеющие сегментарное строение имеют особенность разрушаться в местах соединения сегментов и мигрировать частями, что невозможно контролировать [3, 5].
В наших наблюдениях у 1 больного стент мигрировал в дистальные отделы подвздошной кишки и вызвал пролежень последней в проекции проксимального и дистального концов стента (рис. 3), что потребовало выполнения оперативного вмешательства в экстренном порядке – выполнена лапаротомия, резекция участка подвздошной кишки с анастомозом конец в конец. Анализируя сроки миграции, мы выявили, что стенты дислоцировалась на 40 – 60 сутки с момента установления. По всей видимости, за этот промежуток времени стриктура полностью раскрывалась и реканализовалась.
Стентирование саморасправляющимися металлическими эндопротезами на длительный срок (от 6 до 16 месяцев) сопровождается тяжелыми осложнениями: сужением просвета пищевода выше и ниже стента или его полной облитерацией; разрастанием грануляционной ткани по краям стента, протяженной рубцовой стриктурой нижней трети пищевода; частичной фрагментацией стента. Постоянное длительное давление протеза приводит к его врастанию в стенку пищевода, ее некрозу и образованию пролежней [3, 6]. Приведенные негативные последствия могут повлечь за собой нежелательное или незапланированное хирургическое вмешательство, исход которого часто непредсказуем. Таким образом, риск возникновения осложнений от длительной экспозиции стента в просвете пищевода больше, чем польза от него. Также, немаловажным недостатком данного способа является отсутствие контроля за дислокацией стента в дистальные отделы желудочно-кишечного тракта.
Результаты
После извлечения нитиноловых конструкций у 12 (75%) больных достигнута стойкая ремиссия (срок наблюдения 3 года). Явлений дисфагии не отмечается. У 4 человек развился рецидив стриктуры, что явилось показанием к выполнению реконструктивной восстановительной операции.
Зачем делают стентирование пищевода?

Наиболее опасный клинический симптом при раке пищевода – дисфагия. Это состояние, при котором сужается просвет, пища и жидкость не могут попасть в желудок. Состояние очень тяжело переносится пациентами, в первую очередь морально. Болезнь развивается и перерастает в дистрофию, кахексию, приводит к летальному исходу.
На поздних стадиях развития рака провести операцию практически невозможно. Также нельзя устранить сужение оперативным способом в определенных случаях. Поэтому используется стентирование.
При данном методе в пищевод вводят специальное устройство – стент, который расширяет проход и выполняет роль каркаса.
Благодаря его установке восстанавливается нормальный пассаж твердой пищи и жидкости.
Как проходит стентирование пищевода

Главная задача стентирования пищевода - облегчить глотание.
Благодаря большой радиальной жесткости, стент выполняет роль каркаса и восстанавливает просвет. Стентирование пищевода проходит таким образом:
- Пациенту назначают проведение операции, предварительно собрав клинические анализы и сделав диагностику.
- Перед вводом стента врач делает разметку участка, где устройство должно раскрыться.
- Имплант обволакивают биологически инертной пленкой или другим материалом и погружают в организм.
- Через 2-5 дней стент полностью раскрывается.
В большинстве случаев стентирование пищевода проходит успешно и без осложнений. Пациент сразу чувствует себя гораздо лучше, возвращается к нормальному питанию и образу жизни.
Показаниями к стентированию пищевода являются:
- Сдавливание пищевода извне;
- Доброкачественные стриктуры пищевода, неразрешимые другими методами;
- Несостоятельность стенки пищевода при химических ожогах;
- Перфорация пищевода опухолевого генеза;
- Трахеореспираторные свищи;
После операции

Дома
Вы можете вернуться к привычному образу жизни (например водить машину и выйти на работу) через 24 часа после процедуры.
Следуйте приведенным ниже инструкциям по употреблению пищи и напитков в течение первых 2 дней после проведения процедуры.
- В день установки стента пейте жидкости. Также можно съесть суп, овсяную или манную кашу, но не ешьте твердую пищу.
- Не употребляйте алкогольные напитки в течение 24 часов после процедуры.
- Через день после процедуры можно начать есть мягкую пищу.
- Через два дня после процедуры разрешается твердая пища.
Прием пищи после установки пищеводного стента
- После возврата к обычному рациону питания кладите пищу в рот небольшими порциями. Всегда тщательно разжевывайте пищу, прежде чем проглотить ее.
- Запивайте еду жидкостью, чтобы облегчить прохождение пищи по стенту. Газированные напитки, например кока-кола или имбирный эль, также способствуют продвижению пищи.
- Всегда принимайте пищу в вертикальном (сидячем) положении. Пища будет легче проходить по пищеводу и стенту благодаря действию силы тяжести.
- Вы можете глотать таблетки или капсулы целиком. Проглотив их, выпивайте не менее 4 унций (120 мл) воды.
Профилактика рефлюкса
Рефлюкс - это жжение или ощущение сытости, поднимающееся из желудка. В целях профилактики рефлюкса попробуйте воспользоваться следующими рекомендациями.
Непроходимость пищевода – патологическое состояние, характеризующееся нарушением прохождения пищевых масс по пищеводу вследствие его стеноза, обтурации или внешней компрессии. В клинической картине преобладают нарушение глотания, повышенное слюноотделение, боли за грудиной и изжога, отрыжка воздухом и съеденной пищей, снижение веса. Для выявления данной патологии используют эзофагоскопию, эндоскопическую биопсию, рентгенографию пищевода, хромоскопию пищевода и желудка, эзофагеальную манометрию. Лечение зависит от этиологии процесса. Для восстановления проходимости используют эндопротезирование пищевода, эндоскопическое рассечение рубцов, бужирование пищевода и т. д.
МКБ-10
Общие сведения
Непроходимость пищевода является серьезным осложнением многих заболеваний, однако чаще всего к ней приводят несчастные случаи (преднамеренный или случайный прием кислот и щелочей как детьми, так и взрослыми) и злокачественные опухоли пищевода. Среди доброкачественных сужений пищевода преобладают ожоговые стриктуры (70%), при этом практически 90% пациентов с рубцами после ожогов составляют лица трудоспособного возраста. Увеличивается и количество пациентов, у которых злокачественные и доброкачественные опухоли пищевода впервые проявляются симптомами непроходимости. Несмотря на непрерывное совершенствование хирургических методов и все более широкое распространение малоинвазивных способов лечения непроходимости пищевода, данная проблема в гастроэнтерологии очень актуальна, поскольку частота критических стенозов пищевода остается стабильно высокой.
Причины
Непроходимость пищевода развивается в том случае, когда его просвет значительно сужен. По причине возникновения стеноза непроходимость пищевода может быть доброкачественной или злокачественной; обусловленной образованием колец пищевода или осложнениями других заболеваний.
Доброкачественная непроходимость пищевода обычно связана с формированием рубцовых стриктур в течение нескольких месяцев или лет после ожога данного органа. Наиболее тяжелые изменения в пищеводе возникают при приеме внутрь активной щелочи. Последствия ожога пищевода кислотой менее катастрофичны, рубцовые изменения не так выражены и легче поддаются коррекции, чем при воздействии щелочи. Достаточно частыми причинами непроходимости могут служить сдавление пищевода извне (опухолью средостения, аберрантными сосудами, увеличенными лимфатическими узлами и др.), доброкачественные опухоли пищевода с внутрипросветным ростом, пептическая язва, длительный воспалительный процесс (эзофагит).
Злокачественные стенозы развиваются на фоне рака пищевода, составляющего более 80% всех заболеваний этого органа и 4% всей онкопатологии. Рак пищевода находится на шестом месте среди всех злокачественных опухолей, является второй по значимости причиной формирования непроходимости пищевода.
Кольца пищевода представляют собой доброкачественные, гладкие, узкие концентрические выпячивания ткани в просвет пищевода. Кольца могут содержать в себе три слоя: слизистый, подслизистый и мышечный. Кольцо пищевода типа А рассматривается как особенность строения органа, чаще всего клинических проявлений не имеет и является случайной находкой во время обследования по поводу других заболеваний. Точная причина возникновения колец пищевода типа В (кольца Шацки) до сих пор неизвестна, хотя чаще всего их появление связывают с нарушением моторики пищевода и гастроэзофагеальным рефлюксом. Кольца типа В могут выявляться у 6% взрослых людей, чаще всего у пациентов после 50 лет. Они долгое время никак не проявляются, однако при формировании нескольких колец, значительном сужении просвета пищевода в месте их локализации возникает выраженная дисфагия и боль, когда пищевой комок задерживается между двумя кольцами и растягивает пищевод.
Одна из самых редких причин непроходимости пищевода – безоар. Безоары формируются в пищеводе или желудке пациентов (в основном – старческого возраста) из растительных волокон, волос, принимаемых лекарств и др. Формирование безоаров происходит из-за нарушения секреции и перистальтики пищевода, вследствие чего образуется плотный комок, перекрывающий просвет органа. При общей дисфункции пищеварительного тракта безоары могут мигрировать в пищевод из желудка и даже из тонкого кишечника. На сегодняшний день в литературе описаны единичные случаи выявления безоаров пищевода.
Симптомы непроходимости пищевода
Первым и основным симптомом непроходимости пищевода обычно выступает нарушение глотания – дисфагия. Степень выраженности этого симптома значительно варьирует в зависимости от уровня стеноза пищевода и консистенции принимаемой пищи. Жидкая пища и вода могут безболезненно и беспрепятственно проникать в желудок, вызывая незначительные ощущения дискомфорта за грудиной. При приеме твердой и плотной пищи дисфагия значительно выражена, сопровождается сильной загрудинной болью и рвотой. Симптоматика дисфагии развивается исподволь, постепенно приводит к тому, что больной может принимать только жидкую пищу и полностью отказывается от другой еды, с чем и связано значительное исхудание на фоне непроходимости пищевода. Кроме дисфагии и загрудинных болей, пациента могут беспокоить отрыжка, гиперсаливация, жжение за грудиной.
Для колец пищевода характерна несколько иная симптоматика. Постоянная дисфагия нетипична; эпизоды нарушения глотания встречаются редко – между двумя случаями могут пройти месяцы, иногда годы. Жидкая пища и вода беспрепятственно продвигаются по пищеводу и не вызывают никаких неприятных ощущений. Сам приступ дисфагии обычно очень короткий. Чаще всего при задержке пищи между двумя кольцами ликвидировать неприятные симптомы помогает рвота, после которой пациент может спокойно продолжать принимать пищу без всяких неприятных ощущений. Дисфагия у пациентов с пищеводными кольцами возникает преимущественно на фоне приема свежеиспеченного хлеба и жареного мяса.
Механическую непроходимость пищевода дифференцируют с функциональными расстройствами (ахалазия - диффузный тонический спазм мускулатуры пищевода), истерическими припадками, паническими атаками, психиатрической патологией.
Диагностика
Консультация гастроэнтеролога требуется для проведения первичной диагностики непроходимости пищевода. После установления окончательного диагноза пациент направляется в отделение хирургии. Выявление рубцовых изменений, стриктур и стенозов производится с помощью рентгенографии пищевода с контрастированием. Консультация врача-эндоскописта нужна для назначения и проведения эзофагоскопии, выявления и верификации непосредственных причин непроходимости пищевода (опухолей, специфических заболеваний, инородных тел и др.). Также для диагностирования опухоли пищевода большое значение имеют компьютерная томография ОГК с контрастированием, эндосонография пищевода.
При подозрении на рак пищевода может потребоваться эндоскопическая биопсия, хромоскопия пищевода и желудка. При системных заболеваниях, подозрении на ахалазию кардии показана эзофагеальная манометрия. При наличии у больного специфических заболеваний (сифилис, туберкулез, склеродермия) план обследования соответствует выявленной патологии.
Лабораторные анализы при непроходимости пищевода отражают патологические изменения, вызванные основным заболеванием. В биохимическом анализе крови может отмечаться анемия, снижение уровня общего белка и нарушение соотношения белковых фракций, гиповитаминоз, признаки гиперкатаболизма.
Лечение непроходимости пищевода
Лечение пациентов с доброкачественной непроходимостью пищевода осуществляется в отделении хирургии, при наличии рака пищевода пациент может находиться в отделении гастроэнтерологии или онкологии. Схема лечения непроходимости пищевода зависит от причины данной патологии.
При доброкачественной непроходимости пищевода предпочтительно использовать эндоскопическое расширение стеноза пищевода, эндоскопическое бужирование стенозированного участка. В последние годы широко применяются такие методики, как эндоскопическое рассечение рубцовой стриктуры пищевода, а при тяжелых формах непроходимости - эндопротезирование (стентирование) пищевода. Для восстановления проходимости пищевода может потребоваться извлечение инородного тела, оперативное удаление опухоли, кисты пищевода. Также проводится консервативное либо оперативное лечение заболевания, которое привело к сдавлению пищевода извне.
Злокачественные формы непроходимости пищевода требуют проведения патогенетического лечения: лучевой либо химиотерапии, хирургического удаления опухоли с последующей эзофагопластикой. Консервативные мероприятия включают в себя нормализацию уровня основных нутриентов в крови, электролитов. При необходимости корректируется питание, назначаются препараты для лечения анемии.
Прогноз и профилактика
Прогноз непроходимости пищевода варьирует в зависимости от этиологии заболевания, возможности осуществления альтернативных методов питания. Доброкачественные формы непроходимости пищевода имеют лучший прогноз и легче поддаются лечению, чем непроходимость пищевода, вызванная прогрессированием раковой опухоли. Специфической профилактики непроходимости пищевода не существует. Для предотвращения данного состояния следует избегать этиологических и патогенетических факторов непроходимости пищевода.
Читайте также:


