Склеродермия при сахарном диабете
Обновлено: 18.04.2024
Склеродермия у детей – второе заболевание по частоте встречаемости среди диффузных заболеваний соединительной ткани у детей, в основе его лежит поражение соединительной ткани с преобладанием фиброза и сосудистая патология по типу своеобразного облитерирующего эндартериита.
Это заболевание в детском возрасте чаще регистрируют у девочек, чем у мальчиков.
Виды склеродермии
Что провоцирует / Причины Склеродермии у детей:
Причина заболевания до сегодняшнего дня остаются загадкой для исследователей. В развитии заболевания могут быть два механизма: иммунный и сосудистый. При иммунном антитела к коллагену образуются вследствие цикличного аутоиммунного процесса, который бывает также при других диффузных болезнях соединительной ткани у детей и взрослых. Если говорить о сосудистом механизме, тут роль играют измененные эндотелиальные клетки. Исследователи говорят также о том, что могут развиваться сразу два механизма.
Патогенез (что происходит?) во время Склеродермии у детей:
При системном виде склеродермии у детей избыточно образуются и откладываются коллаген и другие белки межклеточного вещества в коже и других органах.
Поражение сосудов
Фиброз при системном виде заболевания развивается после поражения мелких артерий, капилляров кожи, почек, желудочно-кишечного тракта, легких и сердца ребенка. Кровоток нарушается, возникает синдром Рейно, который считается вв большинстве случаев первым признаком болезни. После повреждения эндотелия и базальной мембраны утолщается интима, сужается и зарастает просвет сосудов.
Выше описанные симптомы прогрессируют, потому количество мелких сосудов становится всё меньшим. Вследствие этого возникает хроническая ишемия кожи и внутренних органов. При капилляроскопии ногтевых валиков фиксируют уменьшение числа капилляров, а также расширение и извитость оставшихся капилляров. Непораженные капилляры разрастаются, появляются телеангиэктазии.
Поражение эндотелия
При системной склеродермии поражение эндотелия может быть спровоцировано разными факторами. В сыворотке в некоторых случаях есть гранзим А–фермент, который приводит к повреждению базальной мембраны сосудов. В других случаях сыворотка повреждает эндотелий.
Сосудистый спазм
Вслед за ним восстановление кровотока может запускать механизмы, приводящие к фиброзу и окклюзии сосудов. В развитии сосудистого спазма играют немалую роль вазоактивные вещества.
Поражение чувствительных нервов
Этот фактор также ведет к спазму сосудов, поскольку вызывает нехватку сосудорасширяющих нейропептидов. Во многих случаях поражение эндотелия сопровождается повышением уровня фактора свертывания VIII и фактора фон Виллебранда в сыворотке.
Иммунные нарушения при системной склеродермии
В развитии фиброза при системной склеродермии у детей играет роль нарушение клеточного иммунитета. Основная роль принадлежит Т-хелперам. Иммунорегуляторный индекс в крови больного ребенка, который определяется соотношением лимфоцитов CD4 и CD8, выше нормы.
В патогенезе играют роль молекулы адгезии, которые опосредуют взаимодействие Т-лимфоцитов с эндотелием. В сыворотке крови повышен уровень ИР-1 и ФНОа, что может говорить про активацию моноцитов. Наряду с множеством других функций эти цитокины обладают способностью активировать фибробласты. Фиброз кожи может возникать также с участием тучных клеток. В дерме обнаруживают повышенное их содержание, причем даже вне очага поражения. Одной из причин дегрануляции тучных клеток может быть их взаимодействие с активированными Т-лимфоцитами.
При системной склеродермии у детей есть нарушения не только клеточного, но также гуморального иммунитета. У подавляющего большинства больных в сыворотке крови обнаруживают антинуклеарные антитела.
Нарушение функции фибробластов
В культуре фибробластов, выделенных из пораженных участков кожи больных при системной склеродермией, продолжается избыточный синтез коллагена. У больных системной склеродермией коллаген VII типа располагается по всей толще дермы, что нормой не является. Предполагают, что это является причиной уплотнения кожи и спаянности ее с тканями, которые лежат на более глубоких уровнях.
Фибробласты, которые находятся в пораженных и непораженных участках кожи ребенка, несут рецепторы тромбоцитарного фактора роста, что также нормой не является. Более чем у 90% больных системной склеродермией возникают хромосомные аномалии:
- кольцевые хромосомы
- ацентрические фрагменты
- разрывы хроматид
Патологическая анатомия системной склеродермии
Кожа
В начале заболевания в коже повышено содержание моноцитов, Т-лимфоцитов, тучных и плазматических клеток. Далее эпидермис становится всё тоньше, параллельно ему в дерме находятся утолщенные гомогенные пучки коллагена. Они врастают в подкожную клетчатку, что становится причиной спаянности с подлежащими тканями. Придатки кожи атрофируются, исчезают межсосочковые клинья эпидермиса.
ЖКТ
В желудочно-кишечном тракте фиброз выражен не так ярко, как в коже. Становится очень тонкой слизистая средней и нижней третей пищевода, в слизистом слое количество коллагена выше нормы. Поражается мышечная оболочка пищевода и прочих отделов желудочно-кишечного тракта. Вследствие истончения слизистой возникают язвы. На поздних стадиях склеродермии происходит дилатация пораженных участков ЖКТ.
Легкие
Появляется диффузный интерстициальный и перибронхиальный фиброз, усиливается пролиферация эпителия бронхов, утолщаются стенки альвиол. Разрыв стенок альвеол может приводить к появлению мелких кист и буллезной эмфиземе легких.
Опорно-двигательиый аппарат
Обнаруживается отек синовиальной оболочки, если есть артрит, также она инфильтруется лимфоцитами и плазматическими клетками. Фибрин откладывается в толще синовиальной оболочки, на ее поверхности, на сухожильных влагалищах. На более поздних стадиях болезни может быть фиброз синовиальной оболочки.
Миопатия
При системном виде склеродермии проявляется интерстициальная и периваскулярная лимфоцитарная инфильтрация, дегенерация мышечных волокон и интерстициальный фиброз. Может быть и утолщение стенок артериол, уменьшение количества капилляров.
Сердце
В миокарде фиксируют дегенерацию кардиомиоцитов и интерстициальный фиброз, который выражен больше всего вокруг сосудов. Фиброз проводящей системы сердца вызывает АВ-блокаду и аритмии.
Почки
При системной склеродермии почти поражены более чем у 50% больных детей. Гистология показывает гиперплазию интимы междольковых артерий, фибриноидный некроз клубочков и приносящих артериол и утолщение базальной мембраны клубочков. Может быть также гломерулосклероз и мелкие инфаркты в корковом веществе почек. Если при склеродермии у ребенка есть синдром Рейно, то снижен почечный кровоток.
Другие органы
При рассматриваемом заболевании печень поражена в редких случаях. Но может развиваться первичный билиарный цирроз печени. Фиброз щитовидной железы может возникать как на фоне хронического лимфоцитарного тиреоидита, так и в его отсутствие.
Симптомы Склеродермии у детей:
Очаговая склеродермия
Для бляшечной формы в начале болезни появляются желтовато-розовые эритематозные бляшки, которые потом становятся очаговыми поражениями – твердыми, восковидными или приобретают оттенок слоновой кости, могут иметь ободок фиолетового цвета. Чаще всего такие очаги располагаются на руках, ногах, торсе.
Для линейной склеродермии в начале болезни типичный такой же (выше описанный) характер изменений в коже. Но в скором времени появляется линейная конфигурация. выглядит она как широкая полоса, располагается часто вдоль сосудисто-нервного пучка любой из конечностей. Склеродермия может проявляться на лбу и волосистой части головы, что называется «удар саблей». При линейной склеродермии у детей поражается не только кожа, но и ткани, которые находятся под ней, что становится причиной больших деформаций. При поражении лица и головы может быть такие увеит и эпилептические припадки у ребенка.
Помимо поражений кожи, также могут быть артриты с утренней скованностью, ограничением движений, но при них воспалительные изменения не выражены. При очаговой форме склеродермии может быть синдром Рейно.
Системная склеродермия
Эта форма заболевания в детском возрасте встречается в крайне редких случаях. Сначала всегда проявляется синдром Рейно с продолжительностью от 2 месяцев до 3-4 лет. Среди других проявлений выделяют:
- парастезии конечностей, торса, лица
- чувство онемения
- «необоснованная лихорадка», сначала субфебрильная
- контрактура пальцев рук
- скованность в кистях
- дискомфорт в суставах
- уменьшение массы тела
Со временем развивается диффузное поражение всех кожных покровов, при котором могут появляться телеангиоэктазии и подкожные кальцификаты. Раньше всего в большинстве случаев происходит поражение кожи лица и рук, а потом оно охватывает шею, живот, грудь и ноги. Почти всегда поражаются и внутренние органы. В пищеводе развивается эзофагит. Изменения в сердце проявляются перикардитом или миокардитом.
Диагностика Склеродермии у детей:
Если у ребенка типичные для склеродермии изменения кожи, диагностика труда не составляет. Следует отличать заболевание от таких синдромов: синдром Бушке, Чайна, а также от эозинофильного фасциита. В диагностики помогает одномоментное развитие индуративного отека шеи, лица, плечей с обратным развитием без атрофии кожи.
Лечение Склеродермии у детей:
Основная терапия заключается в местном применении средств для улучшения микроциркуляции. Врачи могут приписать ребенку димексид, гепариновую мазь или демиксид + гепарин. При наличии синдрома Рейно врачи могут назначить больному антиагреганты — аспирин в дозах 10-15 мг/кг массы тела в сутки, курантил, препараты с содержанием никотиновой кислоты, нифедипин.
Если изменения кожи при склеродермии у детей прогрессируют, врачи назначают глюкокортикоиды в умеренной дозировке – из расчета 0,5 мг на 1 кг массы тела в сутки. Могут быть назначен D-пеницилламин, в аналогичной дозировке, как при ЮХА. Лечение системной склеродермии не обходится без использования ГКС из расчета 0,5-1 мг /кг массы тела в сутки, D-пеницилламина. В последние годы всё с большим успехом начинают применять метотрексат.
Профилактика Склеродермии у детей:
Профилактика склеродермии у детей заключается в оберегании кожи от отморожений, избежании травмирования кожи и слизистых, от ожогов. Ребенок должен как можно меньше нервничать. При диагностировании склеродермии у ребенка он должен постоянно находиться под диспансерным наблюдением.
К каким докторам следует обращаться если у Вас Склеродермия у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Склеродермии у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
ФГБУ "Эндокринологический научный центр" Минздрава России, Москва
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», Москва, Россия
Эндокринологический научный центр, Москва
Сочетание липоатрофического сахарного диабета с системной склеродермией и фенилкетонурией
Журнал: Проблемы эндокринологии. 2017;63(2): 130‑133
ФГБУ "Эндокринологический научный центр" Минздрава России, Москва
Впервые описана редкая форма липоатрофического сахарного диабета у ребенка с парциальной аутоиммунной липодистрофией в сочетании с системной склеродермией и фенилкетонурией. Рассмотрены особенности клинических проявлений, диагностики и терапии. Для исключения моногенной формы липодистрофии проведен молекулярно-генетический анализ генов ZMPSTE24, LMNA, BSCL2, PLIN1, PTRF, LMNB2, POLD1, AKT2, CIDEC, PIK3CA, PPARG, PSMB8, CAV1, PPP1R3A, AGPAT2, ответственных за развитие липодистрофии и инсулинорезистентности, который не выявил мутаций. Наличие у пациентки системной склеродермии, имеющей аутоиммунный генез, позволяет диагностировать аутоиммунную форму липодистрофии. Лечение инсулинорезистентного сахарного диабета при липодистрофиях представляет большие сложности: из-за нарушений функций печени лечение бигуанидами опасно, а инсулинотерапия недостаточно эффективна; требуется назначение высоких доз. Наличие фенилкетонурии еще больше затрудняет соблюдение диетического режима. Сочетание у одной пациентки трех редких заболеваний — липоатрофического диабета, фенилкетонурии, системной склеродермии — не встречалось в доступной нам литературе.
ФГБУ "Эндокринологический научный центр" Минздрава России, Москва
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», Москва, Россия
Эндокринологический научный центр, Москва
Липодистрофии представляют собой гетерогенную группу заболеваний, характеризующуюся полным или частичным отсутствием жировой ткани, выраженной дислипидемией и жировым гепатозом, уменьшением уровня гормонов адипоцитов — лептина и адипонектина [1—4]. Несмотря на манифестацию в разном возрасте, клиническая картина заболевания схожа. Кроме потери жировой ткани, заболевание проявляется выраженной инсулинорезистентностью, диабетом, триглицеридемией и стеатогепатитом [5—7].
Выделяют наследственную и приобретенную формы заболевания. При наследственных формах липодистрофии возможен отягощенный семейный анамнез, при генетическом обследовании находят мутации в ряде генов: AGPAT2, BSCL2, CAV1, PTRF, LMNA, PPARG, PLIN1, AKT2, CIDEC, кодирующих различные звенья липогенеза. Возможен как рецессивный, так и доминантный пути наследования [5—11].
При отсутствии генетических мутаций, а также при наличии у пациента других аутоиммунных заболеваний и сниженного уровня компонентов системы комплимента С3 и С4 предполагается преимущественно аутоиммунный генез заболевания [2, 5]. И при наследственной, и при приобретенной липодистрофии в зависимости от распределения подкожно-жировой клетчатки выделяют генерализованную [1, 8, 10] и парциальную [1, 12—15] формы.
Липодистрофии относят к редким заболеваниям. Частота встречаемости 1:10 000 000—15 000 000 человек. В литературе имеются немногочисленные их описания [1, 2, 4—6, 8, 10, 11, 13]. Приводим случай парциальной формы липодистрофии в сочетании с системной склеродермией и фенилкетонурией.
Описание случая
В ФБГУ ЭНЦ из Института ревматологии направлена пациентка Ю., 12 лет, с нарушением углеводного обмена. Из анамнеза известно, что с 1,5 мес жизни установлен диагноз фенилкетонурии, подтвержденный генетически (R261Q/R408W). Пациентка находилась на специальной диете. В возрасте 1 года 2 мес диагностирована системная склеродермия. Получала лечение пеницилламином, преднизолоном, нестероидными противовоспалительными средствами. C 11 лет отмечается ремиссия заболевания.
С 9 лет наблюдается гастроэнтерологом с диагнозом реактивный гепатит в связи с повышением в 5 раз уровня трансаминаз, увеличением размеров и гиперэхогенностью печени (по данным УЗИ). Аутоиммунный и инфекционный генез гепатита был исключен. В 12 лет впервые выявлено повышение гликемии натощак до 6,73 ммоль/л. При ОГТТ диагностирована нарушенная толерантность к глюкозе. Диету не соблюдала. В 12,5 года впервые обследована в НИИ ревматологии, где выявлена гликемия натощак — 7,81 ммоль/л, в течение суток колебания гликемии от 5,3 до 14,6 ммоль/л. Гликированный гемоглобин 9,4%, инсулин 89 мкЕд/мл (норма 3,0—25,0), С-пептид 10,1 нг/мл (норма 1,1—4,4).
При первичном осмотре в ФГБУ ЭНЦ: рост 162 см, SDS роста 1,4. Масса тела 45 кг, ИМТ 17 кг/м, SDS ИМТ –0,5. Подкожно-жировая клетчатка полностью отсутствует в области туловища, конечностей и сохранена на лице, шее (рис. 1—3). Курчавые волосы (с 5 лет). Распространенная депигментация на передней поверхности грудной клетки, шеи, дистрофические изменения кожи дистальных отделов конечностей (см. рис. 1—3). Скованность суставов кистей. Тоны сердца звучные, тахикардия до 100 уд/мин. В легких дыхание везикулярное, хрипов нет. Живот увеличен в объеме. Печень выступает на 2 см из-под края реберной дуги, край плотный, безболезненный. Половое развитие: Таннер 2. При обследовании: гипертриглицеридемия до 3,5 (норма 0,1—1,7) ммоль/л при нормальном уровне холестерина, АЛТ 119,7 Ед/л (норма 0—41), АСТ 90,4 Ед/л (норма 0—38). ОГТТ: гликемия 0—60—120 мин: 6,4—15,6—13,7 ммоль/л соответственно; ИРИ 0—60—120 мин: 91,87—479,4—698,8 мкмоль/мл, С-пептид: 9,27—21,57—26,3 нг/мл соответственно. Индекс HOMA 27,1 (норма <3,2), Caro 0,07 (норма >0,3).

Рис. 1. Больная Ю., 12 лет, внешний вид.

Рис. 2. Больная Ю., нижние конечности.

Рис. 3. Больная Ю., кисти руки.
Таким образом, при обследовании диагностирован инсулинрезистентный сахарный диабет. При молекулярно-генетическом анализе не выявлены мутации в генах ZMPSTE24, LMNA, BSCL2, PLIN1, PTRF, LMNB2, POLD1, AKT2, CIDEC, PIK3CA, PPARG, PSMB8, CAV1, PPP1R3A, AGPAT2 (анализ проведен на панели custom Ampliseq_IR_LD (инсулинорезистентность, липодистрофии) в лаборатории наследственных эндокринопатий ФГБУ ЭНЦ (руководитель — проф. А.Н. Тюльпаков).
По данным эугликемического гиперинсулинемического КЛЭМП теста, М — 1,38, что соответствует выраженной инсулинорезистентности. Протонная МР-спектроскопия печени подтвердила наличие жирового гепатоза.
Назначена диетотерапия с исключением легкоусвояемых углеводов и жиров животного происхождения, на фоне которой в течение 2 нед стационарного лечения уровень глюкозы составлял 5,0—8,0 ммоль/л, однако после выписки гликемия возросла до 10—14 ммоль/л, в связи с чем по месту жительства был назначен метформин в дозе 850 мг 2 раза в день с хорошим эффектом. Уровень трансаминаз оставался прежним. Через 6 мес после начала терапии — гликированный гемоглобин 6,7%, инсулин 44,8 мкЕд/мл, индекс НОМА 14, АЛТ 108,5 Ед/л, АСТ 58 Ед/л. Однако через год терапии уровень АЛТ повысился до 415 Ед/л, АСТ до 120 Ед/л. При приеме гепатопротекторов уровень трансаминаз оставался высоким, в связи с чем доза метформина была снижена до 1000 г в сутки. Уровень гликированного гемоглобина через 5 мес повысился до 9,8%. При повторном поступлении в ФГБУ ЭНЦ бигуаниды были отменены, начата инсулинотерапия в интенсифицированном режиме. Суточная доза инсулина (Хумалог + Левемир) постепенно была повышена до 1,8 ед/кг, однако компенсации достичь не удавалось. При переводе на помповую инсулинотерапию суточная доза инсулина была снижена до 1,3 ед/кг веса в сутки. Учитывая снижение уровня трансаминаз, через 2 нед после госпитализации к терапии был вновь добавлен метформин в дозе 250 мг 2 раза в сутки, на фоне чего наблюдалось улучшение компенсации углеводного обмена и отсутствие гепатотоксичности. Выписана с дозой инсулина 1,1 ед/кг в сутки. Гликемия от 5,0 до 12 ммоль/л. Из-за материальных трудностей в покупке расходных материалов помпа была снята через 3 мес.
При следующей госпитализации пациентка поступила на терапии инсулином Хумалог перед основными приемами пищи в дозе 20 ед. 3 раза в день. Гликированный гемоглобин 8,2%, АЛТ 218 Ед/л, АСТ 93 Ед/л. При выписке: АЛТ 144 Ед/л, АСТ 47 Ед/л. Переведена на инсулин Лантус в дозе 30 ед. в сутки, метформин 250 мг 2 раза в день. Достигнута компенсация углеводного обмена. При последней госпитализации в марте 2017 г. HbA1c 9,9%, ТГ до 11,3 ммоль/л, АЛТ 289 Ед/л, АСТ 154 Ед/л. Вновь госпитализирована на инсулинотерапии Лантус 30 ед. в сутки, метформин 250 мг 2 раза в день, гликемия при поступлении от 8,0 до 17 ммоль/л. Пациентка не комплаентна, нарушает диету. На фоне диетотерапии уровень трансаминаз снизился (АЛТ 175 Ед/л, АСТ 75 Ед/л) и улучшились показатели углеводного обмена. Динамика лабораторных показателей представлена в таблице.

Динамика лабораторных показателей
Парциальная семейная форма липодистрофии (синдром Даннигана—Кобберлинга) впервые описана M. Dunnigan и соавт. в 1964 г. В 1975 г. J. Kobberling описал данную форму липодистрофии в книге по генетике сахарного диабета [12, 13, 15].
Приобретенная парциальная форма липодистрофии с характерным уменьшением подкожно-жировой клетчатки лица и туловища и нормальным или увеличенным ее объемом в области таза и ног впервые описана испанским врачом R. Barraquer и немецким врачом A. Simons в начале ХХ века [14].
В нашей стране первое подробное клиническое описание липодистрофий принадлежит Н.Т. Старковой и Е.К. Летовой [1].
С развитием молекулярной генетики появилась возможность разделить врожденную и приобретенную (аутоиммунную) форму липодистрофии.
В нашем случае отсутствие отягощенной наследственности и мутаций в вышеперечисленных генах, а также наличие аутоиммунного заболевания (системной склеродермии) позволяет предположить аутоиммунный генез липодистрофии.
Верификация диагноза парциальной липодистрофии у данной пациентки имела определенные сложности, поскольку клинические проявления склеродермии в некоторой степени напоминают симптоматику парциальной липодистрофии (сходные изменения кожных покровов). Диагноз парциальной формы липодистрофии установлен пациентке в 12 лет, со времени появления сахарного диабета, однако повышенный уровень трансаминаз и триглицеридемия выявлены с 9 лет. Отсутствие подкожно-жировой клетчатки на туловище и конечностях расценивалось как склеродермическое поражение.
Заключение
Лечение сахарного диабета при липодистрофиях представляет большие сложности. Из-за нарушения функции печени лечение бигуанидами ограничено, а инсулинотерапия требует больших доз и достаточной комплаентности пациентов. Наличие фенилкетонурии еще больше затрудняет соблюдение диеты. Данное наблюдение представляет значительный интерес в связи с сочетанием трех редких заболеваний и их взаимных влияний на клинические проявления и особенности терапии.
В настоящее время для лечения генерализованной формы липодистрофии используют генно-инженерный препарат метрилептин, однако при парциальной форме он неэффективен [9].
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Согласие пациента. Пациентка и ее мама добровольно подписали информированное согласие на публикацию персональной медицинской информации в обезличенной форме (именно в этом журнале).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Благодарности. Тюльпакову Анатолию Николаевичу, профессору, руководителю лаборатории наследственных эндокринопатий ФГБУ ЭНЦ.
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ "Эндокринологический научный центр" Минздравсоцразвития России, Москва
Случай сочетания сахарного диабета 1-го типа и системной склеродермии у девочки 13 лет
Журнал: Проблемы эндокринологии. 2018;64(4): 231‑234
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
Системная склеродермия — аутоиммунное заболевание соединительной ткани неизвестной этиологии, характеризующееся индуративными изменениями кожи, поражением опорно-двигательного аппарата, внутренних органов, синдромом Рейно. Важным звеном патогенеза cистемной склеродермии является нарушение микроциркуляции с пролиферацией и деструкцией эндотелия, утолщением стенок и сужением просвета микрососудов, вазоспазмом, агрегацией форменных элементов, стазом, деформацией и редукцией капиллярной сети (облитерирующая микроангиопатия). Различают две основных формы заболевания — диффузную и ограниченную (локализованную). Системный характер диффузной формы наиболее очевиден в коже, однако также вовлекаются желудочно-кишечный тракт, органы дыхания, почки, сердечно-сосудистая, эндокринная, опорно-двигательная и мочеполовая системы. Заболеваемость системной склеродермией составляет 6,3—12 случаев на 1 млн населения. В литературе существуют единичные случаи описания сочетания склеродермии с другими аутоиммунными заболеваниями. В данной статье описан редкий случай сочетания двух аутоиммунных заболеваний — сахарного диабета 1-го типа и системной склеродермии у подростка 13 лет.
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ "Эндокринологический научный центр" Минздравсоцразвития России, Москва
Системная склеродермия — прогрессирующее гетерогенное заболевание, встречающееся в различных формах — от ограниченного поражения кожи до диффузного кожного склероза и вовлечения внутренних органов. Возможно и молниеносное течение болезни. Причина склеродермии неизвестна. Болезнь не наследуется, однако к ней имеется генетическая предрасположенность. Как и при сахарном диабете 1-го типа (СД1), при системной склеродермии обнаруживается ассоциация с маркерами HLA II класса [1, 2].
Основу патогенеза системной склеродермии составляют нарушения иммунитета, фиброзообразования и микроциркуляции, взаимодействующие на уровне клеточных (иммунокомпетентные клетки — фибробласты — эндотелий — клетки крови) и рецепторно-лигандных систем (молекулы адгезии, факторы роста, интерлейкины и др.). Системная склеродермия характеризуется широким спектром нарушений клеточного и гуморального иммунитета, включая появление антицентромерных (АЦА), антитопоизомеразных (АТА) или анти-СКЛ-70 и анти-РНК-антител, а также антинейтрофильных цитоплазматических (АНЦА), антиэндотелиальных антител, антител к различным компонентам соединительной ткани и др. Изменения метаболизма соединительной ткани с повышенным коллаген- и фиброзообразованием определяют нозологическую специфику заболевания.
Важным звеном патогенеза cистемной склеродермии является нарушение микроциркуляции с пролиферацией и деструкцией эндотелия, утолщением стенки и сужением просвета микрососудов, вазоспазмом, агрегацией форменных элементов, стазом, деформацией и редукцией капиллярной сети (облитерирующая микроангиопатия) [2, 3].
Различают две основных формы заболевания [1, 2, 4]: диффузную и ограниченную (локализованную).
Локализованная склеродермия чаще наблюдается на локтях и коленях, но могут вовлекаться лицо и шея. Внутренние органы при этом не поражаются. Болезнь имеет доброкачественное течение с вовлечением только кожи. Синонимом такого состояния является линейная склеродермия.
Диффузная склеродермия проявляется утолщением кожи на туловище и конечностях, выше локтей и колен, а также вовлечением лица. Встречаются редкие случаи типичного для склеродермии поражения внутренних органов при неизмененной коже.
Описание случая
В отделение сахарного диабета Института детской эндокринологии ФГБУ ЭНЦ направлена пациентка В., 13 лет, с жалобами на нестабильные показатели гликемии (колебания от 3 до 15 ммоль/л и более), изменение кожи и подкожной жировой клетчатки на внутренней поверхности левого бедра.
Анамнез заболевания
Больна СД1 в течение 7 лет (с ноября 2009 г.). Манифестация классическая (полиурия, полидипсия, снижение массы тела). СД1 диагностирован в больнице по месту жительства при наличии кетоза и гликемиии 24 ммоль/л. Назначена инсулинотерапия Детемир+Апидра. После госпитализации в ФБГУ ЭНЦ в апреле 2014 г. девочка переведена на помповую инсулинотерапию — помпа Accu Chek Combo (инсулин — Апидра). Однако через 2 мес помпа была снята в связи нежеланием девочки использовать данный вид терапии из-за дискомфорта при ношении. За все время заболевания тяжелых гипогликемий и эпизодов кетоацидоза не отмечалось.
Динамика HbA1c: 02.2010 — 8,3%; 11.2011— 7,6%; 07.2012 — 8,5%; 01.2013 — 10,0%; 12.2013 — 10,9%; 04.2014 — 9,3%; 09.2016 — 10,2%.
В январе 2016 г. на фоне декомпенсации углеводного обмена отмечено появление гематомы на внутренней поверхности левого бедра после травмы (удар мячом во время игры в футбол). В дальнейшем появилась зона мышечной атрофии (минус ткань) и гиперпигментации кожи. В настоящее время на фоне регулярных физических нагрузок отмечено некоторое снижение выраженности атрофии.
В последнее время колебания гликемии от 4 до 15 и более ммоль/л, контроль гликемии до 5 раз в сутки, дневник самоконтроля девочка ведет, подсчету хлебных единиц обучена. Коррекция инсулинотерапии не проводится. Инсулинотерапия на момент поступления: Апидра + Детемир в суточной дозе 33 Ед (0,77 Ед/кг/сут).
В ФГБУ ЭНЦ поступила повторно с целью коррекции терапии, скрининга осложнений и определения дальнейшей тактики ведения в отношении имеющихся кожных изменений.
Результаты физикального, лабораторного и инструментального исследования
Физикальное обследование. Рост 149 см. (SDS –0,98). Масса тела 42,8 кг. ИМТ 19,28 кг/м² (SDS +0,18).
Кожные покровы обычной окраски, умеренной влажности, патологических высыпаний нет. В местах инъекций (передняя брюшная стенка, плечи) — липодистрофии по гипертрофическому типу. Подкожная жировая клетчатка развита умеренно, распределена равномерно.

На внутренней поверхности левого бедра и голени отмечается линейный очаг глубокой атрофии кожи и подкожной клетчатки, переходящей в область индурации. Гиперпигментации кожи, фиброз в области левого коленного сустава в верхней трети голени. Сгибательная контрактура в левом коленном суставе. Сгибание ограничено (см. рисунок). Линейный очаг глубокой атрофии кожи и подкожной клетчатки, переходящей в область индурации, на внутренней поверхности левого бедра и голени.
Лабораторно-инструментальное обследование. HbA1c — 11,7%. СОЭ — 29 мм/ч., дислипидемия. Консультация офтальмолога: OU — осложненная катаракта. Эхографические признаки гепатомегалии и диффузных изменений поджелудочной железы. При трехкратном исследовании мочи (разовая порция) выявлено повышение уровня альбумина до 26—56 мг/л (норма 0—20 мг/л) и соотношения альбумин/креатинин до 5,05—5,7 мг/ммоль (норма 0—3,5 мг/ммоль). Рентгенография коленных суставов: равномерный пороз суставных концов, больше слева, протяженно в диафизах. Асимметрия суставных щелей, больше слева. Суставные поверхности четкие. В трубчатых костях структурных изменений не выявлено. Кортикальный слой четкий.
На основании клинической картины у девочки была заподозрена системная склеродемия, диагноз которой был подтвержден в детском ревматологическом отделении Университетской детской клинической больницы 1-го МГМУ им. И.М. Сеченова, куда пациентка была переведена для дальнейшего лечения. Диагноз основной: СД1, стадия компенсации. Диабетическая нефропатия в стадии микроальбуминурии. OU — осложненная катаракта.
Диагноз сопутствующий: системная склеродермия, гемиформа с поражением левой нижней конечности, стадия глубокой атрофии и фиброза, периартрит левого коленного сустава, контрактура.
Проведена пульс-терапия солу-медрол 375 мг № 3. В дальнейшем — метипред 16 мг/сут, метотрексат 15 мг/нед в комбинации с фолиевой кислотой 1 мг/сут.
За время наблюдения состояние стабильное. Самочувствие улучшилось. При повышении гликемии (максимально до 19,6 ммоль/л) при первом пульсе глюкокортикоидов проводилась коррекция инсулинотерапии. На фоне проведенного лечения была купирована сгибательная контрактура и улучшено сгибание в коленном суставе. Уплотнения на пораженных участках кожи стали менее выраженными. На момент выписки суточная доза инсулина увеличена на 16 ЕД и составляла 51 ЕД/сут (1,2 ЕД/кг): инсулин Глулизин — 21 ЕД/сут; инсулин Гларгин — 30 ЕД/сут.
Рекомендовано продолжение терапии метипредом, метотрексатом и курсы сосудистых препаратов, а также местная терапия на очаги кожного поражения (актовегин-гель, радевит) под наблюдением ревматолога. В связи с микроальбуминурией рекомендованы также ингибиторы АПФ.
Термин «склеродерма» — от греческих слов skleros (жесткий, твердый) и derma (кожа) — используется для описания заболевания, сопровождающегося прогрессирующим уплотнением кожи. Болезнь была известна еще Гиппократу. Однако первое относительно полное ее описание было сделано в 1752 г., а название «склеродермия» применяется с 1836 г. В 1945 г. Р. Гетц [1, 2] начал использовать выражение «прогрессирующий системный склероз», чтобы подчеркнуть поражение всего организма и его прогрессирующий характер. Склеродемия проявляется клинически рядом синдромов [2, 3, 5]. Кожный синдром в своей эволюции проходит 3 фазы: воспалительный отек, уплотнение (индурация) и атрофия кожи. Для мышечно-суставного синдрома типичны отечность и скованность суставов, артралгии. Вследствие уплотнения кожи формируются сгибательные контрактуры, развиваются теносиновиты. Возможен остеолиз ногтевых фаланг, приводящий к укорочению пальцев. Висцеральные поражения могут затрагивать ЖКТ (90% случаев), легкие (70%), сердце (10%), почки (5%). Со стороны органов пищеварения отмечаются дисфагия, изжога, тошнота и рвота. Развивается рефлюкс-эзофагит, усугубляющийся образованием язв и стриктур пищевода. Поражение легких может проявляться пневмофиброзом и легочной гипертензией. Почечный синдром чаще протекает в форме латентной нефропатии с умеренными функциональными нарушениями. Однако у ряда больных в первое пятилетие от дебюта заболевания развивается «острая склеродермическая почка» — гиперренинемия, злокачественная артериальная гипертензия, тромбоцитопения и гемолитическая анемия.
Американской коллегией ревматологов разработаны критерии диагноза системной склеродермии. Среди них выделяют большой критерий (проксимальная склеродермия — уплотнение кожи кистей рук, конечностей, лица и туловища) и малые (склеродактилия, дигитальные рубчики, двусторонний пневмофиброз). При выявлении двух малых или одного большого признака клинический диагноз можно считать подтвержденным.
Заключение
В литературе существуют единичные случаи описания сочетания склеродермии с другими аутоиммунными заболеваниями, в том числе с СД1 у детей и подростков. Чаще системная склеродермия встречается у взрослых пациентов с сахарным диабетом 2-го типа [3—5]. Регулярный и грамотный самоконтроль, использование современных аналогов инсулина ультракороткого и пролонгированного действия, адекватная коррекция доз инсулина позволяют проводить необходимую патогенетическую иммуносупрессивную терапию без ухудшения показателей гликемии.
Дополнительная информация
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи, о которых следует сообщить.
Согласие пациентов. Пациентка и ее законные представители дали письменное согласие на публикацию медицинской информации в журнале.
Благодарности. Авторы выражают благодарность профессору Н.С. Подчерняевой (ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва, Россия).
Участие авторов: все авторы внесли существенный вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 37 лет.
Над статьей доктора Есипенко И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [10]
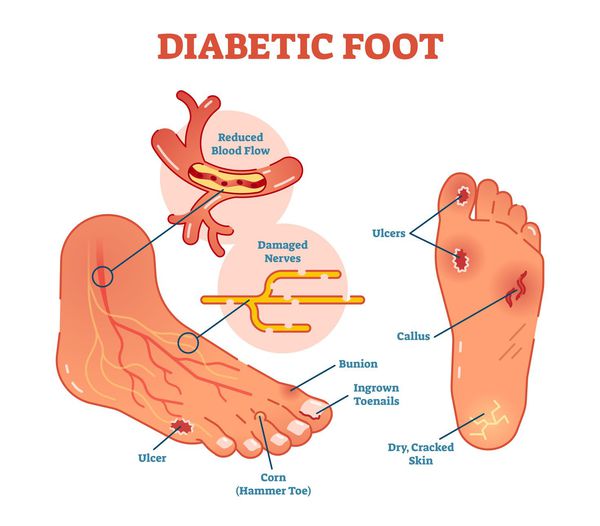
Главная причина ДС — это сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «сахарный диабет» должен помнить о таком грозном возможном осложнении.
Хронические раны на ногах у людей с сахарным диабетом встречаются в 4-15 % случаев. В некоторых случаях они становятся первым признаком развившегося диабета [10] .
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
- несоответствующий размер обуви (меньше или больше, чем нужно);
- стоптанные и/или высокие каблуки;
- рубец на стельке;
- дефект подошвы;
- мокрая обувь;
- несоответствие обуви времени года.
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-"мозолью" в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
- укусы животных;
- уколы шипами растений;
- порезы при педикюре и т. п.
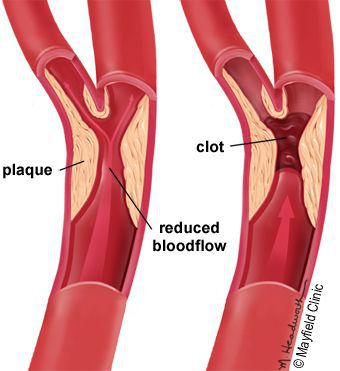
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
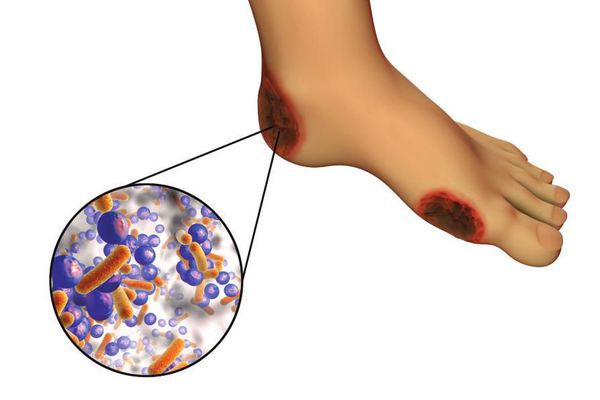
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
- онемение, зябкость, жжение, отёки в стопах и другие неприятные ощущения;
- выпадение волос на на стопах и голенях, потливость стоп;
- изменение окраски кожи (гиперемия, гиперпигментация, цианоз);
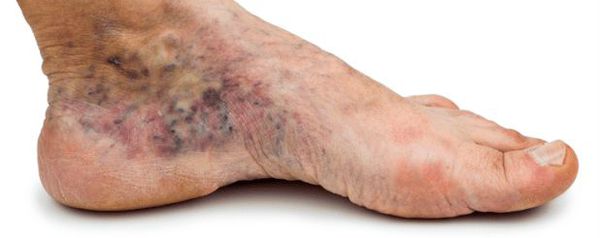
- утолщение, расслаивание, изменение формы и цвета ногтевых пластинок;
- кровоизлияния под ногтевой пластинкой в виде «синяков» под ногтями;
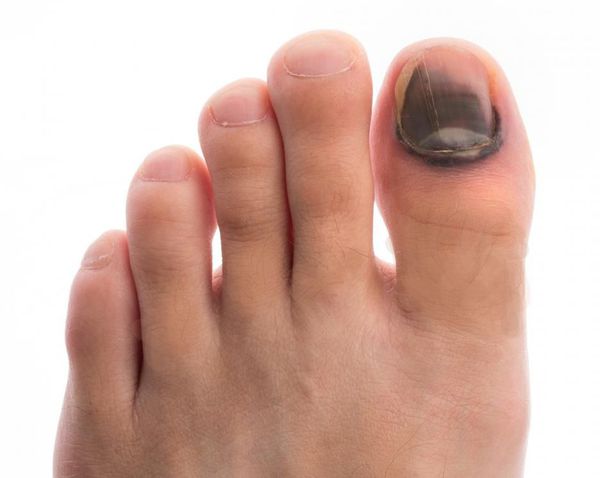
- деформация стоп;
- снижение чувствительности стоп — вибрационного, температурного, болевого и тактильного восприятия;
- боль в области стопы и язвы, возникающая как в покое или ночью, так и при ходьбе на определённые расстояния;
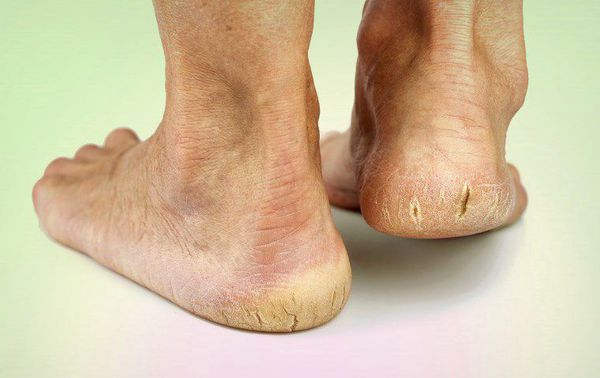
- истончение кожи, шелушение;
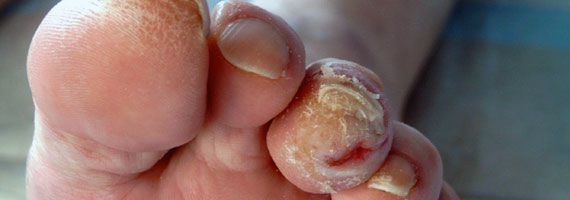
- понижение или увеличение температуры стоп и голеней;
- длительная эпителизация (заживление) микротравм — до двух месяцев, при этом остаются коричневые рубцы;
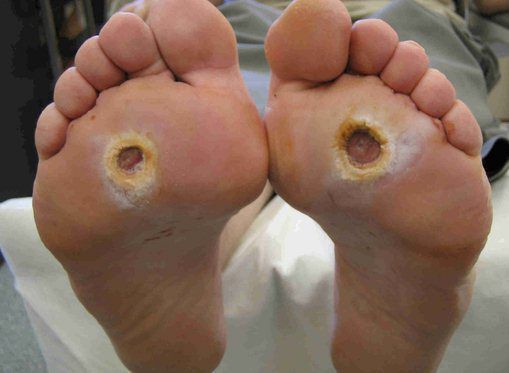
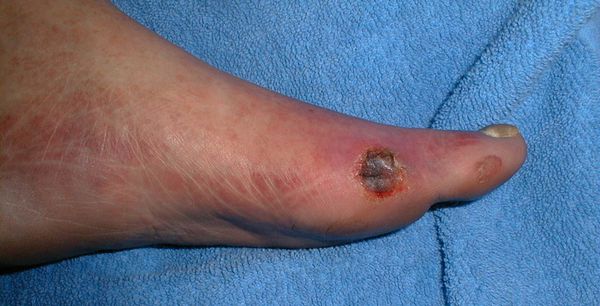
- трофические язвы, длительно не заживающие на стопах.
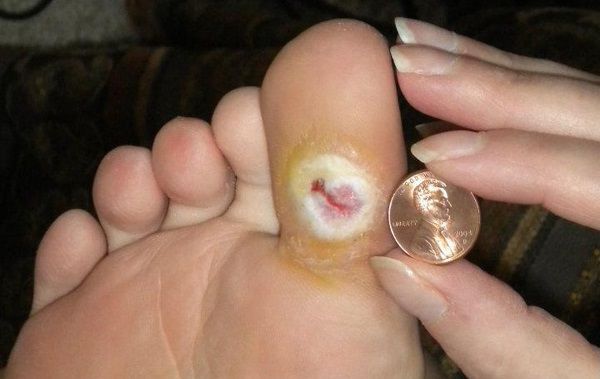
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
Механизм развития СДС представляет собой следующую последовательность нарушений:
- Снижается выработка гормона инсулина.
- Увеличивается уровеь глюкозы в крови — развивается гипергликемия.
- Блокируется кровоток в мелких сосудах, через сосудистую стенку перестаёт поступать кислород и другие микроэлементы.
- Разрушаются нервные волокна и рецепторы.
- Наступает микро- и макроишемия тканей стопы.
- Образуются трофические язвы.
Таким образом, при СДС происходит повреждение всех тканей ноги.
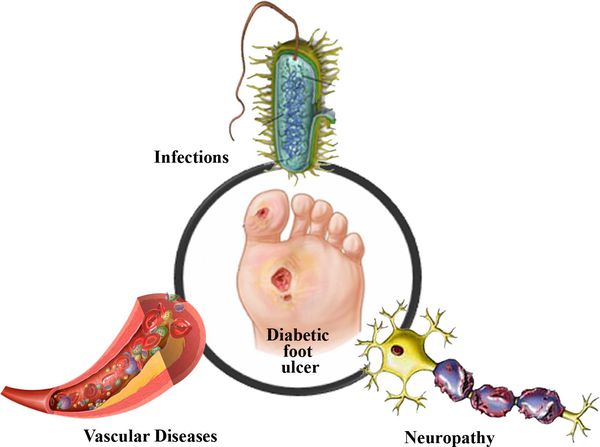
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
- на стенках сосудов скапливаются иммунологические вещества;
- мембраны становятся отёчными;
- просвет сосудов сужается.
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
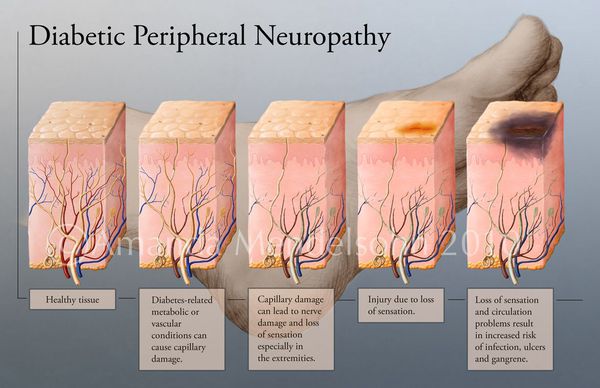
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
- нейропатическая инфицированная стопа:
- длительное течение сахарного диабета;
- позднее возникновение осложнений;
- отсутствие болевого синдрома;
- цвет и температура кожи не изменены;
- уменьшение всех видов периферической чувствительности;
- наличие периферического пульса.
Классификация Вагнера
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
- Стадия 0 — изменение костной структуры стопы — артропатия;
- Стадия 1 — изъязвление (язвы) кожи;
- Стадия 2 — изъязвление всех мягких тканей, дном язвы являются кости и сухожилия;
- Стадия 3 — абсцедирование и остеомиелит (воспаление костной ткани);
- Стадия 4 — образование гангрены дистальных отделов стопы (пальцев);
- Стадия 5 — образование гангрены стопы и отделов голени.
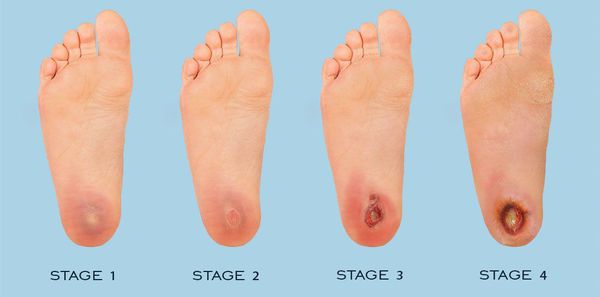
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.
Склеротерапия – инновационный метод лечения варикозной болезни вен нижних конечностей. Невзирая на кажущуюся простоту методики выполнения процедуры, она имеет ряд противопоказаний, которые учитывают флебологи Юсуповской больницы при принятии решения о применении этого метода. Чтобы предотвратить развитие осложнений, врачи проводят комплексное обследование пациента с помощью аппаратуры ведущих мировых производителей.
Различают следующие противопоказания для проведения склеротерапии:
- Беременность;
- Аллергия к ингредиентам склерозирующего вещества;
- Облитерирующие заболевания сосудов нижних конечностей;
- Тромбофлебит, венозный и артериальный тромбоз нижних конечностей.
Можно ли делать склеротерапию во время месячных? Врачи предпочитают не выполнять инвазионных процедур в период менструации в связи со снижением способности образования тромбов. Склеротерапия при грудном вскармливании откладывается до того времени, когда у женщины прекратится лактация. Врачи Юсуповской больницы индивидуально принимают решение о выполнении процедуры пациентам с относительными противопоказаниями. Вначале проводят лечение сопутствующего заболевания, а затем выполняют склеротерапию.
Обследование пациента перед склерозированием вен
Склеротерапия – малоинвазивный метод лечения варикозной болезни. Противопоказанием к проведению склеротерапия является наличие соматических заболеваний, которые могут повлиять на результаты процедуры и процесс реабилитации. По этой причине врачи Юсуповской больницы проводят комплексное обследование пациента накануне выполнения склерозирования вен, которое включает следующие исследования:
- Общий анализ крови;
- Общий анализ мочи;
- Анализ крови на наличие антител к возбудителю сифилиса, гепатитов В и С, ВИЧ;
- ЭКГ диагностику;
- Флюорографию;
- Допплерографию сосудов нижних конечностей;
- Определение группы крови и резус фактора;
- Анализ крови на свёртываемость.
Когда можно делать склеротерапию? Решение о выполнении процедуры врачи принимают в случае отсутствия изменений в анализах и результатах исследований. Противопоказанием к проведению склеротерапия является нарушение свёртываемости крови, поэтому врачи рекомендуют пациентам за несколько дней до процедуры воздержаться от приёма неспецифических противовоспалительных препаратов и средств, которые могут увеличить кровоточивость. Если пациент принимает гормональные препараты, он должен предупредить об этом флеболога.
Методика склеротерапии
Различают следующие виды склеротерапии:
- Компрессионная склеротерапия
- Foam-Form склеротерапия
- Эхо-склеротерапия
- Микросклеротерапия
- Катетерная склерооблитерация.
Компрессионная пункционная склеротерапия позволяет избавить пациента от варикозно трансформированных подкожных вен. Перед процедурой хирург производит маркировку варикозных вен в вертикальном положении, поскольку в положении лёжа они спадаются, пунктирует варикозную вену в самой нижней её точке и поднимает ногу пациента на 15-20 градусов, чтобы освободить вену от крови. Затем он второй рукой пережимает вену выше и ниже места пункции и быстро вводит необходимый объём склерозирующего препарата. Через 20-30 секунд место инъекции плотно прижимают марлевой салфеткой и бинтуют эластическим бинтом с фиксацией специальной латексной подушечки для улучшения компрессии.
При отсутствии противопоказаний для склерозирования вен врачи применяют методику микропенной (Foam-Form) склеротерапии. Для процедуры используют мелкую пену (смесь склерозанта с воздухом). Флебологи отдают предпочтение микропенной склеротерапии для устранения ретикулярных вен, варикозно изменённых притоков, несостоятельных перфорантов, для склерозирования магистральных стволов подкожных вен.
Эхо-склеротерапия выполняется под полным ультразвуковым контролем пункции вены и введения препарата. Это позволяет производить склерозирование наиболее глубоко расположенных и крупных вен. Компрессионная микросклеротерапия заключается в множественных микроинъекциях склерозирующего препарата в сосудистые звёздочки (телеангиоэктазии) и ретикулярные вены нижних конечностей. Для этого флебологи используют специальные маленькие шприцы и очень тонкие иглы.
С помощью катетерной склерооблитерации врачи склерозируют большой или малой подкожной вены, то есть, устраняют ведущий механизм развития варикозной болезни — устьевой и стволовой рефлюксы. Суть методики заключается во введении в просвет вены катетера и подаче через него склерозанта. Флебологи применяют 2 модификации катетерной склеротерапии: интраоперационную и пункционную. Интраоперационную катетерную склерооблитерацию выполняют как последний этап комбинированной флебэктомии после обязательной приустьевой перевязки большой или малой подкожной вены. Пункционная катетерная склерооблитерация выполняется без разреза в паховой области. Для реализации данной методики врачи применяют тщательный ультразвуковой контроль на всех этапах.
Использование сочетания разнообразных современных методик склеротерапии позволяет флебологам Юсуповской больницы решить вопрос радикального лечения начальных форм варикозной болезни безоперационным способом. С помощью склеротерапии достигают хороших результатов в лечении варикоза, но она отнюдь не является универсальной методикой и в связи с наличием противопоказаний возможна далеко не у каждого пациента. Для того чтобы пройти обследование и при отсутствии противопоказаний лечение варикозной болезни с помощью метода склеротерапии, звоните по номеру телефона контакт центра или записывайтесь на приём к флебологу онлайн.
Читайте также:

