Синдром парри-ромберга при склеродермии
Обновлено: 05.05.2024
ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
ФГБУ «ЦНИИС и ЧЛХ» Минздрава России, Москва, ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва
отделение функциональной диагностики ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздрава России, Москва, Россия
ООО АНТА-Мед, Москва
Возможности применения комбинированных методов липофилинга при лечении пациентов с гемиатрофией мягких тканей лица
ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
На базе клиники Центрального научно-исследовательского института стоматологии и челюстно-лицевой хирургии в период с 2015 по 2018 г. были обследованы и пролечены 30 пациентов с диагнозом первичной гемиатрофии (1-я группа) и гемиатрофии после реконструктивных операций (2-я группа). Деформацию мягких тканей устраняли, комбинируя микро-, нано- и классический липофилинг в 2 этапа с промежутком в 6 мес. С целью определения дефицита объема тканей на пораженной стороне до и на этапах лечения была выполнена компьютерная томография с построением математической поверхности лица (МПЛ). Изучение характера изменений подлежащих структур в каждой группе осуществлялось с помощью УЗИ-сканирования и лазерной допплеровской флоуметрии. Применение неинвазивных методов исследования позволило отследить динамику преобразования кожи и подлежащих структур. В обеих группах пациентов, комбинируя микро-, нано- и классический липофилинг, были достигнуты не только увеличение объема и устранение деформации мягких тканей, но и преобразование качества кожи. Таким образом, сочетание различных методов липофилинга позволило добиться более стойкого результата и повысить эффективность лечения.
ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
ФГБУ «ЦНИИС и ЧЛХ» Минздрава России, Москва, ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва
отделение функциональной диагностики ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздрава России, Москва, Россия
ООО АНТА-Мед, Москва
Липофилинг уже давно зарекомендовал себя в пластической и реконструктивной хирургии как метод коррекции объемно-контурных деформаций. Всесторонний интерес вызывает изучение потенциала жировых клеток [1]. На протяжении последних 20 лет происходит активное выделение популяций мультипотентных мезенхимальных стволовых клеток (ММСК) из жировой ткани [2]. Rodriguez и соавт. описали изоляцию и культуру ММСК, а также доказали их содержание не только в жировой части липоаспирата, но и свободной липидной жидкости. Полученные ММСК способны дифференцироваться в нескольких направлениях: адипоциты, хондроциты, остеобласты, миоциты, нейрональные клетки, кардиомиоциты и гепатоциты [3]. Изучение потенциала ММСК позволило применить их в лечении пациентов с дефектами мягких тканей, костей скелета, хроническими трофическими и лучевыми язвами, ожогами, болезнью Крона, рассеянным склерозом, инфарктом миокарда, инсультами различного генеза, а также при гемиатрофии [4].
Гемиатрофия, или синдром Парри—Ромберга, характеризируется нарастающей деформацией лица из-за атрофии кожи и подкожно-жировой клетчатки, уменьшением в объеме мышц, в более тяжелых случаях — всех тканей, включая костные структуры лица [5]. Согласно данным Национальной организации редких заболеваний, в мире около 1 млн людей страдают гемиатрофией [6]. Существует предположение, что началу заболевания предшествуют травма лица, инфекционные заболевания, а также очаговая склеродермия. Гемиатрофия чаще возникает у женщин: соотношение 3—0,2, в детском и юношеском возрасте, чаще — до 30 лет. Консервативная терапия, как правило, не эффективна. В литературе приводятся способы хирургического устранения деформации и восстановления симметрии лица: применение кожно-жировых трансплантатов, индивидуально смоделированных силиконовых имплантатов [7], введение биогелей, устранение деформации с помощью реваскуляризированных лоскутов [8], а также использование аутотрансплантации жировой ткани.
Первые попытки аутотрансплантации жировой ткани при гемиатрофии лица давали высокую степень резорбции липоаспирата. Этой теме было посвящено колоссальное количество работ о влиянии донорской зоны, принципах выделения и получения липоаспирата на частоту приживления трансплантата. Не так давно был предложен новый метод аутотрансплантации жировой ткани — микро- и нанолипофилинг. Полученный материал содержал до 98% ММСК и 2% разрушенных адипоцитов [1]. Автор показал, что применение нанолипофилинга улучшает структуру тканей и может положительно влиять на атрофические процессы в коже.
Цель нашего исследования — повысить эффективность лечения пациентов с первичной гемиатрофией лица и пациентов после реконструктивных операций с помощью комбинированных методов липофилинга.
Материал и методы
На базе Центрального научно-исследовательского института стоматологии и челюстно-лицевой хирургии (ЦНИИС и ЧЛХ) с 2015 по 2018 г. получили лечение 30 пациентов с первичной гемиатрофией лица и пациенты после реконструктивных операций. Мы разделили пациентов на две группы: 1-я — первичные пациенты с гемиатрофией лица, 2-я — пациенты с уже проведенными реконструктивными операциями. Все пациенты предъявляли жалобы на асимметрию лица, дефицит мягких тканей. У 16 была впервые выявлена гемиатрофия мягких тканей; у 14 асимметрия лица сохранялась на фоне наличия ранее установленных индивидуально смоделированных силиконовых имплантатов.
Для определения дефицита тканей на стороне поражения применялись данные мультиспиральной компьютерной томографии (МСКТ) в костном и мягкотканном режимах, с толщиной среза не более 0,5 мм, записанные в формате DICOM, позволяющие, кроме стандартных диагностических исследований, проводить расчеты в системах CAD, CAM, CAE. Сравнивали зоны поражения со здоровыми тканями на контралатеральной стороне. На основе DICOM данных была построена математическая поверхность лица (МПЛ) пациента. Зеркально отраженная МПЛ по горизонтальной оси накладывалась на зону поражения, что позволило визуально и расчетно оценить объемы дефицита. Расчет дефицитного объема осуществлялся с применением булевских операций, исходя из полученных МПЛ как исходной, так и симметризованной. Результаты оценивали спустя 12 мес.
Для определения толщины кожи и подлежащих тканей, оценки качественных характеристик выполняли высокочастотное УЗ-сканирование кожи на аппарате DUB Skin Skanner с использованием датчика 33 МГц. Исследование осуществлялось на этапах до лечения, через 6 и 12 мес и результаты сравнивали с таковыми на здоровой стороне. При помощи УЗ-сканирования кожи оценивали прирост дермы и гиподермы, динамику состояния кожи, структуру слоев, эффективность липофилинга.
Микроциркуляцию в тканях кожи в области аутотрансплантации жировой ткани исследовали методом лазерной допплеровской флоуметрии (ЛДФ) с помощью многофункционального диагностического лазерного комплекса ЛАКК-М (ООО «ЛАЗМА», Москва; №ФСР 2009/05953). На данном аппарате определяли: показатель микроциркуляции М (перф. ед.), характеризующий уровень тканевого кровотока; показатель σ (перф. ед.), определяющий колеблемость потока эритроцитов; коэффициент вариаций Kv (%), характеризующий вазомоторную активность микрососудов. Исследование проводилось на этапах до лечения, после него и спустя 6 мес и результаты сравнивали с таковыми на здоровой симметричной стороне. Все полученные в ходе работы данные подвергались статистической обработке с использованием методов вариационной статистики: вычисление среднего арифметического, ошибки среднего арифметического, среднеквадратичного отклонения. Достоверность различий между средними величинами определяли по критериям Уилкоксона. Для статистической обработки применяли программу MS Excel.
Результаты и обсуждение
Для оценки результатов применения комбинированных методов липофилинга при контрольном МСКТ можно наблюдать увеличение толщины мягких тканей, восстановление объема. На основании данных МСКТ в мягкотканном режиме при помощи алгоритмов CAD, CAM методом булеровской операции по принципу зеркального отображения выявлен дефицит объема мягких тканей на стороне поражения. Спустя 12 мес у пациентов с первичной гемиатрофией при контрольной МСКТ, выполненной методами диагностики и сегментирования, отмечены: увеличение толщины мягких тканей на аксиальном срезе; устранение дефекта при 3D-реконструкции мягких тканей в полуавтоматическом режиме (рис. 1), Рис. 1. 3D-реконструкция мягких тканей в полуавтоматическом режиме (диапазон WL): 106 WW: 553. сохранение объема введенного липоаспирата методом сегментации жировой ткани в ручном режиме с последующим математическим обсчетом (рис. 2). Рис. 2. Сегментация и 3D-реконструкция жировой ткани в ручном режиме.
У пациентов с ранее установленными силиконовыми имплантатами после проведенного хирургического лечения установлены увеличение подкожно-жировой клетчатки, увеличение толщины кожи, снижение выраженности рубцового процесса по периферии силиконового имплантата (рис. 3, 4). Рис. 4. Сегментация и 3D-реконструкция мягкотканных структур в автоматическом режиме; отмечены места введения липофильтрата (а); сегментация и 3D-реконструкция мягкотканных структур в ручном режиме; липофильтрат выделен как самостоятельный объект (б). Рис. 3. МСКТ; мягкотканное окно WL: 106 WW: 553, аксиальный срез толщиной 0,5 мм.
Методом сегментации изображений, разработанным в ЦНИИС и ЧЛХ, выделен липоаспират как самостоятельный математический объект и определены его свойства. По результатам исследования после 2 этапов липофилинга спустя 12 мес сохраняется 80% липоаспирата, введенного над имплантатом у пациентов 2-й группы. Это связано скорее всего с тем, что при наличии имплантата в мягких тканях сохраняется тенденция к атрофии тканей, в результате чего условий для приживления липоаспирата нет. Прирост тканей никак не сопровождался повреждением капсулой самого имплантата.
Согласно результатам УЗ-сканирования кожи, у всех пациентов при первичном исследовании наблюдались снижение толщины мягких тканей, преимущественно дермы и гиподермы, а так же деформация, изменение ультразвукового «рисунка» более глубоких слоев мягких тканей по сравнению с таковыми в контрольных точках. При этом наибольшие изменения происходили в дерме и гиподерме. После терапии толщина дерм значительно увеличилась, у пациентов 1-й группы этот показатель достигал 10—15% от исходного. Толщина гиподермы тоже значительно увеличивалась — в 1,5—2 раза и более — по сравнению с исходной.

У пациентов 2-й группы наибольшие изменения отмечались со стороны структуры мягких тканей — уменьшение проявлений их деформации. Внутренняя структура рубцовых изменений подвергалась ремоделированию, что отражалось в изменении «рисунка» ультразвуковой структуры тканей (рис. 5). Рис. 5. Результаты УЗ-сканирования: до лечения и спустя 6 мес.
Анализ результатов ЛДФ-исследования до и после лечения выявил ряд особенностей в состоянии микроциркуляции в тканях кожи. По данным ЛДФ, в 1-й группе исходно на фоне неизмененного уровня тканевого кровотока (М) ( <9,5%) его интенсивность (σ) и вазомоторная активность (Kv) были выше на 33%, чем на здоровой стороне, что свидетельствовало о снижении уровня микроциркуляции в тканях кожи. Через 6 мес после лечения уровень тканевого кровотока (М) и его интенсивность (σ) повысились до уровня показателей симметричной стороны и вазомоторная активность (Kv) увеличилась в 2 раза, что свидетельствовало об улучшении перфузии тканей кровью (табл. 1). Таблица 1. Динамика показателей микроциркуляции в тканях кожи у пациентов 1-й группы (M±m) Во 2-й группе в тканях кожи исходный показатель интенсивности кровотока (σ) и вазомоторной активности микрососудов (Kv) повысился соответственно на 45 и 15% по сравнению со здоровой стороной. Через 6 мес после операции уровень тканевого кровотока возрос на 30%, его интенсивность (σ) и вазомоторная активность микрососудов (Kv) повысились до уровня показателей симметричной стороны (см. табл. 1, 2). Таблица 2. Динамика показателей микроциркуляции в тканях кожи у пациентов 2-й группы (M±m)
Таким образом, через 6 мес после липофилинга уровень тканевого кровотока в тканях кожи повысился, что, возможно, связано с активацией неоангиогенеза и совпадает с данными экспериментального исследования Ю.А. Галлямовой [9].
Техника выполнения липофилинга включает стандартные этапы: забор, обработку и введение аутожира. Забор жира осуществляется из области внутренней поверхности колен, бедер, нижней трети живота с помощью канюли с диаметром отверстий 0,7 мм. Полученный липоаспират промывается до чистых вод. Затем для получения наноаспирата механически выполняется этап эмульгирования с многократными прогонами через систему фильтров разного диаметра (от большего — 2,4 мм — к меньшему — 1,2 мм). В заключение с целью концентрации клеточной фракции биоматериал пропускают дополнительно через специальный картридж с двойной сито-системой с диаметрами 0,33 и 0,22 мм. Полученный в ходе обработки наноаспират вводят внутрикожно шприцом с диаметром игл 30G или 0,22 мм. Классический липоаспират вводят субдермально с помощью канюли диаметром 1,2 мм, осуществляя послойное распределение жировых трансплантатов. У пациентов после реконструктивных операций липоаспират вводят над областью имплантата, не повреждая капсулу, создавая каналы без перекрещивания для наилучшей васкуляризации.
Проведенное нами исследование демонстрирует эффективность липофилинга в комбинации с микро- и нанолипофилингом у пациентов с первичной гемиатрофией (рис. 6) Рис. 6. Пациентка С., 35 лет; гемиатрофия левой половины лица до операции, после 1-го этапа операции спустя 6 мес и после 2-го этапа операции. и пациентов после реконструктивных операций (рис. 7). Рис. 7. Пациентка, 32 лет; гемиатрофия правой половины лица.
Анализ данных МСКТ позволил оценить прирост мягких тканей лица, восполнение дефицита объема. С помощью методики сегментации изображений был выделен липоаспират как самостоятельный математический объект и определены его свойства (см. рис. 4). По результатам УЗ-сканирования после лечения отмечено увеличение толщины кожи и подлежащих тканей за счет дермы и гиподермы, структура дермы приобретала направленность. Анализ данных ЛДФ-исследования выявил изменения показателей микроциркуляции. После лечения улучшилась перфузия тканей кровью, показатели микрогемодинамики приблизились к таковым на здоровой стороне (рис. 8, 9). Рис. 9. Динамика показателей ЛДФ у пациентов 2-й группы. Рис. 8. Динамика параметров ЛДФ у пациентов 1-й группы.
Таким образом, применение комбинированных методов липофилинга у пациентов с гемиатрофией мягких тканей лица и пациентов после реконструктивных операций позволяет восполнить дефицит объема тканей, дает стойкий прогнозируемый результат, значительно упрощает и сокращает период реабилитации. Метод демонстрирует высокую эффективность, однако для более четкого представления об изменениях в зоне коррекции и окружающих тканях необходимо исследовать их морфологическую структуру.
Очаговая склеродермия – это хроническое заболевание соединительной ткани, характеризующееся преимущественным поражением кожных покровов. Клинически проявляется уплотнением (индурацией) различных участков кожи с последующей атрофией и изменением пигментации, образованием контрактур. Диагноз ставится на основании симптоматики, обнаружения в крови антинуклеарного фактора и антицентромерных антител. В сомнительных случаях проводится гистологическое исследование кожи. Лечение заключается в применении глюкокортикостероидов, иммунодепрессантов, антифиброзных средств, блокаторов кальциевых каналов и проведении ПУВА-терапии. В ряде случаев выполняются хирургические операции.
МКБ-10
Общие сведения
Очаговая (локализованная, ограниченная) склеродермия – хроническое аутоиммунное заболевание из группы диффузных болезней соединительной ткани. Патология встречается повсеместно, распространенность составляет от 0,3 до 3 случаев на 100 000 человек. Чаще страдают женщины европеоидной расы. Возраст манифестации очаговой склеродермии зависит от формы. Бляшечная склеродермия чаще встречается у взрослых (30-40 лет), линейная - у детей от 2 до 14 лет, склероатрофический лихен – у женщин старше 50 лет. При локализованной форме, в отличие от системной, поражение внутренних органов в большинстве случаев либо минимально, либо отсутствует. Имеется ассоциация склеродермии с патологиями щитовидной железы (тиреоидитом Хашимото, болезнью де Кервена).

Причины
Точная причина заболевания неизвестна. Предполагается этиологическая роль бактерии Borrelia burgdorferi, вызывающей лайм-боррелиоз, однако убедительных данных за эту теорию на сегодняшний день нет. В развитии склеродермии важную роль играет наследственная предрасположенность. Были выявлены более частые случаи очаговой склеродермии среди близких родственников. При проведении генетических исследований обнаружена взаимосвязь между определенными генами гистосовместимости (HLA – DR1, DR4) и локализованной формой заболевания. Провоцирующими факторами, способствующими возникновению склеродермии, являются переохлаждения, травмы, постоянные вибрационные воздействия на кожу, прием лекарственных препаратов (блеомицина). Триггерными эффектами также обладают различные химические соединения (хлорвинил, кремний, нефтепродукты, сицилий, эпоксидная смола, пестициды, органические растворители).
Патогенез
Выделяют три основных патогенетических механизма склеродермии – фиброз (разрастание соединительной ткани), аутоиммунное повреждение и сосудистые нарушения. Иммунная аутоагрессия заключается в выработке лимфоцитами антител к соединительной ткани и ее компонентам. Также лимфоциты синтезируют интерлейкины, которые стимулируют пролиферацию фибробластов, гладкомышечных клеток и образование коллагена. Разрастающаяся при этом соединительная ткань замещает нормально функционирующую ткань. В результате повреждения эндотелия сосудов антителами и пролиферирующими гладкомышечными клетками снижается уровень простациклина (вещества, обладающего антиагрегантными и вазодилатирующими свойствами). Это приводит к спазму микрососудов, повышению адгезии и агрегации форменных элементов крови, внутрисосудистой коагуляции и микротромбозу.
Классификация
Очаговая склеродермия подразделяется на множество форм. Наиболее распространенными являются бляшечная и линейная. У ряда пациентов могут наблюдаться одновременно несколько вариантов заболевания. Существует целый ряд классификаций, но наиболее оптимальной и широко используемой считается классификация клиники Мэйо, включающей следующие разновидности очаговой склеродермии:
- Бляшечная. Данная форма в свою очередь подразделяется на поверхностную (морфеа) и узловатую (келоидоподобную). Характерны типичные участки уплотнения кожи с атрофией и нарушением пигментации.
- Линейная. К ней относятся полосовидная, саблевидная формы, а также прогрессирующая гемиатрофия лица Парри-Ромберга. Очаги располагаются в виде линий по ходу сосудисто-нервного пучка.
- Генерализованная (многоочаговая). Проявляется сочетанием бляшечного и линейного вариантов. Очаги распространены по всему телу.
- Буллезная. При данной разновидности на коже возникают пузыри с жидкостным содержимым, оставляющие после себя эрозии.
- Пансклеротическая инвалидизирующая. Наиболее неблагоприятная форма очаговой склеродермии. Характеризуется тяжелым, прогрессирующим течением, плохо поддается лечению. Поражаются все слои кожи и ткани, лежащие под ней. Развиваются грубые контрактуры суставов и длительно незаживающие язвы на коже.
- Склероатрофический лихен Цумбуша (болезнь белых пятен). Характерно образование пятен белого цвета, сопровождающихся нестерпимым зудом. Преимущественная локализация пятен – половые органы.
Симптомы
Для клинической картины типично образование на коже очагов, которые проходят три последовательных стадий развития – отек, индурацию (уплотнение) и атрофию. В начале заболевания на коже конечностей, шеи или туловища появляются пятна сиреневого или лилового цвета, имеющие нечеткие края. Размер пятен может сильно варьировать – от просяного зерна до размеров ладони и больше. На этом этапе пациент не испытывает каких-либо неприятных ощущений или боли. Затем пятна начинают отекать, кожа в центре очага уплотняется, становится блестящей, приобретает цвет слоновой кости. Пациент начинает ощущать зуд, покалывания, стянутость кожи, болезненность. Далее наступает стадия атрофии. Кожа в очагах истончается, прекращается рост волос, нарушается потоотделение, возникает стойкая дисхромия (гипер- или депигментация) и телеангиэктазии. Иногда развивается атрофодермия (участки западения кожи).
При линейной склеродермии очаги расположены по ходу нервов и сосудов. В случае локализации на коже лица очаги по внешнему виду напоминают рубец от удара саблей (саблевидная форма). Прогрессирующая гемиатрофия представляет собой глубокий процесс с поражением всех тканей половины лица - кожи, подкожной клетчатки, мышц и костей лицевого скелета, что приводит к выраженной деформации лица, обезображивающей внешний вид пациента. Также происходит атрофия половины языка и снижение вкусовой чувствительности.
Из внекожных признаков очаговой склеродермии стоит отметить офтальмологические и неврологические проявления при гемиатрофии Парри-Ромберга. Они включают выпадение ресниц и бровей на стороне поражения, западение глазного яблока из-за атрофии глазных мышц и орбитальной клетчатки, нейропаралитический кератит, головокружения, когнитивные нарушения, мигренозные головные боли, эпилептические припадки. Также возможно развитие феномена Рейно. Симптомы синдрома Рейно следующие – стадийное изменение окраски кожи пальцев рук вследствие вазоспазма и последующей гиперемии (бледность, цианоз, покраснение), сопровождающееся онемением, болью и покалыванием в пальцах рук. Остальные экстрадермальные проявления, характерные для системной склеродермии, встречаются крайне редко.
Осложнения
Наиболее распространенная проблема рассматриваемого заболевания – косметические дефекты. Серьезные осложнения, представляющие угрозу для жизни больного, возникают редко. К ним относятся нарушение мозгового кровообращения при гемиатрофии лица, ишемия и гангрена пальцев рук при феномене Рейно, выраженные контрактуры суставов, инвалидизирующие пациента. Через несколько лет после дебюта болезни могут развиться тяжелые поражения внутренних органов – фиброз легких, легочная гипертензия, фиброз миокарда, перикардит, стриктуры пищевода, острая нефропатия, почечная недостаточность.
Диагностика
Пациентов с очаговой склеродермией курируют врачи ревматологи и дерматологи. При постановке диагноза учитывается клиническая картина, семейный анамнез. Все методы диагностики направлены в первую очередь на определение степени вовлечения внутренних органов и исключение системной склеродермии. С этой целью применяются следующие исследования:
- Лабораторные. В анализах крови выявляются эозинофилия, повышение уровня ревматоидного фактора, гаммаглобулинов, высокие титры антицентромерных антител и антинуклеарного фактора (АНФ). Наличие антител к топоизомеразе (анти-Scl 70) свидетельствует в пользу системного процесса. При развитии «склеродермической почки» в моче появляются белок и эритроциты.
- Инструментальные. При капилляроскопии наблюдается дилатация капилляров без участков некроза. По данным ФЭГДС могут встречаться признаки эзофагита, стриктуры пищевода. При фиброзе миокарда на ЭКГ иногда обнаруживаются нарушения ритма сердца, на ЭхоКГ – зоны гипокинеза, выпот в перикардиальную полость. На рентгенографии или компьютерной томографии легких отмечаются интерстициальные изменения.
- Гистологическое исследование биоптата кожи. Заключительный этап, позволяющий достоверно поставить диагноз. Проводится при сомнительных результатах предыдущих исследований. Характерны следующие признаки - инфильтрация лимфоцитами, плазмоцитами и эозинофилами в ретикулярном слое дермы, утолщенные коллагеновые пучки, набухание и склероз сосудистой стенки, атрофия эпидермиса, сальных и потовых желез.
Очаговую склеродермию дифференцируют с другими формами склеродермии (системной, склеродермой Бушке), дерматологическим заболеваниями (саркоидозом кожи, липонекробиозом, склеродермоподобной формы поздней кожной порфирии, базально-клеточным раком), поражением мягких тканей (панникулитом, липодерматосклерозом, эозинофильным фасциитом). В дифференциальной диагностике принимают участие онкологи, гематологи.
Лечение
Этиотропной терапии не существует. Метод лечения и вид лекарственного средства необходимо подбирать с учетом формы заболевания, тяжести течения и локализации очагов. При линейной и бляшечной формах используются топические глюкокортикостероиды высокой и сверхвысокой активности (бетаметазон, триамцинолон), синтетические аналоги витамина Д. При выраженной индурации кожи эффективны аппликации с диметилсульфоксидом. В случае поражений внутренних органов с целью уменьшения фиброзообразования назначаются пеницилламин и инъекции гиалуронидазы.
При неглубоких процессах хорошим терапевтическим действием обладает ПУВА-терапия, которая включает облучение кожи ультрафиолетовыми волнами длинного спектра с одновременным пероральным или наружным применением фотосенсибилизаторов. Тяжелое поражение кожи служит показанием к применению иммунодепрессантов (метотрексата, такролимуса, микофенолата), синдром Рейно - блокаторов кальциевых каналов (нифедипина) и препаратов, улучшающих микроциркуляцию (пентоксифиллина, ксантинола никотината). При склероатрофическом лихене проводится низкоинтенсивная лазеротерапия. В случае развития контрактур суставов, значительно затрудняющих движения, или грубых деформаций скелета и косметических дефектов лица требуется хирургическая операция.
Профилактика и прогноз
В подавляющем большинстве случаев очаговая склеродермия имеет доброкачественное течение. Правильно подобранная терапия позволяет добиться регресса симптомов. Иногда наступают спонтанные ремиссии заболевания. Неблагоприятные исходы возникают при тяжелых формах (прогрессирующей гемиатрофии лица, пансклеротической инвалидизирующей склеродермии), а также поражении внутренних органов. Эффективных методов профилактики не разработано. Рекомендуется избегать или максимально ограничить контакт кожи с химическими соединениями (кремнием, сицилием, хлорвинилом, нефтепродуктами, органическими растворителями, пестицидами, эпоксидной смолой).
2. Ревматические заболевания/ Под ред. Дж.Х. Клиппела, Дж.Х. Стоуна, Л.Дж. Кроффорд, П.Х. Уайт – 2012.
3. Диффузные болезни соединительной ткани: руководство для врачей/ под ред. проф. Мазурова В.И. –2009.
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России
Синдром Парри—Ромберга в сочетании с линейной склеродермией en coup de sabre
Журнал: Клиническая дерматология и венерология. 2021;20(5): 32‑35
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России
Синдром Парри—Ромберга — орфанное заболевание, которое характеризуется медленно прогрессирующей односторонней атрофией и дегенерацией кожи лица, мягких тканей и костей с развитием деформации и асимметрии лица. В ряде случаев синдром Парри—Ромберга сочетается с линейной склеродермией по типу удара саблей. Связь этих двух редких состояний до сих пор неясна. Эти заболевания имеют четкие клинико-морфологические различия, но частое их сочетание может свидетельствовать об общих патогенетических механизмах. Локализация патологических очагов на лице может сопровождаться снижением качества жизни пациентов в связи с наличием косметического дефекта, что приводит к развитию депрессии и тревожности. Поздняя диагностика и неадекватная терапия могут приводить к инвалидизации и социальной дезадаптации пациентов. Представляем обзор современной литературы и клинический случай редкого нейрокожного синдрома — болезни Парри—Ромберга в сочетании с линейной склеродермией по типу удара саблей (en coup de sabre) у женщины в возрасте 24 лет. Повышение осведомленности дерматовенерологов, неврологов, оториноларингологов и врачей других специальностей позволит своевременно диагностировать сочетание двух заболеваний и проводить адекватную терапию.
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России

Склеродермия — это хроническое заболевание соединительной ткани неизвестной причины. Склеродермия может быть классифицирована на локализованную и системную.
Локализованная склеродермия поражает кожу и не наносит вреда другим основным органам. Существует два типа локализованной склеродермии, а именно бляшечная форма (морфея) и локализованная линейная склеродермия.
Системная склеродермия вовлекает в патологический процесс кожу, ткани под кожей, основные органы и кровеносные сосуды. Системная склеродермия также имеет 2 различных типа, а именно: ограниченная системная склеродермия и диффузная системная склеродермия.
Локализованная линейная склеродермия: дебют и этиология
Локализованная склеродермия обычно дебютирует в возрасте от 25 до 55 лет. Тем не менее, локализованная линейная склеродермия:
• чаще встречается у женщин;
• чаще поражает лиц европейского происхождения, чем у афроамериканцев.
Начало линейной склеродермии иногда бывает внезапным и иногда связано с травмой. Активность заболевания коррелирует с титром антигистоновых аутоантител, которые снижаются при разрешении болезни.
Несмотря на значительные усилия, идентификация первоначального триггера остается серьезной проблемой. Современные гипотезы предполагают возможный инфекционный или, возможно, химический агент, который активирует иммунную систему, что, в свою очередь, вызывает повреждение / дисфункцию сосудов и постоянную активацию фибробластов.
Смотрите самые интересные видео на нашем канале в Youtube
Макроскопические особенности локализованной линейной склеродермии
Линейная склеродермия является воспалительным заболеванием дермы и подкожной клетчатки. Развивается в виде линейной полосы склеротической гипопигментированной или гиперпигментированной кожи, чаще на конечностях. В отличие от морфеи, процесс склерозирования при линейной склеродермии может распространяться на нижележащую дерму, подкожную клетчатку, мышцы и кости и вызывать значительные деформации.

Когда линейная склеродермия затрагивает лицо или кожу головы, она называется «en coup de saber» и связана с синдромом Парри-Ромберга, состоянием, связанным с атрофией гемифациальной ткани ниже лба с небольшим поражением кожи.
Микророскопические особенности локализованной линейной склеродермии

Локализованная склеродермия характеризуется тремя отличительными особенностями: отложение коллагена в дерме и подкожном слое, сосудистые изменения и инфильтрат воспалительных клеток, особенно на ранних стадиях.
Другие гистологические особенности:
• эпидермис может быть нормальным, несколько атрофичным или даже немного более толстым, чем обычно;
• дерма увеличена и состоит из широких склеротических коллагеновых пучков;
• коллаген замещает жир вокруг потовых желез и распространяется в подкожную клетчатку;
• наблюдается увеличение количества фибробластов;
• наблюдается атрофия придаточных структур, особенно пилосебальных единиц;
• эккриновые потовые железы расположены на относительно высоком уровне в дерме в результате накопления коллагена под ними;
• мезенхимальные элементы периферических нервов участвуют в склеротическом процессе;
• сосудистыми изменениями являются утолщение стенок мелких кровеносных сосудов и сужение их просвета. В мелких артериях наблюдается фибромуциновое утолщение интимы;
• инфильтрат воспалительных клеток состоит из лимфоцитов с некоторыми макрофагами и плазматическими клетками. Иммуногистохимическая характеристика инфильтрата показала наличие Т-лимфоцитов как CD4 и CD8 подтипа, так и клеток Лангерганса и естественных клеток-киллеров.
Менеджмент локализованной линейной склеродермии
Лечение линейной склеродермии чаще всего включает использование метотрексата или противомалярийных препаратов, но также использовались циклоспорин и аллотрансплантаты тканей. Указывалось на успешное применение регенеративной клеточно-обогащенной жировой ткани для лечения деформации «en coup de saber».
Систематический обзор показал, что фототерапия, метотрексат / системные кортикостероиды, кальципотриен и местный такролимус наиболее эффективны при лечении морфеи.
Таким образом, локализованная линейная склеродермия является проявлением аутоиммунной патологии, которая поддается терапии с помощью современных цитостатиков и гормональных препаратов. Своевременная диагностика является ключевым фактором для приостановления процесса прогрессирования.

Синдром Парри-Ромберга (также известный как прогрессирующая гемиатрофия лица) представляет собой редкое заболевание, характеризующееся прогрессирующей дегенерацией тканей под кожей, обычно только на одной стороне лица (гемиатрофия лица), но иногда распространяющееся на другие части тела.
Подозревается аутоиммунный механизм, и синдром может быть вариантом локализованной склеродермии, но точная причина и патогенез этого приобретенного расстройства остается неизвестным. В литературе сообщалось о возможных последствиях симпатэктомии. Синдром имеет более высокую распространенность среди женщин и обычно проявляется в возрасте от 5 до 15 лет.
Клинические характеристики прогрессирующей гемиатрофии лица
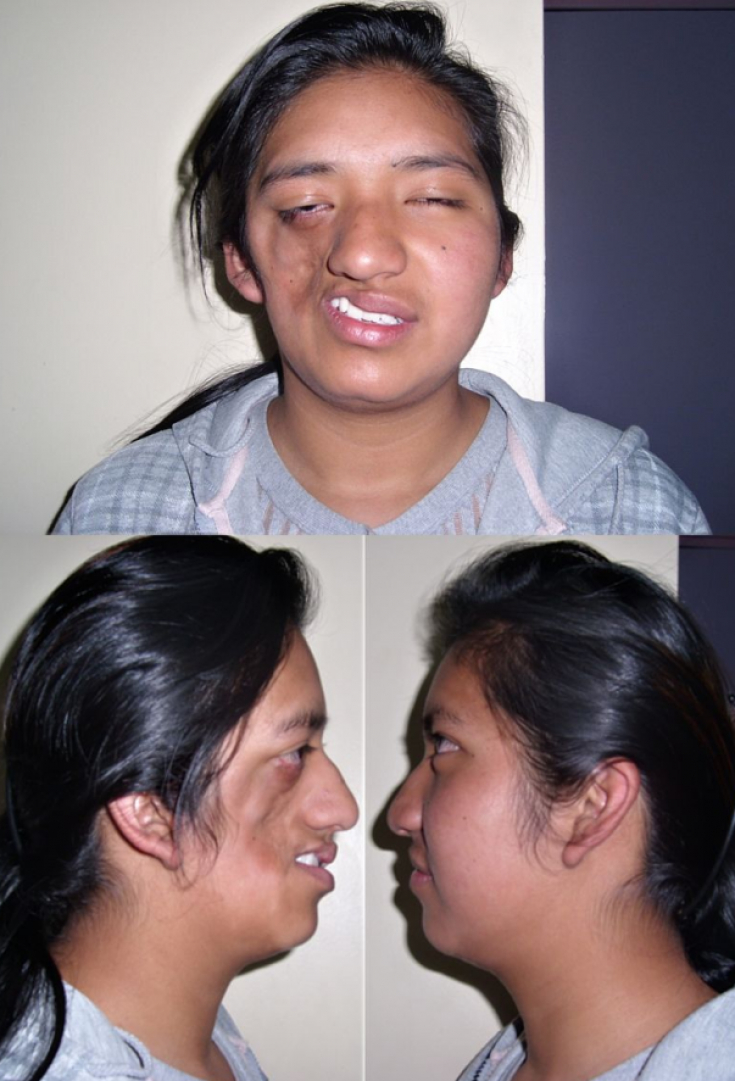
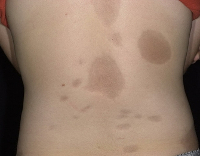
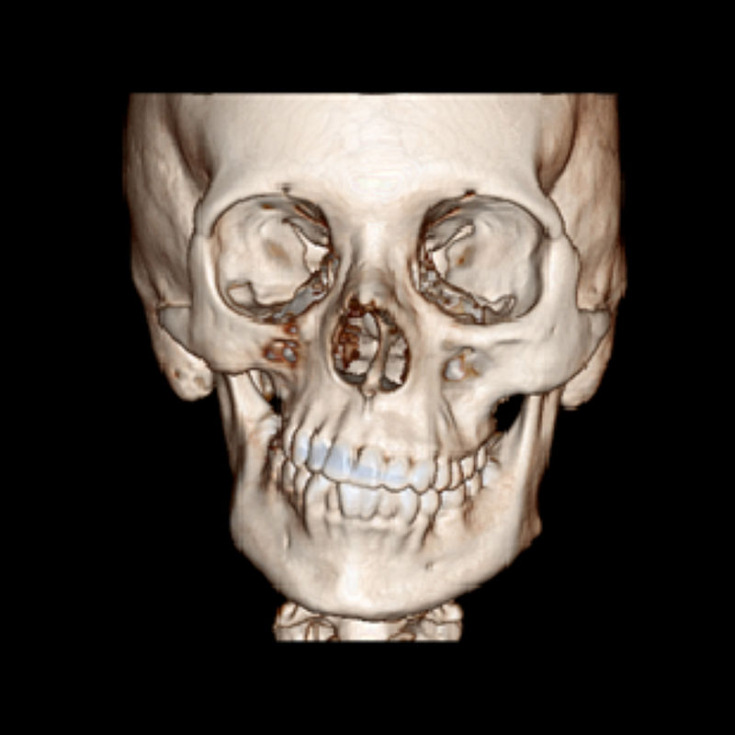
Заболевание прогрессивно распространяется от области скуловой кости, что приводит к атрофии кожи и ее придатков, а также нижележащих подкожных структур, таких как соединительная ткань (жир, фасция, хрящ, кости) и / или мышцы одной стороны лица. Рот и нос обычно отклоняются к пораженной стороне лица.
Процесс может в конечном итоге распространиться на ткани между носом и верхним углом губы, верхней челюстью, углом рта, областью вокруг глаза и брови, ухом и / или шеей.
Синдром также может начинаться с ограниченного участка склеродермии в лобной области, что проявляется выпадением волос и появлением линейного рубца, распространяющегося вниз через середину лица на пораженной стороне.
Часто напоминает шрам от раны, сделанной саблей, и неотличим от шрама, наблюдаемого при фронтальной линейной склеродермии.
В 20% случаев волосы и кожа, покрывающие пораженные участки, могут стать гиперпигментированными или гипопигментированными. В 20% случаев заболевание может распространяться на ипсилатеральную (на одной стороне) или контралатеральную (на противоположной стороне) половину шеи, туловища, руку или ногу.
Болезнь может прогрессировать в течение нескольких лет, прежде чем в конечном итоге перейти к ремиссии.
Читайте нас в Facebook
Неврологические нарушения синдрома Парри-Ромберга
Неврологические нарушения распространены. Приблизительно 45% людей с синдромом Парри-Ромберга также страдают невралгией тройничного нерва и / или мигренью.
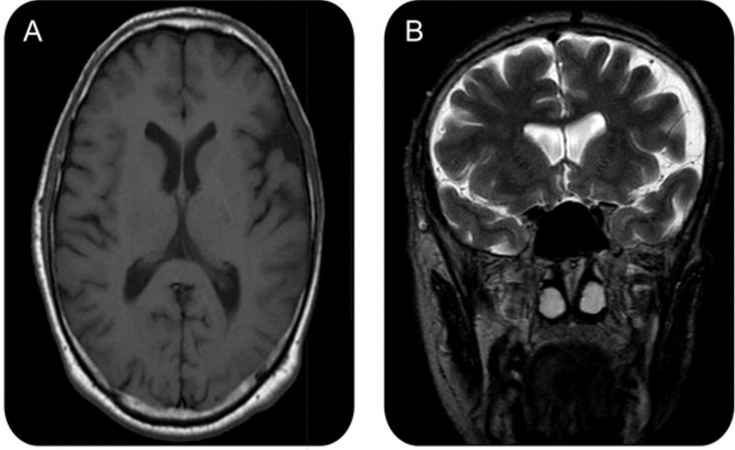
У 10% пострадавших развивается судорожное расстройство как часть заболевания. Эпилептические приступы, как правило, носят джексоновский характер (характеризуются сокращением мышечной группы, которые впоследствии распространяются на соседние мышцы) и происходят со стороны, противоположной пораженной стороне лица. Половина этих случаев связана с аномалиями как в сером, так и в белом веществе мозга — обычно ипсилатеральном, но иногда контралатеральном — которые обнаруживаются при сканировании с помощью магнитно-резонансной томографии (МРТ).
Энофтальм (смещение глазного яблока внутрь) является наиболее распространенной патологией глаза, наблюдаемой при синдроме Парри-Ромберга, что вызвано уменьшением подкожной клетчатки вокруг орбиты. Другие проявления включают птоз, сужение зрачка (миоз), покраснение конъюнктивы и снижение потоотделения (ангидроз) пораженной стороны лица.
Другие нарушения зрения включают офтальмоплегию (паралич одной или нескольких экстраокулярных мышц), косоглазие, увеит и гетерохромию радужной оболочки.
Стоматологические проявления синдрома Парри-Ромберга
Ткани полости рта, в том числе язык, десна, зубы и мягкое небо, обычно вовлекаются в патологический процесс при синдроме Парри-Ромберга:
• у 50% людей развиваются аномалии зубов, такие как отсроченное прорезывание, резорбция корней зубов на пораженной стороне;
• 35% испытывают затруднения или невозможность полноценно открыть рот или другие симптомы, включая расстройство височно-нижнечелюстного сустава и спазм жевательных мышц на пораженной стороне;
• у 25% развивается атрофия одной стороны верхней губы и языка.
Смотрите самые интересные видео на нашем канале в Youtube
Что является причиной прогрессирующей гемиатрофии лица
Тот факт, что некоторые люди, пораженные этим заболеванием, имеют циркулирующие антиядерные антитела в своей сыворотке, подтверждает теорию, что синдром Парри-Ромберга может быть аутоиммунным заболеванием, в частности, вариантом локальной склеродермии.
Национальная организация по редким заболеваниям заявила, что нет доказательств того, что синдром Парри-Ромберга может передаваться детям.
Были предложены различные другие теории о причине и патогенезе, в том числе изменения в периферической симпатической нервной системе (возможно, в результате травмы или инфекции, включающей шейное сплетение или симпатический ствол).
Диагностика прогрессирующей гемиатрофии лица
Диагноз может быть поставлен исключительно на основании анамнеза и физикального обследования людей, у которых присутствует только лицевая асимметрия. Для тех, кто сообщает о неврологических симптомах, таких как мигрень или судороги, МРТ-сканирование головного мозга является предпочтительным методом визуализации. Диагностическая люмбальная пункция и сывороточный тест на аутоантитела также могут быть показаны. Олигоклональные полосы и повышенный индекс IgG могут быть обнаружены у 50% пациентов.
Современные возможности менеджмента синдрома Парри-Ромберга
Медицинский менеджмент может включать иммунодепрессанты, такие как метотрексат, кортикостероиды, циклофосфамид и азатиоприн.
Пострадавшие люди могут извлечь выгоду из аутологичной трансплантации жира, чтобы восстановить более нормальный контур лица. Тем не менее, при больших дефектах объема может потребоваться микрохирургическая реконструктивная операция, которая может включать перенос островкового параскулярного фасциокутального лоскута или свободного лоскута из паха, мышц прямой мышцы живота (поперечно-прямой мышц живота или лоскута «TRAM») или широчайшей мышцы спины на лицо.
Читайте также:

