Сидерофаги это клетки эпителия
Обновлено: 04.05.2024
Что такое Материал, полученный при гинекологическом, урологическом осмотрах?
Цитологическое исследование мазков шейки матки является высокоинформативным тестом для диагностики предрака и рака данной локализации и позволяет с большой точностью (95%-98%) отобрать группы больных для углубленного исследования, лечения и наблюдения. Критерием эффективности цитологического скрининга рака шейки матки служит снижение заболеваемости за счет увеличения количества ранних стадий уменьшения запущенных форм. Показатель заболеваемости на рак шейки матки в Украине за последние десять лет был стабильным (17,8 в 1990 г. И 17,7 на 100 тыс. женщин в 1999 г.). показатель смертности за этот период был стабильным (9,6 на 100 тыс. женщин в 1990 и 1999 гг.), что указывает на необходимость усовершенствования проведения скрининга.
Целью цитологического обследования является выявление фоновых, предраковых заболеваний и ранних форм рака шейки матки. Выявленные при этом цитологические изменения интерпретируются не всегда однозначно, иногда спорно, поскольку отсутствуют единые критерии оценки цитологического скрининга, что в значительной степени снижает эффективность и клиническую значимость цитологических исследований.
Цитологическому скринингу подлежат женщины, что впервые на протяжении года обратились в лечебно-профилактические учреждения, независимо от возраста и заболевания. Исключением являются те случаи, когда при первичном осмотре клинически заподозренный или установленный рак шейки матки. Такие цитологические мазки в тот же день отправляют в цитологическую лабораторию для срочного цитологического вывода (то есть женщина выводится из программы скрининга).
Классификация предопухолевых состояний и рака шейки матки
- 1. Эндоцервикоз (железистая эрозия): Обычный (с новообразованием железистых структур). Пролиферирующий. Заживающий (перекрытие многослойным сквамозным эпителием).
- Полипы: Обычный. Пролиферирующий (новообразование желез). С эпидермизацией.
- Папилломы (покрывной эпителий без признаков атипии).
- Обычная лейкоплакия.
- Б. Воспалительные:
- Рак in situ.
- Рак in situ с начальной инвазией.
- Микрокарцинома.
- Сквамозный ороговевший, не ороговевший.
- Аденокарцинома разной степени зрелости.
- Светлоклеточный рак (мезонефральный).
- Железисто-плоскоклеточный рак
- Аденоидно-кистозный рак.
- Недифференцированный рак.
Формулировка цитологического заключения имеет важное значение для правильной оценки клиницистами полученных данных. Наибольшее распространение в мире получила классификация цитологических заключений по Папаниколау. Она включает 5 групп.
I группа - атипических клеток нет; нормальная цитологическая картина, не вызывающая подозрений.
II группа - изменение морфологии клеточных элементов, обусловленных воспалением.
III группа - имеются единичные клетки с аномалиями цитоплазмы и ядер, однако окончательный диагноз установить не удается. Требуется повторное цитологическое исследование, по рекомендации - гистологическое.
IV группа - обнаруживают отдельные клетки с явными признаками злокачественности: аномальная цитоплазма, измененные ядра, хроматиновые аберрации, увеличение массы ядер.
V группа - в мазках имеется большое количество типично раковых клеток; диагноз злокачественного процесса не вызывает сомнений.
Почему важно делать Материала, полученный при гинекологическом, урологическом осмотрах?
Мазки пролиферативного типа.
Отмечаются чаще всего у женщин в первые пять лет после наступления менопаузы. Преобладают клетки поверхностного слоя с раздельным размещением клеток. Фон светлый, лейкоциты или отсутствуют, или наблюдаются в небольшом количестве.
Мазки пролиферативного типа отображают отсутствие прогестероной активности яичников при продолжительной продукции эстрогенов.
Мазки промежуточного типа.
Преобладают промежуточные клетки (до 90%), которые размещены пластами пластами, группами и отдельно. Скрученность краев клеток (как при прогестероновой стимуляции) не наблюдается. Поверхностные клетки часто окрашены в базофильные тона. Этот тип мазка встречается через 3-5 лет после наступления менопаузы.
Мазки смешанного типа.
В мазках отмечаются все виды клеток эпителия влагалищной части шейки матки: поверхностные, промежуточные и парабазальные. Их процентное соотношение может быть самым разным. Лейкоциты наблюдается в большом количестве, но иногда совсем отсутствуют. Мазки смешанного типа являются переходными к мазкам истинного атрофического типа.
Мазки атрофического типа.
Основную массу клеток этого типа мазка составляют парабазальные клетки. Чем больше выраженная атрофия эпителия шейки матки, тем больше в мазке парабазальных клеток с нижних слоев эпителия. В зависимости от степени атрофии увеличивается размер ядер в этих клетках. В мазке много лейкоцитов. В случаях Нерезко выраженной атрофии эпителия в мазках встречается до 50% промежуточных клеток. Мазки такого типа чаще всего встречаются после 5 лет менопаузы и свидетельствуют о резко сниженной продукции эстрогенов.
Мазки цитолитического типа.
В препаратах много отдельно размещенных «голых» ядер, частиц цитоплазмы разрушенных промежуточных клеток. Поверхностные клетки цитолизу не поддаются. Такие мазки могут соответствовать и лютеиновой фазе менструального цикла.
В период климакса и менопаузы происходит эпидермизация эндоцервикса, атрофия призматического эпителия и кистозное расширение желез. Поэтому в цитологических препаратах из цервикального канала могут отсутствовать клетки железистого эпителия.
В диагностике воспалительных процессов половых путей женщины важнейшую роль играет изучение микрофлоры отделяемого. С современных позиций нормальную микрофлору половых путей рассматривают как совокупность микробиоценозов, занимающих многочисленные экологические ниши на коже и слизистых оболочках. Микроорганизмы, составляющие нормальную микрофлору влагалища, находятся между собой в разнообразных взаимоотношениях (нейтрализм, конкуренция, комменсализм, синергизм, паразитизм и др.). Изменение численности того или иного вида микроорганизмов в соответствующем биотопе или появление несвойственных данному месту обитания бактерий служит сигналом для обратимых или необратимых изменений в соответствующем звене микроэкологической системы. Особенностью нормальной микрофлоры половых путей у женщин является ее многообразие. В таблице представлен видовой состав нормальной микрофлоры влагалища.
Факультативные лактобациллы преобладают во влагалищном содержимом женщин с регулярным менструальным циклом и беременных; практически отсутствуют у девочек в препубертатном периоде и женщин в постменопаузе. Продукция эстрогенов у женщин репродуктивного возраста повышает содержание гликогена во влагалищном эпителии. Гликоген метаболизируется в глюкозу и в последующем с помощью лактобацилл - в молочную кислоту. Она обеспечивает низкий уровень рН (менее 4,5), что является благоприятным для роста таких ацидофильных микроорганизмов, как лактобациллы.
На фоне преобладания кислотопродуцирующих микрорганизмов создается оптимально кислая среда цервикально-вагинальной ниши, что и обуславливает равновесие между различными видами бактерий, колонизирующих женские половые пути. Нормальная бактериальная флора выполняет антагонистическую роль, препятствуя инвазии патогенных микроорганизмов, а любая инвазия в здоровый эпителий почти всегда сопровождается изменениями микрофлоры влагалища.
Видовой состав нормальной микрофлоры влагалища [Краснопольский В.И. и др., 1997]
Для оценки состояния микрофлоры влагалища в клинической практике длительное время использовалась бактериологическая классификация о четырех степенях чистоты с учетом количества лактобацилл, наличия патогенных бактерий, лейкоцитов, эпителиальных клеток.
Первая степень. В мазках эпителиальные клетки и чистая культура факультативных лактобацилл; реакция влагалищного содержимого кислая (рН 4,0-4,5).
Вторая степень. Небольшое количество лейкоцитов, палочек факультативных лактобацилл меньше, имеются другие сапрофиты, преимущественно грамположительные диплококки; реакция содержимого остается кислой (рН 5,0-5,5).
Третья степень. Большое количество клеток эпителия, лейкоциты. Факультативные лактобациллы в незначительном количестве, разнообразная кокковая флора; реакция содержимого слабокислая или основная (рН 6,0-7,2).
Четвертая степень. Клетки эпителия, много лейкоцитов, разнообразная гноеродная флора при полном отсутствии влагалищной палочки, реакция основная (рН выше 7,2).
В настоящее время очевидны условность данной классификации и недостаточная ее информативность. В ней не учитываются многообразие видов нормальной микрофлоры, их взаимоотношения, а также возможное присутствие патогенных возбудителей - гонококков, трихомонад, грибов, хламидий и др.
Нарушение соотношения количественного уровня различных видов микроорганизмов или видового состава ассоциаций микробиотопов влагалища приводит к возникновению воспалительных процессов в последнем. К механизмам, изменяющим нормальную экосистему влагалища, относятся:
Для правильной интерпретации патологических изменений при воспалительных процессах в половых путях женщин важное значение имеет знание цитоморфологических особенностей нормальной слизистой оболочки влагалища.
Эпителий влагалища (многослойный плоский) на протяжении менструального цикла подвержен циклическим изменениям под влиянием воздействия половых гормонов. В многослойном плоском эпителии влагалища можно выделить следующие слои: поверхностный, промежуточный, внешний базальный и внутренний базальный. В первые дни после менструации остается около одной трети части влагалищного эпителия, затем на протяжении менструального цикла он снова восстанавливается.
В мазках из влагалища различают четыре вида клеток эпителия.
Клетки поверхностного слоя большие (35-30 мкм), полигональной формы, ядро маленькое (6 мкм), пикнотичное; чаще располагаются раздельно. В большом количестве встречаются главным образом с 9-го по 14-й день менструального цикла.
Клетки промежуточного слоя меньшие по размеру (25-30 мкм), форма неправильная, ядро более крупное, круглое или овальное; часто располагаются пластами. Встречаются во всех фазах менструально-овариального цикла.
Клетки парабазального слоя маленькие по размеру, округлой формы, с большим круглым центрально-расположенным ядром. Встречаются в небольшом количестве только во время Клетки базальные (или атрофические) меньше парабазальных, округлой формы, с большим ядром, соотношение ядра и цитоплазмы 1:3. Появляются в период менопаузы и при послеродовой аменорее.
Во влагалищных мазках, помимо эпителиальных клеток, могут встречаться: эритроциты - (при незначительных повреждениях ткани); лейкоциты - в количестве 6-8, а после овуляции до 15 в поле зрения, встречаются во всех мазках, попадают в отделяемое или путем миграции через вагинальную стенку, или как составная часть воспалительного экссудата.
Слизистая оболочка цервикального канала покрыта высоким призматическим эпителием с базальным расположением ядер, цитоплазма клеток содержит слизь. Под призматическим эпителием нередко обнаруживают резервные (камбиальные) клеточные элементы. Два вида эпителия: многослойный плоский и призматический - контактируют в области наружного маточного зева. В мазках в норме обнаруживают клетки призматического эпителия, единичные метаплазированные клетки, слизь (в слизистой пробке насчитывают до 60-70 лейкоцитов в поле зрения).
Воспалительные заболевания женских половых органов занимают первое место (55-70 %) в структуре гинекологической заболеваемости. Значительную долю в них занимают инфекции вульвы, влагалища и шейки матки. У женщин репродуктивного возраста вагиниты обусловлены наличием бактериального инфицирования (40-50 %), вульвовагинального кандидоза (20-25 %) и трихомониаза (10-15 %).
Все воспалительные процессы половых органов делят на неспецифические и вызванные инфекцией, передающейся половым путем.
Исследование влагалищного отделяемого играет важную роль в диагностике воспалительных заболеваний нижнего отдела половых органов. Общими признаками воспалительного процесса являются лейкоциты, нейтрофильные и эозинофильные, лимфоидные элементы и макрофаги.
Неспецифические вагиниты - инфекционно-воспалительные заболевания влагалища, обусловленные действием условно-патогенных микроорганизмов (кишечная палочка, стрепто-, стафилококки и др.). При неспецифических вагинитах в мазках обнаруживают большое количество лейкоцитов (30-60 и более в поле зрения), ключевые клетки отсутствуют, но достаточно много клеток слущенного эпителия влагалища. Как правило, обнаруживают несколько видов микроорганизмов. В целом микроскопическая картина характерна для воспалительного экссудата.
Концентрация различных факультативных (Gardnerella vaginalis) и анаэробных (бактероиды) бактерий при бактериальном вагинозе выше, чем у здоровых женщин. Фактически общая концентрация бактерий во влагалище возрастает до 10 11 в 1 мл. Большие концентрации этих бактерий влекут за собой изменения в состоянии влагалища. В отличие от пациенток с нормальной микрофлорой больные с бактериальным вагинозом имеют не факультативные, а анаэробные лактобациллы. Уменьшение количества факультативных лактобацилл приводит к снижению образования молочной кислоты и повышению рН. У больных бактериальным вагинозом рН влагалища находится в пределах 5,0-7,5.
Gardnerella vaginalis (выявляется у 71-92 % больных и составляет более 5 % всех представителей микрофлоры) и другие анаэробы способствуют интенсификации процессов отторжения эпителиальных клеток, особенно в условиях алкалоза, что приводит к образованию патогномоничных ключевых клеток.
Вследствие увеличения количества факультативных анаэробов при бактериальном вагинозе возрастает продукция аномальных аминов. Амины при увеличении вагинального рН становятся летучими, обусловливая типичный «рыбный запах» влагалищного отделяемого. Для его выявления в лаборатории проводят аминотест. При добавлении 10 % раствора КОН к капле влагалищного секрета появляется этот специфический запах (тест положительный).
При окраске мазков по Граму у больных бактериальным вагинозом в иммерсионном поле обнаруживают менее 5 лактобацилл и более 5 гарднерелл или других морфотипов.
Наличие в мазках из влагалища большого количества лейкоцитов не характерно для бактериального вагиноза.
При каких заболеваниях делается Материал, полученный при гинекологическом, урологическом осмотрах?
Трихомониаз широко распространен среди женщин в возрасте 20-40 лет; реже обнаруживается у мужчин и исключительно редко у детей.

Цитологическое исследование щитовидной железы ― лабораторная диагностика клеточного и межклеточного строения ткани щитовидной железы, полученной путём пункционной биопсии.
Термины цитологического исследования
Биопси́я (греч. βίος ― жизнь, ὄψις ― вид) ― материал из живого органа. Слово «биопсия» обычно используется врачами для обозначения самого процесса получения материала из железы. Часто говорят так: «Нужно сделать биопсию». Под этим может пониматься вся последовательность действий от прокола щитовидной железы, до получения результата.
Пункция (лат. punctio) ― прокол (укол), применяемый в медицине для диагностики (взятие материала через иглу) или лечения (введения вещества через иглу).
Биоптат ― живой материал (клетки и межклеточное вещество), полученное из иглы в результате диагностической пункции. Некоторые специалисты применяют некорректный в данном случае термин «пунктат».
Предметное стекло ― обычное стекло размерами 76х26х1 мм, на которое наносят ткань (биоптат) из щитовидной железы, для последующей подготовки к изучению под микроскопом.
Мазок ― приём распределения материала из железы (биоптата) на предметном стекле. Вещество стараются распределить тонким равномерным слоем на стекле для полноценной окраски и удобства зрительной оценки под микроскопом. Существуют разные варианты окрашивания мазков.
Подготовка к пункционной биопсии щитовидной железы
Специально готовиться к этому исследованию не нужно. И всё же есть несколько рекомендаций. Постарайтесь в предшествующий день лечь спать раньше и полноценно выспаться. Заранее в меру покушайте: не следует быть голодной, но и наедаться непосредственно перед процедурой не желательно. Одеваться нужно так, чтобы было удобно раскрыть зону шеи и верхней части грудной клетки (при необходимости, раздеться по пояс сверху).
После процедуры пункционной биопсии на место проколов накладывается повязка, фиксирующаяся лейкопластырем. Старайтесь не мочить её в день биопсии при гигиенических водных процедурах.
Сразу после пункционной биопсии можно выполнять почти любую привычную для вас работу (вести автомобиль, пользоваться компьютером, поездки самолётом или поездом). Лучше отложить на другой день спортивные нагрузки и уборку квартиры, приём алкоголя. Важен свежий воздух и психический комфорт.
Методика пункции щитовидной железы
Диагностический прокол щитовидной железы осуществляется в положении пациента лёжа. Для удобства подкладывают подушку или валик под естественные места изгибов тела.
Очень важно чтобы пункцию проводили только под контролем ультразвука! Даже если узел крупный и попасть в него не сложно, введение иглы в железу должно контролироваться УЗИ! Не соглашайтесь на доводы врача, обосновывающие не нужность УЗИ. Более того, проведение пункционной биопсии без УЗИ ― признак непрофессонализма. В таком случае уместно сделать исследование в другом медучреждении у другого врача.
Процедуру осуществляют два человека (врач+врач или врач+медсестра), но опытный специалист способен полноценно выполнить пункцию самостоятельно. Место предполагаемого прокола предварительно готовят. Наносят поверхностный анестетик и затем антисептически обрабатывают. Для датчика УЗИ должен применяться стерильный гель.
Для щитовидной железы используют «тонкоигольную аспирационную пункционную биопсию» (ТИАПБ или ТАПБ). Такая техника уменьшает травмирование клеток железы и её сосудов.
Процедура чувствительная в момент непосредственного прокола, но терпимая. Бояться не следует.
Специалист может выполнить один или несколько заборов материала из ткани узла, в зависимости от его величины и строения. При нескольких узлах осуществляется забор материала из тех узлов, которые по данным УЗИ имеют признаки вероятной злокачественности.
Протокол цитологического исследования
В результате исследования пациенту предоставляется медицинский документ (протокол) «Цитологическое исследование щитовидной железы». В письменном виде в документе указываются:
• дата и анкетные данные (медучреждение, ФИО пациента и врача),
• под номерами места изъятия материала (биоптата),
• описание содержания предметных стёкол из каждого места (узла, или частей узла) щитовидной железы,
Наиболее важным в протоколе цитологической диагностики является описание, в котором должны подробно указываться всё то, что увидел специалист (морфолог) в микроскоп. Помните, что заключение (краткий и обобщающий вывод) не заменяет описания! Важно не заключение, а полноценное описание клеток и межклеточного вещества.
В описании цитологического протокола должны содержаться не обобщающие, а конкретные признаки. Например, вместо «выявлены атипичные клетки» специалист обязан указать, в чём конкретно заключена их «нетипичность» (не одинаковость с обычными клетками щитовидной железы). Частыми атипичными клетками при болезнях щитовидной железы являются истощенные (дистрофически и деструктивно изменённые) доброкачественные клетки.
Показание для пункции щитовидной железы
Единственное главное показание для пункционной биопсии является необходимость исключить злокачественный процесс в узле. Если нет узла в щитовидной железе ― пункция не нужна.
Большинство эндокринологов рекомендует исследовать пункцией все узлы, с наибольшим размером от 10 мм. Лишь в некоторых случаях применяют пункцию к узлам менее 10 мм (но не меньше 4-5 мм). Это связано с технической сложностью попадания иглы в узел.
При абсолютно доброкачественных ультразвуковых признаках узла пункционная биопсия не показана. В таких случаях должно быть сочетание всех доброкачественных признаков: приближенность к правильной (сферической или овоидной) форме, чёткая граница и гипоэхогенный (черный на снимке УЗИ) ободок, однородная изоэхогенная (светлосерая на снимке УЗИ) ткань узла. Такое сочетание характерно для первой стадии узлового процесса ― стадии развития.
Аутоиммунный тиреоидит, острый и подострый тиреоидит, тиреоидит Риделя, травма коллоидно-кистозное преобразование не являются показаниями к диагностической пункции щитовидной железы. Также не путайте диагностическое исследование с лечебной пункцией при гнойном тиреоидите (абсцессе) или паразитарном процессе.
Врач обязан пояснить пациенту показание для проведения пункции, но лишь пациент принимает окончательное решение о проведении такого исследования.
Расшифровка данных цитологического исследования
Случается так, что по техническим причинам результат пункционной биопсии не позволяет сделать диагностический вывод. Иначе говоря, в материале из щитовидной железы обнаруживается лишь кровь или иное, не относящееся к ткани самой железы. В таком случае врач пишет о «неинформативности» данных. Неинформативный результат пункции совершенно не означает что-либо злокачественное. В таком случае могут быть объективные причины: кистозная структура узла, недостаточное внимание и/или опыт специалиста. Для повторной биопсии лучше выбирать другого специалиста в другом медучреждении.
Расшифровывать результат цитологического исследования лучше с помощью вашего лечащего врача или иного компетентного специалиста. Тем не менее, даже в таком случае важно знать ключевые ориентиры, с тем, чтобы избежать ошибки.
Если найдены «тиреоциты» или «фолликулярный эпителий», то это означает, что выявлены обычные клетки щитовидной железы. Коллоид является обычным для железы веществом. «Мало обычных клеток и много коллоида» или «разрозненность расположения обычных клеток (тироцитов)» указывают на доброкачественность.
На злокачественность ориентирует только сочетание признаков. Например, многоклеточность, расположение клеток пластами, многоядерные клетки (более двух ядер; клетки с двумя ядрами ― это нормальные клетки в фазе деления), псамомные тельца, В-клетки ― всё это вместе предполагает папиллярную карциному.
Найденные отдельные В-клетки (Ашкинази-Гюртля) не являются характерным признаком рака. Они могут присутствовать при доброкачественном процессе. Это активно функционирующие клетки, которые встречаются при любом перенапряжении деятельности щитовидной железы.
Часто морфологи пишут в заключении цитологического протокола о том, что выявлена «фолликулярная опухоль». Как расшифровать и понять это обозначение? Этот термин не означает рак. Злокачественность формулируется иначе: фолликулярная карцинома. Понятие «фолликулярная опухоль» применяется в случаях, когда специалист сомневается и не может однозначно указать, что процесс доброкачественен или нет. Далее →
Слово «опухоль» в данном случае должно пониматься как дополнительное образование ткани. Поскольку 96% узлов щитовидной железы в популяции доброкачественные, то в них в большем или меньшем количестве образуется доброкачественная ткань. Такие узлы также можно отнести к фолликулярным опухолям.
Для схематической интерпретации данных цитологического исследования щитовидной железы применяют статистическую классификацию Батесда, рекомендованной в 2007 году Национальным Институтом Рака в США. В 2015 году эта система была принята Российской Ассоциацией Эндокринологов в качестве оптимальной системы для заключений.
Классификация цитологических данных щитовидной железы
(The Bethesda System For Reporting Thyroid Cytopathology (TBSRTC), 2007)
Для каждого пункта такой классификации предложен процент вероятности злокачественности и медицинская тактика. По сути, это схематический алгоритм, основанный на статистических данных, и служащий для решения статистических медицинских задач, главной целью которого является не пропустить рак. Цена такого статистического классификационного фильтра ― значительное увеличение операционных удалений щитовидной железы.
Не следует беспокоиться, если вам в заключении цитологической диагностики определили один из пунктов классификации по Батесда (Bethesda). Важно внимательно оценить реальный процесс по описанию цитологической картины, историю ультразвукового контроля щитовидной железы, структуру и кровоснабжение узла и вместе с компетентным специалистом понять все ключевые обстоятельства изменений. Важен не общий статистический, а индивидуальный принцип диагностики.
Заключение из протокола не является диагнозом. Заключение ― это краткий вывод. Эта общая оценка должна быть конкретной, индивидуальной. Заключение должно исходить из описания цитологической картины и служить для диагностической ориентации, а не быть абсолютным предписанием к окончательному диагнозу.
Последствие пункции
В месте введения иглы некоторое время может ощущаться различной выраженности дискомфорт. Неприятные ощущения могут продолжаться от нескольких дней до нескольких недель, в зависимости от травмирования нервных веточек во время процедуры и возбудимости местной нервной системы. Все беспокойства от пункции раньше или позже прекращаются.
Не следует беспокоиться о том, что прокол узла может вызвать распространение его содержимого в ткань железы и далее. Пункционное исследование не приводит к активизации процессов внутри узла и не способствует распространению клеток узла в ткани щитовидной железы.
Если в результате цитологического исследования биоптата получен неинформативный ответ или выявлена вероятность злокачественности, то следует провести повторное исследование у другого специалиста в другом медучреждении. Также вы можете оценить предметные стёкла у разных морфологов, предложив им подробно описать цитологическую картину.
Гемосидероз – заболевание группы пигментных дистрофий, характеризующееся избыточным накоплением железосодержащего пигмента гемосидерина в тканях организма. Различают местные формы заболевания (кожный и легочный гемосидероз) и общие (с отложением гемосидерина в клетках печени, селезенки, почек, костного мозга, слюнных и потовых желез). Диагностика гемосидероза основывается на определении содержания железа в плазме крови, общей железосвязывающей способности крови, а также содержания пигмента в биоптатах тканей и органов. В зависимости от клинической картины лечение гемосидероза включает медикаментозную терапию (глюкокортикоиды, цитостатики, ангиопротекторы, витамин С), в некоторых случаях плазмаферез, местную PUVA-терапию.
Общие сведения
Гемосидероз - нарушение обмена гемоглобиногенного пигмента гемосидерина с его локальным или системным отложением в тканях. Гемосидерин представляет собой железосодержащий внутриклеточный пигмент, образующийся в процессе ферментативного расщепления гемоглобина. Синтез гемосидерина происходит в клетках-сидеробластах. Наряду с другими производными гемоглобина (ферритином, билирубином) гемосидерин участвует в транспорте и депонировании железа и кислорода, метаболизме химических соединений. В норме в небольших количествах гемосидерин обнаруживается в клетках печени, селезенки, костного мозга, лимфатической ткани. При различных патологических состояниях может происходить избыточное образование гемосидерина с развитием гемосидероза. Изучение эпидемиологии гемосидероза затруднено ввиду большого разнообразия форм данного нарушения.
В зависимости от распространенности патологического процесса различают локальный (местный) и генерализованный (общий) гемосидероз. Локальный гемосидероз служит результатом экстраваскулярного гемолиза, т. е. внесосудистого разрушения эритроцитов. Местный гемосидероз может развиваться как в очагах ограниченных кровоизлияний (гематомах), так и в пределах целого органа (легкого, кожи). Генерализованный гемосидероз является следствием интраваскулярного гемолиза - внутрисосудистого разрушения эритроцитов при различных общих заболеваниях. В этом случае гемосидерин депонируется в клетках печени, селезенки и костного мозга, придавая органам бурую («ржавую») окраску.
К самостоятельным формам гемосидероза относят:
- гемосидероз кожи (болезнь Шамберга, кольцевидная телеангиэктатическая пурпура Майокки, старческий гемосидероз, лихеноидный пигментный и пурпурозный ангиодермит, охряный дерматит и др.)
- идиопатический легочный гемосидероз (бурая индурация легких)
В том случае, когда отложение гемосидерина сопровождается структурными изменениями тканей и нарушением функции органа, говорят о гемохроматозе. Вследствие многообразия причин и форм гемосидероза его изучением занимаются иммунология, дерматология, пульмонология, гематология и другие дисциплины.

Причины гемосидероза
Общий гемосидероз является вторичным состоянием, этиологически связанным с болезнями системы крови, интоксикациями, инфекциями, аутоиммунными процессами. Возможными причинами избыточного отложения гемосидерина могут служить гемолитические анемии, лейкемия, цирроз печени, инфекционные заболевания (сепсис, бруцеллез, малярия, возвратный тиф), резус-конфликт, частые гемотрансфузии, отравления гемолитическими ядами (сульфаниламидами, свинцом, хинином и др.).
Этиология гемосидероза легких не вполне ясна. Высказаны предположения относительно наследственной предрасположенности, иммунопатологического характера заболевания, врожденных нарушений структуры стенки легочных капилляров и др. Известно, что развитию гемосидероза легких в большей степени подвержены пациенты с декомпенсированной сердечной патологией (кардиосклерозом, пороками сердца и пр.).
Кожный гемосидероз может быть первичным (без предшествующего поражения кожи) или вторичным (возникает на фоне кожных заболеваний). К развитию первичного гемосидероза кожи предрасполагают эндокринные заболевания (сахарный диабет), сосудистая патология (хроническая венозная недостаточность, гипертоническая болезнь). К вторичному накоплению гемосидерина в слоях дермы могут приводить дерматиты, экзема, нейродермит, травмы кожи, фокальная инфекция (пиодермии). Провоцировать дебют заболевания могут переохлаждение, переутомление, прием лекарственных средств (парацетамола, НПВС, ампициллина, диуретиков и др.).
Гемосидероз легких
Идиопатический легочный гемосидероз – заболевание, характеризующееся повторными кровоизлияниями в альвеолы с последующим отложением гемосидерина в легочной паренхиме. Заболевание поражает преимущественно детей и людей молодого возраста. Течение гемосидероза легких характеризуется легочными кровотечениями различной интенсивности, дыхательной недостаточностью и гипохромной анемией.
В острой фазе заболевания у больных возникает влажный кашель с выделением кровянистой мокроты. Следствием длительного или обильного кровохарканья служит развитие тяжелой железодефицитной анемии, бледность кожных покровов, иктеричность склер, жалобы на головокружение, слабость. Прогрессирующее течение гемосидероза легких сопровождается развитием диффузного пневмосклероза, отражением которого является одышка и цианоз. Периоды обострения сопровождаются болями в грудной клетке и животе, артралгиями, лихорадкой. Объективные данные характеризуются притуплением перкуторного звука, наличием влажных хрипов, тахикардии, артериальной гипотонии, сплено- и гепатомегалии.
В периоды ремиссии жалобы не выражены или отсутствуют, однако после каждой последующей атаки длительность светлых промежутков, как правило, сокращается. У больных с хроническим течением гемосидероза часто формируется легочное сердце; нередко возникают тяжелые инфаркт-пневмонии, рецидивирующие пневмотораксы, которые могут послужить причиной летального исхода. Идиопатический гемосидероз легких может сочетаться с геморрагическим васкулитом, ревматоидным артритом, системной красной волчанкой, гломерулонефритом, синдромом Гудпасчера.
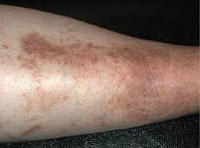
Гемосидероз кожи
При кожном варианте гемосидероза отложение железосодержащего пигмента происходит в дерме. Клинически заболевание характеризуется появлением на коже геморрагической сыпи или пигментных пятен диаметром 0,1-3 см. Свежие высыпания имеют кирпично-красную окраску; старые приобретают бурый, темно-коричневый или желтоватый цвет. Чаще всего пигментированные очаги локализуются на коже лодыжек, голеней, кистей, предплечий; иногда высыпания сопровождаются легким зудом. В местах поражения кожи могут возникать петехии, узелки, лихеноидные папулы, телеангиэктазии, бляшки «ржавого» цвета.
Гемосидероз кожи носит хроническое течение (от нескольких месяцев до нескольких лет), чаще встречается у мужчин в возрасте 30-60 лет. Общее состояние пациентов при кожном гемосидерозе остается удовлетворительным; внутренние органы не поражаются. Заболевание следует отличать от атипичных форм красного плоского лишая, псевдосаркомы и саркомы Капоши.
Диагностика гемосидероза
В зависимости от формы гемосидероза его диагностика может осуществляться дерматологом, пульмонологом, инфекционистом, гематологом и другими специалистами. В дополнение к физикальному обследованию проводится общий анализ крови, определение сывороточного железа, общей железосвязывающей способности крови. Для выявления гемосидероза наибольшее значение имеют данные биопсии тканей (кожи, печени, легкого, костного мозга), при гистологическом исследовании которых обнаруживается отложение гемосидерина. В качестве диагностического теста применяется десфераловая проба - определение количества железа в моче после внутримышечного введения 500 мг дефероксамина. При содержании более 1 мг железа в моче проба считается положительной.
При гемосидерозе легких дополнительно проводится рентгенография грудной клетки, КТ, перфузионная сцинтиграфия легких, микроскопическое исследование мокроты, спирометрия. Проведение бронхоскопии с взятием промывных вод позволяет обнаружить сидерофаги и эритроциты в лаважной жидкости.
Лечение гемосидероза
Препаратами первого ряда, применяемыми для терапии легочного гемосидероза, служат глюкокортикостероиды, однако они оказываются эффективны лишь в половине случаев. Предложена методика комбинированного лечения иммунодепрессантами (азатиоприн, циклофосфан) в сочетании с плазмаферезом. Кроме этого, используется симптоматическая терапия: препараты железа, кровоостанавливающие средства, гемотрансфузии, бронхолитики, ингаляции кислорода. В некоторых случаях ремиссия заболевания наступает после проведения спленэктомии.
Лечение гемосидероза кожи включает местное использование кортикостероидных мазей, криотерапию, прием аскорбиновой кислоты, рутина, препаратов кальция, ангиопротекторов. При тяжелых кожных проявлениях гемосидероза прибегают к ПУВА-терапии, назначению дефероксамина.
Прогноз и профилактика гемосидероза
Идиопатический легочный гемосидероз - трудно диагностируемое заболевание с серьезным прогнозом. Прогрессирующее течение патологии приводит к инвалидизации пациента, развитию жизнеугрожающих осложнений – массивного легочного кровотечения, дыхательной недостаточности, легочной гипертензии. Течение гемосидероза кожи благоприятное. Заболевание в большей степени представляет косметический дефект и склонно к постепенному разрешению.
Предупреждению нарушения обмена гемосидерина может способствовать своевременная терапия кожных и общих инфекционных, сосудистых, гематологических и других заболеваний, предупреждение гемотрансфузионных осложнений, исключение лекарственных и химических интоксикаций.
В представленной статье дана сравнительная оценка традиционных и современных методов диагностики патологии молочных желез с синдромом патологической секреции. Показана низкая информативность скрининговых методов в выявлении внутрипротоковой патологии и установлена высокая значимость электроимпедансной маммографии и радиотермометрии при отборе пациенток в группу риска. Представлены результаты высокой информативности цитологической диагностики с помощью современных методов забора цитологического материала: путем наружной вакуумной аспирации (при нескольких сецернирующих протоках) и дуктального лаважа (при одном-двух сецернирующих протоках).

1. Апанасевич В. И. Диагностическое значение и патогенез важнейших маммологических симптомов / В. И. Апанасевич, Л. А. Кулик, Б. А. Сотниченко и др. // Актуальные вопросы восстановительной и реконструктивной хирургии: сб. тр. - М., 1999. - С. 155-160.
3. Бухарова Т. Н., Кандаева Н. В., Панина О. Н. Выделения из молочных желез // Опухоли женской репродуктивной системы. - 2008. - № 2. - С. 5-6.
4.Закиров Р. Ф. Диагностика и комплексное лечение больных с доброкачественными внутрипротоковыми заболеваниями молочных желез: Автореф. дисс. канд. мед. наук. - Казань, 2003. - 25 с.
5. Короткова М. Е., Карпов А. Ю. Методика оценки электроимпедансного изображения молочной железы: Материалы исследования в Клинической больнице № 9. - Ярославль, 2006.
6. Травина М. Л. Клиническая оценка патологической секреции в комплексной диагностике внутрипротоковых опухолей молочной железы: Автореф. дисс. канд. мед. наук. - М., 2005. - 26 с.
8. Школьник Л. Д. Возможности ультразвукового метода исследования протоковой системы молочных желез путем трехмерного представления ультрасонографических данных: Автореф. дисс. канд. мед. наук. - М., 1999.
10. Dooley W. C., Ljung B. M., Veroneay U. et. Al. // J. Natl. Cancer Inst. - 2001. - Vol. 93. - Р. 1624-1632.
Клиническим маркером внутрипротоковой патологии является синдром патологической секреции (СПС), который подразумевает наличие из соска выделений, не связанных с лактацией [13]. Как известно, внутрипротоковый рак молочной железы (РМЖ) относится к трудно диагностируемым формам, учитывая, что на долю внутрипротокового рака приходится 70-85 % опухолей данной локализации [6, 14]. Внутрипротоковая патология молочных желез требует верификации на ранних этапах ее развития [13]. Синдром патологической секреции наблюдается при заболеваниях, представляющих различный риск (фиброзно-кистозная мастопатия, хронический дуктофорит, внутрипротоковая папиллома, интраканикулярная фиброаденома, аденома соска, внутрипротоковый рак молочной железы) [11]. При этом качество секрета не всегда отражает характер патологии. Трудности ранней диагностики внутрипротоковой патологии обусловлены тем, что скрининговый метод (маммография) является малоинформативным и установить внутрипротоковую атипическую гиперплазию с помощью данного исследования удается только у 10-12 % обследованных [11], в связи с тем, что патологические очаги, не выходящие за пределы протоков, при маммографии не выявляются [7]. Рентгенологическая и эхоконтрастная дуктография с последующей реконструкцией двухмерного и трехмерного представления протоковой системы относятся к передовым технологиям и используются в маммологической практике [8]. Но даже они не всегда выявляют наличие у пациенток внутрипротоковой патологии, особенно деформирующего дуктофорита, когда имеются интра- и перидуктальная деформация протоков как результат фибротизации [4]. Проводимая с помощью маммографии толстоигольная биопсия узловых образований обычно обеспечивает получение ткани из концевых отделов долек, но далеко не всегда может представить информацию о наличии протоковой гиперплазии [9]. Цитологическое исследование мазков-отпечатков не позволяет выявить истинную внутрипротоковую патологию вследствие малого количества клеточного материала или его отсутствия [1, 6].
В последние несколько лет зарубежными авторами проводятся цитологические исследования внутрипротокового содержимого молочных желез, полученных с помощью забора наружной вакуумной аспирации и дуктального лаважа, у женщин в группах повышенного риска с целью выявления атипических клеток [10]. Однако до настоящего времени не проводилось исследований, указывающих на применение этих методов у пациенток с хроническим дуктофоритом и СПС. Нет оценки информативности цитологического и бактериологического исследований патологического секрета, полученного с помощью наружной вакуумной аспирации и дуктального лаважа при данной патологии. Между тем данная патология встречается в практической деятельности акушера-гинеколога и маммолога достаточно часто. Хронический дуктофорит (ХД) в структуре синдрома патологической секреции составляет 20-30 %, у 95 % женщин с ХД наблюдается диффузная мастопатия [3]. Несостоятельность диагностики традиционных методов, применяемых для обследования пациенток с СПС, часто подменяется большим количеством неоправданных секторальных резекций [2, 4]. При этом резекция не устраняет фоновой патологии, спровоцировавшей СПС, и является дополнительным фактором риска в виде операционной раны и, как следствие, рубцовой ткани в молочной железе. На сегодняшний день перспективным для оптимизации диагностики внутрипротоковой патологии является развитие двух направлений: цитологической верификации и установления локализации внутрипротоковой патологии. Так как верифицировать диагноз возможно при наличии клеток протокового эпителия, необходимы технологии, при которых возможен забор секрета на протяжении всего протока с достаточным количеством цитологического материала. Также перспективным является совершенствование метода дуктографии в качестве уточняющей диагностики внутрипротоковой патологии.
Целью исследования явилась сравнительная оценка эффективности традиционных и современных методов диагностики для дифференциации внутрипротоковой патологии молочных желез, сопровождающейся синдромом патологической секреции.
Материалы и методы
В клиническое исследование были включены 483 женщины, обратившиеся в краевой маммологический центр с жалобами на патологическую секрецию молочных желез.
Критерием включения в исследование явились пациентки с синдромом патологической секреции. Критерием исключения - женщины с синдромом галактореи (выделения молозивного характера). Женщины были рандомизированы по возрасту, социальному статусу, характеру соматической и гинекологической патологии. В зависимости от информированного согласия проводимого объема диагностики (стандартное или с включением современных технологий) были выделены две группы. Группу сравнения составили 140 женщин, у которых был использован традиционный диагностический алгоритм, применяемый в ЛПУ края и России: маммография, ультразвуковое исследование, дуктография. цитологическое исследование патологического секрета, полученного эксфолиативным методом забора. В случаях установленного по результатам цитологии воспалительного процесса (хронический дуктофорит), выполнялось бактериологическое исследование патологического секрета.
Основную группу составили 343 пациентки, у которых метод забора внутрипротокового секрета осуществляли с помощью наружной вакуумной аспирации (НВА) и дуктального лаважа (ДЛ). В дополнение к стандартному методу исследования проводили электроимпедансную маммографию и радиотермометрию. Средний возраст пациенток в основной группе составил 43,46±0,51 лет, в группе сравнения - 44,18±0,54 года.
Стандартная бесконтрастная маммография проводилась на рентгеновском маммографе «Mammodiagnost» фирмы Philips, УЗИ выполнено на аппарате «Sonoline» фирмы Siemеns. Электроимпедансную маммографию проводили на электроимпедансном компьютерном томографе при частоте тока 50 кГц и силе тока - 0,5 мА. Радиотерметрия выполнялась на современном аппарате РТМ-01-РЭС с компьютерной обработкой полученных данных. При наличии кистозных и узловых образований проводили пункционно-аспирационную биопсию под контролем УЗИ. При непальпируемых образованиях для уточняющей диагностики в условиях рентгеновского контроля осуществляли прицельную биопсию с помощью системы «пистолет-игла» на рентгенографическом аппарате со стереотаксической приставкой «Цитогайд». Наружную вакуумную аспирацию осуществляли с помощью устройства, напоминающего мини-отсос. Объем содержимого, полученного из протоков, при данном методе забора составлял в среднем около 2 мл. Дуктальный лаваж проводили с предварительной дилатацией сецернирующего протока аналогично методике, проводимой при дуктографии (W. C. Dooley с соавт., 2003 г.). После этого устье протока катетеризировали, вводили 2-6 мл физиологического раствора, затем извлекали катетер и путем компрессии молочной железы опорожняли протоковое русло от введенного раствора вместе с его содержимым. Дуктографию проводили с использованием комплекта инструментов фирмы «Galactography Kit» и фирмы «Angiotech» с рентгеноконтрастным веществом - «йогексол» (омнипак 240). У женщин основной группы дуктографию проводили после дуктального лаважа, что упрощало методику ее проведения. Из-за отсутствия необходимости выполнять дилатацию протока с помощью бужей становится возможным вводить канюлю в просвет протока и через нее - рентгеноконтрастное вещество. Цитологическое исследование проводилось путем визуальной оценки цитологических препаратов с использованием микроскопа «МИК МЕД 2» фирмы «ЛОМО». Бактериологическое исследование материала осуществлялось после окрашивания по Грамму с использованием микроскопа «МИК МЕД 2» фирмы «ЛОМО». Статистическая обработка данных проведена с помощью пакета statistica. С учетом того, что значения являются непараметрическими данными, применялись критерии Кохрена и Фридмана. Для выяснения различий между методами в постановке конкретных диагнозов использовали непараметрический критерий Фридмана (пакет Statistica).
Результаты исследования и обсуждение
Макровизуальная оценка выделений показала, что характер секрета в группах сравнения не отражал патологию. При диффузной форме мастопатии в большей степени встречались серьёзные выделения в основной и группе сравнения (57,4 % и 57,5 % соответственно), реже - выделения зеленого цвета (18,9 % и 21,3 %). У больных с мастопатией, осложненной хроническим дуктофоритом, в выделениях из соска превалировала примесь эритроцитов. Наблюдались сукровичные выделения в основной группе у 55,6 % пациенток и в группе сравнения - в 56,0 % случаев и светло-коричневые - в 7,2 % и 20,0 % случаев соответственно. Еще чаще сукровичные выделения встречались при раке молочной железы без статистических различий с хроническим дуктофоритом (55,6 % и 52 %). Однако при воспалительном процессе повышенное содержание эритроцитов наблюдалось как результат деструкции тканей, при раке - как результат распада опухоли. Гиперпролактинемия как причина патологической секреции была исключена у всех женщин в обеих группах: уровень пролактина находился в пределах референтных значений: 244,38±0,64 мМЕ/л в основной группе и 287,45±0,59 мМЕ/л в группе сравнения.
Информативность УЗИ была выражена по отношению к кистозным полостям в группах сравнения: 36,9 % и 44,7 % (табл. 1). Такой признак как дилатация млечных протоков является косвенным при установлении внутрипротоковой патологии. Дилатация протоков статистически не различалась в группах сравнения: при хроническом дуктофорите (49,5 % и 52,5 % соответственно), при внутрипротоковом папилломатозе (42,6 % и 48,0 %), при внутрипротоковом раке ( 44,0 % и 33,3 %).
Таблица 1 Результаты ультразвукового исследования молочных желез в группах сравнения (%)
Хромопротеиды - окрашенные белки, или эндогенные пигменты, играют важную роль в жизни организма. С помощью хромопротеидов осуществляются дыхание (гемоглобин, цитохромы), выработка секретов (желчь) и инкретов (серотонин), защита организма от воздействия лучевой энергии (меланин), пополнение запасов железа (ферритин), баланс витаминов (липохромы). и т. д. Обмен пигментов регулируется вегетативной нервной системой, эндокринными железами, он тесно связан с функцией органов кроветворения и системы моноцитарных фагоцитов.
Классификация. Эндогенные пигменты принято делить на 3 группы: гемоглобиногенные, представляющие собой различные производные гемоглобина, протеиногенные, или тирозиногенные, связанные с обменом тирозина, и липидогенные, или липопигменты, образующиеся при обмене жиров.
Нарушения обмена гемоглобиногенных пигментов
В норме гемоглобин проходит ряд циклических превращений, обеспечивающих его ресинтез и образование необходимых для организма продуктов. Эти превращения связаны со старением и разрушением эритроцитов (гемолиз, эритрофагия), постоянным обновлением эритроцитной массы. В результате физиологического распада эритроцитов и гемоглобина образуются пигменты ферритин, гемосидерин и билирубин. В патологических условиях вследствие многих причин гемолиз может быть резко усилен и осуществляться как в циркулирующей крови (интраваскулярно), так и в очагах кровоизлияний (экстраваскулярно). В этих условиях, помимо увеличения образующихся в норме гемоглобиногенных пигментов, может появляться ряд новых пигментов - гематоидин, гематины и порфирин.
В связи с накоплением гемоглобиногенных пигментов в тканях могут возникать различные виды эндогенных пигментации, которые становятся проявлением ряда заболеваний и патологических состояний.
Ферритин - железопротеид, содержащий до 23% железа. Железо ферритина связано с белком, который носит название апоферритина. В норме ферритин обладает дисульфидной группой. Это неактивная (окисленная) форма ферритина - SS-ферритин. При недостаточности кислорода происходит восстановление ферритина в активную форму - SH-ферритин, который обладает вазопаралитическими и гипотензивными свойствами. В зависимости от происхождения различают анаболический и катаболический ферритин. Анаболический ферритин образуется из железа, всасывающегося в кишечнике, катаболический - из железа гемолизированных эритроцитов. Ферритин (апоферритин) обладает антигенными свойствами. Ферритин образует берлинскую лазурь (железосинеродистое железо) под действием железосииеродистого калия и соляной, или хлористоводородной, кислоты (реакция Перлса) и может быть идентифицирован с помощью специфической антисыворотки при иммунофлюоресцентном исследовании. Большое количество ферритина содержится в печени (депо ферритина), селезенке, костном мозге и лимфатических узлах, где обмен его связан с синтезом гемосидерина, гемоглобина и цитохромов.
В условиях патологии количество ферритина может увеличиваться как в тканях, так и в крови. Повышение содержания ферритина в тканях наблюдается при гемосидерозе, так как полимеризация ферритина ведет к образованию гемосидерина. Ферритинемией объясняют необратимость шока, сопровождающегося сосудистым коллапсом, так как SH-ферритин выступает в роли антагониста адреналина.
Гемосидерин образуется при расщеплении гема и является полимером ферритина. Он представляет собой коллоидную гидроокись железа, связанную с белками, гликозамшгогликанами и липидами клетки. Клетки, в которых образуется гемосидерин, называются сидеробластами. В их сидеросомах происходит синтез гранул гемосидерина. Сидероблаеты могут быть как мезенхимальной, так и эпителиальной природы. Гемосидерин постоянно обнаруживается в ретикулярных и эидотелиальных клетках селезенки, печени, костного мозга, лимфатических узлах. В межклеточном веществе он подвергается фагоцитозу сидерофагами.
Присутствие в гемосидерине железа позволяет выявлять его с помощью характерных реакций: образование берлинской лазури (реакция Перлса), турнбулевой сипи (обработка срезов сульфидом аммония, а .затем железосинеродистым калием и хлористоводородной кислотой). Положительные реакции на железо отличают гемосидерин от сходных с ним пигментов (гемомеланин, липофусцин, меланин).
В условиях патологии наблюдается избыточное образование гемосидерина - гемосидероз. Он может иметь как общий, так и местный характер.
Общий, или распространенный, гемосидероз наблюдается при внутрисосудистом разрушении эритроцитов (интраваскулярный гемолиз) и встречается при болезнях системы кроветворения (анемии, гемобластозы), интоксикациях гемолитическими ядами, некоторых инфекционных заболеваниях (возвратный тиф, бруцеллез, малярия и др.), переливаниях иногруппной крови, резус-конфликте и т. д. Разрушенные эритроциты, их обломки, гемоглобин идут на построение гемосидерина. Сидеробластами становятся ретикулярные, эндотелиальные и гистиоцитарные элементы селезенки, печени, костного мозга. лимфатических узлов, а также эпителиальные клетки печени, почек, легких, потовых и слюнных желез. Появляется большое число сидерофагов, которые не успевают поглощать гемосидерин, загружающий межклеточное вещество. В результате этого коллагеновые и эластические волокна пропитываются железом. При этом селезенка, печень, костный мозг и лимфатические узлы становятся ржаво-коричневым.
Близко к общему гемосидерозу своеобразное заболевание - гемохроматоз, который может быть первичным (наследственный гемохроматоз) или вторичным.
Первичный гемохроматоз - самостоятельное заболевание из группы болезней накопления. Передается доминантно-аутосомным путем и связано с наследственным дефектом ферментов тонкой кишки, что ведет к повышенному всасыванию пищевого железа, которое в виде гемосидерина откладывается в большом количестве в органах. Обмен железа эритроцитов при этом не нарушен. Количество железа в организме увеличивается в десятки раз, достигая 50-60 г. Развивается гемосидероз печени, поджелудочной железы, эндокринных органов, сердца, слюнных и потовых желез, слизистой оболочки кишечника, сетчатки глаза и даже синовиальных оболочек; одновременно в органах увеличивается содержание ферритина. В коже и сетчатке глаз увеличивается содержание меланина, что связано с поражением эндокринной системы и нарушением регуляции меланинобразования. Основными симптомами болезни являются бронзовая окраска кожи, сахарный диабет (бронзовый диабет) и пигментный цирроз печени. Возможно развитие и пигментной кардиомиопатии с нарастающей сердечной недостаточностью.
Вторичный гемохроматоз - заболевание, развивающееся при приобретенной недостаточности ферментных систем, обеспечивающих обмен пищевого железа, что ведет к распространенному гемосидерозу. Причиной этой недостаточности могут быть избыточное поступление железа с пищей (железосодержащие препараты), резекция желудка, хронический алкоголизм, повторные переливания крови, гемоглобинопатии (наследственные заболевания, в основе которых лежит нарушение синтеза гема или глобина). При вторичном гемохроматозе содержание железа повышено не только в тканях, но и в сыворотке крови. Накопление гемосидерина и ферритина, наиболее выраженное в печени, поджелудочной железе и сердце, приводит к циррозу печени, сахарному диабету и кардиомиопатии.
Местный гемосидероз - состояние, развивающееся при внесосудистом разрушении эритроцитов (экстраваскулярный гемолиз), т. е. в очагах кровоизлияний. Оказавшиеся вне сосудов эритроциты теряют гемоглобин и превращаются в бледные круглые тельца («тени» эритроцитов), свободный гемоглобин и обломки эритроцитов идут на построение пигмента. Сидеробластами и сидерофагами становятся лейкоциты, гистиоциты, ретикулярные клетки, эндотелий, эпителий. Сидерофаги могут долго сохраняться на месте бывшего кровоизлияния, нередко они переносятся током лимфы в близлежащие лимфатические узлы, где задерживаются, и узлы становятся ржавыми. Часть сидерофагов разрушается, пигмент высвобождается и в дальнейшем снова подвергается фагоцитозу.
Гемосидерин образуется при всех кровоизлияниях, как мелких, так и крупных. В небольших кровоизлияниях, которые чаще имеют характер диапедезных, обнаруживается только гемосидерин. При крупных кровоизлияниях по периферии, среди живой ткани образуется гемосидерин, а в центре - кровоизлияния, где аутолиз происходит без доступа кислорода и участия клеток, появляются кристаллы гематоидина.
В зависимости от условий развития местный гемосидероз может возникать в пределах не только участка ткани (гематома), но и целого органа. Таков гемосидероз легких, наблюдающийся при ревматическом митральном пороке сердца, кардиосклерозе и др. Хронический венозный застой в легких ведет к множественным диапедезным кровоизлияниям, в связи с чем в межальвеолярных перегородках, альвеолах, лимфатических сосудах и узлах легких появляется большое число нагруженных гемосидерином клеток (см. Венозное полнокровие).
Билирубин - важнейший желчный пигмент. Его образование начинается в гистиоцитарно-макрофагальной системе при разрушении гемоглобина и отщеплении от него гема. Гем теряет железо и превращается в биливердин, при восстановлении которого образуется билирубин в комплексе с белком. Гепатоциты осуществляют захват пигмента, конъюгацию его с глюкуроновой кислотой и экскрецию в желчные капилляры. С желчью билирубин поступает в кишечник, где часть его всасывается и вновь попадает в печень, часть - выводится с калом в виде стеркобилина и мочой в виде уробилина. В норме билирубин встречается в растворенном состоянии в желчи и в небольшом количестве в плазме крови.
Билирубин представлен красно-желтыми кристаллами. Он не содержит железа. Для выявления его употребляют реакции, основанные на способности пигмента легко окисляться с образованием различно окрашенных продуктов. Такова, например, реакция Гмелина, при которой под воздействием концентрированной азотной кислоты билирубин дает сначала зеленое, а затем синее или пурпурное окрашивание.
Нарушение обмена билирубина связано с расстройством его образования и выделения. Это ведет к повышенному содержанию билирубина в плазме крови и желтому окрашиванию им кожи, склер, слизистых и серозных оболочек и внутренних органов - желтухе.
Механизм развития желтухи различен, что позволяет выделять три ее вида: надпеченочную (гемолитическую), печеночную (паренхиматозную) и подпеченочную (механическую).
Читайте также:

