Сера и спирт при лечении витилиго
Обновлено: 19.04.2024
В статье на основе обзора литературы показана биологическая роль макроэлемента серы в организме человека и необходимость поддержания баланса данного элемента для сохранения здоровья. Представлены современные препараты, содержащие серу, и специализированна
On the basis of literature overview, the article describes biological role of sulfur macroelement in human organism and necessity to maintain the balance of this element for health keeping. Modern drugs containing sulfur were presented, as well as special cosmetics used in seborrhea, acne, rosacea, and trichodystrophy therapy.
Фундаментальные науки (фармакология, биохимия, физиология) включают в свои основы коррекцию витаминного и металлолигандного гомеостаза как необходимый фон для проведения фармакотерапии у больного. Сохранение баланса микро- и макроэлементов это в первую очередь сохранение регенеративных и репаративных способностей организма. Микро- и макроэлементы содержатся в организме человека в очень малых количествах, однако элемент может входить в молекулу фермента или кофермента, может просто активировать биологическую реакцию, также образовывать слабые и сверхслабые биокоординационные связи или создавать ионное окружение. Из 92 встречающихся в природе элементов 81 обнаружен в организме человека, среди них одним из важных элементов является сера [1].
Исследование содержания серы в организме и ее метаболизма продолжается, открывая новые возможности использования ее в фармакологии. В настоящее время на российском рынке появились средства, содержащие серу, представленные в виде таблеток для приема внутрь Дрожжи сухие очищенные Эвисент (биологически активная добавка) и специализированной косметики по уходу за проблемной кожей лица и волосистой частью головы — Эвисент на основе пивных дрожжей и серы. Комплекс препаратов Эвисент рекомендуется использовать в лечении ониходистрофий, триходистрофий, акне, себорейного дерматита, розацеа и перорального дерматита. Однако особое значение приобретает не только достоверная информация о препаратах, но и грамотная ее интерпретация для последующего обоснования назначений. Успех терапии зависит в том числе и от фундаментальных знаний роли элементов в организме человека, которые позволяют оценить и рационально использовать препараты.
Макроэлемент сера необходима для обеспечения многих жизненно важных функций в организме человека и является составной частью любой живой материи. Биологическое значение серы определяется прежде всего тем, что она входит в состав аминокислот метионина, глутатиона и цистеина и, следовательно, в состав белков и пептидов [1]. Свою роль этот макроэлемент осуществляет через образование дисульфидных связей и сульфгидрильных групп.
Дисульфидные связи или цистеиновые мостики (–S–S–) в полипептидных цепях участвуют в формировании пространственной структуры белков. Цистеиновые мостики связывают между собой аминокислоты, образуя пептид, обеспечивая его уникальную структуру, таким образом, определяя его основные физико-химические свойства [2]. Расщепление дисульфидных связей приводит к нарушению нативной структуры белков и утрате ими биологической активности [3]. Именно благодаря дисульфидным соединениям сохраняется прочность и упругость волос и сухожилий, без дисульфидных мостиков невозможно образование коллагена.
Сульфгидрильные группы или тиоловые соединения (–SH) играют важную роль в активных центрах ферментов. Обладая уникальными физико-химическими свойствами и наиболее высокой реакционной способностью, сульфгидрильные группы легко вступают в обратимую окислительно-восстановительную реакцию в нормальных физиологических условиях. Сера, в составе сульфгидрильных групп, вступая в реакции алкилирования, ацилирования, тиолдисульфидного обмена, образует меркаптиды (при реакции с ионами тяжелых металлов), меркаптали, меркаптолы (при реакции с альдегидами и кетонами), тем самым способствуя нейтрализации в организме токсичных веществ. Сульфгидрильные группы, являясь составной частью кофермента А и липоевой кислоты, участвуют в ферментативных реакциях образования и переноса ацильных остатков, связанных с метаболизмом липидов и углеводов. Доказано, что блокирование сульфгидрильных групп при помощи специфичных реагентов вызывает частичное или полное торможение активности многих ферментов [3].
В научной литературе обсуждаются антиоксидантные свойства серы, которые проявляются в способности присоединять атом кислорода, таким образом, окисление серы в организме позволяет уменьшить свободную продукцию избыточных радикалов кислорода. По мнению авторов, именно благодаря антиоксидантным свойствам сера замедляет процесс старения и увеличивает продолжительность жизни [4, 5]. Аналогично сера взаимодействует и со свободными радикалами, нейтрализуя их повреждающее действие в условиях оксидативного стресса [4–6].
По результатам научного исследования, проведенного В. А. Малоземовой (2010), установлено, что, с увеличением возраста обследованных, имеется тенденция к повышению уровня окисленной серы и к снижению уровня восстановленной серы, уменьшение ее общего количества и тиолдисульфидного отношения с достоверным изменением показателей с каждым десятилетием жизни. Это свидетельствует о накоплении с годами жизни окисленных продуктов в организме человека и усилении процессов свободнорадикального окисления, что подтверждается достоверным снижением уровня тиолдисульфидного отношения и уменьшением SH-групп с увеличением возраста. У пожилых пациентов отмечена наибольшая активность окисления серы и снижение ее общего количества. Данные изменения связаны со снижением буферной емкости антиоксидантной системы и могут привести к патологической модификации белкового субстрата, а также повышают риск развития окислительного стресса и связанной с ним заболеваемости [7].
Резюмируя вышесказанное, можно сказать, что сера обеспечивает стабильность структуры белков, входит в состав незаменимых аминокислот — метионина, цистеина, цистина и таурина, которые участвуют в синтезе белков и ферментов, является важным катализатором многих биологических процессов и обладает антиоксидантными свойствами. Необходимо отметить, что макроэлемент сера восстанавливает и поддерживает эластичность и упругость кожи, за счет участия в синтезе коллагена, входит в состав структуры волос и ногтей, нормализует работу сальных желез, а при топическом применении оказывает антисептический, фунгицидный и антипаразитарный эффекты.
Как известно, в кератине волос присутствуют две группы белков: с высоким содержанием серы (16–24% цистеина) и ультравысоким содержанием серы (> 30% цистеина) [8]. Согласно многочисленным исследованиям, в основе триходистрофии лежит дефектный синтез белков с высоким содержанием серы. В результате чего макроэлемент распределяется неравномерно по всей длине стержня, обуславливая хрупкость волос [9–12]. При исследовании в поляризационном микроскопе в волосах обнаруживаются перемежающиеся темные и светлые зоны [13], обусловленные дефектным синтезом белков с высоким содержанием серы.
Однако согласно наблюдениям, проведенным британскими учеными, клинические признаки ломких волос в детском возрасте чаще встречаются при серодефицитных состояниях, чем при генетически обусловленных триходистрофиях [14]. Принимая во внимание все эти наблюдения, можно еще раз подчеркнуть важную роль макроэлемента серы в формировании прочной структуры стержня волос.
Говоря о терапевтических возможностях препаратов серы в лечении кожных заболеваний, достаточно вспомнить о широком применении осажденной серы (sulfur praecipitatum) в лечении себорейного дерматита, экземы и аллергических процессов. Однако при поступлении осажденной серы в кишечник организма сразу образуются сульфаты. Сульфаты плохо всасываются из кишечника и быстро выводятся через почки. Хорошо известно, что доза сульфатов 1,0–2,0, при приеме внутрь, оказывает на человека слабительное действие, приводя к очищению пищеварительного канала. Например, широко применяемый в медицине сульфат магния в концентрациях выше 100 мг/л действует на людей как слабительное. Таким образом, биодоступность солей серы очень низкая. Из этого следует вывод, что сложно скорректировать у больного дефицит серы за счет потребления осажденной серы, поскольку при ее приеме внутрь отмечается низкая всасываемость и усвоение, слабое включение в метаболизм и побочные эффекты, в основном со стороны желудочно-кишечного тракта [15].
В настоящее время существует современное решение проблемы с помощью второго поколения элементоорганических препаратов, в которых макро- и микроэлементы содержатся в виде органических солей или комплексов с аминокислотами. БАД Эвисент — дрожжи сухие пивные очищенные содержат широкий спектр макро- и микроэлементов: кальций, серу очищенную, витамины (В1 (тиамин), В6 (пиридоксин), В2 (рибофлавин) и другие витамины группы В). Пивные дрожжи, входящие в состав препарата, содержат витамин РР (ниацин), витамин D (в прошлом, до получения синтетического аналога, пивные дрожжи использовали в качестве сырья для получения витамина D); аминокислоты и оротовую кислоту, которая стимулирует обменные процессы в организме.
Однако главным преимуществом средства Эвисент является то, что витамины, элементы, в том числе сера, находятся в белковых комплексах, что определяет постепенный характер их поступления в организм человека и обеспечивает легкую усвояемость активных веществ. Данное свойство достигается за счет особой технологии приготовления препарата, инкубирование (доращивание) дрожжевых культур происходит на специальных обогащенных серой средах. Технология обеспечивает поглощение и сохранение микронутриентов дрожжевой клеткой. Уникальная низкотемпературная технология сушки на финальной стадии производства гарантирует повышенное содержание витаминов группы В в дрожжах Эвисент.
Важно, что в производстве средства учитывался важный момент — синергизм витаминов, микро- и макроэлементов и аминокислот. Например, витамин В6, фолиевая кислота и магний, действуя в синергизме, подавляют активную работу сальных желез.
Пивные дрожжи также являются источником других микроэлементов — селена и цинка. Селен защищает клетки от ультрафиолетового повреждения, тормозит фотостарение кожи, а также участвует в производстве серосодержащего клеточного антиоксиданта — глютатиона. Цинк обладает противовоспалительным и себорегулирующим действием, участвует в пролиферации клеток кожи, стабилизирует клеточные мембраны и регулирует клеточный иммунитет.
Не стоит забывать и об эффективности серы при топическом применении на коже. Кератолитическое и антисептическое свойства серы обусловлены реакцией, которая возникает при прямом взаимодействии между серой и кератиноцитами. Под влиянием серы присутствующий в роговом слое цистеин превращается в цистин, при этом выделяется сероводород (H2S). В результате такой реакции достигается антисептический эффект за счет сероводорода и лизис кератиноцитов. Кроме того, чем мелкодисперснее сера при наружном применении, тем больше степень такого взаимодействия и, следовательно, возрастает терапевтическое воздействие [16].
Эффективность наружного применения серы изучалась многими авторами. Ряд преимуществ в использовании препаратов серы в кремах против акне при простом изготовлении, высокой стабильности и низкой стоимости продемонстрирован J. Q. del Rosso (2009) и P. Y. Chen с соавт. (2011). По мнению авторов средства наружной терапии, содержащие 5% серы и широко использующиеся в лечении акне, розацеа, себорейного дерматита с 1962 г. и по настоящее время, эффективны и не вызывают привыкания [17–20]. Сохраняющаяся актуальность использования серы в наружных средствах объясняется ее основным достоинством — отсутствием развития резистентности микрофлоры. Таким образом, комплексное применение наружной косметики для проблемной кожи «Дрожжи с серой Эвисент» (пенка для умывания, лосьон и крем точечного воздействия) позволяет широко использовать свойства серы в терапии себорейного дерматита, перорального дерматита, розацеа, акне 1–2 степени и, как средства косметического ухода, при акне тяжелой степени.
Пенка для умывания Эвисент создана на основе биоактивного дрожжевого комплекса, серы, которая нормализует дренаж кожного сала, цинка, который снимает воспаление и регулирует уровень жирности кожи, и натуральных противовоспалительных экстрактов — череды и березы, аллантоина с антиоксидантным и регенерирующим эффектами и инулина для повышения местного иммунитета кожи. Благодаря натуральному составу, пенка для умывания Эвисент тщательно очищает кожу, удаляет остатки макияжа, препятствует образованию комедонов, сужает расширенные поры, регулирует работу сальных желез, матирует, устраняя жирный блеск кожи, не пересушивает, не вызывает чувство стянутости кожи после использования и поэтому идеально подходит для глубокого очищения проблемной кожи, склонной к образованию акне.
Также незаменимым условием правильного ежедневного ухода за проблемной кожей является использование специализированного лосьона после умывания Эвисент. Лосьон Эвисент помимо биоактивного дрожжевого комплекса и серы содержит экстракт коры ивы белой, которая является натуральным источником салициловой кислоты с выраженным антисептическим и противовоспалительным действием и Д-пантенол, обладающий увлажняющим и регенерирующим действием. Лосьон Эвисент не содержит спирта и имеет нейтральный pН, поэтому подходит для ухода за любым типом кожи.
Крем точечного действия Эвисент на основе дрожжей, серы и салициловой кислоты (источник — экстракт коры ивы белой) наносится непосредственно на участок воспаления и проблемную зону, устраняет воспаление, обладая кератолитическим действием, препятствует образованию высыпаний по типу «постакне». Запатентованный компонент Sepitonic® M3 (цинк, медь, магний) нормализует работу сальных желез, стимулирует клеточное обновление, ускоряет выработку коллагена, стимулирует регенерацию кожи и увеличивает энергопотенциал клеток. Натуральные компоненты — экстракт клевера и масло розового дерева — восстанавливают кожу, стимулируют синтез коллагена и гиалуроновой кислоты, обладают антиоксидантным и успокаивающим действием и устраняют отеки, с помощью легкого дренажного эффекта.
Косметическая линия Эвисент включает специализированную косметику для проблемных и истонченных волос для базового ухода в виде мягкого шампуня без сульфатов и бальзама Эвисент на основе биоактивного дрожжевого комплекса, серы и экстракта чеснока для улучшения микроциркуляции кожи головы и усиленного питания волосяного фолликула. Бальзам-ополаскиватель Эвисент также содержит декспантенол, который увлажняет и восстанавливает поврежденную структуру волос.
Специализированная косметика Эвисент для проблемной кожи и ослабленных истонченных волос и дрожжи Эвисент при комплексном применении обладают синергическим эффектом, потенцируя действие друг друга.
Таким образом, специализированная косметика Эвисент и дрожжи Эвисент, содержащие макроэлемент серу, витамины, аминокислоты, можно рассматривать как перспективные средства в дерматологии, комплексное применение которых позволяет улучшить терапию акне, розацеа, себорейного дерматита, ониходистрофий, триходистрофий, поддерживать красоту и здоровье кожи, волос и ногтей.
Литература
- Ребров В. Г., Громова О. А. Витамины, макро- и микроэлементы. М.: ГЭОТАР-Медиа, 2008. 960 с.
- Бышевский А. Ш., Одиссей А. Т. Биохимия для врача. Екатеринбург, 1994. 384 с.
- Торчинский Ю. М. Сульфгидрильные и дисульфидные группы белков, М., 1971. 43 с.
- Nishida M., Kumagai Y., Ihara H., Fujii S., Motohashi H., Akaike T. Redox signaling regulated by electrophiles and reactive sulfur species // J Clin Biochem Nutr. 2016 Mar; 58 (2): 91–98.
- Spolitak T., Hollenberg P. F., Ballou D. P. Oxidative hemoglobin reactions: Applications to drug metabolism // Arch Biochem Biophys. 2016 Jun 15; 600: 33–46.
- Wang M. J., Cai W. J., Zhu Y. C. Hydrogen sulphide in cardiovascular system: A cascade from interaction between sulphur atoms and signalling molecules // Life Sci. 2016, May 15; 153: 188–197.
- Малоземова В. А. Роль серы в патогенезе острых воспалительных заболевании органов дыхания и коррекция ее содержания в плазме крови. Автореф. дисс. к.м.н. СПб, 2010. 30 с.
- Emonet N., Michaille J. J., Dhouailly D. Isolation and characterization of genomic clones of human sequences presumably coding for hair cysteine-rich proteins // J Dermatol Sci. 1997 Jan; 14 (1): 1–11.
- Itin P. H., Sarasin A., Pittelkow M. R. Trichothiodystrophy: update on the sulfur-deficient brittle hair syndromes // J Am Acad Dermatol. 2001 Jun; 44 (6): 891–920; quiz 921–924.
- Price V. H., Odom R. B., Ward W. H., Jones F. T. Trichothiodystrophy: sulfur-deficient brittle hair as a marker for a neuroectodermal symptom complex // Arch Dermatol. 1980 Dec; 116 (12): 1375–1384.
- Khumalo N. P., Dawber R. P., Ferguson D. J. Apparent fragility of African hair is unrelated to the cystine-rich protein distribution: a cytochemical electron microscopic study // Exp Dermatol. 2005 Apr; 14 (4): 311–314.
- Sass J. O., Skladal D., Zelger B., Romani N., Utermann B. Trichothiodystrophy: quantification of cysteine in human hair and nails by application of sodium azide-dependent oxidation to cysteic acid // Arch Dermatol Res. 2004 Sep; 296 (4): 188–191.
- Елькин В. Д., Митрюковский Л. С. Избранная дерматология. Редкие дерматозы и дерматологические синдромы. Справочник по диагностике и лечению дерматозов. Пермь, 2000. 699 с.
- Cheng S., Stone J., de Berker D. Trichothiodystrophy and fragile hair: the distinction between diagnostic signs and diagnostic labels in childhood hair disease // Br J Dermatol. 2009 Dec; 161 (6): 1379–1383.
- Зупанец И. А., Налетов С. В., Викторов А. П. Клиническая фармакология. В 2 т. Харьков, 2005. 448 с.
- Фридман Р. А. Технология косметики. 2-е изд., перераб. и доп. М.: Изд-во пищ. пром-сти, 1984. 488 с.
- Del Rosso J. Q. The use of sodium sulfacetamide 10%-sulfur 5% emollient foam in the treatment of acne vulgaris // J Clin Aesthet Dermatol. 2009 Aug; 2 (8): 26–29.
- Draelos Z. D. The multifunctionality of 10% sodium sulfacetamide, 5% sulfur emollient foam in the treatment of inflammatory facial dermatoses // J Drugs Dermatol. 2010 Mar; 9 (3): 234–236.
- Lin A. N., Reimer R. J., Carter D. M. Sulfur revisited // J Am Acad Dermatol. 1988 Mar; 18 (3): 553–558.
- Chen P. Y., Luo C. H., Chen M. C., Tsai F. J., Chang N. F., Shih Y. Screen-printed carbon electrodes modified with cobalt phthalocyanine for selective sulfur detection in cosmetic products // Int J Mol Sci. 2011; 12 (6): 3810–3820.
Ю. А. Галлямова, доктор медицинских наук, профессор
Что такое серная пробка? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сысоевой Александры Николаевны, ЛОРа со стажем в 8 лет.
Над статьей доктора Сысоевой Александры Николаевны работали литературный редактор Юлия Липовская , научный редактор Евгений Буданов и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Серная пробка — скопление ушной серы, которое перекрывает наружный слуховой проход. Чаще всего развивается из-за усиленной работы серных желёз [5] .
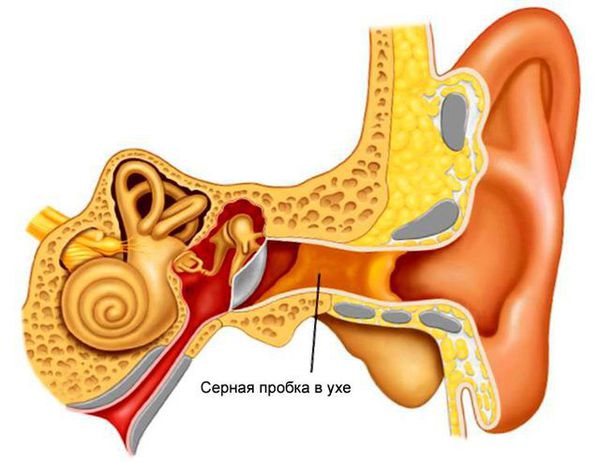
Причины развития серных пробок
1. Повышенное серообразование. Возможные причины гиперсекреции серы — индивидуальная особенность или генетическая предрасположенность. Но чаще всего образование серы усиливается из-за раздражения кожи слухового прохода, которое может быть вызвано:
- Неправильной гигиеной, например ежедневной чисткой ушей ватными палочками [11] .
- Использованием слуховых аппаратов, вакуумных наушников или берушей. Эти предметы могут травмировать наружный слуховой проход. При появлении потёртостей выработка ушной серы увеличивается.
- Загрязнениями, которые попадают в уши при высокой запылённости воздуха на производстве, например на табачных фабриках, мельницах и в шахтах.
- Сопутствующие эндокринные (сахарный диабет) и кожные заболевания ( экзема наружного слухового прохода). — повышенная потливость кожи, в том числе в слуховом проходе. Вместе с потовыми железами усиливается и работа серных желёз.
2. Механическое препятствие, мешающее оттоку серы:
- Узкий или извитый наружный слуховой проход. Такая особенность может быть врождённой или приобретённой, например после операции.
- Отёк кожи слухового прохода, например при воспалении наружного уха — наружном отите.
- Попадание инородных тел[10] .
- Костные разрастания в наружном слуховом проходе — экзостозы и остеомы.
- Новообразования наружного слухового прохода.
3. Изменение состава ушной серы:
При попадании воды в уши серные пробки не образуются. Вода лишь размягчает уже имеющиеся там серные массы, они увеличиваются в объёме, и из-за этого возникает заложенность.
Распространённость
Серная пробка — распространённая проблема, по данным профессора В. С. Козлова , с ней сталкивается около 4 % населения России. Всего в стране серные пробки выявляются у 4 млн людей трудоспособного возраста, у 750 тыс. пожилых людей и 860 тыс. детей [5] .
Ч аще сера скапливается у детей и пожилых людей. У детей это связано со строением наружного слухового прохода: из-за активного роста и перестроек в организме он может быть узким и извитым. У пожилых — с усиленным серообразованием из-за сопутствующих патологий, например сахарного диабета или заболеваний кожи (экземы, дерматита, псориаза ).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы серной пробки
Серная пробка не вызывает симптомов, пока полностью не закроет слуховой проход.
Основные симптомы включают:
- ощущение заложенности в ухе;
- аутофония — состояние, при котором ч еловек слышит эхо своего голоса в ушах ;
- снижение слуха;
- оталгия — боль в ухе, чаще распирающего характера;
- ушной зуд, особенно если сера сухая или есть заболевания кожи слухового прохода;
- субъективный шум в ухе (монотонный, низкочастотный) [8] .
Плотная и большая серная пробка может давить на барабанную перепонку. Из-за этого иногда возникает головная боль, головокружение, тошнота и кашель. Кашель, как правило, сухой, появляется при раздражении окончаний большого затылочного нерва.
Родители могут заподозрить серную пробку у детей, если увидят большое скопление серы в ухе. Когда пробка находится глубоко в слуховом проходе, увидеть её можно только на осмотре у специалиста.
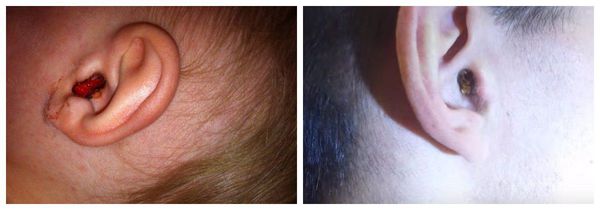
На серную пробку может указывать неприятный запах из уха. Однако другие симптомы тоже должны присутствовать, так как запах бывает признаком и других заболеваний уха, например отомикоза (грибкового поражения кожи наружного слухового прохода). Иногда встречаются сразу обе патологии.
Патогенез серной пробки
Образование ушной серы — физиологический процесс, который нужен для защиты органа слуха и его нормальной работы. В наружном слуховом проходе выделяют два отдела:
- перепончато-хрящевой — расположен ближе к выходу;
- костный — находится рядом с барабанной перепонкой.
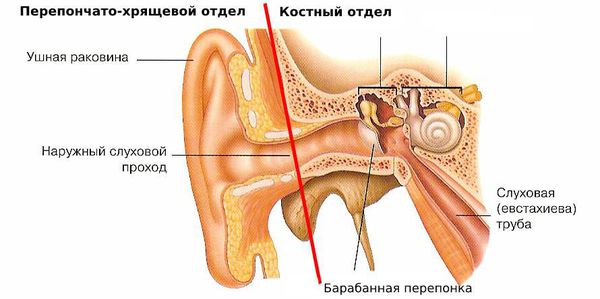
Сера образуется только в перепончато-хрящевом отделе [11] . О коло 2000 серных желёз вырабатывают примерно 15-20 мг ушной серы в месяц [8] . Ушная сера состоит из секрета серных и сальных желёз, а также слущенного эпителия кож и наружного слухового прохода. В её составе есть белки, жиры, свободные жирные кислоты, и минеральные соли.
Функции ушной серы:
- Увлажнение кожи наружного слухового прохода.
- Очищение уха от омертвевших клеток и частичек грязи. Ушная сера "захватывает" инородные частицы и "выводит" их наружу.
- Защита от грибковых и бактериальных инфекций благодаря кислой среде.
В норме наружный слуховой проход очищается благодаря естественному процессу обновления кожи: омертвевшие клети кожи слущиваются по направлению от барабанной перепонки наружу, сдвигая серу к выходу. Когда мы разговариваем или едим, этот процесс проходит быстрее за счёт движений височно-нижнечелюстного сустава. Реснички на коже слухового прохода тоже помогают выводить серу. Они совершают колебательные движения и продвигают ушную серу наружу.
Чаще всего пробки возникают из-за гиперсекреции серных желёз, которая обычно вызвана раздражением кожи слухового прохода. Сера не успевает выводиться из уха, она скапливается, и образуется пробка. Когда мы чистим уши ватными палочками, мы раздражаем кожу, вызывая усиленную выработку серы. Кроме этого, ватные палочки проталкивают серную массу за перешеек к барабанной перепонке и спрессовывают её в комок. Так образуется серная пробка [11] .
Если у пациента есть кожные заболевания , например экзема , эпидермис обновляется слишком быстро. Из-за этого скапливается большое количество отмерших клеток, которые смешиваются с серой и закупоривают проход.
Пробка также может возникнуть при нарушении оттока серных масс из-за механического препятствия. Например, при попадании инфекции ткани воспаляются и образуется отёк, который сужает просвет наружного слухового прохода и мешает выводить серу.
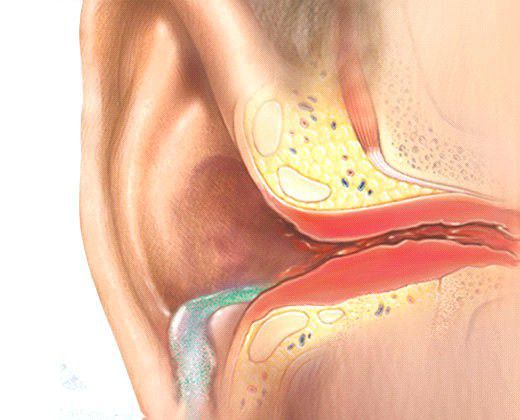
Повышение уровня холестерина тоже может быть причиной серной пробки. Холестерин входит в состав ушной серы, следовательно высокое содержание холестерина в крови увеличивает вязкость серы, что препятствует нормальному самоочищению наружного слухового прохода.
Если слуховой проход перекрыт не полностью, то даже при большой серной пробке слух остаётся нормальным. Но когда в ухо попадает вода, серная пробка разбухает и появляется ощущение заложенности [11] .
Классификация и стадии развития серной пробки
Генетически обусловленные типы ушной серы:
- Мягкий тип (доминантный признак) встречается в Европе и Африке. Сера тёмно-коричневого цвета.
- Сухой тип (рецессивный признак) характерен для жителей Азии и Америки. Масса сухая, слоистая, серого цвета [8] .
Типы серных пробок у детей:
- Молочные пробки образуются, когда грудные дети срыгивают молоком и жидкость затекает в ухо.
- Эпидермальные пробки возникают у детей с нарушением питания тканей, тяжёлой формой атопического дерматита , синдромом Картагенера. При этом наблюдается усиленное слущивание кожи.
Цвет серной пробки — от жёлтого до тёмно-коричневого. Консистенция сначала мягкая, далее восковидная, а потом плотная и даже каменистая. Цвет и консистенция зависят от времени, когда образовалась серная пробка. Чем она темнее и плотнее, тем дольше формировалась. Процесс может протекать годами.
Мягкая пробка не снижает слух и почти не беспокоит пациента. Плотная вызывает ряд неприятных жалоб: снижение слуха, боль, шум, головокружение и др.
Осложнения серной пробки
Серная пробка не вызывает серьёзных осложнений, но иногда присоединяется воспалительный процесс слухового прохода — наружный отит.
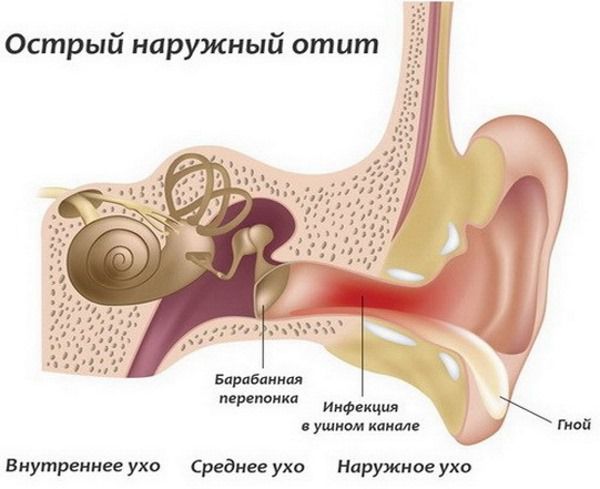
Причиной воспаления может быть:
- Долгое нахождение серной пробки в ухе.
- Сдавление тканей слухового прохода большой плотной пробкой, что создаёт благоприятные условия для размножения бактерий и грибов.
- Повреждение кожи слухового прохода, например при попытке самостоятельно извлечь пробку.
Воспаление вызывает боль в ухе при жевании и надавливании на козелок ушной раковины [8] .
При наружном отите ухудшается слух, однако это нарушение обратимое. Слух возвращается после удаления пробки и лечения воспалительных изменений наружного слухового прохода.
Осложнений можно избежать, если вовремя обратиться к специалисту.
Диагностика серной пробки
Установить диагноз "серная пробка" помогает сбор анамнеза, осмотр пациента, а также результаты исследований .
При сборе анамнеза важно оценить жалобы пациента. Как правило, человек жалуется, что плохо слышит и ощущает заложенность при попадании воды в ухо [8] .
Осмотр. Невооружённым глазом при осмотре можно увидеть только большую серную пробку, в других случаях необходимо провести отоскопию. Это исследование наружного слухового прохода и барабанной перепонки с использованием освещающего ухо лобного рефлектора и воронки, которую врач вставляет в слуховой проход. Иногда перед воронкой устанавливают линзу для лучшей визуализации. Иногда вместо воронки используют специальный прибор — отоскоп.

Следует проверить остроту слуха до удаления серной пробки и после, что понять, улучшился слух после лечения или нет. Проще всего оценить слух живой речью. Это можно сделать на амбулаторном приёме. Обычно используют шёпотную речь. В норме пациент должен слышать шёпот с расстояния более 6 метров .
Проверить слух можно и с помощью камертона. Прибор начинает звучать после удара или щипка. Вра ч устанавливает камертон пациенту на макушку, и пациент должен сказать, где он слышит звук: посередине, в левом или правом ухе.
Е сли после лечения острота слуха остаётся на прежнем уровне, нужно исключить другие заболевания уха. Для этого пациенту назначают тональную пороговую аудиометрию с последующей консультацией сурдолога — врача, который занимается диагностикой и лечением нарушения слуха.
Дифференциальную диагностику нужно проводить со следующими патологиями:
-
, особенно у детей;
- эпидермальными (кожными) пробками, которые формируются при быстром слущивании эпидермиса;
- холестеатомными массами — специфическими массами, которые образуются при хроническом среднем отите , когда эпидермис начинает прорастать в полость среднего уха. — грибковым поражением уха [7] .
Дифференциальную диагностику проводит врач при осмотре наружного слухового прохода.
Лечение серной пробки
Лечение серной пробки подразумевает её удаление. Для этого могут использовать церуменолиз, вымывание (ирригацию), аспирацию и инструментальный кюретаж. Все манипуляции должен выполнять врач-оториноларинголог [9] .
При церуменолизе в уши закапывают специальные капли: 3 % раствор перекиси водорода, Ремо-Вакс, А-Церумен и др. Эти средства размягчают и растворяют серную массу, но не всегда удаляют её полностью. Поэтому церуменолиз обычно используют для гигиены ушей и профилактики образования серных пробок [5] . Также его применяют для размягчения плотных пробок, но после этого требуется удаление остатков серной массы другим способом, например вымыванием. Благодаря размягчающим препаратам сера удаляется легче.
Большинство препаратов для церуменолиза нельзя применять при воспалении наружного и среднего уха, а также при наличии перфорации (разрыва) барабанной перепонки. Поэтому перед использованием размягчающих препаратов обязательно нужно проконсультироваться с врачом-оториноларингологом.
Побочных эффектов при церуменолизе не отмечается, так как препараты применяются местно.
Ирригация — это промывание наружного слухового прохода. Для этого используют шприц Жане или электронный ирригатор. Ирригацию проводят, только если нет противопоказаний: перфорации барабанной перепонки и наружного отита. Если есть воспаление уха, промывание может его усилить.
Для ирригации используется тёплая жидкость (примерно 37 °С), так как низкая температура раздражает вестибулярный аппарат и вызывает у пациента головокружение. Такое состояние быстро проходит самостоятельно, без каких-либо дополнительных мер [8] .
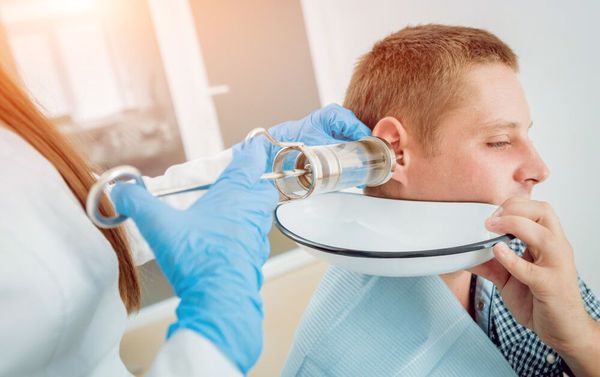
Аспирация серной пробки выполняется с помощью электроотсоса, который вытягивает пробку из уха за счёт создания отрицательного давления в наружном слуховом проходе. При аспирации не применяется жидкость, поэтому её можно проводить пациентам с перфорацией барабанной перепонки [8] .
Инструментальное удаление (кюретаж) серной пробки выполняется, когда невозможно сделать промывание: при перфорации барабанной перепонки или подозрении на неё, хроническом среднем отите, после операции на среднем ухе и при вестибулярных нарушениях (фистуле лабиринта, остром лабиринтите, вестибулярном нейроните, болезни Миньера и пр.). Процедура выполняется под визуальным контролем, иногда требуется микроскоп для лучшей визуализации и полного удаления серных масс.
Если ушная сера мягкой консистенции, её удаляют с помощью ирригации или аспирации. Если пробка застарелая, плотно спаяна с кожей и не поддаётся вымыванию, её необходимо предварительно размягчить. Для этого пациенту назначают размягчающие капли в течение 1-2 дней. После этого проводится ирригация или аспирация серных масс.
Также существуют ушные фитосвечи, но применять их не рекомендуется. Эффективность этого метода сомнительная, и есть риск, что воск попадёт в наружный слуховой проход и на барабанную перепонку, что грозит ожогом и воспалением мягких тканей.
Прогноз. Профилактика
Прогноз благоприятный. Иногда серные пробки эвакуируются самостоятельно при жевании, это физиологический механизм очищения наружного слухового прохода.
Повторно серные пробки могут формироваться у пациентов с анатомически узкими слуховыми проходами, повышенным серообразованием, с кожными или эндокринными заболеваниями, а также при частом или неправильном использовании ватных палочек. Этой категории пациентов рекомендуется посещать врача-оториноларинголога не менее одного раза в год, особенно перед купальным сезоном.
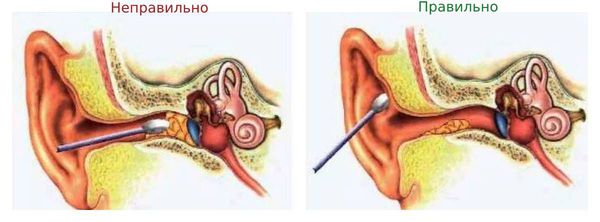
Для очищения слуховых проходов нельзя использовать ватные палочки, зубочистки, спички, шпильки и др. Это не только приводит к образованию серных пробок, но и повышает риск воспаления и грибкового поражения кожи наружного слухового прохода. Сера выполняет защитную функцию, поэтому постоянное её вычищение провоцирует рост болезнетворной флоры (грибов и бактерий). Кроме этого, при использовании ватных палочек можно случайно повредить барабанную перепонку. Нужно помнить, что ватными палочками можно чистить только ушную раковину.
Водолазам, аквалангистам и дайверам нельзя совершать глубоководные погружения, если в слуховом проходе есть серная пробка. При попадании воды сера разбухает, между пробкой и барабанной перепонкой образуется замкнутое пространство "относительного вакуума", что грозит барометрической травмой из-за разницы давления [8] .
Для профилактики образования серных пробок и гигиенического ухода за наружными слуховыми проходами можно применять размягчающие капли. Однако перед их использованием нужно обследоваться у специалиста, чтобы убедиться в отсутствии противопоказаний.
Маленьким детям чистят только ушную раковину с помощью специальных ватных палочек с фиксатором.
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Современный взгляд на проблему лечения витилиго
Журнал: Клиническая дерматология и венерология. 2012;10(2): 118‑123
Усовецкий И.А., Шарова Н.М., Короткий Н.Г. Современный взгляд на проблему лечения витилиго. Клиническая дерматология и венерология. 2012;10(2):118‑123.
Usovetskiĭ IA, Sharova NM, Korotkiĭ NG. The current view of the problem of vitiligo therapy. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(2):118‑123. (In Russ.).
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Представлены результаты собственных исследований, посвященных особенностям клинического течения разных форм витилиго, некоторым патогенетическим аспектам развития данного заболевания и оценке клинической эффективности комплексной терапии сегментарной и несегментарной формы витилиго.
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Витилиго характеризуется внезапным возникновением депигментированных пятен вследствие нарушения секреторной функции меланоцитов или их гибели, развивается у лиц с генетической предрасположенностью, сопровождается выраженными дисрегуляторными изменениями клеточно-опосредованных реакций иммунной системы, вегетативного дисбаланса с преобладанием симпатического тонуса и серьезной социальной дезадаптацией, обусловленной личностными особенностями и внешними социальными факторами.
Витилиго является распространенным дерматозом. В мире число больных с данным заболеванием превышает 1% всего населения. В 70% случаев заболевание начинается в возрасте 10—25 лет, дети младше 10 лет, в том числе новорожденные и грудного возраста, составляют приблизительно 25% всех больных витилиго [1]. Витилиго может возникнуть в любом возрасте, длиться неопределенно долго, самопроизвольное восстановление нормальной окраски кожи наблюдается редко.
Причины появления депигментированных очагов не известны. Недостаточно понятно, в результате каких нарушений резко прекращается синтез меланина и погибают меланоциты. Разные эндогенные и экзогенные факторы могут оказывать прямое и опосредованное повреждающее действие на меланоциты.
Среди внешних факторов наибольшее значение придают инфекционным и токсическим агентам, чрезмерному ультрафиолетовому облучению, стрессам. На протяжении многих десятилетий витилиго связывали с аутоиммунным тиреоидитом, ревматоидным артритом, красной волчанкой, атопическим дерматитом, заболеваниями печени инфекционного или токсического генеза, глистной инвазией и рядом врожденных синдромов [2]. Однако частота встречаемости витилиго у этих больных не выше, чем в популяции в целом. Ряд авторов [3, 4], подводя итоги многолетним исследованиям, считают, что больные витилиго в большинстве случаев не имеют никаких тяжелых или хронических сопутствующих заболеваний, а терапия выявленных у 28% больных функциональных расстройств органов пищеварения, вегетососудистой дистонии не оказывала влияния на результат репигментации.
Многие исследователи считают [5, 6], что витилиго является серьезным косметическим дефектом, возникает у лиц с генетической предрасположенностью и в у большинстве случаев, перенесших эмоциональные расстройства. Лишь у 4—7% больных витилиго сочетается с аутоиммунным тиреоидитом.
В современных генетических исследованиях продемонстрирована связь возникновения витилиго с разными аспектами наследования. Среди спорадических случаев витилиго в европейской популяции средний возраст возникновения заболевания составляет 24,2 года, тогда как в семьях с множественными случаями заболевания средний возраст составляет 21,5 года (статистически достоверные различия) [7]. Более раннее начало заболевания в «семейных» случаях и риск заболевания у отдаленных родственников является типичной характеристикой полигенного заболевания. Около 20% больных витилиго имеют не менее одного кровного родственника с подобным заболеванием. Формально-генетический сегрегационный анализ витилиго определяет существование многих локусов, нарушения в которых формируют предрасположенность к витилиго. Однако не обнаружены ключевые гены, ответственные за манифестацию, прогрессирующее течение или предрасположенность к данному заболеванию.
При витилиго обнаружено снижение антиоксидантного потенциала, приводящего к активному повреждающему воздействию на меланоциты свободных радикалов и накоплению продуктов перекисного окисления липидов [8, 9]. Позднее выяснилось, что свободные радикалы оказывают повреждающее действие на разные клетки, участвующие в воспалительных реакциях разного типа, и нарушения антиоксидантной защиты не являются основными механизмами депигментации при витилиго.
Теория нарушений иммунных механизмов регуляции является наиболее обоснованной. При длительном течении и распространенном патологическом процессе наблюдаются изменения в субпопуляционном составе Т-лимфоцитов. Одновременно с этим, особенно на начальных стадиях заболевания, повышаются уровни активационных рецепторов лимфоцитов, отражающие степень активации иммунокомпетентных клеток [10]. В настоящее время большинство исследователей полагают, что ведущая роль в развитии аутоиммунных заболеваний принадлежит клеточно-опосредованным реакциям, при которых наблюдается выраженный дисбаланс цитокинов. При витилиго выявляется снижение активности регуляторных Т-лимфоцитов, что подтверждается уменьшением количества трансформирующего фактора роста-β (TGF-β) и интерлейкина-10 (ИЛ-10) в сыворотке крови больных [11].
Лечение витилиго является сложнейшей задачей. Так как причины его возникновения неизвестны, в большинстве случаев заболевание развивается на фоне полного физического благополучия. Предлагается применять в основном топические стероиды и/или иммуномодуляторы при площади поражения до 20%, а также длительную фототерапию [12, 13]. В комплексную терапию включают ферментные препараты, гепатопротекторы, витамины и микроэлементы (цинк, медь) [14, 15]. В ряде рекомендаций содержатся сведения о применении седативных и антидепрессивных средств.
Цель настоящего исследования — изучение клинических особенностей течения витилиго и эффективности комплексной терапии, включающей иммуномодулирующий компонент — тимоген и наружно 1% пимекролимус, и коррекцию аффективных расстройств у больных разными формами витилиго с использованием препарата антидепрессивного действия агомелатин.
Материал и методы
Все больные разными формами витилиго были полностью обследованы (проведены клинические анализы крови и мочи, биохимический анализ крови, ультразвуковое исследование органов брюшной полости и щитовидной железы, гормоны щитовидной железы Т3, Т4, тиреотропный гормон — ТТГ и антитела к тиреоидной пероксидазе — АТ-ТПО по показаниям, консультация невропатолога по показаниям, консультация психиатра, иммунологические исследования — популяционный и субпопуляционный состав лимфоцитов, уровень провоспалительных и регуляторных цитокинов).
Результаты
Под нашим наблюдением с 2006 по 2011 г. находились 84 больных витилиго (46 женщин, 38 мужчин) в возрасте от 18 до 56 лет.

Давность заболевания варьировала от 6 мес до 30 лет, средняя продолжительность составила 6,5±4,8 года. Среди вероятных причин развития витилиго большинство больных называли перенесенный стресс (39 пациентов, 46%). Витилиго возникло после оперативных вмешательств у 3 (3,5%) пациентов, после травм — у 4 (4,5%). По мнению 4 (5%) женщин, впервые депигментированные пятна появились у них после родов, в период лактации, причем 1 пациентка отмечала, что после 2- и 3-х родов увеличивалась площадь поражения и появлялись свежие очаги. У 14 (17%) больных заболевание возникло после воздействия длительного ультрафиолетового излучения, 20 (24%) пациентов не могли связать появление депигментированных пятен с какими-либо значимыми причинами (рис. 1). Рисунок 1. Вероятные причины развития витилиго. У 21 больного среди ближайших родственников имелись проявления витилиго разной давности и степени распространенности, у 2 из них, помимо поражений кожи были обесцвечены участки волос.
При обследовании больных витилиго обнаружено, что наиболее часто (у 48 больных, 57,1%) встречаются дискинезия желчевыводящих путей и желчекаменная болезнь, хронический холецистит, жировой гепатоз. Гастрит обнаружен у 16 (19%) больных. В процессе обследования патология щитовидной железы (аутоиммунный тиреоидит, диффузный токсический зоб, кисты щитовидной железы) выявлена или подтверждена у 13 (15,4%) больных витилиго. Только у 4 больных из 13 с патологией щитовидной железы были обнаружены АТ-ТПО, что подтверждало диагноз аутоиммунный тиреоидит.

Гинекологические заболевания (дисфункциональные нарушения менструального цикла, миома) обнаружены у 5 (5,9%) женщин. У 10 (11,9%) больных подтверждена гипертоническая болезнь I—II степени, у 1 (1,2%) выявлен сахарный диабет 2-го типа, у 3 (3,5%) обнаружено алиментарное ожирение II—III степени. Достоверных отклонений от нормальных значений в клинических анализах крови не обнаружено. Тяжелых хронических заболеваний или декомпенсированных состояний у больных витилиго не выявлено (табл. 1).
Мы наблюдали за больными с разными формами витилиго (табл. 2). Среди них 7 (8,3%) больных имели сегментарную форму с площадью поражения 2% (рис. 2). Рисунок 2. Сегментарная форма витилиго. Вульгарная форма наблюдалась у 44 (52,3%) больных. В этих случаях площадь поражения составляла 3—70% площади кожного покрова (рис. 3, а, б). Рисунок 3. Пациентка (а) и пациент (б) с вульгарной формой витилиго. Отдельную группу составили больные с акрофациальной формой (31 человек, 36,9%) с депигментированными очагами на лице и конечностях (рис. 4, а—в). Рисунок 4. Акрофациальная форма витилиго (а—в). У 10 (11,9%) пациентов при клиническом обследовании обнаружены невусы Сеттона (рис. 5). Рисунок 5. Невусы Сеттона.
Витилиго является серьезной психологической проблемой [16, 17]. При исследовании уровня тревожности методом Спилбергера—Ханина низкий уровень реактивной тревожности наблюдается у 52 (61,9%) больных, а у 32 (38,1%) — умеренно выраженная реактивная тревожность. У 55 (77,4%) больных витилиго отмечен высокий уровень личностной тревожности, причем он не зависел ни от площади поражения, ни от давности заболевания. Наличие депрессивных расстройств подтверждены с помощью госпитальной шкалы Гамильтона (средний показатель 13,9±2,4 балла) и шкалы Бека (средний показатель 22,4±2,8 балла). У большинства обследованных выявлялись депрессивные расстройства невротического уровня, характеризующиеся подавленностью настроения, нарушением сна, тревожными и астеническими проявлениями.
Таким образом, в ходе обследования каких-либо тяжелых сопутствующих заболеваний не выявлено. По данным литературы, аффективные и вегетативные нарушения наблюдаются практически у всех больных витилиго и требуют адекватной коррекции.
При иммунологическом исследовании, проведенном 25 больным витилиго, обнаружены достоверные отклонения от контрольных значений в субпопуляционном составе Т-лимфоцитов и дисбаланс провоспалительных цитокинов (табл. 3; рис. 6). Рисунок 6. Содержание цитокинов в сыворотке больных витилиго. Примечание. ИЛ-2, ИЛ-8, ФНО-α, ИФН-γ, ИЛ-10 в пг/мл; TGFβ, в нг/мл. Так, содержание CD8+ в крови больных витилиго было достоверно выше, чем у здоровых, иммунорегуляторный индекс (ИРИ) также имел достоверные отличия от контрольных значений. В сыворотке крови больных витилиго обнаружено повышенное содержание ИЛ-2, ИЛ-6, ИЛ-8 и фактора некроза опухоли-α (ФНО-α), интерферона-γ (ИФН-γ) на фоне низкого уровня регуляторных цитокинов TGF-β и ИЛ-10 по сравнению с контролем.
Комплексное лечение больных проводили с учетом клинических особенностей витилиго, в том числе давности, распространенности и активности патологического процесса. Использовали направленную иммуномодулирующую терапию — тимоген (назальный спрей по 1 мл/сут в течение 20 дней) и пимекролимус (1% крем 2 раза в сутки в течение 4—6 мес). Психокорригирующую терапию проводили агомелатином, который является агонистом мелатонина (МТ1- и МТ2-рецепторов) и антагонистом 5НТ2с. Агомелатин больные витилиго принимали по 25 мг/сут 1 раз в день не менее 6 нед. После консультации психиатра 5 больным с умеренно выраженными признаками депрессии агомелатин был назначен в суточной дозе 50 мг на 12—24 нед.
Мы провели комплексное лечение 57 больным разными формами витилиго (3 пациента — с сегментарной формой, 25 — с акрофациальной, 29 — вульгарной).
У всех больных с сегментарной формой витилиго 100% репигментация наблюдалась через 4 мес после начала терапии.
У больных акрофациальной формой полная клиническая ремиссия отмечена в 16 (64%) случаях через 5 мес терапии. Значительное улучшение со 100% репигментацией большинства очагов и уменьшением площади очагов депигментации более чем на 60% имелось у 7 пациентов. Незначительная эффективность отмечена у 2 больных, причем полностью восстановилась нормальная окраска кожи в периорбитальных и периоральной областях, на тыльной поверхности кистей и в области фаланг площадь депигментированных очагов практически не изменилась, частично (до 40%) уменьшилась площадь очагов в области голеностопных суставов.
Положительные изменения после проведенной комплексной терапии наблюдались у всех больных вульгарной формой витилиго. Клиническая ремиссия отмечалась у 20 из 29 больных данной группы.
В течение первых 3 мес терапии (12 нед) у этих пациентов началась активная репигментация очагов, площадь которых сокращалась на 30—60%. К концу 6-го месяца цвет кожи восстановился полностью.

У 6 больных наблюдалось сокращение площади депигментированных очагов на 50—70% за счет полной репигментации отдельных очагов и частичного восстановления нормального цвета кожи отдельных участков. У 3 пациентов отмечались незначительные позитивные изменения, которые выражались в восстановлении пигментации свежих, небольших по площади участков (не более 2 см 2 ), сглаживании границ по периферии очагов депигментации (табл. 4).
Все больные хорошо переносили лечение, побочных эффектов, осложнений, отказов от терапии не было. В процессе терапии удалось изменить отношение пациентов к своему заболеванию, оценить позитивные изменения в процессе лечения. На фоне активной репигментации очагов нормализовались иммунологические показатели и произошла редукция признаков депрессивных расстройств.
Таким образом, полученные нами результаты свидетельствуют о возможности обоснованного эффективного и безопасного лечения витилиго.
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
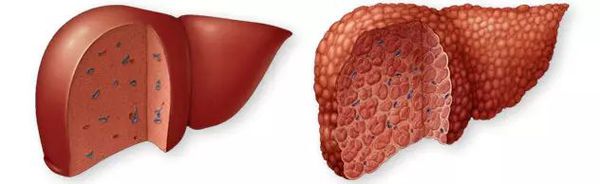
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
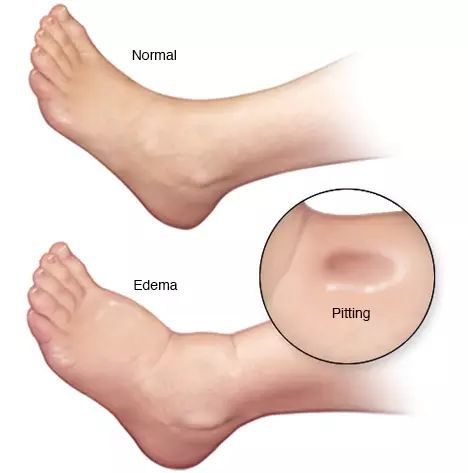
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
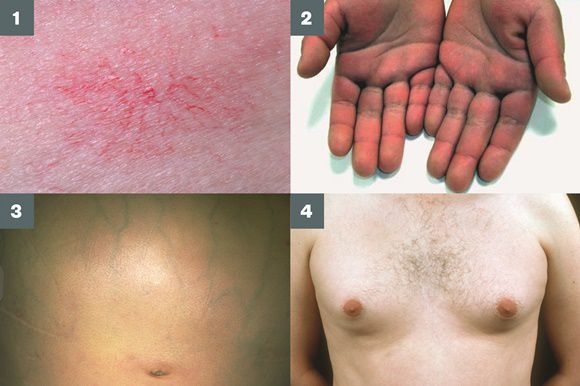
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Читайте также:

