Рецептор эпидермального фактора роста что это
Обновлено: 26.04.2024
Продолжительность жизни больных распространенным EGFR-позитивным НМРЛ, получавших осимертиниб
Осимертиниб является необратимым ингибитором третьего поколения тирозинкиназы рецептора эпидермального фактора роста (EGFR). Препарат избирательно воздействует на клетки немелкоклеточного рака легкого (НМРЛ) с сенсибилизирующими мутациями EGFR, а также резистентной мутацией T790M.
В исследовании 3 фазы FLAURA осимертиниб сравнивался с другими ингибиторами EGFR в первой линии терапии EGFR-положительного НМРЛ. Так, 556 пациентов с мутациями в экзоне 19 или мутацией L858R были рандомизированы в группу осимертиниба или в группу гефитиниба/эрлотиниба. Ранее сообщалось, что в исследовании была достигнута главная цель – риск прогрессирования болезни снижался на 54% у больных, получавших осимертиниб. Данные окончательного анализа общей выживаемости были представлены только сейчас.
Медиана общей выживаемости составила 38,6 месяца в группе осимертиниба и 31,8 месяца в группе ингибиторов EGFR первого поколения. Относительный риск смерти (HR) был 0,8 (95,05% ДИ 0,64-1,00; P=0,046). Через 3 года 28% больных продолжили получать осимертиниб и только 9% – ингибиторы EGFR первого поколения. Медиана продолжительности терапии составила 20,7 месяца и 11,5 месяца в этих группах соответственно. 3-летняя общая выживаемость была 54% и 44%. Согласно подгрупповому анализу, отличий в выживаемости у пациентов азиатской расы не было (HR=1,00), при этом они составляли большую половину популяции (N=347). С другой стороны, эффект осимертиниба на продолжительность жизни у пациентов неазиатской расы был более выраженным, чем в общей группе (HR=0,54). Интересно, что в этом подгрупповом анализе осимертиниб не имел преимуществ по сравнению с ингибиторами первого поколения у пациентов с хорошим статусом по критериям ВОЗ (0) и у пациентов с мутацией L858R.
Частота нежелательных явлений 3 степени и выше была 42% при лечении осимертинибом и 47% – гефитинибом/эрлотинибом.
Авторы сделали вывод, что среди пациентов с ранее нелеченным, распространенным, EGFR-положительным НМРЛ более длительную общую выживаемость имели больные, которые получали осимертиниб. Профиль безопасности для осимертиниба был аналогичен профилю ингибиторов первого поколения, несмотря на большую продолжительность использования препарата.
Источник: Ramalingam SS, et al. N Engl J Med. 2020.
Интервью с экспертом

Артамонова Елена Владимировна
Заведующая отделением химиотерапии №1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, заведующая кафедрой онкологии и торакальной хирургии ФПК ГБУЗ «МОНИКИ им. М.Ф. Владимирского», профессор кафедры онкологии и лучевой терапии «РНИМУ им. Н.И. Пирогова», член правления RUSSCO, доктор медицинских наук, Москва
– Елена Владимировна, какое у Вас общее впечатление от результатов исследования FLAURA?
– Осимертиниб продемонстрировал значительное преимущество по сравнению с ингибиторами тирозинкиназы (ИТК) первого поколения как в отношении выживаемости без прогрессирования и длительности ответа, так и в отношении общей выживаемости. Это первое рандомизированное исследование ИТК EGFR, в котором удалось добиться достоверного увеличения общей выживаемости, ни один из препаратов ИТК прошлых поколений не смог показать таких результатов.
– Считаете ли Вы различия в общей выживаемости между группами статистически значимыми, учитывая цифры относительного риска смерти (HR) 0,8 и различия P=0,046?
– Важно помнить, что первичной конечной точкой исследования была выживаемость без прогрессирования – параметр, который позволяет оценить прямой эффект терапии, в то время как на общую выживаемость влияет не только выбор первой линии терапии, но и все последующие события и стратегия ведения пациента после прогрессирования.
В отношении выживаемости без прогрессирования было продемонстрировано впечатляющее увеличение медианы в группе осимертиниба по сравнению с ИТК первого поколения, кривые выживаемости без прогрессирования начинают расходиться уже при первой оценке эффективности терапии.
Полученные результаты по общей выживаемости демонстрируют, что преимущество по выживаемости без прогрессирования транслируется в увеличение общей выживаемости, несмотря на то, что дизайн исследования предполагал кросс-овер (перекрест) и большое количество пациентов из контрольной группы получили осимертиниб после прогрессирования на ИТК первого поколения. Статистическая мощность исследования закладывалась в первую очередь для оценки именно выживаемости без прогрессирования, однако различия общей выживаемости также достигли статистической значимости, поскольку дизайном исследования значение р для подтверждения статистической значимости при финальном анализе общей выживаемости было определено равным 0,0495.
Медиана общей выживаемости в группе осимертиниба превысила 3 года, а разница между группами составила 6,8 мес. Согласно мнению рабочей группы экспертов Американского общества клинической онкологии (ASCO), клинически значимым улучшением может считаться относительное увеличение медианы общей выживаемости на 20% и более и/или относительный риск (HR) ≤0,8 (что соответствует приросту медианы на 2,5-6 месяцев). Таким образом, можно заключить, что осимертиниб продемонстрировал не только статистически, но и клинически значимое увеличение общей выживаемости.
– Как можно объяснить отсутствие различий по общей выживаемости у больных азиатской расы? А у больных с мутацией L858R?
Разница между подгруппами больных азиатской и не азиатской расы действительно наиболее выражены и в группе азиатской расы (HR почти равен 1), однако если посмотреть на кривые выживаемости для этой группы, видно, что кривые начинают расходиться с самого начала и расхождение сохраняется на протяжении почти 3 лет, при последующем наблюдении присутствует много цензурированных (то есть пропущенных) данных, которые ограничивают возможность интерпретации. Такое расхождение кривых общей выживаемости соответствует ранее полученным результатам подгруппового анализа выживаемости без прогрессирования, в котором показано, что осимертиниб эффективен в том числе и у больных азиатской расы (HR=0,55).
– В практике, если Вы получите заключение, в котором сказано «У пациента имеется мутация EGFR L858R», Вы назначите осимертиниб или отдадите предпочтение, например, гефитинибу?
– Улучшение выживаемости без прогрессирования при применении осимертиниба продемонстрировано у всех пациентов независимо от типа мутации, HR для больных с мутацией L858R равен 0,51. Медиана выживаемости без прогрессирования 14,4 мес. vs. 9,5 мес. при применении осимертиниба и ИТК первого поколения соответственно. Более выраженная эффективность у больных с мутацией гена EGFR в 19 экзоне, по сравнению с теми, у кого мутация обнаружена в 21-м экзоне, общее свойство для всех ИТК.
– Наличие мутации T790M все же будет для Вас главным критерием выбора в пользу осимертиниба?
– Только для пациентов с прогрессией на ИТК предыдущих поколений. В первой линии терапии осимертиниб продемонстрировал превосходящую эффективность у больных с активирующим мутациями, и тестирование на мутацию Т790М больным, ранее не получавшим лечение, не требуется.
– Частота пациентов, получивших последующее лечение при прогрессировании болезни на препаратах в исследовании FLAURA, была выше в группе ингибиторов первого поколения. Почему, на Ваш взгляд? У нас меньше лекарственных опций после осимертиниба? Что бы Вы назначили при прогрессировании на нем?
– Это связано с тем, что на момент анализа бо́льшее количество пациентов в группе осимертиниба продолжают терапию первой линии без прогрессирования болезни (22% в группе осимертиниба vs 5% в группе препаратов сравнения). Доля пациентов, которые не получали последующую терапию, одинакова в обеих группах и составляет 30%.
Что касается возможной тактики при прогрессировании на осимертинибе, прежде всего нужно оценить характер прогрессирования. При бессимптомном прогрессировании, а также при симптомном прогрессировании с метастазами в головной мозг или изолированными метастазами во внутренние органы целесообразно продолжить терапию осимертинибом с добавлением – при необходимости – локальных видов лечения. При системном прогрессировании на осимертинибе могут быть доступны несколько терапевтических опций в зависимости от общего состояния больного, такие как химиотерапия или комбинация иммунотерапии и химиотерапии. Кроме того, в настоящее время проводится ряд исследований по оценке эффективности новых таргетных препаратов в зависимости от того, какой механизм лежит в основе резистентности к осимертинибу.
– 47% больных из тех, кто прогрессировал на первой линии терапии ингибиторами EGFR, получили во второй линии осимертиниб. Как Вы считаете, могло ли это повлиять на результаты общей выживаемости в исследовании?
– С учетом того, что осимертиниб показал высокую эффективность у больных с мутацией Т790М после прогрессирования на ИТК 1-2 поколений, конечно последующее получение осимертиниба могло улучшить результаты по общей выживаемости пациентов из группы сравнения, т.е. влияние осимертиниба на увеличение общей выживаемости по сравнению с ИТК первого поколения может быть недооценено. Но даже при таком значительном кросс-овере удалось впервые показать клинически и статистически значимое преимущество в отношении общей выживаемости.
– Подтверждает ли это гипотезу, что лучше начинать с осимертиниба в первой линии, чем назначать терапию этим препаратом во второй и последующих линиях?
– Применение осимертиниба в первой линии лечения позволит наибольшему количеству пациентов получить пользу от этого препарата: к сожалению, не все пациенты могут продолжить лечение после первого прогрессирования болезни и даже среди тех, кому может быть назначения терапия второй линии, осимертиниб должен использоваться только при подтвержденном наличии мутации Т790М.
– Как бы Вы описали токсичность осимертиниба? Как можно объяснить различия в токсичности между препаратами первого и третьего поколений?
– Профиль безопасности осимертиниба и ИТК первого поколения как минимум сопоставимы, а по некоторым параметрам осимертиниб лучше в отношении переносимости и профиля безопасности.
Частота нежелательных явлений 3 степени и выше в группе осимертиниба и группе сравнения были аналогичными (42% vs 47%), при этом только у 18% пациентов в группе осимертиниба (vs 29% пациентов в группе сравнения) они были расценены как возможно связанные с терапией. Отмена терапии по причине нежелательных явлений требовалась в группе осимертиниба реже, чем в группе сравнения. При этом длительность терапии осимертинибом почти в 2 раза превышала длительность терапии ИТК первого поколения.
Частота нежелательных явлений, характерных для терапии ИТК EGFR, таких как диарея и сыпь, была ниже в группе осимертиниба, что, вероятно, связано с тем, что осимертиниб неактивен в отношении EGFR дикого типа, в отличие от ИТК первого поколения.
В настоящее время огромное число фундаментальных исследований сфокусировано на поиске новых рациональных подходов к противоопухолевой терапии. Понимание молекулярных механизмов, ответственных за митогенную активность трансформированных клеток, открывает новые пути контроля опухолевого роста. Одним из объектов, активно изучаемых в последние годы в качестве новой противоопухолевой мишени, является рецептор эпидермального фактора роста (EGFR).
EGFR - трансмембранный гликопротеин молекулярной массой 170 kD, обладающий тирозинкиназной активностью. EGFR (или HER1) относится к семейству рецепторов эпидермального фактора роста, которое также представлено другими его видами: erbB2/HER2-neu; erbB3/HER3 и erbB4/HER4.
EGFR экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток и участвует в регуляции клеточного роста и дифференцировки. Как и все рецепторные тирозинкиназы, EGFR состоит из трех участков: внеклеточный лиганд-связывающий домен, трансмембранный гидрофобный участок и внутриклеточный тирозинкиназный домен (рис. 1).
Рис. 1. Схематическое строение EGFR.
В роли лигандов выступают экскретируемые нормальными и/или опухолевыми клетками ростовые факторы EGF и TGF-a, которые аутокринным и/или паракринным путем регулируют активность рецептора эпидермального фактора роста. Активация EGFR происходит после связывания одного из специфичных лигандов с внеклеточным доменом, последовательных конформационных изменений в виде димеризации рецептора и реакции фосфорилирования тирозиновых остатков внутриклеточного домена.
На этапе взаимодействия с факторами роста существует возможность не только гомодимеризации EGFR, т.е. образования двух идентичных рецепторов EGFR связанных с общим лигандом, но может произойти и гетеродимеризация EGFR с другими представителями семейства erbB, в частности с рецептором Her2/neu и erB3. Образование гетеродимера приводит к значительному усилению внутриклеточных сигнальных импульсов.
В результате всех этих взаимодействий активированная тирозинкиназа через специальные белки запускает целый каскад внутриклеточных процессов, передающих импульс к ядру клетки и, тем самым, инициирует клеточную пролиферацию и ряд других биологических эффектов, ответственных за опухолевую прогрессию: адгезию и инвазию трансформированных клеток, включение антиапоптотических механизмов (1). Более того, TGF-a и EGF могут индуцировать процессы опухолевого ангиогенеза за счет гиперэкспрессии васкулярного эндотелиального фактора роста (VEGF) (1,2).
Таким образом, можно выделить следующие основные механизмы активации EGFR-зависимых сигнальных путей в опухолевых клетках: 1) гиперэкспрессия EGFR, 2) избыточная продукция факторов роста (TGF-a, EGF), 3) мутация EGFR и, как следствие этого, его повышенная активность при отсутствии факторов роста, 4) гетеродимеризация рецептора.
При ряде опухолей эпителиальной природы (раке легкого, яичников, толстой кишки, предстательной железы, плоскоклеточном раке головы и шеи) обнаруживается избыточная экспрессия EGFR и/или одного из его лигандов (EGF; TGF-a), что может служить причиной повышенной пролиферативной активности трансформированных клеток (3,4). Гиперэкспрессия EGFR опухолевыми клетками, как правило, ассоциируется с поздними стадиями и метастатическим фенотипом заболевания и, соответственно, коррелирует с плохим прогнозом (5).
Таблица 1.
Экспрессия EGFR различными видами опухолей.
В итоге, выбор EGFR в качестве противоопухолевой мишени выглядит вполне обоснованным и логичным. Помимо этого, результаты экспериментальных исследований указывают на возможность усиления цитотоксического действия других противоопухолевых агентов: платиновых производных, доксорубицина, гемцитабина и таксанов при сочетании последних с ингибиторами EGFR (6,7,8). Интересно, что наблюдаемый в этих случаях противоопухолевый синергизм не требует повышенного уровня экспрессия EGFR.
В самом деле, механизмы действия цитотоксических препаратов и EGFR ингибиторов кардинально отличаются, и идея их совместного использования крайне привлекательна. С одной стороны, цитотоксический эффект позволяет добиться максимальной циторедукции, т.е. уменьшения объема опухолевой массы, с другой - дополнительное цитостатическое антипролиферативное воздействие обеспечивает продолжительное сохранение достигнутого эффекта или стабилизации.
Представляется также, что эффективность терапии ингибиторами EGFR должна оцениваться в большей степени с точки зрения отдаленных, чем непосредственных результатов лечения.
Существует несколько возможностей блокирования реализуемого через EGFR биологического эффекта:
- использование моноклональных антител, связывающих экстрацеллюлярный участок рецептора или образующих неактивный комплекс с EGF и TGF-a;
- применение рекомбинантных пептидных лигандов EGF и/или TGF-a, конъюгированных с проникающими внутрь клетки цитотоксинами;
- с помощью низкомолекулярных ингибиторов, способных воздействовать на внутриклеточный домен EGFR и прервать процесс тирозинкиназного фосфорилирования (ZD 1839; OSI-774).
На протяжении последних 15 лет все эти подходы интенсивно разрабатываются в эксперименте с целью поиска новых потенциальных противоопухолевых агентов и внедрения их в клиническую практику. Результатом этого поиска явился синтез таких препаратов как цетуксимаб (С225), иресса (ZD1839) и OSI-774, которые активно изучаются уже в рамках II и III фаз клинических исследований.
Цетуксимаб (С225) представляет собой рекомбинантое химерное моноклональное антитело, обладающее высокой специфичностью к внеклеточному домену EGFR и, соответственно, способное конкурировать с естественными лигандами (EGF; TGF-a) за связывание с рецептором. Препарат синтезирован на основе мышиного моноклонального антитела М225, к которому для снижения иммуногенности присоединили фрагмент человеческого IgG1.
Результаты клинических исследований, проведенных в рамках I фазы и представленных в 2000 г. на ASCO, выглядят многообещающими (таблица 2). Дизайн этих исследований был нацелен на изучение переносимости препарата, фармакокинетических параметров и поиск оптимальной дозы цетуксимаба. Одним из критериев включения являлось наличие гиперэкспрессии EGFR опухолевой тканью, определяемой иммуногистохимическим методом на парафиновых блоках.
Токсичность терапии была незначительной и в основном проявлялась в виде лихорадки, астении, повышении уровня трансаминаз и кожных реакций (угревидной сыпи). За исключением кожной, другие виды токсичности не зависели от разовой и/или суммарной дозы С225. Всего у одного больного на фоне терапии выявлено повышение титра анти-С225 антител.
Таблица 2.
Результаты I фазы клинических исследований по изучению цетуксимаба.
Rubin et al. (10) на небольшой группе больных (8 чел.), ранее уже получавших противоопухолевую лекарственную и/или лучевую терапию, также продемонстрировали хорошую переносимость и потенциальную эффективность комбинации С225+цисплатин и С225+иринотекан.
Вселяют оптимизм представленные в этом году результаты двух других исследований в рамках II фазы. В первом изучена комбинация С225 и гемцитабина у ранее не леченых больных раком поджелудочной железы (12). Цетуксимаб первоначально вводился в насыщающей дозе 400 мг/м 2 с последующей поддерживающей дозой 250 мг/м 2 1 раз в неделю в комбинации с еженедельной инфузией гемцитабина 1000 мг/м 2 в течение 7 недель. Из 41 больного у 5 (12%) наблюдался частичный эффект и еще у 16 (39%) - минимальный ответ или стабилизация болезни. Время до прогрессирования составило 16 недель.
Следует отметить, что в онкологической практике уже накоплен некоторый клинический опыт применения моноклональных антител. Так, за относительно короткий срок трастузумаб (Герцептин), ингибитор Erb2 рецептора, зарекомендовал себя при лечении диссеминированных форм рака молочной железы с повышенным уровнем экспрессии Her2/neu, а ритуксимаб (анти-CD20 антитела) - при лечении злокачественных В-клеточных лимфом.
Однако не меньший интерес с точки зрения практического использования вызывают препараты из группы низкомолекулярных ингибиторов тирозинкиназной активности EGFR - ZD1839 (иресса) и OSI-774. Преимущество препаратов заключается в том, что на их активность не влияет уровень секреции EGF и/или TGF-a, т.к. они не конкурирует с последними за связывание с внеклеточным доменом рецептора, а реализует свое действие уже внутри клетки блокируя фосфорилирование рецепторной тирозинкиназы.
Кроме того, благодаря своей низкой молекулярной массе препараты обладают хорошей проникающей способностью и, что не менее важно, удобны в применении, поскольку назначаются per os.
ZD1839 (Иресса). Препарат синтезирован в лаборатории компании Astra Zeneca. В ходе одного из первых клинических исследований I фазы монотерапия ZD1839 в режиме эскалации дозы от 50 до 700 мг/сутки при минимальной токсичности продемонстрировала убедительную противоопухолевую эффективность в основном у больных немелкоклеточным раком легкого, ранее леченых с помощью стандартных химиотерапевтических подходов (14). Частичные ремиссии (2-9+ мес.) отмечены у 4 (25%) из 16 пациентов и еще в 2 (12%) случаях наблюдались стабилизации (5-5+ мес.). Дозолимитирующим видом токсичности являлась диарея 3 ст., зафиксированная в 3% случаев при использовании максимальной дозы 700 мг/сутки.
Эти результаты подтверждаются данными Baselga et al. (15), которые сообщили об эффективности и хорошей переносимости Ирессы при лечении 127 больных различными видами опухолей. Максимальная переносимая доза не была достигнута. Из токсических проявлений 1-2 ст. ведущее место занимали кожные реакции (58%), диарея (44%), тошнота (25%) и рвота (22%). Всего 4 пациента были досрочно исключены из исследования в связи развившейся токсичностью 3-4 ст.: у 1 больного отмечалась кожная сыпь и у 3 - диарея, которая носила обратимый характер.
Несмотря на то, что объективного эффекта удалось добиться только у 2 пациентов (немелкоклеточный рак легкого и рак предстательной железы), частота минимальных эффектов (3 больных) и стабилизаций заболевания продолжительностью более 3 мес. (29 больных) приближалась к 41%. Минимальная доза препарата, при которой регистрировались ремиссии, составляла 150 мг/сутки. На данном этапе, ориентируясь на результаты 6 клинических исследований I фазы, в которые в общей сложности включены более 300 больных, можно сделать вывод о том, что биологически эффективная доза препарата значительно ниже максимальной переносимой дозы и колеблется от 250 мг до 500 мг.
Успешное завершение I/II фазы клинических исследований позволило инициировать рандомизированные плацебо контролируемые многоцентровые исследования в рамках III фазы по изучению роли ZD1839 в наиболее активных химиотерапевтических комбинациях (гемцитабин/цисплатин и паклитаксел/карбоплатин) у больных немелкоклеточным раком легкого. В предстоящем сравнительном анализе выживаемость больных будет являться основным показателем, определяющим эффективность того или иного лекарственного подхода.
Рассматриваются также возможности комбинированного применения герцептина и ирессы у больных раком молочной железы при одновременной экспрессии опухолью EGFR и Her2/neu, которая может встречаться в 10-36% случаев (5). Для этого подхода имеются свои предпосылки. Во-первых, доклинические исследования показывают, что трастузумаб не снимает EGF индуцированную активность рецептора эпидермального фактора роста (16), во-вторых, сочетание двух препаратов сопровождается более выраженным угнетением пролиферативной активности опухолевых клеток in vitro (17).
OSI-774 - другой низкомолекулярный ингибитор EGFR с потенциально широкими возможностями использования в клинической практике. Препарат доказал свою активность у больных плоскоклеточным раком головы/шеи и немелкоклеточным раком легкого в ходе II фазы клинических исследований. Предклинические испытания показали, что применение OSI-774 в ежедневной дозе 150 мг/сутки обеспечивает достаточную для реализации противоопухолевого эффекта концентрацию препарата в сыворотке крови.
В другой работе неплохих результатов удалось добиться у больных с IIIB-IV стадиями немелкоклеточного рака легкого с прогрессированием и/или рецидивом болезни после проведенной химиотерапии с включением платиновых производных (19). В группе из 56 пациентов, получавших монотерапию OSI-774, у 6 (11%) больных зафиксирована частичная ремиссия и у 19 (34%) - стабилизация заболевания. Причем эффекты наблюдались вне зависимости от степени экспрессии EGFR опухолью и регистрировались также при низких значениях этого показателя.
Суммируя все вышеизложенное, можно констатировать, что постепенно с развитием фундаментальной науки открываются новые перспективы лекарственного лечения злокачественных новообразований. Регулирование активности EGFR - это только один из многих принципиально новых механизмов противоопухолевого контроля, которые успешно пробивают себе дорогу в клиническую практику.
T790M — обозначение мутации, которая происходит в гене рецептора эпидермального фактора роста (EGFR). Этот белок представляет собой рецептор, встроенный в клеточную мембрану. Когда он активируется, в клетке запускается каскад биохимических реакций, и она начинает бесконтрольно размножаться.
Мутации, активирующие ген EGFR, встречаются в разных злокачественных опухолях, в частности, при раке легкого. Существуют таргетные препараты, с помощью которых можно заблокировать этот белок: гефитиниб (Иресса), эрлотиниб (Тарцева), афатиниб (Гиотриф). Их назначают при местно-распространенном или метастатическом раке легкого, и они эффективны примерно у 10–20% пациентов с этим заболеванием.
Однако, даже если поначалу ингибиторы EGFR хорошо помогали, постепенно их эффективность снижается. Она сходит на нет в течение 8–12 месяцев. Заболевание начинает снова прогрессировать, в таких случаях говорят, что развилась резистентность. Это происходит из-за того, что в опухолевых клетках возникают новые мутации. Одна из них — T790M.
В чем суть мутации, и как это влияет на эффективность лечения?
Ген белка EGFR находится в седьмой хромосоме. Сам белок является трансмембранным, то есть встроен в клеточную мембрану. Он выполняет рецепторную функцию — принимает сигналы извне и вызывает в клетке определенные эффекты путем активации каскадов биохимических реакций.
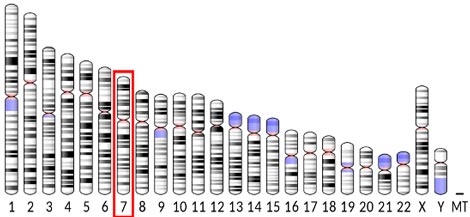
Расположение гена EGFR в геноме человека.
EGFR активируется, когда соединяется с определенными молекулами-лигандами, например, эпидермальным фактором роста. После этого две молекулы EGFR объединяются — происходит реакция димеризации. Далее, чтобы сигнал передался внутрь клетки, и запустилась цепочка биохимических реакций, нужно, чтобы с частью EGFR, находящейся внутри клетки (тирозинкиназой), связалась молекула аденозинтрифосфата (АТФ).
Из-за некоторых мутаций EGFR постоянно активируется, и клетка начинает бесконтрольно размножаться. Таргетные препараты, такие как гефитиниб и эрлотиниб, занимают место АТФ и не дают ему присоединиться к тирозинкиназе. За счет этого сигнал блокируется.
Однако, все меняется, когда в гене EGFR возникает мутация T790M. Из-за нее повышается сродство тирозинкиназы к АТФ. В результате таргетные препараты не могут вытеснить аденозинтрифосфат и перестают оказывать эффекты.
Известно, что на лечение гефитинибом и эрлотинибом реагируют 10–20% всех пациентов с немелкоклеточным раком легкого и около 85% пациентов с мутацией EGFR. Но даже у них спустя некоторое время развивается резистентность. Более чем в 50% случаев это происходит из-за мутации T790M. В остальных случаях виноваты другие вторичные мутации, такие как L747S, D761Y, Т854А. В некоторых злокачественных опухолях играет роль амплификация (увеличение количества копий) MET, сверхэкспрессия HGF, IGF-1R. Генетические исследования помогают разобраться в причинах лекарственной устойчивости раковых клеток и выбрать дальнейшую оптимальную тактику лечения.
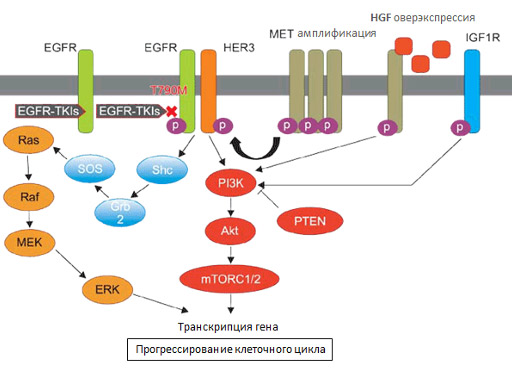
На рисунке показана цепочка биохимических реакций, которую активирует EGFR, действие препаратов, эффекты мутации T790M и других вторичных мутаций. Обозначения: EGFR-TKIs — ингибиторы EGFR; p — фосфорилирование в результате реакции с АТФ.
Аббревиатура T790M отражает характер мутации: в белке происходит замена аминокислоты треонина (T) на метионин (M) в положении 790. Соответственно, в гене происходит замена цитозина на тимин во второй «букве» кодона 790. Так одна небольшая, точечная ошибка кардинальным образом меняет работу белка и реакцию злокачественной опухоли на таргетную терапию.
В каких случаях нужно проводить анализ на мутацию T790M?
Мутации в гене T790M бывают первичными, и тогда пациент изначально не будет реагировать на лечение, но чаще всего они возникают вторично. Именно поэтому терапия сначала работает, а потом становится неэффективной.
Таким образом, тестирование на мутацию T790M показано всем пациентам с немелкоклеточным раком легкого, которые перестали реагировать на терапию ингибиторами тирозинкиназы EGFR.
Как понять, что лечение перестало работать? Для этого пациент регулярно проходит контрольные обследования. Если заболевание начинает прогрессировать (растут опухолевые очаги, появляются новые) — значит, лечение больше не помогает.
Как выявляют мутацию?
Для тестирования не подходят образцы ткани, которые были получены во время предыдущей биопсии и хранятся в лаборатории. Ведь если ранее ингибиторы EGFR помогали, то мутации не было, она возникла позже.
Нужно получить новый материал. Проще всего провести анализ крови: в ней присутствует циркулирующая ДНК опухолевых клеток, и можно обнаружить мутацию T790M. Если результат положительный («мутация обнаружена»), то его подтверждать не требуется. В таких случаях ошибки практически исключены.
Схема обследования при подозрении на мутацию T790M может выглядеть следующим образом:
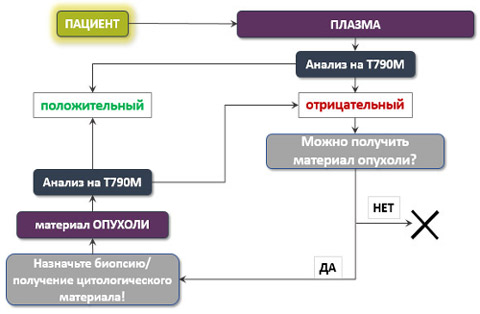
Как лечить онкологических больных, у которых обнаружена мутация T790M?
Для того чтобы в обществе царили мир и порядок, каждый человек должен соблюдать закон и уважать интересы окружающих. Это правило работает не только в социуме, но и в биологии. Тело человека, как и любого другого многоклеточного организма, не сможет существовать, если его отдельные клетки не будут подчиняться общим законам. Каждый житель «многоклеточного государства» должен знать свое место, выполнять определенные функции и помнить, что он — часть единого целого.
Что же заставляет живые клетки позабыть об эгоизме и работать на благо всего организма? Это свойство закодировано в их генетическом коде. Существуют определенные молекулы, белки, которые регулируют клеточную жизнь.
Одна из таких молекул — рецептор эпидермального фактора роста, по-английски — epidermal growth factor receptor, сокращенно — EGFR. Еще его обозначают как ErbB-1 и HER1. За открытие этой молекулы в 1986 году получили Нобелевскую премию два ученых — американский биохимик Стэнли Коэн и итальянский биолог Рита Леви-Монтальчини.
Какие функции в организме выполняет рецептор эпидермального фактора роста?
В названии этого белка не случайно есть слово «рецептор». В анатомии рецепторами называют нервные окончания, благодаря которым мы ощущаем прикосновения, тепло, холод, боль и пр. В молекулярной биологии это белок, который находится на поверхности клетки и обеспечивает её «чувствительность» к определенным молекулярным сигналам.
Молекула EGFR как бы пронизывает клеточную мембрану: одна ее часть «выглядывает» наружу, а другая находится внутри клетки.
Когда сигнальная молекула (например, эпидермальный фактор роста) достигает клетки и взаимодействует с EGFR, этот белок активируется и запускает внутри клетки каскад биохимических реакций. В итоге клетка начинает размножаться.
Такой сигнал должен «включаться» строго в определенное время. Его усиление или ослабление грозят серьезными последствиями. Если EGFR недостаточно активен, у человека может развиваться болезнь Альцгеймера. А чрезмерная активность рецептора приводит к тому, что клетка бесконтрольно размножается — и это может привести к раку. А начинается всё с генов. Белок EGFR становится чрезмерно активен при определенных мутациях. Из-за одних генетических дефектов этого белка слишком много, из-за других меняется его структура. А итог один — клетки постоянно делятся.
Мутации EGFR и рак
Мутации гена EGFR определяются при разных типах рака, включая злокачественные опухоли легких, головы и шеи, толстой кишки, поджелудочной, молочной железы, яичников, мочевого пузыря, почек и др.
Из-за повышенной активности рецептора эпидермального фактора роста опухолевые клетки быстрее размножаются, агрессивнее вторгаются в окружающие ткани, метастазируют. Усиливается ангиогенез — образование новых кровеносных сосудов, питающих опухоль.
В общем наличие мутации EGFR в опухолевых клетках ухудшает прогноз для пациента.
Когда ученые поняли, что рецептор эпидермального фактора роста играет роль в развитии рака, возникла идея создать лекарственные препараты, которые могли бы блокировать этот белок. И сегодня такие препараты существуют.
Но нужно понимать, что молекулярно-генетические характеристики и гистологический тип рака — разные и не всегда связанные между собой вещи. Если взять две одинаковые злокачественные опухоли легких, то в одной активность EGFR может быть повышена, а в другой нет. Рассматривая опухоль под микроскопом, нельзя сказать, есть ли в ней такие мутации, будут ли в данном случае эффективен препараты из группы блокаторов EGFR. Для этого нужны специальные анализы. И они тоже существуют.

Кому показан анализ на EGFR?
В настоящее время показанием к исследованию является немелкоклеточный рак легкого (НМРЛ), в особенности если он представлен аденокарциномой (гистологический тип НМРЛ, который встречается в 40% случаев), в случаях, когда пациенту показано лечение ингибиторами EGFR. Это исследование помогает проверить, будет ли пациент реагировать на терапию.
- Ингибиторы EGFR эффективны у 80% больных, имеющих мутацию в гене рецептора эпидермального фактора роста. Причем, у некоторых из этих пациентов препараты действуют довольно сильно и в течение длительного времени.
- При отсутствии данных мутаций ингибиторы EGFR эффективны лишь у 10% пациентов.
Не все мутации в гене EGFR делают рак чувствительным к ингибиторам рецептора эпидермального фактора роста. Некоторые, напротив, вызывают резистентность. Одна из таких мутаций обозначается как T790M. Если она обнаружена, применяют препарат, который эффективен в таких случаях — осимертиниб. Именно из-за мутации T790M злокачественные опухоли чаще всего (в 60% случаев) перестают реагировать на ингибиторы EGFR.
Анализ на мутации в гене EGFR может быть выполнен как отдельно, так и в составе панели, которая также включает исследования других мутаций — в частности, в генах KRAS, ALK, ROS1, BRAF. Это поможет врачу подобрать оптимальную терапию.
Специалисты из Колледжа американских патологов (CAP), Международной ассоциации по изучению рака легких (IASLC) и Ассоциации по молекулярной патологии (AMP) рекомендуют всем пациентам с раком легких, в частности, аденокарциномой, сдавать анализы на наличие генетических мутаций, при которых показано лечение таргетными препаратами, независимо от пола, этнической принадлежности и отношения к курению.
Избыточная активность гена рецептора эпидермального фактора роста, как мы упомянули, встречается и при других типах рака. Но на данный момент анализ рекомендован только при немелкоклеточном раке легкого.
Методы определения статуса мутаций EGFR
Для того чтобы провести анализ на мутации в гене EGFR, нужно провести биопсию — получить образец опухолевой ткани. При этом образец должен быть достаточно большого размера и содержать достаточное количество опухолевых клеток. Поэтому важно, чтобы забор материала проводил опытный врач, который хорошо владеет этим навыком.
Для того чтобы обнаружить мутантный ген EGFR, обычно применяют полимеразную цепную реакцию (ПЦР): метод предполагает создание множества копий ДНК с помощью ферментов.
Когда анализ завершен, лаборатория выдает одно из двух заключений:
- Результат положительный: обнаружена мутация в гене EGFR, при этом указывают, какая именно.
- Результат отрицательный: мутация не обнаружена.
На основе этих данных врач (онколог, химиотерапевт) определяется с дальнейшей тактикой лечения.
Методы лечения: ингибиторы EGFR и их эффективность
Ингибиторы EGFR относятся к группе таргетных препаратов. В отличие от классических химиопрепаратов, они действуют прицельно, на определенную молекулу, а не поражают все подряд быстро размножающиеся клетки.
Для лечения рака легкого применяют такие ингибиторы EGFR, как гефитиниб (Иресса), эрлотиниб (Тарцева), афатиниб (Гиотриф), бригатиниб (Алунбриг), икотиниб (Конмана). При раке толстой кишки применяют цетуксимаб (Эрбитукс), панитумумаб (Вектибикс).
Ингибиторы EGFR имеют разную химическую структуру, разные механизмы действия, и в зависимости от этого их можно разделить на две большие группы:
- «Малые молекулы» воздействуют на тирозинкиназу — часть EGFR, которая находится внутри клетки и запускает каскад биохимических реакций при активации рецептора. К этой группе относятся: Тарцева, Иресса, Алунбриг.
- Моноклональные антитела — аналоги антител, которые работают в составе иммунной системы и защищают организм от инфекций, других патогенов. Они распознают участок EGFR, который находится снаружи клетки, связываются с ним и не дают рецептору активироваться. К этой группе относят Эрбитукс, Вектибикс.
При раке легкого ингибиторы EGFR чаще всего используют на поздних стадиях, отдельно или в сочетании с химиопрепаратами.
Таргетные препараты действуют более прицельно по сравнению с классическими химиопрепаратами, тем не менее, они могут приводить к некоторым побочным эффектам. При применении ингибиторов EGFR чаще всего возникают такие проблемы, как сыпь и инфекции кожи, диарея, потеря аппетита. Более серьезные побочные эффекты встречаются редко.
Гефитиниб (Иресса) в лечении больных с мутацией EGFR
Гефитиниб — таргетный препарат из группы ингибиторов EGFR для лечения немелкоклеточного рака легких в случаях, когда опухоль проросла в окружающие ткани, либо имеются отдаленные метастазы. В 2002 году он был одобрен в Японии, в 2003 году — в США. На данный момент гефитиниб продается более чем в 60 странах мира.
Препарат принимают в виде таблеток, по одной в день. Доказано, что в более высоких дозах гефитиниб не действует более эффективно, но возрастает риск побочных эффектов.
Чем доказана эффективность гефитиниба?
В 2009 году завершилась третья фаза клинического исследования, в котором участвовали пациенты с запущенной аденокарциномой легкого из Восточной Азии. Испытуемых поделили на три группы. В первой группе лечение проводилось гефитинибом, в двух других — химиопрепаратами карбоплатином и паклитакселом. В подгруппе пациентов, имеющих мутацию гена EGFR, эффективность гефитиниба оказалась значительно выше.
Имянитов Евгений Наумович
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Онкоген HER2 (ERBB2/NEU) был идентифицирован в середине 1980-х гг. посредством различных экспериментальных подходов, в частности, как гомолог рецептора эпидермального фактора роста (Human Epidermal growth factor Receptor 2 – HER2), второй гомолог вирусного онкогена erbB (ERBB2), а также онкоген нейроглиобластомы у крыс (NEU) [Schechter et al., 1994; Coussens et al., 1985; Semba et al., 1985]. Данный ген кодирует рецепторную тирозинкиназу, которая отличается исключительно сильной активностью и способностью образовывать гетеродимеры с другими белками семейства HER (EGFR/HER1, HER2, HER4) [Hudis et al, 2007]. В 1987 г. Dennis Slamon и соавт. продемонстрировали высокую встречаемость активации гена HER2 в опухолях молочной железы и причастность этого явления к агрессивному течению заболевания [Slamon et al., 1987]. Более того, в ходе модельных экспериментов были представлены неопровержимые аргументы в пользу прямого участия онкогена HER2 в процессах злокачественной трансформации; соответственно, направленная инактивация данного гена в опухолевых клетках сопровождалась частичной реверсией злокачественного фенотипа [Wada et al., 1990].
Онкоген HER2 (ERBB2/NEU) был идентифицирован в середине 1980-х гг. посредством различных экспериментальных подходов, в частности, как гомолог рецептора эпидермального фактора роста (Human Epidermal growth factor Receptor 2 – HER2), второй гомолог вирусного онкогена erbB (ERBB2), а также онкоген нейроглиобластомы у крыс (NEU) [Schechter et al., 1994; Coussens et al., 1985; Semba et al., 1985]. Данный ген кодирует рецепторную тирозинкиназу, которая отличается исключительно сильной активностью и способностью образовывать гетеродимеры с другими белками семейства HER (EGFR/HER1, HER2, HER4) [Hudis et al, 2007]. В 1987 г. Dennis Slamon и соавт. продемонстрировали высокую встречаемость активации гена HER2 в опухолях молочной железы и причастность этого явления к агрессивному течению заболевания [Slamon et al., 1987]. Более того, в ходе модельных экспериментов были представлены неопровержимые аргументы в пользу прямого участия онкогена HER2 в процессах злокачественной трансформации; соответственно, направленная инактивация данного гена в опухолевых клетках сопровождалась частичной реверсией злокачественного фенотипа [Wada et al., 1990].
Лабораторное тестирование статуса онкогена HER2
В рутинной клинической практике используется 2 основных метода диагностики статуса онкогена HER2: иммуногистохимия (ИГХ) и гибридизация in situ (in situ hybridization, ISH) [Wolff et al., 2007; Sauter et al., 2009].
Иммуногистохимический метод выявления активации HER2 получил наибольшее распространение. Принцип его действия основан на взаимодействии антигена и антител. В качестве антигена выступает определенный эпитоп (участок) белка HER2. К этому эпитопу фирмы-производители диагностических наборов подбирают специфические антитела. Применение иммуногистохимического метода подразумевает инкубацию диагностических антител с иммобилизованным на предметном стекле гистологическим срезом опухоли. При этом антитела взаимодействуют со специфическим белком-антигеном и остаются «прикрепленными» к срезу даже после промывки препарата. Как сделать провзаимодействовавшие антитела видимыми для детекции? Для этого используется технология т.н. «сэндвича», подразумевающая применение вторых, «меченых» антител. Например, если для взаимодействия с антигеном-мишенью используются моноклональные мышиные антитела, то для детекции образовавшихся комплексов антиген-антитело добавляются «антимышиные» антитела, имеющие встроенную метку для визуализации.
Иммуногистохимия имеет колоссальные преимущества по сравнению с другими методами. Эта разновидность анализа чрезвычайно проста, не требует дорогостоящего оборудования и может использоваться в любой морфологической лаборатории. Иммуногистохимия позволяет визуализировать компоненты среза, которые демонстрируют окрашивание, в частности, дифференцировать опухолевую и внеопухолевую экспрессию того или иного белка. Помимо этого, ИГХ помогает локализовать нахождение белка внутри клетки, в частности, дискриминировать между мембранным, цитоплазматическим и ядерным окрашиванием.
Помимо преимуществ, ИГХ имеет целый ряд ограничений. Традиционный протокол иммуногистохимического прокрашивания по своему принципу напоминает проявление черно-белых фотографий в домашних условиях. В случае обработки фотографий критическим фактором является состояние проявителя, а также время и условия инкубации (фотографы-любители знают, что «свежий» проявитель «работает» лучше «старого», и обычно контролируют время инкубации «на глаз», прекращая процесс проявления по мере достижения желаемой интенсивности снимков). В случае иммуногистохимии в качестве «проявителя» выступает раствор специфических антител. Разумеется, применение столь критического реагента подразумевает его одинаковую рабочую активность от партии к партии. В реальности антитела могут частично разрушаться при хранении, особенно при несоблюдении требуемых условий или сроков. Помимо этого, скорость взаимодействия антител и антигена чрезвычайно зависит от температуры инкубации: столь важный фактор должен контролироваться с точностью до градуса, однако подобное требование на практике не всегда выполняется. Многие лаборатории практикуют нанесение раствора антител на поверхность гистологического среза; подобное прокрашивание «в капле» позволяет экономить антитела, но не обеспечивает идеальных условий инкубации. Альтернативой является применение специальных ванночек для предметных стекол, которые предназначены для относительно больших объемов раствора антител (десятки миллилитров); в этом случае условия инкубации отличаются хорошей воспроизводимостью, однако расход антител существенно возрастает. Помимо изложенных выше объективных особенностей метода следует признать, что в большинстве отечественных лабораторий в целях экономии практикуется разведение антител ниже рекомендованных производителем концентраций.
Гибридизация in situ ориентирована на оценку копийности гена-мишени. В качестве специфического зонда используется одноцепочечный нуклеотидный фрагмент гена, помеченный специальной меткой. Этот фрагмент гибридизуется с гистологическим препаратом, содержащим денатурированную ДНК. ДНК-зонд распознает ген-мишень по принципу комплементарности и образует двуцепочечные молекулы ДНК. Каждая копия гена визуализируется в виде отдельной «точки». В норме клетки (ядра) содержит 2 точки, при делеции генетического материала количество точек на клетку уменьшается до 1 или 0, а при амплификации – возрастает в зависимости от степени увеличения копийности гена. Результаты ISH обычно оценивают при помощи подсчета количества «точек» в нескольких десятках клеток опухоли. В отличие от иммуногистохимии, в ISH всегда присутствует внутренний стандарт. При оценке геномного статуса HER2 в качестве контроля может использоваться фрагмент генетического материла, расположенный в центре хромосомы 17; увеличение копийности гена HER2, локализованного на длинном плече той же хромосомы, выражается соотношением количества HER2-специфических и контрольных сигналов. В случае отсутствия гена-рефери копийность гена HER2 оценивается по среднему количеству сигналов HER2 в ядрах опухолевых клеток; при этом нормальные клетки гистологического препарата, содержащие 2 копии гена, выступают в качестве контроля. В отличие от ИГХ, ISH отличается объективностью оценки результатов и хорошей воспроизводимостью.
Наибольшее распространение получила т.н. флуоресцентная гибридизация in situ (FISH). К недостаткам этого метода следует отнести проблематичность визуальной гистологической оценки препарата, а также необходимость в специальном оборудовании. Значительную популярность приобрели различные модификации FISH, в частности «chromogenic in situ hybridization» (CISH, хромогенная гибридизация in situ). В отличие от исходного метода, в CISH используются цветные метки, поддающиеся визуализации в обычном световом микроскопе. Таким образом, CISH не требует специального оборудования для детекции флуоресцентного сигнала и позволяет осуществлять гистологическую оценку изучаемого препарата [Tanner et al., 2000].
Показания к HER2-тестированию
Статус онкогена HER2 определяется у всех больных, для которых рассматривается вопрос о применении антагонистов этого рецептора. Наиболее очевидной категорией пациенток являются женщины с метастатическим раком молочной железы. Другую группу больных составляют прооперированные случаи инвазивного РМЖ, для которых может представляться целесообразным адъювантное лечение Герцептином. Следует учитывать, что показания к специфическому адъювантному лечению HER2-позитивных РМЖ достаточно широки. В частности, они включают опухоли с наличием как минимумом 1 вовлеченного лимфатического узла или отсутствием экспрессии рецепторов эстрогенов и прогестерона; если же РМЖ демонстрирует положительную окраску по ER и/или PR и имеет статус N0, то наличие даже одного дополнительного фактора риска рецидива (размер карциномы более 2 см; умеренная или высокая степень злокачественности опухоли; возраст пациентки моложе 35 лет) считается достаточным оправданием для назначения Герцептина. Таким образом, в качестве кандидатов для адъювантного лечения данным препаратом не рассматриваются только те исключительно редкие случаи РМЖ, которые характеризуются маленьким размером первичного новообразования, отсутствием лимфогенного метастазирования на момент диагноза, низкой степенью злокачественности опухоли, наличием гормональных рецепторов и возрастом старше 35 лет. Следует прокомментировать, что карциномы молочной железы in situ (внутрипротоковые раки без инвазивного компонента), несмотря на частую гиперэкспрессию HER2, не подвергаются адъювантному лечению антагонистами данной тирозинкиназы.
Новое в стандартах HER2-тестирования
Опыт клинического применения Герцептина, а также появление дополнительных показаний к его назначению несколько видоизменили стандарты HER2-тестирования. Примечательно, что в настоящее время существуют некоторые различия в подходах к определению статуса HER2 при раке молочной железы и желудка.
В диагностике рака молочной железы в настоящее время сосуществуют 2 альтернативных подхода к выявлению активации HER2. Первый предусматривает двухэтапную процедуру. Исследование начинается с иммуногистохимического анализа экспрессии HER2-белка. Случаи с сильным окрашиванием (3+) сразу расцениваются как HER2-позитивные и отбираются на терапию Герцептином без каких-либо дополнительных процедур. РМЖ с отсутствием реактивности (0) или слабым окрашиванием (1+) исключаются из дальнейшего рассмотрения. Образцы со степенью окраски 2+ повергаются дополнительной процедуре – ISH-анализу – и направляются на лечение Герцептином только в случае обнаружения амплификации гена HER2 [Wolff et al., 2007; Sauter et al., 2009]. Альтернативный подход к HER2-тестированию предусматривает полный отказ от иммуногистохимии и использование ISH в качестве единственного лабораторного метода HER2-анализа [Sauter et al., 2009]. Сторонники теста на амплификацию гена HER2 акцентируют внимание на общеизвестных недостатках ИГХ (недостаточная межлабораторная воспроизводимость и субъективизм оценки результатов), а также на почти полное соответствие геномного и экспрессионного статуса данного онкогена. Существенно, что один из главных аргументов против расширенного использования ISH – несколько большая стоимость по сравнению с ИГХ – представляется абсолютно несостоятельным, если принять во внимание потенциальный источник экономии – отказ от заведомо безрезультатного многомесячного лечения HER2-ингибиторами.
Опыт HER2-тестирования РМЖ показывает, что ложно-позитивные результаты встречаются значительно чаще ложно-негативных. В целях устранения этого недостатка в 2007 г. были значительно сужены критерии, позволяющие расценивать опухоль как 3+ по результатам иммуногистохимического теста и проводить лечение Герцептином без подтверждения активации этого гена посредством ISH-анализа. Если ранее для присуждения статуса 3+ считалось достаточным выявить сильное мембранное окрашивание как минимум 10% опухолевых клеток, то в настоящее время этот порог повышен до 30% [Wolff et al., 2007].
Рекомендации к HER2-тестированию опухолей желудка заметно отличаются от таковых для РМЖ. Во-первых, анализ состояния гена HER2 всегда начинается с иммуногистохимического исследования. Во-вторых, для присвоения статуса 3+ достаточно наблюдать выраженное окрашивание 10% исследованных клеток. В третьих, при анализе карцином желудка не применяется требование к полному мембранному окрашиванию. В четвертых, рекомендуется анализировать несколько участков опухоли (как минимум 6-8), при этом обнаружение активации гена HER2 даже в одном из исследованных образцов расценивается как достаточное условие для назначения Герцептина [Rüschoff et al., 2010].
Все перечисленные выше подходы к идентификации HER2-активированных опухолей имеют значительные ограничения, поэтому в настоящее время осуществляется интенсивный поиск новых методов HER2-тестирования. В частности, исключительно хорошие результаты продемонстрировал протокол оценки статуса HER2 по уровню его экспрессии на уровне РНК, основанный на применении полимеразной цепной реакции (ПЦР; polymerase chain reaction, PCR). При использовании данной методики из опухолевого материала сначала выделяется тотальная РНК, а затем на матрице РНК при помощи фермента обратной транскриптазы синтезируется комплементарная ДНК (кДНК); именно кДНК является непосредственным субстратом для молекулярного анализа. В ходе ПЦР-теста осуществляется мониторинг кинетики накопления HER2-специфического продукта в режиме реального времени (real-time PCR). Примечательно, что в случае активации гена HER2 наблюдается 100-кратное и более увеличение уровня его транскрипта; столь высокие отличия от «нормального» статуса HER2 значительно облегчают отбор пациентов на лечение HER2-ингибиторами [Baehner et al., 2010; De et al., 2010].
Читайте также:

