Реактивные изменения эпителия пищевода что это
Обновлено: 19.04.2024
Причины и признаки воспаления пищевода
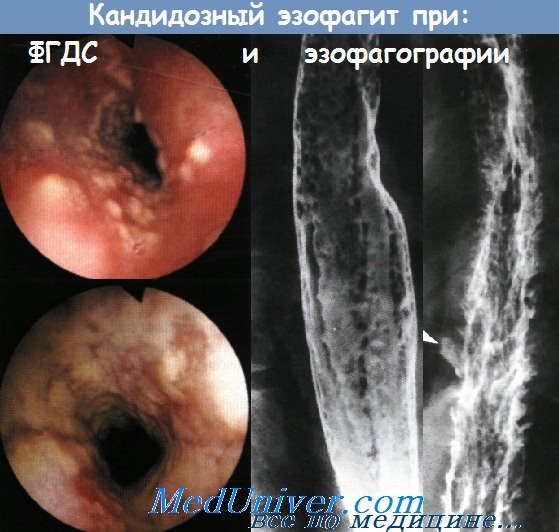
У неспецифического эзофагита, который проявляется болью при глотании и изжогой, существует целое множество причин. Наиболее распространенным этиологическим фактором инфекционного эзофагита является микроорганизм Candida albicans. Риск данного заболевания повышен у пациентов с иммунодефицитом, либо длительно принимающим антибактериальные препараты; основными симптомами являются боль и дисфагия.
Для постановки диагноза исследования только лишь полости рта недостаточно, потому что часто кандидозный эзофагит не сопровождается образованием налетов в полости рта или глотке. Грибковую инфекцию стоит заподозрить при обнаружении при эзофагоскопии белесоватых бляшек с эритематозным основанием. Лечение состоит в назначении топических или системных противогрибковых препаратов. Топическое лечение можно начать с назначения раствора нистатина для полоскания и глотания (400000-600000 ЕД 4 раза в день) или пастилок клотримазола (одна 10 мг пластинка медленно рассасывается 5 раз в день). При применении топических препаратов эффективность лечения зависит от достаточного контакта между препаратом и слизистой оболочкой.
Если топическое лечение оказывается неэффективным, предпочтительно назначение перорального флюконазола. Минимальная начальная нагрузочная доза составляет 200 мг, затем по 100-200 мг в течение 14-21 дня. При неэффективности такого лечения следует взять биопсию с посевом культуры гриба.
Лекарственный эзофагит сопровождается появлением точечных изъязвлений на слизистой пищевода, вызван он постоянным длительным контактом слизистой оболочки с лекарственным препаратом. По всей видимости, лекарственный эзофагит развивается из-за того, что лекарственный препарат медленнее проходит по пищеводу и вызывает его местное химическое раздражение. Наиболее часто лекарственный эзофагит вызывается теграциклинами, хлористым калием, доксициклином, аспирином и бифосфатами.
К основному фактору риска развития лекарственного эзофагита относится неправильный прием медикаментов (прием препарата без достаточного количества жидкости и/или прием препарата сразу перед тем, как принять горизонтальное положение). Степень повреждения может разниться от поверхностного воспаления до формирования глубоких язв и стриктур. Как правило, заболевание разрешается самостоятельно в течение нескольких дней. Самым главным является его предотвращение, а не лечение. По мере заживления пищевода все препараты желательно принимать в жидком виде. В качестве дополнительного лечения могут использоваться антирефлюксные препараты. Также способствует заживлению и защищает слизистую оболочку суспензия сукральфата.
Пациентов нужно предупреждать о том, что лекарственные препараты следует запивать большим количеством воды, а после их приема находиться в вертикальном положении. Если пациент не может пить и принимать пищу из-за выраженных болей при глотании, на небольшой период времени его можно перевести на парентеральное питание и внутривенное введение жидкостей.
К редким воспалительным заболеваниям пищевода относится эозинофильный эзофагит. Согласно заключению рабочей группы Американского общества гастроэнтерологов, эозинофильный эзофагит является клинико-патологическим заболеванием, которое характеризуется следующими признаками:
(1) симптомы включают, но не ограничиваются дисфагией и затруднением прохождения пищи;
(2) потеря аппетита и симптомы гастроэзофагеальной рефлюксной болезни (ГЭРБ) у детей;
(3) наличие более 15 эозинофилов в поле зрения при анализе биоптата слизистой оболочки пищевода.
Причины заболевания неизвестны. В последнее время диагноз эозинофильного эзофагита выставляется все чаще и чаще. Считается, что его природа связана с аллергией. Для объяснения патогенеза эозинофильного эзофагита были предложены две гипотезы. Согласно первой из них, клеточный ответ на определенную пищу или аллергены вызывает продукцию цитокинов. Согласно результатам исследований питающихся элементными смесями детей, перевод на такую гипоаллергенную диету может вести к полному разрешению эозинофилии; следовательно, хотя бы у некоторого числа пациентов эозинофильный эзофагит связан с пищевыми аллергенами.
Согласно второй теории, ГЭРБ приводит к пептическому повреждению межклеточных контактов эпителиальных клеток, в результате чего их проницаемость повышается, а в очаг воспаления мигрируют воспалительные клетки, в особенности эозинофилы. Одним из общепризнанных диагностических критериев является обнаружение 15 и более эозинофилов в поле зрения при исследовании биоптата. Слизистая пищевода уникальна в том отношении, что в норме она лишена эозинофилов. Тем не менее, эозинофилы могут появляться в ней при самых различных заболеваниях, например, при ГЭРБ, болезни Крона, системных коллагенозах, лекарственном эзофагите.
Следовательно, перед постановкой диагноза эзонофильного эзофагита больного требуется тщательно обследовать и исключить все другие возможные причины его состояния. При проведении дифференциальной диагностики необходимо учитывать анамнез пациента, клиническую картину, эндоскопические признаки и точный подсчет эозинофилов под микроскопом. У взрослых обычно не отмечается повышение эозинофилов или IgE в периферической крови. При эндоскопии может отмечаться «трахеолизация» пищевода, когда на его внутренней поверхности появляются кольца. Но в некоторых случаях пищевод может выглядеть абсолютно нормальным, поэтому для постановки диагноза требуется высокая степень настороженности.
К эндоскопическим признакам эозинофильного эзофагита относят появление продольных борозд, кровоточивость, отек, продольные разрывы, возвышающиеся белесоватые бляшки, белый налет, вид слизистой оболочки, напоминающий «гофрированную бумагу», сужение пищевода, временные или постоянные кольца на пищеводе. В обзоре, выполненном Американским обществом гастроэнтерологов, у 86% пациентов обнаруживались кольца, стриктуры или сужение пищевода. И хотя ни один из этих признаков не может считаться патогномоничным, при определенных условиях одновременное наличие нескольких из них может свидетельствовать в пользу эозинофильного эзофагита. Лечение начинается после проведения эндоскопии и взятия биопсии. Возможно назначение местных или системных кортикостероидов, оценка аллергического статуса, пробное исключение возможных аллергенов. При проведении эзофагоскопии следует быть особенно осторожным, потому что пациенты с эозинофильным эзофагитом имеют повышенный риск травматизации слизистой и перфорации пищевода.
Эозинофильный эзофагит.
Обратите внимание на отек слизистой оболочки, продольные бороды,
вид слизистой по типу «гофрированной бумаги» и белые налеты.
Полимиозит представляет собой воспалительно-дегенеративное заболевание поперечно-полосатой мускулатуры, которые сопровождается ослаблением функции пораженных мышц. Наиболее частым симптомом полимиозита является слабость проксимальных мышц плечевого пояса и бедер. Если полимиозит сопровождается появлением высыпаний на коже, то такое состояние обозначают как «дерматомиозит». При полимиозите возможно снижение силы перистальтики, дискоординация сократительной активности пищевода, расширение просвета пищевода. При манометрии определяется снижение тонуса верхнего пищеводного сфинктера и уменьшение силы перистальтических волн. Лечение направлено на увеличение силы пораженных мышц и предотвращение внемышечных осложнений.
При дерматомиозите лечение направлено на устранение симптомов со стороны кожи. Чаще всего для обследования и лечения пациенты с полимиозитом направляются к ревматологу. Обычно назначают кортикостероиды, иногда могут использоваться азатиоприн и метотрексат. Длительность приема системных кортикостероидов может составлять один год.
Для ГЭРБ характерен заброс содержимого желудка обратно в пищевод. Это заболевание является наиболее частой причиной эзофагита. Дальнейший заброс пищи в глотку носит название ларингофарингеальной рефлюксной болезни (ЛФРБ) или внепищеводного рефлюкса. К типичным симптомам ГЭРБ относят регургитацию, изжогу, боль за грудиной. К симптомам ЛФРБ относят дисфагию, периодическую дисфонию, желание «прочистить горло», ощущение кома в горле и кашель. Механизм развития ГЭРБ связан с периодическими аномальными сокращениями нижнего пищеводного сфинктера и с растяжением желудка. Механизм развития ЛФРБ изучен менее подробно, но, вероятно, связан с аномальными сокращениями верхнего пищеводного сфинктера.
Забрасываться обратно в пищевод может пища, воздух, желудочная кислота, желчные кислоты (желчный рефлюкс), содержимое пищевода (при пищеводно-глоточном рефлюксе). Повреждение пищевода при ГЭРБ может проявляться эрозивным эзофагитом и пептическими стриктурами. Для постановки диагноза рефлюкса обнаружение эндоскопических изменений в пищеводе не требуется (неэрозивная рефлюксная болезнь). Рефлюкс часто сопровождает грыжу пищеводного отверстия диафрагмы. Длительно существующая ГЭРБ повышает риск развития пищевода Баррета и аденокарциномы пищевода. Тем не менее подход со сведением заболеваний в «единый» спектр сменило подразделение ГЭРБ на несколько «категорий»: неэрозивный эзофагит, эрозивный эзофагит, пищевод Баррета; а переход из одной категории в другую является достаточно редким явлением.
По имеющимся данным тяжесть ГЭРБ может со временем усиливаться, но по данным наблюдений за 20 лет процесс идет относительно медленно. Для постановки диагноза ГЭРБ в амбулаторных условиях выполняется pH-метрия и манометрия. Манометрия полезна для подтверждения правильного расположения рН-пробы и для диагностики нарушений моторики. Перед проведением pH-метрии необходимо прекратить прием антисекреторных препаратов. Согласно рекомендациям Американского общества гастроэнтерологов, всем пациентам с ГЭРБ и дисфагией, у которых эмпирическое назначение ингибитора протонной помпы два раза в день оказалось неэффективным, требуется выполнение эндоскопии с биопсией. Лечение рефлюксной болезни состоит в изменении образа жизни и назначении препаратов, снижающих секрецию соляной кислоты, например, ингибиторов протонной помпы.
Сами ингибиторы протонной помпы никак не влияют на рефлюкс, вместо этого они снижают кислотность забрасываемых в пищевод продуктов (повышают pH). К сожалению, даже вещества с нейтральным или слабокислым pH могут повреждать пищевод и вызывать симптомы рефлюкса.
Пищевод Баррета является потенциальным осложнением длительно существующей ГЭРБ. Для данного заболевания характерно превращение нормального плоского эпителия проксимальной части пищевода в цилиндрический эпителий кишечного типа (метаплазия). Пищевод Баррета является самым значительным последствием ГЭРБ, способным привести к развитию аденокарциномы пищевода. Соответственно, всем пациентам с длительно существующим ГЭРБ, особенно мужчинам-европеоидам среднего возраста, рекомендуется периодически проходить эндоскопический скрининг на предмет пищевода Баррета.
При подтверждении диагноза необходимы регулярные эндоскопические осмотры, чтобы вовремя определить развитие дисплазии и аденокарциномы. Риск развития аденокарциномы на фоне существующего пищевода Баррета составляет около 0,5% в год, но значительно возрастает у пациентов с дисплазией высокой степени и с обширным повреждением пищевода (более 3 см). Цель наблюдения — диагностировать рак на ранней стадии, когда еще сохраняется вероятность успешного лечения. Согласно рекомендациям по эндоскопическому скринингу, биопсию следует брать из четырех квадрантов с интервалами по 2 см так, чтобы захваченным оказался весь пораженный участок пищевода. Частота проведения эндоскопии зависит от выраженности дисплазии.
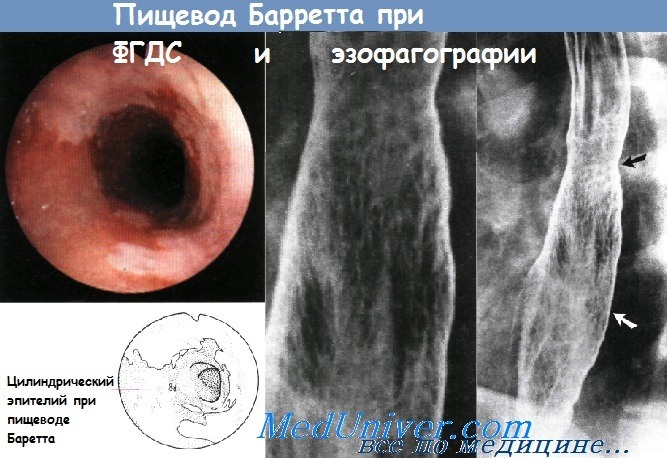
Эндоскопически вокруг здоровой бледно-розовой слизистой оболочки, выстланной плоским эпителием, видны области темно-розового метапластического цилиндрического эпителия, простирающегося по меньшей мере на 3 см вверх от желудочно-пищеводного соединения.
При эзофагографии пищевода Барретта с двойным контрастированием виден сетчатый рисунок слизистой оболочки. В середине пищевода заметны нежные стриктуры с характерным ретикулярным рисунком (черная стрелка), дистально продолжающимся на значительное расстояние от стриктуры (к уровню белой стрелки). Сетчатый рисунок лучше виден на увеличенном изображении.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Эзофагит - заболевание пищевода, сопровождающееся воспалением его слизистой оболочки вследствие различных причин.
Примечание 1
В данную подрубрику включены:
1. Абсцесс пищевода.
2. Эзофагит:
- неуточненный;
- лекарственный, по сути - химический без ожога;
Следует использовать дополнительные коды V01-Y98 "Внешние причины заболеваемости и смертности", если это необходимо для определения причины эзофагита.
Примечание 2. Приведенные в данной подрубрике описания отдельных форм и этиологий эзофагита выполнены для общего представления о данном заболевании.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
При классификации эзофагита выделяют следующие виды заболевания:
А. Клинические формы эзофагита
1. Острый эзофагит – воспаление стенки пищевода, проявляющееся болями, наиболее выраженными при прохождении пищи. В основной массе случаев он протекает в сочетании с болезнями желудка (ГЭРБ) или регургитацией и поражает обычно нижнюю часть пищевода. Возникновению заболевания способствуют нарушения питания, ожоги, химические вещества, обширная инфекция, полигиповитаминоз. Продолжительность острого эзофагита - до 3 месяцев.
2. Хронический эзофагит – хроническое воспаление стенки пищевода. Заболевание может развиться при недостаточно вылеченном остром эзофагите или как первично-хронический процесс. Хронический эзофагит может также возникать при длительном приеме слишком грубой или острой пищи, крепких алкогольных напитков. Течение хронического эзофагита характеризуется периодическими обострениями и ремиссиями. При позднем начале лечения и неуклонно прогрессирующем эзофагите, могут образовываться рубцовые изменения пищевода.
По выраженности поражения стенки хронический эзофагит делят на 4 степени согласно классификации Савари и Миллера (классификация эндоскопических признаков хронического эзофагита):
- I - гиперемия без эрозивных дефектов в дистальных отделах;
- II - разрозненные мелкие эрозивные дефекты слизистой;
- III - эрозии слизистой сливаются друг с другом;
- IV - язвенное поражение слизистой, стеноз.
3. Особые формы:
3.1 Идиопатический язвенный (ульцерозный) эзофагит (имеет некоторые общие морфологические черты с неспецифическим язвенным колитом) см. K22.1 Язва пищевода.
3.2 Неспецифический регионарный стенозирующий эзофагит (гранулематоз пищевода) - особая форма хронического эзофагита, для которой характерны трансмуральное неспецифическое гранулематозное воспаление пищевода, утолщение его стенки и почти полная облитерация просвета. Поражение пищевода при этом напоминает болезнь Крона, но в отличие от последней, в клеточном составе гранулёмы отсутствуют эозинофилы и гигантские клетки. Этиология заболевания неизвестна. Заболевание развивается преимущественно у молодых лиц (до 25-30 лет) одинаково часто у женщин и мужчин. Начало заболевания постепенное.
Б. Морфологические формы эзофагита:
1. Катаральная (отечная) форма характеризуется гиперемией и отечностью слизистой оболочки пищевода, является наиболее распространенной формой эзофагита.
2. Эрозивная форма наиболее часто развивается при острых инфекционных болезнях и действии на стенку пищевода раздражающих веществ.
3. Геморрагическая форма развивается при некоторых инфекционных и вирусных болезнях (например, при сыпном эпидемическом тифе, гриппе).
4. Псевдомембранозная форма наблюдается при дифтерии, скарлатине, при данной форме фибринозный экссудат не спаян с подлежащими тканями.
5. Эксфолиативная форма наблюдается при дифтерии, скарлатине, при этой форме фибринозный экссудат прочно связан с подлежащими тканями.
6. Некротическая форма встречается при тяжелом течении таких инфекционных болезней, как корь, скарлатина, брюшной тиф и др., а также при кандидозе, агранулоцитозе , сопровождается образованием глубоких язв (см. K23.8* Поражения пищевода при других болезнях, классифицированных в других рубриках).
7. Флегмонозная форма образуется в результате внедрения в стенку пищевода инфицированного инородного тела (T18.1 Инородное тело в пищеводе) или инфекции. Процесс склонен к абсцедированию и может распространиться вдоль пищевода и в сторону средостения .
В. Этиологические формы эзофагита:
1. Поражения при ГЭРБ (наиболее частая причина) - см. Гастроэзофагеальный рефлюкс с эзофагитом (K21.0).
2. Алиментарый эзофагит - возникает вследствие злоупотребления чрезмерно горячей и острой пищей, крепкими спиртными напитками.
3. Профессиональный эзофагит - возникает в результате воздействия вредной среды (пары концентрированных кислот и едких щелочей, соли тяжелых металлов и др. во время исполнения профессиональных обязанностей).
7. Инфекционные эзофагиты (вирусные грибковые, бактериальные).
8. Поражения при приеме некоторых лекарств.
9. Радиационные (в дозе поглощенного облучения >30 Грей).
Г. По локализации процесса
По локализации и распространенности воспалительного процесса различают дистальный, проксимальный и тотальный эзофагит.
Этиология и патогенез
Основные причины
Желудочно-пищеводный рефлюкс является основной причиной возникновения эзофагита. Он приводит к повреждению слизистой пищевода вследствие воздействия кислотно-пептического фактора. Эзофагит, вызванный рефлюксом, называется рефлюкс-эзофагитом (см. "Гастроэзофагеальный рефлюкс с эзофагитом" - K21.0).
Эзофагит может быть вызван химическим ожогом щелочью или кислотой, растворителем (бензин, ацетон), сильным окислителем типа перманганата калия. Такой эзофагит обычно регистрируется у детей в результате случайной пробы, также наблюдается у взрослых после попытки суицида с применением щелочи, кислоты, растворителя или окислителя ("Химический ожог пищевода" - T28.6).
Эзофагит часто встречается у алкоголиков, в качестве повреждающего фактора выступает спирт.
Возможно развитие эзофагита как профессионального заболевания (при контакте с парами различных повреждающих веществ).
Физическое повреждение пищевода вследствие лучевой терапии, введения зонда ("Инородное тело в пищеводе" - T18.1) также может быть причиной эзофагита.
- лекарственной терапией (в 90% случаев антибиотики из группы тетрациклинов, НПВС, хинидина, фосамакса, эмперониума бромида. Важными факторами являются химическая природа лекарства, его растворимость, время контакта с слизистой оболочкой, размер, форма и покрытие таблетки, малое количество воды при глотании таблетки, существующие изменения пищевода (например, стриктуры, ахалазия);
- ингаляционным наркозом (видимо связан с рефлюксом или раздражающим действием паров анестетиков);
- аллергической патологией (с 2007 года эозинофильный эзофагит выделен в отдельное заболевание, связанное с аллергической реакцией по типу атопии, сезонными обострениями, семейной предрасположенностью. Предположительно 6 основных продуктов связаны с большинством случаев обострения - пшеница, молоко, яйца, рыба / морепродукты, бобовые / арахис, соя);
Морфологические варианты острого эзофагита:
1. Язвенный процесс характерен для поражения пищевода вирусами группы герпеса, отмечается и при туберкулезе.
3. Мембранозный эзофагит возникает при ожогах пищевода и тяжелых инфекционных заболеваниях. Пленки отторгаются болезненно, оставляя рубцовые изменения.
4. Некротический эзофагит развивается в случае поражений пищевода при сепсисе, кандидамикозе, лучевой терапии, на фоне лечения болезней крови цитостатиками. Эндоскопически выявляются некроз и изъязвления слизистой оболочки пищевода; исходом воспалительного процесса являются рубцовые образования.
5. Септический эзофагит встречается при гнойном воспалении стрептококковой этиологии, ранениях пищевода инородными телами.
Эпидемиология
Признак распространенности: Редко
Частота случаев инфекционного эзофагита, наблюдаемого у иммунокомпрометированных лиц высока, у лиц без поражения иммунитета является казуистикой или следствием другой патологии (травмы, туберкулез и т.д.).
Аллергический (эозинофильный) эзофагит регистрируется в с распространенностью 45-55 случаев на 100 000 населения в развитых странах.
Факторы и группы риска
- погрешности питания;
- употребление недостаточного количества воды при проглатывании таблеток;
- прием некоторых лекарственных препаратов;
- прием алкоголя;
- курение;
- семейная (генетическая) предрасположенность к аллергии;
- недостаточность иммунитета;
- вредная профессиональная среда.
Клиническая картина
Клинические критерии диагностики
боль при глотании, дисфагия, одинофагия, кровавая рвота, рвота кофейной гущей, мелена, саливация, боль за грудиной, боль в эпигастрии, изжога, регургитация
Cимптомы, течение
Симптомы эзофагита: затруднения и/или болезненные ощущения при глотании, изжога, боли во рту, ощущение чего-то застрявшего в горле, тошнота, рвота.
При остром эзофагите возможно повышение температуры тела, наблюдается общее недомогание, возникают неприятные ощущения по ходу пищевода во время продвижения пищи, может беспокоить жжение, иногда резкая боль в пищеводе. Больные могут жаловаться на боль в области шеи, отрыжку, нарушенное глотание, слюнотечение.
Примечание
В зависимости от этиологии эзофагита, могут появляться дополнительные признаки, связанные с непосредственной причиной заболевания. Например, пузырьковая сыпь при герпесе, молочница слизистой рта, связь с приемом определенной пищи, сезонные обострения, ассоциированная патология (астма) и прочие.
Радиационный эзофагит может возникнуть спустя значительное время после лучевой нагрузки.
Эозинофильный эзофагит не имеет четкой клинической картины и может не распознаваться длительное время.
Любые пациенты с клиникой хронического рефлюкс-эзофагита, резистентные к проводимой антирефлюксной терапии, должны рассматриваться как пациенты с вероятными редкими причинами эзофагита (все причины кроме ГЭРБ Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) - хроническое рецидивирующее заболевание, обусловленное спонтанным, регулярно повторяющимся забросом в пищевод желудочного и/или дуоденального содержимого, что приводит к поражению нижнего отдела пищевода. Часто сопровождается развитием воспаления слизистой дистального отдела пищевода - рефлюкс-эзофагитом, и/или формированием пептической язвы и пептической стриктуры пищевода, пищеводно-желудочных кровотечений и других осложнений
Подробно ).
Диагностика
Лабораторная диагностика
Обязательные исследования:
- общий анализ крови с определением ретикулоцитов, тромбоцитов;
- общий анализ мочи.
Дополнительные исследования: биохимический анализ крови (общий белок, альбумин, С-реактивный белок, сиаловые кислоты, глюкоза, АлАТ, АсАТ, билирубин, амилаза, ЩФ, мочевина, креатинин, электролиты).
Дифференциальный диагноз
Дифференциальный диагноз при эзофагите проводится в первую очередь с ГЭРБ (отсутствие эффекта от антирефлюксной терапии).
Также необходима дифференциальная диагностика с врожденными мембранами пищевода, стриктурами пищевода, неврогенной анорексией, поражениями пищевода при склеродермии, опухолями пищевода, термическими, химическими, лучевыми поражениями и т.д.
При первичном эозинофильном гастроэнтерите (Аллергический и алиментарный гастроэнтерит и колит - K52.2), наряду с эозинофильной инфильтрацией слизистой желудка и тонкой кишки, также возможны подобные изменения и в пищеводе. Помочь дифференцировать эозинофильный эзофагит от первичного эозинофильного гастроэнтерита могут отрицательные по эозинофильной инфильтрации образцы биопсии из желудка, двенадцатиперстной и толстой кишки.
Инфекционный эзофагит имеет, как правило, признаки инфекции другой локализации и сочетается с иммунодефицитом.
Смешенные опухоли пищевода. Доброкачественные опухоли и изменения желудка.
Карциносаркома редкая опухоль пищевода, в которой сочетаются злокачественные эпителиальный и мезенхимальный компоненты. Эпителиальный компонент обычно представлен плоскоклеточным раком. Мезенхимальный компонент может имегь строение полиморфно-клеточной или веретенообразно-клеточной саркомы, в некоторых случаях в ее клетках выявляют поперечную исчерченность. а также признаки дифференцировки в хрящевую или костную ткань. Макроскопически карциносаркома обычно имеет форму полиповидного образования, выбухающего в просвет пищевода.
При гистологической диагностике карциносаркомы необходимо помнить, что плоскоклеточный рак может состоять из вытянутых веретенообразных клеток и иметь сходство с саркомой. Кроме того, в многослойном плоском эпителии, покрывающем злокачественную неэиителиальную опухоль, иногда наблюдают реактивные изменения, которые могут симулировать рак. Наконец, в раковой опухоли может наблюдаться реактивная пролиферация стромы так называемая псевдосаркоматозная реакция.
Первичная меланома изредка встречается в пищеводе, ее источником служат меланобласты слизистой оболочки. Опухоль растет в просвет пищевода и имеет форму нолиповидного образования. Подтверждением первичного характера опухоли являются признаки ее связи с эпителием, в частности пограничная активность. Микроскопическое строение меланомы такое же, как и меланом другой локализации; характерно большое количество пигмента в опухоли. Однако чаще в пищеводе наблюдают метастазы меланомы.
Очень редко в пищеводе встречаются участки гетеротопии ткани поджелудочной железы. Могут обнаруживаться участки слизистой оболочки желудка, которые в верхнем отделе пищевода являются гетеротопическими, а в нижнем отделе, вероятно, чаще возникают на фоне хронического эзофагита (синдром Баррета).
В толще стенки пищевода, чаще в наружном слое, могут обнаруживаться врожденные кисты, являющиеся пороком развития. Стенка кисты образована фиброзной или гладкомышечной тканью выстлана реснитчатым, многослойным плоским или желудочным эпителием, а также их сочетанием.
Фиброваскулярный (фиброзный) полип чаще обнаруживается в верхней части пищевода, хотя может встречаться на любом уровне. Он состоит из соединительной и жировой тканей, среди которых видны тонкостенные кровеносные сосуды. Полип покрыт неизмененной слизистой оболочкой, обычно имеет длинную узкую ножку и может достигать больших размеров. Фиброваскулярный полип необходимо отличать от воспалительного фиброзного полипа, который изредка наблюдается в пищеводе, но более характерен для желудка и кишечника.
Представляет собой опухолевидное образование на широком основании, часто изъязвленное. Состоит из соединительной ткани с признаками воспаления и пролиферации. В инфильтрате часто выявляются многочисленные эозинофилы, характерно наличие так называемых реактивных сосудов с расположением вокруг них фибробластов по типу луковичной чешуи.
Доброкачественные опухоли и изменения желудка.
Правильный морфологический диагноз аденомы, особенно по материалу гастробиопсии, имеет важное практическое значение в связи с большой опасностью их малигнизации (5— 70%). Кроме того, аденомы часто сочетаются с раком желудка.
Аденома желудка может иметь вид полиповидного образования с неровной дольчатой или ворсинчатой поверхностью, чаще всего на широком основации, реже имеет хорошо выраженную ножку. Нередко аденомы бывают плоскими, лишь слегка возвышающимися над поверхностью слизистой оболочки. Аденомы чаще одиночные, чем множественные. Размеры их варьируют 0,3 - 5 см (чаще 1,5-2 см). Существует мнение, что вероятность малигнизации аденом зависит от их размеров (редко оказываются малигнизированными аденомы, размеры которых менее 1,5-2 см). Однако при динамическом наблюдении отмечено, что малигнизация может происходить не только в увеличивающихся опухолях, но и в остающихся стабильными при эндоскопическом осмотре, и возможна при любом размере опухоли.
Аденомы обычно обнаруживают на фоне хронического гастрита, особенно часто при пернициозной анемии. Большинство аденом желудка морфологически сходно с аденомами толстой кишки. Часто можно наблюдать их развитие на фоне кишечной метаплазии, однако возникновение типичных аденом из желудочного покровно-ямочного эпителия без признаков кишечной метаплазии нередкое явление. Кроме того, существуют аденомы, клетки которых по цитологическим и гистохимическим свойствам сходны с покровно-ямочным эпителием, а также смешанные.
Отличительной чертой аденом как истинных новообразований является атипия (дисплазия) эпителия. Все признаки дисплазии (клеточная атипия, нарушение дифференцировки и дезорганизация структуры слизистой оболочки) присутствуют в аденомах. В зависимости от выраженности изменений выделяют аденомы со слабой, умеренной и выраженной (тяжелой) дисплазией.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Рис. 1. Схематическое изображение эпителия в месте сочленения пищевода (Oesophagus) и желудка (Stomach), в котором встречаются эпителиальные клетки разных типов. Переходный эпителий (Transitional epithelium) образован базальными (Basal layer) и люминальными (Luminal layer) клетками, которые характеризуются различным уровнем экспрессии трех белков-маркеров (p63, KRT5 и KRT7). Рефлюкс, вызванный желчными кислотами, или нарушение экспрессии каких-то генов могут вызвать превращение эпителия пограничной области в аномальный — подобный эпителию кишечника — с включениями бокаловидных клеток (Goblet cell), и формируется разрастающаяся структура, называемая пищеводом Барретта (Barrett's oesophagus). Рисунок из популярного синопсиса к обсуждаемой статье
Ученым удалось разобраться в механизме возникновения предракового состояния в месте соединения пищевода и желудка — синдрома Барретта. Они смогли детально охарактеризовать эпителий в этой пограничной области и на лабораторных мышах показали, что базальные клетки с определенным набором маркеров могут стать предшественниками ткани, подобной ткани кишечника, которая замещает нормальный эпителий этой области. Клетки со сходными свойствами найдены на границе пищевода и желудка и у человека, поэтому данное исследование должно помочь улучшить методы ранней диагностики и лечения онкологических заболеваний.
Хорошо известно, что чем раньше диагностировать и начать лечить рак, тем легче может быть само лечение и тем выше шансы на выздоровление. Для некоторых типов рака выявлены так называемые предраковые состояния — изменения тканей, которые сами по себе не являются злокачественными, но повышают вероятность развития рака в этих тканях. Такие состояния известны пока для относительно небольшого числа раков. Поэтому, с одной стороны, нужно пытаться расширять список соответствий между злокачественными опухолями и предраковыми состояниями, а с другой стороны — выяснять механизмы возникновения этих состояний, чтобы повышать эффективность профилактики рака.
Один из типов предраковых состояний — метаплазии, при которых происходит замещение клеток одного типа клетками другого (как правило, обратимое). Метаплазии часто возникают на границах между разными типами эпителия и могут в таких случаях порождать карциномы — злокачественные опухоли эпителиальных клеток. Эпителий — это ткань, выстилающая поверхность тела (то есть, грубо говоря, кожа), внутренние полости и слизистые оболочки органов. В российской медицине различают два основных вида эпителия — многослойный плоский эпителий (кожа, слизистые оболочки, пищевод) и однослойный цилиндрический эпителий (желудок, кишечник). Особо выделяют эпителий, выстилающий органы, подвергающиеся сильному растяжению (например, в мочевыводящей системе), так называемый переходный. В западной медицине принята более детальная классификация эпителия (см. Epithelium).
Самая распространенная и активно исследуемая форма метаплазии — пищевод Барретта (синдром Барретта). Это — опасное осложнение рефлюксной болезни — заброса содержимого желудка в пищевод, при котором свойственный в норме пищеводу многослойный плоский эпителий в пограничной области соединения пищевода с желудком замещается цилиндрическим (свойственным желудку) с вкраплениями свойственных кишечнику бокаловидных клеток — «одноклеточных желез», выделяющих увлажняющую слизь (см. рис. 1). Частота встречаемости синдрома при рефлюксе составляет 10%, а в целом по популяции — 1%. За последние 40 лет частота встречаемости пищевода Барретта возросла почти в 8 раз. Он считается предраковым состоянием, так как высоколетальная аденокарцинома нижней части пищевода возникает при нем в 10 раз чаще, чем в нормальном пищеводе.
Хотя с момента описания синдрома Барретта в 1950 году он активно изучался, ключевые процессы его развития оставались неизвестными: как возникает замещение плоского эпителия на цилиндрический (метаплазия)? от каких клеток происходит вновь формирующийся цилиндрический эпителий пищевода? как идет последующая трансформация в злокачественные новообразования?
Для объяснения метаплазии было предложено пять основных теорий (они схематично показаны на рис. 2):
1) возможна прямая конверсия плоского эпителия в цилиндрический — повреждение может вызвать превращение одного типа ткани в другой (рис. 2, a);
2) предшественниками цилиндрического эпителия являются циркулирующие в кровотоке стволовые клетки, способные дифференцироваться в цилиндрический эпителий (рис. 2, b);
3) предшественниками цилиндрического эпителия являются клетки субмукозных (слизистых) желез, локализованных под плоским эпителием (рис. 2, c);
4) возможна экспансия в пограничную область клеток цилиндрического эпителия желудка (рис. 2, d);
5) предшественниками цилиндрического эпителия являются остаточные эмбриональные клетки, локализованные вблизи пограничной области (рис. 2, e).

Рис. 2. Гипотезы возникновения пищевода Барретта, предложенные ранее. a — передифференцировка плоского эпителия пищевода; b — дифференцировка циркулирующих в крови стволовых клеток костного мозга; c — экспансия клеток слизистых желез пищевода и их превращение в эпителий Барретта; d — превращение стволовых клеток слизистых желез; e — экспансия и дифференцировка спящих остаточных эмбриональных клеток пограничной области пищевода/желудка. Рисунок из обсуждаемой статьи в Nature
Но ни одна из этих теорий не получила строгого экспериментального подтверждения. И ни одна не объясняла появления вкраплений бокаловидных клеток, свойственных кишечнику (а не пищеводу или желудку).
Большой коллектив ученых из Медицинского центра Колумбийского университета и других научных учреждений США и Китая провел сравнительный анализ экспрессии генов, характерных для эпителия. Они показали, что у мышей пограничный эпителий, состоящий из базальных и люминальных (обращенных в просвет пищевода) клеток, характеризуется различной экспрессией в этих клетках трех маркеров. В базальных клетках экспрессируются два цитокератина — Krt5 и Krt7, а также фактор регуляции транскрипции р63. В клетках люминального слоя экспрессируется только Krt7. Это отличает пограничную область от выше расположенной области пищевода, в которой ни в базальных клетках, ни в плоском эпителии нет экспрессии Krt7 (рис. 1). В эпителии желудка ни один из этих маркеров не экспрессируется.

Рис. 3. Схема анастомоза между двенадцатиперстной кишкой и пищеводом мыши, в результате которого желчные кислоты (красные стрелки) поступают в пищевод. Рисунок из обсуждаемой статьи в Nature
В следующей серии экспериментов авторы провели тонкую хирургическую операцию на мышах и сделали анастомоз между пищеводом и двенадцатиперстной кишкой (рис. 3). В результате желчные кислоты поступали в пищевод, что позволило имитировать рефлюкс.
Через 18 недель после операции воздействие желчных кислот на пограничную область приводило к формированию клеток «пищевода Барретта», в которых экспрессировался характерный маркер CDX2, и в этой области появлялись бокаловидные клетки. Примечательно, что в расположенной выше части пищевода таких клеток не наблюдалось, несмотря на то что она также подвергалась воздействию желчных кислот.
Ученые решили исключить возможность замещения эпителия в пограничной области пищевода мигрирующими клетками соседних тканей. Для этого с помощью генно-инженерных методов они получили мышей, у которых экспрессия гена Krt7 в клетках эпителия пограничной области была сопряжена с экспрессией красного флюоресцирующего белка Tomato. Эксперименты показали, что в клетках цилиндрического эпителия «пищевода Барретта» экспрессируется Tomato, то есть Krt7. А как уже говорилось, ген Krt7 экспрессируется в эпителии пограничной области, но не экспрессируется в расположенной выше области пищевода и в желудке. Следовательно, клетки цилиндрического эпителия «пищевода Барретта» происходят исключительно от базальных клеток пограничной области (рис. 4).

Рис. 4. Предшественники базальных клеток (экспрессирующие гены p63 и KRT7) и люминальные клетки (KRT7 + ) эпителия пограничной области пищевод/желудок у мышей. Squamous epithelium — плоский эпителий пищевода. Transitional epithelium — эпителий пограничной области пищевода. Cardia — желудок. Рисунок из обсуждаемой статьи в Nature
В заключение авторы решили проверить, насколько похожа структура пограничной области между пищеводом желудком у человека и у мыши. Они провели анализ экспрессии эпителиальных маркеров человек и показали их сходство с мышиными. В этой области у человека были найдены базальные клетки с экспрессией генов p63, KRT5 и KRT7, а также люминальные клетки, в которых экспрессировался KRT7, но не было экспрессии гена p63. В базальных клетках, принадлежащих расположенной выше области пищевода, KRT7 не экспрессировался (рис. 5).


Рис. 5. В пограничной области пищевода и желудка человека локализован специфический переходный эпителий, который разрастается при пищеводе Барретта. a — микроскопическое изображение предшественников базальных клеток (отмечены стрелками) и люминальных клеток эпителия, окраска гематоксилином и эозином. Длина масштабного отрезка — 50 мкм. b — базальные клетки эпителия пограничной области экспрессируют гены p63, KRT5 и KRT7 (продукты экспрессии отмечены треугольниками). Базальные клетки плоского эпителия пищевода не экспрессируют KRT7 (отмечены стрелками). Иммуногистологическое окрашивание разными флюоресцирующими красителями. Длина масштабного отрезка — 50 мкм. c — схема строения эпителия пограничной области пищевод/желудок человека, обозначения как на рис. 4. Рисунок из обсуждаемой статьи в Nature
С помощью проточной цитометрии были разделены два типа базальных клеток пищевода человека (с маркерами p63 + KRT7 − и p63 + KRT7 + ). Из этих клеток in vitro были получены трехмерные культуры органоидов и оказалось, что органоиды, полученные из клеток типа p63 + KRT7 + и происходящие из пограничной области пищевода, способны формировать эпителиальные клетки, подобные эпителию кишечника. Органоиды, полученные из клеток типа p63 + KRT7 − , взятых из выше расположенной области, таким свойством не обладали.
Таким образом, ученым удалось на модели лабораторных мышей охарактеризовать эпителий пограничной области между пищеводом и желудком, который дает начало предраковому состоянию — пищеводу Барретта, а также проверить, что у людей все устроено аналогично. Оказалось, что этот эпителий более чувствителен к повреждающим факторам, чем эпителий расположенных выше областей пищевода или эпителий желудка. Полученные результаты лучше всего согласуются с выдвинутой ранее гипотезой происхождения пищевода Барретта о прямом превращении тканей эпителия пограничной области: показано, что базальные клетки пограничного эпителия могут быть предшественниками эпителия, подобного кишечному, который включает и бокаловидные клетки.
В то же время выявленные в ходе исследования генетические маркеры клеток эпителия пограничной зоны как таковые вряд ли могут быть причиной формирования пищевода Барретта и дальнейшего развития рака. В этом, скорее всего, задействованы какие-то иные факторы — кислотный рефлюкс, другие химические раздражители, гормональные нарушения или вирусные инфекции.
Несмотря на оставшиеся вопросы, обсуждаемая работа дает детальную картину формирования пищевода Барретта. Поскольку предраковые состояния и злокачественные опухоли особенно часто возникают именно в пограничных областях эпителия разных органов (матка, пищевод, прямая кишка), то можно надеяться, что там работают аналогичные механизмы. Впрочем, дальнейшие исследования должны будут прояснить этот вопрос, равно как и то, является ли пограничный эпителий единственным местом возникновения этой метаплазии и дальнейшей трансформации ее в рак. Ведь уже давно было показано, что структура, подобная пищеводу Барретта, может возникнуть и у больных, у которых пограничная область пищевода была удалена (S. R. Hamilton, J. H. Yardley, 1977. Regnerative of cardiac type mucosa and acquisition of Barrett mucosa after esophagogastrostomy). Так что полученные результаты могут способствовать разработке методов диагностики, профилактики и лечения этих состояний не только применительно к пищеводу, но и к другим органам.
Источники:
1) Ming Jiang, Haiyan Li, Yongchun Zhang, Ying Yang, Rong Lu, Kuancan Liu, Sijie Lin, Xiaopeng Lan, Haikun Wang, Han Wu, Jian Zhu, Zhongren Zhou, Jianming Xu, Dong-Kee Lee, Lanjing Zhang, Yuan-Cho Lee, Jingsong Yuan, Julian A. Abrams, Timothy C. Wang, Antonia R. Sepulveda, Qi Wu, Huaiyong Chen, Xin Sun, Junjun She, Xiaoxin Chen & Jianwen Que. Transitional basal cells at the squamous-columnar junction generate Barrett's oesophagus // Nature. 2017. V. 550. P. 529–533.
2) Lizhe Zhuang & Rebecca C. Fitzgerald. Cancer development: Origins in the oesophagus // Nature. 2017. V. 550. P. 463–464. Синопсис к обсуждаемой статье.
Опухоли пищевода. Доброкачественные и злокачественные опухоли пищевода.
В дистальном отделе пищевода изредка наблюдают аденому, имеющую такое же строение, что и аденомы желудка. Она может развиваться из слизистой оболочки при так называемом пищеводе Баррета, когда в результате хронического рефлюкс-эзофагита и гегеротопяи (что менее вероятно) многослойный плоский эпителий нижней части пищевода замещается цилиндрическим эпителием с формированием структур, соответствующих слизистой оболочке фундального или кардиального отделов желудка, нередко с явлениями кишечной метаплазии.
Рак — наиболее часто встречающаяся злокачественная опухоль пищевода. Чаще наблюдают у мужчин? возраст большинства которых 50—70 лет. К предрасполагающим факторам относятся особенности питания — употребление очень горячей и грубой пищи; недостаток витаминов, особенно В2, А; железа, меди, цинка; вредные привычки (курение, алкоголь и др.); некоторые географические особенности местности; аномалии и посттравматические рубцовые изменения пищевода, грыжа пищеводного отверстия диафрагмы, тилоз (гиперкератоз ладоней и подошв), синдром Пламмера—Винсона (железодефицитная анемия, гипохлоргидрия, дисфагия), наблюдающийся преимущественно у жительниц стран Скандинавского полуострова в возрасте 40 -45 лет и др.
Заболеваемость раком пищевода колеблется в очень широких пределах, достигая наиболее высоких показателей в некоторых районах Ирана, Китая, Туркменской, Казахской, Узбекской ССР и др. Эпидемиологические исследования показали, что в этих районах среди населения чрезвычайно широко распространен хронический эзофагит (60—80% населения и более), который, очевидно, имеет значение в развитии рака пищевода. При гистологическом исследовании на фоне хронического эзофагита обнаруживают очаговые и диффузные атрофические и гиперпластические изменения многослойного плоского эпителия, пролиферацию базальных клеток, очаги дисплазии, внутриэпителиальный и ранний инвазивный рак.
Такие же изменения часто можно обнаружить при раке пищевода, исследуя слизистую оболочку на различном расстоянии от опухоли. Эти изменения, по-видимому, являются основными этапами морфогенеза рака пищевода, что подтверждается динамическими наблюдениями, проведенными в районах Китая с повышенной заболеваемостью раком пищевода.
Предраковые изменения в многослойном плоском эпителии пищевода принципиально не отличаются от аналогичных изменений в шейке матки. Гистологическими критериями дисплазии являются усиление пролиферации и нарушение дифференцировки клеток. Количество базальных клеток, которые в норме занимают не более 15% толщины эпителиального пласта, при дисплазии увеличивается, клетки становятся более крупными, полиморфными, увеличивается число митозов. В зависимости от выраженности клеточных изменений и степени их распространения в эпителиальном пласте различают слабую» умеренную и тяжелую дисплазию. Выраженные полиморфизм и атипия клеток, большое количество митозов, утрата полярности расположения клеток и деления на слои при сохранении базальной мембраны характерны для внутриэпителиального рака.
В тех случаях, когда базальная мембрана не прослеживается, имеется тенденция к погружному росту и отшнуровка эпителиальных комплексов, изменения должны расцениваться как начало инвазивного рака.
При гистологическом исследовании, особенно по материалу эндоскопической биопсии, бывает трудно дифференцировать диспластические (предраковые) изменения и реактивную гиперплазию базальных клеток, которая может наблюдаться, например, при рефлюкс-эзофагите.
Трудности возникают также при дифференциальной диагностике тяжелой дисплазии, карциномы in situ и инвазивного рака. Для уточнения характера процесса необходимы динамическое наблюдение за такими больными и повторные биопсии.
Основная масса форм плоскоклеточного рака пищевода, видимо, развивается из покровного эпителия. Другим источником развития рака пищевода могут быть слизистые железы, в которых при хроническом гастрите также наблюдают атрофические и гиперпластические изменения, образование кист, пролиферацию резервных клеток, плоскоклеточную метаплазию и дисплазию эпителия. Из них могут возникать плоскоклеточный рак, аденокарцинома, железисто-плоскоклеточный рак, а также мукоэлидермоидная опухоль и аденокистозный рак (цилиндрома), аналогичные соответствующим опухолям слюнных желез. Аденокарциномы в пищеводе могут развиваться также от остатков цилиндрического эпителия, выстилающего пищевод на ранних стадиях эмбриогенеза, участков гетеротопии слизистой оболочки желудка.
Аденокарциномы дистальной части пищевода могут развиваться также на фоне так называемого пищевода Баррета. Во многих случаях труден или невозможен дифференциальный диагноз такой аденокарциномы и рака кардиального отдела желудка, прорастающего в пищевод.
Рак пищевода наиболее часто локализуется в средней его трети, затем следует нижняя треть пищевода; верхняя его треть поражается редко. Исключение составляет рак пищевода при синдроме Пламмера—Винсона, который наблюдается преимущественно у женщин 40—45 лет и поражает самый верхний отрезок пищевода.
Макроскопически большинство форм рака пищевода представляет собой изъязвленные блюдцеобразные или эндофитные опухоли, часто циркулярно охватывающие стенку, нередко на значительном протяжении. Экзофитные опухоли встречаются редко. Рак пищевода может распространяться по подслизистому слою далеко за пределы видимого очага опухоли, а также прорастать в прилежащие к пищеводу ткани и органы. Для суждения о степени распространенности процесса и радикальности оперативного вмешательства при исследовании удаленного отрезка пищевода необходимо изучение линий операционных разрезов и глубины прорастания стенки пищевода.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

