Разрез кожи при трепанации
Обновлено: 17.04.2024
ТРЕПАНАЦИЯ ЧЕРЕПА (франц. trepanation, от греч. trypanon бурав, трепан) — хирургическая операция, заключающаяся во вскрытии полости черепа с целью снижения внутричерепного давления или обеспечения доступа к внутричерепным образованиям.
Имеются археологические данные, свидетельствующие о том, что Т. ч. производили еще во времена неолита и бронзового века. Техникой этой операции владели лекари в Киевской Руси (10—11 вв.). В России Т. ч. была уже достаточно хорошо известна в 17 и 18 вв.
Существует два способа Т. ч.— резекционный и костно-пластический. До конца 19 в. производили только резекционную Т. ч., для выполнения к-рой пользовались различными долотами и специальными инструментами — трепаном и трефином (см. Нейрохирургический инструментарий). В результате резекционной Т. ч. остается дефект костей стенки свода черепа. Костно-пластическая Т. ч. состоит в создании трепанационного окна путем выпиливания костного лоскута, к-рым после выполнения необходимых манипуляций на внутричерепных структурах закрывают операционный дефект черепа.
Резекционная трепанация черепа получила также название декомпрессивной, поскольку она направлена на снижение давления в полости черепа, т. е. на создание наружной декомпрессии (в отличие от внутренней декомпрессии, когда для достижения такой же цели производят резекцию патологически измененных участков головного мозга).
Показанием к декомпрессивной Т. ч. является прогрессирующий отек и набухание головного мозга (см.) после острой черепно-мозговой травмы (см.), подозрение на внутричерепную гематому, нек-рые случаи глубинных неудалимых опухолей полушарий головного мозга с инфильтративным ростом.
Типичную декомпрессивную Т. ч. производят в височной области.
В наст, время ее применяют редко, гл. обр. как неотложную операцию при быстро прогрессирующем ухудшении общего состояния больного с черепно-мозговой травмой и невозможности в связи с этим уточнить локализацию патол. процесса. При подозрении на внутричерепную гематому невыясненной локализации накладывают пробные фрезевые отверстия (трефинация черепа) в височных областях. К трефинации черепа в соответствующих типичных точках прибегают также при необходимости пункции боковых желудочков головного мозга.

Рис. 1. Схематическое изображение кожного разреза (обозначен жирной черной линией) в височной области при декомпрессивной трепанации черепа: разрез проходит от середины верхнего края скуловой дуги до теменного бугра.

Рис. 2. Схематическое изображение этапов декомпрессивной трепанации черепа: а — наложение фрезевого отверстия в центре освобожденного от мягких тканей участка кости; б — резекция кости костными щипцами.
Техника декомпрессивной Т. ч., разработанной X. Кушингом, состоит в следующем. В положении больного на боку, противоположном стороне операции, после обработки операционного поля намечают линию разреза, вдоль к-рой производят послойную инфильтрационную анестезию 0,25% р-ром новокаина. Разрез начинают от средины верхнего края скуловой дуги (не ниже, во избежание повреждения ветвей лицевого нерва) и заканчивают в области теменного бугра (рис. 1). Кожу и апоневроз отпрепаровывают в обе стороны. Рассекают фасцию височной мышцы, затем по ходу волокон раздвигают височную мышцу и рассекают надкостницу, к-рую распатором отслаивают в стороны, обнажая чешую височной кости. Края раны разводят крючками пли ранорасширителем. Операция может быть выполнена также с помощью дугообразного разреза мягких тканей. В центре освободившегося участка кости трепаном накладываютфрезевое отверстие (рис. 2, а) и расширяют его путем резекции кости костными щипцами, образуя трепанационное окно диам. 6—7 см (рис. 2, б). Скусывание кости в базальном направлении необходимо производить осторожно во избежание повреждения средней менингеальной артерии, к-рая может находиться в костном канале. В случае повреждения артерии кровотечение останавливают путем диатермокоагуляции или промазывания края кости мед. воском. После визуального и пальпаторного определения степени напряжения твердой оболочки головного мозга ее крестообразно вскрывают. При значительном напряжении оболочки для снижения внутричерепного давления предварительно вводят дегидратационные средства (маннитол, салуретики). Операцию заканчивают послойным наложением шелковых швов на височную мышцу, ее фасцию, апоневроз и кожу.

Рис. 3. Схематическое изображение кожных разрезов, применяемых при резекционной трепанации черепа для доступов к различным отделам задней черепной ямки: а — срединный, б — парамедианный, в — полуарбалетный, г — подковообразный.
Резекционную Т. ч. в наст, время также применяют для обеспечения доступов к различныхм отделам задней черепной ямки, причем в зависимости от локализации и объема патол. очага (опухоли, абсцессы и др.) пользуются различными кожными разрезами (рис. 3). Важным элементом Т. ч. при срединных доступах к задней черепной ямке является предложенная X. Кушингом резекция края большого (затылочного) отверстия и задней дуги атланта, к-рая направлена на предотвращение сдавления продолговатого мозга в послеоперационном периоде.
После декомпрессивной Т. ч. в связи с нарушением герметичности полости черепа, суточными колебаниями внутричерепного давления и перепадами атмосферного давления могут отмечаться головные болит церебрастенические явления, признаки раздражения оболочек мозга и прилежащих к зоне трепанации церебральных структур, что обозначают как синдром трепанированных. При незначительной его выраженности применяют симптоматическую терапию. В случае выраженных явлений рекомендуется операция закрытия дефекта черепа (см. Краниопластика).

Рис. 4. Схематическое изображение этапов костно-пластической трепанации черепа по методу Вагнера — Вулфа (а) и по методу Оливекруны (б): а — выкроен и отвернут единый кожно-надкостнично-костный лоскут; б — выкроен и отвернут кожно-апоневротический лоскут с широким основанием, наложены трепанационные отверстия, под кость между соседними трепанационными отверстиями проведены проводник Оливекруны (1) и проволочная пила (2).
Костно-пластическая трепанация черепа с выкраиванием единого кожно-надкостнично-костного лоскута была разработана в эксперименте Вулфом (J. R. Wolfe) в 1863 г. и впервые осуществлена в клинике Вагнером (W. Wagner) в 1(889 г. Она получила название метода Вагнера — Вулфа (рис. 4, а). Недостатком этого метода является возможность нарушения кровоснабжения кожно-апоневротического лоскута в области его узкой ножки. В 1930 г. Оливекруна (H. A. Olivecrona) предложил выкраивать вначале кожно-апоневротический лоскут с широким основанием, а затем — мышечно-надкостнично-костный, что позволяет при необходимости произвести более обширную трепанацию и облегчает технику ее выполнения (рис. 4, б).
Показаниями для костно-пластической Т. ч., обеспечивающей доступ к соответствующим внутричерепным образованиям, являются объемные внутричерепные процессы, сосудистые и воспалительные заболевания мозга и его оболочек и другие патол. процессы преимущественно супратенториальной локализации. Выбор места и объема костно-пластической трепанации зависит от локализации и величины патол. очага. Для доступа к лобным долям мозга , нижней поверхности его в области передней черепной ямки и области турецкого седла больного укладывают па спину, при процессах в области других отделов полушарий головного мозга — на бок.

Рис. 5. Схематическое изображение дугообразных кожных разрезов, применяемых при костно-пластической трепанации черепа для доступов к различным отделам головного мозга: а - разрез для доступа к лобной доле; б — разрез для доступа к теменной доле; в — разрез для доступа к височной доле; г — разрез для доступа к затылочной доле.

Рис. 6. Схематическое изображение линейных разрезов, применяемых при костнопластической трепанации черепа для доступов к различным отделам головного мозга: а — вертикальные разрезы для доступа к височной и теменной долям; б — горизонтальные разрезы для доступа к лобной, теменной и затылочной долям; пунктиром обозначена сагиттальная плоскость.
Костно-пластическую Т. ч. почти всегда Производят под эндотрахеальным наркозом (см. Ингаляционный наркоз). Форма кожного разреза зависит от вида хирургического доступа к различным участкам мозга и другим внутричерепным структурам. Наиболее часто применяют дугообразные (рис. 5) и линейные разрезы (рис. 6), реже — фигурные (S-образные, Т-образные и др.). Дугообразный разрез должен располагаться так, чтобы ножка кожного лоскута была широкой и направленной в сторону главных питающих сосудов данной области. Следует избегать повреждения таких сосудов, т. к. это может привести к некрозу части лоскута.
Для вскрытия передней черепной ямки и для доступа к лобным долям и области турецкого седла производят дугообразный одно- или двусторонний разрез в лобной области (рис. 5, а.). Для доступа к теменной доле разрез начинают кпереди от ушной раковины, ведут до сагиттального (стреловидного) шва, огибая теменной бугор, и заканчивают позади уха (рис. 5, б). Для подхода к височной доле подковообразный разрез проводят от середины верхнего края скуловой дуги, вверх и кзади к теменному бугру и заканчивают у сосцевидного отростка (рис. 5, в). Для подхода к затылочной доле разрез начинают у верхнего края ушной раковины, продолжают кверху и кзади по направлению к средней линии и заканчивают у наружного затылочного выступа (рис. 5, г).
Э. И. Злотник предложил применять линейные разрезы кожи при любой локализации трепанационного окна. При этом кожный разрез по длине должен примерно вдвое превосходить вертикальный размер костного лоскута. Преимущество таких разрезов заключается в меньшей травматичности, кровоточивости, лучшем заживлении раны и уменьшении частоты осложнений (нагноения, гематомы, ликвореи).
Типичную костно-пластическую трепанацию выполняют следующим образом. После подготовки операционного поля и нанесения линии кожного разреза 10% р-ром нитрата серебра или метиленовым синим кожу с апоневрозом рассекают по намеченной линии частями, разрезая каждый последующий участок только после остановки кровотечения на предыдущем. Во избежание излишней кровопотери кожу в момент рассечения сильно прижимают к кости концами пальцев, слегка оттягивая ее в обе стороны от линии разреза. Кожно-апоневротический лоскут с помощью скальпеля или тупым путем отделяют от подлежащих тканей так, чтобы подапоневротическая клетчатка и надкостница оставались на кости. Отделенный лоскут отворачивают и прикрывают салфетками. Затем, отступая от краев кожного разреза на 1 — 2 см, дугообразным разрезом рассекают надкостницу. Нижние концы разреза продолжают на височную мышцу. Отслоив надкостницу распатором в обе стороны от разреза, трепаном просверливают в кости 5— 6 фрезевых отверстий по линии разреза надкостницы. Кость между ними пропиливают проволочной пилой после предварительного проведения под кость между соседними отверстиями проводника Оливекруны (рис. 4, б). Пропиливать кость необходимо наклонно, с тем чтобы костный лоскут в последующем плотно лежал на краю отверстия, не проваливаясь в него. Кость у основания костного лоскута частично резецируют щипцами Дальгрена, после чего лоскут приподнимают элеваторами и надламывают у основания. Твердую мозговую оболочку вскрывают подковообразным или крестообразным разрезом. После завершения внутричерепной части операции твердую мозговую оболочку зашивают шелковыми швами, костный лоскут укладывают на место и фиксируют швами. Затем послойно ушивают узловатыми швами надкостницу, височную мышцу, апоневроз и кожу. В заднем углу раны на 1 — 2 сут. оставляют резиновый дренаж и накладывают провизорный шов, к-рый затягивают а завязывают после удаления дренажа.
Библиогр.: 3лотник Э. И. О применении линейных разрезов кожи при трепанации черепа, Вопр. нейрохир., № 4, с. 34, 1969; Многотомное руководство по хирургии, под ред., Б. В. Петровского, т., 3, кн. 2, с. 528, М., 1968; Угрюмое В. М., Васкин И. С. и Абраков Л. В. Оперативная нейрохирургия, с. 65, Л., 1959; Cushing Н, Subtemporal decompressive operations for the intracranial complications associated with bursting fractures of the skull, Ann.. Surg., v. 47, p. 641, 1908; О 1 i v e с r o-n a H. Die chirurgische Behandlung der Gehirntumoren, B., 1927; Vara Lopez R. La craniectomla a trav£s de los siglos, Valladolid, 1949; Wagner W* Die temporare Resektion der Schadeldaches an Stelle der Trepanation, Zbl. Chir., Bd 16, S. 833, 1889.
Костно-пластическая трепанация черепа. Показания для трепанации черепа. Методика выполнения трепанации черепа.
Костно-пластическая трепанация черепа выполняется с целью доступа в полость черепа. Показаниями для костно-пластической трепанации черепа неё являются операции по поводу опухолей и инсультов мозга, ранений сосудов твёрдой мозговой оболочки, вдавленных переломов костей черепа.
Отличие костно-пластической трепанации от резекционной заключается в том, что широкий доступ в полость черепа создаётся путём выкраивания большого костного лоскута, который после выполнения оперативного приёма укладывают на место. После такой трепанации не требуется повторной операции с целью ликвидации дефекта кости, как при резекционной трепанации (рис. 5.36).
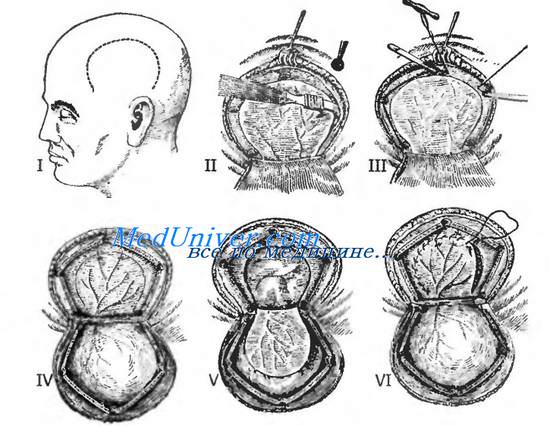
Костно-пластическая трепанация черепа в височной области. I — выкраивание кожно-апоневротического лоскута; II — в кости после отслоения надкостницы распатором фрезами сделано три отверстия; III — промежутки между отверстиями пропиливаются пилкой Джильи с использованием проводника Поленова; IV - надкостнично-костный лоскут отвернут, разрезана твердая мозговая оболочка; V — отвернут лоскут твердой мозговой оболочки, обнажено вещество мозга; VI — после выполнения оперативного приёма накладывается непрерывный шов на твердую мозговую оболочку.
Подковообразный разрез мягких тканей производят с таким расчетом, чтобы основание лоскута было внизу. Тогда не пересекаются идущие радиально снизу вверх сосуды и кровоснабжение лоскута мягких тканей не нарушается. Длина основания лоскута не менее 6-7 см. После остановки кровотечения кожно-мышечно-апоневротический лоскут отворачивают книзу на марлевые салфетки и сверху прикрывают марлей, смоченной изотоническим раствором хлорида натрия или 3 % раствором перекиси водорода.
Выкраивание костно-надкостничного лоскута начинают с дугообразного рассечения надкостницы скальпелем, отступив на 1 см кнутри от краев кожного разреза. Надкостницу отслаивают от разреза в обе стороны на ширину, равную диаметру фрезы, которой затем наносят в зависимости от величины создаваемого трепанационного дефекта 5-7 отверстий с помощью ручного или электрического трепана. Сначала используется копьевидная фреза, а при появлении костных опилок, окрашенных кровью, что свидетельствует о попадании фрезы в диплоический слой кости, копьевидную фрезу заменяют конусовидной или шаровидной фрезой, чтобы не «провалиться» в полость черепа.
Участки между этими отверстиями пропиливают проволочной пилой Джильи. Из одного отверстия в другое пилу проводят с помощью тонкой стальной пластинки — проводника Поленова. Распил ведут под углом 45° к плоскости операционного поля. Благодаря этому наружная поверхность лоскута кости оказывается больше внутренней: при возвращении лоскута на место он не проваливается в дефект, созданный при трепанации. Так распиливают все перемычки между отверстиями, кроме одной, лежащей сбоку или снизу по отношению к основанию лоскута мягких тканей. Эту перемычку надламывают, в результате чего весь костный лоскут остаётся связанным с неповреждёнными участками костей только надкостницей. Костный лоскут на надкостничной ножке, через которую обеспечивается его кровоснабжение, отворачивают. Далее выполняется запланированный оперативный приём. Завершая операцию, сначала зашивают твёрдую мозговую оболочку. Костный лоскут укладывают на место и фиксируют кетгутовыми швами, проведенными через надкостницу, мышцу и сухожильный шлем. Рану мягких тканей послойно зашивают.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Пациенты с раком имеют подавленную иммунную систему и более восприимчивы к инфекциям.
12 марта 2020 г. 8:26
Исследователи представили структуру и механизм белков, которые экспрессируются при различных формах рака и связаны с плохим прогнозом пациента.
9 марта 2020 г. 12:07
В низких дозах тетродотоксин заменяет опиоиды для облегчения боли, связанной с раком.
5 марта 2020 г. 14:24
Новый метод картирования сил, которые кластеры клеток оказывают на микроокружение, может помочь в изучении развития тканей и метастазирования рака.
Как и любая другая часть тела, мозг подвержен таким проблемам, как кровотечение, инфекции, травмы и иные повреждения. Возникает необходимость оперативного вмешательства с целью диагностики или лечения проблем. Краниотомия (трепанация черепа) – вид операции на головном мозге. Существует несколько типов хирургических вмешательств на мозге, но восстановление после трепанации такое же, как и в большинстве случаев. Она выполняется чаще всего.
Трепанация черепа в клинике Ассута открывает неограниченные возможности в сфере коррекции сложных заболеваний и травм головного мозга. Преимущества обращения в частный медицинский госпиталь неоспоримы:
- Лечение ведут лучшие нейрохирурги страны, возглавляющие профильные отделения больниц Израиля, прошедшие стажировку в ведущих западных клиниках.
- Революционное техническое оснащение операционных залов, наличие роботизированных систем, навигационных комплексов.
- Быстрые сроки организации лечения - диагностика и составление терапевтического протокола занимают всего 3-4 дня.
Мы ждем вас на лечение в профильных отделениях сети Assuta. Доступные цены, профессиональный подход, индивидуальные схемы терапии.
Существует целый ряд поражений и аномалий, которые влияют на череп и его содержимое и требуют проведение краниотомии:
- Череп. Самая распространенная проблема – доброкачественная опухоль.
- Головной мозг. Чаще всего причиной обращения являются – глиомы, метастазы в головном мозг из других органов, абсцесс (локализованная инфекция).
- Оболочки. Эти ткани в основном поражают доброкачественные новообразования – менингиомы, которые увеличиваются в размерах и давят на мозг, приводя к его повреждению.
- Кровеносный сосуд. Сосуды у основания мозга может поражать аневризма, которая способна привести к их разрыву и кровотечению вокруг головного мозга (субарахноидальному кровоизлиянию).
- Спинномозговая жидкость. Возникновение препятствия в ликворобращении приводит к гидроцефалии (отеку мозга), что в некоторых случаях требует трепанации.
В каких случаях делают трепанацию черепа – общие показания:
- Осмотр видимых проблем головного мозга.
- Серьезная черепно-мозговая травма или травма головы.
- Удаление тромба или гематомы.
- Биопсия – взятие образца ткани для проверки на наличие раковых клеток.
- Дренирование очага абсцесса головного мозга.
- Снижение давления в черепе в связи с опухолью.
- Для контроля кровотечения, вызванного аневризмой.
- Восстановление кровеносных сосудов.
- Доброкачественная и злокачественная опухоль мозга.
- Нервные расстройства.
- Инфекции головного мозга.
Если не лечить, любое состояние, требующее оперативного вмешательства, вызовет дальнейшее повреждение.
Виды трепанации черепа
Существует несколько способов краниотомии, на выбор влияет тип операции, который за ней следует:
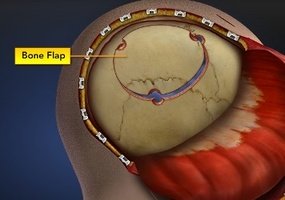
- Традиционная трепанация – костный лоскут или часть черепа удаляют в начале операции и возвращают на место в завершении.
- Эндоскопическая краниотомия проводится через небольшое отверстие в черепе посредством эндоскопа.
- Стереотаксическая трепанация – стандартный метод дополняется исследованиями МРТ и КТ. В итоге хирург получает трехмерное изображение с точной локализацией очага. Преимущество методики – она четко отделяет здоровые ткани от патологических.
Предоперационная подготовка
Диагностика в клинике Ассута может включать физическое обследование, анализы крови, ЭКГ, рентген грудной клетки. Нейровизуализация осуществляется посредством КТ или МРТ, артериограммы.
Перед операцией пациенту могут предписать лекарства для облегчения беспокойства, уменьшения риска судорог, отека и инфекции после хирургии. Коррелируется прием средств, разжижающих кровь (гепарина, аспирина) и нестероидных противовоспалительных препаратов (ибупрофена, мотрина, адвила) в связи с повышением вероятности тромбообразования после трепанации черепа. Их прием прекращают минимально за 7 дней.
При диагнозе опухоль головного мозга назначают стероиды. Они устраняют отек, вызванный новообразованием. Лечение продолжается после краниотомии по точному предписанию врача. Важно четко следовать инструкциям. Последствием приема стероидом бывает раздражение желудка. Чтобы уменьшить его, нужно принимать таблетки с едой или стаканом молока. Иногда назначают препараты, предотвращающие раздражение.
За 1-2 недели до операции больной прекращает курение, жевание табака и употребление алкоголя. Эти действия вызывают осложнения во время и после операции, замедляет заживления прооперированной области.
Пациенту в клинике Ассута предоставляют больничную одежду и специальные чулки, которые помогают предотвратить тромбоз глубоких вен. После операции есть риск этого нежелательного последствия в связи с длительным отсутствием движения.
Хирург беседует с больным по поводу операции, побочных эффектов и осложнений. Пациент подписывает форму согласия. Также больной встречается с анестезиологом.
Как делают трепанацию черепа?
Традиционная краниотомия включает следующие этапы:
- На оперируемой области сбривают волосы.
- Пациенту дают общий наркоз. Местный анестетик вводят в кожу головы, чтобы уменьшить послеоперационную боль.
- Голову фиксируют на специальном подголовнике, чтобы оперируемая область была доступна. Движения сводят к минимуму, удерживая голову посредством специального устройства с тремя болтами, помещенными на внешнюю поверхность черепа.
- С помощью предварительного сканирования и применения системы нейронавигации нейрохирург определяет самое подходящее место для трепанации. Процедура начинается с разреза кожи головы.
- Посредством дрели высокой мощности в черепе просверливают небольшие отверстия.
- Краниотом (хирургический инструмент для пробуравливания черепа) используется для создания съемного костного лоскута (он формируется между отверстиями). Так открывается доступ к мозгу.
- Далее в зависимости от диагноза – восстанавливаются кровеносные сосуды, удаляет тромб или опухоль.
- В завершении операции костный лоскут устанавливают на место, фиксируют специальными зажимами, мышцы и кожу зашивают. Размещают дренаж внутри мозга, чтобы удалить избыток крови, закрепляют его одним швом. Так рана заживает быстрее.
Длительность хирургического вмешательства порядка 2,5 часов.
Восстановление после трепанации черепа
Сразу же после краниотомии тестируется реакция зрачка, после наркоза оценивается психическое состояние, движение конечностей (рук и ног).
Артериальное давление тщательно контролируется вместе с пульсом. Катетер, вставленный в артерию, может быть использован для непрерывного мониторинга давления. Внутричерепное давление контролируют посредством небольшого катетера, помещенного внутрь головы и соединенного с манометром.
Медсестры берут образцы крови для определения уровня красных клеток крови и количества натрия и калия.
Обеспечивается внутривенное вливание – в организм пациента поступает физиологический раствор. Когда больной будет в состоянии самостоятельно принимать пищу и жидкость, инфузию убирают.
Вскоре после операции пациент начинает выполнять дыхательные упражнения для очищения легких. Вставать он сможет примерно через сутки после трепанации.
Для контроля боли, отеков и судорог назначают лекарства. Антибиотики предписывают для профилактики инфекций.
Дренаж извлекают на следующий день. Отек и синяки будут присутствовать первое время на лице.
Хирургические скобы удаляют на 5-7 день после трепанации черепа. Голову нельзя мочить до удаления скоб.
Выписка
В клинике пациент обычно пребывает пять дней, в некоторых случаях – дольше. Назначаются лекарства, которые понадобятся после операции.
Длительное наблюдение требуется, если речь идет об инфекции или опухоли.
Инфекция предполагает такое состояние, как абсцесс мозга. Врач назначает конкретные антибиотики для инфекционного агента, вызывающего абсцесс. В некоторых случаях прием длиться несколько месяцев.
Последующий уход при опухоли зависит от ее характера – доброкачественного или злокачественного.
Пациенты с доброкачественными новообразованиями наблюдаются у врачей несколько лет, чтобы убедиться в отсутствии рецидивов. Если болезнь возвращается, операцию повторяют или проводят лучевую терапию.
Злокачественные опухоли имеют иную перспективу. Применяются дополнительные методы лечения:
- Облучение проводят после удаления метастатических очагов и новообразований, которые возникли непосредственно в головном мозге, к примеру, глиобластомы. Выживаемость увеличивается вдвое после операции с последующей радиотерапией.
- Химиотерапия применяется при глиобластоме, но часто помогает незначительно, также вызывает нежелательные побочные эффекты.
- Иммунотерапия повышает работу иммунной системы. При глиобластоме опухоль часто берут во время операции для изготовления вакцину. Введённая вакцина стимулирует клетки крови создавать лимфоциты, которые будут находить и атаковать патологический очаг. Ранние исследования показали, что иммунотерапия улучшает выживаемость у некоторых пациентов, вызывая минимальные побочные эффекты.
Реабилитация после трепанации черепа
Полное восстановление занимает до двух месяцев, но чаще пациенты возвращаются к полноценной жизни за меньшее время.
На выздоровление влияют следующие факторы:
- Вид черепно-мозговой травмы.
- Степень серьезности травмы.
- Осложнения.
- Наличие или отсутствие неврологических проблем.
- Тип проведенной операции.
- Побочные эффекты или осложнения послеоперационного лечения.
- Возраст и общее состояние здоровья, в том числе наличие других болезней.
Возможны ощущения усталости и беспокойства до восьми недель после краниотомии. Это нормально, понадобиться дневной сон во второй половине дня. Вопрос о возвращении к работе можно будет обсудить с врачом. Если рабочая деятельность не предполагает нагрузки, примерно через 6 недель приступают к ней.
Следующих видов деятельности во время восстановления следует избегать:
- Вождения. Автомобиль можно будет водить спустя 3 месяца.
- Контактных видов спорта – не менее года.
- Употребления спиртных напитков.
- Нахождения в положение сидя длительное время.
- Подъем тяжестей – не более 2,25 кг.
- Занятий домашним хозяйством (загрузки/разгрузки стиральной или посудомоечной машины, уборки пылесосом, глажки, стрижки газона или озеленения).
После выписки назначаются необходимые препараты, обезболивающие. Примерно две недели могут наблюдаться головные боли. Некоторые анальгетики вызывают запор. Рекомендуется употреблять больше фруктов, овощей и клетчатки, пить больше жидкости. Алкоголь взаимодействует с некоторыми лекарствами, поэтому важно заранее проконсультироваться с врачом.
Рана может болеть несколько дней после краниотомии. По мере заживления наблюдается зуд. Возможен отек в этой области. Несколько месяцев на одной стороне раны может наблюдаться онемение.
У некоторых пациентов отмечаются приступы до или после трепанации черепа. В таком случае предписываются противосудорожные препараты. Если возникают побочные эффекты, важно обратиться к врачу.
Требуется помощь специалиста, если возникли любые признаки раневой инфекции или какие-либо другие необычные симптомы – сильная головная боль, судороги, рвота, спутанность сознания или боль в груди.
Трепанация черепа – последствия после операции
Каждая оперативное вмешательство несет в себе риск. Осложнения после трепанации черепа – нечастое явление. На степень вероятности развития побочных эффектов влияют такие факторы, как вид поражения мозга, общее состояние здоровья и возраст.
Хирург объяснит потенциальные осложнения пациенту и даст представление о риске их появления:
- Приступы.
- Утечка ликвора (жидкости вокруг мозга).
- Тромбоз глубоких вен.
- Легочная эмболия.
- Пневмония.
- Инфаркт.
- Повреждение кожи головы из-за фиксирующего устройства.
- Травмы лицевых мышц.
- Повреждение пазух.
- Судороги.
- Повреждение мозга, которое может вызвать ухудшение или утрату функции – глухоту, двоение в глазах, онемение, паралич, слепоту, потерю обоняния, снижение памяти.
- Отек головного мозга.
- Инсульт.
- Аллергические реакции на анестетик.
- Гематомы.
- Кровотечение.
- Инфекции мочевыводящих путей.
- Инфицирование костного лоскута.
Некоторые из этих последствий трепанации черепа достаточно серьезные и опасные для жизни. Частота их возникновения составляет 5%.
Вопросы, которые можно задать врачу в Ассуте:
- Как проводится операция?
- Какие тесты и подготовка необходимы перед оперативным вмешательством?
- Какие риски связаны с трепанацией черепа?
- Как часто наблюдается повреждение здоровой ткани мозга во время такой операции?
- Каков ожидаемый исход краниотомии?
- Какие осложнения могут возникнуть?
- Сколько времени необходимо для восстановления?
- Сколько таких операций проводилось в прошлом году в клинике?
Рекомендуем к прочтению
Краниотомия под местной анестезией (трепанация черепа в сознании)
Краниотомия в сознании (awake craniotomy) – показания, ход операции, последующее восстановление, потенциальные риски.
Суть краниотомии заключается в выполнении разреза («томия» – греч.) черепной коробки («кранио» – греч.). Это общее понятие, описывающее целый ряд операций, в ходе которых производится хирургическое вскрытие черепной кости. Эта операция наиболее распространена в нейрохирургии – медицинском направлении, отвечающем за хирургию мозга и центральной нервной системы.
Краниотомия выполняется с целью коррекции таких медицинских состояний, как доброкачественные и злокачественные опухоли головного мозга (в этих случаях иногда необходимо выполнить биопсию или даже частичное или полное удаление опухоли; операция удаления части опухоли мозга называется также «частичным удалением» или «операцией по снижению объема опухолевой ткани» – debulking), устранение патологических изменений сосудов головного мозга (например, аневризма сосудов головного мозга и артериовенозная мальформация (arteriovenous malformation – AVM)), лечение местных травм (таких как перелом или внутримозговое кровотечение), лечение инфекционных процессов мозга (гнойник, абсцесс), а также с целью лечения ряда неврологических явлений (таких как острый эпилептический приступ).
Метод краниотомии, как правило, применяется в случае первичных опухолей мозга – в большинстве случаев доброкачественных (типа менингеомы) или злокачественных (типа глиомы (glioma)), глиом низкой степени злокачественности (степени 1 и 2), редких видов опухолей мозга (например, гермином или лимфом), а также вторичных опухолей мозга.
Каковы ожидаемые результаты данной процедуры?
Краниотомия – это операция, которая выполняется при различных медицинских состояниях:
- С целью удаления доброкачественной или злокачественной опухоли, которая давит на мозг и приводит к таким явлениям, как головная боль или дезориентация.
- Устранение патологических изменений сосудов головного мозга.
- Лечение местных травм, таких как перелом или внутримозговое кровотечение.
- Лечение инфекционных процессов мозга (гнойник, абсцесс).
- Лечение неврологических явлений, таких как острый эпилептический приступ.
- Устранение врожденных пороков черепа у детей.
При помощи операции будет достигнуто улучшение функциональных и сенсорных возможностей пациента, поскольку операционное лечение в большинстве случаев облегчает характерные симптомы заболевания. Вместе с тем важно помнить, что речь идет об операции трепанации черепа и проникновении в мозг, что считается одной из самых сложных операций в нейрохирургии.
Как на практике выполняется эта процедура?
Краниотомию можно выполнять под местным или общим наркозом. Непосредственно перед операцией пациент будет подключен к системе, предназначенной для внутривенного введения препаратов, через которую анестезиолог введет успокоительные препараты, цель которых – помочь пациенту снизить ощущение тревоги.
Если принимается решение о выполнении регионарной анестезии, это значит, что хирург и анестезиолог смогут разговаривать с пациентом на протяжении всей операции. Если принимается решение о выполнении общего наркоза, это значит, что пациент погрузится в глубокий сон на все время операции и не будет осознавать того, что с ним происходит. В обоих случаях голова пациента будет закреплена с помощью особого устройства, которое называется «держатель головы», и его назначение состоит в том, чтобы предотвратить любое движение или смещение головы, и за счет этого обеспечить наибольшую точность в ходе выполнения операции.
Сегодня в ходе операции краниотомии хирурги пользуются высокотехнологичной системой навигации, позволяющей обнажить в точности тот участок мозга, который предполагается оперировать, и уменьшить степень повреждения окружающих областей и тканей. Системы навигации оснащены современными средствами визуализации, такими как ультразвук, МРТ (визуализация с помощью магнитного резонанса) и КТ (компьютерная томография).
Перед началом операции предварительно побритый участок операционного поля будет обработан антисептическим раствором. После того, как будет установлено, что наркоз начал действовать, хирург выполнит разрез кожи головы, с тем чтобы оголить черепную кость. На следующем этапе часть черепной кости будет распилена специальной высокоскоростной дрелью и удалена. Удаление части черепной кости обнажит оболочку мозга, которая называется «твердой мозговой оболочкой» (dura mater). Хирург вскроет твердую мозговую оболочку и обнажит тот участок, который предстоит прооперировать.
Начиная с этого этапа, операция будет проходить под специальным микроскопом. В случае наличия опухоли ее удаление будет проводиться с помощью аспиратора (suction), электрического пинцета (Bipolar Forceps) или ультразвукового аспиратора (Ultrasonic Aspirator), который разделяет ткани при помощи ультразвука. Кровотечение в мозгу будет дренировано, и в случае необходимости обработки кровеносных сосудов хирург прижжет проблемные сосуды и закроет операционную область.
В конце операции хирург тщательно проверит, что отсутствует кровотечение из всех кровеносных сосудов операционного поля, и только после этого он наложит шов на твердую мозговую оболочку и вернет на место участок черепной кости. После того, как участок черепной кости будет закреплен, хирург совместит края разреза на коже, наложит на них швы и накроет прооперированный участок повязкой.
В случае необходимости хирург вставит дренаж для оттока жидкости и крови из операционной области, который будет находиться там как минимум два дня. Также, возможно, будет необходимость в поддержке дыхания пациента после операции с помощью аппарата искусственной вентиляции легких.
Какой наркоз будет использоваться в ходе процедуры?
Регионарный или общий.
Сколько времени будет длиться процедура?
3–4 часа или больше, в зависимости от вида операции.
Часть пациентов будет получать стероиды до или после операции с целью уменьшения отека в операционной области. Также пациент должен будет получать противосудорожные препараты с целью предотвращения эпилептических приступов.
Как подготовиться к операции и госпитализации?
Следует взять с собой медицинское заключение семейного или лечащего врача, содержащее диагнозы и принимаемые пациентом лекарственные препараты, для того чтобы хирург и анестезиолог получили наиболее полную медицинскую и личную информацию о пациенте.
Необходимо пройти анализы крови, включающие в себя общий анализ крови и биохимический анализ крови, а в особых случаях потребуется также анализ свертываемости крови. Пациентам старше 40 лет необходимо выполнить и представить результаты ЭКГ.
Также необходимо провести визуализацию состояния мозга. Как правило, это компьютерная томография мозга (КТ), магнитно-резонансная томография мозга (МРТ), функциональная магнитно-резонансная томография (фМРТ) или ангиография (катетеризация сосудов мозга). В некоторых случаях, возможно, потребуются дополнительные обследования, такие как ПЭТ-сканирование (позитронное сканирование) и КТ-ангио (визуализация кровеносных сосудов).
За неделю до операции Вы должны прекратить прием противосвертывающих препаратов (таких как аспирин и кумадин). Необходимо проконсультироваться с семейным врачом или хирургом относительно необходимости применения альтернативных препаратов.
В день проведения операции, за 6 часов до ее начала, необходимо воздерживаться от еды и питья (включая воду). Рекомендуется воздерживаться даже от жевания жевательной резинки и курения. Перед входом в операционную необходимо снять зубные протезы, украшения и личную одежду.
Что будет происходить после операции?
Краниотомия – это серьезная операция, требующая госпитализации длительностью от 3 до 6 дней.
После того, как пациент окажется в послеоперационном отделении и выйдет из состояния наркоза, он будет переведен в реанимационное отделение как минимум на 24 часа для продолжения наблюдения и тщательного мониторинга. В зависимости от своего состояния, пациент может оставаться в реанимационном отделении около двух дней.
По окончании пребывания в реанимации его переведут в обычное отделение, где он уже сможет с помощью персонала садиться на кровати или в кресле, есть мягкую пищу и пить. Продолжительность госпитализации и дата выписки будут установлены в зависимости от эффективности восстановления после операции.
Что произойдет после выписки из больницы?
В большинстве случаев примерно через неделю после госпитализации пациент будет выписан домой.
Во время периода выздоровления важно тщательно следить за чистотой послеоперационной области и ежедневно промывать ее водой и мылом.
Следует избегать физической нагрузки в течение 6–8 недель после операции. Рекомендуется воздерживаться от вождения автомобиля, пока окончательно не исчезнут слабость и головокружение.
Если Вы или Ваши близкие нуждаетесь в проведении квалифицированной программы диагностики и лечения Вам рекомендуется обратиться к представителю нашего международного отдела, который поможет Вам в организации приезда в Израиль и в проведении профессиональной медицинской программы.
Кафедра нейрохирургии ГОУ ДПО РМАПО Росздрава, Москва
Российская медицинская академия последипломного образования, Москва
Кафедра нейрохирургии ГОУ ДПО РМАПО Росздрава, Москва
кафедра нейрохирургии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва, Россия
Эволюция хирургических доступов к передней и средней черепным ямкам: от расширенной краниотомии к супраорбитальному keyhole-доступу
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2016;80(3): 99‑105
Кафедра нейрохирургии ГОУ ДПО РМАПО Росздрава, Москва
На начальном этапе развития нейрохирургии недостаточное освещение операционного поля, ограниченная визуализация и отсутствие точной дооперационной диагностики требовали выполнения обширных краниотомий. По мере технологического прогресса и появления адекватных технических средств нейровизуализации, микрохирургии и нейроэндоскопии стало возможным минимизировать нейрохирургические доступы и соответственно связанные с ними осложнения. Философия минимально инвазивной хирургии в наше время приобретает особую актуальность, поскольку небольшие доступы способствуют быстрому восстановлению пациентов и сокращению сроков стационарного лечения. Цель исследования - представить краткий исторический обзор эволюции хирургических доступов к основанию черепа от расширенной краниотомии к минимально инвазивным вмешательствам.
Кафедра нейрохирургии ГОУ ДПО РМАПО Росздрава, Москва
Российская медицинская академия последипломного образования, Москва
Кафедра нейрохирургии ГОУ ДПО РМАПО Росздрава, Москва
кафедра нейрохирургии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва, Россия
На начальных этапах развития нейрохирургии хирургическое лечение внутричерепной патологии сопровождалось выполнением обширных краниотомий. В те времена это была вынужденная мера. Расширенные трепанации выполнялись по многим причинам: предоперационная диагностика зачастую не позволяла четко локализовать патологию, освещение в операционной было недостаточным, отсутствовали и специальные нейрохирургические инструменты. Поэтому широкая краниотомия планировалась для поиска глубинных образований. В дополнение, хирургическая бригада состояла в среднем из трех хирургов и можно представить, как сложно было ориентироваться в хирургическом поле [1, 2].
Субфронтальный и трансфронтальный доступы впервые были описаны J. Durante в 1884 г. Автор использовал эти доступы для резекции ольфакторной менингиомы. Послеоперационное течение было гладким, без осложнений, и пациент был выписан домой без неврологического дефицита [2].
Первое описание супраорбитального субфронтального и трансфронтального доступов представлено F. Krause в 1908 г. (рис. 1). В своем труде «Surgery of the Brain and Spine» проф. F. Krause привел 2 наблюдения.

Рис. 1. F. Krause (1857-1937).
Первому больному субфронтальный доступ выполнен с целью удаления пули из области турецкого седла. Оперативное вмешательство выполнялось спустя 4 года после ранения. Доступ выполнен латеральнее лобной пазухи. F. Krause визуализировал зрительный нерв и сонную артерию. Пациент выписан без неврологических осложнений.
Второй пациентке оперативное вмешательство выполнено по поводу менингиомы передней черепной ямки. Примечательно, что операция осуществлялась двухэтапно. Первым этапом выполнена краниотомия, но в связи с отеком и пролабированием мозга оперативное вмешательство завершено. Вторым этапом спустя 3 нед выполнено удаление опухоли. F. Krause отмечал необходимость значительной тракции мозга ассистентом двумя большими шпателями (рис. 2).

Рис. 2. Рисунок из книги F. Krause «Surgery of the Brain and Spine».
Вскрытие твердой мозговой оболочки проводилось в области крыльев основной кости. Опухоль удаляли пальцем, что вызвало впоследствии кровотечение, остановленное тампонадой.
В послеоперационном периоде F. Krause отметил более позднее пробуждение больной, при этом грубого очагового неврологического дефицита не было. Позднее на фоне нарушения сознания и дыхательных расстройств больная скончалась. На вскрытии выявлена гематома в области ложа удаленной опухоли [3, 4].
В 1920 г. J. Tandler и E. Ranzi [5] также использовали субфронтальный экстрадуральный доступ к гипофизу. C. Frazier и L. McArthur [6, 7] в 1912 и 1913 г. модифицировали субфронтальный доступ, добавив остеотомию верхнего края орбиты (рис. 3). Вскрытие твердой мозговой оболочки выполнялось на уровне переднего наклоненного отростка. По убеждению C. Frazier, расширение краниотомии создавало возможность меньшей тракции лобной доли и увеличения обзора глубинных структур.

Рис. 3. Субфронтальный доступ с остеотомией верхней стенки орбиты по McArthur и Frazier. а - разрез кожи при субфронтальном доступе; б - отведение костно-апоневротического лоскута до линии остеотомии верхнего края орбиты; в - ретрактор устанавливался на лобную долю, глазное яблоко отводилось книзу, вскрытие твердой мозговой оболочки проводилось на уровне крыльев основной кости и переднего наклоненного отростка, доступ позволял визуализировать хиазму и параселлярное пространство [6].
H. Cushing выполнил первое тотальное удаление менингиомы бугорка турецкого седла из субфронтального доступа в 1916 г. Нередко оперативные вмешательства разделялись на 2 и 3 этапа, что было вызвано развитием интраоперационного отека, кровопотерей и артериальной гипотензией. В 1938 г. H. Cushing и L. Eisenhardt [8] опубликовали свой опыт удаления 28 опухолей - труд, ставший классическим.
В 1920 г. G. Heuer [9] представил серию больных после удаления опухолей гипофиза из субфронтального доступа. При этом для доступа к хиазмальной области выполнялась достаточно широкая краниотомия с целью значительной тракции долей (рис. 4).

Рис. 4. Хирургический доступ к опухолям хиазмально-селлярной области. а - разрез кожи при субфронтальном доступе; б - тракция мозга; в - визуализация хиазмы после удаления опухоли [9].
Помимо осложнений, связанных с гипофизарной дисфункцией, автор выделял осложнения, связанные с тракцией мозга, в виде эпилептических приступов и грубого неврологического дефицита. У 2 больных рефрактерная внутричерепная гипертензия в послеоперационном периоде привела к летальному исходу [9]. В 1922 г. W. Dandy [12] опубликовал результаты хирургического лечения менингиом передней черепной ямки, где он также использовал достаточно широкую краниотомию.
Проблема неадекватного освещения, отсутствия инструментария и точной диагностики заставляла нейрохирургов идти на расширенные доступы со значительной тракцией мозговой ткани, подвергая опасности жизнь пациентов [10].
Первое планируемое оперативное вмешательство - по клипированию аневризмы - W. Dandy [11, 12] выполнил 23 марта 1937 г. (рис. 5).

Рис. 5. Первый гипофизарный доступ по W. Dandy к аневризме внутренней сонной артерии. а - вид пациента до операции; б - объем гипофизарного доступа, по данным краниографии, видна клипса (указано стрелками); в - вид пациента через 12 дней после вмешательства. Виден значительный регресс пареза глазодвигательного нерва [11].
Клипирование аневризмы устья задней соединительной артерии серебряной клипсой с сохранением просвета артерии выполнено из фронто-латерального или так называемого «гипофизарного» доступа пациенту 43 лет. В протоколе операции W. Dandy акцентирует внимание на значительной релаксации мозга после вскрытия хиазмальной цистерны, что дало больше пространства для манипулирования инструментами. Интересно, что разрез кожи впервые проводился в пределах волосистой части головы.
Вмешательство было выполнено только на основании клинических симптомов в виде пареза глазодвигательного нерва, без ангиографии. К 1944 г. W. Dandy накопил значительный опыт операций по поводу внутричерепных аневризм, что и отобразил в своей первой монографии.
Важнейшим этапом в развитии нейрохирургии было появление и широкое использование микронейрохирургической техники, одним из пионеров ее применения был Yasargil. В 1975 г. M. Yasargil [16] модифицировал «гипофизарный» доступ W. Dandy. Отличием птериональной краниотомии была более базальная резекция костных структур с резекцией латерального крыла основной кости.
M. Brock и соавт. [17] в 1978 г. опубликовали опыт хирургического лечения аневризм передней циркуляции из ограниченного фронто-латерального доступа. В 1982 г. J. Jane и соавт. [18] представили описание супраорбитального доступа при аневризмах и новообразованиях супраселлярной локализации и орбиты. Позже J. Delashaw и соавт. [19, 20] модифицировали этот доступ, используя технику, при которой крыша орбиты ломалась, либо дополняя краниотомию темпоральным распространением. R. Delfini [21] выполнял супраорбитальную краниотомию с отдельным выпиливанием верхней стенки орбиты. O. Al-Mefty и соавт. [22, 23] для доступа к опухолям основания черепа выполняли супраорбитально-птериональный доступ, дополняя его остеотомией верхней и латеральной стенок орбиты. R. Smith и соавт. [24] описали расширенные доступы с претемпоральным распространением для клипирования аневризм передней циркуляции. J. Zabramski и соавт. [25] подробно представили технические особенности орбитозигоматического доступа и его преимущества при патологии передней и средней черепной ямок. Во всех этих публикациях сделан акцент на широких доступах с более агрессивной резекцией структур основания черепа. Основные цели таких доступов заключались в увеличении обзора, сокращении расстояния до патологического субстрата и уменьшении тракционной травмы мозга посредством увеличения костного коридора. Однако травматизация мягких тканей, агрессивная и распространенная костная резекция, тракционная травма нередко обусловливали послеоперационные осложнения, которые не были непосредственно связаны с целью операции.
В 1998 г. E. van Lindert и соавт. [26] опубликовали свой опыт выполнения супраорбитальной субфронтальной краниотомии через разрез по брови в лечении 197 аневризм. В последующие годы появились публикации выполнения супраорбитальной краниотомии через различные кожные разрезы преимущественно при аневризмах передней циркуляции 28. Несмотря на разные названия и определенные модификации, очевидно, что все эти разновидности доступа берут свое начало от пионерской работы F. Krause [3]. F. Krause [3] понимал анатомическую обоснованность субфронтального доступа, при котором никакие структуры, включая полюс височной доли, не загораживали параселлярное пространство, что давало уникальную возможность свободного манипулирования инструментами.
Концепция keyhole-хирургии
Работа D. Wilson [30], опубликованная в 1971 г., явилась одной из определяющих в разработке принципов концепции keyhole-хирургии. D. Wilson основывался на работах известного хирурга W. Halsted [31], который еще в 1924 г. опубликовал свои взгляды, касающиеся необходимости усовершенствования хирургической техники и минимизации хирургической агрессии.
D. Wilson и соавт. начали модифицировать свою технику с 1966 г., в соответствии с требованиями микрохирургии - появление микроскопа позволило хорошо визуализировать глубинные структуры через малую трепанацию. D. Wilson использовал небольшие линейные разрезы кожи волосистой части головы, длиной около 5-6 см, при различной патологии, включая аневризмы, опухоли, абсцессы и пр. (рис. 6).

Рис. 6. Первая публикация о малоинвазивных доступах. а - варианты кожных разрезов; б - трепанационное окно [30].
На основании своего опыта D. Wilson сделал ряд заключений: малая трепанация возможна и в некоторых случаях является предпочтительной: доступ проще, быстрее и менее травматичен по сравнению с классическими и расширенными доступами, ограниченный доступ позволяет минимизировать повреждение тканей, таким образом заживление происходит быстрее, отек мозга минимален. Подобная техника позволяет хирургу больше времени уделять непосредственной цели операции. Автором выполнено более 100 краниотомий, при этом осложнения были редки и быстро поддавались коррекции. D. Wilson отмечал, что keyhole-хирургия не является фетишем, и необходима тщательная оценка внутричерепной патологии для выбора больных, у которых данный доступ может быть применен.
Пионером современной keyhole-нейрохирургии несомненно является Axel Perneczky (рис. 7). Обладая значительным опытом, A. Perneczky популяризировал минимально инвазивную нейрохирургию, сформулировав основные идеи концепции keyhole и ее возможности в современных условиях. В наши дни накоплен значительный опыт keyhole-хирургии, доказывающий эффективность методики в отношении минимизации хирургической агрессии при правильном подборе пациентов 33.

Рис. 7. Профессор Axel Perneczky (1945-2009).
Важнейший тезис keyhole-концепции - снижение травматизации тканей. Работа в течение нескольких часов при краниотомии с использованием ретракторов всегда означает определенное повреждение мозговой ткани нефизиологичной для внутричерепного содержимого средой - воздействием температуры, интенсивного света от микроскопа, растворов для ирригации, ватников, коагуляции и пр.
Тракционная травма может приводить к стойкому неврологическому дефициту, а в определенных условиях и к возникновению больших внутримозговых гематом с соответствующими последствиями. Для уменьшения тракционной травмы были предложены различные методы, включая определенные анестезиологические пособия, положение пациента на операционном столе, инновационные ретракторные системы. Однако наилучшая тракция - это ее отсутствие [36]. Современные тенденции в нейрохирургии предполагают использование динамической тракции, т. е. тракции инструментами, находящимися в руках хирурга, будь то аспиратор или биполярная коагуляция. Создание условий для безретракторной хирургии возможно при адекватном анестезиологическом пособии, релаксации мозга и правильном выборе положения пациента на операционном столе, с использованием естественной гравитации.
Очевидно, что отказаться от тракции мозга не всегда возможно. Однако действия нейрохирурга должны быть направлены на ее минимизацию. В случае keyhole-хирургии, когда время оперативного вмешательства значительно сокращается, создаются условия для минимизации тракционной травмы.
Важно осознавать, что при образованиях, расположенных конвекситально, требуется выполнение краниотомии, которая хотя бы немного превышает размеры самого образования. При распространенных артериовенозных мальформациях (АВМ) доступ должен быть достаточно широким для визуализации афферентов АВМ и дренирующих вен. Наоборот, при глубинных образованиях могут быть использованы keyhole-доступы 39.
Заключение
Философия минимально инвазивной хирургии в наше время приобретает особую актуальность, поскольку нейровизуализация в большинстве случаев дает исчерпывающую информацию о характере и локализации патологии, а современное оборудование операционной позволяет хирургу, при наличии специальных навыков, оперировать через «замочную скважину». Оперативное вмешательство должно проходить с минимумом ятрогенных осложнений и достигать максимальной эффективности.
Очевидно, что концепция keyhole - инновационное направление в нейрохирургии. В современных условиях при наличии эндоскопической ассистенции, микроскоп-ассоциированных опций, таких как ангиография и флюоресцентное окрашивание опухолевой ткани, при интраоперационных нейрофизиологических методах контроля и возможностях современной нейроанестезиологии минимально инвазивные вмешательства, являясь частью эволюционного процесса в хирургии, позволяют значительно снижать травматичность хирургических доступов, ассоциированные с доступами осложнения и негативные косметические эффекты. Быстрое восстановление пациентов и сокращение сроков стационарного лечения с возможностью скорейшей социальной и трудовой адаптации после сложных нейрохирургических вмешательств являются приоритетными в наши дни.
Необходимо подчеркнуть, что keyhole-доступы не должны быть самоцелью. Обязательным условием их применения служит тщательный отбор больных для таких вмешательств, с учетом размера и характера патологического образования, состояния окружающей мозговой ткани, прогнозируемых осложнений хирургического вмешательства.
Конфликт интересов отсутствует.
Комментарий
Авторы представляют последовательный исторический анализ эволюции субфронтального доступа от расширенной краниотомии до минимально инвазивных вмешательств. Минимизация краниотомии для доступа к базальной патологии явилась естественным процессом как следствие появления высокоинформативной диагностики внутричерепной патологии, усовершенствования микронейрохирургической техники и интраоперационной визуализации, а также нейроанестезиологии и нейрореанимации. В наше время нейрохирург в большей мере должен владеть разными техниками доступа к образованиям основания черепа, нежели использовать один универсальный доступ вне зависимости от локализации и размера образования. С другой стороны, выбор keyhole-доступов не может рассматриваться как универсальный, и подбор кандидатов для подобных вмешательств должен быть взвешенным и весьма индивидуальным, чтобы не подвергать риску жизнь пациента.
Читайте также:

