Пролиферация клеток эпидермиса что это
Обновлено: 27.04.2024
1 ФГБОУ ВО Ростовский государственный медицинский университет Министерства здравоохранения Российской федерации
Цель: сравнительно оценить в эксперименте влияние на морфологические изменения в коже при дерматите простом раздражительном контактном (ДПРК) препаратов, содержащих омега-3 и 6 полиненасыщенные жирные кислоты (ПНЖК), и средства противовоспалительного действия. Материал и методы: выполнены гистопатологические исследования 18 фрагментов кожи экспериментальных белых крыс с приготовлением парафиновых блоков и последующей окраской срезов гематоксилином-эозином и пикрофуксином по ван-Гизон. Результаты: Авторы отметили после 11-дневного лечения инъекциями внутрь брюшной полости Омегавена и наружно Кремом «Витамин Ф99» жирным (содержат омега-3 и 6 ПНЖК) менее выраженную, чем у леченных, Радевит мазью, лейкоцитарную инфильтрацию вокруг зон некроза в пораженной коже с преобладанием лимфоцитов и макрофагов. Выявлена также меньшая толщина полоски грануляционной ткани под активно пролиферирующими клетками эпидермиса. Заключение: удалось установить более выраженное противовоспалительное действие при экспериментальном ДПРК лечения – внутрь брюшной полости Омегавена и наружно – Крем «Витамин Ф99» жирный по сравнению с Радевит мазью.




1. Гребенников В.А. Местная терапия в дерматологии. Фармакологический справочник / В.А. Гребенников, Л.А. Анисимова, В.Е. Темников и др. – Ростов-на-Дону, 2014. – 131 с.
2. Каркищенко Н.Н. Основы биомоделирования / Н.Н. Каркищенко. – М.: Межакадемическое изд-во ВПК, 2003. – 500 с.
3. Каркищенко Н.Н. Руководство по лабораторным животным и альтернативным моделям в биомедицинских технологиях /под ред. Н.Н. Каркищенко и С.В. Грачева / Н.Н. Каркищенко. – М.: Профиль, 2010. – 358 с.
4. Миллер Л.Г. Регенерация кожи в условиях экспериментального дерматита и на фоне лечения препаратами «Эйковит»: дис. … канд. мед. наук: 03.00.25 /Миллер Лидия Георгиевна. – Тюмень, 2004. – 125 с.
5. Справочник Видаль. Лекарственные препараты в России: справочник. – М.: ЮБМ Медика Рус, 2014. – 1600 с.
7. Heller A.R. Omega-3 fatty acids improve liver and pancreas function in postoperative cancer patients /A.R. Heller, T. Rossel, B. Gottshlich et al. // Int. J. cancer. – 2004. – V.111. – P.611-616.
8. McLean C.H. Effects of omega-3 fatty acids on lipids and glycemic control in type 2 diabetes and the metabolic syndrome and on inflammatory bowel disease, rheumatoid arthritis, renal disease, systemic lupus erythematosus, and osteoporosis /C.H. McLean, W.A. Mojica, S.C. Marton et al. // Evid. Rep. Technol. Assess. (Summ.). – 2004. – V.89. – P. 1-4.
Воспалительные заболевания кожи весьма распространены, а повышение эффективности их лечения является актуальной проблемой современной клинической фармакологии.
В исследованиях ряда авторов показано противовоспалительное действие полиненасыщенных жирных кислот (ПНЖК) [4,7]. Содержащие омега-3 ПНЖК препараты при системной терапии проявляют противовоспалительное, антиоксидантное и мембраностабилизирующее влияние [6, 8]. В доступной литературе нет морфологических исследований влияния Омегавена и Крема «Витамин Ф99» жирного на воспалительную реакцию кожи. Мы стремились в настоящей работе осветить этот вопрос. Цель: сравнительно оценить в эксперименте влияние на морфологические изменения в коже при дерматите простом раздражительном контактном (ДПРК) препаратов, содержащих омега-3 и 6 полиненасыщенные жирные кислоты, и средства противовоспалительного действия.
Материал и методы
Экспериментальное исследование выполнено с соблюдением Международных принципов Европейской конвенции о защите позвоночных животных с учетом норм и правил биомедицинской этики (с разрешения этического комитета РостГМУ – протокол № 16/13 от 14.11.2013 г.) [2, 3]. Ожоговую травму экспериментальным животным наносили металлической пластиной круглой формы площадью 3,8 см квадратных при толщине в 1,5 мм, нагревали на электрической плитке с закрытой спиралью при начальных проявлениях покраснения покрывающей спираль металлической части. Металлическую пластину после нагревания охлаждали до 120 градусов. Это достигалось охлаждением трафарета размещением его в течение 20 секунд на металлическом основании комнатной температуры. Экспериментальных животных было 18 возраста 3–6 мес и массой тела 300–350 гр. Белых крыс без ДПРК было 2, для отработки термического повреждения – 5 животных, в группе без лечения 4 дня после ожоговой травмы – 2 крысы, 3 группы по 11 дней лечения Радевит мазью, сочетанием Омегавена и Крема «Витамин Ф9» жирный и лишь только таким кремом – по 3 животных. Биоптаты кожи животных, включающие зону ожога (верхняя часть спины справа), фиксировали в нейтральном формалине 24 часа и после обычной проводки заключали в парафин. Гистологические срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином, пикрофуксином по ван Гизон. Использовали методы обзорной микроскопии.
При лечении ДПРК были применены Омегавен, Радевит мазь и Крем «Витамин Ф99» жирный. Омегавен является, согласно данным доступной нам литературы, единственным лекарственным препаратом ПНЖК для парентерального введения. Фармакологическое действие – восполнение дефицита ПНЖК. Показания: термические и химические ожоги и др. (Инструкция по применению, производитель «Фрезениус Каби, Австрия ГмБХ»; [5]). Применение – внутривенно, для инфузии в вену при суточной дозе 1–2 мл/кг/сутки препарата. Наружно были использованы Крем «Витамин Ф 99» жирный и Радевит мазь. Крем «Витамин Ф99» жирный (ООО НИЛ «Стрелец», Россия) в составе включает витамин Ф – источник незаменимых ПНЖК, эфиры омега-3 жирных кислот, концентрат масла облепихового и др. [1].
Примененная Радевит мазь («Ретиноиды», Россия) представляет комбинированный препарат от белого до желтоватого цвета, в составе которой Ретинола пальмитат, Альфа-токоферола ацетат, Эргокальциферол и др. Фармакологическое действие – смягчающее, увлажняющее, противовоспалительное, репаративное, противозудное, нормализует процессы ороговения, усиливает защитную функцию кожи. Показания включают эрозии, ожоги и др. [1]. При инъецировании Омегавена (3,0 мл/кг/сут – ежедневно) белую крысу располагали головой вниз, легко встряхивали, иглой инъекционного шприца прокалывали брюшную стенку в 3–4 см кпереди от лонного сочленения. Крем и мазь наносили ежедневно тонким слоем.
Результаты и их обсуждение
Без лечения, 4 дня после ожоговой травмы (№;69, 71)
Коагуляционный некроз с кариопикнозом, кариорексисом и плазмокоагуляцией клеток в центре очагов повреждения захватывает эпидермис и слои дермы. В центре очага повреждения – коагуляционный некроз. Придатки кожи не определяются. На границе дермы и в гиподерме полнокровие, кровоизлияния, лейкоцитарная инфильтрация.
Некротизированы волосяные луковицы и сальные железы. В зоне повреждения на всем протяжении, до краев дефекта придатки не обнаруживаются.
На границе с гиподермой и в жировой клетчатке признаки острого воспаления: полнокровие, отек, инфильтраты из сегментоядерных лейкоцитов. По краю зоны повреждения некроз распространяется до 2/3 сетчатого слоя дермы, частично сохраняются луковицы волос и сальные железы. По границе некроза полнокровие, отек, выраженная (3+)*инфильтрация дермы сегментоядерными лейкоцитами.
Отмечаются признаки регенерации. Под коагуляционный некроз (струп) проникают пролиферирующие клетки эпидермиса толщиной до 10 слоев за счет росткового слоя. Пролиферация клеток эпидермиса выявлена вокруг сохранившихся волосяных стержней. Тяжи эпидермальных клеток, внедряющиеся в зону некроза в дерме, окружены сегментоядерными лейкоцитами.
В гиподерме – полнокровие, отек, периваскулярная лейкоцитарная инфильтрация. Вокруг сосудистых сплетений на границе гиподермы – инфильтраты из сегментоядерных лейкоцитов.
Лечение Радевит мазью, 11 дней после ожоговой травмы (№ №72, 76, 78)
В центре очагов повреждения – коагуляционный некроз с кариопикнозом, кариорексисом и плазмокоагуляцией клеток охватывает эпидермис и оба слоя дермы (рис. 1).
*/Слабо выраженная клеточная инфильтрация – 1+, умеренно выраженная
инфильтрация – 2+, выраженная инфильтрация – 3+ и резко выраженная инфильтрация – 4+.
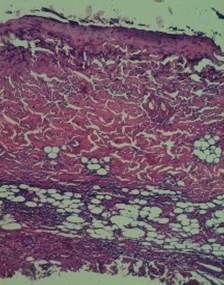
Рис. 1. Окраска гематоксилином-эозином, х 100 (№ 72). Центр очага повреждения. Коагуляционный некроз захватывает эпидермис, сосочковый и сетчатый слои дермы. На границе гиподермы, в жировой клетчатке и мышечном слое выраженная лейкоцитарная инфильтрация (3+)
Волосяные луковицы и сальные железы некротизированы. В зоне повреждения на всем протяжении до краев дефекта придатков обнаружить не удалось.
На границе гиподермы в жировой клетчатке и мышечном слое – выраженная лейкоцитарная инфильтрация с преобладанием сегментоядерных нейтрофильных лейкоцитов (3+). В нижних отделах сетчатого слоя дермы и в гиподерме – развитие грануляционной ткани с большим количеством капилляров, основного вещества и клеток. Грануляционная ткань выявлена и в краях очага повреждения. Она располагается под пролиферирующим эпидермисом, который в виде языка наползает на зону некроза. Толщина пласта эпидермальных клеток достигает 15 слоев. Отмечена пролиферация эпидермальных клеток вокруг сохранившихся волосяных влагалищ с образованием колбообразных выпячиваний. Местами эпидермальные клетки проникают под зону некроза и образовывают тонкие полоски толщиной в 1–2 клетки, как при заживлении под струпом.
Выраженная лейкоцитарная инфильтрация (3+) и развитие грануляционной ткани отмечены под зоной некроза в дерме и гиподерме. Следует отметить, что зрелость грануляционной ткани увеличивается по направлению к периферии. Ближе к центру очага она более рыхлая и содержит большое количество капилляров, основного вещества, фибробластов и клеток крови, среди которых преобладают сегментоядерные нейтрофильные лейкоциты и эозинофильные лейкоциты. Это свидетельствует о задержке острой фазы воспаления.
Лечение - Омегавен и Крем «Витамин Ф 99» жирный, после ожоговой травмы – 11 дней (№81, 82, 84)
В центре очагов повреждения выявляется коагуляционный некроз эпидермиса и обоих слоев дермы. Кариопикноз, кариорексис и плазмокоагуляция наблюдаются в клетках эпидермиса и мезенхимы. Некротизированы волосяные луковицы и сальные железы. В зоне повреждения на всем протяжении, до краев дефекта придатков обнаружить не удалось. В дерме полнокровие, кровоизлияния и инфильтрат из сегментоядерных лейкоцитов, большей частью некротизированных. Под зоной некроза, на границе эпидермиса и дермы слабо выраженная (1+) периваскулярная лейкоцитарная инфильтрация (рис. 2).
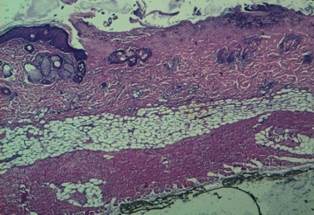
Рис. 2. Окраска гематоксилином – эозином, х 100 (№ 82). Центр очага повреждения. Под зоной некроза, на границе эпидермиса и дермы слабо выраженная периваскулярная лейкоцитарная инфильтрация (1+)
Рис. 3. Окраска гематоксилином-эозином, х 40 (№ 84). Край очага повреждения. Некроз распространен до ½ сетчатого слоя дермы; сохранены части волосяных луковиц. Вокруг них пролиферация клеток эпидермиса. Лейкоцитарная инфильтрация сохранившейся дермы и гиподермы слабо выражена (1+)
В краях очагов повреждений некроз распространяется до половины сетчатого слоя, частично сохранены луковицы волос (рис.3). Регенерация проявляется прежде всего пролиферацией клеток эпидермиса. Толщина пласта клеток эпидермиса достигает 10 клеток. Он в виде тонких язычков или булавовидных утолщений проникает под некротизированную ткань. Отмечается пролиферация клеток эпидермиса вокруг сохранившихся волосяных влагалищ с образование колбообразных выпячиваний. В дерме вокруг пролифератов клеток эпидермиса слабо выраженная лейкоцитарная инфильтрация (1+). Инфильтраты преимущественно из лимфоцитов и макрофагов. Преобладание лимфоцитов и макрофагов характерно для всех инфильтратов дермы и гиподермы. Местами в дерме отмечены своеобразные тяжи: периваскулярные лимфо-макрофагальные инфильтраты и тонкие полоски грануляционной ткани, распространяющиеся от гиподермы до зоны некроза. Тонкие полоски грануляционной ткани обнаруживаются и под эпидермисом.
Лечение Кремом «Витамин Ф 99» жирным, 11 дней после ожога (№ 86, 88, 90)
Центральную зону в очагах повреждения занимает участок коагуляционного некроза, который захватывает эпидермис, сосочковый и сетчатый слои дермы. Его характеризуют кариопикноз, кариорексис, плазмокоагуляция клеток эпидермиса и стромы. Волос и сальных желез в этой зоне не обнаружено. Под зоной некроза, на границе дермы, в жировой клетчатке гиподермы и мышечном слое выраженная лейкоцитарная инфильтрация с преобладанием сегментоядерных лейкоцитов (3+) и развитие грануляционной ткани с большим количеством капилляров, основного вещества и клеток, среди которых много эозинофильных лейкоцитов, что свидетельствует о регенерации. В краях очага некроза признаки заживления более выражены.
Пролиферирующие плоские клетки эпидермиса образуют резко утолщенный (до 10 рядов) слой, с неравномерно выраженным ороговением. Он погружен под некротические массы – заживление под струпом, образовал своеобразные выпячивания «почки», либо распространяется по поверхности. Отмечается пролиферация эпидермальных клеток вокруг сохранившихся волосяных влагалищ.
Выраженная лейкоцитарная инфильтрация (3+) и грануляционная ткань разной степени зрелости выявляются под эпидермисом, в дерме и гиподерме. Менее зрелой она определяется ближе к центру повреждения, более зрелой – по периферии краев.
Гистопатологические исследования пораженной кожи белых крыс с дерматитом простым раздражительным контактным при различных методах лечения позволили выявить определенные закономерности. От контрольной группы биоптаты кожи крыс с повреждением без лечения через 4 дня отличаются наличием очагов коагуляционного некроза, признаками воспаления: полнокровие, отек, кровоизлияния, выраженная инфильтрация сегментоядерными нейтрофильными лейкоцитами вокруг зон некроза, в дерме и гиподерме. Пролиферация эпидермиса в краях зон повреждения слабо выражена.
Биоптаты кожи крыс после 11 дней лечения Радевит мазью и Кремом «Витамин Ф99» жирным между собой практически не различаются. Отмечается выраженная инфильтрация сегментоядерными нейтрофильными лейкоцитами с примесью эозинофильных лейкоцитов (3+) и развитие большого количества грануляционной ткани вокруг некроза, под пролиферирующим эпидермисом, в толще дермы и в гиподерме. Грануляционная ткань более зрелая у краев очага повреждения.
Заключение
В биоптатах крыс после 11-дневного лечения инъекциями внутрь брюшной полости Омеговена и наружно – Крем «Витамин Ф 99» жирный в дерме отмечена менее выраженная – во всех препаратах 1+ (чем у леченных Радевит мазью либо только Кремом «Витамин Ф99» жирный – во всех препаратах 3+) лейкоцитарная инфильтрация вокруг зоны некроза, причем в инфильтратах преобладали лимфоциты и макрофаги, что свидетельствует о преобладании клеточного ответа. Под пролиферирующими активно клетками эпидермиса отмечена тонкая полоска грануляционной ткани, значительно менее выраженная, чем при лечении Радевит мазью, что, по-видимому, приведет к формированию более нежного рубца. Тем самым отмечено более выраженное противовоспалительное действие при экспериментальном дерматите простом раздражительном контактном средств лечения, содержащих омега-3 и 6 ПНЖК (Омегавен и Крем «Витамин Ф 99» жирный), по сравнению с Радевит мазью (судя клеточному составу инфильтратов – лимфоциты и макрофаги в одном случае и нейтрофильные сегментоядерные лейкоциты и эозинофилы – в другом случае, а также по выраженности клеточных инфильтратов).
2.1.10. Механизмы развития пролиферации в очаге воспаления
Пролиферация является завершающей фазой развития воспаления, обес-печивающей репаративную регенерацию тканей на месте очага аль-
терации. Пролиферация развивается с самого начала воспаления наряду с яв-лениями альтерации и экссудации.
При репаративных процессах в очаге воспаления регенерация клеток и фиброплазия достигаются как активацией процессов пролиферации, так и ог-раничением апоптоза клеток. Размножение клеточных элементов начинается по периферии зоны воспаления, в то время как в центре очага могут еще про-грессировать явления альтерации и некроза. Полного развития пролиферация соединительнотканных и органоспецифических клеточных элементов дости-гает после «очистки» зоны повреждения от клеточного детрита и инфекци-онных возбудителей воспаления тканевыми макрофагами и нейтрофилами. В связи с этим следует отметить, что процессу пролиферации предшествует формирование нейтрофильного и моноцитарного барьеров, которые форми-руются по периферии зоны альтерации.
Восстановление и замещение поврежденных тканей начинается с выхода из сосудов молекул фибриногена и образования фибрина, который формиру-ет своеобразную сетку, каркас для последующего клеточного размножения. Уже по этому каркасу распределяются в очаге репарации быстро образую-щиеся фибробласты. Деление, рост и перемещение фибробластов возможны только после их связывания с фибрином или коллагеновыми волокнами. Эта связь обеспечивается особым белком – фибронектином. Размножение фиб-робластов начинается по периферии зоны воспаления, обеспечивая формиро-вание фибробластического барьера. Хемотаксис, активация и пролиферация фибробластов осуществляются под воздействием:
1. Факторов роста фибробластов.
2. Тромбоцитарного фактора роста.
3. Цитокинов - ФНО, ИЛ-1.
6. Трансформирующего фактора роста b.
Сначала фибробласты не зрелые и не обладают достаточной синтетиче-ской активностью. Созреванию предшествует внутренняя структурно-функциональная перестройка фибробластов: гипертрофия ядра и ядрышка, гиперплазия ЭПС, повышение содержания ферментов, особенно щелочной фосфатазы, неспецифической эстеразы, b-глюкуронидазы. Только после пе-рестройки фибробласты начинают синтезировать коллаген, эластин, коллаге-нассоциированные белки и протеогликаны. Коллагеногенез стимулируется следующими биологически активными веществами - ФНО, ИЛ-1, ИЛ-4, фак-тором роста фибробластов, тромбоцитарным фактором роста.
Интенсивно размножающиеся фибробласты продуцируют кислые муко-полисахариды – основной компонент межклеточного вещества соединитель-ной ткани (гиалуроновую кислоту, хондроитинсерную кислоту, глюкозамин, галактозамин). При этом зона воспаления не только инкапсулируется, но и начинаются постепенная миграция клеточных и бесклеточных компонентов соединительной ткани от периферии к центру, формирование соединитель-нотканного остова на месте первичной и вторичной альтерации.
Наряду с фибробластами размножаются и другие тканевые и гематоген-ные клетки. При разрушении базальных мембран сосудов в зоне альтерации происходит миграция клеток эндотелия по градиенту ангиогенных факторов. Просвет новообразующегося капилляра формируется путем слияния внекле-точных пространств соседних эндотелиоцитов. Вокруг новообразующихся капилляров концентрируются тучные клетки, макрофаги, нейтрофилы, кото-рые освобождают биологически активные вещества, способствующие про-лиферации капилляров.
Важнейшими факторами, стимулирующими ангиогенез, являются:
1. Факторы роста фибробластов (основной и кислый).
2. Сосудистый эндотелиальный фактор роста.
3. Трансформирующие факторы роста .
4. Эпидермальный фактор роста.
Фибробласты вместе с вновь образованными сосудами создают грануля-ционную ткань. Это, по существу, молодая соединительная ткань, богатая клетками и тонкостенными капиллярами, петли которых выступают над по-верхностью ткани в виде гранул.
Основными функциями грануляционной ткани являются: защитная – пре-дотвращение влияния факторов окружающей среды на очаг воспаления и ре-паративная – заполнение дефекта и восстановление анатомической и функ-циональной полноценности поврежденных тканей.
Формирование грануляционной ткани не строго обязательно. Это зависит от величины и глубины повреждения. Грануляционная ткань обычно не раз-вивается при заживлении ушибленных кожных ранок или мелких поврежде-ний слизистой оболочки (Кузин М.И., Костюченок Б.М. и соавт., 1990). Гра-нуляционная ткань постепенно превращается в волокнистую ткань, называе-мую рубцом. В рубцовой ткани уменьшается количество сосудов, они запус-тевают, уменьшается количество макрофагов, тучных клеток, снижается ак-тивность фибробластов. Небольшая часть клеточных элементов, распола-гающаяся среди коллагеновых нитей, сохраняет активность. Предполагают, что сохранившие активность тканевые макрофаги принимают участие в рас-сасывании рубцовой ткани и обеспечивают формирование более мягких руб-цов.
Параллельно с созреванием грануляций происходит эпителизация раны. Она начинается в первые часы после повреждения, и уже в течение первых суток образуются 2-4 слоя клеток базального эпителия. Скорость эпителиза-ции обеспечивается следующими процессами: миграцией, делением и диф-ференцировкой клеток. Эпителизация небольших ран осуществляется, в ос-новном, за счет миграции клеток из базального слоя. Раны более крупные эпителизируются за счет миграции и митотического деления клеток базаль-ного слоя, а также дифференцировки регенерирующего эпидермиса. Новый эпителий образует границу между поврежденным и подлежащим слоем, он препятствует обезвоживанию тканей раны, уменьшению в ней электролитов и белков, а также предупреждает инвазию микроорганизмов.
В процессе пролиферации участвуют и органспецифические клеточные элементы органов и тканей. С точки зрения возможностей пролиферации ор-ганспецифических клеточных элементов все органы и ткани могут быть рас-классифицированы на три группы:
К первой группе могут быть отнесены органы и ткани, клеточные элемен-ты которых обладают активной или практически неограниченной пролифе-рацией, достаточной для полного восполнения дефекта структуры в зоне воспаления (эпителий кожи, слизистых оболочек дыхательных путей, слизи-стой желудочно-кишечного тракта, мочеполовой системы; гемопоэтическая ткань и др.).
Ко второй группе относятся ткани с ограниченными регенерационными способностями (сухожилия, хрящи, связки, костная ткань, периферические нервные волокна).
К третьей группе относятся те органы и ткани, где органоспецифические клеточные элементы не способны к пролиферации (сердечная мышца, клетки ЦНС). Основными факторами, регулирующими процессы пролиферации и дифференцировки клеток в очаге воспаления, являются:
1. Факторы роста, продуцируемые макрофагами, лимфоцитами, тромбо-цитами, фибробластами и другими клетками, стимулированными в зоне вос-паления. К ним относятся:
- факторы роста эпидермиса (стимулятор пролиферации и созрева-ния эпителия, стимулятор ангиогенеза);
- трансформирующий фактор роста- (стимулятор ангиогенеза);
- трансформирующий фактор роста- (хемоаттрактант фибробла-стов, стимулятор синтеза коллагена, фибронектина, ангиогенеза, ингибитор протеолиза);
- тромбоцитарный фактор роста (стимулятор миграции, пролифе-рации и синтеза белка в клетках-мишенях, обладает провоспалительным эф-фектом);
- фактор роста эндотелиоцитов;
- фактор роста фибробластов кислый и основной (стимуляторы пролиферации всех клеток сосудистой стенки);
- колониестимулирующие факторы (гранулоцитарный и макрофа-гальный стимуляторы дифференцировки, пролиферации и функциональной активности клеток гранулоцитарного и моноцитарного ряда) - цитокины (ФНО, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7) , продуцируемые Т- и В-лимфоцитами, мононуклеарами, тучными клетками, фибробластами, эндоте-лиоцитами, обеспечивают хемотаксис, фиброгенез, ингибируют апоптоз, стимулируют процессы пролиферации в очаге воспаления. Ингибиторами роста для некоторых клеток служат те же цитокины, которые стимулируют пролиферацию других – это ФНО, трансформирующий фактор роста и - интерферон (Зайчик А.Ш., Чурилов Л.П., 1999);
- фактор роста нервов (стимулятор пролиферации, роста, морфоге-неза симпатических нейронов, эпителиальных клеток). Ростовые факторы, взаимодействуя с рецепторами на клетках- мишенях, могут непосредственно стимулировать синтез ДНК в клетках или подготавливать внутриклеточные рецепторы и ферменты к митотической деятельности.
2. Пептид гена, родственного кальцитонину, стимулирует пролифе-рацию эндотелиальных клеток, а субстанция Р индуцирует выработку ФНО в мак-рофагах.
3. Простагландины группы Е потенцируют регенерацию путем усиления кровоснабжения.
4. Кейлоны и антикейлоны, продуцируемые различными клетками, дейст-вуя по принципу обратной связи, могут активировать и угнетать митотиче-ские процессы в очаге воспаления (Бала Ю.М., Лифшиц В.М., Сидельникова В.И., 1988).
5. Полиамины (путресцин, спермидин, спермин), обнаруживаемые во всех клетках млекопитающих, жизненно необходимы для роста и деления клеток.
Они обеспечивают стабилизацию плазматических мембран и суперспи-ральной структуры ДНК, защиту ДНК от действия нуклеаз, стимуляцию транскрипции, метилирование РНК и связывание ее с рибосомами, актива-цию ДНК-лигаз, эндонуклеаз, протеинкиназ и многие другие клеточные про-цессы. Усиленный синтез полиаминов, способствующих пролиферативным процессам, отмечается в очаге альтерации (Березов Т.Т., Федорончук Т.В., 1997).
6. Циклические нуклеотиды: цАМФ ингибирует, а цГМФ активирует про-цессы пролиферации.
Морфологически процесс заживления раны может протекать различно, в зависимости от анатомического субстрата поражения, степени инфицирован-ности, общего состояния организма, характера лечебных мероприятий (Ку-зин М.И., Костюченок Б.М. и соавт., 1990). Однако в любом случае течение раневого процесса отражает один из классических типов заживления:
1. Заживление первичным натяжением.
2. Заживление вторичным натяжением.
3. Заживление под струпом.
Заживление раны первичным натяжением. Такой тип заживления харак-теризуется сращением краев раны без видимой промежуточной ткани, путем соединительнотканной организации раневого канала. Заживление первичным натяжением является наиболее экономичным видом заживления. Для зажив-ления первичным натяжением необходимы следующие условия:
1. Небольшая зона повреждения.
2. Плотное соприкосновение краев раны.
3. Сохранение жизнеспособности краев раны.
4. Отсутствие очагов некроза и гематомы.
5. Асептичность раны.
Заживление раны вторичным натяжением происходит при обширных по-вреждениях тканей, при наличии в ране нежизнеспособных тканей, гематомы и при развитии инфекции в ране. Любой из этих факторов ведет к заживле-нию вторичным натяжением. При различных вариантах течения заживления вторичным натяжением речь идет о заживлении гнойной раны, то есть о за-живлении через нагноение и гранулирование. На 5-6-е сутки после альтера-ции, после отторжения некротизированных клеток в ране появляются ост-ровки грануляций, которые, постепенно разрастаясь, заполняют всю полость раны. Изменения характера грануляций всегда объективно отражают ослож-нения заживления, которые могут наступить под влиянием местных и общих факторов. Реорганизация рубца проявляется активной эпителиизацией раны. Эпителий нарастает на поверхность грануляций в виде голубовато-белой каймы очень медленно. Помимо эпителизации заживлению способствует фе-номен раневой контракции - равномерного концентрического сокращения краев и стенок раны. Этот феномен объясняется появлением в грануляцион-ной ткани в период регенерации фибробластов, обладающих способностью к сокращению.
Заживление раны под струпом характерно для незначительных повреж-дений (ссадины, царапины, небольшие по площади ожоги 1-й и 2-й степени). Раневой процесс начинается свертыванием излившейся крови или только лимфы, которая подсыхает с образованием струпа. Под ним происходит бы-страя регенерация эпидермиса, и струп затем отторгается. Весь процесс длится 3-7 дней. Если заживление под струпом происходит без осложнений, то рана заживает первичным натяжением; если под струпом начинается на-гноение, то заживление идет по типу вторичного натяжения. В ряде случаев может развиться вялотекущее флегмонозное поражение жировой клетчатки, окружающей рану. В такой ситуации необходимы хирургическая обработка раны и удаление струпа (Кузин М.И., Костюченок Б.М. и соавт., 1990).
Пролиферативная активность клеток отражает интенсивность роста опухолей. В статье приведены данные изучения уровня пролиферации клеток базалиомы — наиболее частой злокачественной опухоли кожи. Исследование проводили иммуногистохимическим методом с маркером пролиферации Ki67. По характеру пролиферации базалиома представляла гетерогенную группу. Солидный, аденоидный, поверхностный мультицентрический тип базалиомы отличались низкой пролиферативной активностью с преимущественным распределением клеток, экспрессирующих Ki67, по периферии комплексов. Высокую пролиферативную активность выявляли в инфильтративном, склерозирующем и микронодулярном типе при равномерном распределении пролиферирующих клеток.
Пролиферативная активность клеток отражает интенсивность роста опухолей. В статье приведены данные изучения уровня пролиферации клеток базалиомы — наиболее частой злокачественной опухоли кожи. Исследование проводили иммуногистохимическим методом с маркером пролиферации Ki67. По характеру пролиферации базалиома представляла гетерогенную группу. Солидный, аденоидный, поверхностный мультицентрический тип базалиомы отличались низкой пролиферативной активностью с преимущественным распределением клеток, экспрессирующих Ki67, по периферии комплексов. Высокую пролиферативную активность выявляли в инфильтративном, склерозирующем и микронодулярном типе при равномерном распределении пролиферирующих клеток.
В структуре злокачественных эпителиальных опухолей кожи первое место занимает базалиома, на долю которой приходится от 75 до 94% [1, 2]. В подавляющем большинстве случаев регистрируются солитарные опухоли, локализующиеся на открытых участках кожи, подверженных инсоляции. Опухоль отличается медленным течением и относительно благоприятным прогнозом. Однако в ряде случав она может значительно увеличиваться в размере, характеризуясь выраженным экзофитным ростом, либо приобретать инвазивные черты, проникая в окружающие и подлежащие ткани, приводя к их разрушению. Подобный рост опухоли обычно ассоциируется с определенными морфологическими типами, которые рассматривают как агрессивные [3].
Показателем интенсивности роста ткани является пролиферативная активность клеток. Она относительно спокойна в доброкачественных процессах и резко возрастает в злокачественных опухолях. Аналогичные тенденции присущи и эпителиальным опухолям кожи. Так, пролиферативная активность клеток базальноклеточного рака кожи выше, чем в очагах лейкоплакии [4], а при раке in situ индекс пролиферации превосходит таковой при предраковом актиническом кератозе [4,5]. Плоскоклеточный рак кожи отличается высоким уровнем пролиферации, который следует за снижением степени его дифференцировки [6, 7, 8].
Предыдущие исследования показали, что по характеру пролиферативной активности клеток базалиома представляет гетерогенную группу. Наиболее интенсивный рост имела язвенная форма, тогда как нодулярная и поверхностная характеризовались умеренными и низкими показателями [9]. Высокий уровень пролиферации отмечали в микронодулярном, метатипическом типе базалиомы и типе морфеа [10, 12]. Также отмечали повышение индекса Ki67 в инфильтративном и метатипическом типе по сравнению с нодулярным и поверхностным [11, 13]. В то же время единого мнения о связи уровня пролиферации с гистологическим типом базалиомы до сих пор нет, так как другие исследования свидетельствовали, что индекс Ki67 в нодулярном и поверхностном мультицентрическом типе базальноклеточного рака значительно превосходил аналогичный показатель в склерозированном и типе морфеа [14, 15]. Учитывая противоречивые данные, представляется интересным и актуальным продолжить изучение пролиферативной активности клеток в различных морфологических типах базалиомы, что позволит более детально понимать маркеры и предикторы агрессивного течения опухоли.
Материалы и методы
В работе исследования использовали 36 биоптатов кожи больных базальноклеточным раком кожи. Биопсию кожи размером 0,5 х 0,5 см проводили под местной анестезией 2% раствором новокаина, биоптаты фиксировали в 10% растворе формалина, забуфференом по Лилли при рН-7,4. Материал заливали в парафин по обычной методике. Серийные срезы толщиной 3–5 мкм депарафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином. Иммуногистохимическое исследование проводили в соответствии со стандартным протоколом. Парафиновые срезы наносили на стекла с адгезивным покрытием, депарафинировали по стандартному протоколу. Срезы, погруженные в цитратный буфер, инкубировали в микроволновой печи при мощности 690 Вт два раза по пять минут. Двадцать минут при комнатной температуре, срезы охлаждали, подсушивали и наносили первичные антитела. Для определения уровня пролиферации использовали моноклональные антитела к протеину Ki67 (DAKO), разведение 1:200. Использовались соответствующие позитивные и негативные контроли – иммунные и неиммунные сыворотки. Срезы промывали в буфере, подсушивали, затем на них наносили EnVision (anti-mouse и anti-rabbit, фирмы DAKO, Дания) на 30–40 минут. Для визуализации реакции наносили DAB+ (3, 3 ґ– диаминобензидин), что позволяло получать специфическую коричневую окраску. Затем срезы докрашивали гематоксилином Майера. Определение уровня пролиферации оценивалась с помощью индекса, который вычислялся как среднее от числа меченных ядер на 100 учтенных ядер (при учете 500–1000 опухолевых клеток). Подсчет меченных ядер проводился в репрезентативных полях зрения с относительно равномерным распределением опухолевых клеток, сверху вниз и слева направо. Клетки на периферии срезов, где чаще всего наблюдается фоновое окрашивание, не учитывались.
Для статистической обработки данных использовались методы t-Стьюдента с поправкой для множественных сравнений; хи-квадрат. Расчеты проводились при помощи программы BIOSTAT. Полученные различия считались достоверными при значениях p ? 0,05.
Среди 36 базалиом пять имели поверхностный мультицентрический тип строения, четыре – поверхностный мультицентрический в сочетании с солидным, семь – солидный, два – аденоидный, два – солидно-аденоидный, пять – инфильтративный, три – микронодулярный. В восьми случаях отмечали различные варианты сочетания солидного, инфильтративного, микронодулярного, склерозирующего строения.
Индекс пролиферации Ki67 в поверхностном мультицентрическом типе и при сочетании его с солидным компонентом варьировал от 14,9 до 31,1%. Средний индекс составлял 22,2%. Пролиферирующие клетки в шести случаях располагались преимущественно по периферии клеточных комплексов, в трех – равномерно по клеточным комплексам. При солидных опухолях средний индекс составил 26,5%, он варьировал от 14,5 до 38,2% (рис.1). Периферическое распределение наблюдали в четырех случаях, равномерное – в трех. При аденоидном строении пролиферирующие клетки распределялись равномерно, индекс пролиферации составлял 22,6 и 31,3%. В случаях, когда имелось сочетание солидного и аденоидного компонентов, индекс пролиферации составлял 36,8 и 19,2%, В первом случае клетки распределялись равномерно, во втором – равномерно в аденоидном компоненте и по периферии – в солидном. В опухолях инфильтративного, микронодулярного строения и при их сочетании клетки, экспрессирующие маркер Ki67, диффузно регистрировались по всем клеточным комплексам. В инфильтративном типе минимальное и максимальное значение индекса было 27,6 и 47,8% (среднее значение – 35,4%) (рис.2). Микронодулярные базалиомы имели средний индекс Ki67 26,9%. В случаях инфильтративно-склерозирующего строения индекс имел значение 40,2 и 31,6%, пролиферирующие клетки равномерно распределялись в комплексах (рис.3). При сочетании инфильтративного, солидного и микронодулярного строения преимущественно отмечали равномерное распределение пролиферирующих клеток, и средний индекс составлял 36,5% (значения варьировали от 22,1 до 50,4%). Солидное строение в сочетании с инфильтративным склерозирующим имели опухли с индексом Ki67 26,7 и 35,3%, в солидном компоненте пролиферирующие клетки располагались преимущественно по периферии комплексов, инфильтративном склерозирующем – равномерно.
При анализе пролиферативной активности клеток мы сгруппировали опухоли в зависимости от характера течения и роста. В группу неинвазивного роста мы включили опухоли, имеющие поверхностный мультицентрический, солидный, аденоидный, сочетание поверхностного мультицентрического и солидного компонентов. В группу с инвазивным ростом нами были включены опухоли инфильтративные, микронодулярные, инфильтративно склерозирующие, а также опухоли сложного строения (инфильтративный + микронодулярный + солидный и солидый + инфильтративный склерозирующий).
Средний индекс пролиферации неагрессивных типов составил 24,77 ± 7, 47 с доверительным интервалом 95% 21,27–28,26 (табл. 1). Средний индекс Ki67 агрессивных типов составлял 33,53 ± 8,94 с доверительным интервалом 95% 28,77–38,29 (табл. 1). Различия в уровне пролиферации между агрессивными и неагрессивными типами носили статистически значимый характер (р = 0,003). Анализ характера распределения пролиферирующих клеток в опухолевых комплексах показал, что в неагрессивных типах периферическое распределение клеток наблюдалось в 50% случаев, равномерное – в 45%, в 5% случаев ряд комплексов в опухоли имели один тип распределения, другие комплексы – иной тип распределения (табл.2). В агрессивных типах 81,25% случаев имели равномерное распределение пролиферирующих клеток, сочетание двух типов распределения – 18,75% (табл. 2). Периферическое распределение пролиферирующих клеток в агрессивных типах не встречалось. При сравнении распределения клеток между агрессивными и неагрессивными типами опухоли было показано, что различия носят статистически достоверный характер (р = 0,003).
Таблица 1. Индекс пролиферации Ki67 в агрессивных и неагрессивных морфологических типах базалиомы
Дерматоскопия: Ангулярные линии по всему образованию, толстая атипичная сеть.
Микроскопическое описание : Лоскут кожи с эпидермисом неравномерной толщины и структурами по типу себорейного кератоза. В эпидермисе асимметричное меланоцитарное новообразование, преимущественно гнездного строения. Гнезда разной величины, в том числе крупные, занимающие почти всю толщу эпидермиса; расположены на разном расстоянии друг от друга. Клетки с мелкими, гиперхромными ядрами и обильной, заполненной пылевидным пигментом, цитоплазмой. Гнезда местами сливаются между собой. В сосочковом слое дермы определяются единичные мелкие гнезда из клеток аналогичного вида; фиброз; солнечный эластоз; скопления меланофагов. Периваскулярные воспалительные инфильтраты. Края резекции без опухолевого роста.
Заключение : Невоидная меланома кожи в фазе горизонтального роста. Уровень инвазии по Кларку II, толщина по Бреслоу 0,3 мм.
Ранняя стадия развития злокачественной меланомы кожи: ![Ранняя стадия развития злокачественной меланомы кожи, врач: Гришко Роман Васильевич]()
Женщина, 42 года. Образование 1,5*1,3 мм. Появилось 3 месяца назад.
Дерматоскопия: Атипичные гранулы и псевдоподы.
Микроскопическое описание : Мелкий фрагмент кожи с эпидермисом неравномерной толщины и гиперпигментацией базального слоя. Нечетко отграниченная, асимметричная пролиферация атипичных меланоцитов в базальном слое с фокальным выраженным педжетоидным ростом. В пределах среза одно гнездо в эпидермисе. В дерме периваскулярные воспалительные инфильтраты с примесью меланофагов .
Заключение : Выявленные морфологические изменения наиболее соответствуют очень ранней стадии развития злокачественной меланомы кожи. Морфологический тип на этой стадии не классифицируемый. Уровень инвазии по Кларку I (in situ) .
Невоидная злокачественная меланома кожи в фазе горизонтального роста:
![Невоидная злокачественная меланома кожи в фазе горизонтального роста, врач: Гришко Роман Васильевич]()
Женщина, 30 лет. Образование 6*4 мм. Выявлено при осмотре.
Дерматоскопия: Асимметричная гиперпигментация по нижнему краю, негативная сеть, кристаллические структуры (стрелки).
Микроскопическое описание : В готовых препаратах лоскут кожи. В эпидермисе определяются неравномерно распределенные по всей его толще сливающиеся гнезда с ретракционным артефактом, из меланоцитов с мелкими гиперхромными ядрами и значительным содержанием пигмента в цитоплазме. Фокальный педжетоидный рост. В сосочковом слое дермы полосовидный лифо-гистиоцитарный инфильтрат с неравномерными скоплениями меланофагов. Среди клеток инфильтрата определяются единичные гнезда и группы атипичных меланоцитов с гиперхромными ядрами и пигментированной цитоплазмой. Очаговая эозинофильная ламеллярная фиброплазия. Края резекции не маркированы.
Заключение : Невоидная злокачественная меланома кожи в фазе горизонтального роста. Уровень инвазии по Кларку II, толщина по Бреслоу 0,4 мм.
Лентигинозная меланома кожи в фазе горизонтального роста: ![Лентигинозная меланома кожи в фазе горизонтального роста, врач: Гришко Роман Васильевич]()
Мужчина, 54 года. Образование 10*7 мм. Выявлено при осмотре.
Дерматоскопия: Атипичная очагово расположенная пигментная сеть, участок негативной сети в центре.
Микроскопическое описание : Лоскут кожи с подкожной клетчаткой. В эпидермисе неравномерная лентигинозная пролиферация эпителия с выраженной гиперпигментацией базального слоя. Отдельные удлиненные выросты сливаются между собой. Внутриэпидермальное меланоцитарное новообразование из мелких асимметричных гнезд и сплошного лентигинозного роста отдельных меланоцитов эпителиоидного фенотипа, практически на большем протяжении замещающих кератиноциты базального слоя. Очаговый педжетоидный рост. Единичные группы клеток в сосочках дермы наиболее вероятно представляют тангенциальный срез гиперплазированных выростов эпидермиса. В дерме очаговые периваскулярные воспалительные инфильтраты с примесью меланофагов. Края резекции без опухолевого роста.
Заключение : Лентигинозная меланома кожи в фазе горизонтального роста. Уровень инвазии по Кларку I (in situ).
Поверхностно распространяющаяся меланома кожи без изъязвления: ![Поверхностно распространяющаяся меланома кожи без изъязвления, врач: Гришко Роман Васильевич]()
Мужчина, 80 лет. Образование 7*8 мм. Выявлено при осмотре.
Дерматоскопия: Хаотичные очаги гиперпигментации, в т.ч. по краю образования, атипичные хаотичные точки, кристаллические структуры в центре.
Микроскопическое описание : Опухоль разрастается как в эпидермисе, так и в сосочковом слое дермы, состоит преимущественно из мономорфных эпителиоидных крупных клеток, формирующих хаотично переплетающиеся тяжи и мелкие солидные структуры. В цитоплазме большей части клеток содержится меланин. В подлежащих участках дермы видна очаговая сливная умеренно выраженная лимфогистиоцитарная инфильтрация с примесью плазматических клеток. В маркированных "краях резекции" роста опухолевой ткани не отмечено.
Заключение : Поверхностно распространяющаяся меланома кожи без изъязвления, pT1а; уровень инвазии по Кларку 2, толщина опухоли по Бреслоу 0, 25 мм.
Поверхностно-распространяющаяся меланома кожи в фазе горизонтального роста без изъязвления: ![Поверхностно-распространяющаяся меланома кожи в фазе горизонтального роста без изъязвления, с признаками регресса, врач: Гришко Роман Васильевич]()
Женщина, 51 год. Образование 9*8 мм. Увеличивалось последние 2 года.
Дерматоскопия: Очаг атипичной утолщенной пигментной сети по левому краю, линии на периферии, атипичные гранулы.
Микроскопическое описание : Лоскут кожи с подкожной клетчаткой. Эпидермис неравномерной толщины с участками атрофии. В эпидермисе асимметричное, нечетко отграниченное меланоцитарное образование из атипичных клеток с обильной цитоплазмой, заполненной пылевидным пигментом, и полиморфными ядрами с крупными эозинофильными ядрышками ("пульвероциты"). Клетки опухоли формируют разновеликие гнезда, расположенные неравномерно. Фокусы педжетоидного роста, некроз отдельных меланоцитов, единичные митозы в пульвероцитах. В фокусах атрофии эпидермиса опухолевые клетки отсутствуют. В сосочках дермы фиброплазия, диффузный воспалительный инфильтрат с очаговой примесью меланофагов. Удалено в пределах здоровых тканей.
Заключение : Поверхностно-распространяющаяся меланома кожи в фазе горизонтального роста без изъязвления, с признаками регресса. Уровень инвазии по Кларку I (in situ).
Атипичная поверхностная внутриэпидермальная пролиферация меланоцитов: ![Атипичная поверхностная внутриэпидермальная пролиферация меланоцитов, врач: Гришко Роман Васильевич]()
Женщина, 50 лет. Образование 3*2 мм. Выявлено при осмотре.
Дерматоскопия: Асимметричная пигментация фолликулов, кольцевидно-зернистые структуры.
Микроскопическое описание : Мелкий фрагмент кожи с термическими повреждениями по краям. Гиперкератоз, расширенные устья волосяных фолликулов, в каждом из которых - структуры Demodex folliculorum. Эпидермальные выросты сглажены. Гиперпигментаиця базального слоя с выраженной, местами - сплошной, лентигинозной пролиферацией атипичных меланоцитов, особо выраженной в эпителии волосяных фолликулов. Единичные редкие гнезда из атипичных меланоцитов с пигментированной цитоплазмой. Слабо выраженный фокальный педжетоидный рост. В сосочковом слое дермы и перифолликулярно - фиброз; признаков актинического эластоза нет. Очаговые воспалительные инфильтраты с примесью меланофагов. Зона пролиферации меланоцитов сохраняется вплоть до участков термического повреждения, что не позволяет достоверно оценить края резекции.
Заключение : Атипичная поверхностная внутриэпидермальная пролиферация меланоцитов, наиболее соответствующая ранней фазе горизонтального роста лентигинозной меланомы (in situ).
Пигментная меланома кожи, поверхностно распространяющегося типа:
![Пигментная меланома кожи, врач: Гришко Роман Васильевич]()
Мужчина, 63 года. Образование 5*4 мм, выявлено при осмотре.
Дерматоскопия: Асимметричные очаги гиперпигментации, резко атипичные гранулы, расположены очагово по краю образования.
Микроскопическое описание : Лоскут кожи с участком утолщения эпидермиса, акантоза. В базальном слое эпидермиса, акантотических тяжах, сосочковом слое дермы тяжи и гнезда эпителиоидных меланоцитов с умеренно выраженным полиморфизмом, отдельными крупными ядрышками и патологическими митозами (1х1 мм кв.). Опухолевые клетки инвазируют эпидермис, проникают в роговой слой. Эпидермис над опухолью не изъязвлен. Меланин в большом количестве расположен внутри- и внеклеточно. В окружающей дерме умеренно выраженная лимфогистиоцитарная инфильтрация. По краю иссечения опухолевые клетки не обнаружены.
Заключение : Пигментная меланома кожи, поверхностно распространяющегося типа, 2 уровень инвазии по Кларку. Толщина опухоли по Бреслоу - 0, 7 мм.
Меланома кожи в фазе горизонтального роста: ![Меланома кожи в фазе горизонтального роста, врач: Гришко Роман Васильевич]()
Мужчина, 52 года. Образование 6*2 мм, выявлено при осмотре.
Дерматоскопия: Очаг гиперпигментации на правом полюсе, атипичная сеть, местами образующая линии.
Микроскопическое описание : Лоскут кожи с эпидермисом неравномерной толщины. В центре лоскута небольшое по протяженности асимметричное, нечетко отграниченное меланоцитарное новообразование, представленное чередующимися фокусами лентигинозной пролиферации атипичных меланоцитов и мелких гнезд из клеток аналогичного фенотипа. Единичные клетки в состоянии педжетоидного роста. В дерме очаговые воспалительные инфильтраты с неравномерными скоплениями меланофагов. Края резекции без опухолевого роста, однако расстояние до ближайшего латерального края резекции в пределах 2 мм.
Заключение : Меланома кожи в фазе горизонтального роста. Уровень инвазии по Кларку I (n situ). Виду очень ранней фазы роста тип горизонтальной фазы не классифицируемый, наиболее вероятно - поверхностно-распространяющийся.
Лентигинозная меланома кожи в фазе горизонтального роста: ![Невоидная меланома кожи в фазе горизонтального роста:, врач: Гришко Роман Васильевич]()
Мужчина, 74 года. Образование 9*13 мм, увеличивалось за последние годы.
Дерматоскопия: Атипичная пигментная сеть по всему образованию, слева: гомогенная розовая область, очаг негативной сети, кристаллические линии.
Микроскопическое описание : Лоскут кожи с подкожной клетчаткой. очаговый гиперкератоз с трансэпидермальной элиминацией пигмента. На фоне общей атрофии эпидермиса неравномерная лентигинозная гиперплазия эпидермальных выростов, чередующаяся с участками атрофии; гиперпигментация кератиноцитов мальпигиева слоя. Асимметричная, нечетко отграниченная по краям лентигинозная и гнездная пролиферация атипичных меланоцитов, местами сплошная, с замещением эпителиальных клеток базального слоя; с поражением эпителия придатков кожи. Фокальный педжетоидный рост. В дерме участки ламеллярной фиброплазии, очаговые воспалительные инфильтраты с примесью меланофагов. Удалено в пределах здоровых тканей. До ближайшего бокового края резекции в срезах 2,5 мм.
Заключение : Лентигинозная меланома кожи в фазе горизонтального роста. Уровень инвазии по Кларку I (in situ).
Поверхностная атипичная пролиферация меланоцитов (SAMPUS): ![Поверхностная атипичная пролиферация меланоцитов (SAMPUS) на фоне малого врожденного меланоцитарного невуса с признаками регресса, врач: Гришко Роман Васильевич]()
Женщина, 44 года. Образование 8*5 мм, увеличилось за последние годы.
Дерматоскопия: Атипичная пигментная сеть по всему образованию, местами образующая радиальные линии, атипичные точки в центре.
Микроскопическое описание : Лоскут кожи с подкожной клетчаткой. Очаговый гиперкератоз, пигмент в роговом слое, роговые пробки в устьях волосяных фолликулов. В дерме структуры мелкого внутридермального невуса с признаками врожденного (поверхностный тип); с участками фиброза и признаками "старения" клеток. Эксцентрично расположен фокус неравномерной гиперплазии эпидермиса протяженностью около 2,5 мм, с гиперпигментацией базального слоя, гнездной и частично лентигигозной пролиферацией меланоцитов с фокальной выраженной цитологической атипией. Гнезда мелкие, различной формы, сливающиеся между собой, распространяющиеся по эпителию выводных протоков потовых желез. В сосочковом слое дермы очаговые воспалительные инфильтраты с неравномерными скоплениями меланофагов; фиброплазия. Удалено в пределах здоровых тканей.
Заключение : Поверхностная атипичная пролиферация меланоцитов (SAMPUS) на фоне малого врожденного меланоцитарного невуса с признаками регресса.
Атипичный лентигинозный пограничный невус Kossard: ![Лентигинозная меланома кожи, врач: Гришко Роман Васильевич]()
Женщина, 61 год. Образование 8*6 мм, выявлено при осмотре.
Дерматоскопия: Атипичные очаги гиперпигментации, в т.ч. по периферии, серо-коричневые участки в центре.
Микроскопическое описание : Лоскут кожи с подкожной клетчаткой. На фоне общей атрофии эпидермиса выявляется протяженный участок неравномерной гиперплазии эпидермальных выростов, сливающихся между собой. Гиперпигментация базального слоя. Сплошная лентигинозная пролиферация меланоцитов с гиперхромными ядрами небольших размеров, в том числе в надсосочковых зонах и в эпителии волосяных фолликулов. Неравномерное формирование гнезд, преимущественно из меланоцитов вытянутой формы, расположенных параллельно поверхности кожи. Слабо выраженный педжетоидный рост. В сосочковом слое дермы фиброплазия (концентрическая и ламеллярная), скопления меланофагов; начальные признаки актинического эластоза. Удалено в пределах здоровых тканей; до ближайшего края резекции 2,5 мм.
Заключение : Выявленные морфологические изменения наиболее соответствуют лентигинозной меланоме кожи (син. - атипичный лентигинозный пограничный невус Kossard) в фазе горизонтального роста. Уровень инвазии по Кларку I (in situ).
Поверхностное, атипичное меланоцитарное новообразование: ![Поверхностное, атипичное меланоцитарное новообразование кожи, врач: Гришко Роман Васильевич]()
Женщина, 77 лет. Образование 8*6 мм, выявлено при осмотре.
Дерматоскопия: Хаотично расположенные очаги гиперпигментации, асимметрично пигментированные фолликулы.
Микроскопическое описание : Лоскут кожи с небольшим прилежащим фрагментом подкожной клетчатки. Гиперкератоз, эпидермальные выросты на большем протяжении сглажены. В центре лоскута эпидермис неравномерно утолщен, с гиперпигментацией кератиноцитов мальпигиева слоя. В этой зоне асимметричная, лентигинозная, местами сплошная, пролиферация атипичных меланоцитов, с формированием небольшого числа гнезд, сливающихся между собой. В дерме слабо выраженный солнечный эластоз, очаговые воспалительные инфильтраты с примесью меланофагов. До ближайшего бокового края резекции 2,5 мм.
Заключение : Поверхностное, атипичное меланоцитарное новообразование кожи, наиболее соответствующее ранней горизонтальной фазе роста злокачественной меланомы кожи (уровень инвазии по Кларку I).
Остались вопросы?
Вы можете записаться на первичный прием и получить бесплатную консультацию врача-дерматоонколога по телефону:
Иссечение образований с наложением швов:
Вы можете записаться на первичный прием и получить бесплатную консультацию врача-дерматоонколога по телефону:
Читайте также:













