Применение иммуномодуляторов при атопическом дерматите
Обновлено: 24.04.2024
Статья посвящена эффективности применения анаферона при атопических заболеваниях. На основании клинического, аллергологического и иммунологического обследования пациентов с различными формами атопических заболеваний показано, что препарат способствует нормализации клеточного и гуморального иммунитета, усилению цитотоксической активности NK- клеток, активации макрофагов, восстанавливает баланс Th1/Th2, и повышает резистентность организма к инфекциям. Учитывая эффективность применения анаферона и анаферона детского, безопасность их использования у пациентов из групп риска, а также возможность применения длительными курсами, можно рекомендовать эти препараты для включения в схемы терапии пациентов с аллергическими заболеваниями.
Согласно официальной статистике, аллергическими заболеваниями в нашей стране страдают от 10 до 15% населения, достигая в экологически неблагоприятных районах 60% (1). Однако эти данные не соответствуют истинным величинам заболеваемости и распространенности аллергических заболеваний среди населения России, т.к. эпидемиологическому учету подлежат, в основном, среднетяжелые и тяжелые формы заболеваний. Среди нозологических форм аллергических заболеваний преобладающими являются аллергодерматозы, поллинозы и бронхиальная астма (таблица 1) (2).
Нозологические формы, преобладающие в структуре аллергических заболеваний
| Заболевание | Распространённость в структуре аллергических заболеваний |
| Бронхиальная астма | 23 — 60 % |
| Поллиноз: аллергический ринит, аллергический конъюнктивит | 10-70% |
| Аллергодерматозы (атопический дерматит, острая крапивница и др.) | 7 — 73 % |
| Лекарственная и пищевая аллергия | 10-30% |
| Инсектная аллергия | 0,5 — 3,5 % |
| Анафилактический шок | 1,5% |
| Прочие аллергические заболевания | 3,5 — 5,2 % |
Контроль течения атопической патологии является одним из направлений современного здравоохранения. Методики ведения данной категории пациентов постоянно совершенствуются. Благодаря внедрению и разработке новых лекарственных средств, стало возможно контролировать эти заболевания, предотвращая развитие тяжелых форм и инвалидизации пациентов. Вместе с тем у этой группы пациентов отмечается высокая заболеваемость острыми респираторными инфекциями вирусной этиологии. Это в свою очередь поддерживает воспалительный процесс и нередко способствует обострению атопической патологии и утяжелению состояния пациента.
Частые ОРВИ у пациентов с аллергическими заболеваниями обусловлены нарушениями в работе иммунной системы. В настоящее время доказано, что аллергия — иммунозависимое состояние, в патогенезе которого особое значение имеют нарушения как клеточного, так и гуморального звена иммунной системы, а также изменение местного иммунитета. Установлено, что у пациентов с атопической патологией отмечается так называемый «фетальный» тип иммунного ответа, характеризующийся преобладаем активности субпопуляции T-хелперов 2-го типа (Th-2) и повышенным синтезом провоспалительных цитокинов. В результате недостаточности T-хелперов 1-го типа (Th-1) происходит снижение синтеза интерферона-γ (ИФН-γ), а следовательно и его ингибирующего влияния на синтез иммуноглобулина Е (IgE), что обуславливает обострение аллергического воспаления.
Следует отметить, что довольно часто некорректное лечение кортикостероидами, антибиотиками широкого спектра действия, антигистаминными препаратами и особенно их комбинацией не исправляет, а усугубляет иммунную недостаточность (3).
На практике возникает порочный круг, когда существование аллергической патологии предрасполагает к частым вирусным инфекциям, а они, в свою очередь, вызывают усугубление атопической патологии и препятствуют подбору базисной терапии.
Поэтому поиск эффективных программ профилактики ОРВИ важен для предупреждения не только инфекционной патологии, но и прогрессирования самого атопического заболевания.
На сегодняшний день наиболее перспективными препаратами, которые используются для профилактики ОРВИ у пациентов с аллергическими заболеваниями, являются иммуномодуляторы. Эта группа препаратов, которые регулируют деятельность иммунной системы и вместе с тем способствую выработке эндогенного ИФН-γ, недостаточность которого выявляется у пациентов с аллергопатологией.
Одними из применяемых для этой цели препаратов являются «Анаферон» (регистрационный номер 003362/01) и «Анаферон детский» (регистрационный номер 000372/01), разработанные учеными НПФ «Материа Медика Холдинг» совместно с сотрудниками НИИ фармакологии СО РАМН.
Анаферон, согласно инструкции по медицинскому применению, является иммуномодулирующим и противовирусным средством (код ATX: L03AX).
Действующим веществом препарата являются сверхмалые дозы антител к гамма-интерферону (ИФН-γ) человека. Анаферон производится по технологии, которая позволяет использовать действующее вещество в сверхмалых дозах, при условии сохранения высокой биологической активности препарата. Создание анаферона базируется на модифицирующем феномене сверхмалых доз антител, открытом в конце прошлого века профессором Эпштейном О.И. (4).
Анаферон проявляет свои эффекты, прежде всего, через влияние на систему эндогенных интерферонов и на экспрессию функционально сопряженных с интерферонами цитокинов — ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10. Так же, как и другие препараты, реализующие свои эффекты через интерфероны, анаферон способствует выработке эндогенных интерферонов -альфа и -гамма (ИФН-α и ИФН-γ), при этом в большей степени он оказывает влияние на ИФН-γ. В отличие от других (классических) индукторов интерферона, пропорционально повышающих все показатели интерферонового статуса (уровень сывороточного ИФН, спонтанная продукция, стимулированная/индуцированная продукция), анаферон, принимаемый для профилактики, оказывает более выраженное влияние на индуцированную продукцию интерферонов, в то время, как применение препарата для лечения обеспечивает влияние на все показатели ИФН-статуса. Как показали доклинические испытания, анаферон активизирует функции Т-эффекторов и Т-хелперов, повышает функциональный резерв клеток, участвующих в иммунном ответе, увеличивает продукцию защитных антител (включая секреторный IgA) и восстанавливает функциональную активность фагоцитов и NК клеток. Являясь индуктором смешанного Th1 и Th2 — типа иммунного ответа, анаферон нормализует (модулирует) баланс Th1/Th2 активностей. Результатом комплексного влияния анаферона на систему противоинфекционной защиты является его способность снижать концентрацию вируса в пораженных тканях (4-9).
За последние 6 лет, в более чем 40 научно-исследовательских и лечебно-профилактических учреждений России и за рубежом были проведено большое количество исследований терапевтической эффективности и безопасности анаферона и анаферона детского, проведенных с высоким уровнем доказательности.
Изучение эффективности анаферона у детей, страдающих атопическими заболеваниями, в том числе бронхиальной астмой, атопическим дерматитом и аллергическим ринитом, было проведено на базах Центра здоровья детей и подростков (г. Москва), Сибирского государственного медицинского университета (г.Томск), Новосибирского государственного медицинского университета (г. Новосибирск), Челябинской государственной медицинской академии (г. Челябинск) (10-16).
При исследовании иммунного статуса детей в группе, получавшей анаферон детский, отмечена достоверное снижение количества детей с исходно низкими показателями ИФН-γ с 58,8% до 16,7% и увеличение количества детей с высокими показателями ИФН-γ с 29,4% до 55,6% (р=0,04). Также было отмечено положительное влияние анаферона детского на состояние слизистой эпителия дыхательных путей, что отражает восстановление клеточных структур слизистой оболочки и улучшение их барьерной функции.
Согласно другим исследованиям, на фоне профилактического применения анаферона детского заболеваемость ОРВИ снижалась в 3,3 раза, также было отмечено значительное снижение частоты обострения атопических заболеваний (аллергический ринит — в 2 раза, БА — в 3,8 раза и атопический дерматит — в 3,2 раза) (10). Были получены данные о том, что у детей, получавших анаферон, отмечалось улучшение и со стороны местного иммунитета. Так, в основной группе наблюдалось повышение в 2 раза содержания общего IgA и его фракций в слюне. Что в свою очередь сопровождалось существенным уменьшением (в 2,5-5 раз) доли детей — носителей вирусных патогенов.
Применение анаферона для профилактики ОРВИ у взрослых пациентов, страдающих атопической патологией (бронхиальная астма) показало, что в группе, получавшей анаферон в течение периода наблюдения (90 дней), в 3 раза сократилось число случаев ОРВИ (р< 0,001), также значительно снизился процент повторных эпизодов ОРВИ (р< 0,001) (рис. 1) (17).
Согласно полученным данным, в группе больных, принимавших анаферон, течение ОРВИ было более легким, также отмечено сокращение продолжительности симптомов интоксикации, уменьшение на 3 дня периода гипертермии, снижение интенсивности и длительности катаральных явлений.
Рис. 1. Структура заболеваемости ОРВИ в группах

Было отмечено, что на фоне профилактического приема анаферона увеличивается временной интервал между эпизодами ОРВИ, а также сокращается количество обострений бронхолегочной патологии (табл. 2), что согласуется с данными других авторов (18, 19).
Характеристика течения ОРВИ и обострения основного заболевания (n- число заболевших ОРВИ)
Кроме бронхиальной астмы, внимание аллергологов привлекла возможность применения анаферона при поллинозе. Поллиноз в структуре аллергических заболеваний занимает второе место, а в некоторых регионах регистрируется даже чаще, чем бронхиальная астма. Стандартом лечения данной нозологии считается аллерго-специфическая иммунотерапия (АСИТ), являющаяся по сути своей единственным патогенетически обоснованным методом терапии поллинозов. Однако во многих случаях терапевтическая эффективность АСИТ ограничена, особенно у лиц с синдромом вторичной иммунологической недостаточности (ВИН), вызванной частыми ОРВИ (20). В связи с этим встает вопрос о разработке методов коррекции ВИН путем включения иммунотропных препаратов в схему лечения больных поллинозом. На базе Ростовского государственного медицинского университета в целях повышения эффективности АСИТ было изучено совместное применение мукозальной АСИТ и анаферона.
В течение 2004-2006 г. было проведено клинико-лабораторное, аллергологическое, иммунологическое обследование и лечение пациентов в возрасте от 16 до 29 лет, страдающих поллинозом с сопутствующим синдромом ВИН (21, 22). В ходе контролируемого рандомизированного исследования, 35 больным, дополнительно к стандартной схеме каждого курса АСИТ проводили иммунокоррекцию анафероном. Препарат назначался совместно с каждым курсом АСИТ (было проведено 2 курса) по 1 таблетке в сутки, сублингвально в течение 2-х месяцев. Контрольную группу составили больные (n=30), получавшие только АСИТ по стандартной схеме без применения иммунокоррекции: водно-солевые экстракты аллергенов вводились интраназально. Динамическое наблюдение осуществлялось в течение 2 лет.
При анализе эффективности мукозальной АСИТ, проведенной на фоне анаферона, отмечено уменьшение частоты и продолжительности простудных заболеваний и обострений хронических воспалительных заболеваний, как по сравнению с исходным уровнем, так и с группой контроля, более чем в 2 раза. У всех пациентов опытной группы отмечался более выраженный терапевтический эффект по шкале Duchaine (4,2±0,2 балла — 1-ый курс АСИТ, 4,4±0,1 балла — 2-ой курс АСИТ, а в контрольной группе 3,1±0,2 и 3,2±0,2 соответственно). На фоне анаферона отмечалась более выраженная положительная динамика при провокационном назальном тесте (ПНТ). После проведения АСИТ на фоне анаферона отмечалась более выраженная, по сравнению с контрольной группой, положительная динамика, проявившаяся в снижении длительности сезонных проявлений поллинозов и уменьшении выраженности симптомов аллергии. Только 14,3% пациентов из группы анаферона после 1-го курса АСИТ и 8, 57% — после 2-го курса не отметили выраженного улучшения, тогда как в контрольной группе они составляли 56% и 43% соответственно.
При анализе данных иммунологического обследования у пациентов группы анаферона отмечены более выраженные положительные сдвиги. Статистически значимо увеличивалось содержание зрелых Т-лимфоцитов CD3+, CD4+ лимфоцитов, NK- клеток. На фоне АСИТ с включением анаферона достоверно снижалось количество клеток, экспрессирующих маркер поздней активации — HLA-DR+, а также Th2-лимфоцитов. При проведении АСИТ на фоне анаферона отмечено повышение спонтанной и ФГА-стимулированной пролиферативной активности с увеличением индекса стимуляции ФГА, снижение аллергенстимулированной бласттрансформации, отмечалась нормализация содержания CD20+ лимфоцитов, которая сопровождалась усилением их функциональной активности, увеличением IgA и IgG, снижением содержания ЦИК. Кроме того, в этой группе регистрировалось повышение активности как спонтанного, так и стимулированного НСТ-теста, что свидетельствовало об увеличении адаптационных резервов фагоцитов. Следует также отметить, что в группе анаферона также наблюдалось статистически достоверное снижение уровня общего и аллергенспецифического IgE.
Резюмируя полученные данные клинического, аллергологического и иммунологического обследований пациентов обеих групп, следует отметить, что включение в традиционные схемы мукозальной АСИТ препарата анаферон особенно актуально у пациентов с ВИН и персистирующими вирусными инфекциями, страдающих частыми ОРВИ. Анаферон у таких больных способствует нормализации клеточного и гуморального иммунитета, усилению цитотоксической активности NK- клеток, активации макрофагов, восстанавливает баланс Th1/Th2, и в конечном счете повышает резистентность организма к инфекциям, создавая благоприятные условия для более эффективного проведения АСИТ.
В заключении хочется отметить, что ведение пациентов с атопической патологией это длительная многоуровневая программа, которая должна включать не только базисные препараты, но и препараты, способствующие коррекции нарушений в иммунной системе и предотвращению возникновения инфекционной патологии. Учитывая эффективность применения анаферона и анаферона детского в практическом здравоохранении, безопасность их использования у пациентов из групп риска, а также возможность применения длительными курсами, можно рекомендовать эти препараты для включения в схемы терапии пациентов с аллергическими заболеваниями.
А.Ю. Павлова, М.С. Зак, М.В. Качанова, С.А. Сергеева
НПФ «Материа Медика Холдинг», Москва
Литература:
1. Эпидемиология аллергических заболеваний в России / Р. М. Хаитов, А. В. Богова, Н. И. Ильина // Иммунология. — 1998. — N 3 . — С. 4-9. — ISSN 0206-4952.
2. Лусс Л. В. Сравнительная оценка диагностической значимости разных методов специфической аллергодиагностики у больных с атопическими заболеваниями /Современные проблемы аллергологии, клинической иммунологии и иммунофармакологии: материалы симпозиума «Новейшие методы диагностики аллергии» 29-31 мая 2001 г., Москва.
3. Земсков А.М., Земсков В.М., Караулов А.В. «Клиническая иммунология», М., 2006 г., С.174-180.
4. Эпштейн О.И., Штарк М.Б., Дыгай А.М. и др. Фармакология сверхмалых доз антител к эндогенным регуляторам функций. М.: Изд. РАМН, 2005. 225 с.
5. Учайкин В.Ф., Эпштейн О.И., Сергеева С.А. и др. Анаферон детский. Отечественный иммунокорректор с противовирусной активностью. Пособие для врачей-педиатров, инфекционистов. Под ред. В.Ф. Учайкина. М. 2003. 31 с.
6. Эпштейн О.И., Зилов В.Г., Судаков К.А. Элементы информационной биологии и медицины. М.2001, с. 135-176.
7. Мартюшев-Поклад А.В. Механизмы противовирусных и иммуномодулирующих эффектов сверхмалых доз антител к гамма-интерферону. Дисс…канд. мед. наук. Томск, 2003, 119 с.
8. Осидак Л.В., Афанасьева О.И., Дриневский В.П. Анаферон детский. Новое средство в терапии и профилактике ОРЗ у детей. Методическое пособие для врачей. Санкт-Петербург. 2003.
9. Саноцкий И.В. Методы определения токсичности и опасности химических веществ. М. Медицина. 1970, с. 5-35.
10. Коровина Н.А., Заплатников А.Л., Ревякина В.А. и др. Новые аспекты применения иммуномодулирующей терапии у пациентов из групп риска. Поликлиника. 2007. №6. С. 95-98.
11. Кондратьева Е.И., Шемякина Т.А., Голикова Е.В. и др. Неспецифическая профилактика острых респираторных заболеваний у детей с бронхиальной астмой. Педиатрия. 2007. №2. С. 76-79.
12. Егоров В.Б., Кладова О.В., Кондюрина Е.Г. и др. Основные вопросы профилактики и терапии вирусных инфекций у детей из групп риска. Поликлиника. 2008. №1. С.20-22.
13. Малахов А.Б., Кондюрина Е.Г., Елкина Т.Н. и др. Современные аспекты профилактики респираторных инфекций у детей с атопией. Лечащий врач. 2007. №7 С.91-93.
14. Кондюрина Е.Г., Елкина Т.Н., Штейнберг М.В. и др. Профилактика острых респираторных инфекций у детей с атопией. Сибирский Консилиум. 2007. №1. С.49-53.
15. Кондюрина Е.Г., Елкина Т.Н., Штейнберг М.В. Профилактика респираторных инфекций при бронхиальной астме у детей в возрасте от года до 5 лет. Педиатрия. 2006. №5. С. 72-77.
16. Кондратьева Е.И., Неряхина С.В., Соболева Н.Г. Новые аспекты применения Анаферона в пульмонологии и педиатрической практике. Поликлиника. 2006. №6 С.17-19.
17. Веревщиков В.К., Копылов А.Н., Павлова А.Ю. Профилактика и лечение вирусных инфекций у пациентов с отягощенным анамнезом. Поликлиника. 2008. №6 С.81-83.
18. Куделя Л.М., Можина Л.Н., Королева О.В., Соколова Н.Б., Тихомирова Е.Г., Манжилеева Т.В. Комплексная терапия обострений хронической обструктивной болезни легких и бронхиальной астмы. //Сибирский консилиум. — 2007. №1 С.47-48.
19. Куделя Л.М., Сидорова Л.Д., Мельникова Е.М., Можина Л.Н., Попова Н.В. Опыт применения индукторов интерферона в комплексной терапии больных бронхиальной астмой в сочетании с хронической обструктивной болезнью легких. //Сибирский консилиум. — 2008. №1 С.16-21.
20. Rudenko M., Siziakina L., Frolova S. Immunomodulation optimizes specific immunotherapy of pollen allergy accompanied by secondary immunodeficiency // FOCIS. Trainee Satellite Symposium.- Boston, Massachusetts, 2005.- P.43.
21. Руденко М.Ю. Эффективность различных схем мукозальной специфической иммунотерапии у больных с поллинозом с сопутствующим синдромом вторичной иммунной недостаточности. // Дисс. … канд. Мед. Наук. — Ростов-на-Дону. — 2006
22. Руденко М.Ю., Сизякина Л.П., Урбан Е.О. Эффективность сверхмалых доз антител к интерферону гамма в комплексной терапии аллергических заболеваний // ХIII Российский национальный конгресс «Человек и лекарство»: Сб. материалов конгресса. Тезисы докладов.- М., 2006.- С.451- 452.
Аллергические болезни являются весьма распространенной патологией в детском возрасте. По данным эпидемиологических исследований, ими страдает до 25% детского населения. Аллергические заболевания у детей в большинстве своем являются атопическими по своей
Аллергические болезни являются весьма распространенной патологией в детском возрасте. По данным эпидемиологических исследований, ими страдает до 25% детского населения. Аллергические заболевания у детей в большинстве своем являются атопическими по своей природе. Их развитие определяется воздействием генетических и средовых факторов, приводящим к сенсибилизации организма. Патогенетическую основу аллергических болезней составляют IgЕ-опосредуемые аллергические реакции, связанные с изменением соотношения Th2/Th1-лимфоцитов за счет преобладания Th2-цитокинового профиля и снижения активности Th1-лимфоцитов.
Возникающая при контакте с причинно-значимым аллергеном активация макрофагов, дендритных клеток Т-лимфоцитов, тучных клеток, базофилов, эозинофилов индуцирует синтез преформированных и липидных медиаторов, противовоспалительных цитокинов, адгезивных молекул, способствующих возникновению в шоковом органе аллергического (иммунного) воспаления.
Проводимая при аллергических заболеваниях у детей терапия является патогенетической и направлена на устранение контакта с причинно-значимыми аллергенами, обратное развитие острой фазы аллергического ответа; при этом предусматривается проведение превентивной противовоспалительной терапии и аллергенспецифической иммунотерапии.
У ряда детей течение аллергических болезней сопровождается частыми острыми респираторными вирусными инфекциями, рецидивирующей герпетической инфекцией, у отдельных больных выявляются микоплазменная и хламидийная инфекции. У некоторых пациентов с атопическим дерматитом имеет место рецидивирующая вторичная инфекция на пораженных аллергическим воспалительным процессом участках кожи. В ряде случаев у детей с аллергической патологией формируются хронические очаги инфекции (хронический тонзиллит, хронический пиелонефрит, синуситы), возникают дисбиотические изменения в составе микрофлоры кишечника. При иммунологическом обследовании детей с аллергическими заболеваниями нередко выявляются признаки вторичной иммунной недостаточности: снижение продукции секреторных иммуноглобулинов, γ-интерферона, снижение фагоцитарных функций. Указанные клинические данные и результаты иммунологических исследований являются основанием для использования в лечении детей, страдающих аллергическими заболеваниями, иммунотропных фармакологических средств. В детской аллергологической практике находят применение следующие фармакологические иммунотропные препараты.
-
Препараты микробного происхождения:
– бактериальные лизаты (ИРС 19, бронхо-мунал, имудон);
– комбинированные и иммунокорригирующие препараты, содержащие антигены бактерий и неспецифические иммуномодуляторы в виде липополисахаридов и протеогликанов (рибомунил, поликомпонентная вакцина ВП-4);
– дрожжевые гидролизаты (натрия нуклеинат);
– синтетические аналоги бактериальных антигенов (ликопид).
– препараты тимуса (тималин, тактивин, тимоптин);
– синтетические аналоги тимических факторов (тимоген).
– препараты интерферона (лейкинферон, альфаферон, интерферон человеческий, виферон);
– синтетические индукторы интерферонов (циклоферон, амиксин).
Иммунотропная активность иммуномодуляторов позволяет использовать их для восстановления функций иммунной системы и обеспечения должной иммунной защиты организма. Проведение терапии иммуномодуляторами способствует устранению острых и хронических очагов инфекции и вторично уменьшению проявлений аллергического процесса [1]. В то же время иммуномодулирующая терапия не является этиотропной по своей направленности. Известно, что в развитии атопических болезней ведущую роль играет повышенная активность Th2-лимфоцитов. В связи с этим наиболее оптимальными иммуномодулирующими препаратами считаются средства, которые способны снижать активность Th2-клеток и повышать активность Th1-лимфоцитов. Разработка подобного рода иммунофармакотерапевтических средств является перспективным направлением исследований в аллергологии и клинической иммунологии, что позволяет надеяться на повышение эффективности лечения и мер профилактики аллергических болезней в будущем. Существующие сегодня иммуномодулирующие препараты могут применяться в аллергологической практике для ускорения наступления клинической ремиссии аллергических болезней.
Применение иммуномодуляторов при бронхиальной астме у детей
Иммуномодуляторы бактериального происхождения относятся к одним из наиболее часто применяющихся в лечении бронхиальной астмы. Препараты этого ряда способны активировать гуморальный иммунный ответ на бактериальные антигены и оказывают косвенное влияние на системный иммунный ответ. Действие иммунотропных препаратов бактериального происхождения направлено на активацию моноцитарно-макрофагальной системы по элиминации чуждых в антигенном отношении субстанций. Указанные препараты, являясь бактериальными вакцинами, стимулируют фагоцитоз и микробицидность, активируют гуморальный и клеточный иммунитет. При создании иммуномодуляторов бактериального происхождения используют бактериальные лизаты, фракции клеточных оболочек микробов, бактериальные рибосомы. Значительное распространение получили поливалентные препараты, активирующие неспецифическую резистентность и обладающие иммуномодулирующим действием (рибомунил, бронхо-мунал, ИРС 19, ВП-4, имудон).
Рибомунил содержит рибосомы K. pneumoniae, S. pyogenes, H. influenzae, S. pneumoniae и мембранные протеогликаны. Препарат рекомендуется для профилактики рецидивирующих инфекций дыхательных путей и ЛОР-органов. Механизм терапевтического действия рибомунила связан с активацией естественных киллеров, В-лимфоцитов, продукции γ-интерферона, sIgA и образования специфических антител к антигенам вакцины. Применение рибомунила у часто болеющих детей способствует уменьшению частоты острых респираторных инфекций [2]. Препарат может использоваться в педиатрической практике. При пероральном лечении рибомунилом детей, страдающих бронхиальной астмой и частыми острыми респираторными заболеваниями, у 93,3% больных было выявлено снижение частоты острых респираторных заболеваний и связанных с ними обострений бронхиальной астмы, сопровождавшееся повышением ИЛ-2, γ-интерферона, увеличением количества CD8+-клеток и CD3+-лимфоцитов, сокращением количества CD4+-клеток, ФНО-альфа, редукцией показателей клеточной активации (уменьшение количества CD 25+- и CD23+-лимфоцитов, повышение уровней IgA, IgG3, IgG4 и снижение уровней IgM, IgG, IgG1, IgG2).
Иммуномодулирующим действием обладает бронхомунал. В состав препарата входят лизаты Streptococcus pneumoniae, Haemophilus influenzae, Klebsiella pneumoniae, Klebsiella ozaenea, Staphylococcus aureus, Streptococcus pyogenes, Branhamella catarrhalis. После курсового лечения бронхо-муналом, назначающимся перорально, у 68% детей с бронхиальной астмой отмечается снижение частоты острых респираторных заболеваний и связанных с ними обострений бронхиальной астмы [3].
Препарат ИРС 19 представляет собой очищенные бактериальные лизаты основных возбудителей инфекций дыхательных путей и некоторых других микроорганизмов: Streptococcus pneumoniae типов I, II, III, V, VIII, XII, Haemophilus influenzae типа В, Klebsiella pneumoniae, Staphylococcus aureus, Acinetobacter calcoaceticus baumannii variety, Moraxella catarrhalis, Neisseria subflava flava variety, Streptococcus pyogenes группы А, Streptococcus disgalactiae группы С, Streptococcus группы G, Enterococcus faecium, Enterococcus faecalis, Yafkia tetragena. ИРС выпускается в форме аэрозоля, после эндоназального впрыскивания этого препарата образуется тонкий слой, покрывающий слизистую оболочку носовых ходов. Препарат способствует уменьшению отека слизистой полости носа, разжижению назального секрета и его эвакуации. Указанные терапевтические эффекты предупреждают возникновение отита, синусита. Препарат ИРС 19 применяют для лечения и профилактики отита, синусита и других воспалительных заболеваний дыхательного тракта.
Под влиянием терапии ИРС 19, проводимой эндоназально, у больных детей с бронхиальной астмой и сочетанными проявлениями бронхиальной астмы и атопического дерматита, наблюдается уменьшение частоты и длительности острых респираторных вирусных инфекций в 1,5 раза, числа обострений хронических воспалительных заболеваний носоглотки — в 1,6 раза, сокращение числа обострений бронхиальной астмы — в 1,4 раза и более легкое ее течение [4]. На фоне терапии ИРС 19 было отмечено снижение уровня ИЛ-2 и повышение содержания ИЛ-6 в сыворотке крови.
Отечественный иммуномодулирующий препарат ВП-4 является бесклеточной бактериальной вакциной, разработанной НИИ вакцин и сывороток им. И. И. Мечникова. Вакцина содержит антигены S. aureus, P. vulgaris, K. Pneumoniae, E. coli. Антигенные комплексы, входящие в состав этой вакцины, выделены с помощью воздействия гидроксиламином или водной экстракцией, стерилизованы и лиофилизированы без стабилизирующих веществ; в препарате тестированы пептидогликаны, поверхностные и полисахаридные антигены указанных микроорганизмов, липополисахариды грамотрицательных бактерий, тейхоевая кислота стафилококка. Штаммы характеризуются высокой иммуногенностью и слабыми сенсибилизирующими свойствами. Первые дозы препарата вводятся эндоназально, последующие — перорально; курс лечения ВП-4 состоит из девяти введений препарата.
Положительные результаты лечения после первого курса терапии ВП-4 отмечаются у 71,1 % больных бронхиальной астмой детей, после второго курса — у 66,7%; при среднетяжелом течении положительные результаты лечения ВП-4 регистрируются реже — у 62,5% детей.
У прошедших курс лечения детей положительный результат проявлялся достижением ремиссии болезни или сокращением числа ее обострений. При анализе частоты приступов бронхиальной астмы, проводившемся в течение года, отмечено уменьшение числа больных, имеющих частые обострения, в 2 раза. При наблюдении за детьми в течение года после окончания курса терапии ВП-4 выявлено уменьшение частоты приступов бронхиальной астмы в 3,1 раза [3].
Терапия ВП-4 способствовала сокращению числа эпизодов острых респираторных вирусных инфекций, уменьшению в 2,9 раза частоты обострений хронических очагов инфекции и острой респираторной инфекции на протяжении года после ее завершения.
В процессе терапии было отмечено влияние лечения ВП-4 на иммунный ответ у детей с бронхиальной астмой, проявившееся повышением показателей СD3+, CD4+, CD8+, CD72+, CD25+ в периферической крови при исходно низких значениях и снижением их — при исходно высоких, повышением уровня IgA в сыворотке крови. У детей с бронхиальной астмой было выявлено иммуномодулирующее действие ВП-4 на продукцию специфических антител к бактериальным антигенам, входящим в состав вакцины. Не было обнаружено влияния ВП-4 на уровни IgM, IgG и IgE в сыворотке крови.
Проведенное в 80–90 гг. ХХ в. в нашей стране исследование по изучению иммуномодулирующих препаратов тимического происхождения показало возможность использования их в терапии бронхиальной астмы у детей. При лечении детей с бронхиальной астмой данными препаратами развиваются позитивные изменения в иммунном ответе: нормализация соотношения Т-хелперов и Т-супрессоров в периферической крови, улучшение состояния больных, проявлявшееся уменьшением частоты острых респираторных инфекций и обострений хронических воспалительных заболеваний, снижение частоты приступов и более легкое их течение [5]. Применение тактивина позволяет повысить эффективность лечения бронхиальной астмы, обусловленной сенсибилизацией к плесневым грибам. При лечении Т-активином отмечается тенденция к снижению уровня общего IgE в сыворотке крови.
При применении тималина отмечено улучшение в состоянии больных в основном при легком и среднетяжелом течении бронхиальной астмы, тогда как при тяжелом течении болезни позитивные изменения в клинической картине болезни отмечаются сравнительно редко.
Одним из возможных подходов к иммунотерапии аллергических болезней является использование с лечебной целью цитокинов. g-интерферон и α-интерферон ингибируют синтез IgE, повышают функциональную активность естественных киллеров, стимулируют пролиферацию CD8+-лимфоцитов, тормозят дегрануляцию тучных клеток. При лечении больных с бронхиальной астмой аэрозолями рекомбинантного интерферона выявлено значительное уменьшение количества эозинофилов в лаважной жидкости бронхов, но при этом не отмечено существенного влияния на клинические проявления бронхиальной астмы и ее течение [6] .
При бронхиальной астме у детей установлено благоприятное влияние индукторов синтеза интерферона на течение бронхиальной астмы. Лечение индуктором синтеза интерферона препаратом циклофероном усиливает синтез лейкоцитами γ-интерферона и α-интерферона, повышает уровень IgA, тормозит синтез общего IgE. У прошедших курс лечения циклофероном больных отмечается сокращение числа эпизодов острых респираторных заболеваний и связанных с ними обострений бронхиальной астмы [7].
Индуктор синтеза интерферона препарат амиксин у детей, больных бронхиальной астмой, способствует более легкому течению интеркуррентных острых респираторных вирусных инфекций, уменьшает количество обострений основного заболевания, стимулирует выработку эндогенного интерферона.
В последние годы повысился интерес к возможности применения при бронхиальной астме синтетических иммуностимуляторов. Одним из таких препаратов является полиоксидоний. Полиоксидоний — это производное полиэтиленпиперазина. Он обладает способностью стимулировать активность макрофагов, кооперацию Т- и В-лимфоцитов, повышает специфический антителогенез, стимулирует неспецифические свойства организма. Применение полиоксидония в комплексном лечении больных бронхиальной астмой детей способствует достижению устойчивой ремиссии болезни в 82,0% случаев, уменьшению частоты интеркуррентных острых респираторных заболеваний — в 72% и нормализации иммунного статуса больных [8].
К синтетическим иммуномодуляторам относится препарат гепон. Гепон активирует синтез α-, β-, γ-интерферона, стимулирует активность макрофагов, усиливает продукцию антител против антигенов инфекционной природы, повышает резистентность организма в отношении вирусных инфекций. Лечение гепоном детей с бронхиальной астмой сопровождается снижением частоты интеркуррентных острых респираторных вирусных инфекций и связанных с ними обострений данного заболевания [9].
Применение иммуномодулирующих препаратов при атопическом дерматите у детей
Течение атопического дерматита у детей нередко сопровождается присоединением вторичной инфекции, в связи с чем встает вопрос о возможности использования при данном заболевании иммуномодулирующих препаратов.
Включение Т-активина и тималина в комплексную терапию детей с атопическим дерматитом, связанным с пищевой аллергией, способствует повышению эффективности лечения данного заболевания. У больных под влиянием указанной терапии отмечается снижение гиперпродукции общего и специфических IgE-антител [10]. Отмечено благоприятное влияние препарата тимуса вилозена на течение атопического дерматита у детей [11]. Применение тималина позволяет повысить эффективность лечения у детей с аллергодерматозами и дермореспираторным синдромом, а также снизить частоту интеркуррентных вирусных инфекций. Достигаемое под влиянием тималина обратное развитие аллергического воспаления кожи сопровождается нормализацией активности кислой фосфатазы и повышением активности сукцинатдегидрогеназы и a-глицерофосфатдегидрогеназы, снижением активности персистирующей энтеровирусной инфекции [10].
Клинические наблюдения свидетельствуют об эффективности препаратов интерферона (лейкинферона, виферона) в патогенетической терапии аллергических болезней кожи у детей [12].
Таким образом, назначение иммуномодулирующих препаратов по строгим показаниям (наличие частых, вялотекущих обострений заболеваний ЛОР-органов, кожи со склонностью к инфицированию, частых респираторно-вирусных инфекций, требующих приема антибиотиков, снижение парциальных иммунных функций) может способствовать повышению эффективности лечения аллергических болезней у детей.
Литература
- Хаитов Р. М., Пинегин Б. В. Современные иммуномодуляторы: Основные принципы их применения//Иммунология. 2000. № 5. С. 4–7.
- Намазова Л. С. Патогенетические основы дифференцированного лечения бронхиальной астмы у детей: Автореф. дис. . д-ра мед. наук. М., 2000. 40 с.
- Степушина М. А. Эффективность поликомпонентной бактериальной вакцины ВП-4 при бронхиальной астме у детей: Автореф. дис. . канд. мед. наук. М., 1999. 24 с.
- Балаболкин И. И., Булгакова В. А., Сенцова Т. Б. Эффективность применения препарата ИРС 19 в комплексной терапии детей с аллергическими заболеваниями: Материалы научно-практической конференции «Фармакотерапия и фармакокинетика в педиатрии». М., 2000. С. 5.
- Тюрин Н. А. Тактивин в комплексном лечении бронхиальной астмы у детей // Педиатрия. 1996. № 4. С. 46–48.
- Bogunewik K., Martin R., Martin D. The effects of nebulized recombinant interferon gamma in asthmatik airways//J.Allergy Clin. Immunol. 1995; 95: 133–135.
- Ляпунов А. В. Иммунотропная терапия при бронхиальной астме у детей: Материалы научно-практической конференции педиатров России по болезням органов дыхания. М., 1999. С. 48.
- Кузнецова Н. И. Особенности бронхиальной астмы при бактериальной сенсибилизации детей: Автореф. дис. . д-ра мед. наук. М., 2004. 34 с.
- Рылеева И. В. Патогенетические основы эффективности аллергенспецифической иммунотерапии и иммунофармакотерапии атопической бронхиальной астмы у детей: Автореф. дис. . д-ра мед. наук. М., 2004. 46 с.
- Балаболкин И. И., Гребенюк В. Н. Атопический дерматит у детей. М.: Медицина, 1999. 238 с.
- Ревякина В. А. Атопический дерматит у детей: Автореф. дис. . д-ра мед. наук. М., 1993. 32 с.
- Смирнова Г. И. Аллергодерматозы у детей. М., 1998. 300 с.
И. И. Балаболкин, профессор, член-корреспондент РАМН
М. В. Сюракшина
Е. С. Тюменцева, кандидат медицинских наук
НЦЗД РАМН, Москва
Местное лечение атопического диффузного нейродермита у детей
Заболевание требует систематического и разностороннего лечения, которое включает увлажнение кожи, использование наружных средств, выявление и устранение провоцирующих факторов, а в ряде случаев — системную терапию.
Для облегчения симптомов обычно используют наружные средства, главным образом увлажнение кожи.
Увлажнение кожи для лечения диффузного нейродермита. Нарушение барьерной функции кожи способствует развитию ксероза (патологической сухости кожи), особенно в зимнее время. Помогают теплые ванночки (не менее 20 мин) с последующими повязками, пропитанными смягчающими средствами, чтобы удержать влагу. Применяют различные кремы и мази на гидрофильной основе. Однако мазь может закупоривать протоки потовых желез и вызывать фолликулит. В таких случаях следует использовать менее вязкие средства.
Увлажнение кожи с помощью ванночек или влажных повязок увеличивает ее проницаемость для глюкокортикоидов. Повязки мешают расчесывать кожу и тем самым ускоряют заживление ранок. Однако сами по себе, без смягчающих средств они могут усиливать высыхание и растрескивание кожи. Возможны также мацерация кожи и вторичное ее инфицирование. Поэтому увлажняющая терапия требует тщательного врачебного наблюдения.
Местная глюкокортикоидная терапия для лечения атопического нейродермита. Местное применение глюкокортикоидов составляет основу противовоспалительной терапии при диффузном нейродермите. Однако необходимо учитывать возможные неблагоприятные последствия такой терапии. Глюкокортикоиды для местного применения подразделяются на семь классов соответственно их сосудосуживающей активности.

Высокоактивные глюкокортикоиды нельзя наносить на межпальцевые промежутки; ими смазывают лишь туловище и конечности и используют очень короткое время. Задача заключается в увлажнении кожи с помощью смягчающих средств; малоактивные глюкокортикоиды должны лишь поддерживать эффект увлажнения. При хроническом диффузном нейродермите мази с глюкокортикоидами средней активности более длительно можно применять на туловище и конечностях.
Мази больше закупоривают поры, но и всасываются быстрее, чем жидкие кремы. Побочные эффекты глюкокортикоидов могут быть как местными, так и системными. Последние обусловлены угнетением ГГНС. К местным побочным эффектам относятся полосы растяжения (стрии) и атрофия кожи. Системные эффекты зависят от активности глюкокортикоидных препаратов, мест их нанесения на кожу, степени закупорки пор, размера покрываемой поверхности и длительности использования.
Риск подавления функции надпочечников при местном применении таких препаратов наиболее высок у грудных и маленьких детей с тяжелым диффузным нейродермитом, требующим интенсивной терапии.
Местное применение иммуномодуляторов при атопическом дерматите
В лечении диффузного нейродермита с успехом применяется мазь с такролимусом — ингибитором кальпиневрина. Такролимус взаимодействует со специфическим связывающим белком и препятствует активации Т-лимфоцитов, клеток Лангерганса, тучных клеток и кератиноцитов. Мазь с такролимусом уже через несколько дней значительно ослабляет зуд и воспаление. Безопасность и эффективность этого средства доказана многими исследованиями.
Действительно, длительное использование мази с такролимусом уменьшает колонизацию кожи S. aureus. В отличие от мазей с кортикостероидами, мазь с такролимусом не вызывает атрофии кожи и ее можно наносить на лицо и веки. FDA разрешает периодическое длительное применение 0,03% мази с такролимусом при диффузном нейродермите у детей в возрасте 2-15 лет. Больные старше 16 лет могут использовать и 0,1% мазь.
Для местного применения и приема внутрь предложены соединения аскомицина, который связывает макрофилин 12 и тем самым препятствует действию кальциневрина. Подобно такролимусу эти вещества ингибируют продукцию цитокинов Тh1- и Тh2-клетками и с успехом используются в лечении диффузного нейродермита.
Препараты дегтя для лечения атопического нейродермита
Препараты дегтя при нанесении на кожу ослабляют зуд и воспаление. Однако они действуют слабее глюкокортикоидов и иммуномодуляторов. Их применяют с целью уменьшения местной глюкокортикоидной терапии. Шампуни с препаратами дегтя особенно полезно при поражении кожи головы. Следует помнить, однако, что препараты дегтя могут раздражать кожу повышать ее светочувствительность и вызывают фолликулит.
Фототерапия при атопическом нейродермите
В качестве дополнительного средства можно использовать УФ-облучение широкополосный ультрафиолет В, широкополосный ультрафиолет А, узкополосный ультрафиолет В (с длиной волны 311 нм), ультрафиолет А (340-400 нм) и комбинацию А/В. Ультрафиолет с псораленом (PUVA) или без него действует, вероятно, на клетки Лангерганса и эозинофилы в эпидермальном слое, а ультрафиолет В блокирут антигенпредставляющую функцию клеток Лангерганса и продукцию цитокинов кератиноцитами PUVA-терапия показана при тяжелом нейродемите, захватывающем большие поверхности тела.
Побочные эффекты фототерапии (гиперемия, загар и пигментация) кратковременны, однако УФ-облучение может повышать риск злокачественных новообразований кожи.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
• Эффективны местные стероиды и смягчающие препараты (эмоленты).
• Имеются некоторые свидетельства в пользу облегчения симптомов у пациентов с атопической триадой после устранения клещей домашней пыли. Исполь зование специального постельного белья оказалось наиболее эффективным способом избавления от пылевых клещей и улучшения течения АД у данной категории пациентов. К сожалению, устранение клещей домашней пыли неэффективно для пациентов с АД, не имеющих полной атопической триады.
• Ограничения в диете полезны только для младенцев с доказанной аллергией на куриные яйца. Исключение яиц способствует снижению тяжести АД у грудных детей с положительным результатом радиоаллергосорбентного теста на куриные яйца.
• Свидетельств в пользу облегчения симптомов у взрослых и детей при изменении диеты недостаточно.
• Местные стероиды при АД весьма эффективны и их применение является основным методом лечения.
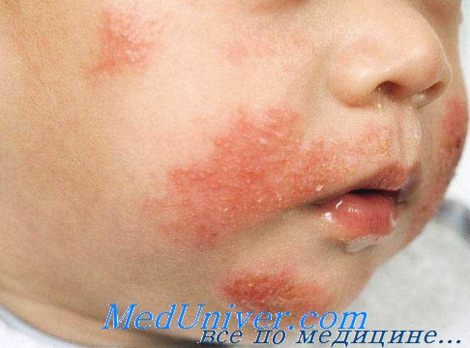
Атопический дерматит
- Мази рекомендуются для сухой растрескавшейся кожи.
- Кремы удобнее для применения и иногда лучше переносятся.
- Для лица и паховой области используются более слабые стероиды.
- Чтобы избежать системной абсорбции, грудным младенцам и маленьким детям также назначаются более слабые стероиды.
- Для толстой кожи па ладонях и ступнях применяются стероиды с большей фармакологической активностью.
- Более мощные стероиды применяются только при тяжелых эпизодах или очагах, не отвечающих на слабые стероиды.
- Чтобы избежать побочных эффектов, стероиды с более высокой фармакологической активностью (клобетазол) не должны применяться непрерывно более двух недель. Однако в случаях рецидивирующего АД их можно назначить с интервалами, используя метод пульс терапии (применять по выходным и не применять по рабочим дням).
• При распространенных обострениях рекомендуется преднизон перорально или триамцинолон (40 мг в 1 см 3 ) внутримышечно.
• При вторичной бактериальной инфекции назначаются местные и системные антибиотики. Самой распространенной является инфекция, вызванная Staphylococcus aureus. Мокнутие и образование корок во время обострения указывают па необходимость применения антибиотиков.
• Роль антигистаминных препаратов при терапии АД противоречива. Если применяются антигистаминные средства, наиболее эффективными из них являются препараты с седативным действием, которые принимаются перед сном.
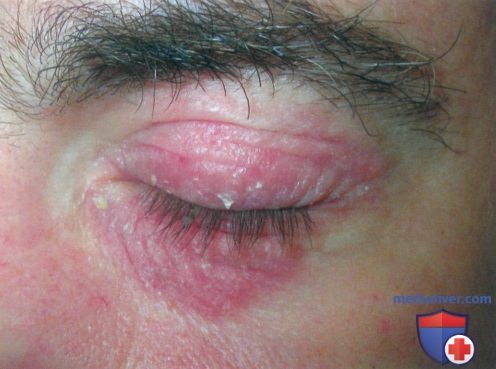
Атопический дерматит (АД) с выраженным поражением век у мужчины среднего возраста. Отмечается хорошая реакция на пимекролимус и мазь со стероидом слабой фармакологической активности
• Кратковременное вспомогательное местное применение доксепина иногда помотает ослабить зуд.
• Местные ингибиторы кальциневрина (иммуномодуляторы, такие как пимекролимус и такролимус) уменьшают тяжесть высыпаний и симптомы АД у детей и взрослых путем подавления антиген-специфической активации Т-клеток и ингибирования высвобождения воспалительных цитокинов. Эти препараты уменьшают потребность в стероидах, что особенно важно при экземе век и других участков, где стероиды могут вызывать истончение кожи. Препараты одобрены для применения с двухлетнего возраста, однако Федеральное агентство по контролю лекарств не рекомендует их в качестве препаратов первой линии из-за возможной канцерогенности. По свидетельству Американской Академии дерматологии «данных, указывающих на опасность местных препаратов пимекролимуса и такролимуса при их правильном применении, не получено».
• В случае тяжелого торпедного АД для длительной поддерживающей терапии, позволяющей избежать рецидивов, применяется циклоспорин.
• При тяжелом торпидном течении АД также с успехом применяется фототерапия УФ-излучением.
б) Консультирование врачом пациента. Пациенты должны знать, что расчесы ухудшают течение их заболевания, а при сухости кожи и/или зуде им ре комендуется пользоваться эмолентами или стероидами. С помощью регулярного применения соответствующих препаратов можно контролировать АД, но не излечить его.
в) Наблюдение пациента врачом. Пациентам с хроническим или трудно поддающимся лечению атопическим дерматитом необходимо регулярное наблюдение. Подбор оптимальной схемы лечения позволяет добиться длительной ремиссии и, таким образом, уменьшить число визитов к врачу.
г) Список использованной литературы:
1. Hanifin JM, Cooper KD, Но VC, et al. Guidelines of care for atopic dermatitis. J Am Acad Dermatol. 2004;50:391-404.
2. Simpson EL. Prevalence and morphology of hand eczema in patients with atopic dermatitis. Dermatitis. 2006;17:123-127.
Системная терапия диффузного атопического дерматита. Антигистаминные средства
В системной терапии диффузного нейродермита применяются антигистаминные средства, глюкокортикоиды, циклоспорин и интерфероны.
Антигистаминные средства при атопическом дерматите. При приеме внутрь эти вещества блокируют Н1-рецепторы в коже и тем самым ослабляют вызываемый гистамином зуд. Однако гистамин — это только один из многих вызывающих зуд медиаторов воспаления, и поэтому системная терапия Н1-блокаторами облегчает состояние больных лишь в слабой степени.
Поскольку зуд обычно усиливается по ночам, лучше применять перед сном Н1-блокаторы, обладающие снотворным свойством (например, гидроксизин или дифенгидрамин). Трициклический антидепрессант доксепина гидрохлорид одновременно блокирует Н1- и Н2-рецепторы. Если ночной зуд сохраняется, можно на короткое время назначить седативные средства.
Испытания новых антигистаминных препаратов дали неоднозначные результаты в отношении облегчающего зуд действия у больных с диффузным нейродермитом, но у небольшой группы больных с сопутствующей крапивницей эти препараты могут оказаться полезными.
Глюкокортикоиды при атопическом дерматите. Системная глюкокортикоидная терапия при диффузном нейродермите показана лишь в редких случаях. Резкое улучшение состояния больных, наблюдающееся при этом, сменяется обострением заболевания после отмены глюкокортикоидов. При обострениях глюкокортикоиды можно принимать внутрь лишь в течение короткого времени, постепенно уменьшая их дозы.
Одновременно усиливают местную терапию, используя мази с глюкокортикоидами и частые ванночки с последующими влажными обертываниями.
Циклоспорин при атопическом дерматите — мощный иммунодепрессант, угнетающий транскрипцию цитокиновых генов в Т-лимфоцитах. Он связывается внутриклеточным белком циклофилином, и этот комплекс ингибирует кальциневрин, необходимый для включения транскрипции цитокиновых генов. По данным многих исследований, кратковременное введение циклоспорина улучшает состояние детей с тяжелым диффузным нейродермитом, устойчивым к другим видам терапии. Положительный эффект наблюдался при введении этого вещества в дозе 5 мг/кг/сут в течение как короткого, так и длительного (до 1 года) времени.
Наибольшие опасения вызывает побочное действие циклоспорина на почки и АД.
Интерфероны при атопическом дерматите. ИФН-у подавляет образование IgE, а также пролиферацию и функцию Th2-клеток. Показано, что введение рекомбинантного ИФН-у больным с диффузным нейродермитом улучшает их состояние, при этом снижается число эозинофилов в крови. В начале лечения могут возникать симптомы гриппа.
Читайте также:

