При увядании кожи меланоциты уменьшаются
Обновлено: 01.05.2024
Методы лечения веснушек и других меланиновых меланозов
В лечении меланозов используют три основных вида терапии: специфическая депигментирующая, фотозащитная терапия и профессиональные косметологические манипуляции.
Депигментирующая терапия. Уменьшение пигментации кожи может быть достигнуто тремя путями: гибель меланоцитов в очаге гиперпигментации, угнетение синтеза меланина в меланоцитах за счет ингибиции фермента тирозиназы и предупреждение проникновения меланосом в кератиноциты.
Гидрохинон может вызвать гибель меланоцитов и обратимо угнетать синтез меланина в меланоцитах. Данный препарат является эффективным отбеливающим средством. В косметологической практике чаще всего применяют 1—2% препараты гидрохинона, в некоторых случаях допускается 4% концентрация. Гидрохинон обычно назначают для лечения мелазмы, брелкового дерматита, веснушек и поствоспалительного гипермеланоза. Мелазма эпидермального типа наиболее чувствительна к терапии гидрохиноном. Лечение должно продолжаться в течение долгого времени (1—6 месяцев), хороший косметический эффект получается у 70—90% пациентов.
Лечение может привести к полному исчезновению гипермеланоза, однако рецидивы возможны. При использовании гидрохинона могут наблюдаться: аллергический и контактный дерматит, поствоспалительная гиперпигментация, депигментация по типу конфетти, охроноз, а также гипопигментация прилегающей нормальной кожи. Не рекомендуется пользоваться гидрохиноносодержащими препаратами более двух лет. Если в течение 6 месяцев положительный эффект не наблюдается, следует перейти на другие отбеливающие средства. В настоящее время применение гидрохинона ограничено, а в Европе он запрещен в составе косметических средств. Это связано с тем, что данный препарат может вызвать необратимую депигментацию за счет гибели меланоцитов.
Азелаиновая кислота обладает депигментирующим действием. Она способна угнетать синтез ДНК и РНК в меланоцитах, ингибировать тирозиназу. Азелаиновая кислота рекомендуется для лечения мелазмы, поствоспалительного гипермеланоза и гипермеланоза, вызванного химическими и фотохимическими факторами. Выпускается в форме 20% крема или геля. Назначается два раза в день в течение 3 месяцев. Во время лечения необходимо защищать кожу от всего спектра солнечного облучения. Мелазма, расположенная в дерме, нечувствительна к действию препарата.
Арбутин и койевая кислота являются ингибиторами фермента тирозиназы. Арбутин содержится в большом количестве в листьях толокнянки обыкновенной. Как правило, используют экстракт из листьев данного растения. Койевая кислота обладает отбеливающим, отшелушивающим и антиоксидантным действием. Основной недостаток койевой кислоты — ее потенциальная аллергенность, поэтому при первых признаках дерматита использование препарата следует прекратить.
Ретиноиды (третиноин, адапален) оказывают специфический депигментирующий эффект. Их применяют при мелазме, веснушках, поствоспалительной гиперпигментации. Мелазма хорошо поддается терапии 0,05% третиноиновым кремом с 0,1% бетаметазона валерата и 2% гидрохинона. Крем третиноина 0,5—1,0% иногда очень эффективен при старческой пигментации кожи.
Аскорбиновая кислота также угнетает меланогенез, восстанавливая ДОФА-хром до ДОФА-хинона и ингибируя тирозиназу. Тем не менее использовать аскорбиновую кислоту в качестве отбеливающего агента долго не удавалось, так как в чистом виде она крайне нестабильна и легко окисляется, а большинство ее стабильных аналогов плохо проникают через кожу. Стабильные формы аскорбиновой кислоты, способные проникать через кожу и сохранять при этом активность, стали использоваться совсем недавно. Одним из таких веществ является стабилизированная аскорбиновая кислота (аскорбил-2-глюкозид), которая, как показали исследования, является эффективным ингибитором меланогенеза.
Стабилизация происходит за счет глюкозидных связей. Дополнительным плюсом препаратов аскорбиновой кислоты является их способность стимулировать синтез коллагена в коже. Как и все кислотосодержащие препараты, отбеливающие средства на основе аскорбиновой кислоты могут вызывать раздражение кожи.

Лазерное лечение веснушек
Кроме того, к средствам с отбеливающим эффектом можно отнести экстракт солодки и тутового дерева, кортикостероиды слабого действия и другие препараты.
Способностью ингибировать проникновение меланосом из меланоцитов в кератиноциты обладает никотинамид.
В настоящее время для лечения меланозов используют средства лечебной косметики фирм «Урьяж», «Биодерма» и «Иклен».
К препаратам фирмы «Урьяж» относят две эмульсии против пигментных пятен: Депидерм и Депидерм SPF 50 с высокой защитой от UVA/UVB. В состав эмульсии Депидерм входят следующие ингредиенты: 0,2% экстракт солодки голой (глабридин), 0,1% экстракт зеленого чая (катехолы), 1% векторизированный витамин С, 3% молочная кислота, 2% салициловая кислота, 0,05% хелат меди, 0,1% стеарил глицирретинат, 5% диоксид титана, 5% никотинамид. Данный препарат подавляет специфические энзимы, необходимые для меланогенеза, удаляет уже пигментированные кератиноциты, ограничивает воспалительные процессы, вызванные УФО, лазерным воздействием и прочее. Данное средство рекомендуют для лечения солнечного лентиго, веснушек, мелазмы и других меланиновых меланозов.
Значительное осветление и уменьшение размеров пигментных пятен наблюдается в среднем через 4—6 недель регулярного применения. Также используют эмульсию против пигментных пятен Депидерм SPF 50 с высокой защитой от UVA/UVB. В состав препарата входит комплекс фильтров против UVA/UVB с Тиносорбом М, 5% никотинамид, 1% векторизированный витамин С, 0,05% экстракт лакрицы (глабридин), 2% хелат меди, 10% термальная вода. Данный препарат предупреждает риск появления гиперпигментаций на участках кожи, подвергшейся дерматологическому лечению, воздействию лазера, электроэпиляции или после воспалительного акне. Также защищает уже существующие гипер-пигментированные участки кожи, препятствуя усугублению процесса и вторичному появлению пигментных пятен.
Для косметического решения проблем пигментных пятен Лабораторией Биодерма разработан и запатентован комплекс активных веществ White Objective (WO), позволяющий эффективно контролировать процессы образования меланина в коже, устраняя локализованные пигментации и предотвращая их повторное появление. На основе этого комплекса создана отбеливающая линия лечебной косметики Биодерма: WO Н20 — мицелловый раствор, WO — активный крем, WO — сыворотка, WO — карандаш. Биодерма отбеливающий мицелловый раствор Н2О очищает кожу с отбеливающим эффектом. Он содержит отбеливающий комплекс WO, который обеспечивает лечение и профилактику пигментации. Биодерма отбеливающий активный крем применяется для дневного отбеливания.
Витамин С, входящий в состав крема, снижает количество пигмента в эпидермисе, уменьшая имеющуюся гиперпигментацию и предотвращая их появление. Данная форма также содержит запатентованный WO-комплекс, воздействующий на основные механизмы появления пигментных пятен. Крем содержит aнти-UVA/UVB-фильтpы. Биодерма отбеливающая сыворотка предназначена для ночного отбеливания. Она также содержит отбеливающий комплекс WO и активный витамин С. Отличительной особенностью является содержание в ней гликолевой кислоты, которая обеспечивает эффект химического пилинга. Удобной формой для обработки локализованных гиперпигментаций является отбеливающий карандаш. Его используют прицельно на пятна 2—3 раза в день. Он также содержит отбеливающий комплекс WO, гликолевую кислоту. Карандаш обладает высокой степенью защиты от UVA/UVB-лучей и «невидимой« текстурой.
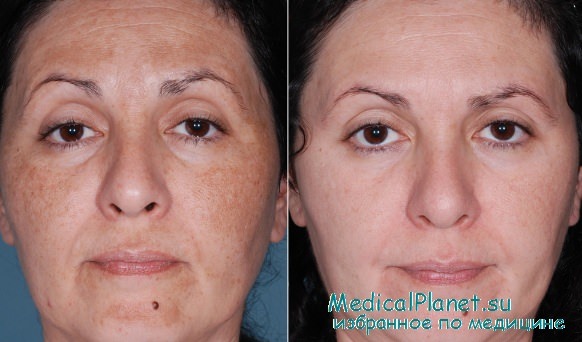
Результаты лазерного лечения мелазмы
Применяются также отбеливающие средства по программе «Иклен». Линия лечебной косметики «Иклен» содержит средства нового поколения для лечения и ухода за кожей с гиперпигментациями: сыворотка, крем, концентрированный крем Мелано-Эксперт и крем Радиане Актив SPF 15.
В состав всех этих препаратов входит вещество Руцинол. Данное запатентованное активное вещество одновременно действует на ключевые энзиматические системы синтеза меланина. Отмечается мощный ингибирующий эффект Руцинола на тирозиназу, превосходящий в 100 раз гидрохинон. В то же время Руцинол не оказывал цитотоксического эффекта на меланоциты, число которых остается неизменным в ходе лечения. Руцинол снижает синтез меланина путем заместительного подавления тирозиназы, препятствуя ее воздействию на L-дофу (L-диоксифенилаланин), и ингибирования TRP1, изофермента тирозиназы, результатом чего является снижение синтеза эумеланина (черного меланина). Руцинол не вызывает фотосенсибилизации, не оказывает цитотоксического и тератогенного эффекта, не провоцирует развитие лейкодермы.
В линии «Иклен» недавно был разработан новый препарат — концентрированный крем пролонгированного действия Иклен Мелано-Эксперт. В состав этого средства входят четыре взаимодополняющих друг друга компонента: Руцинол, Софора альфа, стабилизированная аскорбиновая кислота и Центаридин. Софора альфа (экстракт растения, растущего на Алтае, в Японии) ингибирует активность меланоцитостимулирующего гормона. Стабилизированная аскорбиновая кислота является эффективным ингибитором меланогенеза. Запатентованный компонент Центаридин (экстракт из цветков тысячелистника) активизирует Rho-протеин, который контролирует проводимость дендритов и ингибирует переход меланосом из меланоцитов в кератиноциты путем сокращения дендритов.
Таким образом, сбалансированный состав крема Иклен Мелано-Эксперт действует на все звенья меланогенеза, подавляя избыточную выработку меланина. Концентрированный крем Иклен Мелано-Эксперт является эффективным и безопасным средством для лечения гиперпигментаций различного происхождения. Наилучшие результаты отмечаются при лечении мелазмы и солнечного лентиго.
Фотозащитные средства используют у пациентов с меланиновыми меланозами регулярного, даже в условиях городского, не очень солнечного дня.
Профессиональные косметологические манипуляции. Эти процедуры направлены на усиление десквамации эпидермиса, его снятие каким-либо способом (пилинг, лазерная шлифовка, дермабразия) или селективную фотодеструкцию меланиносодержащих клеток. Косметологи выполняют следующие манипуляции: химический пилинг, лазерное воздействие, фотоомоложение. При химическом пилинге отшелушиваются слои эпидермиса, содержащие пигмент. Но после таких процедур кожа очень уязвима к солнечным лучам.
В худшем случае на месте удаленного светлого пигментного пятна при эпидермальном меланиновом меланозе, выведенного с помощью пилинга, может образоваться контрастное пятно с содержанием меланина в дерме, избавиться от которого будет крайне сложно. Химический пилинг лучше проводить в середине зимы, когда солнечные лучи малоактивны. Применяют различные методы лазерного воздействия на пораженную кожу, используя при этом лучи разной длины, что дает возможность воздействовать только на пигментированные ткани, не повреждая остальные. Кроме того, сейчас популярным методом является фотоомоложение. Оно дает возможность не только избавиться от пигментации, но и улучшить состояние кожи, которая становиться более упругой.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
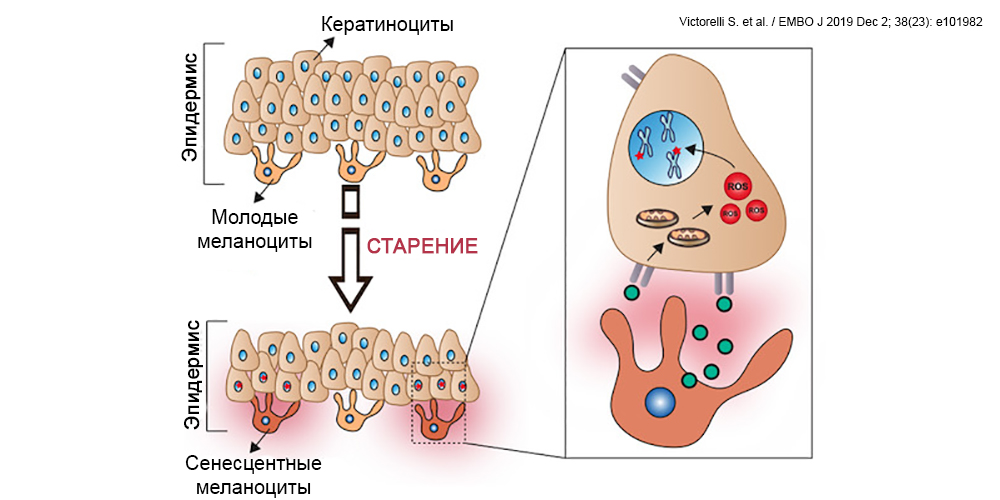
Меланоциты — крупные отростчатые клетки, располагающиеся в базальном слое эпидермиса, родственники клеток нервной системы. Они отвечают не только за цвет и защиту нашей кожи от солнечных ожогов, но вносят существенный вклад в реакцию на практически любые стрессовые воздействия, работая в содружестве с всеми остальными клетками кожи и нейроиммунной системой.
Несмотря на то, что за последние десятилетия ученые узнали много нового об особенностях жизни меланоцитов, мы до сих пор точно не знаем, сколько они живут. Точнее, не знаем, сколько живут меланоциты эпидермиса, срок жизни меланоцитов волосяных фолликулов нам известен, и он относительно небольшой — 3–5 лет. Что касается меланоцитов эпидермиса, известно, что после 30 лет их количество уменьшается примерно на 10–20% каждое десятилетие, т.е. живут они как минимум десятки лет.
Однако клеточная гибель — не единственный вариант, который ожидает «повидавшего жизнь» меланоцита. Также, как и многие другие клетки, меланоциты, которые накопили критическое количество повреждений и которые защитные системы клетки более не хотят допускать к делению, могут либо умереть, либо перейти в так называемое сенесцентное состояние. Это состояние, в котором они не способны более делиться и таким образом передавать дефектный геном, однако могут продолжать выполнять некоторые из своих функций, хотя и гораздо хуже, чем молодые коллеги. Проблема в том, что сенесцентные клетки также приобретают ассоциированный со старением секреторный фенотип (senescence associated secretory phenotype, SASP). Этот фенотип («образ жизни») связан с выделением во внеклеточную среду множества провоспалительных факторов, которые ускоряют старение тканей и приводят к развитию различных заболеваний. Этот процесс наиболее изучен у дермальных фибробластов, и нам известно негативное влияние сенесцентных фибробластов на состояние внеклеточного матрикса. Новое исследование ученых из США и Великобритании показало, что меланоциты в коже зрелых людей также приобретают сенесцентный фенотип. Более того, именно меланоциты предлагается считать основными виновниками старения эпидермиса.
Оказалось, что маркер старения p16 INK4A , который поддерживает жизнеспособность стареющих клеток, препятствуя их апоптозу, экспрессируется практически только сенесцентными меланоцитами. Меланоциты имеют менее эффективную систему репарации ДНК после окислительного повреждения, чем остальные клетки кожи, хотя именно они, как мы уже говорили, являются основными датчиками подобного вида стрессов в коже. Неудивительно, что защитные системы «выключают» пролиферативную активность накопивших повреждения зрелых меланоцитов (хотя и у молодых она невысокая). В молодости любые подобного типа клетки элиминируются иммунной системой, однако с возрастом ее активность также падает, поэтому сенесцентные клетки продолжают жить и «осложнять» жизнь своим соседям.
Так, в экспериментальных моделях секретируемые сенесцентными меланоцитами агенты нарушали деление базальных кератиноцитов, таким образом тормозя обновление клеток эпидермиса, а также вызывали уплощение дермоэпидермального соединения, что приводило к состоянию, аналогичному возрастной атрофии эпидермиса. И вовлечены сюда были механизмы, связанные с негативным воздействием активных форм кислорода на теломеры кератиноцитов. Более того, удаление сенесцентных меланоцитов приводило к восстановлению пролиферации эпидермальных клеток.
Надо отметить, что эти данные были получены не на живых людях, а на кожных эквивалентах. Однако исследование очень интересное и еще раз говорит нам о важности использования солнцезащитных средств, ведь именно ультрафиолет — важнейший фактор, обуславливающий повреждение меланоцитов.
Подробно об особенностях жизнедеятельности меланоцитов, нюансах меланогенеза, а также средствах, которые используются для профилактики и коррекции пигментных дефектов (в том числе солнцезащитных) вы можете прочитать в новой книге из серии Моя специальность косметология «Пигментация в практике косметолога», которая совсем скоро выйдет в свет. Перед началом солнечного сезона это как никогда важная информация. Следите за нашими обновлениями!
Источник:
В статье описаны клинические случаи пациентов с невусом Ота, монгольским пятном. Многие из дермальных меланозов могут быть связаны с риском поражения органов слуха, зрения, нервной системы и развития меланомы. Поэтому таким пациентам необходимо диспансерн
Dermal melanocytosis V. D. Ljah, V. V. Gagiev, M. A. Ufimtseva, I. P. Nikulin, I. N. Vorozhejkina, A. S. Shubina, N. V. Simonova
The article describes the clinical cases of patients with nevus Ota, Mongolian spot. Many of dermal melanosis can be associated with a risk of damage to the organs of hearing, vision, nervous system and melanoma development. Therefore, such patients need dispensary observation and examination by narrow specialists. Methods of laser therapy for dermal melanocytosis are described.
Дермальные меланоцитозы объединяют группу меланоцитарных невусов, локализующихся в дерме, которые возникают в результате неполной миграции меланоцитов из неврального гребня, клинически проявляются интенсивной пигментацией серо-синего цвета. Дермальные меланоцитозы включают невус Ота, невус Ямамото, невус Хори, невус Ито, невус Хидано.
Невус Oтa (син. глазокожный меланоз, факоматоз Oта-Сато, синий офтальмоверхнечелюстной невус) относится к нейрокожным синдромам, представлен односторонним образованием пигментного невуса в области иннервации первой и второй ветвей тройничного нерва [1]. Невус Oтa назван по фамилии японского офтальмолога М. Ota (1939), который опубликовал исследование с клиническим описанием нескольких сот наблюдений невоидного заболевания кожи и глаз, которое назвал «черно-синюшным глазоверхнечелюстным невусом». Новообразование наблюдается преимущественно у лиц монголоидной расы, чаще у женщин. Невус Ота бывает врожденным, может появиться в детстве или в подростковом возрасте. В отличие от монгольского пятна у детей, невус Ота не регрессирует с возрастом [2]. Невус Oтa образован дермальными меланоцитами, которые в процессе эмбриональной миграции из ганглионарной пластинки не достигли эпидермиса, остались в дерме. Клинически проявляется темно-синим или почти черным пятном, равномерной окраски, локализующимся на лице периорбитально, на лбу, щеках, периназально в зоне иннервации I и II ветвей тройничного нерва. Характерно поражение слизистых оболочек глаз, носа, неба, гортани и глотки. В большинстве случаев новообразование располагается с одной стороны лица. По степени выраженности и преимущественной локализации различают четыре типа и два подтипа невуса Ота: 1-й тип — слабо выраженный (подтипы орбитальный и скуловой), 2-й тип — умеренно выраженный, 3-й тип — интенсивный, 4-й тип — двусторонний [1].
Описано сочетание невуса Oтa с нейросенсорной глухотой, гемиатрофией лица, деформацией затылка, врожденной катарактой и глаукомой. Открытоугольная глаукома отмечается в 9% у пациентов с невусом Oтa. F. T. Almeida и соавт. (2018) описали женщину, у которой невус Ота входил в симтомокомплекс пигменто-васкулярного факоматоза, проявляясь пятнами «портвейна», аномальными венами и прогрессирующим увеличением конечности в сочетании с синдромом Клиппеля–Треноне [3]. Крайне редко на месте невуса развивается меланома. S. Shima и соавт. (2018) представили редкий случай супратенториальной менингеальной меланомы, ассоциированной с ипсилатеральным невусом Oтa у 32-летнего мужчины [4].
Диагностика осуществляется на основании типичной картины и локализации невуса, его дифференцировки от меланомы. Проводится дерматоскопия, при необходимости — биопсия. Дерматоскопические признаки включают гомогенную аспидную (синевато-серую) пигментацию. Гистологически выявляются отдельные диффузно в верхнем и в среднем слоях дермы гиперпигментированные дендритные меланоциты, не образующие гнезд (рис. 1).
Невус Хори по клиническим признакам напоминает невус Ота, но имеет двустороннюю симметричную локализацию. R. M. Bhat и соавт. (2014) описали 42-летнего мужчину с невусом Хори, с двусторонней симметричной локализацией сине-серых пятен на коже лица, с поражением слизистой глаз, а также слизистой твердого неба [5]. Отличительной особенностью невуса Хори являются расположение в верхних и средних отделах дермы веретеновидных меланоцитов в отличие от невуса Ота, при котором меланоциты располагаются в средних и нижних слоях дермы.
Невус Ито (невус темно-синий дельтовидно-акромиальный) характеризуется серо-синей пигментацией в надключичных и лопаточных областях. Описано несколько случаев нейросенсорной тугоухости и развития на его месте меланомы [6].
Монгольское пятно (син. врожденный дермальный меланоцитоз, МП) (рис. 2) присутствует с рождения у 80,0–90,0% детей негроидной и монголоидной рас, у детей европеоидной расы встречается крайне редко [1].
Впервые МП описал немецкий профессор E. Baelz в 1885 г. и назвал его «Mongolen Flecke» [7]. Механизм образования МП такой же, как и при невусе Ота. Клиническая картина представлена ограниченным округлым или овальным пятном на задней поверхности нижней части туловища, преимущественно в пояснично-крестцовой области, равномерной тусклой серовато-синюшной или коричневой окраски, реже черной или зеленоватой. Диаметр достигает 5–15 см, но не более 5,0% поверхности тела. Наиболее интенсивная окраска наблюдается в возрасте 1 года, к 7–13 годам пятно исчезает и лишь изредка присутствует у взрослых [1, 7, 8]. Регресс высыпания объясняют тем, что меланоциты находятся в защитной внеклеточной волокнистой оболочке, с течением времени они ее теряют и пятна исчезают. Также исследователи отмечают, что механизмы персистенции дермальных меланоцитов включают в себя наличие избыточного количества факторов, местно-стимулирующих рост меланоцитов, нарушение процессов регуляции пролиферации меланоцитов в эпидермальном меланине и генетические факторы [7].
МП более 10 см могут быть связаны с нейрокристопатией. Термин «нейрокристопатия» относится к расстройству, характеризующемуся нарушениями миграции нейронов, роста и дифференцировки. Наиболее распространенным лизосомальным расстройством памяти, связанным с МП, является болезнь Херлера, сопровождаемая ганглиозидозом GM1. Помимо GM1-ганглиозидоза и мукополисахаридоза типа I (болезнь Херлера), о МП сообщалось в связи с мукополисахаридозом II типа (синдром Хантера), муколипидозом, болезнью Ниманна–Пика и маннозидозом [7, 8].
Невус Ямамото клинически схож с монгольским пятном, но локализуется на туловище или конечностях [5].
Лечение монгольского пятна и невуса Ямамото, как правило, не проводится [9]. M. Shirakawa и соавт. (2012) описали эффективное лечение монгольского пятна широкополосным импульсным светом (515–1200 нм) у семи пациентов в возрасте 0–7 лет [10]. Для удаления невуса Ота, невуса Хори, невуса Ито, невуса Хидано с успехом применяются лазерные технологии [11–13]. Описано эффективное применение лазеротерапии, в том числе лазера Nd:YAG-QS, работающего в диапазоне 1064/532 нм. Исследователи отмечают, что принцип действия лазера Nd:YAG-QS заключается в избирательном действии на пигмент, исключается возможность образования рубцов. Указано, что, в зависимости от интенсивности окраски невуса и его площади, для удаления необходимо провести от 5 до 20 процедур с интервалом в месяц. Y. Liu et al. (2018) в результате ретроспективного исследования, включающего оценку эффективности удаления невуса Ота у 224 пациентов с использованием лазерной системы Nd:YAG-QS, отмечают, что у 99,1% лиц был достигнут 75%-й эффект в среднем после 3,7 процедуры, лишь в 3,6% случаев наблюдался рецидив [14].
В исследовании X. Wen и соавт. (2016) провели оценку эффективности и переносимости удаления билатерального невуса Ота у 17 пациентов с использованием Nd:YAG-QS и Alex-QS (755 нм). Авторы указывают, что, при одинаковой клинической эффективности, переносимость пациентами удаления билатерального невуса Ота с применением лазера Nd:YAG-QS была выше, чем при использовании Alex-QS (755 нм) [15]. Также описано комбинированное использование неабляционного фракционного лазера Er:YAG (2940 нм) и Nd:YAG-QS как эффективный и безопасный метод терапии невуса Хори [16].
Таким образом, дермальные меланоцитозы, локализуясь на открытых участках тела, представляют не только медицинскую, но и социальную проблему, а также обуславливают необходимость обследования пациентов в связи с риском поражения органов слуха, зрения, нервной системы, динамического наблюдения для профилактики развития меланомы.
Литература
- Ламоткин И. А. Онкодерматология: атлас. Учебное пособие. M.: Лаборатория знаний, 2017. 878 с.
- Елькин В. Д., Митюковский Л. С., Лысов А. Ю. Практическая дерматоонкология. Справ. руководство по опухолям кожи, опухолеподобным заболеваниям и связанным с ними синдромам. М.: Практическая медицина, 2014. 480 с.
- Almeida F. T., Caldas R., Duarte M. D. L., Brito C. Port-wine stain as a clue for two rare coexisting entities // BMJ Case Rep. 2018. pii: bcr-2018–225721. DOI: 10.1136/bcr-2018–225721/.
- Shima S., Sato S., Moteki Y., Inoue T., Suzuki K., Niimi Y., Okada Y. Supratentorial Meningeal Melanoma with Nevus of Ota: A Case Report // No Shinkei Geka. 2018. 46 (2). P. 139–145.
- Bhat R. M., Pinto H. P., Dandekeri S., Ambil S. M. Acquired Bilateral Nevus of ota-like Macules with Mucosal Involvement: A New Variant of Hori’s Nevus // Indian J Dermatol. 2014. 59 (3). P. 293–296.
- Krieken J. H., Boom B. W., Scheffer E. Malignant transformation in a naevus of Ito. A case report // Histopathology. 1988.12 (1). P. 100–102.
- Gupta D., Thappa D. M. Mongolian spots // IJDVL. 2013. 79 (4). P. 469–478.
- Gupta D., Thappa D. M. Mongolian spots: How important are they? // World J Clin Cases. 2013. 1 (8). P. 230–232. DOI: 10.12998/wjcc.v1.i8.230.
- Horácek J. Pale blue Yamamoto nevus // Cesk Dermatol. 1974. 49 (1). P. 51–54.
- Shirakawa M., Ozawa T., Tateishi C., Fujii N., Sakahara D., Ishii M. Intense pulsed light therapy for aberrant Mongolian spots // Osaka City Med J. 2012. 58 (2). P. 59–65.
- Wong T. H. S. Picosecond Laser Treatment for Acquired Bilateral Nevus of Ota-like Macules // JAMA Dermatol. 2018. DOI: 10.1001/jamadermatol. 2018.2671.
- Belkin D. A., Jeon H., Weiss E., Brauer J. A., Geronemus R. G. Successful and safe use of Q-switched lasers in the treatment of nevus of Ota in children with phototypes IV–VI // Lasers Surg Med. 2018. 50 (1). P. 56–60.
- Nam J. H., Kim H. S., Choi Y. J., Jung H. J., Kim W. S. Treatment and Classification of Nevus of Ota: A Seven-Year Review of a Single Institution’s Experience // Ann Dermatol. 2017. 29 (4). P. 446–453
- Liu Y., Zeng W., Li D., Wang W., Liu F. A retrospective analysis of the clinical efficacies and recurrence of Q-switched Nd: YAG laser treatment of nevus of Ota in 224 Chinese patients // J Cosmet Laser Ther. 2018. 9. P. 1–5.
- Wen X., Li Y., Jiang X. A randomized, split-face clinical trial of Q-switched alexandrite laser versus Q-switched Nd: YAG laser in the treatment of bilateral nevus of Ota // J Cosmet Laser Ther. 2016. 18 (1). P. 12–15.
- Tian B. W. Novel treatment of Hori’s nevus: A combination of fractional nonablative 2,940-nm Er: YAG and low-fluence 1,064-nm Q-switched Nd: YAG laser // J Cutan Aesthet Surg. 2015. 8 (4). P. 227–229.
В. Д. Лях*,
В. В. Гагиев*,
М. А. Уфимцева** , 1 , доктор медицинских наук
И. П. Никулин*
И. Н. Ворожейкина*
А. С. Шубина**
Н. В. Симонова**
* ФГКУЗ 5 ВКГ ВНГ РФ, Екатеринбург
** ФГБОУ ВО УГМУ МЗ РФ, Екатеринбург
Дермальные меланоцитозы/ В. Д. Лях, В. В. Гагиев, М. А. Уфимцева, И. П. Никулин, И. Н. Ворожейкина, А. С. Шубина, Н. В. Симонова
Для цитирования: Лечащий врач № 11/2018; Номера страниц в выпуске: 24-26
Теги: кожа, монгольское пятно, лазерная терапия
Гипомеланоз – состояние кожных покровов, характеризующееся очаговым уменьшением количества меланина, обусловленным генетическими или некоторыми физическими (ультрафиолетовое воздействие) факторами. Основным симптомом гипомеланоза служит появление на поверхности кожи очагов гипопигментации разных размеров и интенсивности в зависимости от формы заболевания. Диагностика данного состояния осуществляется на основании результатов физикального осмотра, люминесцентного и гистологического исследования. Во многих случаях этиотропное лечение гипомеланоза невозможно, применяют разнообразные местные лекарственные, физиотерапевтические и косметологические процедуры.
Общие сведения
Гипомеланоз является одним из вариантов лейкодермы, при котором по различным причинам нарушается формирование меланина или меланоцитов на отдельных участках кожи. Существует множество форм этого состояния, большую роль в его развитии играют генетические особенности организма. Также в развитии некоторых разновидностей гипомеланоза доказана провоцирующая роль ультрафиолетового излучения, локального переохлаждения, приема некоторых лекарственных средств. В большинстве случаев кожные проявления являются единственным симптомом этого заболевания, но иногда они могут сопровождаться признаками дизэмбриогенеза – поражением центральной нервной системы, пороками развития костей, сердца, половых органов. Встречаемость гипомеланоза оценить довольно сложно, так как нередко больные не обращаются к дерматологу по причине слабой выраженности симптомов.

Причины гипомеланоза
Гипомеланоз разных типов может иметь несколько отличающиеся механизмы развития кожных проявлений. Однако в общем плане это состояние становится следствием нарушения процесса образования меланоцитов (большинство случаев идиопатического гипомеланоза), их повышенного разрушения (при каплевидном гипомеланозе) или нарушения миграции в эмбриональном периоде (гипомеланоз Ито). В результате этого на определенных участках кожных покровов формируются очаги с пониженным содержанием меланоцитов в дерме, что визуально оценивается как осветление с ровными и четкими контурами. Механизмы, которые приводят к таким процессам, досконально не изучены, в некоторых случаях описаны семейные формы гипомеланоза (что доказывает его генетическую природу), но немалую роль играют и внешние факторы среды, такие как ультрафиолетовое излучение.
Также гипомеланоз, особенно у детей, может сопровождать некоторые другие наследственные заболевания и состояния. Наиболее распространенным заболеванием такого типа является синдром Ваандербурга, при котором очаг гипопигментации формируется на голове и выглядит как участок белой кожи со светлыми волосами надо лбом. Другое заболевание – туморозная склеродермия – также характеризуется гипомеланозом в виде небольших очагов, рассыпанных по всему телу. Иногда к одной из форм заболевания относят и витилиго, однако ряд исследователей полагает, что это отдельное дерматологическое состояние, лишь внешне схожее с гипомеланозом. Основной аргумент при этом сводится к тому, что при витилиго пигмент полностью исчезает из очагов поражения кожных покровов, тогда как при гипомеланозе лишь уменьшается его количество.
Классификация гипомеланоза
Существует несколько основных разновидностей гипомеланоза, которые различаются между собой клиническими проявлениями, возрастом дебюта заболевания, причинами и другими факторами. При этом классификация учитывает только те формы этого состояния, которые являются самостоятельными заболеваниями (за исключением гипомеланоза Ито), а не сопровождают другие наследственные и иные патологии. Таким образом, выделяют следующие основные формы гипомеланоза:
1. Каплевидный гипомеланоз – является наиболее распространенной формой данного состояния. Он возникает преимущественно у женщин старше 30-ти лет, которые имеют 1-3 тип кожи – то есть, светлый оттенок с низким содержанием меланина. Достоверно установлено, что каплевидный гипомеланоз провоцируется длительным воздействием ультрафиолетового излучения или солнечного света. Предполагается, что эти факторы ускоряют разрушение меланоцитов на определенных участках кожи, а восполнение их потери происходит намного медленнее, из-за чего общее количество пигментных клеток в конечном итоге уменьшается. Также найдена взаимосвязь между развитием каплевидного гипомеланоза и одной из форм лейкоцитарного антигена (HLA-DR8), что может указать на участие иммунных механизмов в развитии данного состояния.
2. Гипомеланоз Ито – генетическое заболевание, преимущественно спорадического происхождения, но описаны и наследственные формы. Кожные проявления при этом состоянии выглядят как полосы зигзагообразной или волнистой формы различных размеров и локализации. Причиной гипомеланоза Ито являются нарушения процесса эмбриогенеза – миграции клеток-предшественников меланоцитов из нервной трубки в будущие ткани кожи во II-III триместре беременности. Примерно в это же время происходит и формирование центральной нервной системы, которое также нарушается. Это приводит к тому, что гипомеланоз Ито сопровождается многочисленными неврологическими нарушениями и другими пороками развития.
3. Идиопатический гипомеланоз – в дерматологии к нему относят практически все формы данного состояния с неясным происхождением. Предполагается, что это разнородная группа нарушений пигментации кожи, суть которых лежит в нарушении одного из этапов миграции или дифференцировки меланоцитов. Иногда выделяют идиопатический каплевидный гипомеланоз, который схож по своим проявлениям с классической одноименной формой, но обусловлен не разрушением, а замедлением формирования новых меланоцитов.
Некоторые дерматологи могут выделять дополнительные формы и разновидности гипомеланоза, но на сегодняшний день вышеуказанная классификация считается общепринятой.
Симптомы гипомеланоза
Общим для всех типов гипомеланоза является появление более светлых участков кожных покровов различного размера, формы и локализации. Если они располагаются на коже, имеющей волосяной покров (голова, лицо у мужчин, паховая область), то волосы на этих участках также теряют пигмент и становятся светлыми. Практически все формы заболевания (за исключением гипомеланоза Ито) сопровождаются только кожными проявлениями и не вызывают иных симптомов или поражений органов.
Каплевидный гипомеланоз возникает у женщин в возрасте 30-50 лет, которые часто подвергали кожу длительной инсоляции. Первые очаги пониженной пигментации возникают на голенях в области разгибательной поверхности коленей, они имеют форму кругов или овалов диаметром до 1-го сантиметра. Постепенно возникают очаги на предплечьях и туловище (спина, живот, область груди), распространения гипопигментации на шею и лицо при каплевидном гипомеланозе чаще всего не происходит. Распространение очагов ускоряется при воздействии ультрафиолетового излучения (в солярии) и солнечного света, в некоторых случаях увеличение площади поражения кожи может быть обусловлено обменными нарушениями.
Гипомеланоз Ито зачастую возникает еще в детстве, с равной степенью вероятности поражает как мужчин, так и женщин. Участки пониженной пигментации в виде линий и зигзагов возникают по всему телу в первые недели и месяцы жизни, их размеры и интенсивность могут варьироваться у разных больных. Однако по мере роста ребенка их выраженность постепенно снижается, а в подростковом периоде они могут совсем исчезнуть. Гипомеланоз Ито более опасен своими неврологическими симптомами – эпилептическими припадками, умственной отсталостью. Судорожные приступы при этой патологии часто бывают упорными и очень плохо реагируют на традиционные противосудорожные препараты. Дети с гипомеланозом Ито могут страдать от аутизма и двигательной расторможенности. Помимо этого возможны многочисленные пороки развития скелета и других органов – макроцефалия, искривление позвоночника, деформации стоп, аномалии развития половых органов, глаз, зубов.
Идиопатический гипомеланоз характеризуется значительным разнообразием симптомов, так как у него может быть множество механизмов развития. Это могут быть небольшие округлые пятна по типу каплевидной формы (идиопатический каплевидный гипомеланоз), более обширные по площади очаги, участки осветления волос и многое другое. Возраст развития проявлений этой разновидности гипопигментации кожи также очень вариабелен – от младенчества до взрослого. Именно поэтому идиопатический гипомеланоз очень сложно дифференцировать от других состояний, сопровождающихся потерей кожных пигментов – частичного альбинизма, витилиго.
Диагностика гипомеланоза
Диагностика гипомеланоза в дерматологии производится на основании результатов осмотра пациента, в том числе при помощи лампы Вуда, а также в спорных случаях - гистологического изучения тканей участка гипопигментации. При осмотре выявляются очаги с более светлой, чем окружающая кожа, окраской и ровными четкими контурами. Последнее многими дерматологами расценивается как патогномоничный признак гипомеланоза в отличие от других форм лейкодермии. Для подтверждения этого можно произвести дополнительный осмотр с применением лампы Вуда с лупой – в ультрафиолетовых лучах намного лучше можно увидеть границу между неизмененной кожей и очагом пониженной пигментации.
Если появляется необходимость в дополнительном гистологическом исследовании, то производят биопсию кожи в очаге гипомеланоза. При микроскопическом рассмотрении будет видно уменьшение количества меланоцитов относительно нормы. Кроме того, при некоторых формах идиопатического гипомеланоза можно заметить деградацию отростков этих клеток. Это дополнительно усугубляет процессы депигментации кожи, что и является причиной развития заболевания. При гипомеланозе Ито диагностика также включает в себя МРТ головного мозга, оценку основных неврологических функций. В ряде случаев обнаруживаются очаговые изменения мозговой ткани, увеличение боковых желудочков, нарушения на электроэнцефалограмме.
Лечение и прогноз гипомеланоза
Этиотропного лечения гипомеланоза не существует, в основном терапия сводится к попыткам устранить пигментные нарушения местными средствами. Для этого используют внутрикожные инъекции кортикостероидов (для усиления активности меланогенеза) непосредственно в очаги пониженной пигментации. Аналогично используют ретиноиды, а также препарат на основе экстракта плаценты. Последний за счет высокого содержания биогенных стимуляторов активизирует процессы образования меланоцитов. Однако эффективность всех вышеперечисленных мер неодинакова у разных больных, поэтому перспективы выздоровления от гипомеланоза довольно неоднозначны.
Прогноз гипомеланоза относительно жизни пациента благоприятный (за исключением тяжелых форм гипомеланоза Ито), однако в плане выздоровления он неопределенный. Профилактика каплевидной формы заболевания заключается в отказе от злоупотребления солнечными ваннами и посещением солярия, особенно это касается женщин со светлой кожей. В отношении других форм гипомеланоза большую роль играют генетические факторы и нарушения эмбриогенеза, поэтому их эффективной профилактики не существует.
Токсическая меланодермия (меланоз Риля) – меланотический профессиональный дерматоз, вызываемый токсическим действием продуктов нефти, каменного угля и фотосенсибилизацией. Особенностью заболевания является возможность возникновения, как на производстве, так и в быту, при использовании печного отопления, обогрева керосином, газом. Дерматоз протекает стадийно, первым проявлением меланодермии становится сетчатая пигментация кожи синевато-коричневого оттенка с последующим развитием кератоза и атрофии. Патология диагностируется клинически с установлением профвредности. Лечение заключается в устранении провоцирующего фактора с подключением витаминотерапии, гепатопротекторов, энтеросорбентов, фотозащиты.
Общие сведения
Токсическая меланодермия – одна из редких разновидностей профессионального меланоза, возникающая на фоне интоксикации углеводородами и фотосенсибилизации. В отличие от других профессиональных дерматозов заболевание не обладает возрастными рамками из-за возможности возникновения в быту. Патологический процесс неэндемичен, не имеет возрастных и расовых различий, при этом причиной возникновения всегда является контакт пациента с вредным веществом. Профдерматоз развивается преимущественно в нефтедобывающих и нефтеперерабатывающих странах у рабочих НПЗ, нефтегазовой отрасли. Впервые описание заболевания появилось в дерматологии в 1917 году, когда венгерский врач Г. Риль выявил 17 случаев дерматоза, связав их с лишениями военного времени. Через два года Э. Хоффман предположил, что причина патологических проявлений связана с контактом пациентов с вредными веществами, ещё через год Р. Габерманн доказал, что токсическая меланодермия является результатом воздействия паров пыли, насыщенных акридином.
Французский дерматолог А. Сиватт в 1923 году описал идентичные клинические проявления, связав их с фотосенсибилизацией. С тех пор дерматологи не могут прийти к консенсусу по вопросу, чем являются заболевания с похожей симптоматикой – разновидностями токсической меланодермии или самостоятельными нозологиями. Актуальность темы связана с ростом заболеваемости в результате развития нефтеперерабатывающего комплекса, с экономическими потерями государств в случаях утраты работоспособности пациентами, страдающими данной патологией, нарушением их качества жизни.

Причины токсической меланодермии
Профессиональные триггеры заболевания известны, ими являются вещества, вызывающие фототоксические реакции: продукты нефтеперегонки, недоброкачественная парфюмерия, гиперинсоляция. Имеет значение и внутреннее состояние организма пациента: недостаток витаминов, патология пищеварительного тракта, вредные привычки. Механизм развития до конца не изучен. Считается, что меланогенез в норме является адаптацией организма к изменениям в окружающей среде. При развитии патологических процессов образования меланина в 60% случаев имеет значение чрезмерное ультрафиолетовое излучение, в 20% – беременность и в 20% – эндокринологические нарушения, не связанные с беременностью.
В первом случае кератиноциты, получившие меланин от меланоцитов, выносят его на поверхность в составе роговых клеток, что визуально проявляется пигментацией кожи. Во втором случае гипоталамо-гипофизарная система стимулирует дисперсию и перемещение меланина из меланоцитов в кератиноциты, которые сами по себе деструктированы. Поэтому одновременно с гиперпигментацией кожи наблюдаются гиперкератоз и явления воспаления.
Поскольку кожа гормонозависима, нарушения в гормональной системе вызывают гипермитотическую активность меланоцитов и кератиноцитов эпидермиса, которые, обмениваясь меланином, инициируют воспаление кожи и её гиперпигментацию. Т-лимфоциты при этом дополнительно сенсибилизируют дерму, разрушая её клетки, провоцируя выброс в дерму цитокинов, интерлейкинов, стимулируя процессы воспаления и пролиферации. Так «каскадно» развивается токсическая меланодермия.
Классификация и симптомы токсической меланодермии
Единого мнения о классификации патологического процесса в современной дерматологии не существует. По первичным элементам выделяют узелковую, буллёзную и смешанную меланодермию. Что касается клинических проявлений, то некоторые дерматологи считают вариантами, точнее – разными стадиями развития токсической меланодермии пойкилодермию Сиватта и меланоз Габерманна-Гоффманна, однако большинство авторов придерживаются мнения о самостоятельности этих нозологий. Специалисты полагают, что с учетом механизма развития токсическая меланодермия вместе с пойкилодермией Сиватта и меланозом Габерманна-Гоффманна входит в большую группу меланоза (его токсическую ретикулярную разновидность), и все перечисленные патологии должны рассматриваться как самостоятельные заболевания.
Болезнь развивается медленно. Дерматологи выделяют три стадии клинического течения токсической меланодермии: эритематозную, пигментную, атрофическую. Первичным элементом клинических проявлений патологического процесса является эритема, которая трансформируется в сетчатую буро-синюшную гиперпигментацию в виде небольших пятен, имеющих тенденцию к росту и слиянию, на открытых участках кожного покрова, особенно в области висков. На поверхности пятен появляются кистозно расширенные капилляры в виде мелких шелушащихся узелков. Гиперпигментированная кожа утолщается, кожный рисунок усиливается, образуются пустулы с исходом в атрофию кожи. Иногда в процесс вовлекаются слизистые. Высыпания сопровождаются продромальными явлениями, из-за нарушения обменных процессов пациент теряет вес. Иногда присутствует неинтенсивный зуд.
Диагностика и лечение токсической меланодермии
Диагноз заболевания ставит дерматолог на основании анамнеза (установление причины дерматоза, выявлении профвредности), клинических и гистологических данных: гиперкератоза, акантоза, скопления меланина в эпидермисе, периваскулярного инфильтрата в дерме. Дифференциальный диагноз проводят с другими меланодермиями, гемохроматозом, пеллагрой, пигментными фотодерматитами, болезнью Аддисона, мышьяковой дисхромией. Лечение состоит в устранении причины, вызвавшей патологический процесс, курсовой витаминотерапии с использованием гепатопротекторов и энтеросорбентов, корректировке обменных процессов. Наружно применяют средства фотозащиты, кератолитические, противовоспалительные и отшелушивающие мази, отбеливающие кожу препараты. Показано соблюдение специальной диеты, насыщенной витаминами и минералами. В качестве профилактики проводят регулярные профосмотры на производстве, улучшают условия труда, пациентов с выявленной токсической меланодермией переводят на другую работу вне контакта с профвредностями. Большое значение в профилактике заболевания принадлежит экспертизе трудоспособности.
Читайте также:

