При красной волчанке бады
Обновлено: 17.04.2024
Цель: Описать схемы терапии АГ при СКВ, определить факторы, ассоциированные с неконтролируемой АГ.
Дизайн: Кросс-секционное исследование.
Методы: Для участия в исследовании по электронной базе клиник McGill Lupus отбирались пациенты, посетившие врача в период с января 2018 по май 2019 и принимавшие гипотензивные препараты. Из исследования исключались пациенты, получавшие гипотензивную терапию по поводу других патологий (например болезнь Рейно). Частота неконтролируемой АГ определялась согласно рекомендациям Канадского и Американского института кардиологии/Американской ассоциации кардиологов. Расчет методом многомерной логистической регрессии (с поправкой на возраст, пол и расу/этническую принадлежность) проводился в том случае, если неконтролируемая АГ сочеталась с высоким индексом массы тела (ИМТ), высокой длительность СКВ, высокой активностью заболевания, наличием повреждения почек, комбинацией из нескольких гипотензивных препаратов, терапией преднизолоном и нестероидными противовоспалительными препаратами (НПВС).
Результаты: Из 442 пациентов с СКВ, 108 получали гипотензивные препараты и 38 принимали комбинированную терапию. Наиболее часто встречались антагонисты рецепторов ангиотензина II, далее следовали блокаторы кальциевых каналов, диуретики, ингибиторы ангиотензин-превращающего фермента и бета блокаторы. Среди 108 пациентов 39.8% (n=43) имели артериальное давление (АД) >140/90 мм.рт.ст., 66.7% (n=72) - АД >130/80 мм.рт.ст. Мультивариантный анализ показал, что неконтролируемая АГ чаще встречается у европеоидов (ОШ 2.72, 95% ДИ, от 1.12 до 6.78) и лиц с высоким ИМТ (ОШ 1.08, 95% ДИ, от 1.00 до 1.19). У пациентов с повреждением почек АГ контролировалась лучше (ОШ 0.39, 95% ДИ. от 0.16 до 0.97). Обнаружить связь с другими переменными не удалось.
Выводы: Неконтролируемая АГ чаще встречается у европеоидов и пациентов с ожирением. Наличие отрицательной связи с повреждением почек обнадеживает, так как контролируемое АД является ключевым фактором защиты почек.
Чтобы исследовать состояние у пациентов с СКВ, которые принимали или недавно прекратили принимать противомалярийные препараты, исследователи выявили 1573 потенциальных участника из долгосрочного наблюдательного когортного исследования в университетской клинике.
Из этой многочисленной группы было выделено 88 клинических случаев - пациентов, которые достигли клинической ремиссии в течение как минимум года и прекратили прием противомалярийной терапии.
Первая контрольная группа была представлена пациентами, которые достигли ремиссии и продолжали принимать лекарства. Также был произведен второй контроль, в результате чего общее количество участников исследования составило 173.
Все пациенты наблюдались не менее 2 лет.
Обострение СКВ было определено как любое увеличение показателей по шкале SLEDAI-2K, при значительном обострении – превышение нормы на 4 или более баллов.
Средний возраст исследуемых составил 44 года, средний возраст в контрольной группе - 46 лет.
Представителями обеих групп были преимущественно белокожие женщины.
Причины отмены препаратов включали собственную инициативу, ремиссию, а также токсическое повреждение сетчатки, кожи, слизистых оболочек и органов сердечно-сосудистой системы.
20 участников экспериментальной группы сообщили о неблагоприятных побочных эффектах противомалярийных препаратов, связанных с их высоким профилем токсичности.
Врачи также сравнили результаты 26 пожилых пациентов с волчанкой, которые принимали гидроксихлорохин в течение как минимум 5 лет до момента прекращения приема препарата, с 32 пациентами контрольной группы, которые продолжали принимать гидроксихлорохин на момент исследования.
Обострение СКВ произошло в 61,4% случаев по сравнению с 45,1% в контрольной группе (P = 0,002), причем наиболее распространенными вариантами обострений были обострения со стороны кожи и скелетно-мышечной системы.
После многомерного анализа риск обострения более чем в два раза возрастал у тех, кто прекратил лечение (отношение шансов, 2,26; 95% доверительный интервал, 1,24–4,11; P = 0,008).
Более чем в половине случаев (n = 46) противомалярийные препараты возобновляли после отмены, что в основном было связано с обострением заболевания.
Из группы пациентов, возобновивших лечение в связи с обострением СКВ: у 88% вновь был достигнут контроль над заболеванием \ произошло улучшение состояния, у оставшихся 12% случились новые обострения.
Из 88 пациентов 51 пациент резко прекратили прием терапии тогда, как 37 пациентов отмену препаратов производили постепенно.
У пациентов, придерживающихся постепенной отмены, было меньше обострений (45,9%) по сравнению с пациентами, прекратившими лечение внезапно (72,6%).
После многофакторного анализа риск обострения более чем в три раза увеличился для группы внезапной отмены лекарств (OR 3,42; 95% ДИ 1,26-9,26; P = 0,016).
Пациенты, снизившие дозу противомалярийных препаратов, позднее возобновили полноценную терапию по сравнению с группой резкой отмены лекарств (37,8% против 62,7%; P = 0,02).
Только у 5 пожилых пациентов из каждой группы - 19,2% в группе отмены и 15,6% в группе пролонгирования терапии произошел эпизод обострения СКВ (OR 1,28; 95% ДИ 0,31-5,30; P = 0,73). Большинство обострений были кожными и скелетно-мышечными по своей природе; ни в одной из групп не было развития серьезных патологических состояний.
Медленное снижение дозы или продолжение приема противомалярийных препаратов может помочь предотвратить обострение болезни у пациентов с СКВ, достигших клинической ремиссии в течение как минимум года.
У пожилых пациентов с СКВ, которые постепенно прекращают прием гидроксихлорохина, также отсутствует повышенный риск обострения болезни.
Полвека кряду это аутоиммунное заболевание оставалось без специфической фармакотерапии.

Несмотря на множество проведенных клинических испытаний экспериментальной терапии системной красной волчанки, только одно таргетное лекарственное средство, белимумаб (belimumab), смогло за минувшие 60 лет добиться регуляторного одобрения. Разработка новых препаратов связана с рядом проблемных факторов, включающих вопросы к протоколам клинических исследований и гетерогенность пациентской популяции. Особенно удручает нехватка достоверных показателей эффективности лечения.
Так, для системной красной волчанки не предложено ни надежного золотого стандарта измерения активности заболевания, ни унифицированного способа оценки ответа на терапию. Фактически разработка лекарств движется быстрее, чем разработка методов анализа их эффективности. Зачастую фармкомпаниям приходится внедрять собственные конечные точки результативности лечения, являющиеся, впрочем, модификациями хорошо известных инструментов, и потому существует весомый риск, что какой-либо препарат-кандидат, который в действительности работает, не уложится в существующие каноны регуляторов ввиду негибкости их парадигм одобрения новых медикаментов.
В минувшем 2018 году из восьми препаратов-кандидатов, дошедших до клинических испытаний фазы II или III, лишь одному удалось показать статистически значимую эффективность терапии системной красной волчанки. «Олумиант» (Olumiant, барицитиниб) — пероральный ингибитор Янус-киназ 1 и 2 (JAK1 и JAK2) авторства «Илай Лилли» (Eli Lilly) и «Инсайт» (Incyte), уже одобренный при умеренно-тяжелом ревматоидном артрите, — продемонстрировал улучшение признаков и симптомов заболевания, однако только в наивысшей 4-мг дозе, которой сопутствовали отрицательные побочные реакции: серьезные инфекции, нейтропения, ухудшение липидных параметров, рост сывороточной креатинфосфокиназы. Пока неизвестно, насколько польза перевешивает риски.
Узнать подробности
Baricitinib for systemic lupus erythematosus: a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet 2018; 392: 222–31. [PDF ] [источник ]
A double-blind, randomized, placebo-controlled, phase II trial of baricitinib for systemic lupus erythematosus: how to optimize lupus trials to examine effects on cutaneous lupus erythematosus. Br J Dermatol. 2019 May; 180(5): 964–965. [PDF ] [источник ]
Тем не менее фармотрасль вплотную подошла к тому, чтобы предложить новые и весьма эффективные лекарственные препараты против системной красной волчанки. Рассмотрим некоторые из них.

Системная красная волчанка
Системная красная волчанка (SLE) — хроническое гетерогенное аутоиммунное заболевание соединительной ткани, характеризующееся наличием аутоантител против ядерных антигенов, ремиссиями и обострениями, а также чрезвычайно изменчивыми клинической картиной, течением болезни и ее прогнозом. Патология может поражать почти любой орган, включая почки, кожу, опорно-двигательный аппарат, сердечно-сосудистую систему, центральную и периферическую нервную систему, кровь. Заболеванию чаще подвержены женщины. Причина остается неизвестной: считается, что развитию системной красной волчанки способствует потеря аутотолерантности, приводящая к аутоиммунным реакциям, у генетически предрасположенных лиц после воздействия определенных факторов окружающей среды в условиях иммунологической и гормональной нестабильности.
Терапия системной красной волчанки направлена на минимизацию органных повреждений, предотвращение обострений в периоды стабильности, оптимизацию качества жизни пациентов. Среди назначаемых препаратов: противомалярийные (гидроксихлорохин), глюкокортикостероиды (преднизон/преднизолон, метилпреднизолон), иммуномодуляторы и иммуносупрессанты (метотрексат, азатиоприн, микофенолата мофетил, циклофосфамид).
Если нет ответа на первую линию терапию, применяют «Бенлиста» (Benlysta, белимумаб) — одобренное в марте 2011 года моноклональное антитело разработки «Хьюман джиноум сайенсиз» (Human Genome Sciences), впоследствии купленной «ГлаксоСмитКляйн» (GlaxoSmithKline). Белимумаб блокирует связывание растворимого фактора активации B-лимфоцитов (BAFF), также известного как стимулятор B-лимфоцитов (BLyS), со своими рецепторами на B-клетках, что приводит к подавлению выживаемости последних, включая патологические аутореактивные, и сдерживает дифференцировку B-клеток в продуцирующие иммуноглобулины плазматические клетки. Вне инструкции используют «Ритуксан»/«Мабтеру» (Rituximab/MabThera, ритуксимаб).
К слову, «Бенлиста» добился положительного регуляторного вердикта без оглядки на провал одного из регистрационных клинических исследований — так велика потребность в новых способах лечения волчанки. Но выход на фактически пустой рынок не всегда означает коммерческий успех: к примеру, в 2018 году, то есть после семи полных лет нахождения в продаже, белимумаб заработал 473 млн фунтов (629 млн долларов), а в 2019-м — 613 млн фунтов (785 млн долларов). Хотя на момент дебюта препарата предсказывалось, что в 2016 году его реализация достигнет внушительных 2,8 млрд долларов. Сейчас, когда с июля 2017 года «Бенлиста» доступен в рецептуре подкожного автоинъектора, спрос на него к 2023 году должен, согласно отраслевым прогнозам, наконец-то перейти бестселлерную отметку в 1 млрд долларов.
В декабре 2020 года «Бенлиста» стал первым одобренным специфическим препаратом для лечения волчаночного нефрита — очень серьезного осложнения системной красной волчанки.
Анифролумаб
«АстраЗенека» (AstraZeneca) раскрыла результаты опорных клинических испытаний экспериментального анифролумаба (anifrolumab), проверенного в терапии умеренно-тяжелой системной красной волчанки. Положительные итоги позволяют надеяться, что препарат, регистрационное досье которого будет отправлено во второй половине 2020 года, появится на рынке не позднее 2021-го, став вторым за минувшие 60 лет новым лекарственным средством, эффективно справляющимся с этим заболеванием.
Анифролумаб (anifrolumab) — полностью человеческое моноклональное антитело, связывающее субъединицу 1 интерферонового рецептора типа I (IFNAR1), и тем самым, в отличие от множества антител только против интерферона альфа (IFN-α), блокирующее все интерфероны типа I, включая IFN-α, интерферон бета (IFN-β) и интерферон омега (IFN-ω). Указанные цитокины вовлечены в воспалительные сигнальные пути. Приблизительно 60–80% пациентов с системной красной волчанкой характеризуются усиленным профилем экспрессии генов, регулирующих интерфероны типа I, что напрямую коррелирует с активностью заболевания.
Клиническое исследование TULIP 2 (NCT02446899) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) охватило взрослых пациентов (n=365) с активной умеренно-тяжелой системной красной волчанкой с наличием аутоантител. Участники получали стандартное лечение. Каждые четыре недели внутривенно назначали анифролумаб в дозе 300 мг или плацебо. Первичная конечная точка была установлена пропорцией пациентов, по истечении 52 недель терапии показавших ответ, установленный композитным показателем на базе индекса Британской группы по изучению системной красной волчанки (BICLA).
В группе анифролумаба к первичной конечной точке вышли 47,8% пациентов против 31,5% в группе плацебо, что оказалась статистически и клинически значимым (p=0,001). Анифролумаб также обеспечил статистически значимое расхождение с контрольной группой в отношении ряда вторичных конечных точек, включая уменьшение необходимости применения пероральных кортикостероидов (p=0,014) и снижение индекса распространенности и степени тяжести кожной красной волчанки (CLASI) [p=0,039]. Назначение анифролумаба отметилось численно меньшим количеством обострений заболевания в пересчете на год: 0,43 против 0,64 (p=0,081).


Профиль безопасности анифролумаба выдал повышенную частоту развития опоясывающего лишая (Herpes zoster), который, всё же носил легко-умеренную степень выраженности, был исключительно кожным и проходил после антивирусной терапии.
Узнать подробности
Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med. 2020 Jan 16;382(3):211-221. [PDF ] [источник ]
Впрочем, не всё так радужно: в августе 2018 года анифролумаб провалил аналогичное по дизайну клиническое исследование TULIP 1 (NCT02446912) фазы III, когда у него не получилось достичь первичной конечной точки, оформленной пропорцией участников, показавших снижение индекса активности заболевания SLEDAI-2K как минимум на 4 балла (SRI-4) вкупе с другими обязательными условиями.
Узнать подробности
«АстраЗенека», мгновенно сориентировавшаяся, поменяла в TULIP 2 первичную конечную точку на BICLA. И, как утверждается, последующий анализ собранных в TULIP 1 данных установил непротиворечивость эффективности анифролумаба по отношению к TULIP 2, если отталкиваться от нового показателя результативности. Опять же, отрасль продолжает дискутировать, какой из показателей эффективности лечения системной красной волчанки, BICLA или SRI-4, более гармоничен: если первый требует фиксации только частичных улучшений, зато справедливых для всех органов, то второй оценивает полный ответ, но лишь для некоторых симптомов системной красной волчанки.
Узнать подробности
Anifrolumab in lupus: the promise and the caution – Author’s reply. [PDF ] [источник ]
Anifrolumab, a monoclonal antibody to the type I interferon receptor subunit 1, for the treatment of systemic lupus erythematosus: an overview from clinical trials. Mod Rheumatol. 2020 Sep 17;1-12. [PDF ] [источник ]
Efficacy of anifrolumab in systemic lupus erythematosus: a critical analysis of the TULIP trials. Lupus. 2020 Jul;29(8):1002-1003. [PDF ] [источник ]
Spotlight on anifrolumab and its potential for the treatment of moderate-to-severe systemic lupus erythematosus: evidence to date. [PDF ] [источник ]
Параллельно «АстраЗенека» проверяет пригодность анифролумаба в терапии волчаночного нефрита.
Анализ объединенного пула данных, собранных в TULIP 1 и TULIP 2, подтвердил клиническую состоятельность анифролумаба для лечения системной красной волчанки.
Узнать подробности
Early and sustained responses with anifrolumab treatment in patients with active systemic lupus erythematosus (SLE) in 2 phase 3 trials. [PDF ] [источник ]
Efficacy of anifrolumab in active systemic lupus erythematosus: patient subgroup analysis of BICLA response in 2 phase 3 trials. [PDF ] [источник ]
Flare assessments in patients with active systemic lupus erythematosus treated with anifrolumab in 2 phase 3 trials. [PDF ] [источник ]
Ценеримод
Швейцарская «Айдорсиа фармасьютикалс» (Idorsia Pharmaceuticals), запущенная основателями «Актелион фармасьютикалс» (Actelion Pharmaceuticals), после того как ее в 2018 году купила «Джонсон энд Джонсон» за внушительных 30 млрд долларов наличными, сообщила об успехах экспериментального ценеримода (cenerimod).


Узнать подробности
First use of cenerimod, a selective S1P1 receptor modulator, for the treatment of SLE: a double-blind, randomised, placebo-controlled, proof-of-concept study. Lupus Sci Med. 2019; 6(1): e000354. [PDF ] [источник ]
Ценеримод (cenerimod) представляет собой пероральный избирательный агонист сфингозин-1-фосфатных рецепторов подтипа 1 (S1PR1). Ценеримод, связываясь с S1PR1 на поверхности T- и B-лимфоцитов, приводит к интернализации первого, тем самым последние теряют способность считывать градиент сфингозин-1-фосфата (S1P), циркулирующего в периферической крови, и перестают мигрировать из лимфоузлов в направлении высокой концентрации S1P. Ценеримод, сдерживая выход лимфоцитов из вторичных лимфоидных органов, не дает им мигрировать к местам воспаления.
Эффективность S1P-модулирования доказана на примере лекарственных средств, применяемых в терапии рассеянного склероза, таких как «Гилениа» (Gilenya, финголимод) и «Майзент» (Mayzent, сипонимод), а также грядущих озанимода (ozanimod) и понесимода (ponesimod). Что важно, ценеримод не приводит к расхожим для данной группы препаратов побочным эффектам вроде индуцирования бронхоспазма и вазоконстрикции.
Телитацицепт
Китайская «Римиджин» (RemeGen), входящая в состав «Яньтай Жунчан фармасьютикал» (Yantai Rongchang Pharmaceutical), уведомила о благоприятных исходах клинического испытания APRIL (NCT02885610) фазы IIb (рандомизированного, двойного слепого, плацебо-контролируемого, многоцентрового) экспериментального телитацицепта (telitacicept). Взрослым пациентам (n=249) с умеренно-тяжелой системной красной волчанкой на протяжении 48 недель еженедельно подкожно назначали препарат-кандидат (80, 160 или 240 мг) либо плацебо — на фоне стандартной терапии. Первичная конечная точка была установлена пропорцией участников, отметившихся снижением индекса активности заболевания SELENA-SLEDAI как минимум на 4 балла (SRI-4) вкупе с другими обязательными условиями.


Телитацицепт (telitacicept, RC18) — рекомбинантный гибридный белок, состоящий из внеклеточного домена рецептора трансмембранного активатора и партнера кальциевого модулятора и лиганда циклофилина (TACI) и Fc-домена иммуноглобулина IgG человека. Телитацицепт, нейтрализуя BAFF и индуцирующий пролиферацию лиганд (APRIL), подавляет развитие и выживаемость зрелых B-клеток, тем самым препятствуя образованию аутоантител, что является основополагающим в патофизиологии аутоиммунных воспалительных заболеваний.
Телитацицепт проходит параллельную проверку в терапии множества других аутоиммунных патологий: ревматоидного артрита, нейромиелита зрительного нерва со спектральным расстройством, рассеянного склероза, IgA-нефропатии (болезнь Берже), миастении гравис, синдрома Шегрена.
Ригеримод
Британская «Имьюфарма» (ImmuPharma) продолжает верить в силу экспериментального иммуномодулятора «Люпузор» (Lupuzor, ригеримод), над которым трудится уже свыше полутора десятков лет. Результаты, однако, не столь очевидны.
52-недельное клиническое испытание LUPUZOR (NCT02504645) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) не выявило статистически значимой разницы с плацебо (p=0,2631) в отношении улучшения индекса активности системной красной волчанки SRI-4 — как утверждается, ввиду чрезмерно высокого ответа в контрольной группе. Хотя среди пациентов с аутоантителами против dsDNA ригеримод продемонстрировал явное превосходство (p=0,0967). Дальнейший анализ собранных данных вскрыл , что в европейской популяции больных с dsDNA-аутоантителами «Люпузор» статистически значимо обошел плацебо (p=0,0218). Дополнительная проверка подтвердила как безопасность, так и эффективность ригеримода, назначаемого подкожно раз в четыре недели на фоне стандартного лечения.
Ригеримод (rigerimod, IPP-201101, P140) — полипептид, соответствующий последовательности 131–151 малого ядерного нуклеопротеина и компонента сплайсосомы snRNP70 с фосфорилированным серином в позиции 140. Механизм действия ригеримода до конца не ясен, но, есть мнение, что он выступает иммуномодулятором: путем связывания с главным комплексом гистосовместимости (MHC) класса II осуществляется подавление T-клеточной реактивности с сопутствующим восстановлением иммунной толерантности. Не исключено, одним из центральных эффектов ригеримода является аутофагия: лекарственное соединение вмешивается в сигнальный путь лизосомальной деградации, вызывая нестабильность MHCII-молекул, которые должны презентировать эндогенные антигены аутореактивным T-клеткам; при этом работа нормальных лимфоцитов не затрагивается. На мышиных моделях показано , что ригеримод сдерживает протеинурию, васкулит и дерматит, препятствует выработке аутоантител против dsDNA.
Устекинумаб
«Янссен» (Janssen), принадлежащая «Джонсон энд Джонсон» (Johnson & Johnson), сделала ставку на «Стелара» (Stelara, устекинумаб), уже разрешенный в терапии бляшечного псориаза, псориатического артрита, болезни Крона, неспецифического язвенного колита.
В клиническом испытании NCT02349061 фазы II (рандомизированном, двойном слепом, плацебо-контролируемом, многоцентровом, международном) среди взрослых пациентов (n=102) с умеренно-тяжелой системной красной волчанкой назначение устекинумаба поверх стандартной терапии привело к тому, что по истечении 24 недель 62% участников добрались до показателя SRI-4 — против 33% больных в контрольной группе (p=0,006). Указанное достижение сохранилось по прошествии 48 недель у 63,3% участников, получавших устекинумаб.
Узнать подробности
Efficacy and safety of ustekinumab, an IL-12 and IL-23 inhibitor, in patients with active systemic lupus erythematosus: results of a multicentre, double-blind, phase 2, randomised, controlled study. Lancet. 2018 Oct 13;392(10155):1330-1339. [PDF ] [источник ]
Maintenance of Efficacy and Safety of Ustekinumab Through One Year in a Phase II Multicenter, Prospective, Randomized, Double-Blind, Placebo-Controlled Crossover Trial of Patients With Active Systemic Lupus Erythematosus. Arthritis Rheumatol. 2020 May;72(5):761-768. [PDF ] [источник ]
Энтузиазм следует умерить до подведения итогов продолжающегося клинического исследования NCT03517722 фазы III, поскольку чрезвычайно гетерогенная природа волчанки зачастую не оставляет шансов на успех в ходе завершающей проверки.
Устекинумаб (ustekinumab) — полностью человеческое моноклональное антитело, которое связывается с белковой p40-субъединицей, общей для интерлейкина 12 (IL-12) и интерлейкина 23 (IL-23). Считается, что оба этих цитокина вовлечены в патогенез системной красной волчанки: IL-12 необходим для клеточного развития T-хелперов типа 1 (Th1) и фолликулярных T-хелперов (TFH), а также цитотоксической T-клеточной активации и функционирования, а IL-23 отвечает за экспансию и выживаемость патогенных Th17 и других клеток, продуцирующих интерлейкин 17 (IL-17), который промотирует воспаление в тканях.

В журнале Rheumatology 06 октября 2017 г. опубликовано руководство по лечению системной красной волчанки у взрослых, подготовленное Британским обществом ревматологии.
Клинические и серологические признаки о вероятном диагнозе системной красной волчанки (СКВ):
1) СКВ является мультисистемным аутоиммунным заболеванием. Диагноз требует наличия комбинации клинических признаков и наличия как минимум одной связанной иммунологической патологии. При подозрении на СКВ необходимо проведение тестов крови, включая тесты на серологические маркеры.
2) Антинуклеарные антитела (ANA) присутствуют у около 95% пациентов с СКВ. Если тест негативен, то имеется низкая вероятность наличия СКВ у пациента. Положительный тест ANA имеется у около 5% взрослых и изолированно имеет низкую прогностическую ценность при отсутствии клинических признаков аутоиммунной ревматической болезни.
3) Наличие антител к двухцепочечной ДНК (анти-dsDNA), низкий уровень комплемента или анти-Sm (Smith) – антитела являются высокопрогностичным признаком диагноза СКВ у пациентов с соответствующими клиническими признаками. Анти Ro/La – антитела, и анти RNP – антитела являются менее специфичными маркерами СКВ, так как они обнаруживаются при других аутоиммунных ревматических болезнях и при СКВ.
4) Необходимо проведение теста на синдром антифосфолипидных антител у всех пациентов с СКВ изначально, особенно с отклонениями беременности в анамнезе, либо с артериальными/венозными тромботическими событиями. Подтверждающими тестами на антифосфолипидный синдром являются положительный волчаночный антикоагулянт, антитела к кардиолипину (IgG и IgM) и/или анти-бета-2 гликопротеин-1 (IgG и IgM) при проведении тестов 2 раза с как минимум 12 недель между тестированием.
Обследование пациентов с СКВ:
1) Клинические проявления у пациентов с СКВ зависят от активности болезни, поражений, токсичности препаратов или наличия сопутствующих заболеваний. По активности болезни, очень важно убедиться является ли это из-за активного воспаления или тромбоза, что и будет обусловливать стратегию лечения.
2) Клиническая оценка пациентов с СКВ должна включать тщательный анамнез и обзор систем, полный клинический осмотр и мониторинг основных показателей состояния организма, общий анализ мочи, лабораторные тесты, оценка состояния здоровья и качества жизни, и измерение активности болезни и степени повреждений с применением стандартных инструментов оценки СКВ. При наличии показаний необходимо проводить методы визуализации, биопсию почек и других тканей.
3) Активность болезни категоризуется на легкую, умеренную и тяжелую с периодами обострений. Легкой активностью болезни является клиническая стабильность без жизне-угрожающего вовлечения органов, с основным проявлением в виде артрита, кожно-слизистых поражений и легкого плеврита. У пациентов с умеренной активностью болезни имеются более серьезные проявления. При тяжелой активности болезни имеются жизне-угрожающие или орган-угрожающие проявления.
1) Пациенты с СКВ должны проходить мониторинг на регулярной основе на проявления болезни, токсичность препаратов и сопутствующие заболевания.
2) Пациенты с активной болезнью должны проходить контрольные осмотры как минимум каждые 1 - 3 месяца с измерением АД, общего анализа мочи, функции почек, анти-dsDNA антитела, уровень комплемента, С-реактивный белок, развернутый общий анализ крови, и печеночные тесты. Пациенты со стабильной болезнью с низкой активностью или в ремиссии могут проходить мониторинг менее часто, например каждые 6 - 12 месяцев.
3) Наличие синдрома антифосфолипидных антител связано с тромботическими событиями, повреждениями и неблагоприятными исходами при беременности. При отрицательном предыдущем тестировании, необходимо повторное тестирование до беременности или операции, либо при наличии новых тяжелых проявлений или сосудистых событий.
4) Анти-Ro/La антитела связаны с неонатальной СКВ (включая врожденной блокадой сердца) и должны быть проверены до беременности.
5) Пациенты с СКВ имеют повышенный риск сопутствующих болезней, таких как атеросклеротическая болезнь, остеопороз, аваскулярный некроз, злокачественных новообразований и инфекций. Необходимо проводить исходную и ежегодную оценку модифицируемых факторов риска, включая гипертонию, дислипидемию, диабет, высокий индекс массы тела и курение.
6) Иммуносупрессивная терапия может приводить к токсическим проявлениям. Необходимо проводить тщательный мониторинг препаратов путем лабораторных тестов и клинической оценки согласно руководствам по мониторингу препаратов.
Лечение легкой СКВ:
1) Лечение легкой орган-не-угрожающей СКВ включают болезнь-модифицирующие препараты гидроксихлорохин и метотрексат, и короткие курсы НПВС для контроля симптомов. Данные препараты позволяют избегать либо снижать дозу кортикостероидов.
2) Для поддерживающей терапии может понадобиться применение преднизолона в низкой дозе ≤ 7,5 мг/день . Возможно применение средств местного применения при кожных проявлениях и внутрисуставных инъекций при артритах.
3) Солнцезащитный крем с высоким SPF UV-A и UV-B является важным в лечении и профилактике вызываемых ультра-фиолетовым излучением поражений кожи. Необходимо информировать пациентов об избегании солнца и ношении соответствующей защитной одежды.
Лечение умеренной СКВ:
1) При лечении умеренной СКВ применяют более высокие дозы преднизолона (до 0,5 мг/кг/день), либо в/м иди в/в дозы метилпреднизолона. Для контроля активной болезни часто необходимы иммуносупрессивные препараты, позволяющие избежать стероиды. Данные препараты также снижают риск повреждений в длительном периоде.
2) Метотрексат, азатиоприн, микофенолата мофетил, циклоспорин и другие ингибиторы кальциневрина должны быть рассмотрены в случаях артрита, кожных поражений, серозитов, васкулите или цитопениях, если гидроксихлорохин оказался недостаточным.
3) В рефрактерных случаях можно рассмотреть возможность применения белимумаба или ритуксимаба.
Лечение тяжелой СКВ:
1) Пациенты с тяжелой СКВ, включая с поражением почек и нейро-психиатрическими проявлениями, нуждаются в тщательном обследовании для исключения других причин, включая инфекции. Лечение зависит от этиологии (воспалительной и/или тромботической) и необходимо соответствующее лечение с применением иммуносупрессии и/или антикоагуляции соответственно.
2) Иммуносупрессивные режимы при тяжелой активной СКВ включают в/в метилпреднизолон или пер-оральный преднизолон в высоких дозах (до 1 мг/кг/день) для приведения к ремиссии, либо изолированно, или как чаще бывает, в составе протокола лечения с другим иммуносупрессивным препаратом.
3) Микофенолата мофетил или циклофосфамид применяются при большинстве случаев волчаночного нефрита и при рефрактерных тяжелых случаях болезни без поражения почек.
4) Можно рассмотреть возможность применения биолоджиков белимумаба или ритуксимаба на индивидуальной основе, когда у пациентов неэффективны или непереносимы другие иммуносупрессивные препараты.
5) Внутривенные иммуноглобулины и плазмаферез могут быть рассмотрены для пациентов с рефрактерной цитопенией, тромботической тромбоцитопенической пурпурой, быстро ухудшающемся остром галлюциногенном состоянии и катастрофической формой антифосфолипидного синдрома.
По препаратам смотрите таблицу 1.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).

Новость
Знаменитый телесериал «Доктор Хаус» запоминается не только циничным и сварливым нравом главного героя — гения медицинской диагностики, — но и аутоиммунным заболеванием системной красной волчанкой, появляющейся там едва ли не в каждой серии и даже ставшей своеобразным рефреном сериала.
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ
В патогенезе СКВ важное место отводится иммунным механизмам, многие аспекты которых, несмотря на интенсивное изучение, остаются невыясненными. СКВ характеризуется обескураживающей «пестротой» иммунологических феноменов, что связывают с изменением практически всех известных функций иммунокомпетентных клеток (рис. 1).

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
«Я знаю пароль, я вижу ориентир»
В конце 1990-х в биофармацевтической компании Human Genome Sciences (Роквилл, Мэриленд, США) открыли молекулярный путь, «сузив» который, можно в какой-то степени сдержать развитие СКВ. В этом пути участвует белок, получивший название «стимулятор B-лимфоцитов» (или BLyS), — цитокин из семейства фактора некроза опухолей. Было обнаружено, что ингибирование BLyS позволяет несколько сдержать разыгравшуюся иммунную систему и уменьшить число колоний B-лимфоцитов, производящих аутоантитела, атакующие здоровые ткани.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
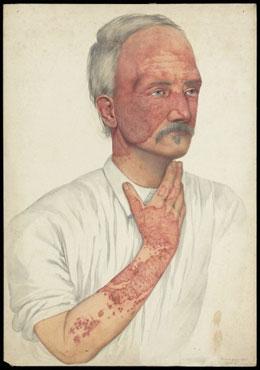
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Дорога к этому свершению была долгой, потому что до 2009 года, когда белимумаб успешно прошел первые две фазы клинического тестирования, ещё ни одно лекарство против волчанки не добиралось до фазы III испытаний — рандомизированного мультицентрового исследования с участием большой популяции пациентов. (О процессе разработки лекарств и о клинических испытаниях см. «Драг-дизайн: как в современном мире создаются новые лекарства» [5].) Дело в том, что «строгая» система клинических проверок, основанная на идеологии доказательной медицины, просто не пропускала препараты-«кандидаты», оказывавшиеся на поверку просто неэффективными или опасными для здоровья пациентов.
«Под проекты разработки лекарств против волчанки было просто не получить финансирования, поскольку все знали, что эти разработки как одна проваливаются», — говорит Ричард Фьюри (Richard Furie), ревматолог из Нью-Йорка, руководивший клиническими исследованиями белимумаба. — «Люди открыто говорили: „вы никогда не добьетесь успеха [в клинических исследованиях]“» [6].
Целенаправленная терапия
Когда исследователи из Human Genome Sciences (HGS) открыли цитокин BLyS [7] на основе анализа генетической активности белых клеток крови, полной последовательности генома человека [8] еще не было. «Это было чудное время», — рассказал Дэвид Гилберт (David Hilbert), бывший руководитель исследований этой компании. — «Мы каждый день сидели над лимфоцитами и получали последовательности все новых и новых генов, про которые совершенно не было понятно, что они такое» [6].
В процессе исследования BLyS сотрудники HGS обнаружили, что количество этого цитокина сильно увеличивается при воспалении, а особенно — у больных волчанкой. Это была очень важная зацепка, хотя и было понятно с самого начала, что дорога предстоит нелёгкая, учитывая количество уже провалившихся клинических испытаний препаратов. Ситуация особенно осложнялась тем, что клинические проявления СКВ крайне разнообразны — от лёгкого дискомфорта у одних до тяжкого бремени на всю жизнь у других, — что и побудило, наверное, авторов «Доктора Хауса» включить волчанку в сериал в таком утрированном контексте.
Кстати, цитокину BLyS даже есть памятник, причем в процессе его синтеза на рибосоме: дочь основателя компании HGS, увлекающаяся молекулярной скульптурой [9], «позаимствовала» у отца белок для ваяния. Скульптура установлена в американском НИИ Колд Спринг Харбор.
Действие лекарств, селективно на молекулярном уровне «выключающих» некоторые ветви иммунитета, должно быть очень точным. Например, в 2008 закончились неудачей клинические испытания атацицепта (atacicept), ингибирующего не только BLyS, но и ещё один родственный белок. Тестирование на больных тяжелой формой волчанки — волчаночным нефритом — пришлось срочно прекратить из-за аномально высокого числа побочных инфекций у принимавших лекарство. Аналогичная ситуация была с антителом окрелизумабом (ocrelizumab), блокировавшим работу B-лимфоцитов по другому механизму.
Следующие на очереди
Белимумаб — только первое лекарство из находящихся на очереди в процессе тестирования у различных фармацевтических фирм (таких как Anthera, Eli Lilly и других). Часть разрабатываемых лекарств действуют также на BLyS, другие — ингибируют работу T-лимфоцитов, «атакуя» белок под «научным» названием B7-родственный белок, ещё один препарат ингибирует медиатор воспаления интерферон-γ. Самому же белимумабу пророчат светлое будущее — с точки зрения фармацевтических гигантов, это обозначает миллиардные продажи, выводящие препарат в заветный список «блокбастеров». Между прочим, это совершенно не обозначает полного излечения от болезни миллионам пациентов — эффективность препарата не такая уж и высокая (согласно официальной информации, помогает он одному пациенту из 11), тем более что тестирование проводили не на тяжелой форме заболевания [10]. Кроме того, белимумаб оказался неэффективен в лечении чернокожих пациентов. Впрочем, это все равно лучше, чем неспецифически «глушить» иммунитет пациентов. Жаль только, что большинству российских больных придется по старинке использовать преднизолон, хоть менее эффективный, но зато намного более дешевый, чем инновационный препарат «с пылу-жару».
Читайте также:

