При герпетической невралгии обезболивающие
Обновлено: 25.04.2024
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Доказано, что повреждение нейрональных структур начинается перед появлением кожной сыпи. При этом VZV по ходу чувствительных нервных волокон проникает в кожу, «ускользая» от факторов врожденного и приобретенного иммунитета, что в конечном итоге обусловливает возникновение односторонней везикулярной кожной сыпи, характерной для опоясывающего лишая.
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Постгерпетическая невралгия (ПГН) — это осложнение опоясывающего герпеса, вызванного тем же вирусом, что и ветряная оспа (лат. herpes zoster virus). При этом заболевании поражаются кожа и нервные волокна, что проявляется сильной жгучей болью уже после заживления герпетических пузырей.
Риск возникновения постгерпетической невралгии увеличивается с возрастом; чаще всего этому заболеванию подвержены люди старше 60-ти лет. Данное состояние возникает примерно у 10–20% пациентов, перенесших опоясывающий герпес . Его вылечить нельзя, но лечение постгерпетической невралгии может облегчить симптомы и снять боль. Больше чем у половины пациентов боли проходят сами по себе спустя некоторое время.
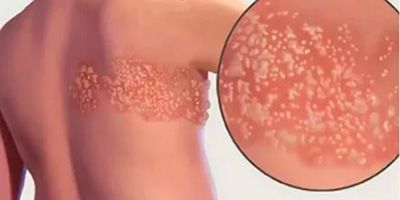
Симптомы постгерпетической невралгии, как правило, ограничиваются той областью кожи, где впервые возникли высыпания — чаще всего они опоясывают туловище или появляются сбоку, впрочем заболевание может поражать и лицо.
Болевые ощущения могут длиться в течение 3-х месяцев и дольше после заживления герпетических пузырьков. Пациенты описывают её, как жгучую, острую, пронзающую или глубокую, она возникает даже при малейшем прикосновении к коже в поражённой области, в том числе и от лёгкого прикосновения одежды (аллодиния). Гораздо реже больные чувствуют зуд и онемение.
Причины постгерпетической невралгии
После того как человек перенёс ветряную оспу, вирус остаётся в организме на всю жизнь. С возрастом иммунная система ослабевает (в частности — от приёма лекарств или химиотерапии) и вирус может активизироваться, в результате чего возникает опоясывающий лишай.
Повреждение нервных окончаний при высыпаниях приводит к возникновению постгерпетической невралгии. Будучи повреждёнными, нервные волокна не могут посылать сигнал от кожи к мозгу так, как они это делают в норме. Вместо этого, ими передаются усиленные сигналы, а пациент чувствует мучительную боль, которая может длиться месяцами или даже годами.
Факторы риска
Если у вас появились признаки опоясывающего лишая, то риск возникновения постгерпетической невралгии значительно усиливается при следующих условиях:
- возраст старше 50-ти лет;
- ярко выраженные симптомы опоясывающего лишая, имеются обильные высыпания и интенсивная боль;
- наличие сопутствующих заболеваний, в том числе сахарного диабета;
- наличие высыпаний на лице.
Осложнения
При длительном течении заболевания, особенно если оно сопровождается очень сильным болевым синдромом, у пациентов часто возникают следующие осложнения:
Ключевая фраза: Наиболее распространенная этиологическая причина невралгии тройничного нерва — компрессия тригеминального корешка в зоне его выхода в мозговой мост.
Невралгия тройничного нерва (НТН) — хроническое рецидивирующее заболевание, протекающее с ремиссиями и обострениями, характеризующееся чрезвычайно интенсивной, стреляющей болью в зонах иннервации третьей, второй и, крайне редко, первой ветвей тройничного нерва (ТН). Синонимы НТН: "болевой тик", "болезнь Фотергилла".
Впервые в истории медицины сведения о тригеминальной невралгии встречаются в трудах знаменитого китайского врача Хуа-То, жившего в начале нашей эры. В Европе тригеминальную невралгию как отдельную нозологическую форму описал английский врач Д.Фотергилл в монографии " Болезненные поражения лица" (1781).
Типичная НТН дебютирует на 5-м десятилетии жизни, встречается чаще у женщин, чем у мужчин (соответственно 5 и 2,7 на 100 тыс населения). Обычно страдает правая сторона лица (60%), реже — левая (28 %), крайне редко отмечается двустороннее поражение (2%).
Предложено множество классификаций НТН. В Классификации и диагностических критериях головных, лицевых и черепных невралгий, предложенной Международным обществом по изучению головной боли (1988), тригеминальная невралгия подразделяется на идиопатическую и симптоматическую; последняя включает в себя компрессионную (корешковую) и центральную формы. Однако клиническая практика свидетельствует о наличии именно компрессии тригеминального корешка в зоне его входа в мозговой мост различными патологическими образованиями этой области.
Взгляды на этиологию НТН во многом расходятся. До начала XX века отмечалась решающая роль переохлаждения лица, местных хронических инфекций (зубочелюстной системы, верхнечелюстных пазух), последствий менингита и арахноидита основания мозга. В качестве первопричины тригеминальной невралгии предполагалась недостаточность кровоснабжения полулунного узла.
Чаще (80%) компрессия тригеминального корешка в зоне его входа в мозговой мост обусловлена патологически извитой петлей верхней мозжечковой артерии. Этим объясняется тот факт, что НТН возникает в пожилом и старческом возрасте и практически не встречается у детей. В остальных случаях указанная компрессия вызвана опухолями мостомозжечкового угла и бляшками рассеянного склероза.
Боль в тригеминальной системе, согласно теории "ворот боли" Мелзака и Уолла (1965), обусловлена нарушением соотношения сенсорных потоков по быстро- и медленнопроводящим волокнам ТН. "Ворота боли" открыты, и болевой поток устремляется в верхние этажи мозга. Теория " ворот боли" объясняет пароксизмальные тригеминальные боли следующим образом. При компрессии корешка ТН патологически извитой верхней мозжечковой артерией волокна глубокой чувствительности подвергаются демиелинизации. Импульсы, возникающие при движениях нижней челюсти, сокращениях мимических и жевательных мышц, в норме осуществляющие антиболевую функцию, в условиях переключения на волокна типа С (поверхностной чувствительности) способствуют выделению возбуждающего вещества Р и прохождению ноцицептивных (болевых) импульсов через синаптическую щель.
Только у 23% больных НТН начинается типичной клинической картиной, тогда как у 77% первые признаки заболевания проявляются преневралгической стадией в виде малоинтенсивных, кратковременных, стреляющих болей. В этот период боли носят спонтанный характер, триггерные факторы четко не определяются. Болевые пароксизмы возникают несколько раз в день, не вызывая особых изменений качества жизни пациента. Акупунктура, физиотерапия, витаминотерапия приводят к прекращению алгического синдрома в среднем через 3 нед. Но спустя 1,5—2 года развивается типичный развернутый тригеминальный приступ, который включает в себя следующие симптомы.
- Боль в лице пароксизмального, стреляющего характера, сравниваемая пациентами с разрядами электрического тока. Болевой пароксизм продолжается в среднем 10—15 с и никогда не превышает 2 мин.
- Между двумя отдельными алгическими приступами есть светлый безболевой промежуток (рефрактерный период), длительность которого зависит от выраженности обострения.
- Болевой рисунок в период обострения в пределах иннервационных тригеминальных территорий имеет не меняющееся на протяжении многих лет направление. Болевой пароксизм всегда бывает определенной протяженности, боль исходит из одного участка лица и достигает другого.
- Наличие триггерных зон, гиперсенситивных участков на коже лица и полости рта, слабое раздражение которых вызывает типичный пароксизм. Наиболее частое расположение триггерных зон — носогубный треугольник и альвеолярный отросток.
- Наличие триггерных факторов, при которых возникают типичные тригеминальные пароксизмы: умывание, чистка зубов, жевание, разговор.
- Во время болевого пароксизма больные не плачут, не кричат, не двигаются, а замирают в той позе, в которой их застиг приступ. Иногда пациенты растирают зону боли или делают чмокающие движения.
- На высоте алгического пароксизма возможны подергивания мимической или жевательной мускулатуры, однако, в последнее время из-за применения антиконвульсантов этот признак встречается редко.
- Отсутствие сенсорного дефекта (выпадение поверхностной чувствительности) в зоне болевых приступов не является обязательным.
Диагностическую роль играют точки Керера — остистые отростки шейных позвонков, глубокая пальпация которых сопровождается иррадиирующей болью в лицо.
На высоте обострения определяется характерный признак симптома "лестницы": если больной оступается, спускаясь по лестнице, возникает хотя и ослабленный, но все же типичный тригеминальный "прострел", что обусловлено "ударом" ликвора в тригеминальной цистерне по патологически измененному корешку.
В этой фазе заболевания часто встречается симптом "осторожного дотрагивания" до триггерной зоны: если пациента просят показать точное расположение участка на лице, при касании которого возникает приступ, он не доносит палец до кожи из-за страха спровоцировать тригеминальный пароксизм.
У ряда больных со временем развивается вторичный мышечно-фасциальный прозопалгический синдром. Все больные НТН как при обострении, так и в период ремиссии, используют для жевания "здоровую" сторону рта. В мышцах гомолатеральной стороны лица возникают дегенеративные изменения с развитием типичных мышечных уплотнений.
Дифференциальный диагноз (наиболее близкие по клиническим проявлениям заболевания)
Постгерпетическая тригеминальная невралгия, в отличие от типичной НТН, обычно локализуется в зоне иннервации первой ветви ТН, что объясняется наименее выраженной ее миелинизацией по сравнению с другими ветвями. Отличительные черты постгерпетической тригеминальной невралгии — сенсорные расстройства в зоне офтальмического подразделения ТН. Заболевание возникает на 6-м десятилетии жизни или позже. Половина кожи лба таких больных покрыта депигментированными рубцами после перенесенных герпетических высыпаний. Сенсопатические нарушения характеризуются в первую очередь постоянным зудом и жжением, в меньшей степени — болью, единичными малоинтенсивными "прострелами", обычно провоцируемыми соприкосновением ресниц или касанием кожи лба на стороне поражения.
Глоссофарингеальная невралгия встречается реже, чем НТН (0,5: 100 тыс) и характеризуется внезапными, жестокими, кратковременными болями в зоне иннервации языкоглоточного нерва — тонзиллярной ямке и прилегающей области. Боли иррадиируют в слуховой проход. На высоте приступа возникают пресинкопальные или синкопальные состояния. Патогномоничный признак — ночные болевые пароксизмы из-за раздражения триггерных зон скапливающейся слюной и рефлекторным глотательным движением.
Невралгия верхнегортанного нерва проявляется односторонними интенсивными пароксизмами жгучей боли, иррадиирующей от щитовидного хряща в угол нижней челюсти и наружный слуховой проход. Приступы жесточайшей боли провоцируются разговором, глотанием, зеванием. Приступ может сопровождаться кашлем, гиперсаливацией, звоном в ушах, вертиго.
Невралгия коленчатого узла отличается от других прозопалгий жесточайшими болями в наружном слуховом проходе, иррадиирующими в околоушную, скуловую области и половину языка. Начало заболевания обычно сопровождается признаками респираторной инфекции и герпетическими везикулами в полости рта и на ушной раковине. Всегда отмечается периферический парез лицевой мускулатуры.
Болезненная офтальмоплегия (синдром Толосы—Ханта). На фоне внезапно развившегося периорбитального отека с ярко выраженным венозным компонентом, ипсилатеральным парезом глазодвигательных нервов, гипостезией в зоне иннервации глазной ветви ТН возникают эпизоды стреляющих болей в этой же области. Причина заболевания — гранулематоз или тромбоз кавернозного синуса.
SUNCT-синдром — невралгоподобные боли с конъюнктивитом и слезотечением. Проявляется односторонними дневными болями продолжительностью в десятки секунд. Боли сопровождаются преходящим конъюнктивитом, слезотечением, незначительной ринореей, легким потением лба.
Периодическая мигренозная невралгия (пучковая головная боль, кластерная невралгия, невралгия Хортона) встречается обычно у мужчин, начинается в молодом возрасте. Обострения возникают и прекращаются спонтанно, болевые пароксизмы продолжаются до 1 ч (как правило, ночью), сопровождаются выраженными вегетативными нарушениями в верхнем и среднем сегментах лица (вегетативная буря), синдромом Горнера, потением кожи лба, моторным возбуждением.
Лечение
Основным препаратом для лечения НТН является карбамазепин, представляющий собой по химическим свойствам производное иминостильбена, чем обусловливается его противосудорожное действие — путем блокады прохождения болевых импульсов на уровне тригеминального ядра спинального тракта и таламических ядер. В нашей стране карбамазепин широко известен под торговым названием финлепсин.
По структуре карбамазепин близок к трициклическим антидепрессантам, а в механизме действия значительную роль играют его ГАМКергические свойства. Противопоказаниями для применения карбамазепина являются предсердно-желудочковая блокада, малые эпилептические припадки, глаукома, заболевания костного мозга, повышенная чувствительность к препарату.
Обычно применяется следующая схема лечения. В первые 2 дня суточная доза составляет 200 мг (по 1/2 таблетки утром и вечером, потом в течение 2 дней — 400 мг/сут (в 2 приема утром и вечером), затем — 600 мг (по 1 таблетке утром, в обед и вечером). Если эффект недостаточный, суточная доза препарата может быть увеличена до 800 или 1000 мг. Однако при таких дозировках могут появиться побочные явления в виде атаксии, диплопии, вертиго. В таких случаях нужно оставить предыдущую дозировку препарата и добавить антидепрессанты или транквилизаторы.
Аналгезирующее действие препарата сохраняется в течение 3—4 ч; если оно менее продолжительное, следует увеличить дозу. Если противоболевой эффект отсутствует, переходят на другой антиконвульсант — дифенин (фенитоин), однако он противопоказан при заболеваниях почек, печени, сердечной недостаточности.
При достижении положительного результата после однократного приема карбамазепина (из общей суточной дозы) — когда пациент в течение нескольких часов способен разговаривать, принимать пищу, умываться и чистить зубы — установленную суточную дозу оставляют на 1 мес, после чего ее медленно снижают (по 50 мг дважды в неделю). При возникновении хотя бы незначительных болевых пароксизмов необходимо вернуться к предыдущей суточной дозе. Карбамазепин принимают длительно, в течение многих месяцев и даже лет. Отмена этого антиконвульсанта осуществляется при отсутствии тригеминальных пароксизмов в течение не менее полугода и по описанной выше методике.
Во время обострения НТН используются антидепрессанты (обычно амитриптилин), оказывающие в умеренных дозах противоболевой эффект.
При тяжелых обострениях НТН наряду с карбамазепином применяют препараты, близкие по химическому строению к ГАМК (натрия оксибутират, учитывая его центральное тормозное действие). Противопоказанием являются гипокалиемия и миастения.
При тяжелых тригеминальных состояниях и статусах дополнительно к базисным препаратам в качестве симптоматического средства прибегают к реланиуму и сосудистым препаратам — тренталу, никотиновой кислоте и др.
Если эффект от консервативного лечения недостаточен, больных направляют на оперативное лечение. Наиболее распространенными нейрохирургическими методами являются микроваскулярная декомпрессия тригеминального корешка, ретрогассеральная терморизотомия, нервэкзерез.
Пластырь с 5% лидокаином (Lidoderm®) состоит из адгезивного материала содержащего 5% лидокаин (700 мг/пластырь) нанесенного на нетканевою полиэстеровую подкладку и покрытый полиэтиленовой снимающейся пленкой [29] . Каждый пластырь размером 10* 14 см назначается в виде аппликации на болезненную кожу и должен покрывать как можно большую пораженную область [31] . Согласно этикетке на упаковке может быть нанесено до трех пластырей (420 см 2 ) один раз в день максимум до 12 часов/сутки. Нет необходимости титровать дозировку. При адекватной терапии пластырями с 5% лидокаином в течение 2 недель некоторые пациенты обычно сообщали об облегчении боли в течение 1 или нескольких дней [32] . Наиболее часто встречающимися нежелательными явлениями, наблюдаемыми при применении пластыря с 5% лидокаином при клинических исследованиях, были умеренная кожная сыпь, покраснение или раздражение на месте нанесения, которые также сообщались при применении только плацебо пластыря [29,30] .
1.1 Обзор стратегии
Для определения первичных исследовательских статей о применении пластыря с 5% лидокаином для лечения пациентов с PHN, был проведен поиск в базе данных Medline с использованием терминов «лидокаин» и «пластырь» (для определения статей или с «пластырь» или с «пластыри»). Этот поиск ограничивался английским языком.
При поиске было определено в целом 310 цитат. Обзор записей Medline исключил 302 цитаты, так как они были обзором статей или исследований которые не имеют отношения к использованию пластыря с 5% лидокаином для лечения PHN. Из восьми оставшихся статей две были исключены, так как в них не сообщалось о результатах клинических исследований [33,34] . Оставшиеся шесть клинических исследования включали: исследование бионакопления у здоровых добровольцев и пациентов с PHN [31] ; исследование фармакокинетики и безопасности при пролонгированном назначении [35] или 24часовой аппликации пластыря [36] и исследования контролирующие безопасность и эффективность облегчения боли у пациентов с PHN 37 . Не опубликованное контролирующее исследование [40] и два опубликованных открыто маркированных исследования [41,42] не индексированные в Medline также были взяты для рассмотрения, так как они были выполнены автором этого обзора или коллегами одного из авторов.
Для борьбы с симптоматикой при защемлении, воспалении нервных окончаний, препятствования развитию болезни врачи используют лекарства. Для этого больному назначают средства различной категории:
- нестероидные противовоспалительные средства помогают уменьшить отёчность, снизить компрессию корешка;
- противовирусные выводят патогенные микроорганизмы;
- анальгетики используются при интенсивном болевом синдроме;
- спазмолитики устраняют спазмы мышечных тканей, тем самым уменьшая болезненные ощущения при невралгии;
- миорелаксанты уменьшают тонус мышц, облегчают самочувствие больного;
- витаминные комплексы устраняют мышечную слабость и неприятную симптоматику;
- седативные средства применяют для повышения настроения больного, помогают расслабить скелетную мускулатуру, избавиться от нервного напряжения.
Против невралгии используют лекарственные препараты в виде мазей, таблеток и уколов. Наиболее удобной для больного считается таблетированная форма препарата. Однако эффект лекарства в данной форме может быть недостаточен, тогда больному назначают уколы. Также большинство таблеток характеризуется негативным влиянием на органы пищеварения. Мази подразумевают поступление активного компонента в кровеносную систему в малой концентрации, что делает данную форму лекарства оптимальным для больных детей, беременных, пожилых пациентов или людей с заболеваниями желудочно-кишечного тракта.

Какие препараты помогают при межрёберной невралгии
Межрёберная невралгия — неопасное заболевание, однако при отсутствии своевременной помощи провоцирует серьёзные осложнения. Лекарства помогают устранить симптоматику, избавиться от недуга.
Таблетки
Для борьбы с данной формой болезни пациенту назначают следующие препараты:
- анальгетики;
- большей эффективностью при межрёберной форме обладают противовоспалительные средства;
- для восстановления мышц назначают спазмолитики;
- пациенту назначают миорелаксанты.
Уколы при межрёберной невралгии
При интенсивных болезненных ощущениях эффективности таблеток недостаточно. Пациенту назначают противовоспалительные растворы или блокаду лидокаином. Укол диклофенака в короткий промежуток времени устранит болезненные ощущения, купирует воспаление. При невыносимой боли назначают Лидокаин, Новокаин. Данные вещества используют в крайней ситуации, так как препараты характеризуются высокой токсичностью.
При межрёберной форме заболевания применяют местные средства, которые способны:
- разогреть кожные покровы, стимулировать кровообмен;
- устранять болевой синдром;
- бороться с болезненными ощущениями и отёчностью;
- ускорить кровообращение.
При уменьшении подвижности позвоночника больному назначают Хондроксид. При длительном развитии невралгии применяют мазь на основе пчелиного яда.
Статью проверил
Дата публикации: 19 Марта 2021 года
Дата проверки: 19 Марта 2021 года
Дата обновления: 24 Июня 2022 года
Содержание статьи
Какие препараты помогают при невралгии тройничного нерва
Лекарства — основа лечения невралгии тройничного нерва на первоначальных стадиях развития заболевания. Изначально устраняется симптоматика недуга, затем доктор избавляется от провоцирующего болезнь фактора. Третий этап в лечении — использование профилактических препаратов для снижения вероятности рецидива.
Таблетки
- Изначально назначают Нимесулид для быстрого купирования болезненных ощущений, уменьшения отёчности. Курс лечения длится до 7 дней;
- Ибупрофен помогает устранить симптоматику, препятствует воспалительном процессу. Характеризуется низкой степенью токсичности;
- вместе с обезболивающими средствами используют миорелаксанты, например Толперизон или Тизанидин;
- для устранения симптомов воспаления используют противосудорожные препараты — Клоназепам или Карбамазепин. Средства уменьшают частоту передачу нервных импульсов. Дозировка подбирается индивидуально;
- для устранения причины возникновения невралгии используют противовирусные средства, например Ацикловир;
- если заболевание спровоцировано атеросклеротическим поражением сосудов больному назначают препарат для уменьшения концентрации холестерина — Фенофибрат, Симвастатин;
- при необходимости применяют средство для нормализации кровообмена головного мозга — Винпоцетин, Бетагистин.
- Нимесулид кроме таблетированной формы выпускается в виде мази, имеет аналогичное воздействие на организм, характеризуется меньшей токсичностью;
- Диклофенак назначают для устранения умеренных болезненных ощущений;
- Фастум гель эффективно устраняет болевой синдром и отёки.
Уколы
Уколы быстро воздействуют на поражённый нерв, в короткий промежуток времени устраняют симптоматику, нормализуют самочувствие. Чаще используют 0,25% раствор новокаина. Инъекция окружает нервное окончание, устраняет болезненные ощущения. При выраженном болевом синдроме, неэффективности таблетированной формы лекарств используют инъекции Кеторола или Анальгина. Курс лечения подразумевает 5 — 10 уколов.
Противопоказания
Любое лекарство имеет ограничения и противопоказания. Перед использованием средства требуется обратиться к врачу. Индивидуальные особенности организма делают невозможным использование некоторых лекарств:
- нестероидные противовоспалительные средства противопоказано использовать при нарушении работы желудочно-кишечного тракта, данная группа препаратов увеличивает вероятность формирования язвы. Также НПВС противопоказаны в процессе вынашивания ребёнка и дисфункции почечной системы;
- часть обезболивающих запрещается использовать при нарушении работы ЖКТ, нервной системы, дисфункции сосудистых каналов;
- миорелаксанты противопоказаны детям до 3 лет. Также данную группу препаратов запрещено использовать страдающим печёночной недостаточностью;
- часть противовирусных средств нельзя принимать при нарушении работы печени или почек, а также в процессе вынашивания ребёнка;
- седативные лекарства противопоказаны при артериальной гипотензии, а также людям, профессия которых требует повышенной реакции.
Что делать при побочных эффектах и что делать, если не помогает
Снизить риск возникновения побочных эффектов удастся, если соблюдать инструкцию по применению и рекомендации врача. При лечении невралгии возможны следующие осложнения:
- нарушение функционирования органов желудочно-кишечного тракта;
- постоянная усталость;
- приступы головокружения;
- ухудшение концентрации внимания;
- появление зудящих участков на кожном покрове;
- изменение давления;
- дисфункция сердечно-сосудистой системы.
Для уменьшения риска возникновения побочных эффектов на приёме доктора требуется известить о ранее перенесённых болезнях, имеющихся аллергических реакциях. При появлении осложнений требуется прекратить использовать препарат и обратиться к лечащему врачу.
Источники
Новый взгляд на патогенез и лечение невралгии тройничного нерва. Карпов С.М. Христофорандо Д.Ю. Батурин В.А. Карпов А.С., 2012
Принципы лечения и ведения больных невралгией тройничного нерва. Л.С. Манвелов, В.М. Тюрников, А.В. Кадыков, 2014
Читайте также:

