Препарат для подкожного введения при ревматоидном артрите
Обновлено: 25.04.2024
Лефлуномид является активным базисным противовоспалительным препаратом для терапии больных ревматоидным артритом. Препарат отличается быстрым развитием эффекта, что приводит к стойкому улучшению функции опорно-двигательного аппарата и улучшения качества ж
Leflunomide is an active basic resolvent for rheumatic arthritis patients therapy. The medication is remarkable for the fast development of the effect, which leads to sustainable improvement of the support-motor apparatus functions and improvement of the patients' life quality. The side reactions are rare.
Лечение ревматоидного артрита (РА), заболевания с неизвестной этиологией, сложным многокомпонентным патогенезом, чрезвычайной вариабельностью вариантов дебюта и течения, всегда представляло определенные трудности для практикующего врача.
Очевидно, что успех лечения во многом зависит от ранней диагностики и, соответственно, раннего начала патогенетической терапии. Последние классификационные критерии РА облегчают эту задачу, так как, используя их, врач в большинстве случаев может установить диагноз РА в течение первых 3–4 месяцев [1].
Лечение РА ориентировано на подавление активности и прогрессирования заболевания. Для лечения воспалительного процесса используются два вида терапии: 1) симптоматическая терапия нестероидными (НПВП) или глюкокортикоидными (ГК) противовоспалительными препаратами и 2) терапия базисными противовоспалительными препаратами (БПВП). Симптоматические средства способны уменьшить выраженность воспаления в синовиальной оболочке, уменьшить боль и скованность, однако эти препараты не влияют на течение РА.
Лечение синтетическими базисными противовоспалительными препаратами (БПВП) начинают сразу после установления диагноза РА (уровень доказательности 1а, уровень соглашения 9,9 ± 0,4) [2]. При раннем начале лечения (первые 3–6 месяцев) у большинства пациентов возможно добиться ремиссии или течения РА с низкой активностью [3–6], что по современным представлениям и является основной целью лечения РА [7]. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. При анализе 14 рандомизированных клинических исследований (РКИ) была оценена частота развития эффекта у 1440 больных (1178 получали различные БПВП и 262 — плацебо) при различной длительности РА учитывались демографические факторы (пол, возраст), функциональный класс (ФК) по Steinbrocker, клинико-лабораторные параметры активности болезни (боль, число болезненных суставов (ЧБС), число воспаленных суставов (ЧВС), СОЭ, опросник состояния здоровья HAQ (Health Assessment Questionnaire) и др.) [8]. При любой длительности РА различия в частоте развития эффекта между активным лечением и плацебо были примерно одинаковы — около 30%. По мере увеличения длительности РА эффективность БПВП снижалась с 52% «ответчиков» ( < 1 года) до 35% «ответчиков» (>10 лет) (табл. 1).
Помимо раннего начала лечения РА БПВП, необходим и жесткий контроль за выраженностью достигнутого эффекта, со своевременной коррекцией терапии. При таком подходе, как это было показано в ряде исследований [9–13], результат лечения лучше, чем при рутинном подходе. Это послужило основанием для формирования концепции современного лечения РА. В последние годы большинство стран Европы, включая и Российскую Федерацию, поддержали инициативу «Лечение РА до достижения цели» (в оригинале — инициатива «Treat to target» — Т2Т) [7].
Общие принципы инициативы Т2Т:
А) Лечение ревматоидного артрита следует проводить на основании совместного решения пациента и ревматолога.
Б) Основная цель при лечении больного ревматоидным артритом — обеспечить максимально продолжительное сохранение высокого качества жизни, связанного с состоянием здоровья, путем контроля клинических проявлений, предотвращения структурного поражения суставов, нормализации функционирования и социальных возможностей пациента.
В) Устранение воспаления — наиболее важный способ достижения этих целей.
Г) Для оптимизации исходов при ревматоидном артрите лечение следует проводить до достижения определенной цели, контролируя активность заболевания и соответствующим образом корригируя терапию.
Первый пункт этих рекомендаций ставит перед врачом задачу обязательного обучения больного для того, чтобы он осознанно участвовал в лечении. Пациенту необходимо разъяснить, что такое хроническое заболевание, какова цель лечения, необходимость длительного многомесячного непрерывного лечения для предотвращения тяжелых исходов и осложнений РА (выраженной деструкции, утраты функции, амилоидоза и пр.).
Основные рекомендации инициативы Т2Т определяют главную цель лечения — достижение клинической ремиссии или, как альтернатива, низкой активности РА, что должно поддерживаться в течение всего периода болезни. Для достижения этой цели больные с умеренной/высокой активностью болезни должны осматриваться ежемесячно, при стабильно низкой активности — реже, раз в 3–6 месяцев, с регистрацией количественных параметров активности и использованием валидированных индексов. Таким образом, врач на каждом визите должен объективно оценить динамику активности болезни. При отсутствии достижения цели (ремиссии или низкой активности, т. е. индекс активности болезни DAS28 > 3,2) через 3 месяца следует принять решение о коррекции терапии. Если врач видит отчетливую стабильно нарастающую тенденцию к улучшению, нет необходимости менять терапию каждые 3 месяца и следует подождать, когда улучшение прекратится и смена терапии станет обоснованной.
В соответствии с рекомендациями Европейской антиревматической лиги (EULAR) лечение РА начинают с монотерапии БПВП, а не с комбинации препаратов, и первым БПВП, назначаемым сразу после установки диагноза РА, должен быть Метотрексат (MTX) [2], по рекомендациям ACR (Американская коллегия ревматологов, American College of Rheumatology) первыми БПВП могут быть MTX и лефлуномид (LEF) [14]. Метаанализ 2008 года [15] показал равнозначную эффективность без значительных различий в переносимости и длительности применения между БПВП (MTX, LEF и Сульфасалазин (SSZ)), которые являются препаратами, наиболее часто применяемыми при РА. В настоящее время Сульфасалазин редко используется как первый препарат в лечении РА (при низкой активности серонегативного варианта болезни).
Метотрексат является высокоэффективным препаратом [16, 17], причем его эффект является дозозависимым [18]. Минимальная терапевтическая доза MTX составляет 10 мг/неделю, но при умеренной/высокой активности РА она должна быть увеличена в течение первых месяцев лечения до 15 мг/нед, а далее доза корригируется в зависимости от успеха лечения. Применяется как в таблетированной, так и в парентеральной форме.
И терапевтические эффекты, и токсичность MTX определяются фолатзависимыми механизмами. Подавление активности дигидрофолатредуктазы, ведущее к снижению синтеза ДНК, наблюдается главным образом при назначении очень высоких доз MTX онкологическим больным и составляет основу антипролиферативного действия препарата. При использовании низких доз MTX в ревматологии ингибиция дигидрофолатредуктазы, вероятно, имеет меньшее значение, а клиническая эффективность связана с действием его глутамированных производных. Весьма вероятно, что на фоне лечения низкими дозами MTX именно накопление метаболитов приводит к противовоспалительному и мягкому иммуносупрессивному эффекту. Таким образом, низкие дозы Метотрексата, используемые в лечении РА, приводят к противовоспалительному эффекту, а не к цитотоксическому, что имеет место при использовании высоких доз MTX в лечении опухолей [19].
Препарат обладает быстрым началом действия (в течение 2–3 месяцев) и дозозависимым эффектом [20]. В таблетированной форме препарата назначается 1 раз в неделю по 2,5 мг через 12 часов, вначале в пробных дозах 5 мг и 7,5 мг/нед, далее доза увеличивается до терапевтической. При применении парентеральных форм лечение также начинают с пробной дозы (5–7,5 мг/нед), далее доза может варьировать от 10 до 30 мг/неделю в зависимости от эффективности и переносимости. В контролируемом многомесячном исследовании было выявлено преимущество формы для подкожного введения перед таблетированной: более высокая эффективность при использовании одинаковых доз [21].
Лефлуномид (Арава) является дериватом изоксазола, создан специально для лечения РА, хотя в последние годы он начал использоваться и для лечения псориатической артропатии. Лефлуномид является «пролекарством», в желудочно-кишечном тракте и плазме быстро превращается в активный метаболит — малононитриламид (А77 1726), имеющий, в отличие от лефлуномида, открытое боковое ароматическое кольцо. Именно действием активного метаболита А77 1726 опосредован эффект лефлуномида.
По данным многочисленных экспериментальных исследований основным механизмом действия лефлуномида на активированные клетки является угнетение de novo синтеза пиримидиновых нуклеотидов в поздней G1-фазе клеточного цикла [22]. Предполагают, что лефлуномид действует избирательно на активированные Т-клетки, в то время как преобладающее большинство лимфоцитов находятся в фазе G0 до тех пор, пока не появится потребность в иммунном ответе [23]. Под воздействием метаболита А77 1726 не уменьшается количество клеток и внутриклеточная концентрация белков в угнетенных клетках после 72 часов воздействия метаболита А77 1726 в концентрации 100 мкмоль/л остается такой же, как в клетках в состоянии покоя. Лефлуномид не влияет на фагоцитоз человека. Все вышеперечисленные свойства позволяют рассматривать лефлуномид в большей степени как иммуномодулятор, нежели как иммунодепрессант.
Угнетение Т-клеточного аутоиммунного ответа сопровождается снижением синтеза провоспалительных цитокинов (интерферона-гамма, фактора некроза опухоли-альфа (ФНО-альфа), интерлейкина 6 (IL-6), интерлейкина-бета (IL-бета), простагландина Е2), оксида азота и матриксных металлопротеиназ (ММР-1, ММР-3, ММР-12) в крови и в культуре синовиальной ткани больных РА. Недавно получены данные о противовоспалительном эффекте лефлуномида в отношении культуры моноцитов и макрофагов синовиальной оболочки больных РА: показано уменьшение синтеза провоспалительных цитокинов культурами клеток [24].
Из-за длительной элиминации А77 1726 лечение лефлуномидом рекомендуется начинать с насыщающей дозы 100 мг в течение 3 дней для достижения устойчивой равновесной концентрации препарата в плазме крови. Без насыщающей дозы лекарства для достижения равновесной концентрации А77 1726 потребуется около 2 месяцев. В ходе многочисленных исследований терапевтическая доза определена как 20 мг/сутки (при слабых симптомах непереносимости возможно временное уменьшение дозы до 10 мг/сутки). Выведение препарата осуществляется желудочно-кишечным трактом (48%) и почками (43%). Возраст и пол не оказывают влияние на фармакокинетику А77 1726; однако у больных РА отмечается более высокая плазменная концентрация свободной фракции А77 1726. Метаболизм лекарства происходит быстрее у курильщиков.
Хотя в целом эффективность LEF и MTX равнозначна [15], но клиническая эффективность LEF имеет ряд особенностей.
Следует отметить очень быстрое развитие эффекта при применении LEF. Эффект LEF проявляется через 4 недели от начала приема, что продемонстрировано в зарубежных исследованиях (рис. 1) [31] и подтверждено нашим собственным опытом [25–28]. Уже через 1 месяц после начала лечения (табл. 2) отмечается отчетливое уменьшение выраженности суставного синдрома и заметное снижение концентрации С-реактивного белка (СРБ) — практически в 2 раза [28]. Известно, что СРБ является лабораторным тестом, гораздо более тесно коррелирующим с активностью РА, чем СОЭ. При продолжении лечения эффект препарата быстро нарастает в течение первых 4–5 месяцев и продолжает увеличиваться при продолжении лечения до 12 месяцев.
Оценивая динамику индекса активности болезни (Disease activity score, DAS) в различной его модификации — DAS 4, DAS 28 (рис. 2), можно увидеть, что Арава через 6, 12, 18, 24 и 36 месяцев достоверно снижала активность заболевания, причем выраженность уменьшения DAS соответствовала хорошему эффекту терапии (критерии EULAR). Из рис. 2 видно, что уже через 3–4 месяца средний уровень активности соответствовал низкой.
Такое быстрое подавление активности РА при приеме LEF обусловило и еще одну особенность препарата. При сравнении влияния лефлуномида на деструктивный процесс в суставах с базисным действием Метотрексата и Сульфасалазина было показано, что эффект LEF сопоставим с действием Метотрексата, но превышает действие Сульфасалазина [29–31]. По нашим многолетним исследованиям влияния базисных препаратов на темпы деструкции при РА (рис. 3) было показано [32], что только под влиянием LEF выраженное уменьшение числа новых эрозий отмечается уже в первые 6 месяцев лечения. Под влиянием всех других базисных средств, включая Метотрексат, в первое полугодие терапии темп прогрессирования деструктивного артрита значительно не меняется и только к 12 месяцам успешной терапии можно зарегистрировать подавление прогрессирования деструкции в суставах кистей и стоп, а наиболее отчетливое подавление деструкции при приеме различных БПВП можно зарегистрировать только через 18 месяцев успешной терапии. Судя по быстрому снижению концентрации СРБ под влиянием лефлуномида, можно утверждать, что Арава быстрее других базисных средств подавляет ревматоидное воспаление в синовиальной оболочке, что и приводит к ранней остановке прогрессирования деструкции. Впервые нами продемонстрировано заживление костной эрозии у больного с тяжелым РА (исходное число эрозий более 100), на фоне ремиссии отмечено заживление эрозии в крючковидной кости левого запястья через 18 месяцев приема LEF (рис. 4) [33].
Лефлуномид возможно применять в длительные сроки (в исследованиях до 5 лет) без развития вторичной неэффективности (рис. 5), что очень важно с учетом хронического характера течения РА [34, 35].
Основной отдаленной целью терапии при РА является сохранение функциональной способности больного, предупреждение развития инвалидности. Поэтому особый интерес представляет влияние терапии лефлуномидом на функциональное состояние больных, оцениваемое по стандартным тестам (HAQ, SF-36): уже через 6 месяцев только у 10% больных средний балл индекса HAQ-DI составлял 1,6–2,1; а средний балл 0,5 (то есть практически полное отсутствие функциональной недостаточности) отмечалось у 54% больных [36]. При оценке качества жизни больных РА по тесту SF-36 уже через 6 месяцев достигнуто достоверное улучшение по 5 из 8 доменов (данные Института ревматологии РАМН). Сравнение влияния на качество жизни лефлуномида и Метотрексата за 1–2 года терапии было продемонстрировано преимущество лефлуномида с достоверным улучшением по 3 из 8 доменов (телесная боль, жизнеспособность и ролевое эмоциональное функционирование) (рис. 6) [37]. Как видно из рисунка, при приеме LEF в ряде доменов качество жизни пациентов приблизилось к популяционной норме.
Отмечается хорошая переносимость лефлуномида в сроки лечения до 2–3 лет, как по данным отечественных, так и зарубежных авторов [31, 41]. Среди наших 50 больных лефлуномид был отменен из-за диареи в 1 случае и из-за кожного зуда у 6 больных, причем отмена препарата вследствие непереносимости потребовалась только у лиц старше 50 лет [28]. У половины больных, получавших LEF, в первые месяцы лечения отмечается повышенное выпадение волос, не потребовавшее отмены лечения. Примерно у 10% больных при назначении LEF может появиться артериальная гипертензия (или измениться течение существовавшей артериальной гипертензии), что требует мониторирования артериального давления и коррекции антигипертензивной терапии. Повышение печеночных ферментов отмечается реже, чем при приеме MTX, однако необходим регулярный мониторинг за уровнем аспартатаминотрансферазы и аланинаминотрансферазы (рис. 8). Развитие инфекционных заболеваний требует перерыва в лечении Аравой до купирования инфекции, далее можно продолжать лечение в обычной суточной дозе. Частота развития реакций непереносимости в контролируемых исследованиях лефлуномида показала, что переносимость лефлуномида не уступает переносимости Метотрексата [30, 35, 42].
Таким образом, лефлуномид является активным базисным противовоспалительным препаратом более чем у 90% больных РА. Препарат отличается быстрым развитием эффекта как в отношении параметров активности РА, так и в отношении прогрессирования деструкции, что приводит к стойкому улучшению функции опорно-двигательного аппарата и улучшения качества жизни больных. Побочные реакции на фоне лефлуномида развиваются редко и в большинстве случаев не ведут к его отмене.
Литература
Н. В. Чичасова, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Одно из поражений соединительной ткани – ревматоидный артрит (РА). Это системное заболевание, которое известно давно, но даже за многовековой опыт изучения патологии многие нюансы о ней остаются неизвестными. Самым главным объектом дискуссий до сих пор остается этиология. Эрозивно-деструктивный процесс ежегодно выявляют у 0.5-1% людей планеты. Поскольку течение воспаления сопровождается изнурительными симптомами, необходимо медикаментозно добиться его ремиссии. Только врач назначает лечение ревматоидного артрита: препараты подбирают с учетом возраста пациента, стадии заболевания, поражений других органов.
Симптоматика
Предопределяющая роль в развитии ревматоидного артрита принадлежит наследственной предрасположенности. К группе риска относятся люди, перенесшие инфекцию в виде герпеса или гепатита. Провоцирующим фактором развития болезни признаны такие состояния, как переохлаждение, пребывание в стрессовой среде и другие факторы, предполагающие пагубное воздействие на иммунитет.
В целом, интенсивность проявления патологии зависит от таких факторов, как локализация очага воспаления, вероятность развития осложнений и степень наличия таковых.
Когда ревматоидный артрит находится в латентной стадии, отмечаются:
- Повышенная утомляемость и слабость, вынуждающие пациента больше отдыхать, чем осуществлять двигательную активность.
- Беспричинное снижение массы тела.
- Необъяснимое повышение общей температуры тела.
- Миалгия разной локализации.
Сложность заболевания заключается в том, что оно поражает не только суставную ткань, но и другие органы и системы. Это особенно тяжело переносить пациентам, которые и без того претерпевают хронические патологии.
Патология имеет бурное течение:
- отек синовиальных сумок сопровождается интенсивным болевым синдромом, покраснением тканей над пораженными суставами. Из-за припухлости пациент не может разжать пальцы, сжать их в кулак. Болезненность возрастает при перемене погоды;
- заболевание отличается симметричностью проявлений: как только происходит поражение суставов одной руки, на второй начинаются аналогичные изменения;
- оказывается пагубное воздействие на органы пищеварительного тракта. Больной не замечает специфических признаков: в 95% клинических случаев его беспокоят лишь общие нарушения состояния пищеварения. Чаще – снижение аппетита, повышенное газообразование, тянущая болезненность в подвздошной области;
- наблюдаются неврологические расстройства: возникает раздражительность, панические атаки, спонтанные и частые перемены настроения, психологическая уязвимость. Нарушается сон, что связано с постоянной болезненностью пораженных суставов. Из-за недосыпания возникают проблемы с запоминанием и способностью концентрировать внимание. Поэтому, назначая препараты при ревматоидном артрите, специалист учитывает перечисленные проявления. Общие назначения дополняются лекарственными средствами группы транквилизаторов и снотворных, чтобы пациент мог полноценно отдохнуть, восстановиться.
Поражение крупных суставов (голеностопных, коленных, плечевых, локтевых) происходит отсроченно, к тому времени патология уже достигает поздней стадии развития. Чаще этот период занимает несколько недель или даже месяцев.
Лечение медикаментами
Очень важно начинать устранение ревматоидного артрита на начальной стадии его развития, когда возникают первые симптомы проблемного состояния суставов. В этом случае появляется больше шансов на быстрое выздоровление.
Врач назначает следующие виды лекарственных средств:
- Миорелаксанты – для расслабления мышечного гипертонуса. Устранив перенапряжение, удастся сократить, а затем и полностью купировать болевые ощущения. Представителями лекарств группы миорелаксантов являются Мидокалм, Седуксен.
- Цитостатики. Препараты обладают свойством подавлять иммунитет, поскольку именно на основании сопротивляемости организма развивается ревматоидный артрит. Данной группой препаратов онкологи лечат злокачественные опухоли. Вероятность развития побочных эффектов минимальна: лишь у 15% пациентов возникают трудности с опорожнением кишечника и высыпания на коже.
- Широко применяют препараты золота при ревматоидном артрите. Пациент принимает соли золота внутрь. Эффективность ауротерапии сравнима только с применением средства Метотрексат. Длительное применение солей золота существенно замедляет появление кист внутри суставов у пациентов с серопозитивным ревматоидным артритом. Улучшается общее состояние костного рельефа, повышается уровень минерализации ткани. Известны случаи, когда кости восстановились даже при ранее имеющихся дефектах. Под благотворным воздействием солей золота особенно быстро заживают повреждения мелких суставов.
- Лечение ревматоидного артрита препаратами нового поколения предполагает назначение средства Ремикейд. Препарат относится к группе цитостатиков, характеризуется способностью очень быстро обеспечивать терапевтический эффект. Это дорогое лекарственное средство (вне зависимости от страны проживания). Главное показание для назначения препарата Ремикейд – необходимость быстро купировать тяжелую форму РА. Лекарство представляет собой настоящее спасение для людей, страдающих ревматоидным артритом, но имеющих непереносимость НПВС и гормонов.
- Селективные ингибиторы ЦОГ 2. Препараты этой группы практически не обезболивают, но качественно подавляют воспалительный процесс, протекающий в суставах. По своим фармакологическим особенностям они угнетают фермент, провоцирующий появление воспаления и способствующий его развитию. Самыми эффективными представителями этой группы признаны Мелоксикам (Мовалис), который пациент должен получать из расчета 8.5-16 мг/день, Пироксикам – по 40-45 мг/день и Рофекоксиб – 13.5 мг/день.
Перечисленные медикаментозные средства характеризуются минимальной вероятностью побочных реакций и обладают целенаправленным видом воздействия. Назначение указанных средств оправдано при наличии заболеваний пищеварительного тракта. Особенности применения лекарственных препаратов этой группы — такие же, как у всех НПВС.
Если у вас есть индивидуальная непереносимость определенных лекарственных средств, нужно изначально сообщить об этом врачу. Даже если ухудшение самочувствия возникло в то время, когда вы уже получаете лечение ревматоидного артрита, новое терапевтическое назначение врача будет не менее эффективным, но без ущерба для здоровья.
На протяжении проводимого лечения врач ориентируется на показатели контрольного лабораторного исследования.
Обезболивание
Доминирующий признак РА — боль в суставах. Неприятное ощущение возникает среди ночи, пробуждает ото сна. Поэтому первостепенная задача при заболевании – купирование болевого синдрома. Врач назначает НПВС при ревматоидном артрите; начинают обычно с Диклофенака. Его свойства оптимальны для купирования признаков заболевания в период рецидива.
Диклофенак обеспечивает следующие реакции:
- сокращает степень проявления болевых ощущений;
- минимизирует отек проблемного участка тела;
- снижает местную гиперемию.
Для достижения положительной динамики нужно придерживаться главного правила – максимальная дозировка препарата не должна превышать 150 мг/день (для взрослого пациента весом до 80 кг вне зависимости от его половой принадлежности).
Для применения всех нестероидных средств существуют такие основы:
- Лекарственные препараты указанной группы обладают накопительным эффектом: не нужно ожидать облегчения самочувствия в первый час после введения раствора. Средний срок, через который отмечаются первые улучшения – 3-4 сутки применения препарата, не раньше.
- Отсутствие терапевтического эффекта по истечении 4 суток говорит о том, что выбранный препарат – слабый в данном клиническом случае, его необходимо заменить более мощным в анальгетическом плане.
- Для предупреждения развития осложнений со стороны пищеварительного тракта и сердца нежелательно применять сочетание из 2 препаратов рассматриваемой группы.
- Инъекции Диклофенака, Ибупрофена или любого другого НПВС проводят только после того, как пациент принял пищу – активные компоненты указанных лекарств сильно раздражают слизистый покров желудка.
Главное осложнение использования НПВП связано с состоянием ЖКТ пациента. Не желая усугубить его, рекомендуется ограничить введение нестероидных средств. Жалобы на боли в желудке, тошноту или рвоту должны послужить основанием для отмены назначения. Обезболивающий эффект по шкале приоритетов менее важен, чем развитие эрозивного гастрита, язвенной болезни желудка или 12-перстной кишки, которыми опасны НПВП. Свести угрозу развития осложнений к минимуму позволит одновременное назначение с НПВС гастропротекторов, защищающих целостность и общее состояние слизистой оболочки желудка. Самым распространенным представителем этой группы является Омепразол – его назначают в дозировке 20 мг.
Проведение гормонотерапии
Чтобы предотвратить развитие патологии и расширение воспалительного спектра, назначают проведение активной гормональной терапии. Положительно зарекомендовали себя кортикостероиды. Гормоны имеют натуральное или искусственное происхождение. Они участвуют в метаболических процессах всех видов.
Востребованность и важность включения гормонов в общий набор лекарств от ревматоидного артрита объясняется их способностью повышать иммунитет до уровня, достаточного для борьбы с системной патологией. Ценится противовоспалительная активность указанных средств.
Гормоны назначают не только отдельно от общего комплекса терапии, но и в качестве дополнения таковой, когда нет ожидаемого эффекта от применения противовоспалительных лекарственных средств нестероидной группы. Кортикостероиды ликвидируют основную симптоматику болезни, купируют процесс поражения внутренних органов.
В клинической практике востребован препарат Преднизолон при ревматоидном артрите. Его назначают из расчета 15-20 мг/день, остальные глюкокортикоиды приравниваются к нему в эквивалентной дозе. К примеру, 5 мг Преднизолона равен 4мг Метилпреднизолона или 0,75 мг Триамцинолона.
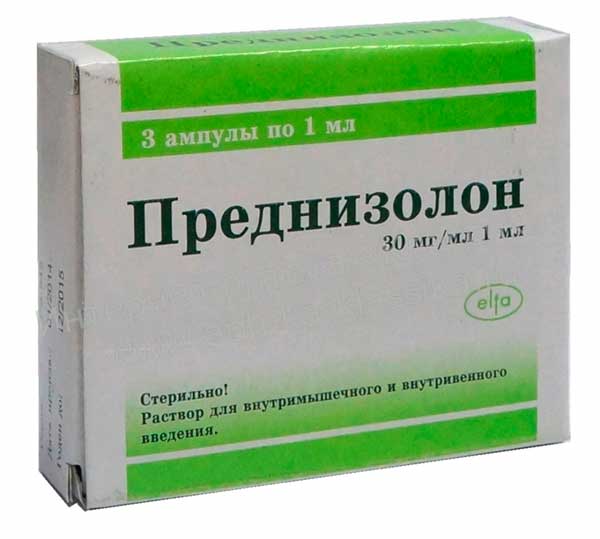
Планируя проведение гормонотерапии, врач учитывает:
- показатели артериального давления больного (гипертония или высокая предрасположенность к таковой – прямое противопоказание к назначению гормонов);
- состояние иммунитета;
- содержание электролитов в крови (концентрацию ионов калия, кальция, натрия, хлора удается выявить только лабораторным способом);
- возраст, пол и вес пациента.
Во избежание побочных эффектов, которые свойственны некорректному применению гормонов, нужно соблюдать основные принципы их использования и фармакокинетические особенности:
- Схема применения гормонов предполагает ежедневное нарастание дозировки. Начинать применение Преднизолона нужно с незначительной дозировки, а подобрав оптимальную терапевтическую дозу для конкретного клинического случая, придерживаться ее.
- Вечерний объем гормонов не должен превышать утренний.
- Достигнув терапевтического эффекта, допустимо незначительно снизить кратность приема глюкокортикоидов. Сокращают применение гормонов до 1 раза в 6-7 дней, а затем полностью отменяют лекарственное средство.
Гормональные лекарства от ревматоидного артрита эффективны с точки зрения обезболивающего свойства, способности купирования воспалительного процесса. Однако на протяжении всего периода их применения нужно контролировать самочувствие пациента. В частности, мониторировать уровень артериального давления, поскольку этот жизненный показатель под влиянием гормональной терапии возрастает.
Выраженный регресс симптомов неврологического происхождения, быстрое купирование боли, расширение возможностей двигательной активности пораженных суставов, улучшение динамики физического состояния пациента создают положительное клиническое впечатление от проведенного лечения.
Лечение Пентоксифиллином
Пентоксифиллин (ПФ) – востребованное медикаментозное средство для лечения ревматоидного артрита. Лекарственный препарат имеет синтетическое происхождение. Является производным веществом Метилксантина (МТ). Препарат активно применяется при стойком нарушении периферического кровообращения. Ценится способность лекарственного средства улучшать реологические свойства крови, одновременно вызывая вазодилатацию.
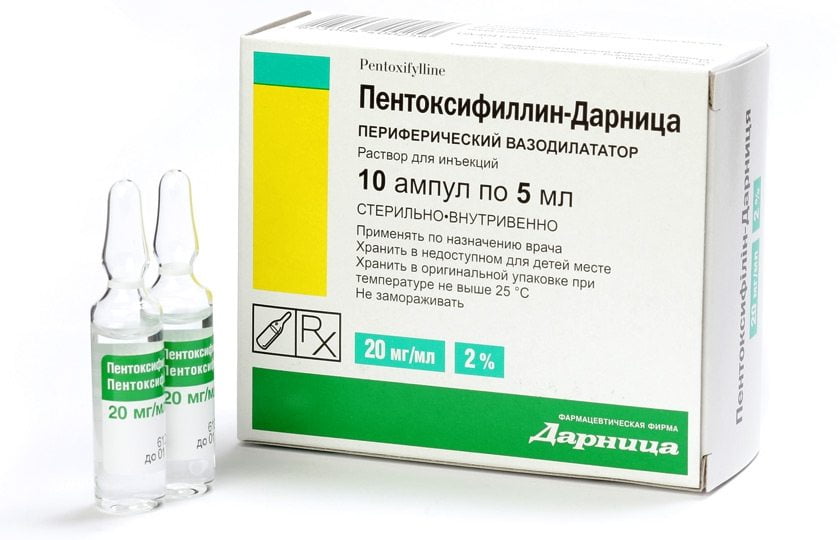
До настоящего времени среди специалистов присутствовали дискуссии относительно целесообразности применения ПФ и МТ. Однако у пациентов в группе применения ПФ суставная болезненность и величина СОЭ были немного меньше, чем в группе МТ. Существенных различий по исходным параметрам между группами пациентов, получавших различные варианты терапии, не установлено.
ПФ применяют только в форме раствора для инъекций – таблетки при ревматоидном артрите менее эффективны. Таблетированные средства характеризуются накопительным эффектом и купируют главные признаки не сразу, а при рассматриваемом заболевании необходимо устранить изнурительную болезненность в минимальные сроки.
Ревматоидный артрит (РА) – достаточно распространенное ревматическое заболевание. Течение патологии на всех этапах сопровождается упорным развитием, сложно поддающимся коррекции и устранению. Опасность системного заболевания заключается в том, что при запускании оно приводит человека к инвалидности. Этот факт в сочетании со статистикой отягощений на фоне и вследствие ревматизма должны послужить серьезным основанием для обращения к врачу.
Не нужно дожидаться развития осложнений, перехода воспаления в хроническую форму – посетите врача при наличии отека и скованности в суставах.
Спектр препаратов, применяемых для лечения РА, ограничен, поэтому оправдан активный поиск новых средств, способных подавлять ревматоидное воспаление. Исследователи отметили, что ПФ снижает активность болезни при РА (симптомы воспаления, число припухших и болезненных суставов).
Длительность лечения Пентоксифиллином при ревматизме составляет не менее 1 месяца. Терапевтический эффект от применения ПФ неоспорим, но в 15% из 100 улучшение может быть отсрочено. Положительная динамика в состоянии пациента (базисный эффект) наступает только при условии применения ПФ длительностью не менее 6 месяцев.
Пентоксифиллин известен не только положительным воздействием на суставы: препарат предполагает вероятность развития побочных эффектов.
Таблица побочных эффектов и изменения показателей лабораторного исследования крови пациентов, принимающих Пентоксифиллин
| Длительность применения средства | Физические осложнения | Изменения лабораторных показателей крови |
| 35 пациентов принимали препарат одновременно с нестероидными средствами на протяжении 14 дней, что позволило визуализировать следующие явления: | Повышенная потливость – у 1 пациента. Чувство прилива жара – у 11. Алопеция – у 1. Кожные высыпания – у 1. Стоматит – у 1. Развитие периферических отеков – у 1 пациента. Гастралгия возникла у 1 больного | В биохимическом анализе крови удалось выявить снижение C-реактивного белка. Клинический анализ крови отражает сниженную скорость оседания эритроцитов (СОЭ). Однако через 6 месяцев терапевтического курса оцениваемые результаты соответствовали исходным данным |
| 30 пациентов принимали препарат отдельно от нестероидных средств на протяжении 21 дня, что позволило визуализировать следующие явления: | Боль в правом подреберье возникла у 2 пациентов. Нарушение вкуса беспокоило 1 больного. Диспепсические расстройства (тошнота, рвота) возникали у 5 человек. Сердцебиение учащалось у 2 пациентов. Головная боль и головокружение возникали у 2 человек | Уменьшение болевого синдрома происходит только при условии применения ПФ вместе с МТ и только на протяжении курса длительностью 3 месяца |
Суммируем проведенные наблюдения: в группе больных, получавших ПФ не в составе комплексной терапии, достоверно не улучшился ни один показатель за весь период наблюдения.
Заключение
Ревматоидный артрит – это серьезное заболевание. Оно не несет угрозы для жизни, как онкологические новообразования, но изнурительная симптоматика и постепенное поражение внутренних органов на фоне ослабленного иммунитета разрушительны для здоровья. Категорически противопоказано проводить терапию по собственному усмотрению.
Даже самое эффективное лекарство от ревматоидного артрита не поможет, если его назначал не врач. Ликвидировать патологию удается не во всех случаях – качественные препараты, которые принимались пациентом по схеме, установленной специалистом, позволяют достичь ремиссии. Однако первое уменьшение болезненности в суставах и минимальное улучшение самочувствия не должны послужить поводом для прекращения лечения – пройдите курс полностью!
Лекарства последнего поколения, разработанные по современным технологиям фармацевтики, облегчают страдания человека, снижают риск дальнейших осложнений. Что же такое ревматоидный артрит, каковы причины, симптомы, какие методы лечения возможны?

Что собой представляет болезнь?
Это системная неврологическая патология, связанная с воспалением хрящевой ткани в суставном сочленении. Причинно-следственные связи клинического состояния различны. Однако все они обусловлены проблемами в работе защитной иммунной организации человека. Наиболее вероятный провоцирующий фактор – инфекционное поражение.

Реакция на воспалительный процесс инфицирования – это медленное разрушение соединительных тканей, связанное с их дегенеративно-дистрофической реорганизацией.
Если вовремя не провести адекватное лечение, то следующим этапом дегенерации станет деформация суставной поверхности. Это влечет значительное ограничение подвижности костно-суставных сегментов ОДА нижней конечности.
Возможные причины возникновения неврологической патологии:
- генетическая зависимость;
- воздействие хронических заболеваний на суставные сегменты;
- действие пусковых факторов: переохлаждение, интоксикация, реакция костно-суставной системы на мутагенные лекарственные средства.
При ревматоидном артрите симптомы заболевания без медикаментозной терапии могут сохраняться длительное время и выражаться в следующих проявлениях:
-
различной степени интенсивности, даже при незначительных нагрузках;
- присутствие отечности, покраснения в месте поражения;
- нарушение температурного режима, как результат воспалительной реакции в соединительной ткани.
Такие симптоматические признаки возможны при любых воспалительных реакциях. Поэтому перед тем как проводить лечение ревматоидного артрита, необходимо идентифицировать диагностические признаки заболевания.

Человеку необходимо обратиться к врачу, который на основе собранного анамнеза, диагностического лабораторного исследования (УЗИ, рентген, МРТ, КТ), других уточняющих процедур диагностики определит степень выраженности неврологической патологии. Он установит причинно-следственную связь воспалительной реакции, назначит медикаментозное лечение.
При лечении обязательна двигательная активность суставных сегментов. С этой целью консультирующий специалист назначает физиотерапевтические процедуры, лечебный массаж, гимнастические упражнения, мануальные методы воздействия на суставную патологию.
Подробное видео о природе заболевания:
Системная медикаментозная терапия
Лечебная терапевтическая реакция предусматривает применение пяти групп фармакологических лекарственных средств.
| № п/п | Фармакологические комбинации | Назначение лекарственных средств |
| 1 | Нестероидные противовоспалительные (НПВП) | Устранение симптомов |
| 2 | Базисные противоревматические группы | Уменьшение воспалительной активности, смягчение костно-суставной деструкции |
| 3 | Глюкокортикостероиды | Нормализация обменных функций, восстановление активного кровообращения |
| 4 | Биологические средства лечения | Устранение ферментативного разрушения близлежащих тканевых соединений суставной поверхности |
| 5 | Миорелаксанты | Для расслабления скелетной мускулатуры при значительном снижении двигательной активности |
Нестероидные противовоспалительные
При обезболивании и устранении воспалительной реакции врачи назначают наиболее известные препараты нестероидной противовоспалительной активности – Диклофенак®, Ибупрофен® или Парацетамол®.

Однако существуют более действенные средства лечения из нестероидной противовоспалительной группы с наименьшим эффектом побочного воздействия, связанным с органами мочеполовой, желудочно-кишечной систем.
Среди нестероидных противовоспалительных комбинаций выделяется Дексалгин® 25 немецкого производителя – компании BERLIN-CHEMIE/MENARINI PHARMA GmbH. Выпускается в виде таблеток с активным действующим веществом декскетопрофеном, отпускаемый в аптечной сети только по рецептурному назначению врача. Благодаря активному компоненту и вспомогательным веществам (кукурузный крахмал, микрокристаллическая целлюлоза и т. д.) нестероидная лекарственная форма оказывает анальгезирующее, противовоспалительное и жаропонижающее действие.
После приема фармацевтического средства основные симптомы ревматоидного артрита — боль, отечность, покраснение – исчезают через 30-40 минут. Однако длительность обезболивания составляет 4-5 часов – и наступает новый виток болевых приступов. Дозировка и курс лечения определяется лечащим специалистом с учетом возрастных, половых, индивидуальных особенностей пациента.
Препарат не назначается беременным женщинам, детям до 12 лет, больным людям с хроническими дыхательными патологиями, почечной и печеночной недостаточностью. Лекарство не предназначено для длительного применения. Курс лечения не должен превышать 5-7 дней.
Следующий нестероидный противовоспалительный препарат нового (последнего) поколения – это Вольтарен® акти российского производителя АО «ГлаксоСмитКляйн Хелскер». Лекарство выпускается в виде таблеток белого цвета. Основное действующее вещество – диклофенак натрия.
Вольтарен® акти обладает всеми свойствами фармакологических средств нестероидной противовоспалительной активности – жаропонижающим, болеутоляющим. Лечебный эффект наступает после 15-20 минут, что делает эффективным применение препарата для скорейшего купирования болевого приступа и урегулирования температурного режима. Курс лечения лекарственным средством не должен превышать 5 дней. Противопоказания: язвенная болезнь желудка, дети до 14 лет, почечная, печеночная или сердечная недостаточность. Принимать его не рекомендуют людям с хронической патологией органов дыхания.
Среди новинок фармацевтической промышленности для наружного применения – противовоспалительный анальгезирующий крем Аэртал® испанской фирмы «ALMIRALL S.A.».
Благодаря активному действующему веществу – ацеклофенаку — применение лекарственной формы целесообразно при воспалении в суставе, других костно-мышечных, суставных сегментах опорно-двигательного аппарата.
Исключения – заболевания кожного покрова в месте предполагаемого проведения терапевтических действий, индивидуальная непереносимость фармакологического продукта.
Базисные противоревматические препараты
Среди интересных модифицирующих антиревматических продуктов фармацевтического рынка:
- Азатиоприн® – рецептурный препарат российского производителя ОАО «МОСХИМФАРМПРЕПАРАТЫ им. Н.А.Семашко», выпускаемый в таблетированной форме. Иммунодепрессант блокирует клеточное деление, пролиферацию (разрастание) поврежденных тканей в полости сустава. Лекарственная форма практически не имеет побочных действий и противопоказаний. Единственное ограничение – это индивидуальная непереносимость пациентом действующего вещества и беременность;
- Сульфасалазин® – лекарственный препарат компании «KRKA d. d.» (Словения), обладает свойствами базисной противоревматической терапии. Это основное средство лечения ревматоидного, ювенильного артритов. Среди ограничений – функциональное нарушение печени и/или почек, болезни крови, повышенная чувствительность к сульфаниламиду и производным салициловой кислоты, детский возраст до 7 лет;
- Доксициклин® – полусинтетический антибиотик от ЗАО «БИНЕРГИЯ» (Россия), обладающий антибактериальным действием. Проникая в организм при помощи внутримышечного введения, лекарство действует разрушающе на синтез протеинов в микробной клетке. Противопоказания: аллергическая реакция на тетрациклиновую группу, дети до 10 лет, беременные, кормящие женщины.
Как и чем лечить болезнь, решает лечащий врач. Данная группа лекарственных препаратов обладает очень медленным терапевтическим эффектом. Рекомендуется применять базисные средства лечения совместно с прочими фармакологическими группами – нестероидными противовоспалительными препаратами, глюкокортикостероидами.
Глюкокортикостероиды
Этот вид фармакологических препаратов представляет собой стероидный гормон, синтезируемый корой надпочечников, обладающий разносторонним физиологическим действием:
- противовоспалительным;
- антиаллергическим;
- иммунорегулирующим;
- антишоковым;
- противострессовым.
Среди назначаемых фармакологических средств последнего поколения наиболее эффективны:
- Преднизолон® буфус – лекарственная форма российского производителя ЗАО «ОБНОВЛЕНИЕ ПФК», раствор для инъекций внутримышечного и внутривенного введения. Фармакологический препарат обладает выраженным действием на метаболизм жиров, белков и углеводов. Преднизолон® буфус оказывает воздействие на соединительные ткани костно-мышечных структур, способствует водно-электролитному обмену веществ и кровообращению. Режим дозирования определяется лечащим врачом, так как лекарственная форма имеет множество побочных действий. Противопоказания: выраженная костно-суставная деструкция, функциональные нарушения работы мочеполовой и желудочно-кишечной систем, дети до 15 лет, женщины II и III триместра беременности;
- Дексазон® – рецептурная лекарственная форма компании «GALENIKA a. d.» (Сербия) выпускается в виде инъекционного раствора с основным действующим компонентом – дексаметазоном. Дексазон обладает всеми свойствами лекарственных средств кортикостероидной активности. Противопоказания определяются по индивидуальным физиологическим параметрам пациента;
- Дипроспан® – суспензия для инъекций российского ООО «МСД ФАРМАСЬЮТИКАЛС». Фармакологическое действие – минералокортикоидная и глюкокортикоидная активность. Лекарственная форма оказывает иммунодепрессивное, противовоспалительное воздействие благодаря активному действующему веществу – бетаметазону. Показания к применению – любые виды заболеваний костно-мышечной системы, мягких соединительных тканей ревматической и артрологической природы. Противопоказания: гиперчувствительность к действующим компонентам.
Являясь мощнейшим контринсулярным гормоном, глюкокортикостероиды практически не назначаются пациентам с сахарным диабетом.
Биологические средства лечения
При ревматоидном артрите происходит ферментация синовиальной оболочки в суставной полости, которая приводит к разрушению дисульфидных связок в близлежащих костно-суставных тканях и хрящах. Это влечет каскадную реакцию, усугубляет клиническую симптоматику неврологического заболевания. Организм отвечает воспалительной реакцией, сопровождающейся выработкой цитокинов, наиболее опасен ФНО – фактор некроза опухоли. Такое состояние может обеспечить пациенту значительное снижение подвижной активности суставов и физическую нетрудоспособность.
Поэтому в комплексное лечение вводятся специальные блокаторы (ингибиторы ФНО) или антицитоновые препараты:
- Ремикейд® российского производителя ООО «МСД ФАРМАСЬЮТИКАЛС» – противоопухолевый ингибитор ФНО, обеспечивающий широкий спектр биологической активности против воспалительной реакции, участвующий в модуляции иммунной системы. Терапия инфликсимабом – основным действующим компонентом лекарственного средства – обеспечивает снижение клеточной инфильтрации в воспаленных участках сустава. Он назначается при активной форме ревматоидного артрита. Частота и длительность лечения устанавливаются по индивидуальной схеме терапевтического лечения. Противопоказания: индивидуальная непереносимость, беременность и кормление грудью у женщин, дети до 18 лет, тяжелые инфекционные поражения;
- Энбрел® – раствор для инъекций компании «WYETH WHITEHALL EXPORT GmbH» (Австрия). Лекарственное средство назначается при умеренной или тяжелой форме ревматоидного артрита, идиопатическом полиартрите у детей, прогрессирующем псориатическом артрите у взрослых, прочих повреждениях суставной массы неврологического характера. Противопоказания: тяжелые инфекции активной формы, беременность и грудное вскармливание, повышенная чувствительность к действующему компоненту – этанерцепту;
- Симзия® – рецептурная лекарственная форма бельгийского производителя компании «UCB Pharma S.A.». Основной действующий компонент раствора для подкожного введения – цертолизумаб пэгол (Certolizumab pegol). Средство является основным ингибитором фактора некроза опухоли (ФНО), широко применяется при ревматоидном артрите суставов нижних или верхних конечностей, псориатическом артрите, аксинальном спондилоартрите. Противопоказания: пожилые пациенты от 65 лет и старше, беременные женщины, дети до 16 лет.
Миорелаксанты
Медицинский термин происходит от латинского myorelaxantia, где myo – это мускул, relaxantis – расслабляющий. Цель их назначения – это снижение мышечного тонуса в зоне неврологического повреждения. Классифицируется лекарственная форма следующим образом (смотреть таблицу).
| Деполяризующие миорелаксанты | Не деполяризующие миорелаксанты | ||
| Ультракороткого действия | Короткого действия | Среднего действия | Длительного действия |
| Дитилин® – деполяризующий миорелаксант короткого действия | Мивакрон® – для кратковременного угнетения нервно-мышечной передачи | Тракриум® – лекарственная форма периферического действия конкурентного типа. Основной компонент – атрикурия безилат снижает чувствительность холинорецепторов, обеспечивая невозможность возбуждения и сокращения мышечного волокна | Павулон® – недеполяризующий миорелаксант продолжительной активности, обеспечивающий релаксацию скелетной мускулатуры |
Доклад на тему медикаментозного лечения:
Прогноз
Обязательным условием для скорейшего выздоровления является не только применение медикаментозных фармацевтических комбинаций. В комплексную терапию необходимо включать физиотерапевтические процедуры, специальные упражнения, лечебный массаж, санаторно-курортное оздоровление.
В случае неэффективности перечисленных методов терапии или при прогрессировании болевой симптоматики в костно-суставном сегменте предусмотрено хирургическое вмешательство:
- артродез;
- синовэктомия;
- эндопротезирование.
Медицинские эксперты отмечают, что продолжительность жизни пациентов с ревматоидной патологией сокращает жизнь человека в среднем на 5-10 лет.
По лабораторным исследованиям американской Клиники Мэйо (США, Миннесота), проведенным в 2005 году, риск сердечно-сосудистых патологий в 2 раза выше у пациентов, страдающих ревматическими и артрологическими заболеваниями. Эта неутешительная статистика в наибольшей степени объясняется хронической стадией ревматоидного артрита опорно-двигательной системы.
Уменьшить риск хронических патологий и увеличить продолжительность жизни поможет назначение биофармацевтических средств лечения. Они активно воздействуют на жизненно важные биологические объекты – кровь, клеточную структуру и соединительные ткани.
В статье приводятся данные о месте метотрексата в соответствии с международными и национальными рекомендациями 2019–2020 гг. в ведении больных ревматоидным и псориатическим артритом. Приведены данные о распространенности данных заболеваний, об эффективнос
Methotrexate in the treatment of rheumatoid arthritis and psoriatic arthritis / N. V. Chichasova*, **, 1, Doctor of Medicine, Professor / A. M. Lila*, **, Doctor of Medicine, Professor / * FSBSI V. A. Nasonova Research Institute of Rheumatology, Moscow, Russia / ** FSBEI FPE RMACPE MON Russia Federal State Budgetary Educational Institution of Further Professional Education «Russian Medical Academy of Continuous Professional Education» of the Ministry of Healthcare of the Russian Federation, Moscow, Russia
Abstract. The article provides data on the place of methotrexate in accordance with international and national recommendations 2019–2020 in the management of patients with rheumatoid and psoriatic arthritis. Data on the prevalence of these diseases, the effectiveness and tolerability of methotrexate according to randomized controlled and cohort studies are presented. The advantages of the subcutaneous form of methotrexate in terms of efficacy and tolerability for both rheumatoid and psoriatic arthritis are discussed. Data on the tolerance of the subcutaneous form of methotrexate from various manufacturers are presented. Analysis of literature data and the results of our own research indicate the need for early prescription of methotrexate in patients with rheumatoid arthritis and patients with peripheral joint lesions in psoriatic arthritis. Numerous studies confirm the effectiveness of methotrexate in rheumatoid arthritis in relation to the symptoms of the disease, both articular and non-articular, structural damage (slowing down X-ray progression), which is accompanied by an improvement in the patient’s functional abilities. With psoriatic arthritis, methotrexate is able to reduce the activity of arthritis, enthesitis, reduce skin manifestations, and improve the functional state of the patient. Treatment with methotrexate, when the clinical effect is achieved, is accompanied by a decrease in cardiovascular complications in inflammatory lesions of the joints.
Резюме. В статье приводятся данные о месте метотрексата в соответствии с международными и национальными рекомендациями 2019–2020 гг. в ведении больных ревматоидным и псориатическим артритом. Приведены данные о распространенности данных заболеваний, об эффективности и переносимости метотрексата по данным рандомизированных контролируемых и когортных исследований. Обсуждаются преимущества подкожной формы метотрексата в отношении эффективности и переносимости как при ревматоидном, так и при псориатическом артрите. Представлены данные по переносимости подкожной формы метотрексата различных производителей.
Анализ данных литературы и результаты собственных исследований свидетельствуют о необходимости раннего назначения метотрексата больным ревматоидным артритом и больным с поражением периферических суставов при псориатическом артрите.
Многочисленные исследования подтверждают эффективность метотрексата при ревматоидном артрите в отношении симптомов болезни, как суставных, так и не суставных, структурных повреждений (замедление рентгенологического прогрессирования), что сопровождается улучшением функциональных способностей больного. При псориатическом артрите метотрексат способен уменьшить активность артритов, энтезитов, уменьшить кожные проявления, улучшить функциональное состояние больного. Лечение метотрексатом при достижении клинического эффекта сопровождается уменьшением кардиоваскулярных осложнений при воспалительном поражении суставов.
Метотрексат в лечении РА
Основные принципы лечения РА хорошо известны клиницистам. В соответствии с разработанной в настоящее время стратегией лечения РА [11] основной целью является достижение ремиссии (или низкой активности заболевания) у всех больных. В соответствии с международными и отечественными рекомендациями терапия синтетическими классическими базисными противовоспалительными препаратами (БПВП) должна начинаться сразу после установления диагноза (желательно в первые 3–6 месяцев от дебюта РА) [1, 12]. По данным анализа 14 рандомизированных контролируемых исследований (РКИ), в которых оценивалась частота развития эффекта у 1435 больных (886 получали различные БПВП и 549 — плацебо) при различной длительности РА (с учетом пола, возраста, клинических и лабораторных параметров активности болезни), по мере увеличения длительности болезни частота развития эффекта БПВП снижалась с 52% (начало терапии в 1-й год болезни) до 35% (длительность РА > 10 лет) больных, ответивших на терапию [13].
«Якорным» препаратом из группы БПВП в лечении РА с конца прошлого столетия является метотрексат (МТ), поскольку он эффективен у большинства больных РА, обладает хорошей переносимостью доз, используемых в ревматологии при ограниченных противопоказаниях (острая инфекция, алкоголизм, беременность) (рис. 1) [14, 15]. МТ при РА может применяться в виде монотерапии, в комбинации с другими синтетическими (классическими и таргетными) БПВП или с генно-инженерными биологическими препаратами (ГИБП). В виде монотерапии (с или без глюкокортикоидов) МТ эффективен в первой линии фармакотерапии с уменьшением активности РА до низкой у 70% больных [16].
Перед назначением МТ следует оценить факторы риска нежелательных лекарственных реакций (НЛР): прием алкоголя, ожирение, нарушение функции печени, почек; исследовать лабораторные параметры (АСТ, АЛТ, альбумин, общий анализ крови, креатинин, глюкоза, липиды, тест на беременность, маркеры вирусных инфекций — ВИЧ, гепатиты В/С), провести рентгенографию органов грудной клетки. Оптимальными терапевтическими дозами при лечении хронических воспалительных артритов считаются от 10–15 до 25–30 мг/неделю [17]. С учетом антифолатного действия МТ показана комбинация его с фолиевой кислотой в дозе 1–2 мг в те дни, когда МТ не принимается, что позволяет уменьшить частоту НЛР [18]. Начинают лечение с дозы 10–15 мг/неделю с увеличением ее на 2,5–5,0 мг каждые 2–4 недели с ориентацией на эффективность и переносимость [1]. В отечественных рекомендациях указано, что при наличии у больного РА высокой активности (т. е. те больные, которым показано использование дозы МТ ≥ 15 мг/неделю) рекомендуется начинать лечение с подкожной формы МТ. Известно, что биодоступность подкожной формы МТ выше, чем пероральной, особенно при назначении рекомендуемых высоких доз МТ и их быстрой эскалации [19]. В табл. приведено соотношение доз таблетированного МТ и МТ для подкожного введения. Кроме того, концентрация МТ в сыворотке при приеме его per os нарастает только до недельной дозы 15 мг, а дальнейшее увеличение дозы не приводит к значимому нарастанию концентрации препарата в сыворотке крови (рис. 2) [20]. Объясняется это особенностями фармакодинамики различных форм МТ. При назначении МТ перорально препарат абсорбируется в проксимальном отделе тощей кишки при посредстве транспортера (PCFT/SLC46A1), что редуцирует фолаты и МТ [21]. Биодоступность орального МТ относительно высока, но варьирует в широких пределах у пациентов и снижается при увеличении дозы, выходя на плато при дозе 15 мг/неделю за счет сатурации интестинального транспорта [19, 20, 22]. При этом концентрация в плазме МТ при подкожном введении продолжает нарастать и при увеличении дозы выше 15 мг/неделю [19].
Результаты многих исследований показали большую эффективность подкожного введения МТ по сравнению с таблетированной формой в равных дозах и возможность достоверного увеличения эффекта в тех случаях, когда оральный препарат был неэффективен или недостаточно эффективен (рис. 3) [23–26]. Подкожная форма МТ лучше переносится, чем оральная. При появлении НЛР со стороны желудочно-кишечного тракта (ЖКТ) или печени показан перевод больного на подкожное введение, что позволяет уменьшить нежелательные проявления или купировать их, а это сопряжено с сохранением (нарастанием) эффекта, увеличивает выживаемость терапии и позволяет избежать или отсрочить назначение дорогостоящей терапии ГИБП [27, 28]. Данные исследования MENTOR (Methotrexate Evaluation of Norwich Treatment Outcomes in RA) оценили эффект перевода больных с орального на подкожный МТ в краткосрочный, средний и долговременный (до 5 лет наблюдения) периоды из-за непереносимости (43,9% больных) или из-за неэффективности (50,5% больных) в когорте из 196 пациентов с длительно текущим РА [29]. Смена формы МТ привела и к увеличению выживаемости терапии (83% больных продолжили лечение в течение 1 года, 75% — в течение 2 лет и 47% — в течение 5 лет) с минимальной потребностью в терапии ГИБП (10% больных). Метаанализ подтвердил преимущества подкожного МТ перед оральной формой в отношении и эффективности, и переносимости [30]
Особенно эффективно назначение подкожного МТ при раннем РА. Это показано на примере когорты St. Gallen [31] — 70 больным терапия подкожным МТ была инициирована без использования оральной формы. Через 1,8 года 53% больным не потребовалось присоединение ГИБП, а 47% больным ГИБП были присоединены через 387 ± 404 дня. Частота достижения низкой активности или ремиссии РА была несколько меньше в группе комбинированной терапии МТ + ГИБП, чем в группе, получавшей только МТ (низкая активность у 78,8% vs 81,1%; ремиссия — 69,7% vs 75,7%).
По нашим данным, назначение подкожного МТ (без использования оральной формы и без комбинации с глюкокортикоидами) 67 больным РА с исходно высокой и умеренной активностью болезни в первые полгода заболевания позволяет во всех случаях в течение 6–12 месяцев достичь ремиссии (в ряде случаев безлекарственной) или минимальной активности заболевания, предотвратить разрушение суставов, сохранить функциональные способности больного при отмене из-за непереносимости (flu-синдром) у 2 больных (3%) [32].
Такие же данные получены сотрудниками Научно-исследовательского института ревматологии им. В. А. Насоновой [33] в исследовании РЕМАРКА: 191 больному была назначена подкожная форма МТ (без использования оральной формы) в начальной дозе 15 мг/неделю с эскалацией дозы до переносимой за 4–8 недель, что позволило добиться ремиссии у 54,1% больных за первый год лечения без применения глюкокортикоидов (ГК) и ГИБП.
Многолетний опыт применения МТ в лечении больных РА свидетельствует о его хорошей переносимости при длительном использовании [36]. Наиболее часто на фоне МТ отмечаются НЛР со стороны ЖКТ, печени и инфекции. Как правило, НЛР со стороны ЖКТ нетяжелые (гастралгии, нарушения стула, диспепсия), применение фолиевой кислоты позволяет существенно уменьшить их частоту, также как и перевод больного с оральной формы препарата на подкожную. Повышение концентрации трансаминаз отмечается в среднем у каждого 5-го пациента, получающего МТ, но увеличение их уровней более чем в 2 раза регистрируется всего у 1–2% больных [37].
В ранние сроки лечения МТ (через 3–4 недели от начала применения) может развиться пневмонит, клинически проявляющийся появлением сухого кашля, одышкой, гипоксемией. Это НЛР рассматривается как идиосинкразия, требует отмены МТ и назначения преднизолона (15–20 мг/сутки) до купирования симптомов [38, 39]. Другие нежелательные легочные реакции связаны преимущественно с развитием респираторных инфекций и пневмонии, что требует только перерыва в приеме МТ до купирования инфекции. По данным метаанализа [40] на фоне МТ отмечается минимальное увеличение риска всех легочных НЛР — 1,1 (95% ДИ 1,02–1,19). Кроме того, имеются данные об эффективности монотерапии МТ или комбинированной терапии МТ и другими БПВП в отношении поражения легких, связанного с РА [41, 42], одного из самых частых внесуставных проявлений РА. Таким образом, риск развития НЛР на фоне лечения МТ, в первую очередь таких потенциально тяжелых, приводящих к необходимости прервать лечение МТ, как легочные и печеночные, представляется существенно преувеличенным, что должно послужить предостережением против необоснованной отмены МТ при РА [43].
Метотрексат в лечении ПсА
При ПсА, как и при РА, раннее назначение терапии и контроль за достаточностью эффекта на этапах лечения способствует лучшему клинико-функциональному и рентгенологическому исходам болезни, о чем свидетельствуют данные зарубежных наблюдательных когортовых исследований [44–46]. Целью лечения ПсА, как и при РА, является достижение ремиссии или низкой активности болезни [47]. В соответствии с международными (Европейская противоревматическая лига — European League Against Rheumatism, EULAR, Международная лига ревматологических ассоциаций — League of Associations for Rheumatology, ILAR, и группа по изучению и оценке псориаза и псориатического артрита — GRAPPA) и национальными рекомендациями [47–50] терапия больных ПсА зависит от субтипа болезни (рис. 4). При наличии периферического артрита показано как можно более раннее назначение БПВП, предпочтительно назначение МТ, особенно при наличии кожных поражений. При моно-/олигоартрите и наличии прогностически неблагоприятных факторов, таких как появление структурных повреждений, высокий уровень СОЭ/СРБ, развитие дактилита или поражения ногтей, также показан старт терапии МТ. При отсутствии прогностически неблагоприятных факторов при данном субтипе ПсА назначают нестероидные противовоспалительные препараты (НПВП) и при необходимости — внутрисуставное введение ГК, достижение цели лечения оценивают через 4 недели. Если цель в эти сроки не достигнута, также рекомендуется начало терапии МТ (или другими БПВП при невозможности назначить МТ). При аксиальной форме поражения БПВП не показаны, лечение начинают с НПВП ± внутрисуставное введение ГК с оценкой достижения цели за 4–12 недель.
МТ уменьшает активность артрита при ПсА. При оценке выраженности синовита по данным повторных биопсий синовиальной оболочки, взятых до назначения МТ и через 6–18 месяцев, было показано, что назначение МТ приводило к уменьшению пролиферации кроющего слоя, редукции инфильтрации подпокровного слоя лимфоцитами (CD3, CD4, CD8, CD68), редукции поликлональных CD4+ Т-клеток, некоторому уменьшению олигоклональных CD8 Т-клеток [51, 52]. У этих пациентов отмечалось и клинически достоверное уменьшение суставного индекса, числа припухших суставов, а также индекса активности болезни (DAS).
Данные об использовании МТ при ПсА немногочисленны, включают небольшие или неубедительные [53] исследования, а также ограниченное количество наблюдательных исследований. Так, при сравнении эффекта МТ у больных ПсА (n = 430) и РА (n = 1218) в течение двухлетнего наблюдения авторы не отметили различий в эффективности МТ при этих нозологиях: через 6 месяцев отмечено и при ПсА, и при РА уменьшение выраженности большинства параметров активности заболевания, а выживаемость терапии через 2 года составила 65% и 66% соответственно [54].
Количество РКИ, оценивающих эффективность монотерапии МТ при ПсА, ограничено, и они выполнены преимущественно в сравнении с ГИБП. Основываясь на данных исследования SEAM-PsA [59], в котором отмечается одинаковый эффект монотерапии МТ, монотерапии этанерцептом и даже комбинации МТ с этанерцептом в отношении уменьшения числа вовлеченных в процесс суставов, кожного поражения, энтезитов, дактилита и улучшения физической функции, эксперты EULAR сформулировали рекомендацию о необходимости быстрого назначения БПВП на ранней стадии ПсА, предпочтительнее МТ при имеющемся поражении кожи [47].
Следует указать, что системное применение МТ ассоциируется с достоверным снижением риска КВ-заболеваний как при РА, так и ПсА [62, 63], и при РА ассоциируется с 70% снижением смертности от КВ-причин (при ПсА этот аспект недостаточно изучен).
Заключение
Анализ данных литературы и результаты собственных исследований свидетельствуют о необходимости раннего назначения МТ больным РА и пациентам с поражением периферических суставов при ПсА.
Многочисленные исследования подтверждают эффективность МТ при РА в отношении симптомов болезни, как суставных, так и не суставных [64], структурных повреждений (замедление рентгенологического прогрессирования) [65], что сопровождается улучшением функциональных способностей больного [64]. При ПсА МТ способен уменьшить активность артритов, энтезитов, кожные проявления, улучшить функциональное состояние больного [47, 57]. Лечение МТ при достижении клинического эффекта сопровождается уменьшением КВ-осложнений при воспалительном поражении суставов [62, 63].
Применение подкожной формы МТ позволяет увеличить эффективность терапии и отсрочить назначение дорогостоящей терапии ГИПБ: в масштабном исследовании, включившем 35 640 больных РА, которым была назначена оральная форма МТ, было показано, что 20 041 больному потребовалось усиление терапии, так что в 87% случаев к оральной форме МТ был добавлен ГИБП, а 13% больных были переведены на подкожную форму МТ, и при 5-летнем наблюдении этим больным потребовался переход на комбинацию с ГИБП только в 28% случаях [66]. Оптимизация лечения МТ больных с периферическими артритами подразумевает переход с оральной формы МТ на подкожную при недостаточном эффекте или появлении симптомов непереносимости, а также предлагается сразу начинать терапию с подкожной формы с учетом ее большей биодоступности и нарастания концентрации препарата в плазме при необходимости увеличения дозы более 15 мг/неделю [67]. И инициация терапии подкожным МТ, и перевод с оральной формы на подкожную сопровождаются увеличением выживаемости терапии и за счет лучшей эффективности, и за счет лучшей переносимости [27–30, 67, 68].
Литература/References
Н. В. Чичасова* , ** , 1 , доктор медицинских наук, профессор
А. М. Лила* , **, доктор медицинских наук, профессор
* ФГБНУ НИИР им. В. А. Насоновой, Москва, Россия
** ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
Метотрексат в лечении ревматоидного артрита и псориатического артрита/ Н. В. Чичасова, А. М. Лила
Для цитирования: Лечащий врач № 7/2020; Номера страниц в выпуске: 42-51
Теги: суставы, воспаление, боль, осложнения
Читайте также:

