После операции не чувствую кожу возле шрама
Обновлено: 26.04.2024
Васкулиты кожи — группа заболеваний мультифакторной природы, при которых ведущим признаком является воспаление кровеносных сосудов дермы и подкожной клетчатки.
Васкулиты кожи — группа заболеваний мультифакторной природы, при которых ведущим признаком является воспаление кровеносных сосудов дермы и подкожной клетчатки.
Трудность в освещении этой темы заключается в том, что до настоящего времени нет общепринятой классификации и даже согласованной терминологии васкулитов. В настоящее время описано около 50 различных нозологических форм, и разобраться в этом многообразии непросто. Пестрота клинических проявлений и недостаточно изученные патогенетические механизмы привели к тому, что под разными названиями может скрываться лишь вариант основного типа поражения кожи. Также, помимо первичных васкулитов, в основе которых лежит воспалительное поражение сосудов кожи, выделяют и вторичные васкулиты (специфические и неспецифические), развивающиеся на фоне определенного инфекционного (сифилис, туберкулез и др.), токсического, паранеопластического или аутоиммунного (системная красная волчанка, дерматомиозит и др.) процесса. Возможна трансформация васкулита кожи в системный процесс с поражением внутренних органов и развитием тяжелых, иногда опасных для жизни осложнений.
Васкулиты кожи — заболевания полиэтиологические. Наиболее часто наблюдается связь с фокальной инфекцией (стрептококки, стафилококки, микобактерии туберкулеза, дрожжевые грибы, вирусы и др.). Определенное значение имеет повышенная чувствительность к ряду лекарственных веществ, в частности к антибиотикам и сульфаниламидным препаратам. Нередко, несмотря на тщательно собранный анамнез и проведенное обследование, этиологический фактор остается невыясненным. Среди факторов риска при васкулитах следует учитывать: возраст (наиболее уязвимы дети и пожилые люди), переохлаждение, чрезмерную инсоляцию, тяжелые физические и психические нагрузки, травмы, операции, заболевания печени, сахарный диабет, гипертонию. Патогенетическим механизмом развития васкулитов кожи в настоящее время считается образование циркулирующих иммунных комплексов с последующей их фиксацией в эндотелии, хотя окончательно это доказано не для всех заболеваний данной группы.
Васкулиты кожи — это неоднородная группа заболеваний, и клинические проявления их чрезвычайно разнообразны. Однако существует целый ряд общих признаков, объединяющих эти дерматозы:
1) воспалительный характер изменений кожи;
2) симметричность высыпаний;
3) склонность к отеку, кровоизлияниям и некрозу;
4) первичная локализация на нижних конечностях;
5) эволюционный полиморфизм;
6) связь с предшествующими инфекционными заболеваниями, приемом лекарств, переохлаждением, аллергическими или аутоиммунными заболеваниями, с нарушением венозного оттока;
7) острое или обостряющееся течение.
Поражения кожи при васкулитах многообразны. Это могут быть пятна, пурпура, узелки, узлы, некрозы, корки, эрозии, язвы и др., но основным клиническим дифференциальным признаком является пальпируемая пурпура (геморрагическая сыпь, возвышающаяся над поверхностью кожи и ощущаемая при пальпации).
Общепринятой классификации васкулитов не существует. Систематизируют васкулиты по разным принципам: этиологии и патогенезу, гистологической картине, остроте процесса, особенностям клинических проявлений. Большинство клиницистов пользуются преимущественно морфологическими классификациями кожных васкулитов, в основу которых обычно положены клинические изменения кожи, а также глубина расположения (и соответственно калибр) пораженных сосудов. Выделяют поверхностные (поражение сосудов дермы) и глубокие (поражение сосудов на границе кожи и подкожной клетчатки) васкулиты. К поверхностным относят: геморрагический васкулит (болезнь Шенлейна–Геноха), аллергический артериолит (полиморфный дермальный ангиит), лейкокластический геморрагический микробид Мишера–Шторка, а также хронические капилляриты (гемосидерозы): кольцевидная телеангиэктатическая пурпура Майокки и болезнь Шамберга. К глубоким: кожную форму узелкового периартериита, острые и хронические узловатые эритемы.
Геморрагический васкулит — системное заболевание, поражающее мелкие сосуды дермы и проявляющееся пальпируемой пурпурой, артралгиями, поражением желудочно-кишечного тракта (ЖКТ) и гломерулонефритом. Встречается в любом возрасте, но наибольшему риску подвергаются мальчики в возрасте от 4 до 8 лет. Развивается после инфекционного заболевания, через 10–20 дней. Острое начало заболевания, с повышением температуры и симптомами интоксикации чаще всего наблюдается в детском возрасте. Выделяют следующие формы геморрагического васкулита: кожная, кожно-суставная, кожно-почечная, абдоминально-кожная и смешанная. Течение может быть молниеносным, острым и затяжным. Длительность заболевания различна — от нескольких недель до нескольких лет.
Процесс начинается симметрично на нижних конечностях и ягодицах. Высыпания имеют папулезно-геморрагический характер, нередко с уртикарными элементами, при надавливании не исчезают. Окраска их меняется в зависимости от времени появления. Высыпания возникают волнообразно (1 раз в 6–8 дней), наиболее бурными бывают первые волны сыпи. Суставной синдром появляется либо одновременно с поражением кожи, либо через несколько часов. Чаще всего поражаются крупные суставы (коленные и голеностопные).
Одним из вариантов заболевания является так называемая некротическая пурпура, наблюдаемая при быстром течении процесса, при котором появляются некротические поражения кожи, изъязвления, геморрагические корки.
Наибольшие трудности вызывает диагностика абдоминальной формы геморрагического васкулита, так как высыпания на коже не всегда предшествуют желудочно-кишечным явлениям (рвоте, схваткообразным болям в животе, напряжению и болезненности его при пальпации, кровью в стуле).
Почечная форма проявляется нарушением деятельности почек различной степени выраженности, от кратковременной нестойкой гематурии и альбуминурии до выраженной картины острого гломерулонефрита. Это поздний симптом, он никогда не встречается до поражения кожи.
Молниеносная форма геморрагического васкулита характеризуется крайне тяжелым течением, высокой лихорадкой, распространенными высыпаниями на коже и слизистых, висцерапатиями, может закончиться смертью больного.
Диагностика заболевания базируется на типичных клинических проявлениях, в атипичных случаях проводится биопсия. При абдоминальной форме необходимо наблюдение хирурга. Рекомендуется наблюдение нефролога в течение трех месяцев после разрешения пурпуры.
Термином «аллергический артериолит» Ruiter (1948) предложил называть несколько родственных форм васкулитов, отличающихся клиническими проявлениями, но имеющих ряд общих этиологических, патогенетических и морфологических признаков.
Патогенетическими факторами болезни считают простуду, фокальные инфекции. Высыпания располагаются обычно симметрично и имеют полиморфный характер (пятна, папулы, пузырьки, пустулы, некрозы, изъязвления, телеангиэктазии, волдыри). В зависимости от преобладающих элементов выделяют три формы заболевания: геморрагический тип, полиморфно-узелковый (соответствует трехсимптомной болезни Гужеро–Дюперра) и узелково?некротический (соответствует узелково?некротическому дерматиту Вертера–Дюмлинга). При регрессе сыпи могут оставаться рубцовые атрофии и рубчики. Заболевание склонно к рецидивам. Нередко перед высыпаниями больные жалуются на недомогание, усталость, головную боль, в разгар заболевания — на боли в суставах (которые иногда припухают) и в животе. Диагностика всех типов заболевания сложна из-за отсутствия типичных, характерных симптомов. При гистологическом исследовании выявляется фибриноидное поражение сосудов мелкого калибра с образованием инфильтративных скоплений из нейтрофилов, эозинофилов, лимфоцитов, плазматических клеток и гистиоцитов.
Геморрагический лейкокластический микробид Мишера–Шторка по клиническому течению сходен с другими формами полиморфных дермальных васкулитов. Признаком, позволяющим выделить это заболевание как самостоятельное, является наличие феномена — лейкоклазии (распад ядер зернистых лейкоцитов, приводящий к образованию ядерной пыли) при гистологическом исследовании. Таким образом, геморрагический лейкокластический микробид может трактоваться как дерматоз, обусловленный хронической фокальной инфекцией (внутрикожные тесты со стрептококковым антигеном положительные), протекающий с выраженной лейкоклазией.
Хронические капилляриты (гемосидерозы), в отличие от остро протекающих пурпур, характеризуются доброкачественным течением и являются исключительно кожными заболеваниями.
Болезнь Шамберга — представляет собой лимфоцитарный капиллярит, который характеризуется наличием петехий и коричневых пурпурных пятен, возникающих чаще всего на нижних конечностях. Пациентов беспокоит исключительно как косметический дефект.
Пурпура Майокки характеризуется появлением на нижних конечностях розовых и ливидно-красных пятен (без предшествующей гиперемии, инфильтрации), медленно растущих с образование кольцевидных фигур. В центральной части пятна развивается небольшая атрофия и ахромия, выпадают пушковые волосы. Субъективные ощущения отсутствуют.
Узелковый периартериит характеризуется некротизирующим воспалением мелких и средних артерий мышечного типа с последующим образованием аневризм сосудов и поражением органов и систем. Наиболее часто встречается у мужчин среднего возраста. Из этиологических факторов важнейшими являются непереносимость лекарств (антибиотиков, сульфаниламидов), вакцинация и персистирование HbsAg в сыворотке крови. Заболевание начинается остро или постепенно с симптомов общего характера — повышения температуры тела, быстро нарастающего похудания, боли в суставах, мышцах, животе, кожных высыпаний, признаков поражения ЖКТ, сердца, периферической нервной системы. Со временем развивается полевисцеральная симптоматика. Особенно характерно для узелкового периартериита поражение почек с развитием гипертонии, которая иногда приобретает злокачественный характер с возникновением почечной недостаточности. Выделяют классическую и кожную форму заболевания. Высыпания на коже представлены узелками — одиночными или группами, плотными, подвижными, болезненными. Характерно образование узлов по ходу артерий, иногда образуют тяжи. Локализация на разгибательных поверхностях голеней и предплечий, на кистях, лице (брови, лоб, углы челюсти) и шеи. Нередко не видны на глаз, могут определяться только пальпаторно. В центре может развиваться некроз с образованием длительно незаживающих язв. Периодически язвы могут кровоточить в течение нескольких часов (симптом «кровоточащего подкожного узла»).
Иногда единственным проявлением заболевания может быть сетчатое или ветвистое ливедо (стойкие фиолетово?красные пятна), локализующиеся на дистальных отделах конечностей, преимущественно на разгибательных поверхностях или пояснице. Характерно обнаружение по ходу ливедо узелков.
Диагностика заболевания основывается на сочетании поражения ряда органов и систем с признаками значительного воспаления, с лихорадкой, изменениями прежде всего в почках, в сердце, наличии полиневрита. Специфических для этой болезни лабораторных показателей не существует. Решающее значение для диагноза имеет динамическое клиническое наблюдение за больным.
Острая узловатая эритема — это панникулит, который характеризуется наличием болезненных розовых узлов на разгибательной поверхности нижних конечностей. Сопровождается лихорадкой, недомоганием, диареей, головной болью, конъюнктивитом и кашлем. Среди взрослых узловатая эритема в 5–6 раз чаще встречается у женщин, пиковый возраст — 20–30 лет. В основе заболевания гиперчуствительность к различным антигенам (бактерии, вирусы, грибы, новообразования и заболевания соединительной ткани). Половина случаев является идиопатическими. Диагностика основывается на данных анамнеза и физического осмотра. Необходимо провести полный анализ крови, рентгенограмму легких (выявляется двусторонняя аденопатия в области корней легких), мазок из зева или быстрый тест на стрептококки.
Хроническая узловая эритема — это группа различных видов узловатых дермогиподермитов. Чаще болеют женщины 30–40 лет. На голенях возникают узлы различной величины с покрасневшей над ними кожей, без наклонности к некрозу и изъязвлению. Воспалительные явления в области высыпаний и субъективные ощущения (артралгии, миалгии) мало выражены. Клинические варианты хронической узловатой эритемы имеют свои особенности, например наклонность узлов к миграции (мигрирующая эритема Беферштедта) или асимметрия процесса (гиподермит Вилановы–Пиноля).
Тактика ведения больного васкулитом кожи
- Классифицировать заболевание (характерная клиническая картина, анамнез, гистологическое исследование).
- Поиск этиологического фактора, но в 30% случаев его установить не удается (поиск очагов хронической инфекции, микробиологические, иммунологические, аллергологические и другие исследования).
- Оценка общего состояния и определение степени активности заболевания: общий анализ крови и мочи, биохимический анализ крови, коагулограмма, иммунограмма. Степень активности васкулитов: I. Высыпания не обильные, температура тела не выше 37,5, общие явления незначительные, СОЭ не выше 25, С-реактивный белок не более ++, комплемент более 30 ед. II. Высыпания обильные (выходят за пределы голени), температура тела выше 37,5, общие явления — головная боль, слабость, симптомы интоксикации, артралгии; СОЭ выше 25, С-реактивный белок более ++, комплемент менее 30 ед., протеинурия.
- Оценка признаков системности (исследование по показаниям).
- Определение вида и режима лечения в зависимости от степени активности: I ст. — возможно лечение в амбулаторных условиях; II ст. — в стационаре. Во всех случаях обострений васкулитов кожи необходим постельный режим, так как у таких больных обычно резко выражен ортостатизм, который следует соблюдать до перехода в регрессирующую стадию. Рекомендуется диета с исключением раздражающей пищи (алкогольные напитки, острые, копченые, соленые и жареные блюда, консервы, шоколад, крепкий чай и кофе, цитрусовые).
- Этиологическое лечение. Если есть возможность устранить причинный агент (лекарство, химикаты, инфекции), то быстро следует разрешение кожных очагов и другого лечения не требуется. Но надо помнить, что при санации очагов инфекции может наблюдаться усиление сосудистого процесса.
- Патогенетическое лечение.
- Профилактические мероприятия: диспансеризация, предупреждение провоцирующих факторов (инфекции, переохлаждение, инсоляции, стрессы и др.), рациональное использование лекарственных средств, трудоустройство, лечебная физкультура, санаторно-курортное лечение.
Лечение геморрагического васкулита
- Глюкокортикостероиды (преднизалон до 1,5 мг/кг) — облегчают проявление кожно-суставного синдрома, но не укорачивают заболевание и не предотвращают поражение почек. Назначаются в тяжелых случаях и под прикрытием гепарина, т. к. повышают свертываемость крови.
- Нестероидные противовоспалительные средства (НПВС) в обычных терапевтических дозировках. Выбор конкретного препарата принципиального значения не имеет (индометацин, диклофенак, ацетилсалициловая кислота).
- Антикоагулянты и антиагреганты. Гепарин при распространенном процессе 300–400 ЕД/кг/сутки. Продолжительность курса должна составлять не менее 3–5 недель. Под контролем коагулограммы.
- Лечебный плазмаферез, когда проявления заболевания не устраняются перечисленными средствами.
- Никотиновая кислота в переносимых дозах в/в капельно.
- Не следует применять: антигистаминные препараты (возможно только в самом начале заболевания), препараты кальция, все витамины.
Лечение васкулитов кожи
1) НПВС (напроксен, диклофенак, Реопирин, индометацин и др.);
2) салицилаты;
3) препараты Са;
4) витамины Р, С, антиоксидантный комплекс;
5) сосудорасширяющие средства (ксантинола никотинат, пентоксифиллин);
6) 2% раствор йодида калия по 1 ст. л. 3 раза в день (узловатая эритема);
7) антикоагулянты и антиагреганты;
8) методы детоксикации в/в капельно;
9) глюкокортикостероиды (ГКС) по 30–35 мг/сутки в течение 8–10 дней;
10) цитостатики;
11) ультравысокочастотная терапия, диатермия, индуктотермия, ультразвук с гидрокортизоном, ультрафиолетовое облучение.
Наружное лечение. При эрозивно-язвенных высыпаниях
1) 1–2% растворы анилиновых красителей;
2) эпителизирующие мази (солкосерил);
3) мази, содержащие глюкокортикоиды, и др.;
4) примочки или мази протеолитическими ферментами (Химопсин, Ируксол);
5) апликации Димексида;
При узлах — сухое тепло.
Лечение не должно заканчиваться с исчезновением клинических проявлений заболевания. Оно продолжается до полной нормализации лабораторных показателей, а в последующие полгода-год больным проводится поддерживающее лечение
Государственный институт усовершенствования врачей Министерства обороны РФ
Государственный институт усовершенствования врачей Министерства обороны РФ
Государственный институт усовершенствования врачей Министерства обороны РФ
Исследование кожной чувствительности у пациентов с келоидными и гипертрофическими рубцами до и после лечения
Журнал: Клиническая дерматология и венерология. 2011;9(1): 10‑13
Шафранов В.В., Таганов А.В., Гладько В.В., Флакс Г.А., Мордовцева В.В., Письменскова А.В. Исследование кожной чувствительности у пациентов с келоидными и гипертрофическими рубцами до и после лечения. Клиническая дерматология и венерология. 2011;9(1):10‑13.
Shafranov VV, Taganov AV, Glad'ko VV, Flaks GA, Mordovtseva VV, Pis'menskova AV. The assessment of skin susceptibility in patients with keloid and hypertrophic scars before and after treatment. Klinicheskaya Dermatologiya i Venerologiya. 2011;9(1):10‑13. (In Russ.).
Российский государственный медицинский университет
Дифференциальная диагностика гипертрофических и келоидных рубцов может представлять затруднения. Исследована сравнительная характеристика келоидов и гипертрофических рубцов на основании определения различных видов кожной чувствительности. Выявлены нарушения всех типов кожной чувствительности, продемонстрирована их динамика в процессе лечения.
Российский государственный медицинский университет
Государственный институт усовершенствования врачей Министерства обороны РФ
Государственный институт усовершенствования врачей Министерства обороны РФ
Государственный институт усовершенствования врачей Министерства обороны РФ
Государственный институт усовершенствования врачей Министерства обороны РФ
Гипертрофические и келоидные рубцы представляют собой фибропластические образования, являющиеся результатом аномального заживления ран. В основе клинических проявлений патологических рубцов лежит локальное избыточное отложение коллагена с изменением гомеостаза дермы и видоизменением ее структуры в зоне поражения [1, 2]. Считается, что у предрасположенных лиц регуляторные процессы регенерации соединительной ткани являются неполноценными [3]. Существует мнение, что гипертрофический и келоидный рубец представляют различные стадии одного и того же процесса [4]. Однако на сегодняшний день уже стало ясно, что различий между келоидами и гипертрофическими рубцами значительно больше, чем сходства. Различия между ними подтверждены с помощью современных методов исследования на основании изучения культур тканей рентгеноструктурным анализом, исследования гистоферментативной активности, изучения структуры аминокислот, а также установления присутствия HLA-антигенов и антиядерных антител [5—9].
Клиническая дифференциальная диагностика данных состояний может представлять затруднения, так как внешне рубцы могут быть очень схожи [5]. Вместе с тем правильная диагностика определяет выбор наиболее оптимального метода лечения [10]. С точки зрения клинических проявлений, субъективные ощущения в зоне рубцов более характерны для келоидов [11]. Они могут проявляться в виде зуда, чувства жжения и боли. Наряду с субъективными жалобами больных, для диагностики представляет интерес сравнение различных видов кожной чувствительности в зоне гипертрофических и келоидных рубцов, а также динамика показателей в процессе лечения.
Материал и методы
Для определения изменения чувствительности келоидных и гипертрофических рубцов в группу исследования было включено 156 пациентов, которые составили две группы наблюдения по 78 пациентов: в 1-ю группу вошли пациенты с морфологически подтвержденным диагнозом «гипертрофические рубцы», во 2-ю — пациенты с морфологически подтвержденным диагнозом «келоидные рубцы» сроком существования до 2 лет. Все рубцы имели площадь от 5 до 10 см 2 . Степень чувствительности оценивали по бальной системе: 1 балл — пониженная чувствительность, 2 балла — нормальная, 3 балла — повышенная, 4 балла — значительно повышенная. Для определения тактильной чувствительности использовался деревянный шпатель, для температурной — металлический шпатель, нагретый до температуры 50°С, для определения болевой глубокой чувствительности проводили надавливание указательным пальцем перпендикулярно рубцу, для болевой поверхностной — укол стерильной тупой иглой.
Результаты и обсуждение
Пациенты с гипертрофическими рубцами до лечения отмечали в области рубца повышение всех видов чувствительности по сравнению с непораженным симметричным участком кожи: тактильной — 62% пациентов, температурной — 19%, болевой глубокой — 23%, болевой поверхностной — 8% (табл. 1, рис. 1). Рисунок 1. Показатели кожной чувствительности в области рубца у пациентов с гипертрофическими рубцами до и после лечения.

После лечения пациенты с гипертрофическими рубцами отмечали в области рубца снижение тактильной чувствительности (27% человек), повышение температурной (23%), болевой глубокой (30%) и болевой поверхностной (21%) чувствительности по сравнению с непораженным симметричным участком кожи (табл. 2, см. рис. 1).
У пациентов с келоидными рубцами до лечения отмечается снижение тактильной чувствительности (58%), температурной (65%), болевой поверхностной (86%) и значительное повышение болевой глубокой чувствительности (97%) в области рубца по сравнению с непораженным симметричным участком кожи (табл. 3, рис. 2). Рисунок 2. Показатели кожной чувствительности в области рубца у пациентов с келоидными рубцами до и после лечения.

После лечения пациенты (51%) отмечали в области рубца снижение тактильной, повышение температурной (69%), болевой глубокой (9%) и болевой поверхностной (19%) чувствительности по сравнению с непораженным симметричным участком кожи (табл. 4, см. рис. 2).
Выводы
Кожная чувствительность у пациентов с келоидными и гипертрофическими рубцами в зонах поражения различается по всем четырем видам чувствительности, которая изменяется в области рубца и постдеструктивной поверхности после лечения в сторону как снижения, так и повышения, в зависимости от исследуемого вида чувствительности.
У пациентов с гипертрофическими рубцами до и после лечения кожная чувствительность изменилась следующим образом: отмечена тенденция к инверсии тактильной кожной чувствительности после лечения с повышения на понижение: с 62% (48) на 27% (21). Температурная, поверхностная и глубокая болевая кожная чувствительность были повышены до и после лечения.
У пациентов с келоидными рубцами до и после лечения отмечали изменение кожной чувствительности. В группе наблюдения отмечена тенденция к инверсии со значительного повышения на понижение болевой глубокой чувствительности с 97% (76) на 9% (7) после лечения. Пониженная до лечения температурная, тактильная, поверхностная болевая чувствительность не имела тенденции к инверсии. Наиболее динамический показатель — поверхностная болевая чувствительность до лечения у 86% (67) пациентов изменялась до 19% (15). Практически неизменными оставались показатели других видов кожной чувствительности: тактильной чувствительности — с 58% (45) на 51% (40) пациентов и температурной чувствительности — с 65% (51) на 69% (54).
Изменение поверхностной болевой чувствительности келоидных рубцов, где прослеживается выраженная динамика на нормализацию кожной чувствительности с 86% (67 пациентов) до лечения на 19% (15) после лечения, может быть использовано в качестве оценки результатов лечения.
Клиника изучения и лечения боли ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», Москва, Россия
Формирование хронической послеоперационной боли в отсроченном периоде (клиническое наблюдение)
Клиника изучения и лечения боли ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», Москва, Россия
Широкое внедрение мультимодального подхода в периоперационном периоде позволяет достаточно эффективно контролировать боль в раннем периоде после перенесенного хирургического вмешательства. Но иногда возникают ситуации, когда при отсутствие боли в раннем послеоперационном периоде, формируется хроническая послеоперационная боль спустя 2—6 месяцев после хирургического вмешательства. Подобные клинические наблюдения, как например случай пациентки К., у которой спустя 5 мес после торакоскопического удаления гамартомы средней доли правого легкого, развилась интенсивная невропатическая боль, успешное лечение которой было возможным только при комплексном диагностическом и лечебном подходе с использованием адекватных инструментов диагностики и лечения.
Клиника изучения и лечения боли ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», Москва, Россия
Дата принятия в печать:
Классификация хронической боли впервые была опубликована Международной ассоциацией по изучению боли (IASP) в 1986 г. В последующем претерпела несколько изменений в 1994 г. (второе издание) и в 2011—2012 гг. [1]. Согласно последнему определению IASP, хроническая послеоперационная боль — это боль, которая наблюдается как минимум через 3 месяца после операции, которая отсутствовала до хирургического вмешательства или имела другие характеристики, локализованная в месте операции при исключении других причин этой боли [2, 3].
Предполагается, что возникновению хронического послеоперационного болевого синдрома после торакотомических вмешательств, способствуют повреждение во время операции межреберных мышц [4], нервов [5], травма ребер [5], применение неоптимальных способов сопоставления ребер [6], наличие дренажей в плевральной полости [7], вывихи реберно-позвоночных суставов [8]. Известно, что на выраженность, частоту и длительность хронических болевых синдромов могут также влиять социодемографические, генетические факторы, индивидуальная болевая чувствительность, психоэмоциональный статус, а также качество обезболивания в послеоперационном периоде [9].
Накопление большого опыта «открытой» торакальной хирургии, появление новых инструментов и аппаратов для разъединения тканей позволило расширить показания к торакоскопическим операциям, а применение сверхтонких инструментов 3 и 5 мм и тончайшей гибкой оптики позволяет существенно снизить травматичность вмешательства, риск кровопотери и минимизировать повреждение межреберных нервов, вследствие чего торакоскопии сопровождаются меньшей интенсивностью боли и потребностью в анальгетиках у пациентов в раннем послеоперационном периоде при сравнении как с мышечносберегающей, так и со стандартной торакотомией [10]. Однако нет различий в частоте формирования хронической боли в послеоперационном периоде у пациентов после открытых торакотомических и торакоскопических вмешательств [8, 10—12].
Хронический постторакотомический болевой синдром — осложнение, возникающее у большинства пациентов, перенесших торакотомию (до 80%). Частота возникновения постторакотомического болевого синдрома (ПТБС) неуклонно возрастает, поскольку он развивается не только после торакотомии, но и у пациентов, перенесших торакоскопические вмешательства, при которых не производят стандартную торакотомию, а площадь межреберных отверстий для установки навигационных систем минимальна [13].
Несмотря на то, что пациенты часто описывают свою боль как слабую и умеренную, они отмечают значимое снижение качества жизни, трудовой и социальной активности.
В августе 2019 г. в Клинику изучения и лечения боли обратилась пациентка К., 52 лет, с жалобами на «жгучие» боли в правой половине грудной клетки, интенсивность которых по визуальной аналоговой шкале (ВАШ) составляла 54 мм. Болевой синдром носил практически постоянный характер и в значительной степени ограничивал ее повседневную активность, отмечалось нарушение сна в течение последних двух месяцев (частые пробуждения, чувство разбитости в утренние часы после сна). Из анамнеза известно, что в марте 2019 г. пациентка перенесла торакоскопическое удаление гамартомы средней доли правого легкого. В раннем послеоперационном периоде болевой синдром был умеренной интенсивности (около 45 мм по ВАШ), провоцировался двигательной активностью. Через две недели после операции боль регрессировала полностью. Около 3 мес назад (спустя 2 мес после перенесенного хирургического вмешательства) женщину стали беспокоить неприятные ощущения «горящего», «жгущего», «пекущего» характера в области послеоперационного рубца, практически постоянного характера, с некоторым усилением интенсивности в ночное время до 60 мм по ВАШ. Прием анальгетиков (простых и комбинированных) не уменьшал выраженность описанных жалоб. В этой связи в июне 2019 г. пациентка обратилась за консультацией к торакальному хирургу. С диагностической целью была проведена мультиспиральная компьютерная томография (МСКТ) органов грудной клетки с контрастным усилением, которая не выявила очаговых изменений; выполнены общеклинический и биохимический анализы крови, показатели которых были в пределах референсных значений; осмотрена кардиологом, эндокринологом, гастроэнтерологом — сопутствующей патологии со стороны сердечно-сосудистой, эндокринной систем и желудочно-кишечного тракта не выявлено. Пациентка продолжала наблюдаться терапевтом по месту жительства, получала нестероидные противовоспалительные препараты (нимесулид по 100 мг 2 раза в сутки в течение 7 дней) с кратковременным эффектом, проводила аппликации местноанестезирующих лекарственных средств (пластырь с 5% лидокаином), был проведен курс внутримышечных инъекций комплекс витаминов группы В (мильгамма 2 мл в/м 5 дней), назначен карбамазепин в дозе 400 мг в сутки на длительный прием. Пациентка принимала противоэпилептический препарат около месяца. На фоне терапии отметила снижение интенсивности боли (до 40—50 мм по ВАШ), но стала предъявлять жалобы на ощущение вялости, сонливости, что ограничивало активность в повседневной жизни, в связи с чем самостоятельно прекратила прием препарата. Болевой синдром сохранялся, в дальнейшем с целью коррекции терапии пациентка была направлена на консультацию в Клинику изучения и лечения боли.
На момент обращения в Клинику (22.08.19) больная предъявляла жалобы на сохраняющиеся «жгучие» боли постоянного характера в правой половине грудной клетки интенсивностью 60—70 мм по ВАШ, которые не усиливаются при дыхании, кашле, чихании и физических нагрузках. Пациентка описывает свои ощущения терминами «горит», «печет», «жжет», усиливающиеся в покое и во время ночного сна, значимо нарушая его качество. Кроме того, женщина жаловалась на чувство тревоги, страха в связи с «физическим неблагополучием», безысходности в сложившейся ситуации. При опросе данных за отягощенную наследственность не выявлено, пациентка имеет среднее образование, не работает, разведена, имеет двоих совершеннолетних детей, живет в частном доме.
Объективные данные при осмотре: повышенного питания (рост 162 см, вес 75 кг, индекс массы тела — 28,58 кг/м 2 ), кожные покровы и видимые слизистые обычной окраски, без патологических высыпаний, в области V—VI межреберных промежутков справа по переднеподмышечной и срединноключичной линиям имеются послеоперационные рубцы диаметром 15 мм в местах установки портов троакаров, болезненные при пальпации, имеется гипестезия в зоне рубцовых изменений и в радиусе 1—1,5 см, механическая аллодиния в этой зоне, тип дыхания смешанный, дыхательные движения грудной клетки симметричны, ритмичны, живот мягкий, безболезненный, расстройств мочеиспускания и дефекации не отмечает, ограничений двигательной активности нет, движения в суставах в полном объеме, со стороны черепных нервов без патологии, сухожильные рефлексы живые симметричные, патологических стопных знаков нет. При оценке когнитивного статуса с помощью Монреальской шкалы оценки когнитивных функций (MoCA) 28 баллов, что соответствует норме.
Для определения вида боли использовался опросник DN4: наличие сенсорных симптомов и выявленное сочетание гипестезии и аллодинии в зоне рубцовых изменений составило 6 баллов, что характеризует данную боль как невропатическую [14]. Для невропатической боли характерны эмоциональные и аффективные расстройства в виде тревоги и депрессии [15], для выявления которых у данной пациентки использовалась Госпитальная Шкала Тревоги и Депрессии (HADS). По шкале тревоги больная набрала 11 баллов, значит имеет место клинически выраженная тревога. По шкале депрессии — 9 баллов, что говорит о субклинически выраженной депрессии.
С учетом характера жалоб анамнестических данных, результатов инструментальных исследований, общего осмотра пациентки, неврологического и психоэмоционального статуса диагностирован хронический послеоперационный болевой синдром ассоциированный с тревожно-депрессивным расстройством.
Международные доказательные рекомендации по лечению невропатической боли в качестве терапии первой линии приводят 3 класса препаратов: трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата норадреналина и серотонина (СИОЗНС), α2-δ-лиганды кальциевых каналов (прегабалин, габапентин) и лидокаин местно (пластырь с 5% лидокаином) [15, 16]. Учитывая невропатический характер боли в сочетании с клинически выраженной тревогой, субклинически выраженной депрессией, препаратом нашего выбора стал дулоксетин — антидепрессант ингибирущий обратный захват серотонина и норадреналина, в результате чего повышается серотонинергическая и норадренергическая нейротрансмиссия в центральной нервной системе и обладает центральным механизмом подавления болевого синдрома, что в первую очередь проявляется повышением порога болевой чувствительности при болевом синдроме невропатической этиологии.
Дулоксетин был назначен в дозе 60 мг в сутки ежедневно на 3 мес, с рекомендацией динамического контроля выраженности болевых ощущений, повторного осмотра пациентки через 1 мес для оценки эффективности и коррекции проводимого лечения. Повторный осмотр был проведен 25.09.19 Пациентка отметила значительное улучшение самочувствия, нормализовался сон, интенсивность боли по ВАШ на момент осмотра 48 мм, сохранился ее невропатический характер (по шкале DN4 — 6 баллов), уровень тревоги снизился до субклинически выраженного (9 баллов), симптомы депрессии сохраняются (9 баллов).
Полученные результаты (снижение интенсивности боли с 60 до 48 мм по ВАШ, улучшение сна, снижение уровня тревоги) свидетельствуют об эффективности назначенной терапии. Учитывая данные других исследований [17—19] по эффективности дулоксетина при хронической нейропатической боли, было рекомендовано продолжить проводимое лечение еще в течение 3 мес.
На приеме 29.12.19 (через 4 мес от начала терапии) больная отметила регресс боли в дневное время суток, ночью боль беспокоит не постоянно, интенсивность ее 30—40 мм по ВАШ, характер боли сохранил невропатический компонент (по шкале DN4 — 4 балла), выраженность тревоги (9 баллов) и депрессии (9 баллов) соответствовали субклиническому уровню (см. рисунок).

Динамика показателей.
Динамический контроль психоэмоционального статуса пациентки, интенсивности боли ее беспокоящей на фоне приема дулоксетина показал эффективность данной монотерапии. Рекомендовано продолжить прием дулоксетина в дозе 60 мг в сутки в течение 2 мес (продолжительность общего курса — до 6 мес) с последующим контролем интенсивности болевого синдрома, психоэмоционального статуса больной для решения вопроса о постепенной отмене препарата.
Заключение
Хронический ПТБС может формироваться не только, как продолжение острой боли в послеоперационном периоде, но и развиваться после периода полного благополучия. Представленный клинический случай демонстрирует развитие подобного сценария, а также необходимость междисциплинарного подхода в диагностике и лечении.
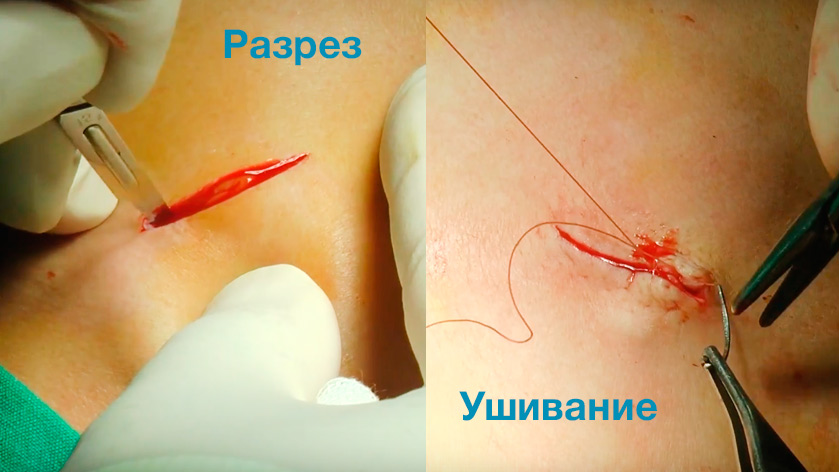
Методы наложения швов и виды используемых материалов
Правильно наложенные швы отличаются аккуратностью и гладкостью. Медицинский шов должен скользить и не травмировать поврежденные ткани дополнительно. Значимыми критериями качества также являются:
способность выдерживать нагрузки, не сдавливая ткани;
биосовместимость и инертность (шовный материал не должен вступать в химическую реакцию с тканями).
Кроме того, материал не должен активно впитывать влагу и разбухать. Рассасываемые материалы должны иметь срок рассасывания, близкий к сроку заживления, который зависит от множества факторов.
Выбор нитей для швов врач осуществляет в зависимости от поставленных задач. Современная индустрия предлагает более 30 видов, среди которых рассасывающиеся и нерассасывающиеся, синтетические и природные, плетеные, крученные, однослойные и многослойные, а также различающиеся видами покрытий. Одни и те же свойства могут являться достоинствами и недостатками в разных случаях.
При этом требования к нитям в хирургии существенно отличаются от привычного представления о качестве людей, не знакомых с данной наукой. Так, гладкие нити не позволяют сформировать прочный, надежный узел. А высокоценимые в других сферах натуральные волокна несут в себе риск аллергической реакции и занесения инфекции.
Нерассасывающиеся материалы
К данной группе относятся шелковые, хлопковые, металлические и синтетические нити. Шелк является прочным и условно нерассасываемым материалом, так как со временем, приблизительно за 12 месяцев, волокно практически полностью рассасывается. При соединении тканей на гораздо менее длительный период шелковый шов отличается относительно высокой прочностью, пластичностью и надежностью. Однако волокно провоцирует заметный иммунный ответ организма и может служить резервуаром для инфекции в ране. Хлопок менее прочен и способен спровоцировать воспаление.
Металл, нержавеющая сталь, отличается исключительно высокой прочностью и не способствует развитию воспаления. Чаще всего используется для соединения сухожилий, а также при операциях на брюшной полости. Наилучшими характеристиками обладают синтетические волокна. Они соединяют в себе прочность и инертность. Их чаще всего применяют для соединения мягких тканей.
Рассасывающиеся шовные материалы
Натуральные рассасывающиеся материалы, изготавливаемые из очищенной соединительной ткани, не получили широкого применения, так как не отличаются прочностью, склонны провоцировать реакцию тканей и воспалительные процессы. Кроме того, неудобны в использовании. Заранее спрогнозировать срок их рассасывания практически невозможно.
Синтетические нити имеют предсказуемые сроки рассасывания и не вызывают тканевых реакций, однако имеют ограниченное применение. Их не используют, когда важна постоянная (неизменная) прочность швов.
Способы наложения хирургических швов
Швы подразделяются на первичные и вторичные. Последние используются для укрепления первичных, как правило, при большом числе грануляций раны. Вторичные швы также накладываются для разгрузки раны. Кроме того, швы подразделяют на узловые, непрерывные и др.
Сроки заживления хирургических швов
Врач всегда стремится обеспечить заживление первичным натяжением. Однако не все зависит от профессионализма врача. При удачном течении (отсутствии нагноения, минимальной отечности) процесс проходит следующие стадии заживления:
Период воспалительной реакции. Обычно длится 5 дней. В это время иммунная система организма уничтожает микробы, разрушенные клетки и инородные частицы. Края раны на этом этапе удерживают только швы.
Период полиферации. Длится по 14 день. В это время происходит активное формирование грануляционной ткани за счет выработки фибрина и коллагена, которая фиксирует края раны.
Период созревания. Длится до заживления. На этом этапе активно формируется соединительная ткань.
Врач снимет швы, когда рана заживет, и уйдет необходимость в дополнительной поддержке краев. Как правило, швы, наложенные в области лица и шеи, снимают в рок до 5 дней, в области туловища и конечностей - до 10 дней.
Факторы, влияющие на срок заживления
Сроки заживления зависят от множества факторов, и в первую очередь это индивидуальные особенно организма, особенности выполненного разреза, вид используемых шовных материалов, а также соблюдение правил ухода в реабилитационный период. Попадание различных веществ, загрязнение и наличие тяжелых хронических заболеваний, например диабета, могут существенно удлинить восстановительный период. Имеет значения общий вес пациента, самочувствие в период реабилитации.
Уход за швами
Уход за швами осуществляется на основе данных врачом рекомендаций. Как правило, рану требуется ежедневно обрабатывать антисептиками и препаратами, ускоряющими регенерацию тканей. В послеоперационный период рекомендуется избегать физических нагрузок, употребления алкоголя, придерживаться рекомендованной врачом диеты.
Если шов разошелся, следует незамедлительно обратиться к врачу. Болезненность швов в восстановительный период считается нормальным явлением. Поэтому в первые дни нередко назначаются обезболивающие препараты. При сохранении интенсивных болей в течение длительного периода и подозрении на инфекцию необходимо обратиться к врачу за консультацией.
Послеоперационная рана остается после хирургических вмешательств и относится к категории резаных ран. Закрывается она с помощью хирургических нитей методом ушивания.
При правильном уходе, восстановление после операции занимает около 2-3 недель. Очень важно, в послеоперационный период, тщательно промывать рану стерильным раствором Пронтосан, своевременно менять послеоперационные повязки, проводить визуальный контроль на наличие признаков инфицирования.
Стадии заживления раны
Это неизбежная стадия, т.к. организм не отличает постоперационные «полезные» раны от обычных и начинает активно вырабатывать вещества, ускоряющие свертывание и образование сгустков крови. Это важно для прекращения кровотечения и защиты.
Процесс способствует успешному заживлению и представляет собой формирование молодой ткани, вид которой разнится в зависимости от стадии. Воспалительные клетки, соединительная ткань, заново сформировавшиеся сосуды образуют грануляционную ткань, которая заполняет полость разреза. Сначала эта зернистая ткань легко кровит, т.к. у сосудов тонкие стенки, но чем ближе конец этой стадии, тем плотнее и светлее становится ткань, а зернистость и кровоточивость исчезают.
Клетки эпителия, образовавшиеся на краях раны, и соединительная ткань постепенно целиком заполняют поврежденный участок. Число сосудов снижается, образуется рубец.
- Формирование шрама – от 3 месяцев до 1 года
Сосуды полностью исчезают, волокна коллагена и эластина постепенно завершают формирование шрама – длительность этого процесса зависит от возраста пациента, состояния его здоровья, тяжести операции и множества других факторов.
Пронтосан - стерильный раствор для промывания ран, 40 мл
Prontosan Wound Irrigation - для промывания, очищения и деконтаминации ран различной этиологии
Читайте также:

