Почему у наркоманов часто бывают чирьи
Обновлено: 27.04.2024
В настоящее время в нашей стране является распространенной проблема наркозависимости, от которой страдает в основном молодое поколение, являющееся будущим трудовым ресурсом нашей страны. В результате данного процесса падает рождаемость, растет заболеваемость, происходит криминализация общества и постепенное старение нации за счет смертности молодого поколения. По больше части за счет увеличения числа лиц с диссоциальным поведением происходит рост численности гнойно-воспалительных заболеваний мягких тканей. Чтобы снизить смертность данной категории людей и избавить их от данной болезни, им оказывают как психологическую помощь, так и хирургические вмешательства. В данной статье рассмотрены основные проблемы диагностики гнойных заболеваний мягких тканей у лиц с диссоциальным поведением, а также наиболее полно описан главный и, на сегодняшний день, самый эффективный метод лечения-это агрессивная хирургическая обработка гнойных очагов. Иными методами комплексного лечения гнойных заболеваний мягких тканей также являются и купирование в короткие сроки воспалительного процесса, антибактериальная терапия, местное медикаментозное лечение, а также предотвращение употребления наркотиков и алкоголя и ранние восстановительные операции.

1. Абаев Ю.К. / Многокомпонентные перевязочные средства в лечении гнойных ран / Хирургия. -1999. №10. - С. 69-71.
2. Алексеева Л.П. / Изучение нарушений личности и эмоционально-волевой сферы у лиц БОМЖ, больных туберкулезом // Проблемы туберкулеза и болезней легких. 2007. -№11. -С. 6-10.
3. Алуханян О.А. / Сосудистые и гнойно-септические осложнения у наркоманов // Ангиология и сосудистая хирургия. 1998.- №2. - С.87.
5. Земляной А.Б., Фурса А.А./Вестник Национального медико-хирургического центра им. Н.И. Пирогова/1 т.6, 2011 года.
6. Скарзов А.В. Клинические особенности гнойно-воспалительных заболеваний мягких тканей у лиц, страдающих наркоманией и пути оптимизации хирургического лечения: автореф. дис. кандидата мед. наук/А.В. Скарзов. -Саратов, 2003. -24 с.
Задача усиления эффективности лечения гнойных заболеваний и их диагностика является важной в хирургии. В настоящее время рост гнойно-воспалительных заболеваний мягких тканей растет по большей части за счет увеличения числа лиц с диссоциальным поведением. Ранее врачи редко сталкивались с данной проблемой и соответственно на данный момент проведено недостаточно исследований течения острых гнойных заболеваний мягких тканей у наркоманов, а также не разработан единый комплекс хирургического лечения [2], чем и обусловлена актуальность затрагиваемой проблемы. В Саратовской области, по словам заместителя главного врача областной психиатрической больницы Святой Софии Дмитрия Павлищева, на наркологическом учете состоят около 6 тыс. человек, большинство из которых- молодые люди до 25 лет.
В нашей стране в основном большая часть наркозависимых- это школьники и люди в возрасте от 16 до 30 лет, тоесть это развивающееся и работающее поколение, которое становится не трудоспособным, что ведет к экономическим убыткам в стране, т.к. нехватку данной категории населения заменяет импорт рабочей силы, который на определенном этапе перестанет компенсировать уменьшение потенциала людских ресурсов. Вскоре падает рождаемость, растет заболеваемость, происходит криминализация общества и постепенное старение нации за счет смертности молодого поколения. [2]
Целью данной статьи является изучение проблемы диагностики и эффективности лечения гнойных заболеваний мягких тканей у лиц с диссоциальным поведением.
Установлено, что риском развития абсцессов и флегмон у наркоманов является подкожное и внутримышечное введение наркотического препарата, использование не стерильных игл и частое введение препарата. Ведущей причиной смертности лиц асоциального поведения является развитие обширных гнойных процессов мягких тканей, вызванных нарушением санитарно-гигиенических норм. Наиболее частыми местами локализации очагов гнойных заболеваний мягких тканей у наркоманов являются зоны частых инъекций наркотиков: область паха, проекция подмышечных вен и подкожных вен верхних конечностей. После хирургического вмешательства отмечается длительное заживление ран, либо развивается сепсис. [1]
Существует прямая зависимость от длительности употребления наркотических средств, их способа поступления в организм и характеристики гнойного очага. Известно, что из определенного количества обследованных людей, наркоманы с низким стажем вводили наркотики в подкожные вены верхних и нижних конечностей. При более длительном употреблении наркотических средств вены под их воздействием сжигаются (Изображение 1) и на первое место выходят внутриартериальный и внутримышечный пути введения.
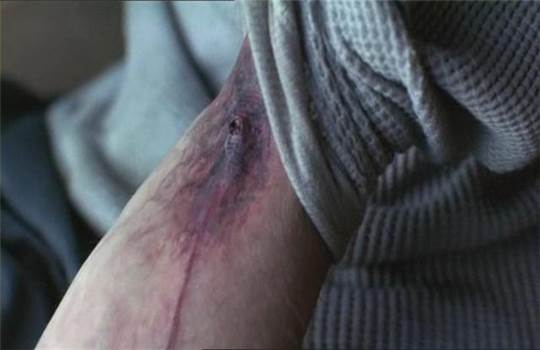
В случае внутриартериального введения наркотических средств развиваются паравазальные гнойные очаги, являющиеся наиболее частой причиной смертности и неоднократной госпитализации наркозависимых. (Изображение 2)
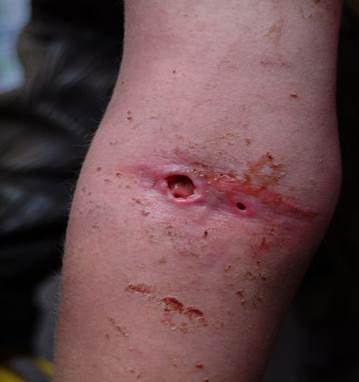
В случае внутримышечного введения- гнойно-воспалительные процессы имели обширный объем поражения тканей за счет распространенности по фасциальным футлярам мышц. [1] У наркоманов со стажем более 10 лет основным методом введения наркотиков является внутримышечный. Из-за частой травматизации тканей образуются рубцовая ткань, которая периодически инфицируется, что приводит к развитию гнойных очагов заболевания мягких тканей.
При исследовании микрофлоры гнойных очагов у лиц с диссоциальным поведением было выявлено преобладание Грам положительной флоры. Степень заражения микроорганизмами в большинстве случаев достигает критического уровня, но уже на 6-7 сутки лечения в ранах около 70% больных преобладает Грам отрицательная флора. При этом нужно учитывать особенности поведения данной группы пациентов в лечебно-профилактическом учреждении.[1]
Методами комплексного лечения гнойных заболеваний мягких тканей являются купирование в короткие сроки воспалительного процесса, антибактериальная терапия, местное медикаментозное лечение, а также предотвращение употребления наркотиков и алкоголя и ранние восстановительные операции. Применяются капельницы с солевыми растворами, прием мочегонных, адсорбирующих средств, витаминов и антидепрессантов с целью ускорения естественной очистки организма, устранения последствий истощения и восстановления обмена веществ. Если нарушена функция печени и почек, применяется искусственная очистка крови при помощи фильтрующих аппаратов- гемосорбция, плазмоферез и гемодиализ.
Абсцессы локализуются в мягких тканях и характеризуются четким контуром, ограничены плотной капсулой и заполнены некротическими тканями и гнойным экссудатом. Наиболее эффективным методом лечения является агрессивная хирургическая обработка гнойного очага, которая была детально разработана сотрудниками Института хирургии им. А.В. Вишневского, заключающаяся в иссечении не только капсулы и ее содержимого, но и иссечение окружающей рубцовой ткани в подкожной клетчатке и мышцах, фасций с рубцовыми изменениями и следов инъекции на коже для предотвращения развития гнойно-воспалительного процесса на ранних сроках.[3]
При агрессивной хирургической обработке флегмон проводится широкое рассечение кожи для более полного открытия зоны гнойного очага. При интоксикации данной группы пациентов проводят дезинтоксикационную терапию с последующим агрессивным хирургическим лечением. Данный метод лечения гнойных заболеваний мягких тканей у данной категории пациентов в 90% случаев является эффективным. [1] Нередко при агрессивной хирургической обработке удаляют обширные участки мышц, костей, либо ампутируют конечность. В некоторых случаях однократная хирургическая обработка не обеспечивает полной ликвидации гнойно-некротического процесса и необходимо повторное проведение процедуры. Повторное хирургическое вмешательство проводится при прогрессировании гнойно-некротического процесса, формировании обширных вторичных некрозов тканей и образовании гнойных карманов.[6]
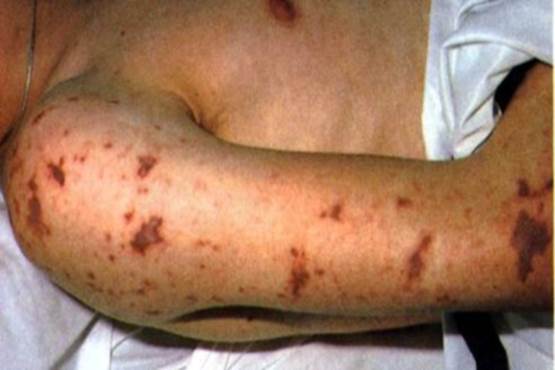
Агрессивная хирургическая обработка должна осуществляться тщательно, так как оставленные некротические ткани служат патологическим субстратом для развития гнойно-некротического процесса с перспективой перехода в стадию сепсиса, тяжелого сепсиса и септического шока. Кожа приобретает землистый цвет с характерно петехиальной сыпью (Изображение 3)
Сепсис также возникает в случае несвоевременного хирургического вмешательства после не стерильного инъекционного введения наркотических веществ или нагноения раны. Также при сниженном иммунитете организм не может сражаться с бактериями, вследствие чего у наркозависимых появляются гнойники, которые развиваются в абсцессы.[7]
При работе с рассматриваемой группой пациентов, как с потенциальным источником инфицирования вирусом гепатита В, С и ВИЧ, особое внимание необходимо уделить защите медицинского персонала, особенно в процессе оперативного вмешательства. Хирурги, имеющие какие-либо повреждения на коже, не допускаются к работе с данным контингентом больных. Лица, не принимающие участие в операции, в операционной находиться не должны. Весь персонал в обязательном порядке надевает две пары резиновых перчаток, непромокаемые фартуки, одноразовые халаты и защитные очки. [7]
Таким образом локализация гнойно-воспалительных очагов у лиц с диссоциальным поведением зависит от стажа употребления наркотических веществ. Владея данной информацией можно оценить возможный оперативный доступ и его объем. Агрессивная хирургическая обработка позволяет перевести гнойное заболевание во вторую стадию течения раневого процесса и продолжать лечение в другом направлении.
- Этиологическая структура парентеральных вирусных гепатитов среди наркоманов
Лица, употребляющие внутривенные наркотики, являются резервуаром возбудителей гепатитов В, С, Д и ВИЧ-инфекции. Заражение вирусами гепатитов может привести к развитию острого гепатита с выраженной клинической картиной, бессимптомному носительству, хроническому течению заболевания.
При обследовании наркоманов у 5-15% из них обнаруживают Hbs-ag. Антитела к вирусу гепатита В имеют 40-60% обследованных, причем лишь треть из них указывают на перенесенный гепатит. Частота носительства вируса гепатита С и антител к нему среди потребителей наркотиков достигает 75-85%. С помощью ПЦР установлено, что из описанных субтипов вируса у наркоманов чаще встречается субтип 3а, тогда как в других группах риска на территории России регистрируются субтипы 1а и 1b. Наибольшая частота обнаружения анти-HCV (до 90%) отмечена у героиновых наркоманов. По данным мировой медицинской литературы, более половины потребителей наркотиков являются резервуаром нескольких вирусов в различных сочетаниях, наиболее распространено инфицирование HBV+HCV.
После заражения, которое обычно происходит в течение первого года внутривенного употребления наркотических препаратов, у трети развивается острый вирусный гепатит. Среди больных наркоманов, находящихся в инфекционных отделениях, у 40-60% диагностируется гепатит смешанной этиологии (В+С), у 30-40% — острый вирусный гепатит С, в 20-30% случаев — острый вирусный гепатит В.
Основным фактором риска при немедицинском парентеральном введении психотропных веществ является использование шприца, контаминированного кровью, содержащей вирусы. Контаминация иглы или шприца происходит при групповом использовании инструмента. При введении наркотика в группе большему риску подвергаются начинающие наркоманы, обычно вводящие наркотик последними, так как лица с большим наркотическим стажем, вводящие препарат первыми, часто являются носителями вирусов. В ряде случаев заражение возможно при применении стерильного или индивидуального инструмента, если человек набирает раствор препарата из общей емкости, которая при этом загрязняется кровью. Такой загрязненный раствор может попадать в продажу. Иногда инфицирование раствора происходит в процессе производства, если производитель-наркоман использует свою кровь в качестве индикатора качества приготовляемого наркотика.
Помимо парентерального механизма, заражение может происходить при половых контактах. Особенно актуально это для потребителей производных амфетамина, кокаина (крэк), эфедрина, которые являются стимулирующими препаратами, приводящими к возбуждению с реализацией его в многочисленных половых контактах. Серьезную опасность в эпидемиологическом плане представляют проститутки, страдающие наркоманией. Гетеросексуальные контакты с частой сменой половых партнеров имеют значение для дальнейшего распространения эпидемии среди лиц, не употребляющих наркотики.
Кроме того, риск передачи вирусов гепатитов В, С, Д, и ВИЧ-инфекции для обычного населения повышается и в связи с тем, что наркоманы часто являются донорами крови и спермы с целью получения средств на приобретение наркотиков.
- Клиника острых вирусных гепатитов у наркоманов
Вирусный гепатит В. Заболевание в большинстве случаев начинается постепенно, с развитием астено-вегетативного и/или диспептического синдрома. Обычно больные в преджелтушном периоде предъявляют жалобы на слабость, снижение аппетита, тошноту, субфебрильную температуру тела, у пациентов отмечается ощущение тяжести в правом подреберье. Достоверно чаще у больных-наркоманов бывают боли в области печени, рвота, головокружение. Такие симптомы, как арталгии, кожный зуд, сыпь, встречаются с той же частотой, что и у больных, не употребляющих наркотики.
Существует корреляция между течением преджелтушного периода и частотой употребления наркотиков в это время. Инъекции провоцируют клинически выраженный вариант течения с большим количеством жалоб и быстрое появление желтухи. Кроме обычных симптомов больного беспокоят сильные боли в эпигастрии и правом подреберье, вздутие живота, заложенность носа или насморк, головная боль, что может быть связано не с течением инфекции, а с действием наркотика.
| Появление и распространение некоторых заболеваний связано с внедрением новой медицинской технологии. Так, впрыскивание (injectio) лекарственных препаратов, предложенное доктором А. Вудом в 1853 году, по своим отдаленным последствиям оказалось не самым полезным для человечества, поскольку сыграло решающую роль в формировании злокачественных форм лекарственной зависимости и распространении ряда опасных инфекций. Доктора прошлого века не могли предположить, что шприц станет одним из главнейших факторов биологического отбора, благодаря которому менее чем через 100 лет произойдет глобальное распространение некоторых инфекционных заболеваний, которые раньше не существовали или из-за малого распространения не заслуживали внимания |
Длительность преджелтушного периода составляет от 3 до 14 суток, но обычно желтуха развивается через неделю на фоне умеренной интоксикации, субфебрилитета и болевого синдрома.
Постоянный симптом вирусного гепатита – увеличение печени. У трети наркоманов с диагнозом острого вирусного гепатита В выявляется гепатомегалия, у остальных при мануальном исследовании печень увеличена на –2,0–3,0 см. Увеличение селезенки регистрируется у 30-40% больных. При УЗИ органов брюшной полости подтверждается наличие гепатолиенального синдрома, однако у наркоманов значительно реже, чем у лиц, не употребляющих наркотики, выявлены диффузные воспалительные изменения в паренхиме органов.
Желтушный период острого ВГВ сопровождается повышением билирубина в крови до 100-180 мкм/л. Бывает пролонгированная гипербилирубинемия, у четверти больных развивается холестаз, однако в большинстве случаев желтуха сохраняется в течение трех недель и лишь у отдельных пациентов затягивается до 40 суток. Уровень АЛТ и АСТ в сыворотке крови у большинства наркоманов не превышает 1500 МЕ в течение первых двух недель желтушного периода, затем происходит постепенное уменьшение уровня ферментемии. Динамика содержания экскреторных ферментов в крови при ВГВ у наркоманов и лиц, не употребляющих наркотики, не отличается. Не выявлено разницы в уровне и соотношении белковых фракций. Аналогичны изменения показателей функции свертывающей системы крови.
Острый вирусный гепатит В у наркоманов обычно имеет среднетяжелое течение, тяжелые формы развиваются крайне редко.
Вирусный гепатит С. Как известно, более половины больных с острым вирусным гепатитом С составляют лица, употребляющие парентеральные наркотики, в связи с чем в литературе это заболевание часто именуют гепатитом наркоманов. Проводимые в последние годы исследования показывают, что инфицирование вирусом приводит к носительству возбудителя, безжелтушной форме острого гепатита или легкому течению инфекции с кратковременной желтухой. Исходом в 90% случав является хронизация процесса, течение которого усугубляется употреблением наркотических препаратов.
 Клинику острых вирусных гепатитов у наркоманов отличает преджелтушный период с полиморфной симптоматикой, наличие болевого синдрома в правой подреберной и эпигастральной областях, сохраняющегося в первые дни желтухи, гепатомегалия, пролонгированная гипербилирубинемия и поздняя нормализация уровня АЛТ и АСТ. Течение заболевания легче, чем у больных без отягощенного анамнеза, но гораздо чаще формируется хронический гепатит, чему в немалой степени способствует преждевременный уход больных из стационара и продолжение практики введения наркотиков в период болезни и реконвалесценции |
Развитие острого гепатита постепенное, с небольшим количеством жалоб в течение 3–7 суток до появления желтухи. Чаще всего в преджелтушном периоде больных беспокоит слабость, тяжесть в правом предреберье, тошнота, повышение температуры тела до субфебрильных цифр, треть пациентов отмечают снижение аппетита вплоть до анорексии. Следует отметить, что у этой группы больных часто бывают умеренно выраженные боли в области печени и эпигастрии и рвота, чего практически не бывает у лиц без отягощенного анамнеза.
Желтуха, как правило, развивается на 4–5-е сутки болезни, редко преджелтушный период затягивается до 8 дней. Самочувствие больных в это время остается прежним, интоксикация не нарастает. При исследовании печени у наркоманов достоверно чаще, как и при ВГВ, отмечается гепатомегалия. Селезенка увеличена у одной трети больных.
При изучении биохимических параметров выявлено, что для наркоманов характерно умеренное, постепенное повышение уровня билирубина в крови (до 150 мкм/л) в течение 1-15 суток с нормализацией показателя к концу третьей недели. Концентрация АЛТ и АСТ в крови составляет обычно 1500-2000 МЕ, тогда как у остальных больных показатели выше 1000 МЕ встречаются редко. Отмечена более поздняя нормализация уровня этих ферментов у лиц, вводящих наркотики. Достоверной разницы в динамике ЩФ, функционирования белковообразующей и свертывающей систем печени у больных ВГС в зависимости от употребления наркотиков пока выявить не удалось.
Острый период болезни в половине случаев протекает легко, однако в организме сохраняется возбудитель, и в дальнейшем развивается хронический гепатит.
Вирусный гепатит смешанной этиологии (В+С). При сравнении результатов наблюдения за больными, использующими внутривенные наркотики, и лицами, в анамнезе которых этот фактор отсутствует, существенных различий в клинической симптоматике острого периода болезни выявить не удается. Динамика лабораторных показателей и данных инструментального обследования в этих группах больных также не имеет достоверных отличий. Следует, однако, отметить, что именно эта группа требует детального подхода при изучении патологического процесса, так как у наркоманов часто диагностируются гепатиты смешанной этиологии.
Тщательное иммунологическое, морфологическое исследование, динамика содержания вирусов в крови и печени позволит выявить, какой возбудитель является ведущим в патологическом процессе, что даст возможность разработать более оптимальные схемы лечения больных гепатитами смешанной этиологии.
Особенности течения гепатитов у наркоманов большинство исследователей связывают с токсическим воздействием препаратов на печень и изменениями иммунной системы. По нашим наблюдениям, заражение вирусными гепатитами происходит в течение первого года употребления наркотиков, когда токсическое воздействие препаратов незначительно и клиническая картина болезни в первую очередь обусловлена действием вирусов. Вопрос о непосредственном поражении печени в результате введения наркотических веществ остается нерешенным. Доказательства прямого негативного воздействия наиболее часто употребляемых препаратов (кокаин, амфетамины, производные конопли) в настоящее время отсутствуют. Имеется ряд клинических данных, результатов исследования in vitro и экспериментальных моделей, которые указывают на развитие гепатита без холестаза (метадон, морфин, диазепам), гепатита с холестазом (мепробамат, фенобарбитал), некроза печени (диазепам, фенобарбитал, галотан). К факторам поражения печени при наркомании относятся алкоголизм, недостаточное питание, воздействие токсических примесей, которые остаются при кустарном производстве наркотиков. В ткани печени у наркоманов неоднократно находили волокна органических и неорганических соединений, тальк, молочный сахар и др.
| В современных условиях роль переносчиков вирусных гепатитов В, С, D и ВИЧ-инфекции успешно выполняет оборудование для инвазивных методов диагностики и лечения. Именно поэтому расцвет этих заболеваний во всемирном масштабе пришелся на конец ХХ столетия, когда инвазивные процедуры стали чрезвычайно популярны как среди врачей, так и среди пациентов. Естественные пути передачи (половой и вертикальный) являются достаточным условием для существования заболевания, но его массовое распространение стало возможным после появления искусственных способов заражения – вот почему до 80-х годов эти инфекции не играли столь существенной роли в общей картине заболеваемости |
Течение вирусных гепатитов и их исход во многом связаны с нарушением иммунного ответа. Практически все наркотические вещества обладают в той или иной степени иммунодепрессивным действием. Наиболее выражен этот эффект у опиатов, которые являются «главными» наркотиками в России. Изменения иммунитета выражаются в снижении фагоцитарной активности лейкоцитов, уменьшении количества Т-лимфоцитов при нарушении соотношения клеток CD-4/CD-8, повышении уровня В-лимфоцитов. В остром периоде вирусных гепатитов у наркоманов регистрируется усиленная выработка сывороточных иммуноглобулинов, повышение в крови количества циркулирующих иммунных комплексов. Все эти изменения иммунитета способствуют развитию хронического течения гепатитов В и С.
Лечение больных острыми вирусными гепатитами с сопутствующей наркоманией на сегодняшний день не имеет особенностей. Так как тяжесть состояния больного и развитие болезни в большей степени обусловлено действием вируса, то обычно применяемая в остром периоде комплексная патогенетическая терапия дает положительный эффект. Дискутируется вопрос о целесообразности применения плазмафереза. Несмотря на то что в разгар желтухи использование этого метода улучшает состояние больного, в дальнейшем он сказывается отрицательно, усугубляя наркотическую зависимость: наркомания у таких больных гораздо хуже поддается лечению. Отмечена также низкая эффективность препаратов интерферонового ряда у лиц, продолжающих использовать наркотики в период лечения.
Особую сложность для практического врача представляют наркоманы, поступившие в инфекционное отделение в состоянии наркотической абстиненции. Обычно на фоне терапии гепатита проводят комплекс мероприятий, рекомендуемых для лечения абстинентного синдрома (см. соответствующую литературу).
Профилактика вирусных гепатитов с парентеральным механизмом заражения должна проводиться в нескольких направлениях.
В связи с тем что сами наркоманы и их дети, зараженные гепатитами, попадая в лечебные учреждения, являются потенциальными источниками внутрибольничных вспышек, профилактика вирусных инфекций, передаваемых через кровь, в среде наркоманов является важным противоэпидемическим мероприятием. Необходимо четко разделять профилактику потребления психотропных средств, особенно у тех, кто не имел наркотической зависимости, и профилактику заражения вирусами гепатитов и ВИЧ у лиц со сформировавшейся зависимостью. Для лиц первой группы информация о возможности заражения вирусами гепатитов и СПИДа при приеме препаратов должна стать одним из важных аргументов против начала или продолжения приема опасных препаратов. Такие профилактические беседы необходимо проводить с молодыми пациентами врачам любой специальности.
Для лиц с явной наркотической зависимостью подобная информация вряд ли станет достаточным аргументом в пользу отказа от одурманивающих средств. В этих случаях имеет право на существование концепция «минимизации ущерба от потребления наркотиков», как выражаются за рубежом. Наркологи должны постоянно распространять среди своих пациентов информацию об угрозе заражения инфекциями, передаваемыми с кровью, рекомендовать пациентам перейти на прием таблеток или препаратов для курения, советовать использовать только персональный и стерильный шприц при внутривенном введении наркотика. Однако, учитывая возможность заражения готовых растворов препаратов, следует перед употреблением кипятить свою дозу в индивидуальной посуде. Разумеется, не приходится рассчитывать, что все потребители наркотиков всегда будут следовать инструкциям «по безопасному впрыскиванию», но если такая практика будет использоваться хотя бы в 30-50% случаев, то это уже во много раз снизит скорость распространения вирусных гепатитов и ВИЧ в этой группе, что в свою очередь уменьшит риск для остального населения.
Снижению заболеваемости вирусным гепатитом В может также способствовать вакцинация, которую следует проводить в возрасте до 13 лет, так как большинство подростков начинают использовать наркотики в 14–16 лет.
По официальным данным МЗ РФ, в последние годы в нашей стране наблюдается значительный рост наркомании, особенно среди молодежи в возрасте 14-25 лет. В связи с этим особую актуальность в настоящее время приобретает проблема так называемых «шприцевых» инфекций, среди которых наиболее часто встречаются ВИЧ-инфекция, вирусные гепатиты В и С, бактериальные гематогенные инфекции, вызывающие тяжелые септические осложнения — бактериальный эндокардит, пневмонию, септицемию [1]. У лиц, употребляющих наркотики, чаще всего внутривенно развивается септический процесс, вызываемый Staphylococcus aureus [2].
В качестве клинических примеров приводим два характерных случая течения «шприцевой» инфекции у молодых женщин с героиновой зависимостью. Эти наблюдения, на наш взгляд, могут помочь практическим врачам познакомиться с особенностями клинического проявления таких осложнений у наркоманов.
Наблюдение первое. Больная Б., 23 лет, поступила в клинику 12.12.1999 с диагнозом «острый пиелонефрит, правосторонняя пневмония?». Больная при поступлении предъявляла жалобы на постоянные интенсивные боли в левой поясничной области с иррадиацией в левую ягодицу, общую слабость, бессоницу, ознобы, повышение температуры до 39-40°С. Вышеуказанные симптомы развились у больной за пять дней до госпитализации. В анамнезе — героиновая зависимость в течение семи лет. Наличие миалгии у больной было расценено как наркотическая «ломка». В клинической картине преобладал интоксикационный синдром с гектическим характером температурной кривой и стойкой артериальной гипотензией (рис. 1). При эхокардиографическом исследовании было выявлено: полости сердца не расширены, фракция выброса — 70%, на створке трехстворчатого клапана — вегетация 10-15 мм в систолу, пролабирующая в правый желудочек. Трикуспидальная регургитация II степени. По данным ЭхоКГ, нельзя было исключить разрыв хорд мелких генераций. На рентгенограмме органов грудной клетки в трех проекциях выявлялись множественные очаги деструкции с незначительной перифокальной реакцией и увеличением медиастинальных, паратрахеальных и перибронхиальных лимфатических узлов с обеих сторон; жидкость в правой плевральной полости, доходящая до V ребра. По данным УЗИ органов брюшной полости определялась умеренная гепатоспленомегалия. В лабораторных анализах отмечалось умеренное повышение уровня сывороточных трансаминаз, незначительное повышение уровня общего билирубина при незначительном увеличении уровня острофазных белков. При посеве крови и мокроты патогенной микрофлоры выявлено не было. У больной методом ИФА были определены антитела к вирусам гепатита В и С. Учитывая тяжесть состояния, больной начали проводить активную парентеральную антибиотикотерапию (ванкомицин, цефабол) в сочетании с дезинтоксикационным лечением. В психическом статусе больная негативна, малоинформативна (с трудом шла на контакт), от предложенных схем лечения и обследования активно отказывалась, несмотря на разъяснения, касающиеся серьезности дальнейшего прогноза и возможности исхода болезни. Больная после введения в стационаре очередной дозы героина была выписана по собственному желанию на восьмые сутки пребывания в стационаре.
Как показывают наши примеры, встречаемость инфекционного эндокардита среди наркоманов увеличивается в связи с широким распространением внутривенного употребления наркотиков. Наиболее часто поражается трикуспидальный клапан. По данным литературы, в процесс могут также вовлекаться и другие клапаны [3]. В кантональном госпитале Цюриха было проведено проспективное исследование 22 пациентов с инфекционным эндокардитом (средний возраст 23 года). Период наблюдения составил три года [3]. Трикуспидальный клапан был поражен у 13 человек, митральный клапан — у четырех, комбинированное трикуспидально-митральное поражение наблюдалось у пяти пациентов и аортальный клапан был поражен у одного больного. Золотистый стафилококк оказался наиболее частым возбудителем (у 15 человек). Потенциальными факторами его патогенности, определяющими клиническую картину септического процесса, являются следующие энтеротоксины: SEA, SEB, SEC, SED и токсин синдрома токсического шока (TSST-1). Эти вещества связываются белками интерстицильного матрикса: фибронектином, колллагеном I и II типа и костным сиалопротеином (BSP). Однако эти факторы не являются преобладающими среди больных с инфекционным эндокардитом, вызванным Staphylococcus aureus [2]. BSP преобладает у больных с кожными поражениями, в то время, как у больных с эндокардитом чаще всего выделяются штаммы микроорганизмов, не вырабатывающие энтеротоксины. На наш взгляд, исходя из такой особенности выработки патогенов, можно предположить, что клинические проявления септического процесса, связанные с первичным очагом инфекции в коже (например, фурункулез), являются по своей картине однородными, в то время как при стафилококковом эндокардите факторы патогенности разнородны или вообще отсутствуют. Это может быть причиной отрицательного результата посевов крови.
Streptococci, по данным швейцарских врачей, являлись причиной бактериального эндокардита у четыреx пациентов, Corynebacteria — у двуx и в одном случае имелась смешанная инфекция [3]. Шесть пациентов были ВИЧ-инфицированы и 17 имели хронический вирусный гепатит. Десять пациентов (трое из них ВИЧ-инфицированные) подверглись хирургическому лечению. При кардиохирургическом лечении было проведено: рассечение трикуспидального клапана с заменой (у одного больного) или без замены (у четыреx больных) клапана, удаление вегетаций и замена клапана (у двух больных), замена митрального клапана (у двуx больных), протезирование аортального клапана (у одного больного). В случае эндокардита трехстворчатого клапана тактика оперативного вмешательства (выполнить резекцию, удалить вегетации или осуществить замену клапана) была выбрана с учетом тяжести поражения клапана и состояния психосоциального статуса пациента. В случае если вегетации присутствуют только на одной створке клапана и могут быть легко удалены, используется вегетоэктомия с аннулопластикой аутологичным перикардом. Удаление клапана без его протезирования является средством выбора среди тех пациентов, у которых нельзя исключить употребление наркотиков в будущем. Протезирование биопротезом используется в том случае, когда налицо полное разрушение клапана и доказано, что пациент воздерживался от употребления наркотиков в течение длительного времени до операции.
Таким образом, приведенные выше клинические наблюдения убедительно показывают, что при «шприцевом» бактериальном инфицировании наиболее серьезным и угрожающим жизни осложнением является бактериальный эндокардит трикуспидального клапана с развитием гематогенной деструкции легких и развернутой картиной сепсиса. Проведение полномасштабной комплексной терапии в реальных условиях весьма проблематично из-за высокой стоимости медикаментозного лечения, необходимости кардиохирургической коррекции и неконтролируемых психопатологических изменений личности.
Литература
1. Медицинская микробиология / Гл. ред. В. И. Покровский, О. К. Поздеев. М.: Гэотар Медицина, 1999. 1200 с.
2. Carrel T., Schaffner A., Pasic M. et al. Surgery of endocarditis in the drug dependent and HIV patient. A prospective comparison with conservative treatment // Helv. Chir. Acta. 1993. Vol. 60. №3. Р. 439-445.
3. Hogevik H., Soderquist B., Tung H. S. et al. Virulence factors of Staphylococcus aureus strains causing infective endocarditis a comparison with strains from skin infections // APMIS. 1998. Vol. 106. № 9. P. 901-908.
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний яв
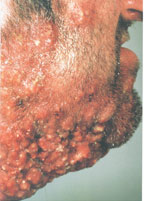
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний является хронический рецидивирующий фурункулез (ХРФ). Фурункул развивается в результате острого гнойно-некротического воспаления волосяного фолликула и окружающих его тканей. Как правило, фурункул является осложнением остеофолликулита стафилококковой этиологии. Фурункулы могут возникать как одиночно, так и множественно (так называемый фурункулез).
В случае рецидивирования фурункулеза диагностируется хронический рецидивирующий фурункулез. Как правило, он характеризуется частыми рецидивами, длительными, вялотекущими обострениями, толерантными к проводимой антибактериальной терапии. В зависимости от количества фурункулов, распространенности и выраженности воспалительного процесса ХРФ классифицируется по степени тяжести (Л. Н. Савицкая, 1987).
Тяжелая степень: диссеминированные, множественные, непрерывно рецидивирующие небольшие очаги со слабой местной воспалительной реакцией, не пальпируемыми или слегка определяющимися регионарными лимфатическими узлами. Тяжелое течение фурункулеза сопровождается симптомами общей интоксикации: слабостью, головной болью, снижением работоспособности, повышением температуры тела, потливостью.
Средняя степень тяжести — одиночные или множественные фурункулы больших размеров, протекающие с бурной воспалительной реакцией, с рецидивами от 1 до 3 раз в год. Иногда сопровождается увеличением регионарных лимфатических узлов, лимфангоитом, кратковременным повышением температуры тела и незначительными признаками интоксикации.
Легкая степень тяжести — одиночные фурункулы, сопровождающиеся умеренной воспалительной реакцией, с рецидивами от 1 до 2 раз в год, хорошо пальпируемыми регионарными лимфатическими узлами, без явлений интоксикации.
Чаще всего пациенты, страдающие фурункулезом, получают лечение у хирургов, в лучшем случае на амбулаторном этапе им проводится исследование крови на сахар, аутогемотерапия, некоторым назначают и иммуномодулирующие препараты без предварительно проведенного обследования, и в большинстве случаев они не получают положительного результата от проведенной терапии. Цель нашей статьи — поделиться опытом ведения больных с ХРФ.
Основным этиологическим фактором ХРФ считается золотистый стафилококк, который встречается, по разным данным, в 60–97% случаев. Реже ХРФ вызывается другими микроорганизмами — эпидермальным стафилококком (ранее считавшимся апатогенным), стрептококками групп А и В и другими видами бактерий. Описана вспышка заболеваемости фурункулезом нижних конечностей у 110 пациентов, являвшихся пациентами одного и того же педикюрного салона. Возбудителем данной вспышки являлся Mycobacterium fortuitium, причем этот микроорганизм был выявлен в ванночках для ног, используемых в салоне. В большинстве случаев ХРФ из гнойных очагов высеваются антибиотикорезистентные штаммы золотистого стафилококка. По данным Н. М. Калининой, St. aureus в 89,5% случаев резистентен к пенициллину и ампициллину, в 18,7% — резистентен к эритромицину и в 93% случаев чувствителен к клоксациллину, цефалексину и котримоксазолу. В последние годы отмечается достаточно широкое распространение метициллин-резистентных штаммов этого микроорганизма (до 25% пациентов). По данным зарубежной литературы, наличие на коже или на слизистой оболочке носа патогенного штамма St. aureus считается важным фактором развития заболевания.
ХРФ имеет сложный и до сих пор недостаточно изученный патогенез. Установлено, что дебют и дальнейшее рецидивирование заболевания обусловлены целым рядом эндо- и экзогенных факторов, среди которых наиболее значимыми считаются нарушение барьерной функции кожных покровов, патология ЖКТ, эндокринной и мочевыделительной систем, наличие очагов хронической инфекции различной локализации. По данным проведенных нами исследований, очаги хронической инфекции различной локализации выявляются у 75–99,7% пациентов, страдающих ХРФ. Наиболее часто встречаются очаги хронической инфекции ЛОР-органов (хронический тонзиллит, хронический гайморит, хронический фарингит), дисбактериоз кишечника с увеличением содержания кокковых форм. У больных хроническим фурункулезом патология ЖКТ (хронический гастродуоденит, эрозивный бульбит, хронический холецистит) определяется в 48–91,7% случаев. У 39,7% пациентов диагностируется патология эндокринной системы, представленная нарушениями обмена углеводов, гормонпродуцирующей функции щитовидной и половых желез. У 39,2% больных с упорно текущим фурункулезом имеется латентная сенсибилизация, у 4,2% — клинические проявления сенсибилизации к аллергенам домашней пыли, пыльцы деревьев и злаковых трав, у 11,1% — повышенная концентрация сывороточного IgE.
Таким образом, для большинства больных ХРФ характерны непрерывно рецидивирующее течение заболевания (41,3%) при тяжелой и средней тяжести течения фурункулеза (88%) и длительные обострения (от 14 до 21 дня — 39,3%). У 99,7% пациентов выявлены хронические очаги инфекции различной локализации. В 39,2% случаев определялась латентная сенсибилизация к различным аллергенам. Основным возбудителем является St. aureus.
В возникновении и развитии хронического фурункулеза, наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами, наличием сопутствующей патологии, большая роль отводится нарушениям нормального функционирования и взаимодействия различных звеньев иммунной системы. Иммунная система, призванная обеспечить биологическую индивидуальность организма и, как следствие, выполняющая защитную функцию при контакте с инфекционными, генетически чужеродными агентами, в силу разных причин может давать сбой, что ведет к нарушению защиты организма от микробов и проявляется в повышенной инфекционной заболеваемости.
Иммунная защита от бактерий-патогенов включает два взаимосвязанных компонента — врожденный (носящий преимущественно неспецифический характер) и адаптивный (характеризующийся высокой специфичностью к чужеродным антигенам) иммунитет. Возбудитель ХРФ при попадании в кожу вызывает «каскад» защитных реакций.
У 26–35% больных, страдающих хроническим фурункулезом, снижается количество В-лимфоцитов. При оценке компонентов гуморального иммунитета у больных фурункулезом выявляются различные дисиммуноглобулинемии. Наиболее часто встречаются снижение уровней IgG и IgM. Отмечено снижение аффинности иммуноглобулинов у больных ХРФ, причем выявлена корреляция между частотой встречаемости этого дефекта, стадией и тяжестью заболевания. Тяжесть нарушений лабораторных показателей коррелирует с тяжестью клинических проявлений фурункулеза.
Из вышесказанного следует, что изменения показателей иммунного статуса у больных ХРФ носят разноплановый характер: у 42,9% отмечено изменение субпопуляционного состава лимфоцитов, у 71,1% — фагоцитарного и у 59,5% — гуморального звена иммунной системы. В зависимости от выраженности изменений в показателях иммунного статуса больных ХРФ можно разделить на три группы: легкой тяжести, средней и тяжелого течения, что коррелирует с клиническим течением заболевания. При легком течении фурункулеза у большинства больных (70%) показатели иммунного статуса находятся в пределах нормы. При средней и тяжелой степени преимущественно выявляются изменения фагоцитарного и гуморального звеньев иммунной системы.
Диагностика и лечение ХРФ
Исходя из вышеуказанных патогенетических особенностей ХРФ алгоритм диагностики должен включать в себя выявление очагов хронической инфекции, диагностику сопутствующих заболеваний, оценку лабораторных параметров состояния иммунной системы (рис.).
В нашем институте был разработан план обследования больных ХРФ.
- Обязательное лабораторное исследование:
- клинический анализ крови;
- общий анализ мочи;
- биохимический анализ крови (общий белок, белковые фракции, общий билирубин, мочевина, креатинин, трансаминазы - АСТ, АЛТ);
- RW, ВИЧ;
- анализ крови на наличие гепатита В и С;
- посев содержимого фурункула на флору и чувствительность к антибиотикам;
- гликемический профиль;
- иммунологическое обследование (фагоцитарный индекс, спонтанная и индуцированная хемилюминесценция (ХЛ), индекс стимуляции (ИС) люминолзависимой хемилюминесценции ЛЗХЛ), бактерицидность нейтрофилов, иммуноглобулины A, M, G, аффинность иммуноглобулинов);
- бактериологическое исследование фекалий;
- анализ кала на яйца глистов;
- посев из зева на флору и грибы.
- Дополнительное лабораторное исследование:
- определение уровня гормонов щитовидной железы (Т3,Т4, ТТГ, АТ к ТГ);
- определение уровня половых гормонов (эстрадиол, пролактин, прогестерон);
- посев крови на стерильность трехкратно;
- посев мочи (по показаниям);
- посев желчи (по показаниям);
- определение базальной секреции;
- иммунологическое обследование (субпопуляции Т-лимфоцитов, В-лимфоциты);
- общий IgE.
- Инструментальные методы обследования:
- гастроскопия с определением базальной секреции;
- УЗИ органов брюшной полости;
- УЗИ щитовидной железы (по показаниям);
- УЗИ женских половых органов (по показаниям);
- дуоденальное зондирование;
- функции внешнего дыхания;
- ЭКГ;
- рентгенография органов грудной клетки;
- рентгенография придаточных пазух носа.
- Консультации специалистов: отоларинголога, гинеколога, эндокринолога, хирурга, уролога.
Тактика лечения больных ХРФ определяется стадией заболевания, сопутствующей патологией и иммунологическими нарушениями. В стадии обострения ХРФ требуется проведение местной терапии в виде обработки фурункулов антисептическими растворами, антибактериальными мазями, гипертоническим раствором; в случае локализации фурункулов в области головы и шеи или наличия множественных фурункулов — проведение антибактериальной терапии с учетом чувствительности возбудителя. В любой стадии заболевания необходима коррекция выявленной патологии (санация очагов хронической инфекции, лечение патологии ЖКТ, эндокринной патологии и т. д.). При выявлении у больных ХРФ латентной сенсибилизации или при наличии клинических проявлений аллергии необходимо в период поллинации добавлять к лечению антигистаминные препараты, назначать гипоаллергенную диету, проводить хирургическое вмешательство с премедикацией гормональными и антигистаминными препаратами.
В последнее время в комплексной терапии больных ХРФ все чаще используют препараты, оказывающие корригирующее действие на иммунную систему.
Разработаны показания к назначению иммуномодуляторов в зависимости от доминирующего типа нарушений иммунного статуса и степени заболевания. Так, в стадии обострения ХРФ рекомендовано применение следующих иммуномодуляторов.
- При наличии изменений фагоцитарного звена иммунитета целесообразно назначение полиоксидония по 6-12 мг внутримышечно в течение 6-12 дней.
- При снижении аффинности иммуноглобулинов - галавит 100 мг № 15 внутримышечно.
- При снижении уровня В-лимфоцитов, нарушении соотношения CD4/CD8 в сторону уменьшения показано применение миелопида по 3 мг в течение 5 дней внутримышечно.
- При снижении уровня IgG на фоне тяжелого обострения ХРФ при клинической неэффективности применения галавита используются препараты иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин).
В период ремиссии возможно назначение следующих иммуномодуляторов.
- Полиоксидоний 6-12 мг внутримышечно в течение 6-12 дней - при наличии изменений фагоцитарного звена иммунитета.
- Ликопид 10 мг в течение 10 дней перорально - при наличии дефектов образования активных форм кислорода.
- Галавит 100 мг № 15 внутримышечно - при снижении аффинности иммуноглобулинов.
Применение ликопида целесообразно также при вялотекущем, непрерывно рецидивирующем фурункулезе. При упорном рецидивировании ХРФ на фоне изменений гуморального звена иммунитета показано назначение препаратов иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин). В некоторых случаях целесообразно комбинированное применение иммуномодулирующих препаратов (например, при обострении фурункулеза возможно назначение полиоксидония, в дальнейшем, при выявлении дефекта аффинности иммуноглобулинов, добавляется галавит и т. д.).
Несмотря на значительные успехи, достигнутые в области клинической иммунологии, эффективное лечение ХРФ остается достаточно сложной задачей. В связи с этим требуется дальнейшее изучение патогенетических особенностей этого заболевания, а также разработка новых подходов к терапии ХРФ.
Неоген является синтетическим трипептидом, состоящим из L-аминокислотных остатков изолецитина, глютамина и триптофана. Неоген применялся в составе комплексной терапии, проводимой больным хроническим фурункулезом. Внутримышечные инъекции препарата неогена проводились по 1 мл 0,01% раствора 1 раз в сутки ежедневно, курс — 10 инъекций. Применение неогена в комплексной терапии больных хроническим фурункулезом на стадии ремиссии заболевания вызывает достоверную нормализацию изначально измененных иммунологических показателей (относительного и абсолютного количества лимфоцитов, относительного количества CD3 + , CD8 + , CD19 + , CD16 + -лимфоцитов, поглотительной способности моноцитов по отношению к St. aureus) и увеличение показателей спонтанной ХЛ и аффинности анти-ОАД-антител, количества HLA-DR+-лимфоцитов, а следовательно, позволяет продлить период ремиссии заболевания по сравнению с группой контроля.
Таким образом, из вышеизложенного следует, что ХРФ протекает под воздействием сложного комплекса этиологических и патогенетических факторов и его нельзя рассматривать только как местное воспаление. Больным с ХРФ необходимо проводить всестороннее обследование с целью выявления возможных очагов хронической инфекции, которые являются источником септицемии и при нарушении элиминации микробов в крови в результате снижения иммунологической реактивности организма приводят к возникновению фурункулов. Так как назначение иммунокорригирующих препаратов может вызвать обострение основного заболевания, мы считаем, что лечение больных необходимо начинать с санации выявленных очагов инфекции.
Вопрос о назначении иммунокорригирующих препаратов должен решаться индивидуально, с учетом стадии заболевания, наличия сопутствующей патологии и типа иммунологического дефекта. При выявлении у больного сенсибилизации к различным аллергенам лечение фурункулеза необходимо проводить на фоне противоаллергенной терапии.
Н. Х. Сетдикова, доктор медицинских наук
К. С. Манько
Т. В. Латышева, доктор медицинских наук, профессор

Наркотики негативно воздействуют на человека, подрывают его психическое и физическое здоровье. Конкретные изменения в организме зависят от вида химии.
В общий перечень потенциальных опасностей входят:
Гепатиты B, C, D
Инъекционные наркотики провоцируют воспаление печени. При несоблюдении больным правил гигиены, вирус распространяется очень быстро.
Кто находится в группе риска?
Вирус поражает наркоманов с ослабленным иммунитетом, половых партнеров носителей инфекции. Вовремя не выявленное заражение может привести к раку и циррозу печени.
ВИЧ и СПИД
Как и гепатит, ВИЧ и СПИД передаются через кровь. Наркоману достаточно ввести дозу использованным шприцем, и если на том остались следы инфицированного, вирус проявится очень быстро.
Помимо инъекционных наркотиков ВИЧ передается через так называемые «клубные» наркотики амфетаминового типа. Как только вирус попадает в организм, иммунная система дает сбой. Любая инфекция может оказаться для наркомана смертельной.
Сепсис
Заражение крови или сепсис — следствие сниженного иммунитета и введения некачественных наркотиков. Распознать заболевание можно по появляющимся у наркомана гнойникам. Вовремя не замеченные, они прогрессируют, поражая подкожные ткани. Температура тела больного повышается, возрастает риск летального исхода.
Другие виды инфекций
Запущенный СПИД может стать причиной многих вирусных заболеваний. Среди них:
Туберкулез
У наркоманов это заболевание встречается чаще, чем у здоровых людей, и если вовремя не обратиться к специалисту, инфекция начнет поражать не только легкие, но и другие органы.
Изоспороз
Недомогание приводит к острому колиту. У здорового человека симптомы могут исчезнуть самостоятельно, инфицированному потребуется медицинская помощь.
Грибковые инфекции
В большинстве случаев наркоманы страдают от кандидоза. В полости рта и на половых органах появляется белый налет. Запущенное заболевание поражает органы дыхательной системы.
Герпес
Не смертельное, но опасное заболевание, вызывающее неприятные ощущения. Болезненные прыщики появляются на лице и половых органах больного.
Рецидивирующий сальмонеллез
У зависимого от наркотиков сальмонеллез приобретает хроническую форму и может иметь осложнения в виде отека мозга и сердечной недостаточности.
Токсопламоз
Одна из наиболее опасных болезней, поражающая головной мозг. Как только вирус поражает организм, у человека начинаются приступы эпилепсии, постепенно снижается качество зрения, пропадает речь. Предотвратить все нежелательные последствия вируса сможет своевременная помощь специалиста.
Лечение наркомании
Международная Антинаркотическая Ассоциация осуществляет:
У наркоманов болезнь протекает быстрее и тяжелее, чем у здорового человека, а заражение организма происходит практически в каждом случае. Задача близких людей зависимого — вовремя обратиться за помощью в специализированный центр лечения наркомании.
Не тяните, обращайтесь в центр реабилитации «Международной Антинаркотической Ассоциации» и мы Вам поможем.
Міжнародна Антинаркотична Асоціація
Міжнародна Антинаркотична Асоціація створена з метою профілактики наркоманії та пропаганди здорового способу життя. Об’єднання засноване на принципах добровільності та рівності.
Читайте также:

