Почему псевдомикозы лечат антибиотиками
Обновлено: 24.04.2024
Актиномикоз — инфекционное заболевание, вызываемое лучистыми грибами (актиномицетами) и имеющее первично-хроническое течение с образованием плотных гранулем, свищей и абсцессов. Актиномикоз может поражать не только кожу, но и внутренние органы. Диагностика заболевания основана на обнаружении характерного мицелия грибов в отделяемом и выявлении роста специфических колоний при посеве на питательные среды. В лечении актиномикоза применяется введение актинолизата в сочетании с антибиотикотерапией, УФО кожи, электрофорезом йода. По показаниям производится вскрытие абсцессов, оперативное лечение свищей, дренирование брюшной и плевральной полости.
МКБ-10
Общие сведения
Актиномикоз — инфекционное заболевание, вызываемое лучистыми грибами (актиномицетами) и имеющее первично-хроническое течение с образованием плотных гранулем, свищей и абсцессов. Актиномикоз может поражать не только кожу, но и внутренние органы. Диагностика заболевания основана на обнаружении характерного мицелия грибов в отделяемом и выявлении роста специфических колоний при посеве на питательные среды.
Причины возникновения актиномикоза
Возбудители актиномикоза — грибы рода Actinomyces часто встречаются в природе. Они могут находиться на почве, растениях, сене или соломе. В организм человека актиномицеты проникают через поврежденную кожу, при вдыхании или с пищей. В большинстве случаев они не вызывают заболевания, а живут на слизистых глаз или ротовой полости в качестве сапрофитной флоры. Воспалительные процессы во рту, желудочно-кишечном тракте или органах дыхания могут привести к переходу актиномицетов в паразитическое состояние с развитием актиномикоза. Актиномикоз также встречается у сельскохозяйственных животных. Однако заражение человека от животных или больных актиномикозом людей не происходит.
Актиномикоз кожи может возникать первично при проникновении актиномицетов через ранки и другие повреждения на коже. Вторичное поражение кожи развивается изнутри, при переходе инфекции из подлежащих тканей (миндалины, зубы, лимфатические узлы, мышцы, молочная железа) и внутренних органов.
Классификация актиномикоза
В зависимости от локализации патологического процесса при актиномикозе выделяют следующие формы:
- шейно-челюстно-лицевая;
- торакальная;
- абдоминальная;
- кожная;
- мочеполовая;
- актиномикоз суставов и костей;
- актиномикоз ЦНС;
- актиномикоз стопы (мицетома, мадурская стопа)
Симптомы актиномикоза
Длительность инкубационного периода при актиномикозе точно не известна. Заболевание характеризуется длительным и прогрессирующим течением и может продолжаться 10-20 лет. В начальном периоде у пациента сохраняется нормальное самочувствие, но при поражении внутренних органов состояние становиться тяжелым, возникает кахексия.
Актиномикоз кожи наиболее часто поражает подчелюстную, крестцовую область и ягодицы. Он характеризуется появлением в подкожной клетчатке уплотнений и синюшно-багровой окраской кожи над ними. Уплотнения имеют шаровидную форму и практически не вызывают болезненных ощущений. Вначале они очень плотные, затем размягчаются и вскрываются с образованием плохо заживающих свищей. В гнойном отделяемом свищей может быть примесь крови. Иногда в нем присутствуют желтые крупинки — друзы актиномицетов.
Актиномикоз кожи бывает 4 видов. При атероматозном варианте, который встречается в основном у детей, инфильтраты напоминают атеромы. Бугорково-пустулезный актиномикоз начинается с образования в коже бугорков, переходящих в глубокие пустулы, а затем и свищи. Для гуммозно-узловатого варианта характерно образование узлов хрящевой плотности. Язвенный актиномикоз, как правило, развивается у ослабленных пациентов. При нем стадия нагноения инфильтрата заканчивается некрозом тканей и образованием язвы.
Шейно-челюстно-лицевой актиномикоз распространен больше других и встречается в нескольких формах: с поражением межмышечной клетчатки (мышечная форма), подкожной клетчатки или кожи. Процесс может распространяться по лицу и шее, захватывая губы, язык, проникая в гортань, трахею и глазницу. При мышечной форме характерный инфильтрат наиболее часто образуется в области жевательных мышц, вызывая тризм и приводя к асимметрии лица.
Торакальный актиномикоз начинается с симптомов простуды: общая слабость, субфебрилитет, сухой кашель. Затем кашель становиться влажным, выделяется слизисто-гнойная мокрота, имеющая вкус меди и запах земли. Постепенно актиномикотический инфильтрат распространяется от центра на грудную стенку и выходит на кожу, образуя при этом свищи, идущие от бронхов. Такие свищи могут открываться не только на поверхности грудной клетки, но и в области поясницы и даже бедра.
Абдоминальный актиномикоз часто имитирует острую хирургическую патологию (кишечную непроходимость, аппендицит и т. п.). Он распространяется на кишечник, печень, почки, позвоночник и может дойти до передней стенки живота с образованием открывающихся на коже кишечных свищей. Актиномикоз прямой кишки протекает с клинической картиной парапроктита. Актиномикоз мочеполовых органов — редкое заболевание, которое чаще возникает вторично при переходе инфекции из брюшной полости.
Актиномикоз суставов и костей обычно возникает при распространении процесса из других органов. Поражение суставов не сопровождается значительным нарушением их функции, а актиномикоз костей протекает по типу остеомиелита. Распространение инфильтрата до поверхности кожи приводит к образованию свищей. Мицетома начинается с появления на подошве нескольких плотных «горошин», кожа над которыми постепенно приобретает буро-фиолетовую окраску. Количество уплотнений увеличивается, возникает отечность, изменяется форма стопы и образуются гнойные свищи. В процесс могут вовлекаться сухожилия, мышцы и кости стопы.
Диагностика актиномикоза
При развитии характерной клинической картины актиномикоза диагностика не вызывает затруднений. Однако важно поставить правильный диагноз еще в начальном периоде актиномикоза. Обнаружение актиномицетов в мокроте, мазках из зева или носа не имеет диагностической ценности, поскольку наблюдается и у здоровых людей. Поэтому для исследования берут отделяемое свищей или проводят чрезкожную пункцию пораженного органа. Обычная микроскопия исследуемого материала может выявить друзы актиномицетов, что позволяет быстро поставить предварительный диагноз актиномикоза. Последующее проведение реакции иммунофлуоресценции (РИФ) со специфическими антигенами направлено на определение вида актиномицетов.
Сложности составляют те случаи актиномикоза, при которых друз нет в исследуемом материале, что наблюдается в 75% заболевания. В таких случаях единственный надежный способ диагностики — это посев гноя или биопсийного материала на среду Сабура. Полное и достоверное исследование посева на актиномикоз может занять более 2-х недель. Но уже через 2-3 дня при микроскопии можно обнаружить характерные для актиномикоза колонии. При исследовании посева обязательно учитывается рост сопутствующей микрофлоры и ее чувствительность к антибиотикам.
Серологическая диагностика актиномикоза, к сожалению, не является достаточно специфичной. А методы ПЦР-исследований в отношении этого заболевания находятся пока в стадии разработки.
Лечение актиномикоза
Лечение актиномикоза проводят внутримышечным и подкожным введением актинолизата. Совместно с этим проводится антибиотикотерапия, направленная на подавление сопутствующей флоры и предупреждение вторичного инфицирования. Как и любая хроническая инфекция актиномикоз требует дополнительной дезинтоксикационной и общеукрепляющей терапии.
К физиотерапевтическому лечению, которое используется при актиномикозе, относится УФО кожи в области поражения, местный электрофорез актинолизата и йода. При образовании абсцессов необходимо их вскрытие. Также может потребоваться хирургическое лечение свищей, дренирование плевральной полости или брюшной полости. В некоторых случаях при больших поражениях легких проводят лобэктомию.
Прогноз и профилактика актиномикоза
При отсутствии специфического лечения актиномикоз внутренних органов может привести к летальному исходу. Наиболее легкой формой считается шейно-челюстно-лицевой актиномикоз. После выздоровления пациентов возможно развитие рецидивов.
Специфической профилактики актиномикоза нет. К неспецифической профилактике можно отнести соблюдение гигиены, предупреждение травмирования кожи, своевременное лечение зубов, воспалительных заболеваний ротовой полости, миндалин, органов дыхания и желудочно-кишечного тракта.
Что такое псевдомембранозный колит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аверина Александра Анатольевича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Аверина Александра Анатольевича работали литературный редактор Вера Васина , научный редактор Роман Васильев и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Псевдомембранозный колит (Pseudomembranous colitis) — это острое воспалительное заболевание толстого кишечника, вызываемое токсигенными штаммами бактерии Clostridium difficile [1] . Микроб вырабатывает токсины А и В, повреждающие кишечную стенку, и белок, угнетающий перистальтику кишечника. В результате возникает диарея, боль в животе, появляется слизь и иногда примесь крови в кале.
Характерным признаком заболевания являются фиброзные наложения на слизистой оболочке толстой кишки [27] [28] .

Псевдомембранозный колит (ПМК) чаще всего развивается после лечения антибиотиками. Его ещё называют Clostridium difficile-ассоциированным псевдомембранозным колитом, антибиотик-ассоциированным псевдомембранозным и клостридиозным колитом.
Эпидемиология
Заболеваемость ПМК лучше всего отслеживается в США и странах западной Европы [2] . В России статистический учёт заражения C. diff не ведётся. Согласно систематическому обзору за 2011 год, каждый 5-й случай из всех антибиотик-ассоциированных диарей (ААД) и каждый 2–3 случай внутрибольничной ААД в странах Европы и Северной Америки вызваны C. diff [3] .
В стационарах США среди внутрибольничных инфекций C. diff занимает первое место (12,1 % от общего количества), опережая K. pneumoniae (9, 7 %) и E. coli (9,3 %) [4] . В 2011 г. было зафиксировано более 450 тыс. случаев C. difficile-ассоциированной болезни и более 29 тыс. смертей от неё [29] .
В европейских странах заболеваемость C. diff составляет около 7 случаев на 10000 койко-дней, т. е. при средней госпитализации 10 дней, 7 случаев из 1000 госпитализаций заканчиваются ПМК. В 20 европейских странах это значение колеблется от 0,7 до 28,7 на 10000 койко-дней [5] .
В России в 2011 году было продано 295 млн упаковок антибиотиков, в 2019 — 379 млн [8] [26] . Антибактериальных препаратов потребляется всё больше, их продажа из аптек не контролируется, поэтому проблемы ААД и ПМК актуальны и в нашей стране.
В клиниках Санкт-Петербурга у пациентов с ААД тест на токсины C. diff был положительным в 47,7 % случаев [6] .
Смертность от ПМК колеблется от 9,3 до 22 % и зависит от возраста пациента, смерть чаще наступает при тяжёлом течении заболевания [7] [26] .
В настоящее время увеличилась внутри- и внебольничная заболеваемость C. difficile-ассоциированной болезнью, расширились группы риска, стали чаще встречаться рецидивы и тяжёлые формы, в том числе вызванные более патогенным штаммом BI/NAP1/027, возросла смертность [27] .
Причины псевдомембранозного колита
Основная причина болезни — это приём антибиотиков. ПМК могут вызывать любые антибактериальные препараты, но наиболее часто к нему приводит применение Клиндамицина, хинолонов, цефалоспоринов 2-го и 3-го поколения, карбапенемов. Реже ПМК развивается после приёма макролидов, пенициллина, Тетрациклина, Тигециклина.
К факторам риска, помимо приёма антибиотиков, относятся:
- возраст старше 65 лет;
- терапия ингибиторами протонной помпы и Н2-гистаминоблокаторами — препаратами, снижающими секрецию соляной кислоты в желудке;
- лечение в стационаре, особенно в отделениях реанимации, — каждые 7 дней госпитализации увеличивают риск ПМК на 8 % [1][9][10] ;
- наличие дополнительной патологии, в том числе воспалительных заболеваний кишечника, ВИЧ, сахарного диабета[31][32][33] ;
- хирургические вмешательства на органах ЖКТ;
- энтеральное питание, в том числе через назогастральный зонд;
- приём иммуносупрессивных препаратов (глюкокортикостероидов, Такролимуса) и противоопухолевых средств [31] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы псевдомембранозного колита
Наиболее частые симптомы лёгкого или умеренного псевдомембранозного колита:
- водянистая диарея (жидкие испражнения, похожие на кашицу) от трёх раз в сутки на протяжении двух и более дней в сочетании с болью в животе;
- лёгкие спазмы в животе, часто сопровождающиеся с позывами на стул, но не всегда приводящие к дефекации;
- примеси слизи, крови или гноя в испражнениях;
- температура тела 38,5 °С и более;
- тошнота или потеря аппетита.
При тяжёлом течении псевдомембранозного колита возникает водянистая диарея с кровью, уровень альбумина снижается менее 30 г/л, что сочетается с одним из следующих симптомов: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) и/или болезненностью при ощупывании живота. На фоне длительной диареи организм теряет много жидкости, что приводит к обезвоживанию и проявляется тёмно-жёлтой мочой, чувством жажды, усталости, головокружением, спутанностью сознания и заторможенностью [1] [9] .
При рецидиве болезни симптомы появляются повторно менее чем через 8 недель после окончания терапии.
Проявления псевдомембранозного колита схожи с симптомами других инфекций, поражающих толстый кишечник. Но в отличие от них признаки ПМК могут быть слабо выражены и, как правило, наблюдаются долго: от одной недели до нескольких месяцев. Также встречаются случаи, когда человек является носителем возбудителя ПМК — C. diff, но симптомы полностью отсутствуют.
Патогенез псевдомембранозного колита
В основе патогенеза ПМК лежит чрезмерное размножение бактерий C. diff на фоне уменьшения или гибели нормальной микробиоты толстого кишечника. C. diff вырабатывает токсины А и В, которые вызывают воспаление в кишечной стенке. На течение заболевания влияет состояние иммунной системы пациента и патогенные свойства бактерий, такие как вирулентность, наличие токсинов А и В.
Основной путь передачи инфекции — фекально-оральный. Бактерии попадают в организм с загрязнённых поверхностей, например с дверных ручек, смесителей, ручек смыва сливного бачка, мебели или медицинского инвентаря. Также переносить инфекцию может персонал больницы и заражённые пациенты.
Бактерии C.diff образуют споры, которые устойчивы к действию антибиотиков и могут длительно сохраняться в желудочно-кишечном тракте человека, заражая окружающих и вызывая рецидивы заболевания у самого пациента [12] .
Для некоторых людей C.diff — это часть нормальной микрофлоры ЖКТ, но в таком случае численность бактерий контролируется за счёт других микроорганизмов и работы иммунной системы.
Основные поражающие факторы C.diff — это выделяемые ею токсины [1] . Токсин А (энтеротоксин, белковая молекула с массой 308 кДа) влияет на секрецию жидкости, приводит к повреждению слизистой оболочки кишечника (мембран клеток) и вызывает воспалительный ответ со стороны иммунной системы.

Токсин В (цитотоксин, белковая молекула с массой от 250 до 270 кДа) в 1000 раз более цитотоксичен по сравнению с токсином А. Он вызывает распад филаментного актина — белка, поддерживающего целостность клеток. В результате клетки слизистой разрушаются и гибнут. Токсин В опасен для человека, но не приводит к воспалению и повреждению слизистой оболочки кишечника у животных.
Под действием токсинов в кишечной стенке развивается специфическое воспаление с характерными изменениями на поверхности слизистой. Она становится отёчной, разрыхляется, приобретает ярко-красный цвет, на ней исчезает сосудистый рисунок. При контакте эндоскопа со слизистой капельки крови не появляются. Наблюдается множество желтовато-белых бляшек диаметром 3–5 мм, которые плотно фиксированы к слизистой оболочке. При взятии биопсии они отрываются с трудом, торцом эндоскопа не снимаются. Преобладает два типа воспалительных реакций: диффузно-катаральное воспаление слизистой и очаги фибриноидного некроза — бело-жёлтые бляшки, или псевдомембраны, поэтому такой тип колита называется псевдомембранозным.
![Бляшки при ПМК [35]](https://probolezny.ru/media/bolezny/psevdomembranoznyy-kolit/blyashki-pri-pmk-35_s.jpg)
В биоптатах, полученных из воспалительно-изменённых участков слизистой, выявляют скопление иммунных клеток крови и слизистой, расширение капилляров и некроз клеток покровного эпителия [1] .
В биоптатах, взятых из бляшек, присутствует фибрин, обрывки некротизированного покровного эпителия, слизь, лейкоциты, плазматические клетки и колонии бактерий.
Чтобы определить патогенность клостридий, нужно выявить их токсины. Посев биоптатов на питательные среды удовлетворительных результатов не даёт. Метод в данном случае затратен и неинформативен, поэтому токсины C. diff определяют в кале.
Воспалительный процесс, как правило, захватывает несколько отделов толстого кишечника, но чаще поражена его прямая и сигмовидная часть, реже вовлекается вся толстая кишка. Протяжённость её поражения связана с тяжестью течения заболевания: чем больше толстого кишечника вовлечено в воспалительный процесс, тем тяжелее протекает колит и ярче симптомы.
Продолжительное воспаление в кишечной стенке приводит к следующим нарушениям:
- не всасывается жидкость, из-за чего развивается обезвоживание;
- потери крови из образующихся эрозий и язв приводят к анемии;
- кишечная стенка становится проницаемой для токсинов возбудителя и продуктов его жизнедеятельности, находящихся в просвете кишки, из-за чего нарастает общая интоксикация.
При тяжёлом течении прекращается перистальтика толстого кишечника, развивается токсический мегаколон и возникает полиорганная недостаточность, из-за чего пациент может погибнуть.
Классификация и стадии развития псевдомембранозного колита
ПМК входит в группу антибиотик-ассоциированных диарей. В Международной классификации болезней (МКБ-10) псевдомембранозный колит кодируется как АО 4.7 — Энтероколит, вызванный Clostridium difficile.
В зависимости от тяжести течения болезни и клинической картины выделяют следующие формы:
- ПМК лёгкой или умеренной тяжести. Проявляется диареей — неоформленным жидким, кашицеобразным стулом три или более раз в сутки и болью в животе.
- ПМК тяжёлого течения. Сопровождается водянистой диареей с кровью и изменениями в анализах. В биохимическом анализе крови отмечается низкий уровень альбумина (меньше 30 г/л), который сочетается с одним из следующих признаков: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) в клиническом анализе крови и/или болезненностью при ощупывании живота.
- Осложнённые формы ПМК. Протекают с водянистой диареей с кровью и одним из следующих симптомов: снижение артериального давления, температура тела ≥ 38,5 °C, отсутствие перистальтики тонкого кишечника, помрачение или угнетение сознания. В клиническом анализе крови лейкоциты повышены > 25×10 9 /л или снижены < 2×10 9 /л, возникает органная и почечная недостаточность, требуется искусственная вентиляция лёгких.
- Рецидивирующее течение ПМК. Заболевание развивается повторно менее чем через 8 недель после окончания терапии [1][14] .
Данная классификация используется для выбора схемы лечения.
Осложнения псевдомембранозного колита
Наиболее частые осложнения псевдомембранозного колита:
- Обезвоживание и электролитные нарушения — из-за сильной и длительной диареи нарушается ритм сердца, снижается артериальное давление и мышечный тонус. Чаще эти осложнения развиваются при недостаточном восполнении потерянной жидкости и солей.
- Почечная недостаточность — при стремительном обезвоживании нарушается работа почек, из-за чего снижается частота мочеиспусканий, появляются отёки, по анализам крови видно, что растёт содержание азотистых шлаков.
- Токсический мегаколон — расширение толстой кишки, редкое осложнение с плохим прогнозом. На фоне диареи частота стула резко урежается до одного раза в сутки, в дальнейшем дефекация прекращается полностью. Это происходит из-за замедления и полного прекращения перистальтики толстого кишечника. Из-за распирания толстого кишечника газами и содержимым нарастает вздутие живота, усиливается боль в нём. Интоксикация и электролитные нарушения приводят к резкому ухудшению самочувствия и выраженной слабости. В дальнейшем стенка кишки разрывается, содержимое изливается в брюшную полость (перфорация кишечника) и начинается перитонит. Как правило, это осложнение наблюдается у ослабленных пациентов, находящихся в отделении реанимации и хирургии.
- Перфорация кишечной стенки — образуется сквозное отверстие в кишечной стенке с излитием содержимого кишечника в брюшную полость и развитием перитонита.
- Полиорганная недостаточность — может привести к гибели пациента [1][15] .
Диагностика псевдомембранозного колита
Тесты на C. diff показаны при длительной диарее с болью в животе и/или примесью крови в стуле, возникшей спустя 3–60 суток после выписки из стационара и/или после приёма антибиотиков [1] .
Чтобы выявить токсигенные штаммы C. diff, токсины A и B определяют в кале [16] .
Для этого используют следующие методы:
- Цитотоксиновый копрологический тест. Чувствительность — 95 %, специфичность — 99 %, результат — в течение 2–3 дней.
- ELISA (Enzyme Linked Immuno Sorbent Assay) — фермент-связанный иммуносорбентный тест для определения токсинов. Чувствительность — 70–90 %, специфичность — 99 %, результат — через 4–6 часов.
- ПЦР (полимеразная цепная реакция) на токсин В. Чувствительность — 96 %, специфичность — 100 %, результат — в течение нескольких часов.
Чувствительность теста — это доля положительных результатов среди больных людей, т. е. вероятность правильно определить инфекцию у заболевших, отсутствие ложноотрицательных результатов. Специфичность — доля отрицательных результатов среди здоровых людей, т. е. отсутствие ложноположительных результатов.
Посев кала на C.diff не проводится, так как этим методом не удаётся определить токсигенные штаммы.
С помощью дополнительных методов можно оценить тяжесть состояния пациента и своевременно выявить осложнения.
К дополнительным обследованиям относятся:
- ректороманоскопия или сигмоидоскопия — позволяют обнаружить типичные изменения стенки кишки (множественные желтоватые бляшки 2–10 мм в диаметре, плотно фиксированные на поверхности слизистой оболочки);
- колоноскопия — помимо типичных изменений кишечной стенки, определяется распространённость процесса и поражение толстого кишечника выше сигмовидной кишки [17] ;
- обзорная рентгенография органов брюшной полости — используется, чтобы выявить признаки пареза кишечника и токсического расширения кишки;
- анализ крови — показывает уровень лейкоцитов (при ПМК повышен до 10–50 × 10 9 ), уровень креатинина (выше нормы) и альбумина (ниже нормы).
Гистологическое исследование биоптатов не является необходимым при C. difficile-ассоциированной болезни, но может быть крайне важным для дифференциальной диагностики.
Лечение псевдомембранозного колита
Методы лечения псевдомембранозного колита в российских и зарубежных клинических рекомендациях совпадают [1] [18] . При лёгком и среднетяжёлом течении его проводят в амбулаторных условиях (дома), при тяжёлом и/или осложнённом — в стационаре.
Для лечения ПМК назначаются антибиотики:
Антибиотики подавляют развитие C. diff. Бактерия чувствительна только к трём перечисленным антибактериальным препаратам.
При развитии осложнений ПМК могут применяться следующие методы:
- При токсическом мегаколоне показана колэктомия — удаление толстой кишки.
- Для лечения рецидивирующего ПМК в качестве экспериментального метода рассматривается трансплантация кишечной микробиоты (fecal microbiota transplantation, FMT) [23][24][25] . Кишечную микробиоту берут от здорового донора и при помощи назоинтестинального зонда, клизмы или колоноскопии переносят пациенту в кишечник. В России такое лечение считается экспериментальным. Проводится в научных клинических учреждениях, например в Федеральном научно-клиническом центре ФМБА России.

В качестве вспомогательных и симптоматических препаратов используются:
- Сорбенты (Диоктаэдрический смектит) — эффективно удаляет токсины C. diff, снижая их действие на кишечную стенку, улучшает качество стула.
- Пробиотики (Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium infantis не менее 1×10 9 КОЕ/г) — подавляют активность C. diff. Данные об их эффективности пока противоречивы [22] .
- Препараты на основе дрожжей Saccharomyces cerevisiae (boulardii) — эффективны как вспомогательные и профилактические средства.
Прогноз. Профилактика
При лёгком или среднетяжёлом течении ПМК и хорошей реакции на стандартную терапию прогноз благоприятный, при тяжёлом и осложнённом — неблагоприятный. При рецидивирующем течении прогноз сомнительный, так как не разработаны эффективные схемы лечения.
Профилактика псевдомембранозного колита
Для профилактики развития ПМК следует:
- чаще мыть руки и соблюдать правила личной гигиены;
- рационально принимать антибиотики — строго по назначению врача с соблюдением всех указаний;
- изолировать пациентов с инфекцией C. diff в отдельные палаты, соблюдать меры санитарного режима;
- тщательно обрабатывать все поверхности хлорсодержащими или другими дезинфицирующими средствами, активными против спор C. diff;
- сокращать сроки госпитализации пациентов старше 65 лет [16] .
Чтобы предотвратить рецидив C. difficile-ассоциированной болезни, после завершения лечения Метронидазолом или Ванкомицином назначаются пробиотики курсом не менее трёх месяцев. Серьёзных побочных эффектов от них не выявлено [34] .
Рисунок 1. Актиномикоз челюстно-лицевой области. Стадия свищевания. Рисунок 2. Актиномикоз молочной железы. Актиномикоз, согласно различным источникам и классификациям, называют также глубоким микозом, псевдомик
Актиномикоз, согласно различным источникам и классификациям, называют также глубоким микозом, псевдомикозом, актинобактериозом, лучисто-грибковой болезнью и др. Это заболевание отличается разнообразием клинических проявлений, что связано со стадийностью развития специфического процесса (инфильтрат, абсцедирование, фистулообразование, рубцевание) и с его многочисленными локализациями (голова, шея, ЛОР-органы, грудная клетка, легкие, молочная железа, подмышечные и паховые зоны, брюшная стенка, печень, кишечник, гениталии, слепая кишка, ягодицы, конечности и др., рисунки 1, 2, 3, 4).
Судя по некоторым публикациям и врачебным заключениям, можно отметить, что существуют определенные разночтения в понимании этиопатогенеза актиномикоза и роли актиномицет в развитии хронических гнойных заболеваний. А знание этиологии заболевания, как известно, особенно важно при выборе этиотропного лечения.
Актиномицеты (микроаэрофильные, аэробные и анаэробные микроорганизмы) широко распространены в природе, они обитают в почве, на растениях, в воде, на камнях, в жилых и производственных помещениях, а также постоянно присутствуют в организме человека. Важным диагностическим признаком актиномикоза является обнаружение актиномицет при культуральном исследовании патологического материала и/или друз лучистого гриба, представляющих собой лучистые образования — утолщенные нити мицелия с характерными «колбочками» на конце (рисунок 5).
В 30—40-х гг. XIX в. актиномицеты (лучистые грибы) считали микроорганизмами, занимающими промежуточное место между грибами и бактериями. Способность актиномицет образовывать воздушный мицелий, отсутствие у них органов плодоношения, дифференцирования, клеточной вегетации сближают их с истинными грибами. Однако по химическому составу оболочек, протоплазмы, строению ДНК, актиномицеты соответствуют бактериям. Окончательно доказано, что возбудители актиномикоза — актиномицеты — являются бактериальными клетками.
В большинстве случаев (70—80%) актиномикоз развивается под сочетанным воздействием актиномицет и других бактерий, которые выделяют ферменты (в том числе гиалуронидазу), расплавляющие соединительную ткань и способствующие распространению актиномикотического процесса.
Немаловажная роль в патогенезе актиномикоза принадлежит эндогенным: гематогенному, лимфогенному и контактному, путям проникновения микроорганизмов.
В месте внедрения актиномицет на I этапе болезни постепенно, без видимых клинических симптомов и субъективных жалоб формируется специфическая гранулема — актиномикома, состоящая из лейкоцитов, гигантских клеток, инфильтративной ткани, микроабсцессов, грануляций, пролиферативных элементов, соединительно-тканных перемычек и окружающей капсулы.
Актиномикоз представляет собой хроническое гнойное неконтагиозное заболевание, поражает людей трудоспособного возраста и без адекватного лечения может длиться годами; заболевание имеет склонность к прогрессированию. Формирование хронического воспаления и специфических гранулем с последующим абсцедированием и образованием свищевых ходов при висцеральных локализациях утяжеляет состояние больного и ведет к нарушению функций пораженных органов, развитию анемии, интоксикации и появлению амилоидоза.
Актиномикоз и другие бактериальные инфекции черепно-лицевой и висцеральной локализации требуют комплексного лечения — назначения противовоспалительных, иммуномодулирующих, общеукрепляющих средств, применения хирургических и физиотерапевтических методов. Лечение тяжелых форм висцерального актиномикоза затруднено из-за позднего поступления больных в специализированные отделения, длительной интоксикации и развития необратимых изменений в органах и тканях. Подбор антибиотиков осложняется антибиотикорезистентностью, необходимостью учитывать сопутствующую актиномикозу микрофлору, ассоциации микроорганизмов. Возникают трудности и при проведении радикальных хирургических операций, в связи с чем потребуется особенно тщательная подготовка к ним пациентов, использование адекватных методик обезболивания и тактики хирургического вмешательства.
Более 40 лет мы применяем в клинической практике отечественный иммуномодулятор — актинолизат, за изобретение которого в 1950 г. наши ученые получили Государственную премию. Этот препарат — свежеприготовленный, стабилизированный фильтрат культуральной жидкости самолизирующихся актиномицетов и является естественным для организма веществом; отсутствие токсичности проверено на 1124 больных. Актинолизат высоко эффективен и толерантен, чем и обусловлены его преимущества перед другими иммунными препаратами. Мощное иммуномодулирующее действие, стимуляция фагоцитоза, влияние на снижение интенсивности воспаления проверены in vitro, подтверждены в экспериментах на животных и в клинической практике при лечении более чем 4 тыс. пациентов с гнойными заболеваниями кожи, подкожной клетчатки и внутренних органов.
Препарат показан взрослым и детям как при самых тяжелых хронических гнойных инфекциях, например актиномикозе, так и при более легких гнойных поражениях кожи, подкожной клетчатки и слизистых оболочек, а также при микробной экземе, трофических язвах, пролежнях, гидрадените, гнойно-осложненных ранах, уретрите и вульвовагините, парапроктите и др.
Актинолизат назначают по 3 мл в/м два раза в неделю: на курс приходится 10—20—25 инъекций; последующие курсы проводят с интервалом в один месяц, по показаниям.
Антибактериальная терапия требует соблюдения целого ряда общих правил, включающих целенаправленное воздействие на возбудитель заболевания (актиномицеты и другие бактерии). Частота высева аэробной микрофлоры из очага актиномикоза составляет, по нашим данным, 85,7%. В составе микробов преобладают стафилококки (59,8%) и кишечная палочка (16,9%); при параректальной локализации имеют место ассоциации нескольких микроорганизмов. Мы выявили более высокую резистентность микрофлоры к антибиотикам при актиномикозе, чем при острых гнойно-септических заболеваниях, что объясняется длительным предшествующим применением различных химиопрепаратов у этих больных. Устойчивость к антибиотикам, в свою очередь, способствует активации вторичной микрофлоры, в том числе — неспорообразующих анаэробных микроорганизмов. За счет применения актинолизата можно существенно повысить эффективность лечения распространенных гнойных заболеваний и при этом сократить дозы антибиотиков. Это особенно важно в связи с участившимися случаями резистентности к химиопрепаратам и появлением тяжелых побочных реакций на них. При выявлении грибково-бактериальных ассоциаций назначают антифунгальные препараты: дифлюкан, орунгал, ламизил, низорал и др. Наряду с актинолизатом, антибактериальными и антигрибковыми антибиотиками, показаны витаминотерапия, симптоматические средства, физиотерапевтическое лечение ультразвуком и др.
В комплексе лечебных мер при актиномикозе значительное место занимают оперативные вмешательства. Хирургическое лечение больных актиномикозом лица и шеи в стадии абсцедирования заключается во вскрытии и дренировании очагов. В литературе встречаются описание редких хирургических вмешательств, например темпоропариентальной краниотомии и лобэктомии с удалением абсцесса у больного актиномикозом мозга. При актиномикозе легких и колонизации легочных каверн актиномицетами проводятся лобэктомия, иногда — с резекцией ребер, вскрытие и дренирование гнойных полостей, каверн и очагов распада. В случае актиномикоза подмышечных и паховых областей, развившегося на фоне хронического гнойного гидраденита, очаги поражения иссекают, по возможности единым блоком, в пределах видимо здоровых тканей. В зависимости от объекта операции, глубины и площади операционного поля хирургические вмешательства заканчивают ушиванием раны наглухо, аутодермопластикой по Тиршу, либо практикуется открытое ведение послеоперационной раны с наложением повязок с антисептическими мазями, которые очищают рану и усиливают регенерацию; применяют также пленкообразующие аэрозоли (рисунок 6).
Развитие актиномикоза на фоне воспаления эпителиально-копчиковой кисты или урахуса, как правило, сопровождается распространением процесса на ягодицы, параректальную область, а иногда — и на тазовую клетчатку. При невозможности радикального удаления очага инфекции ограничиваются частичным иссечением или кюретированием свищевых ходов; такие больные нуждаются в нескольких поэтапных операциях.
Лечение экстрасфинктерного параректального актиномикоза осуществляется лигатурным методом — толстую шелковую лигатуру после иссечения очага проводят через стенку прямой кишки выше сфинктера и параректальный разрез. Лигатуру тонически затягивают и при последующих перевязках постепенно подтягивают для прорезания сфинктера.
Трудности лечения актиномикоза поясничной, ягодичных и бедренных областей с поражением забрюшинной клетчатки обусловлены особенностями анатомического расположения очагов, глубиной длинных извилистых свищевых ходов, склонностью больных к развитию интоксикации, стойкой анемии и амилоидоза. После тщательной предоперационной подготовки прибегают к иссечению очагов актиномикоза, полному или частичному кюретированию свищевых ходов, вскрытию и дренированию глубоких очагов абсцедирования.
При развитии актиномикотического процесса в молочной железе производят секторальное иссечение очагов актиномикоза с предварительным прокрашиванием свищевых ходов.
Больных актиномикозом передней брюшной стенки оперируют после ревизии свищей и выявления их возможной связи с сальником и прилежащей кишкой (рисунок 7).
В послеоперационном периоде противовоспалительную и иммуномодулирующую терапию актинолизатом продолжают, по показаниям проводят гемотрансфузии и физиопроцедуры, ежедневно делают перевязки. В случаях заживления послеоперационной раны первичным натяжением швы снимают на седьмой-восьмой день. На раны, которые ведут открытым способом, в первые дни накладывают повязки с йодоформной эмульсией, раствором диоксидина 1%, йодопироновой мазью 1% для активации грануляций. С целью санации раны применяют антисептики широкого спектра действия. Для очищения ран от гнойно-некротического отделяемого используют водорастворимые мази: левосин, левомеколь, диоксиколь, а также ируксол, пантенол, винизоль, пленко- и пенообразующие аэрозоли. Для ускорения регенеративного процесса и эпителизации накладывают повязки с метилурациловой мазью, солкосерилом, винилином, облепиховым маслом и т. д.
Чтобы своевременно диагностировать и эффективно лечить актиномикоз, отличающийся многообразием локализаций и клинических проявлений, необходимо знать этиологию и закономерности его патогенетического развития, предрасполагающие факторы, микроскопические и культуральные характеристики возбудителей, схемы лечения актинолизатом и химиопрепаратами, методики хирургической тактики.
С. А. Бурова, доктор медицинских наук.
Национальная академия микологии. Центр глубоких микозов, ГКБ №81
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Демодекоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Демодекоз – паразитарное кожное заболевание, которое вызывает клещ-железница (Demodex). Клещ размножается в волосяных фолликулах, сальных железах кожи и мейбомиевых железах (видоизмененных сальных железах, располагающихся по краю века) и поражает в основном кожу лица и наружных ушных раковин, хотя в редких случаях может мигрировать на кожу груди и спины. Питательной средой, необходимой для размножения клеща, служит кожное сало (себум).
Носителями клеща могут быть многие люди, но заболевание проявляется остро только при нарушении микробного биоценоза кожи и снижении иммунитета.
В таких случаях клещ начинает активно размножаться, в результате чего на коже формируются асимметричные шелушащиеся розовые пятна, телеангиэктазии, розовая или красная сыпь, на месте которой затем возникают пустулы (пузырьки с гноем) или везикулы (пузырьки с прозрачной жидкостью). Кожа в этих местах воспаляется, утолщается и покрывается мокнущими корочками. При отсутствии лечения поражение кожи может усиливаться, захватывая более глубокие слои.
Причины появления демодекоза
Клещ-железница относится к условно-патогенным организмам и у 90% людей входит в состав нормального микробного биоценоза кожи лица, при этом никак себя не проявляя. Активное размножение клеща становится возможным, если биоценоз нарушается, а местный иммунитет снижается. Чаще всего изменение микробной среды происходит вследствие различных кожных заболеваний (воспалительных, бактериальных), использования иммуносупрессантов (препаратов, снижающих иммунную защиту), например, местных стероидных мазей. Распространению демодекоза способствуют нарушения в работе нервной, сосудистой и эндокринной систем, заболевания желудочно-кишечного тракта, патологии обменных процессов.
Немаловажным фактором развития заболевания служит повышенное образование кожного сала и изменение его состава. Увеличение поверхностных липидов в составе себума приводит к усиленному размножению патогенной флоры, которая, в свою очередь, инициирует активность клеща. Гиперпродукция кожного сала возникает у женщин в период гормональной перестройки, а также в результате эндокринных заболеваний и генетической предрасположенности. Существенную роль в активизации клеща играет уровень инсоляции, влияющий на усиление продукции себума.
В жаркое время года регистрируется всплеск заболеваемости демодекозом, что связано с повышенной выработкой провоспалительных веществ из-за чрезмерного воздействия ультрафиолетовых лучей.
Классификация заболевания
Демодекоз относится к группе паразитарных заболеваний кожи. Различают две клинические формы – первичный и вторичный демодекоз. При внезапном всплеске размножения клещей (более 5 особей на 1 см 2 кожи), отсутствии сопутствующих дерматитов (акне, розацеа, себореи) и успешном излечении после терапии с использованием противопаразитарных средств ставят диагноз «первичный демодекоз». Как правило, заболевание отмечают у пациентов старше 40 лет.
При наличии сопутствующих поражений кожи (акне, розацеа, перорального дерматита и т.д.), системных заболеваний (лейкоза, ВИЧ и др.) диагностируют вторичный демодекоз. Чаще всего он возникает у пациентов со значительно ослабленным иммунитетом. Иногда к вторичному демодекозу приводят терапия ингибиторами рецепторов эпидермального фактора роста, хроническая почечная недостаточность и УФ-воздействие. Заболевание может манифестировать в любом возрасте и характеризоваться значительной площадью поражения и выраженностью симптомов. Поражение век приводит к демодекозному блефароконъюнктивиту (воспалению век и их слизистой оболочки, прилежащей к глазу), который возникает как изолированно, так и параллельно с демодекозом кожи лица.
В зависимости от характера проявлений на коже различают:
- Акнеформный демодекоз. На коже присутствуют папулы и пустулы, напоминающие высыпания при угревой сыпи.
- Розацеаподобный демодекоз. Папулы появляются на фоне разлитой эритемы (покраснения кожи).
- Себорейный демодекоз. Сыпь на коже сопровождается пластинчатым шелушением.
- Офтальмологический демодекоз. Кожа век воспалена, присутствует чувство инородного тела в глазах.
На коже человека паразитируют два вида клеща Demodex folliculorum (длинный клещ) и Demodex brevis (короткий клещ).
В зависимости от вида клеща преобладают те или иные элементы поражения кожи. Развитие Demodex folliculorum чаще приводит к эритеме и слущиванию эпителия кожи. Demodex brevis вызывает формирование конусовидных папул, покрытых серыми чешуйками. Иногда отмечаются симметричные папулопустулезные элементы (пузырьки с прозрачной жидкостью или гноем), окруженные воспалительным инфильтратом.
Иногда размножение клещей приводит к присоединению вторичной гнойной инфекции, в ходе которой развиваются крупные гнойные пустулы и даже абсцессы.
При локализации клеща на коже век на краю ресниц и вокруг них образуются чешуйки и своеобразный «воротничок». Больной жалуется на зуд, усиливающийся под воздействием тепла и УФ-лучей, ощущение инородного тела в глазах, усталость глаз, чувство жжения. В углах глаз скапливается вязкое и клейкое отделяемое, особенно по утрам. Кожа становится сухой и истонченной, а пораженные демодекозом участки утолщаются и покрываются мокнущими корками.
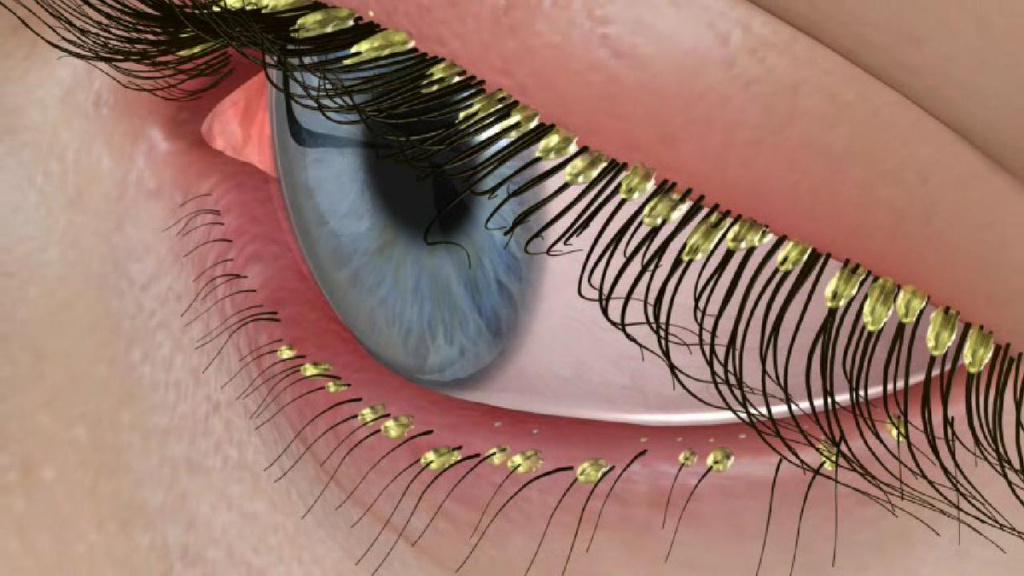
Длительное течение заболевания может привести к потере ресниц и замещению волосяных фолликулов рубцовой соединительной тканью.
Диагностика демодекоза
Выявить демодекоз можно лишь по совокупности клинических признаков и с помощью лабораторной диагностики. Кожные проявления при демодекозе могут существенно варьироваться, «маскируясь» под другие заболевания, что затрудняет постановку диагноза. Так, при акнеформном демодекозе папулы и пустулы напоминают угревую сыпь, при розацеаподобной форме папулы и пустулы появляются на фоне эритемы, при себорейной форме сыпь покрывается сероватыми корочками.
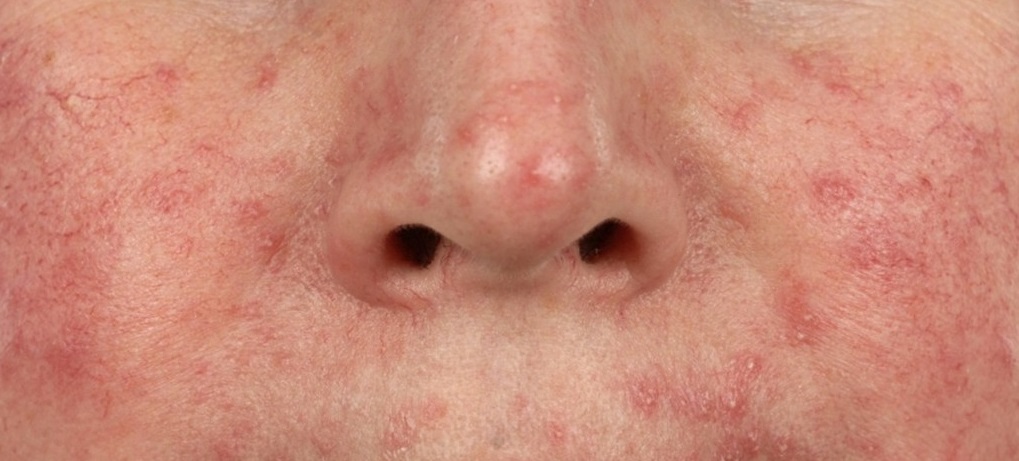
Такие разнообразные проявления демодекоза делают обязательной лабораторную диагностику для выделения клещей из очагов поражения.
Лабораторная диагностика предусматривает микроскопию секрета сальных желез и содержимого пустул.
Информацию о приеме биоматериала в медицинских офисах необходимо заранее уточнить, позвонив в справочную службу ИНВИТРО по телефону. Клещ-железница размерами 0,2-0,5 мм, рода Demodex (Demodex folliculorum, Demodex brevis), является частым эктопаразитом человека. Он вызывает демодекоз, относящи.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Онихомикоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Онихомикоз – это грибковое поражение ногтя, при котором наблюдается изменение его цвета, толщины и отделение от ногтевого ложа. Онихомикоз - часто встречающееся заболевание ногтевого аппарата (не менее 50% всех заболеваний ногтей), которым болеет около 5,5% людей во всем мире. Взрослые болеют чаще, чем дети, поскольку распространенность онихомикозов увеличивается с возрастом (поражение ногтевых пластинок грибком встречается почти у 50% лиц старше 70 лет).
Причины возникновения онихомикоза
Онихомикоз могут вызывать грибы-дерматофиты, дрожжевые грибы и плесневые грибы-недерматофиты.
Дерматофиты становятся причиной заболевания в 60-70% случаев, при этом до 50% приходится на Тrichophyton rubrum. Плесневые грибы-недерматофиты вызывают около 20% всех онихомикозов, а дрожжевые грибы, в том числе Candida spp., - 10-20%.
Достаточно часто обнаруживается ассоциированное поражение грибами и бактериями, а также одновременное инфицирование ногтевой пластинки двумя и более грибами.
Развитию онихомикоза способствуют травмы опорно-двигательного аппарата, нарушение кровоснабжения конечностей (например, вследствие сердечной недостаточности, облитерирующего эндартериита или варикозного расширения вен), сахарный диабет, ожирение, плоскостопие, деформация стоп, курение, псориаз, иммунодефициты. К другим предрасполагающим факторам относят ношение тесной обуви, повышенную потливость, травмы ногтей. Высокий риск приобрести грибок есть у тех, кто участвует в спортивных мероприятиях, посещает общественные бани и бассейны, проживает с родственниками, у которых диагностирован грибок, или у тех, кто уже болел онихомикозом ранее.
Ногти на ногах поражаются чаще, чем на руках, что, вероятно, связано с их более медленным ростом, худшим кровоснабжением и с тем, что ношение тесной обуви создает среду, благоприятную для размножения грибка.
Заражение патогенными грибками может происходить при непосредственном контакте с больным онихомикозом, а также через обувь, одежду, предметы обихода (коврики в ванной, мочалки, маникюрные принадлежности и др.). В условиях повышенной влажности (в бассейнах, банях, душевых) грибы длительное время сохраняются и размножаются, особенно на неокрашенных деревянных поверхностях.
При заражении возбудитель проникает в ногтевую пластинку, ложе, матрикс и проксимальный валик ногтя. Ноготь не обладает эффективным клеточным иммунитетом, поэтому очень восприимчив к инфекции. Грибы производят ферменты, разрушающие ногтевую пластину, что облегчает их проникновение вглубь.
Частые очаги онихомикоза - подошвы и межпальцевые промежутки. Обычно грибы поражают ногтевую пластинку, начиная со свободного края, таким образом основные патологические процессы протекают не в самой пластинке, а под ней - в ложе ногтя.
Классификация онихомикоза
Различают нормотрофический, гипертрофический и онихолитический (атрофический) онихомикоз.
При нормотрофической форме пораженный ноготь сохраняет свою толщину и блеск, но меняет цвет.
При гипертрофической форме помимо изменения цвета наблюдается нарастающий подногтевой гиперкератоз. Ноготь теряет блеск, становится тусклым, утолщается и деформируется вплоть до образования онихогрифоза (утолщения и искривления ногтя наподобие когтя мифической птицы грифона), частично разрушается, особенно с боков, нередко пациенты испытывают боль при ходьбе.
Для онихолитической формы характерна тусклая буровато-серая окраска пораженной части ногтя, ее атрофия и отторжение от ложа - обнаженный участок покрыт рыхлыми гиперкератотическими наслоениями; в то же время проксимальная часть ногтя долго остается без существенных изменений.
Кроме того, применяют классификацию, основанную на локализации поражения ногтя: выделяют дистальный онихомикоз (с поражением ногтя у свободного края), латеральный (с поражением боковых сторон), проксимальный (с поражением заднего валика) и тотальный (с поражением всего ногтя).
Симптомы онихомикоза
Основное проявление онихомикоза – изменение цвета ногтевой пластинки: она белеет или становится желто-коричневой, может приобретать фиолетовый, зеленоватый или черный цвет. К другим клиническим проявлениям относят утолщение и зуд кожи в области ногтевых валиков (подногтевой гиперкератоз), отслоение ногтя от ногтевого ложа (онихолизис) и утолщение ногтевой пластинки (онихауксис). Для грибкового поражения ногтя характерен такой признак как дерматофитома - продольная полоса желтовато-белого или коричневатого цвета, локализующаяся в глубине ногтевой пластинки.
Ногти пальцев ног поражаются в 7-10 раз чаще, чем рук, причем чаще всего поражаются большие пальцы. Как правило, грибок одновременно присутствует на нескольких ногтях, нередко у больных онихомикозом выявляется также микоз стоп.
Диагностика онихомикоза
Диагностика онихомикоза основывается на данных клинической картины и результатах лабораторных исследований.
-
Проведение микроскопического исследования пораженных ногтевых пластинок.
Исследование используется в диагностике грибковых заболеваний кожи и ногтей. Особенности инфекции. Грибковые заболевания (микозы) кожи и ногтей – заразные заболевания, передающиеся от человека к человеку. Передача инфекции может произойти при непосредственном контакте с активным о.
Читайте также:

