Почечный криз при склеродермии
Обновлено: 24.04.2024
1 ФГБНУ «Научно-исследовательский институт ревматологии имени В.А. Насоновой», г. Mocква
2 ФГБУ «Учебно-научный медицинский центр» УДП РФ, кафедра терапии, кардиологии и функциональной диагностики с курсом нефрологии и ревматологии, г. Москва
Рассматриваются варианты хронического поражения почек (ПП) при системной склеродермии (ССД). Среди проявлений, свидетельствующих о субклиническом ПП при этом заболевании, следует отметить: 1) изолированное снижение скорости клубочковой фильтрации; 2) увеличение индекса резистивности почечных сосудов; 3) снижение почечного функционального резерва. 15-летняя выживаемость больных ССД без ПП составляет 72%, при наличии ПП – не более 13%. Подробно обсуждается значение феномена сосудисто-эндотелиальной дисфункции в патогенезе ПП при ССД. Подчеркивается, что развитию ПП при ССД могут способствовать разнообразные лекарственные средства, применяемые при этом заболевании, в первую очередь D-пеницилламин.
Системный склероз, или системная склеродермия (ССД), – аутоиммунное заболевание соединительной ткани, основные клинические признаки которого обусловлены распространенными нарушениями микроциркуляции, фиброзом кожи и внутренних органов [1].
Почки часто вовлекаются в патологический процесс при ревматических заболеваниях. В большинстве случаев их поражение протекает бессимптомно, и для его выявления требуется применение дополнительных инструментальных и лабораторных методов диагностики [2]. Наиболее грозное и хорошо известное поражение почек (ПП) при CCД – склеродермический почечный криз (СПК). До конца 1970-х гг. СПК выступал ведущей причиной смерти больных ССД [3]. Более 40 лет назад, с открытием ингибиторов ангиотензинпревращающего фермента (иАПФ), СПК стал курабельным состоянием. Прогресс в лечении СПК, связанный с началом применения иАПФ, привел к значительному снижению интереса клиницистов к проблеме ПП у больных ССД. Следует отметить, что ПП, не связанные с развитием СПК, также описаны у пациентов с ССД. В целом, по данным морфологических исследований, у 80% больных ССД выявляются изменения почек, в том числе не связанные с ревматическими заболеваниями [4]. При этом 15-летняя выживаемость пациентов с ССД без ПП составляет 72%, а при их наличии – не более 13%.
В данной статье представлены основные варианты хронических ПП при ССД. Среди проявлений, свидетельствующих о субклиническом ПП при этом заболевании, следует отметить: 1) изолированное снижение скорости клубочковой фильтрации (СКФ); 2) увеличение индекса резистивности (ИР) почечных сосудов; 3) снижение почечного функционального резерва (ПФР).
По данным многочисленных наблюдений, существенное снижение СКФ у пациентов с ССД встречается уже при субклиническом ПП, обнаруживаясь, по результатам ряда исследований, почти у половины больных ССД с нормальным уровнем креатинина крови [5]. В клинической практике клиренсные методики определения СКФ давно уступили место расчетным методам. Как в общей популяции, так и у больных ССД величина СКФ, рассчитанная по формуле CKD-EPI, оказалась наиболее близка к результатам ее измерения с использованием одной из референтных методик (клиренс ЭДТА, с меченым технецием-99m) [6]. Выявление снижения СКФ важно не только для определения почечного прогноза, но и для расчета доз лекарственных препаратов, в том числе антибиотиков, иммуносупрессантов, при использовании рентгенконтрастных веществ и определения прогноза ССД в целом. A. Campo и соавт. в своем исследовании продемонстрировали, что снижение расчетной СКФ
Метод цветной доплеросонографии позволяет диагностировать ренальную патологию у больных ССД до развития клинических симптомов ПП. C. Nishijima и соавт. [8] измеряли ИР с помощью цветной доплеросонографии в междольковых и сегментарных артериях у 53 больных ССД, 12 – с системной красной волчанкой, 3 – с дерматомиозитом и у 16 здоровых пациентов с нормальной функцией почек по результатам определения расчетной СКФ и анализов мочи. У пациентов с ССД ИР в почечных артериях оказался достоверно выше, чем в группах сравнения. При этом с повышением ИР коррелировали следующие симптомы: дигитальные язвы, снижение апертуры открытия рта, контрактуры пальцев кистей, легочный фиброз, вовлечение сердца, наличие и титр антител к топоизомеразе I (Scl-70), повышение уровня С-реактивного белка, снижение показателей жизненной емкости легких. Не коррелировали с этим параметром артериальное давление, уровень креатинина, протеинурия, уровень ренина, СКФ, поражения желудочно-кишечного тракта и других органов. Исследователи сделали вывод, что латентные и субклинические ПП могут быть предикторами развития СПК. По другим данным, ИР коррелирует с наличием склеродермического паттерна изменений при капилляроскопии и СКФ [9].
Гипертонический криз — внезапное повышение систолического и/или диастолического АД, сопровождающееся признаками ухудшения мозгового, коронарного или почечного кровообращения, а также выраженной вегетативной симптоматикой. Гипертонический криз, как правило, развивается у нелеченых больных, при резком прекращении приёма антигипертензивных средств, а также может быть первым проявлением гипертонической болезни или симптоматической артериальной гипертензии у больных, не получающих адекватного лечения. Статистические данные. 1% больных с артериальной гипертензией.
Клинические проявления • Клинически гипертонический криз проявляется повышением АД, может сопровождаться возникновением: •• острой гипертонической энцефалопатии •• субарахноидального кровоизлияния •• инсульта •• ИМ •• острой левожелудочковой недостаточности в виде отёка лёгких •• расслоения аорты •• ОПН • При гипертоническом кризе больных могут беспокоить сильная головная боль, выраженное головокружение, нарушения зрения в виде снижения остроты и выпадения полей зрения, загрудинные боли (в связи с ишемией миокарда, аорталгией), сердцебиение, одышка • При обследовании больного следует выявлять признаки поражения органов-мишеней: •• изменения глазного дна (сужение артериол, кровоизлияния, экссудаты, отёк соска зрительного нерва) •• нарушения функции левого желудочка (тахикардия, «ритм галопа», отёк лёгких, расширение вен шеи) •• нарушения мозгового кровообращения (неврологические признаки).
Дополнительное обследование. В клинических условиях, кроме измерения АД, необходимо провести рентгенографию грудной клетки, ЭКГ, исследование глазного дна, анализы крови и мочи. При возможности рекомендуется мониторирование АД (лучше внутриартериальное).
ЛЕЧЕНИЕ
Общая тактика • Интенсивная терапия • Постельный режим • Благоприятная психологическая обстановка • Диеты №10, 10а • Интенсивная терапия с внутривенным введением антигипертензивных препаратов на фоне постоянного контроля АД (оптимально — с использованием артериального катетера) • После нормализации АД — подбор антигипертензивных препаратов для систематического приёма • С клинической точки зрения целесообразно выделить неотложные состояния, когда необходимо снизить высокое АД в течение 1 ч, и состояния, когда можно снизить повышенное АД в течение нескольких часов (снижение в течение 1 ч среднего АД примерно на 20–25% от исходного или диастолического АД до 100–110 мм рт.ст.) • Состояния, при которых необходимо снизить АД в течение 1 ч •• Расслоение аорты (расслаивающая аневризма аорты) •• Острая сердечная недостаточность •• ИМ •• Нестабильная стенокардия •• Тяжёлое носовое кровотечение •• Энцефалопатия •• Внутричерепное кровоизлияние •• Субарахноидальное кровоизлияние •• Травма черепа •• Эклампсия •• Катехоламиновый криз при феохромоцитоме •• Послеоперационные кровотечения из области сосудистых швов • Состояния, при которых АД можно снижать в течение нескольких часов (12–24 ч) •• Систолическое АД 240 мм рт.ст. и/или диастолическое АД 130 мм рт.ст. и более без осложнений •• Злокачественная артериальная гипертензия без осложнений •• Артериальная гипертензия в пред- и послеоперационный период •• Выраженный синдром отмены антигипертензивных средств •• Тяжёлые ожоги •• Почечный криз при склеродермии
Лекарственная терапия • ЛС для купирования гипертонического криза •• Нитропруссид натрия 0,25–10 мкг/кг/мин в/в капельно, начало действия — немедленно, продолжительность действия — 1–2 мин •• Нитроглицерин 5–100 мкг/мин в/в капельно, начало действия — 2–5 мин, продолжительность действия — 3–5 мин •• Эналаприл 1,25–5 мг в/в, начало действия — 15–30 мин, продолжительность действия — 6 ч •• Эсмолол 250–500 мкг/кг/мин за 1 мин, затем 50–100 мкг/кг/мин за 4 мин, начало действия — 1–2 мин, продолжительность действия — 10–20 мин •• Фентоламин 5–15 мг в/в болюсно, начало действия — 1–2 мин, продолжительность действия — 3–10 мин •• Бендазол 50–70 мг в/в болюсно, начало действия — 10–15 мин, продолжительность действия — 1 ч и более •• Клонидин 0,075–0,150 мг в/в медленно, начало действия — 10–20 мин, продолжительность действия — 4–8 ч •• Каптоприл 6,25–50 мг внутрь, начало действия — 15 мин, продолжительность действия — 6–8 ч •• Фуросемид 20–120 мг в/в болюсно, начало действия — 5 мин, продолжительность действия — 2 ч • Рекомендации по лечению состояний, требующих снижения АД в течение 1 ч •• Гипертоническая энцефалопатия: нитропруссид натрия •• Субарахноидальное кровоизлияние: нимодипин, нитропруссид натрия •• Ишемический инсульт: нитропруссид натрия •• ИМ: нитроглицерин, нитропруссид натрия •• Острая левожелудочковая недостаточность: нитропруссид натрия, нитроглицерин •• Расслоение аорты: b -адреноблокаторы, нитропруссид натрия •• ОПН: нитропруссид натрия •• Эклампсия: магния сульфат, гидралазин, блокаторы медленных кальциевых каналов •• Гиперадренергические состояния (феохромоцитома, отмена клонидина, употребление кокаина, амфетаминов): фентоламин, нитропруссид натрия, клонидин (при синдроме отмены клонидина) •• Гипертонический криз в послеоперационном периоде: нитроглицерин, нитропруссид натрия
Особенности снижения АД при различных состояниях • При нарушениях мозгового кровообращения среднее АД должно быть снижено не более чем на 20–25% от исходного уровня или диастолическое АД не должно быть ниже 105–110 мм рт.ст. Данный уровень АД рекомендуют сохранять в течение нескольких дней с момента его повышения • У пожилых людей даже небольшие дозы антигипертензивных средств при приёме внутрь могут значительно снизить АД и привести к артериальной гипотензии.
Течение и прогноз. При адекватной терапии прогноз благоприятный. В тяжёлых случаях криз осложняется комой, отёком лёгких, инсультом, тромбозом и эмболией различных артерий, ОПН. Резкое снижение АД может привести к острому нарушению мозгового и коронарного кровообращения.
Код вставки на сайт
Гипертонический криз — внезапное повышение систолического и/или диастолического АД, сопровождающееся признаками ухудшения мозгового, коронарного или почечного кровообращения, а также выраженной вегетативной симптоматикой. Гипертонический криз, как правило, развивается у нелеченых больных, при резком прекращении приёма антигипертензивных средств, а также может быть первым проявлением гипертонической болезни или симптоматической артериальной гипертензии у больных, не получающих адекватного лечения. Статистические данные. 1% больных с артериальной гипертензией.
Клинические проявления • Клинически гипертонический криз проявляется повышением АД, может сопровождаться возникновением: •• острой гипертонической энцефалопатии •• субарахноидального кровоизлияния •• инсульта •• ИМ •• острой левожелудочковой недостаточности в виде отёка лёгких •• расслоения аорты •• ОПН • При гипертоническом кризе больных могут беспокоить сильная головная боль, выраженное головокружение, нарушения зрения в виде снижения остроты и выпадения полей зрения, загрудинные боли (в связи с ишемией миокарда, аорталгией), сердцебиение, одышка • При обследовании больного следует выявлять признаки поражения органов-мишеней: •• изменения глазного дна (сужение артериол, кровоизлияния, экссудаты, отёк соска зрительного нерва) •• нарушения функции левого желудочка (тахикардия, «ритм галопа», отёк лёгких, расширение вен шеи) •• нарушения мозгового кровообращения (неврологические признаки).
Дополнительное обследование. В клинических условиях, кроме измерения АД, необходимо провести рентгенографию грудной клетки, ЭКГ, исследование глазного дна, анализы крови и мочи. При возможности рекомендуется мониторирование АД (лучше внутриартериальное).
ЛЕЧЕНИЕ
Общая тактика • Интенсивная терапия • Постельный режим • Благоприятная психологическая обстановка • Диеты №10, 10а • Интенсивная терапия с внутривенным введением антигипертензивных препаратов на фоне постоянного контроля АД (оптимально — с использованием артериального катетера) • После нормализации АД — подбор антигипертензивных препаратов для систематического приёма • С клинической точки зрения целесообразно выделить неотложные состояния, когда необходимо снизить высокое АД в течение 1 ч, и состояния, когда можно снизить повышенное АД в течение нескольких часов (снижение в течение 1 ч среднего АД примерно на 20–25% от исходного или диастолического АД до 100–110 мм рт.ст.) • Состояния, при которых необходимо снизить АД в течение 1 ч •• Расслоение аорты (расслаивающая аневризма аорты) •• Острая сердечная недостаточность •• ИМ •• Нестабильная стенокардия •• Тяжёлое носовое кровотечение •• Энцефалопатия •• Внутричерепное кровоизлияние •• Субарахноидальное кровоизлияние •• Травма черепа •• Эклампсия •• Катехоламиновый криз при феохромоцитоме •• Послеоперационные кровотечения из области сосудистых швов • Состояния, при которых АД можно снижать в течение нескольких часов (12–24 ч) •• Систолическое АД 240 мм рт.ст. и/или диастолическое АД 130 мм рт.ст. и более без осложнений •• Злокачественная артериальная гипертензия без осложнений •• Артериальная гипертензия в пред- и послеоперационный период •• Выраженный синдром отмены антигипертензивных средств •• Тяжёлые ожоги •• Почечный криз при склеродермии
Лекарственная терапия • ЛС для купирования гипертонического криза •• Нитропруссид натрия 0,25–10 мкг/кг/мин в/в капельно, начало действия — немедленно, продолжительность действия — 1–2 мин •• Нитроглицерин 5–100 мкг/мин в/в капельно, начало действия — 2–5 мин, продолжительность действия — 3–5 мин •• Эналаприл 1,25–5 мг в/в, начало действия — 15–30 мин, продолжительность действия — 6 ч •• Эсмолол 250–500 мкг/кг/мин за 1 мин, затем 50–100 мкг/кг/мин за 4 мин, начало действия — 1–2 мин, продолжительность действия — 10–20 мин •• Фентоламин 5–15 мг в/в болюсно, начало действия — 1–2 мин, продолжительность действия — 3–10 мин •• Бендазол 50–70 мг в/в болюсно, начало действия — 10–15 мин, продолжительность действия — 1 ч и более •• Клонидин 0,075–0,150 мг в/в медленно, начало действия — 10–20 мин, продолжительность действия — 4–8 ч •• Каптоприл 6,25–50 мг внутрь, начало действия — 15 мин, продолжительность действия — 6–8 ч •• Фуросемид 20–120 мг в/в болюсно, начало действия — 5 мин, продолжительность действия — 2 ч • Рекомендации по лечению состояний, требующих снижения АД в течение 1 ч •• Гипертоническая энцефалопатия: нитропруссид натрия •• Субарахноидальное кровоизлияние: нимодипин, нитропруссид натрия •• Ишемический инсульт: нитропруссид натрия •• ИМ: нитроглицерин, нитропруссид натрия •• Острая левожелудочковая недостаточность: нитропруссид натрия, нитроглицерин •• Расслоение аорты: b -адреноблокаторы, нитропруссид натрия •• ОПН: нитропруссид натрия •• Эклампсия: магния сульфат, гидралазин, блокаторы медленных кальциевых каналов •• Гиперадренергические состояния (феохромоцитома, отмена клонидина, употребление кокаина, амфетаминов): фентоламин, нитропруссид натрия, клонидин (при синдроме отмены клонидина) •• Гипертонический криз в послеоперационном периоде: нитроглицерин, нитропруссид натрия
Особенности снижения АД при различных состояниях • При нарушениях мозгового кровообращения среднее АД должно быть снижено не более чем на 20–25% от исходного уровня или диастолическое АД не должно быть ниже 105–110 мм рт.ст. Данный уровень АД рекомендуют сохранять в течение нескольких дней с момента его повышения • У пожилых людей даже небольшие дозы антигипертензивных средств при приёме внутрь могут значительно снизить АД и привести к артериальной гипотензии.
Течение и прогноз. При адекватной терапии прогноз благоприятный. В тяжёлых случаях криз осложняется комой, отёком лёгких, инсультом, тромбозом и эмболией различных артерий, ОПН. Резкое снижение АД может привести к острому нарушению мозгового и коронарного кровообращения.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Симптомы поражения почек при склеродермии
Поражение почек при системной склеродермии наиболее часто развивается у больных с диффузной кожной формой болезни, при остром прогрессирующем её течении, в сроки от 2 до 5 лет от начала, хотя возможно развитие нефропатии и при хроническом медленно прогрессирующем течении склеродермии. Основные клинические признаки склеродермической нефропатии - протеинурия, артериальная гипертензия и нарушение функции почек.
- Протеинурия характерна для большинства пациентов системной склеродермией с поражением почек. Как правило, она не превышает 1 г/сут, не сопровождается изменениями мочевого осадка и у 50% больных сочетается с артериальной гипертензией и/или нарушением функции почек. Нефротический синдром развивается крайне редко.
- Артериальная гипертеизия отмечается у 25-50% больных со склеродермической нефропатией. Для большинства пациентов характерна умеренная артериальная гипертензия, которая может персистировать годами, не приводя к нарушению функции почек. Эта форма артериальной гипертензии отмечается при медленно прогрессирующей форме системной склеродермии и характеризуется поздним развитием. У 30% гипертензивных больных развивается злокачественная артериальная гипертензия, для которой характерно внезапное и резкое повышение артериального давления более 160/100 мм рт.ст., сочетающееся с прогрессирующим ухудшением функции почек вплоть до развития олигурической острой почечной недостаточности, с ретинопатией, поражением ЦНС и сердечной недостаточностью. Эта форма артериальной гипертензии имеет неблагоприятное прогностическое значение.
- Хроническая почечная недостаточность у больных системной склеродермией, как и артериальная гипертензия, ассоциирована с неблагоприятным прогнозом. В большинстве случаев склеродермической нефропатии хроническая поченая недостаточность сочетается с артериальной гипертензией, однако возможно её развитие и при нормальных цифрах артериального давления. В этом случае отмечено частое сочетание нарушения функции почек с микроангиопатической гемолитической анемией и тромбоцитопенией, которыми хроническая почечная недостаточнсть может манифестировать.
Течение и симптомы склеродермии
Симптомы склеродермии отличаются значительным полиморфизмом и включает следующие проявления:
- поражение кожи, проявляющееся плотным отёком, индурацией, атрофией, очагами де- и гиперпигментации;
- поражение сосудов с развитием генерализованного синдрома Рейно более чем у 90% больных, сосудисто-трофических нарушений (дигитальные язвы, некрозы), телеангиэктазий;
- поражение опорно-двигательного аппарата в виде полиартралгий, артритов, миозита, атрофии мышц, остеолиза, кальциноза мягких тканей, чаще периартикулярного;
- поражение органов дыхания с развитием у большинства больных фиброзирующего альвеолита и диффузного пневмофиброза. при длительном хроническом течении заболевания развивается лёгочная гипертензия;
- поражение ЖКТ с преимущественным вовлечением пищевода (дисфагия, расширение, сужение в нижней трети, рефлюкс-эзофагит, стриктуры и язвы пищевода), реже - кишечника (дуоденит, синдром нарушенного всасывания, запор, в ряде случаев - кишечная непроходимость);
- поражение сердца, наиболее часто представленное развитием интерстициального миокардита, кардиосклероза, ишемии миокарда, что клинически проявляется нарушением ритма и проводимости, нарастающей сердечной недостаточностью. Реже отмечают поражение эндокарда с формированием клапанных пороков, преимущественно митрального, перикардит;
- поражение нервной и эндокринной систем в виде полинейропатии, гипофункции щитовидной железы, нарушения функции половых желёз.
Общие симптомы склеродермии могут быть представлены лихорадкой, потерей массы тела, слабостью, которые отмечаются при высокой активности болезни.
Классификация системной склеродермии
Существует несколько субтипов (клинических форм) системной склеродермии. В зависимости от распространённости и выраженности кожных изменений выделяют две основные формы - диффузную и лимитированную.
При лимитированной системной склеродермии, отмечаемой более чем у 60% больных, процесс ограничен кожей кистей, шеи и лица, органные нарушения присоединяются поздно - через 10-30 лет от начала болезни.
Диффузная системная склеродермия характеризуется генерализованным поражением кожи туловища и конечностей с ранним - в течение 5 лет - развитием висцеральных поражений. Лимитированная форма имеет более доброкачественное течение и благоприятный прогноз по сравнению с диффузной. По характеру течения выделяют острую, подострую и хроническую системную склеродермию.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12]
Поражение почек
Первое описание поражения почек при системной склеродермии было сделано в 1863 г. Н. Auspitz, который сообщил о развитии острой почечной недостаточности у больного склеродермией, посчитав это случайностью. Восемьдесят лет спустя J.H. Talbot и соавторы впервые описали гиперплазию интимы и фибриноидный некроз междольковых артерий при системной склеродермии. Однако только в начале 50-х годов XX века, после описания Н.С. Moore и H.L. Shechan морфологических изменений в почках трёх больных системной склеродермией, умерших от уремии, была признана возможность развития тяжёлой нефропатии при склеродермии.
Точную частоту нефропатии при системной склеродермии определить трудно, поскольку умеренно выраженное поражение почек в большинстве случаев не проявляется клинически. Частота почечного поражения зависит от использованных для его выявления методов: клинические симптомы нефропатии отмечаются у 19-45% больных системной склеродермией. Применение функциональных методов исследования позволяет обнаружить снижение почечного кровотока или скорости клубочковой фильтрации (СКФ) у 50-65% пациентов, а морфологические признаки сосудистого почечного поражения выявляются у 60-80% больных.
Поражение почек, наряду с другими висцеритами, может развиться у больных с лимитированной формой системной склеродермии, однако преимущественно возникает при диффузной кожной форме болезни. При этом тяжёлую форму нефропатии в виде нарастающей артериальной гипертензии и острой почечной недостаточности («истинная склеродермическая почка») отмечают не более чем у 10-15% больных.
Очаговая склеродермия – это хроническое заболевание соединительной ткани, характеризующееся преимущественным поражением кожных покровов. Клинически проявляется уплотнением (индурацией) различных участков кожи с последующей атрофией и изменением пигментации, образованием контрактур. Диагноз ставится на основании симптоматики, обнаружения в крови антинуклеарного фактора и антицентромерных антител. В сомнительных случаях проводится гистологическое исследование кожи. Лечение заключается в применении глюкокортикостероидов, иммунодепрессантов, антифиброзных средств, блокаторов кальциевых каналов и проведении ПУВА-терапии. В ряде случаев выполняются хирургические операции.
МКБ-10
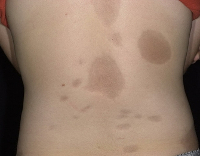
Общие сведения
Очаговая (локализованная, ограниченная) склеродермия – хроническое аутоиммунное заболевание из группы диффузных болезней соединительной ткани. Патология встречается повсеместно, распространенность составляет от 0,3 до 3 случаев на 100 000 человек. Чаще страдают женщины европеоидной расы. Возраст манифестации очаговой склеродермии зависит от формы. Бляшечная склеродермия чаще встречается у взрослых (30-40 лет), линейная - у детей от 2 до 14 лет, склероатрофический лихен – у женщин старше 50 лет. При локализованной форме, в отличие от системной, поражение внутренних органов в большинстве случаев либо минимально, либо отсутствует. Имеется ассоциация склеродермии с патологиями щитовидной железы (тиреоидитом Хашимото, болезнью де Кервена).

Причины
Точная причина заболевания неизвестна. Предполагается этиологическая роль бактерии Borrelia burgdorferi, вызывающей лайм-боррелиоз, однако убедительных данных за эту теорию на сегодняшний день нет. В развитии склеродермии важную роль играет наследственная предрасположенность. Были выявлены более частые случаи очаговой склеродермии среди близких родственников. При проведении генетических исследований обнаружена взаимосвязь между определенными генами гистосовместимости (HLA – DR1, DR4) и локализованной формой заболевания. Провоцирующими факторами, способствующими возникновению склеродермии, являются переохлаждения, травмы, постоянные вибрационные воздействия на кожу, прием лекарственных препаратов (блеомицина). Триггерными эффектами также обладают различные химические соединения (хлорвинил, кремний, нефтепродукты, сицилий, эпоксидная смола, пестициды, органические растворители).
Патогенез
Выделяют три основных патогенетических механизма склеродермии – фиброз (разрастание соединительной ткани), аутоиммунное повреждение и сосудистые нарушения. Иммунная аутоагрессия заключается в выработке лимфоцитами антител к соединительной ткани и ее компонентам. Также лимфоциты синтезируют интерлейкины, которые стимулируют пролиферацию фибробластов, гладкомышечных клеток и образование коллагена. Разрастающаяся при этом соединительная ткань замещает нормально функционирующую ткань. В результате повреждения эндотелия сосудов антителами и пролиферирующими гладкомышечными клетками снижается уровень простациклина (вещества, обладающего антиагрегантными и вазодилатирующими свойствами). Это приводит к спазму микрососудов, повышению адгезии и агрегации форменных элементов крови, внутрисосудистой коагуляции и микротромбозу.
Классификация
Очаговая склеродермия подразделяется на множество форм. Наиболее распространенными являются бляшечная и линейная. У ряда пациентов могут наблюдаться одновременно несколько вариантов заболевания. Существует целый ряд классификаций, но наиболее оптимальной и широко используемой считается классификация клиники Мэйо, включающей следующие разновидности очаговой склеродермии:
- Бляшечная. Данная форма в свою очередь подразделяется на поверхностную (морфеа) и узловатую (келоидоподобную). Характерны типичные участки уплотнения кожи с атрофией и нарушением пигментации.
- Линейная. К ней относятся полосовидная, саблевидная формы, а также прогрессирующая гемиатрофия лица Парри-Ромберга. Очаги располагаются в виде линий по ходу сосудисто-нервного пучка.
- Генерализованная (многоочаговая). Проявляется сочетанием бляшечного и линейного вариантов. Очаги распространены по всему телу.
- Буллезная. При данной разновидности на коже возникают пузыри с жидкостным содержимым, оставляющие после себя эрозии.
- Пансклеротическая инвалидизирующая. Наиболее неблагоприятная форма очаговой склеродермии. Характеризуется тяжелым, прогрессирующим течением, плохо поддается лечению. Поражаются все слои кожи и ткани, лежащие под ней. Развиваются грубые контрактуры суставов и длительно незаживающие язвы на коже.
- Склероатрофический лихен Цумбуша (болезнь белых пятен). Характерно образование пятен белого цвета, сопровождающихся нестерпимым зудом. Преимущественная локализация пятен – половые органы.
Симптомы
Для клинической картины типично образование на коже очагов, которые проходят три последовательных стадий развития – отек, индурацию (уплотнение) и атрофию. В начале заболевания на коже конечностей, шеи или туловища появляются пятна сиреневого или лилового цвета, имеющие нечеткие края. Размер пятен может сильно варьировать – от просяного зерна до размеров ладони и больше. На этом этапе пациент не испытывает каких-либо неприятных ощущений или боли. Затем пятна начинают отекать, кожа в центре очага уплотняется, становится блестящей, приобретает цвет слоновой кости. Пациент начинает ощущать зуд, покалывания, стянутость кожи, болезненность. Далее наступает стадия атрофии. Кожа в очагах истончается, прекращается рост волос, нарушается потоотделение, возникает стойкая дисхромия (гипер- или депигментация) и телеангиэктазии. Иногда развивается атрофодермия (участки западения кожи).
При линейной склеродермии очаги расположены по ходу нервов и сосудов. В случае локализации на коже лица очаги по внешнему виду напоминают рубец от удара саблей (саблевидная форма). Прогрессирующая гемиатрофия представляет собой глубокий процесс с поражением всех тканей половины лица - кожи, подкожной клетчатки, мышц и костей лицевого скелета, что приводит к выраженной деформации лица, обезображивающей внешний вид пациента. Также происходит атрофия половины языка и снижение вкусовой чувствительности.
Из внекожных признаков очаговой склеродермии стоит отметить офтальмологические и неврологические проявления при гемиатрофии Парри-Ромберга. Они включают выпадение ресниц и бровей на стороне поражения, западение глазного яблока из-за атрофии глазных мышц и орбитальной клетчатки, нейропаралитический кератит, головокружения, когнитивные нарушения, мигренозные головные боли, эпилептические припадки. Также возможно развитие феномена Рейно. Симптомы синдрома Рейно следующие – стадийное изменение окраски кожи пальцев рук вследствие вазоспазма и последующей гиперемии (бледность, цианоз, покраснение), сопровождающееся онемением, болью и покалыванием в пальцах рук. Остальные экстрадермальные проявления, характерные для системной склеродермии, встречаются крайне редко.
Осложнения
Наиболее распространенная проблема рассматриваемого заболевания – косметические дефекты. Серьезные осложнения, представляющие угрозу для жизни больного, возникают редко. К ним относятся нарушение мозгового кровообращения при гемиатрофии лица, ишемия и гангрена пальцев рук при феномене Рейно, выраженные контрактуры суставов, инвалидизирующие пациента. Через несколько лет после дебюта болезни могут развиться тяжелые поражения внутренних органов – фиброз легких, легочная гипертензия, фиброз миокарда, перикардит, стриктуры пищевода, острая нефропатия, почечная недостаточность.
Диагностика
Пациентов с очаговой склеродермией курируют врачи ревматологи и дерматологи. При постановке диагноза учитывается клиническая картина, семейный анамнез. Все методы диагностики направлены в первую очередь на определение степени вовлечения внутренних органов и исключение системной склеродермии. С этой целью применяются следующие исследования:
- Лабораторные. В анализах крови выявляются эозинофилия, повышение уровня ревматоидного фактора, гаммаглобулинов, высокие титры антицентромерных антител и антинуклеарного фактора (АНФ). Наличие антител к топоизомеразе (анти-Scl 70) свидетельствует в пользу системного процесса. При развитии «склеродермической почки» в моче появляются белок и эритроциты.
- Инструментальные. При капилляроскопии наблюдается дилатация капилляров без участков некроза. По данным ФЭГДС могут встречаться признаки эзофагита, стриктуры пищевода. При фиброзе миокарда на ЭКГ иногда обнаруживаются нарушения ритма сердца, на ЭхоКГ – зоны гипокинеза, выпот в перикардиальную полость. На рентгенографии или компьютерной томографии легких отмечаются интерстициальные изменения.
- Гистологическое исследование биоптата кожи. Заключительный этап, позволяющий достоверно поставить диагноз. Проводится при сомнительных результатах предыдущих исследований. Характерны следующие признаки - инфильтрация лимфоцитами, плазмоцитами и эозинофилами в ретикулярном слое дермы, утолщенные коллагеновые пучки, набухание и склероз сосудистой стенки, атрофия эпидермиса, сальных и потовых желез.
Очаговую склеродермию дифференцируют с другими формами склеродермии (системной, склеродермой Бушке), дерматологическим заболеваниями (саркоидозом кожи, липонекробиозом, склеродермоподобной формы поздней кожной порфирии, базально-клеточным раком), поражением мягких тканей (панникулитом, липодерматосклерозом, эозинофильным фасциитом). В дифференциальной диагностике принимают участие онкологи, гематологи.
Лечение
Этиотропной терапии не существует. Метод лечения и вид лекарственного средства необходимо подбирать с учетом формы заболевания, тяжести течения и локализации очагов. При линейной и бляшечной формах используются топические глюкокортикостероиды высокой и сверхвысокой активности (бетаметазон, триамцинолон), синтетические аналоги витамина Д. При выраженной индурации кожи эффективны аппликации с диметилсульфоксидом. В случае поражений внутренних органов с целью уменьшения фиброзообразования назначаются пеницилламин и инъекции гиалуронидазы.
При неглубоких процессах хорошим терапевтическим действием обладает ПУВА-терапия, которая включает облучение кожи ультрафиолетовыми волнами длинного спектра с одновременным пероральным или наружным применением фотосенсибилизаторов. Тяжелое поражение кожи служит показанием к применению иммунодепрессантов (метотрексата, такролимуса, микофенолата), синдром Рейно - блокаторов кальциевых каналов (нифедипина) и препаратов, улучшающих микроциркуляцию (пентоксифиллина, ксантинола никотината). При склероатрофическом лихене проводится низкоинтенсивная лазеротерапия. В случае развития контрактур суставов, значительно затрудняющих движения, или грубых деформаций скелета и косметических дефектов лица требуется хирургическая операция.
Профилактика и прогноз
В подавляющем большинстве случаев очаговая склеродермия имеет доброкачественное течение. Правильно подобранная терапия позволяет добиться регресса симптомов. Иногда наступают спонтанные ремиссии заболевания. Неблагоприятные исходы возникают при тяжелых формах (прогрессирующей гемиатрофии лица, пансклеротической инвалидизирующей склеродермии), а также поражении внутренних органов. Эффективных методов профилактики не разработано. Рекомендуется избегать или максимально ограничить контакт кожи с химическими соединениями (кремнием, сицилием, хлорвинилом, нефтепродуктами, органическими растворителями, пестицидами, эпоксидной смолой).
2. Ревматические заболевания/ Под ред. Дж.Х. Клиппела, Дж.Х. Стоуна, Л.Дж. Кроффорд, П.Х. Уайт – 2012.
3. Диффузные болезни соединительной ткани: руководство для врачей/ под ред. проф. Мазурова В.И. –2009.
Обсуждаются клинические, патогенетические и прогностические особенности острой склеродермической нефропатии, а также подходы к ее лечению.
Острая склеродермическая нефропатия (ОСН; склеродермический почечный криз) – острая или быстропрогрессирующая почечная недостаточность, обусловленная тяжелым генерализованным окклюзирующим поражением внутрипочечных сосудов, патогенетически связанным с системной склеродермией. Будучи на первый взгляд “редким” осложнением нечасто встречающегося системного заболевания, ОСН сегодня – одно из наиболее труднокупируемых и угрожающих жизни проявлений системной склеродермии. Интерес к изучению клинико-патогенетических особенностей склеродермического почечного криза сохраняется еще и потому, что он представляет собой уникальную модель быстропрогрессирующего органного фиброза, ассоциированного с выраженными гемодинамическими нарушениями, которая может быть использована для оценки эффективности принципиально новых терапевтических стратегий и отработки режимов их использования.
Как правило, склеродермический почечный криз возникает в течение первых 5 лет с момента дебюта болезни у пациентов с распространенным кожным поражением, вовлечением других внутренних органов (пищевод, сердце, легкие) [1, 2]. Тем не менее ОСН может стать и первым проявлением системной склеродемии [3], развивающимся задолго до других ее характерных клинических признаков [4]. Cклеродермический почечный криз всегда отражает тяжесть течения системной склеродермии и является одним из наиболее достоверных маркеров неблагоприятного прогноза.
Источником данных о частоте склеродермического почечного криза служат преимущественно составляемые в специализированных клинических центрах регистры, суммирующие опыт обследования, лечения и длительного наблюдения за больными системной склеродермией. Можно предположить, что ОСН является самой частой формой поражения почек при системной склеродермии, требующей специализированной медицинской помощи, в то время как другие варианты, например хроническая склеродермическая нефропатия, часто остаются малосимптомными, не приобретая, таким образом, ведущего клинического и прогностического значения и в связи с этим их своевременно не распознают. S. Guerini и соавт. (2007) [1] обнаружили признаки почечного поражения у 19 из 193 обследованных пациентов, страдавших системной склеродермией. У 11 из 19 больных был констатирован склеродермический почечный криз, у 5 – хроническая склеродермическая нефропатия, у 2 – нефротический синдром, индуцированный D-пеницилламином, у 1 – ANCA-ассоциированный гломерулонефрит. В целом признаки ОСН обнаруживают не более чем у 10 % больных системной склеродермией, но в группе высокого риска, характеризующейся высокой активностью заболевания и быстрым вовлечением органов-мишеней, а также получающей некоторые лекарственные препараты, частота склеродермического почечного криза может достигать 20 % [5]. ОСН как первое проявление системной склеродермии встречается крайне редко и служит предметом описания в виде отдельных клинических наблюдений [3, 4, 6].
Роли генетических детерминант, возможно, предрасполагающих к развитию системной склеродермии, например HLADQB1, HLA-DR5, HLA-DR2 [7], в развитии склеродермического почечного криза установить не удалось. В то же время известно, что склеродермический почечный криз развивается у 25 % пациентов, имеющих антитела к РНК-полимеразе III, а также у пациентов с антителами к топоизомеразе. При этом он редко выявляется у пациентов, имеющих антицентромерные антитела и страдающих лимитированной формой склеродермии (процесс ограничен кожей кистей, шеи и лица; органные нарушения менее выражены и присоединяются поздно) [8–10]. Проанализировав 46 больных системной склеродермией, V. Codullo et al. (2009) [11] показали, что в группе с ранним (
Очевидно, что в развитии склеродермического почечного криза заметно большее значение имеют внешнесредовые факторы, реализующие свои эффекты при определенных особенностях течения болезни – высокой активности, обычно сохраняющейся на протяжении первых 4–5 лет ее существования. Среди факторов, инициирующих склеродермический почечный криз, определенное значение имеют неспецифические, в целом схожие с провоцирующими развитие и прогрессирование других системных заболеваний, протекающих с вовлечением почек (переохлаждение, инсоляция, травма, вирусные и бактериальные инфекции, кровотечения, прекращение приема лекарственных препаратов, использующихся для лечения системной склеродермии). Провоцировать развитие ОСН может также беременность, при этом экскреция белка с мочой может достигать значительных величин, что не вполне типично для склеродермического почечного криза, развивающегося при других обстоятельствах [12]. Описано также формирование склеродермического почечного криза непосредственно после аборта [13]. ОСН может также развиваться после массивной кровопотери [14]. У большинства пациентов индуктора почечного склеродермического криза выделить не удается.
Читайте также:

