Плазмаферез при системной красной волчанке
Обновлено: 30.04.2024
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский» предоставляется скидка 5% на ВСЕ мед.
Скидки для друзей из социальных сетей!
Эта акция - для наших друзей в "Одноклассниках", "ВКонтакте", "Яндекс.Дзене", YouTube и Telegram! Если вы являетесь другом или подписчиком стр.
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
Мы в Telegram и "Одноклассниках"
Болезнь или синдром Шёгрена - системное аутоиммунное заболевание, известное также как «сухой синдром». Болезнь Шёгрена получила свое название в честь шведского офтальмолога Генриха Съогрена. В 1929 году он обследовал и лечил пациента, которого сильно тревожили сухость в глазах, во рту и боль в суставах.
У женщин болезнь Шёгрена встречается намного чаще, чем у мужчин (в 9 из 10 случаев), причем, как правило, это касается женщин после менопаузы. Однако в целом заболевание поражает людей любого пола и возраста. Общемировой статистики нет, но в развитых странах, включая Россию, заболеваемость оценивается в миллионах, болезнь Шёгрена - одно из самых распространённых ревматических заболеваний.
При болезни Шёгрена иммунитет человека воспринимает клетки собственного организма как чужие и начинает их медленно и планомерно уничтожать. Клетки иммунной системы попадают в ткани желез внешней секреции (слезные, слюнные, бартолиниевы железы влагалища), поражают их, и те начинают выделять меньше соответствующего секрета (слюны, слез и т.д.).
Кроме того, болезнь нередко затрагивает и иные органы, провоцируя артралгии, боли в суставах, мышцах (полимиозит), одышку и т.д.
Есть также синдром Шёгрена (вторичное воспаление слюнных и слезных желез), который сопутствует ревматоидному артриту, диффузным болезням соединительной ткани, заболеваниям желчевыводящей системы и другим аутоиммунным заболеваниям.

Диагностика болезни Шёгрена

Важно обратиться к врачу при первых симптомах, так как «запущенная» болезнь Шёгрена может принять неблагоприятный характер и затронуть жизненно важные органы, что нередко приводит к осложнениям, в редких случаях - к летальному исходу.
Причины развития
Одним из главных факторов, «запускающих» болезнь, является аутоиммунный сбой. При данном нарушении иммунная система начинает уничтожать клетки желез внешней секреции человека. Почему это происходит? Этот механизм при болезни Шёгрена еще нуждается в уточнении.
Другим фактором появления заболевания является генетическая предрасположенность. Иногда, если эта болезнь есть у матери, то она может быть выявлена и у дочери. Изменения в гормональном фоне женщины тоже могут спровоцировать болезнь.
Синдром Шёгрена обычно развивается на фоне других системных заболеваний (напр., при ревматоидном артрите и системной красной волчанке).
Клиническая картина болезни Шёгрена
Все симптомы болезни Шёгрена можно условно разделить на железистые и внежелезистые.
Железистые симптомы болезни Шёгрена
Железистые симптомы болезни проявляются в снижении выработки секретов желез.
Одним из основных признаков болезни Шёгрена является воспаление глаз, связанное с уменьшением секреции глазной жидкости. Больных беспокоит чувство дискомфорта: жжение, царапанье, «песок» в глазах. Вместе с этим люди часто ощущают отек век, покраснение, скопление в углах глаз белой вязкой жидкости. На следующем этапе заболевания пациенты начинают жаловаться на светобоязнь, ухудшение остроты зрения.
Второй постоянный признак болезни Шёгрена - воспаление слюнных желез, которое переходит в хроническую форму. Больной жалуется на сухость во рту и увеличение слюнных желез. В начале болезни отмечается небольшая или непостоянная сухость во рту, которая появляется только в результате волнения или физической нагрузки. Затем сухость во рту становится постоянной, слизистая оболочка и язык чрезмерно сохнут, приобретают ярко розовый цвет и часто воспаляются, быстро прогрессирует зубной кариес.
Иногда до появления этих признаков у больного может появиться «беспричинное» увеличение лимфатических узлов.
Поздняя стадия болезни характеризуется сильной сухостью во рту, человеку становится очень сложно разговаривать, проглатывать твердую пищу, не запивая ее водой. На губах появляются трещины. Может появиться хронический атрофический гастрит с недостаточностью секреции, которая сопровождается отрыжкой, тошнотой, снижением аппетита. У каждого третьего больного на поздней стадии отмечается увеличение околоушных желез.
Наблюдается поражение желчных путей (холецистит), печени (гепатит), поджелудочной железы (панкреатит).
На поздней стадии заболевания становится очень сухой носоглотка, в носу образуются сухие корочки, может развиться отит и снижение слуха. Из-за сухости в гортани появляется осиплость голоса.
Появляются вторичные инфекции: часто рецидивирующие синуситы, трахеобронхиты, пневмонии. У каждой третьей больной наблюдается воспаление половых органов. Слизистая оболочка красная, воспаленная.
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Однако далеко не во всех случаях классическая ПТ позволяет быстро и надежно решать сложнейшие вопросы лечения в критических ситуациях и прогностически неблагоприятных вариантах течения СКВ. В настоящее время достаточно четко выявляется особая группа риска. В эту группу в первую очередь включаются пациенты с развитием СКВ в подростковом возрасте, быстропрогрессирующим волчаночным нефритом с диффузным поражением клубочкового аппарата и «полулуниями», стойкой артериальной гипертензией и азотемией, быстрым развитием нефротического синдрома в молодом возрасте, церебропатией с судорожным синдромом и комой, поперечным миелитом, геморрагическим пневмонитом, тромбоцитопенией, генерализованным поражением кожи и слизистых оболочек с развитием некрозов, сопровождающихся криоглобулинемией, гипокомплементемией и высоким уровнем антиядерных антител. Огромное значение в оценке жизненного прогноза у этой группы пациентов имеет своевременное назначение патогенетической терапии.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Изолированное применение ПФ при СКВ в большинстве случаев существенно ограничено развитием так называемого синдрома рикошета, возникающего непосредственно после удаления достаточно большого объема плазмы. Резкое повышение уровня аутоантител в ближайшие дни после процедуры — «рикошет» — связывается со стимуляцией лимфоцитов, продуцирующих аутоантитела по принципу обратной связи. Обычно лабораторный «рикошет» сопровождается обострением клинической картины, что в целом производит впечатление терапевтической неудачи. Логичными представляются два выхода из этой ситуации. Первый — сокращение времени между процедурами и проведение длительных серий ПФ в течение нескольких месяцев или даже лет. Второй, по-видимому, более рациональный и эффективный способ достижения стойкого клинического эффекта при назначении ПФ у больных СКВ — комбинирование экстракорпоральных методов и пульс-терапии МП и ЦФ в синхронном режиме.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Для цитирования: Соловьев С.К., Насонова В.А. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ ОБ ИНТЕНСИВНОЙ ТЕРАПИИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ. РМЖ. 1998;18:6.
Даны подробные сведения об интенсивной терапии системной красной волчанки, ее современном содержании и перспективе.
The paper gives detailed information on intensive therapy for systemic lupus erythematosus, its present-day content and perspectives.
С.К. Соловьев, В.А. Насонова — Институт ревматологии РАМН, Москва
S.K.Solovyev, V.A.Nasonova, Institute of Rheumatology, Russian Academy of Medical Sciences, Moscow
С истемная красная волчанка (СКВ) является классическим примером аутоиммунного заболевания. Прогрессирующее поражение жизненно важных органов и систем определяет жизненный и социальный прогноз больных СКВ [1]. За последние два десятилетия принципы терапии СКВ претерпели существенные, практически революционные изменения. На смену прерывистому назначению малых и средних доз глюкокортикостероидных гормонов (ГКС) пришли схемы длительного, многомесячного приема “подавляющих” доз – от 1 до 1,5 мгкгдень и цитотоксические иммунодепрессанты. Комбинированная терапия преднизолоном, циклофосфамидом или азатиоприном позволила увеличить до 40 – 60% 5-летнюю выживаемость в различных группах больных СКВ. Начиная с середины 70-х годов, в практическую ревматологию активно внедряется внутривенное введение сверхвысоких доз метилпреднизолона (МП) и циклофосфана (ЦФ), обозначаемое впоследствии термином “пульс-терапия” (ПТ). С начала 80-х годов для купирования острой моно- или полиорганной недостаточности у больных СКВ все чаще с успехом применяется экстракорпоральная терапия – гемосорбция (ГС) и плазмаферез (ПФ), внутривенное введение мегадоз иммуноглобулина G(ВИГ). Вскоре различные схемы и комбинации экстракорпоральных методов лечения и внутривенного введения ударных доз ГКС, ЦФ и иммуноглобулина послужили основой для определения принципов интенсивной терапии (ИТ) СКВ.
Пульс-терапия метилпреднизолоном
Наиболее известным и распространенным методом ИТ, безусловно, является ПТ. Традиционным, классическим вариантом ПТ считается внутривенное введение 1г МП за 30 – 40 мин в течение 3 последующих дней [2]. Патофизиологическим обоснованием для применения ударных доз ГКС является их способность активно взаимодействовать с системой иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ПТ – подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную лимфопению. Тормозящее воздействие ПТ на b-лимфоциты приводит к достаточно стойкому (2 – 4 нед) снижению уровня иммуноглобулинов и иммунных комплексов в плазме крови, что важно в случаях гиперпродукции аутоантител и повышенным уровнем циркулирующих иммунных комплексов (ЦИК). Иммуномодулирующее действие ПТ определяется и ингибированием экспрессии и функциональной активности Fc и C3 рецепторов мононуклеаров, что, видимо, и обусловливает клинический эффект у больных с цитопениями.
Противовоспалительный и иммунорегуляторный эффект ПТ в значительной степени обусловлен ее воздействием на систему цитокинов (в особенности на противовоспалительные цитокины – интерлейкины -1,-6 и -8), фактор некроза опухоли и подавлением транскрипции генов металлопротеиназ и липокортина.
Впервые ПТ 6-МП была с успехом применена у больных с активным волчаночным нефритом Kimberly в 1976 г. В дальнейшем 3-дневная ПТ оказалась высокоэффективным способом лечения при многих внепочечных проявлениях СКВ – лихорадке, полисерозите, полиартрите, в некоторых случаях волчаночной церебропатии и цитопении [1, 2]. Лихорадочный синдром, полиартрит и полисерозит обычно бывают полностью купированы на 2 – 3 день от начала ПТ. Эффективность ПТ при церебропатии подтверждается в случаях органического поражения мозга. При появлении первых симптомов (головные боли, зрительные расстройства) 1 г МП вводится в течение 3 – 7 последующих дней. В случаях поперечного миелита эффективность ПТ невысока, около 50%, и зависит от сроков начала лечения. ПТ высокоэффективна у больных СКВ с лейкопениями, в том числе и лекарственными, в некоторых случаях аутоиммунной анемии и тромбоцитопении (синдром Верльгофа). При лечении наиболее прогностически неблагоприятного и сложного для курации волчаночного нефрита ПТ, безусловно, занимает одно из центральных мест. Эффективность лечения во многом зависит от длительности нефрита, морфологической стадии и выраженности почечной недостаточности. Наиболее эффективно назначение 3-дневной ПТ МП на самых ранних стадиях нефрита, без признаков серьезного изменения почечной ткани и почечной недостаточности. В этих случаях длительность “почечной” ремиссии может достигать многих месяцев и даже лет. У больных с активным быстропрогрессирующим люпус-нефритом стандартная ПТ приводит к быстрому уменьшению протеинурии, мочевого осадка и отеков, улучшению функции почек и стабилизации АД. Для повышения клинической эффективности ПТ при прогрессирующем нефрите используется ежемесячное, повторное внутривенное введение 1 г МП в течение 6 – 12 мес [3, 4]. Программное проведение ПТ у больных люпус-нефритом способствует стойкому улучшению азотовыделительной функции почек, уменьшению протеинурии и уровня антиядерных антител в сыворотке крови. Нестабильный клинический эффект ПТ наблюдается у больных с длительным, многолетним течением люпус-нефрита, преобладанием склероза клубочкового аппарата (Y класс по классификации ВОЗ), стойкой артериальной гипертензией и прогрессирующей азотемией.
Побочные явления ПТ МП обычно ограничены тахикардией, гиперемией лица и небольшим эмоциональным возбуждением. Значительно более редко можно наблюдать брадикардию, артериальную гипер- или гипотензию, кратковременный артрит крупных суставов, икоту. Известны единичные случаи внезапной смерти, желудочковые аритмии, вероятно, обусловленные острыми метаболическими нарушениями в миокарде. Для уменьшения риска кардиальных осложнений запрещено сочетание ПТ и фуросемида.
Ударные дозы циклофосфана
Алкилирующий цитотоксик ЦФ по частоте применения у больных с острым и неблагоприятным течением СКВ прочно занимает второе место после ГКС. Наиболее эффективным в настоящее время считается внутривенное введение ударных доз ЦФ [1, 5]. При активном волчаночном нефрите ЦФ назначают из расчета 1000 мг/м2 поверхности тела или 15 – 20 мг на 1 кг массы тела. Наилучшие результаты достигаются при ежемесячном назначении 1 г препарата в течение 6 мес, и далее по 1 г каждые 3 мес до 1,5 лет. Существует и более интенсивная схема внутривенного применения ЦФ – по 500 мг еженедельно, длительностью до 10 нед. У больных СКВ с одновременным поражением почек, кожи, ЦНС и высокой иммунологической активностью целесообразно комбинированное назначение ударных доз МП и ЦФ. Добавление 1 г ЦФ во 2-й или 3-й день стандартной ПТ МП существенно повышает эффективность лечения, приводит к быстрому улучшению клинической картины, нормализации иммунологических и воспалительных показателей активности [6]. Одновременно назначение ударных доз МП и ЦФ может быть высокоэффективным в лечении аутоиммунной волчаночной тромбоцитопении, анемии, распространенном поражении кожи и слизистых оболочек. Особенно актуальна комбинированная ПТ у больных с геморрагическим пневмонитом и такими поражениями ЦНС, как поперечный миелит и поражение зрительного нерва. Внутривенное введение МП в дозах от 250 до 1000 мг одновременно с ЦФ не только значительно усиливает противовоспалительный эффект терапии, но и обладает определенным протективным действием, нивелируя цитотоксические проявления ЦФ. Интенсивная терапия ЦФ, значительно расширяя возможности курации СКВ с полиорганнной недостаточностью, имеет свои особенности и ограничения. Так, у больных с люпус-нефритом, успешно пролеченных ЦФ, может развиться обострение вскоре после отмены препарата. Значительно снижается эффективность ПТ ЦФ при преобладании фиброзных и склеротических изменений в гломерулах (IY класс классификации ВОЗ), нарушении азотовыделительной функции почек с развитием креатининемии. Среди побочных реакций и осложнений наиболее часто можно наблюдать лейко- и нейтропению, учащение вторичной инфекции и аменорею. Ударные дозы ЦФ, вводимые внутривенно, практически никогда не приводят к развитию геморрагического цистита, а угроза развития опухолей реально рассматривается только при суммарной дозе более 60 г.
Внутривенный иммуноглобулин G
ВИГ является препаратом нормального полиспецифического иммуноглобулина, полученного из пула сывороток не менее чем 5000 доноров. Коммерческий ВИГ должен содержать не менее 97% очищенной фракции IgG с сохранной функцией фрагментов F(ab) и Fc, без спонтанной агрегации, быть безопасным по ВИЧ и гепатиту и с периодом полужизни – 21 день. Стандартными препаратами ВИГ, отвечающими этим требованиям, являются сандоглобулин, октагам и некоторые другие препараты IY поколения. Основные механизмы действия ВИГ сводятся к блокаде Fc-рецепторов клеток, ингибированию синтеза антител, модуляции Т-лимфоцитов и влиянию на синтез цитокинов. Большое значение в реализации лечебного эффекта имеет наличие в препарате антиидиотипических антител. При СКВ наибольшую эффективность препарата наблюдают у больных с аутоиммунными цитопениями и при развитии тяжелой церебропатии, сопровождающейся комой, судорогами и психозом [2]. ВИГ в этих случаях назначают как “последнее средство” по 0,5 г на 1 кг массы тела в течение 5 последующих дней. Описаны единичные наблюдения успешного применения ВИГ у больных с генерализованным кожным васкулитом, рецидивирующим полисерозитом и в случаях привычного невынашивания беременности при антифосфолипидном синдроме (АФС).
У больных с волчаночным нефритом назначение ВИГ требует большой осторожности из-за опасности резкого прогрессирования почечной недостаточности. Встречаются аллергические реакции в виде озноба, сыпи, лихорадочной реакции, головокружения и тошноты. Абсолютным противопоказанием для применения ВИГ является дефицит IgA.
Плазмаферез. Сорбционные методы лечения
В современном исполнении ПФ осуществляют с помощью центрифужной или мембранной технологии, с удалением за одну процедуру 40 – 60 мл/кг плазмы. Рекомендуемые курсы ПФ состоят из 3 – 6 процедур, проводимых последовательно или с короткими интервалами. ПФ у больных СКВ показан как “острое вмешательство” при осложненной криоглобулинемии, гипервязком синдроме и тромбоцитопенической пурпуре [2]. ПФ может быть использован как дополнительное высокоэффективное средство при состояниях, непосредственно угрожающих жизни: молниеносный васкулит, полимиелорадикулоневрит, церебральная кома, геморрагический пневмонит. Оправдано подключение ПФ в случаях волчаночного нефрита, рефрактерного к ГКС и цитотоксикам, у больных с АФС с привычными викидышами [7].
Среди сорбционных методов лечения различают селективное и неселективное удаление из циркуляции патологических белковых структур. К неселективным относится ГС, в основе которой лежат физико-химические свойства активированного угля. Помимо прямого удаления ЦИК, аутоантител и цитокинов, ГС стимулирует антиидиотипическую активность, фагоцитоз и повышает чувствительность клеточных рецепторов к лекарственным препаратам. В лечении больных СКВ ГС имеет те же показания, что и ПФ.
Селективная сорбция осуществляется с помощью селективных иммуносорбентов (биологических или химических), способных целенаправленно удалять РФ, антитела к ДНК и ЦИК. Экспериментальные исследования в этой области свидетельствуют о высокой эффективности иммуносорбентов у больных СКВ с высокой иммунологической активностью. Побочные проявления экстракорпоральной терапии обычно сводятся к транзиторной гиповолемии и ознобу, противопоказанием является язвенная болезнь в стадии обострения, маточное кровотечение, непереносимость гепарина. Несмотря на подчас фантастические результаты в критических ситуациях при СКВ, ПФ и ГС как самостоятельные методы лечения редко находят свое место в плановой терапии. Их применение в значительной степени сдерживается развитием так называемого синдрома рикошета, возникающим непосредственно после процедуры и характеризующимся рецидивом клинической активности и резким повышением уровня антител и ЦИК. Подавление активности антителопродуцирующих b-лимфоцитов и предотвращение синдрома рикошета достигается путем последовательного, синхронного применения ПФ и ПТ МП-ЦФ [2]. Синхронизация интенсивной терапии в виде многомесячной программы, возможно, превосходит по эффективности все известные способы лечения СКВ с неблагоприятным жизненным прогнозом [8]. Существует несколько методик синхронной интенсивной терапии: 1) серия плазмаферезов из 3 – 6 последовательных процедур с дальнейшим коротким курсом мегадоз ЦФ внутривенно; 2) начальная серия процедур ПФ (обычно 3) синхронно с внутривенным введением ЦФ 1 г и МП 3 г и в дальнейшем по 1 процедуре ПФ в 1 – 3 мес в течение года, синхронно с 1 г ЦФ и 1 г МП. Вторая схема синхронной интенсивной терапии представляется более убедительной, так как обеспечивает программный контроль в течение года. Программное назначение комбинации ПФ и ПТ МП и ЦФ показано в первую очередь больным СКВ с неблагоприятным жизненным прогнозом, обусловленным началом заболевания в подростковом и молодом возрасте [9], быстрым развитием нефротического синдрома, быстропрогрессирующим типом нефрита [8], стойкой артериальной гипертензией и с развитием угрожающих жизни состояний (церебральный криз, поперечный миелит, геморрагический пневмонит, тромбоцитопения и др.).
В последние годы агрессивные методы лечения перестают быть “терапией отчаяния”, уделом реанимационных отделений и ургентных ситуаций. Плановое назначение этих методов способно существенно улучшить отдаленный жизненный прогноз у значительной части больных СКВ.
В ближайшей перспективе вполне очевидно появление новых схем и программ интенсивной терапии СКВ, например, синхронизация ВИГ и ПФ, иммуносорбции и ЦФ, ударные дозы препаратов интерферона и антицитокиновых антител.
1. Иванова М. М. Системная красная волчанка. В кн. Ревматические болезни. М., Медицина, 1997;160–72.
2. Cоловьев С.К. В кн. Ревматические болезни. М., Медицина. 1997;106–7;125–7;100–2.
3. Harisdangkul V, Rockhold L, Myers A. Lupus nephritis: efficacy of monthly pulse therapy with intravenous methylprednisolone. South Med J 1989;82(3):321–7.
4. Liebling MR, McLaughlin K, Boonsue S, Kasdin J, Barnett EV. Monthly pulses of methylprednisolone in SLE nephritis. J Rheumatol 1982;9(4):54.
5. Steinberg AD. Cyclophosphamide in lupus nephritis. J Rheumatol 1995;22(10):1812–5.
6. Соловьев С.К., Иванова М.М., Насонов Е.Л. и др. Комбинированное применение ударных доз 6-метилпреднизолона и циклофосфана у больных системной красной волчанкой. Тер. Арх., 1985;8:7–12.
7. Wallace DJ. Plasmapheresis in Lupus. Lupus 1993;2:141–3.
8. Euler HH, Schroeder JO, Harten P, et al. Treatment-free remission in severe systemic lupus erythematosus following synchronization of plasmapheresis with subsequent pulse cyclophosphamide. Arthr Rheum 1994;37(12):1784–94.
9. Соловьев С.К., Шайков А.В., Чикликчи А.С. и др. Программная интенсивная терапия у подростков с неблагоприятным вариантом течения системной красной волчанки. Детск. ревматология. 1995;1:52–8.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

Фото: АстраЗенека
Главный герой одного из популярных «медицинских» сериалов при дифференциальном диагнозе именно системную красную волчанку (СКВ) подозревал у каждого трудного пациента. И хотя у кинематографических сценариев свои законы, авторы этого сценария четко уловили важную особенность СКВ — невероятную многоликость заболевания.

О многогранности проявлений сложной хронической патологии, при которой иммунная система организма атакует свои собственные клетки как чужеродные, о потенциальных причинах ее развития и о возможностях современных терапевтических стратегий корреспондент МВ узнал у Татьяны Решетняк, докт.мед.наук, врача высшей квалификационной категории, заведующей лабораторией тромбовоспаления ФГБНУ «Научно-исследовательского института ревматологии им. В.А. Насоновой».
— На самом деле, история этого заболевания значительно глубже. Первым, кто описал кожные язвы herpes esthiomenos, был еще Гиппократ (460-375 до н. э.). Название «красная волчанка» (Lupus erythematosus — лат.), происходит от латинских слов lupus — «волк» (из-за характерной, похожей по форме на бабочку сыпи на лице, напоминающей белые отметины на морде волка), и erythematosus — «красная», что указывает на цвет кожных высыпаний.
Выделяют несколько периодов изучения СКВ: классический, при котором описаны кожные проявления заболевания и их отличие от туберкулеза кожи; неоклассический — выделение диссеминированных или системных проявлений заболевания; современный, начало которого относится к описанию LE-клеточного феномена при СКВ, а продолжение характеризуется дальнейшими успехами в диагностике и терапии заболевания.
По определению ВОЗ и акад. В.А. Насоновой, «Системная красная волчанка (СКВ) — хроническое полисиндромное заболевание преимущественно молодых женщин и девушек, развивающееся на фоне генетически обусловленного несовершенства иммунорегуляторных процессов и приводящего к неконтролируемой продукции антител к собственным клеткам и их компонентам, с развитием аутоиммуного и иммунокомплексного хронического воспаления». Как следует из определения, контингент больных — в основном, молодые женщины трудоспособного и репродуктивного возраста, в связи с чем это заболевание остается актуальным как в мире, так и в России.
Теперь о распространенности. В учете истинной частоты и степени преобладания заболевания в различных этнических группах есть трудности. Связаны они с методологическими различиями в проведенных исследованиях.
Результаты исследования 2007 года, суммирующего данные 1950-2004 годов, приводят частоту заболевания от одного до 241 случая на 100 тыс. населения. При этом отмечается, что частота встречаемости СКВ возрастает с каждым десятилетием (с 1950 по 1979 год она составляла 1,51 на 100 тыс. населения, а с 1980 по 1992 год — 5,56 на 100 тыс.).
По данным российских исследований, распространенность данного заболевания колеблется в диапазоне от 4 до 250 случаев на 100 тыс. населения 1 .
К сожалению, в нашей стране отсутствует регистр по СКВ, но число новых случаев такое же, как и по Европе (например, по данным регистра Швеции — это 39-45 случаев на 100) 2 .
— Системная красная волчанка — сложное заболевание, этиология которого до конца не изучена. Расскажите, пожалуйста, что известно современной медицине о его патогенезе?
— Патогенез СКВ сложен и действительно до конца не изучен. Системная красная волчанка — заболевание с наследственной предрасположенностью, но не в полной мере наследственное заболевание. Выявлено достаточно много генов, которые вовлечены в механизм его развития (более 40). Однако сам ген волчанки до настоящего времени не найден, поэтому говорить о том, что это наследственное заболевание, мы пока не можем.
СКВ — аутоиммунная болезнь, возникающая в случае, когда иммунная система человека теряет способность отличать чужеродные агенты от собственных тканей и клеток. Иммунная система вырабатывает наряду с другими активными молекулами аутоантитела, которые расценивают собственные нормальные клетки организма как чужеродные и атакуют их.
Отмечается гиперактивность В-лимфоцитов и дефицит Т-супрессорной функции лимфоцитов, при этом отмечается продукция большого количества аутоантител (антиядерных, антител к двуспиральной, нативной ДНК, микросомам, лизосомам, митохондриям, форменным элементам крови и др.). Наибольшее патогенетическое значение имеют антитела к нативной ДНК (нДНК), которые, соединяясь с ней, образуют иммунные комплексы и активируют комплемент.
В патогенезе СКВ задействован как врожденный, так и приобретенный иммунитет, и важную роль в их дисрегуляции играет интерферон I типа (ИФН I типа). Недавние исследования обнаружили тесную взаимосвязь между ИФН I типа, особенно ИФН-α. С этим заболеванием более чем у половины пациентов с СКВ экспрессия генов «сигнатуры ИФН типа I» была выявлена в мононуклеарах периферической крови. ИФН-α может активировать лимфоциты, дендритные клетки и естественные киллерные клетки (NK), нарушая аутоиммунную толерантность. Результатом является аутоиммунная реакция, вызывающая воспаление определенных органов (суставов, почек, кожи и т. д.).
Также известно, что СКВ может быть спровоцирована гормональным дисбалансом в период полового созревания, стрессом, факторами окружающей среды (например, воздействием ультрафиолета), вирусной инфекцией, приемом лекарственных средств (таких, как изониазид, гидралазин, прокаины или противосудорожные препараты).
— Для волчанки характерно многообразие симптомов и проявлений. Врачам каких специальностей нужно иметь настороженность в отношении этого заболевания?
— Симптомы СКВ действительно многообразны и могут быть связаны с поражением любых систем и органов. Именно поэтому СКВ определяют как мультидисциплинарную проблему.
Врач любой специальности на практике имеет возможность «встретиться» с больным системной красной волчанкой. В первую очередь, это может быть терапевт, дерматолог, нефролог, невролог, гематолог, кардиолог, акушер-гинеколог, а также аллерголог и инфекционист.
— Татьяна Магомедалиевна, на что врачу следует обратить внимание, чтобы не пропустить такого пациента? Какие органы и системы поражаются при этом заболевании? Каковы наиболее часто встречающиеся симптомы при СКВ?
— Как правило, у пациента можно выделить какой-либо один пораженный орган-мишень, определяющий тяжесть состояния. При легкой степени активности СКВ наиболее часто вовлечены кожно-слизистая и костно-мышечная системы. Для тяжелой степени активности характерно поражение жизненно-важных органов.
Одинаковых случаев СКВ нет. У разных пациентов заболевание может проявляться по-разному. Это может быть, к примеру, лихорадка неясного генеза, боли в суставах, кратковременные, мигрирующие боли в области грудной клетки, которые могут быть связаны с дыханием или с переменой положения тела, адгезивный полисерозит. С такими проявлениями пациенты обращаются к терапевтам.
К неврологам попадают пациенты с эпилептическим статусом, хореиформными гиперкинезами, нарушением чувствительности, проблемами с мочеиспусканием или недержанием мочи у молодых пациентов. Встречаются также энцефаломиелопатии и радикулополинейропатии, которые обычно сочетаются с лихорадкой и другими проявлениями.
При поражении почек у больных СКВ болевых ощущений чаще всего нет. И врачи ориентируются на лабораторные анализы — появление белка в моче. Это в первую очередь требует исключения гломерулонефрита после ангины или простудного заболевания, на фоне приема лекарственных препаратов. О вовлечении почек зачастую говорит и появление отеков, преимущественно в области стоп, голеней, а также появление одутловатости лица и параорбитальных отеков.
При волчанке может наблюдаться феномен Рейно (изменение окраски кончиков пальцев или пальцев целиком в связи со стрессом или холодом). Поражения кожи при СКВ в 25-50% довольно типичны, поэтому дерматологи и терапевты сразу их замечают — высыпания эритематозного характера на скулах, спинке носа, подбородка, надбровных дуг. К проявлениям волчанки относятся и язвы во рту и носу — с такими жалобами пациент может попасть к отоларингологу или опять же к терапевту.
Системная красная волчанка иногда сопровождается так называемым сухим синдромом, или синдромом Шегрена, при котором отмечается сухость во рту, трудности с проглатыванием твердой пищи, снижение количества слез.
Кроме того, существует субтип волчанки с антифосфолипидным синдромом. Он вызывает рецидивирующие тромбозы любой локализации и акушерскую патологию, проявляющуюся рецидивирующими потерями беременности. Бывает, что первая беременность заканчивается самопроизвольным абортом, и при обследовании выявляется позитивная реакция Вассермана (реакция на сифилис), а при проверке эта реакция оказывается ложно-позитивной — это еще один признак волчанки.
— Очевидно, что и при СКВ важно как можно раньше поставить диагноз. Каким будет прогноз при запоздалой диагностике заболевания?
— Поздняя диагностика приводит к плохому прогнозу, как и запоздалое выявление повышения активности СКВ — это ведет к неконтролируемой выработке аутоантител и нарастанию функциональной недостаточности органов.
Самые серьезные из возможных поражений — поражения почек и центральной нервной системы. При волчаночном нефрите быстро наступает хроническая болезнь почек и уремия, что вызывает необходимость диализа, в перспективе трансплантации почек.
При поражении центральной нервной системы возможен поперечный миелит, приводящий пациентов с энцефаломиелопатией или радикулополинейропатией без своевременного лечения к инвалидизации. Наличие антифосфолипидного синдрома при СКВ ведет к возрастанию риска инсульта и нарушений когнитивных функций.
Как говорилось выше, антифосфолипидный синдром может также проявляться акушерской патологией с рецидивирующими случаями потери плода на разных сроках беременности. При этом фертильность у пациенток с СКВ не страдает, беременность наступает довольно легко. Поэтому при активной волчанке и при приеме иммуносупрессивных препаратов обязательно пользоваться средствами контрацепции.
Все перечисленные специалисты наблюдают пациента совместно с ревматологом.
— Какие современные терапевтические стратегии предлагает медицина для пациентов с этим сложным и мало предсказуемым заболеванием?
— Длительно существующее аутоиммунное воспаление, как это бывает при системной красной волчанке, может вызвать повреждение тканей и нарушить их нормальное функционирование, поэтому лечение СКВ направлено прежде всего на подавление аутоиммунных реакций.
В настоящее время выявлен ряд мишеней для создания лекарственных препаратов для лечения СКВ. Несмотря на большое число клинических исследований сегодня ревматологи располагают ограниченным набором высокотехнологичных лекарственных средств.
Генно-инженерная биологическая терапия — многообещающая опция в лечении СКВ. Она подразумевает разработку моноклональных антител, оказывающих селективное воздействие на основные звенья иммунопатогенеза СКВ. К сожалению, пока таких препаратов одобрено мало. Биологические препараты, рекомендуемые для терапии СКВ, влияют только на В-клеточное звено иммунитета.
Согласно последним научным данным, считается, что ведущий механизм развития СКВ связан с семейством интерферонов (ИФН) типа I, поэтому антитела к ИФН-α имеют большое будущее в лечении волчанки. В ближайшее время ожидается появление нового препарата — ингибитора ИФН типа I.
— Излечить волчанку пока нельзя, но этот диагноз уже не звучит фатально. Какова выживаемость пациентов с СКВ в наше время? Благодаря чему она достигнута?
— Да, сегодня 10-летняя выживаемость достигла 95%. Это результат и своевременной диагностики, и адекватного лечения. Появление новых биологических таргетных препаратов ведет к снижению дозы глюкокортикоидов и цитостатиков, что, в свою очередь, снижает нежелательные явления стандартной терапии, уменьшается повреждение органов, что способствует не только контролю активности заболевания, но и достижению еще одной важной цели в терапии СКВ — улучшению качества жизни пациентов.
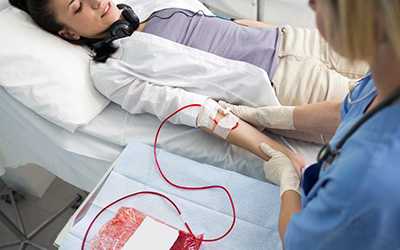
Плазмаферез – один из самых популярных видов экстракорпоральной детоксикации, направленной на изменение органического, газового или водно-электролитного состава кровяной субстанции посредством её химической и механической обработки вне организма. Для проведения манипуляций по очистке требуется специально оборудование. Изменениям подвергаются как качественные, так и количественные характеристики
Особенности процедуры
Суть метода предусматривает элиминацию (удаление) всех элементов, содержащихся в плазме. Максимально значимый терапевтический эффект достигается, когда вредные вещества сконцентрированы именно в жидкой составляющей кровотока.
Как и любая другая лечебная процедура, плазмаферез требует точного дозирования количества забираемого объема циркулирующей плазмы (ОЦП). Расчет допустимого ОЦП определяется для каждого пациента индивидуально по специальным таблицам с учетом возрастных характеристик, половой принадлежности, антропометрических данных.
В зависимости от количества удаляемой за одну процедуру плазмы выделяют несколько разновидностей этого метода:
Показания
Плазмаферез в современной медицинской практике используется как основной или вспомогательный метод.
К патологическим состояниям, при которых процедура является одним из основных компонентов терапии, относятся:
- эритромиелоз;
- посттрансфузионная пурпура;
- повышение числа лейкоцитов и тромбоцитов при гемобластозах (неопластических процессах);
- миастения Гравис (тяжелое аутоиммунное заболевание, сопровождающееся разрушением собственных рецепторов в поперечнополосатых мышцах);
- серповидно-клеточные нарушения строения гемоглобина;
- генетически обусловленный сбой обмена железа;
- нарушения пигментного обмена;
- наследственное увеличение содержания холестерина;
- отравление химикатами и ядами;
- синдром Гийена-Барре (полирадикулоневрит);
- массивный распад эритроцитов в кровотоке;
- хронические множественные поражения периферических нервов, приводящие к параличам и парезам;
- болезненная реакция на холод;
- повышение вязкости крови, как одно из проявлений миеломной болезни (злокачественной опухоли появляющейся из плазматических клеток);
- синдром Гудпасчера (аутоиммунное заболевание, разрушающее альвеолы легких и почечные клубочки);
- ДВС-синдром (одно из нарушений свертываемости);
- ускоренное образование тромбов и закупорка мелких сосудов;
- тромбоцитопеническая пурпура (одна из разновидностей недостатка тромбоцитов);
- миоглобинемия.
Перечень заболевания, терапия которых предусматривает включение процедуры очистки крови в протокол лечения:

- тяжелые формы аллергии и псевдоаллергических реакций;
- аутоимунное поражение миелиновой оболочки нервных волокон головного и спинного мозга;
- псориаз;
- ревматоидный артрит;
- пузырные дерматозы;
- системные воспаления и разрушения сосудистых стенок (васкулиты);
- экстракапилярный гломерулонефрит;
- острый панкреатит;
- бронхиальная астма;
- красная волчанка;
- тяжелая форма сепсиса.
Плазмаферез: польза и вред
Лечебное действие плазмафереза основывается на следующих молекулярных механизмах:
- Количественное выведение различных биомолекул: парапротеинов, антител, продуктов распада, экзотоксинов, неспецифических эндогенных молекул и др.
- Полное или частичное возмещение недостающих компонентов донорскими.
- Воздействие на структуры форменных элементов крови мембраны плазмофильтра (деплазмирование эритроцитов, уменьшение вязкости фильтруемой жидкости).
- Допустимый плацебо – эффект, наиболее ожидаемый в терапии хронических заболеваний.
В то же время, одномоментное выведение из организма более 30% ОЦП дает стабильное существенное снижение концентраций полезных для организма человека белков плазмы, факторов, обеспечивающих свертывание, и иммунных антител. Восстановление этих показателей происходит на протяжении долгого времени (не менее 7 дней). При удалении за один сеанс около 50 % ОЦП, в организме отсутствуют резервы для самостоятельного восстановления и обеспечения нормального функционального состояния органов. Такие состояния поддаются коррекции с помощью введение донорских компонентов. Выведение свыше 100% ОЦП не корригируется даже инфузиями альбумина и донорской плазмы, такие состояния тяжело переносятся пациентами. Поэтому процедура плазмообмена проводится лишь в критических и угрожаемых для жизни состояниях.
Как делают плазмаферез крови (разновидности методик)
Гравитационные методы основываются на фрагментации кровяной субстанции на форменные элементы и плазму, под воздействием ускоренного осаждения.
Этот метод предусматривает два варианта проведения плазмафереза:
- неаппаратный – осуществляющийся посредством естественного осаждения клеточных структур;
- центрифужный, когда разделение крови обеспечивается с помощью центрифугирования определенного ее объема.
Современные клиники выполняют два вида аппаратного гравитационного плазмафереза:
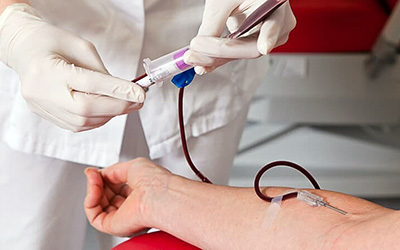
- Дискретный. Осуществляется забор крови у пациента в специальную пластиковую тару объемом 400-450 мл м последующее центрифугирование полученного материала, после этого функциональные клетки крови разводят в стерильном растворе для инфузий и возвращают пациенту.
- Непрерывно – поточный. Эта методика предусматривает использование специального аппарата для плазмафереза (сепаратора), благодаря которому производится одномоментные забор крови, разделение и возвращение пациенту неудаляемых компонентов.
Самым инновационным методом плазмафереза является мембранный, осуществляемый через особую мембрану, имеющую поры диаметром 0,2-0,6 мкм. Такой размер пропускного отверстия позволяет задерживать клетки крови и без проблем пропускает плазму. Эта методика адаптирована для выведения патологических гамма-глобулинов и хорошо зарекомендовала себя при аллергии. Одна из его разновидностей – каскадная очистка, подразумевающая пропускание кровяной субстанции через два мембранных фильтра.
Противопоказания
Существуют относительные и абсолютные противопоказания к очищению крови при помощи плазмафереза.
К ним относятся:

- критические и некомпенсируемые состояния у пациента;
- хирургические кровотечения и потенциальные источники неконтролируемых кровотечений (эрозии, опухоли, язвы);
- индивидуальная непереносимость или аллергические реакции в анамнезе на один из компонентов процедуры;
- инфекционные и гнойные процессы в стадии обострения;
- гипертермии неясного генеза;
- первичные или вторичные патологические нарушения гемостаза;
- анемии различной этиологии;
- гипопротеинемия;
- отсутствие возможности обеспечения периферического или центрального венозного доступа;
- период беременности, менструационных кровотечений у женщин.
Преимущества плазмафереза крови
Благодаря гемосорбции удается достичь:
- Полного или частичного исчезновения клинически значимых симптомов многих заболевания.
- Повышения эффективности базисной специальной медикаментозной терапии или снижение дозировок медикаментов.
- Полного выздоровления.
Побочные эффекты
Несмотря на неоспоримую пользу плазмафереза, во время проведения процедуры или сразу после ее окончания иногда могут наблюдаться следующие состояния:

- эмболические поражения мелких и крупных сосудов;
- острая гиповолемия, проявляющаяся резким снижением показателей артериального давления;
- острая гиперволемия, характеризующаяся левожелудочковой острой недостаточностью (одышка, дыхательная недостаточность, отек легких);
- геморрагический синдром;
- аллергические реакции различной интенсивностивплоть до анафилактического шока;
- пирогенные реакции;
- гипокальциемия (ощущения онемения конечностей, языка, губ).
При этом частота осложнений при плановых процедурах, после проведения всех подготовительных и диагностических мероприятий сводится к минимуму.
Читайте также:

