Папилломы пищевода при эзофагите
Обновлено: 19.04.2024
Опухоли пищевода. Доброкачественные и злокачественные опухоли пищевода.
В дистальном отделе пищевода изредка наблюдают аденому, имеющую такое же строение, что и аденомы желудка. Она может развиваться из слизистой оболочки при так называемом пищеводе Баррета, когда в результате хронического рефлюкс-эзофагита и гегеротопяи (что менее вероятно) многослойный плоский эпителий нижней части пищевода замещается цилиндрическим эпителием с формированием структур, соответствующих слизистой оболочке фундального или кардиального отделов желудка, нередко с явлениями кишечной метаплазии.
Рак — наиболее часто встречающаяся злокачественная опухоль пищевода. Чаще наблюдают у мужчин? возраст большинства которых 50—70 лет. К предрасполагающим факторам относятся особенности питания — употребление очень горячей и грубой пищи; недостаток витаминов, особенно В2, А; железа, меди, цинка; вредные привычки (курение, алкоголь и др.); некоторые географические особенности местности; аномалии и посттравматические рубцовые изменения пищевода, грыжа пищеводного отверстия диафрагмы, тилоз (гиперкератоз ладоней и подошв), синдром Пламмера—Винсона (железодефицитная анемия, гипохлоргидрия, дисфагия), наблюдающийся преимущественно у жительниц стран Скандинавского полуострова в возрасте 40 -45 лет и др.
Заболеваемость раком пищевода колеблется в очень широких пределах, достигая наиболее высоких показателей в некоторых районах Ирана, Китая, Туркменской, Казахской, Узбекской ССР и др. Эпидемиологические исследования показали, что в этих районах среди населения чрезвычайно широко распространен хронический эзофагит (60—80% населения и более), который, очевидно, имеет значение в развитии рака пищевода. При гистологическом исследовании на фоне хронического эзофагита обнаруживают очаговые и диффузные атрофические и гиперпластические изменения многослойного плоского эпителия, пролиферацию базальных клеток, очаги дисплазии, внутриэпителиальный и ранний инвазивный рак.
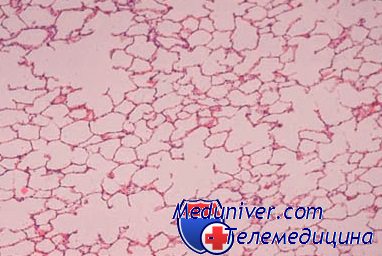
Такие же изменения часто можно обнаружить при раке пищевода, исследуя слизистую оболочку на различном расстоянии от опухоли. Эти изменения, по-видимому, являются основными этапами морфогенеза рака пищевода, что подтверждается динамическими наблюдениями, проведенными в районах Китая с повышенной заболеваемостью раком пищевода.
Предраковые изменения в многослойном плоском эпителии пищевода принципиально не отличаются от аналогичных изменений в шейке матки. Гистологическими критериями дисплазии являются усиление пролиферации и нарушение дифференцировки клеток. Количество базальных клеток, которые в норме занимают не более 15% толщины эпителиального пласта, при дисплазии увеличивается, клетки становятся более крупными, полиморфными, увеличивается число митозов. В зависимости от выраженности клеточных изменений и степени их распространения в эпителиальном пласте различают слабую» умеренную и тяжелую дисплазию. Выраженные полиморфизм и атипия клеток, большое количество митозов, утрата полярности расположения клеток и деления на слои при сохранении базальной мембраны характерны для внутриэпителиального рака.
В тех случаях, когда базальная мембрана не прослеживается, имеется тенденция к погружному росту и отшнуровка эпителиальных комплексов, изменения должны расцениваться как начало инвазивного рака.
При гистологическом исследовании, особенно по материалу эндоскопической биопсии, бывает трудно дифференцировать диспластические (предраковые) изменения и реактивную гиперплазию базальных клеток, которая может наблюдаться, например, при рефлюкс-эзофагите.
Трудности возникают также при дифференциальной диагностике тяжелой дисплазии, карциномы in situ и инвазивного рака. Для уточнения характера процесса необходимы динамическое наблюдение за такими больными и повторные биопсии.
Основная масса форм плоскоклеточного рака пищевода, видимо, развивается из покровного эпителия. Другим источником развития рака пищевода могут быть слизистые железы, в которых при хроническом гастрите также наблюдают атрофические и гиперпластические изменения, образование кист, пролиферацию резервных клеток, плоскоклеточную метаплазию и дисплазию эпителия. Из них могут возникать плоскоклеточный рак, аденокарцинома, железисто-плоскоклеточный рак, а также мукоэлидермоидная опухоль и аденокистозный рак (цилиндрома), аналогичные соответствующим опухолям слюнных желез. Аденокарциномы в пищеводе могут развиваться также от остатков цилиндрического эпителия, выстилающего пищевод на ранних стадиях эмбриогенеза, участков гетеротопии слизистой оболочки желудка.
Аденокарциномы дистальной части пищевода могут развиваться также на фоне так называемого пищевода Баррета. Во многих случаях труден или невозможен дифференциальный диагноз такой аденокарциномы и рака кардиального отдела желудка, прорастающего в пищевод.
Рак пищевода наиболее часто локализуется в средней его трети, затем следует нижняя треть пищевода; верхняя его треть поражается редко. Исключение составляет рак пищевода при синдроме Пламмера—Винсона, который наблюдается преимущественно у женщин 40—45 лет и поражает самый верхний отрезок пищевода.
Макроскопически большинство форм рака пищевода представляет собой изъязвленные блюдцеобразные или эндофитные опухоли, часто циркулярно охватывающие стенку, нередко на значительном протяжении. Экзофитные опухоли встречаются редко. Рак пищевода может распространяться по подслизистому слою далеко за пределы видимого очага опухоли, а также прорастать в прилежащие к пищеводу ткани и органы. Для суждения о степени распространенности процесса и радикальности оперативного вмешательства при исследовании удаленного отрезка пищевода необходимо изучение линий операционных разрезов и глубины прорастания стенки пищевода.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Опухоли пищевода – доброкачественные и злокачественные новообразования, возникающие из различных слоев пищеводной стенки. Клинически проявляются нарушением глотания, рвотой и отрыжкой, болями и тяжестью за грудиной, ощущением комка в горле, кашлем, исхуданием, анемией. В диагностике используются рентгенография пищевода с контрастированием, эзофагоскопия, эндоскопическая биопсия, обзорная рентгенография органов грудной клетки, МРТ и КТ органов грудной клетки. Лечение доброкачественных опухолей пищевода только хирургическое, злокачественных – комплексное (оперативное, лучевая и полихимиотерапия).
Общие сведения
За термином «опухоли пищевода» практически всегда скрывается рак, так как доброкачественные новообразования этого органа встречаются чрезвычайно редко. В литературе по гастроэнтерологии описано примерно 400 случаев выявления доброкачественных опухолей пищевода, в подавляющем большинстве у мужчин в возрасте около 40 лет. Злокачественные новообразования встречаются намного чаще – рак пищевода занимает седьмое место среди всех опухолей, а по уровню смертности – третье (после онкологических заболеваний легких и желудка). Общая распространенность данного заболевания – 5-6%. Средний возраст выявления онкологии пищевода составляет 60-65 лет. Замечено, что в странах с высокой распространенностью эзофагеального рака имеется тенденция к омоложению этой патологии, выравниванию различий по полу (мужчины и женщины болеют одинаково часто). В последние десятилетия в России отмечается некоторое снижение заболеваемости новообразованиями пищевода.
Классификация опухолей пищевода
Все опухоли пищевода разделяют на две большие группы: доброкачественные (менее 1%) и злокачественные (более 99%). Доброкачественные опухоли классифицируют по гистологическому строению и характеру роста. Гистологически выделяют следующие виды доброкачественных опухолей пищевода: эпителиальные (полипы, аденомы, папилломы), неэпителиальные (липомы, фибромы, ангиомы, миомы, нейрофибромы, хондромы, миксомы и др.). Неэпителиальные опухоли встречаются гораздо чаще. По характеру роста опухоль пищевода может быть внутрипросветной и интрамуральной (внутристеночной).
Злокачественные опухоли пищевода классифицируют по гистологическому строению, расположению, распространенности процесса и т. д. В морфологическом плане выделяют эпителиальные злокачественные новообразования - плоскоклеточный ороговевающий и неороговевающий рак (более 95%), базальноклеточный, переходноклеточный, мукоэпидермоидный и анапластический рак, аденокарцинома (менее 5%); неэпителиальные – саркома, лимфома, меланома.
Классификация TNM систематизирует рак пищевода по следующим критериям:
1. Анатомическая область – шейный отдел пищевода, внутригрудной отдел (верхний, средний, нижний). Если опухоль поражает одновременно пищевод и желудок, то ее локализация определяется исходя из преимущественного поражения органа (более 50% образования находится в пищеводе или желудке). В случаях, когда новообразование равномерно распространяется в обе стороны, опухолью пищевода считают плоскоклеточный и мелкоклеточный рак, недифференцированные опухоли; опухолью желудка – аденокарциному и перстневидноклеточный рак.
2. Вовлечение в патологический процесс регионарных и отдаленных лимфоколлекторов.
3. Первичная опухоль – какие слои пищевода поражены, есть ли инвазия опухоли в соседние органы и ткани.
4. Степень дифференцировки – высокая, средняя, низкая, недифференцированная опухоль пищевода.
Доброкачественные опухоли пищевода
Симптомы доброкачественных опухолей пищевода
Доброкачественные опухоли пищевода встречаются достаточно редко и насчитывают не более 1% всех новообразований этого органа пищеварения. Львиная доля доброкачественных новообразований - это неэпителиальные опухоли, 70% из которых занимает лейомиома пищевода. Интрапросветные опухоли обычно представлены полипами эпителиального (железистые полипы, папилломы, аденомы) либо мезенхимального (фибромы, липомы, смешанные полипы) происхождения. В отдельную группу выделяют такие редко встречающиеся опухоли, как миксома, хондрома, гамартома, гемангиома.
Доброкачественные новообразования обнаруживаются во всех отделах пищевода. Обычно это одиночные опухоли на широкой ножке, имеющие гладкую или бугристую структуру. Учитывая достаточно медленный рост таких новообразований, клиническое течение часто бывает бессимптомным, а по достижению опухолью больших размеров появляются признаки непроходимости пищевода и сдавления органов средостения. Однако чаще всего доброкачественные опухоли пищевода являются случайной находкой во время обзорной рентгенографии органов брюшной полости.
Различные виды доброкачественных опухолей имеют определенные особенности клинической и рентгенологической картины. Так, полип пищевода может быть одиночным либо множественным, располагаться в любом отделе органа. Он явно выступает в просвет пищевода, имеет выраженную подвижность за счет широкого основания и ножки. Проявляется дисфагией, периодически возникающей в течение многих лет. Характерным признаком при рентгенологическом исследовании является смещаемый дефект наполнения барием с четкими и ровными контурами, сохраненная рельефность и перистальтика на уровне дефекта.
Папиллома обычно имеет большие размеры, чем полип, дольчатую или бородавчатую поверхность. Склонна к малигнизации. Лейомиомы являются наиболее распространенными опухолями пищевода. Располагаются в нижних и средних его отделах, интрамурально на широком основании. Течение обычно бессимптомное, первыми признаками являются изъязвление опухоли и кровотечение. Липомы встречаются очень редко, не имеют четких клинических отличий от других опухолей.
Диагностика и лечение доброкачественных опухолей пищевода
При проведении рентгенографии пищевода с контрастированием выявляются дефекты наполнения, деформация просвета пищеводной трубки, изменения рельефа слизистой. По рентгенологической картине можно выделить опухоли, полностью находящиеся в просвете органа; растущие как в просвет, так и интрамурально; распространяющиеся из внутренних слоев пищевода кнаружи и сдавливающие его извне. Отличием доброкачественных неэпителиальных опухолей от рака является сохраненный рельеф слизистой и эластичность стенок пищевода на уровне расположения новообразования. Диагноз подтверждается гистологически.
Дифференциальная диагностика проводится с такими заболеваниями, как инородное тело, варикозное расширение вен, злокачественные новообразования пищевода. Для установления правильного диагноза в условиях стационара проводится эзофагоскопия и хромоскопия пищевода, эндоскопическая биопсия тканей опухоли с последующим гистологическим исследованием, обзорная рентгенография грудной полости и рентгенография пищевода с контрастированием. При трудностях диагностики показано проведение магнитно-резонансной или компьютерной томографии органов грудной клетки.
Следует обращать внимание на такие неблагоприятные прогностические признаки, как быстрый рост опухоли, изъязвление, нетипичная форма опухолевого узла, изменение рельефа слизистой и эластичности стенок пищевода в месте локализации новообразования. Данные симптомы могут говорить о малигнизации доброкачественной опухоли и требуют от гастроэнтеролога обязательного назначения эзофагоскопии с биопсией.
Лечение только хирургическое, удаление доброкачественных опухолей пищевода может проводиться эндоскопическим либо полостным способом. В послеоперационном периоде назначается специальная диета, ингибиторы протонного насоса длительным курсом (в случае, если опухоль сопровождалась явлениями эзофагита, недостаточности кардии).
Злокачественные опухоли пищевода
Симптомы злокачественных опухолей пищевода
Злокачественные опухоли пищевода в подавляющем своем большинстве представлены раком. Это новообразование коварно тем, что выявляется обычно уже на поздних стадиях, в связи с чем доля операбельных опухолей составляет не более 30%, а летальность превышает 15%. Достаточно часто встречаются множественные злокачественные опухоли пищевода. По гистологической структуре чаще выявляется плоскоклеточный неороговевающий рак, реже базальноклеточный и ороговевающий, крайне редко – аденокарцинома и другие злокачественные новообразования. Чаще всего злокачественные новообразования локализуются в средней части пищевода, а расположение опухоли в дистальных отделах обычно связано с ее распространением из желудка. Растущая опухоль может поражать трахею, крупные артерии и вены, корень легкого, лимфатический проток, печень и диафрагму. Метастазы при раке пищевода выявляются в 60% случаев.
Злокачественные опухоли пищевода имеют характерную клинику: медленно прогрессирующая дисфагия, боль при глотании, отрыжка, слюнотечение. Часто отмечается отвращение к мясу. На поздних стадиях развиваются симптомы опухолевой интоксикации, гнойный медиастинит. Бессимптомное течение злокачественных новообразований возможно только на начальных этапах развития опухоли.
Саркома пищевода может происходить из соединительной, мышечной, сосудистой, нервной, пигментной тканей; также встречаются смешанные и дисэмбриопластические опухоли. Чаще всего диагностируются лейомиосаркомы. По характеру роста выделяют инфильтрирующие опухоли и полиповидные. Рентгенологические признаки сарком неспецифичны, напоминают доброкачественные опухоли. Отличительной чертой может служить множественность опухолевых узлов.
Злокачественные лимфомы пищевода обычно развиваются при генерализованных онкологических заболеваниях лимфатической ткани. Выделяют опухолевую, инфильтративную и комбинированную формы лимфом. Рентгенологически данные новообразования весьма схожи с эзофагеальным раком, отличает их менее выраженный стеноз пищевода, высокая частота изъязвлений с разрывом пищевода, формированием свищей. Также для лимфом характерно сохранение перистальтики пищеводной стенки над опухолью.
Диагностика и лечение злокачественных опухолей пищевода
Диагностирование злокачественных опухолей пищевода обычно включает в себя эзофагоскопию с биопсией, контрастную рентгенографию пищевода, МРТ и компьютерную томографию. Признаки, которые говорят в пользу злокачественного новообразования: нетипичное изменение рельефности слизистой; неравномерность контуров пищеводной стенки или дефект наполнения, сопровождающийся отсутствием перистальтики на этом уровне; неравномерность просвета пищевода, стеноз пищевода с расширением просвета над опухолевым узлом, подрытые контуры стенки пищевода на границе здоровой ткани и опухоли. Компьютерная томография позволяет с большой вероятностью определить возможности оперативного лечения, составить прогноз для выздоровления и жизни пациента.
Лечение злокачественных опухолей пищевода является весьма сложной задачей. Учитывая тип опухоли, стадию и распространенность процесса, может использоваться оперативное лечение (резекция, экстирпация пищевода с последующей эзофагопластикой), лучевая и полихимиотерапия в различных комбинациях. На поздних этапах заболевания терапия паллиативная (гастростомия).
Прогноз опухолей пищевода
При доброкачественных опухолях пищевода прогноз благоприятный, однако пациенты требуют пожизненного диспансерного наблюдения из-за высокой частоты рецидивов. При злокачественных новообразованиях прогноз зависит от сроков выявления и начала лечения опухоли. При наличии метастазов прогноз для выздоровления и жизни неблагоприятный. Специфической профилактики опухолей пищевода не существует.
Эзофагит - это поражение слизистой оболочки пищевода воспалительного характера. Проявлениями эзофагита могут служить жгучая боль за грудиной, нарушения глотания, изжога, повышенная саливация. Осложнением эзофагита могут явиться пептическая язва, стеноз, перфорация пищевода, болезнь Барретта. Диагностический минимум состоит из проведения эзофагоскопии, эндоскопической биопсии и рентгенографии пищевода. Лечение назначается с учетом этиологии эзофагита; включает диету, медикаментозную терапию, физиотерапию; при необходимости – хирургическое лечение сужения пищевода (бужирование, рассечение рубцовых стриктур и др.).
МКБ-10



Общие сведения
Эзофагит – воспалительное заболевание стенки пищевода острого или хронического течения. При эзофагите воспалительный процесс развивается во внутренней, слизистой оболочке пищевода и при прогрессировании может поражать более глубокие слои. Среди заболеваний пищевода эзофагит является наиболее частым, в 30-40% случаев заболевание может протекать без выраженной симптоматики.
Эзофагиты могут быть следствием различного рода повреждений слизистой пищевода или развиться вследствие инфекционного поражения, гастрита, заброса желудочного сока (иногда с желчью) из желудка. Эзофагит вследствие рефлюкса (заброса) желудочного содержимого выделяется как отдельное заболевание – гастроэзофагеальная рефлюксная болезнь.

Причины эзофагита

Острый эзофагит развивается вследствие повреждающего фактора кратковременного действия:
- острые инфекционные процессы (грипп, грибковое поражение, дифтерия и др.);
- физическое повреждение (ожог, травмирование при введении зонда, повреждение инородными телами);
- химический ожог (повреждение едкими химическими веществами);
- аллергическая реакция на пищевые продукты (как правило, сочетается с другими признаками аллергии).
Наиболее тяжелыми бывают повреждения пищевода после ожогов. В патогенезе инфекционного эзофагита основным фактором развития воспаления считается снижение иммунных свойств организма.
Причины развития хронических эзофагитов также разнообразны:
- алиментарный эзофагит (употребление очень горячей, острой пищи, крепкого алкоголя);
- профессиональный эзофагит (работа, связанная с вдыханием паров едких химических веществ);
- застойный эзофагит (раздражение слизистой остатками скопившейся пищи при разного рода затруднениях эвакуационной функции пищевода);
- аллергический эзофагит (развивается в связи с пищевой аллергией);
- дисметаболический эзофагит (связан с нарушениями обмена – гиповитаминозами, недостаточностью микроэлементов и тканевой гипоксией, продолжительной интоксикацией организма и т. п.);
- идиопатический ульцерозный эзофагит (особая форма хронического воспаления пищевода неясной этиологии, морфологически подобная язвенным колитам и гранулематозу пищевода (неспецифический регионарный стенозирующий эзофагит).
В качестве отдельного заболевания выделяют пептический, или рефлюкс-эзофагит. Он развивается вследствие гастроэзофагеального рефлюкса (заброса желудочного содержимого в пищевод). Иногда сочетается с дуодено-гастральным рефлюксом. Рефлюкс из желудка в пищевод может возникать по следующим причинам: недостаточность кардии (нижнего пищеводного сфинктера); хиатальная грыжа (грыжа пищеводного отверстия диафрагмы); недостаточная длина пищевода.
Классификация
Эзофагит по течению может быть острым, подострым и хроническим. По характеру воспалительного процесса и его выраженности в гастроэнтерологии различают катаральный, отечный, эрозивный, псевдомембранозный, геморрагический, эксфолиативный, некротический и флегмонозный эзофагиты.
Катаральный и отечный эзофагит (наиболее часто встречающиеся формы) ограничиваются гиперемией слизистой и ее отеком. При остром инфекционном процессе, а также химических и тепловых ожогах пищевода возможно развитие эрозий слизистой оболочки (эрозивный эзофагит). При тяжелом течении инфекции нередко происходит развитие некротической формы. Геморрагический эзофагит сопровождается кровоизлияниями в стенку пищевода. При псевдомембранозной форме фиброзный экссудат не сращен с подслизистой тканью в отличие от эксфолиативного эзофагита. Флегмона пищевода, как правило, развивается при повреждении стенки пищевода инородным телом.
По локализации и распространенности воспалительного процесса различают дистальный, проксимальный и тотальный эзофагит. Классификация эзофагита по степени поражения имеет различия для острого и хронического течения заболевания. Острые эзофагиты и ожоги пищевода делят на три степени:
- поверхностное поражение без эрозивных и язвенных дефектов;
- поражение всей толщи слизистой с язвенными дефектами и некрозом;
- поражение распространяется на подслизистые слои, образуются глубокие дефекты с возможностью перфорации стенки пищевода, кровотечения. После залечивания возможно образование рубцовых стриктур.
Хронический эзофагит по выраженности поражения стенки делят на 4 степени согласно классификации Савари и Миллера (классификация эндоскопических признаков хронического эзофагита):
- гиперемия без эрозивных дефектов в дистальных отделах;
- разрозненные мелкие эрозивные дефекты слизистой;
- эрозии слизистой сливаются друг с другом;
- язвенное поражение слизистой, стеноз.
Симптомы острого эзофагита
Выраженность симптоматики при остром эзофагите имеет прямую зависимость от выраженности воспалительного процесса в слизистой пищевода. При катаральной форме эзофагит может протекать без клинических симптомов, только иногда проявляясь повышенной чувствительностью пищевода к горячей или холодной пище. Тяжелые формы эзофагита проявляются выраженным болевым симптомом (острая, сильная, жгучая боль за грудиной, отдающая в шею и спину), расстройством глотания (дисфагия) из за сильной боли, изжогой, повышенным слюноотделением.
В крайне тяжелых случаях – кровавая рвота вплоть до шокового состояния. Тяжело протекающий эзофагит спустя неделю может смениться периодом мнимого благополучия (резкое стухание симптомов, возможно даже употребление твердой пищи), но без адекватного лечения спустя несколько недель (до 3-х месяцев) заживления тяжелых дефектов пищеводной стенки может привести к образованию грубых рубцов и стеноза, что приведет к прогрессированию дисфагии и регургитации пищи.
Симптомы хронического эзофагита
При рефлюкс-эзофагите основным клиническим проявлением является изжога (жжение в области эпигастрия и за грудиной). Как правило, изжога усиливается после приема жирной, острой пищи, кофе, газированных напитков. Переедание также способствует развитию симптоматики. Другими вероятными симптомами могут быть: отрыжка (воздухом, кислым, горьким с примесью желчи); ночью может проявляться регургитация. Нередки присоединения расстройств дыхания, ларингоспазм, бронхиальная астма, частые пневмонии. Симптомы нарушения дыхания проявляются, как правило, ночью, в горизонтальном положении тела.
Хронический эзофагит может протекать с болями за грудиной в районе мечевидного отростка, иррадиирующими в спину и шею. Для хронического эзофагита характерна умеренная выраженность болевого симптома.
У детей первого года жизни недостаточность сфинктера пищевода можно диагностировать по многократным умеренным срыгиваниям сразу после кормления в горизонтальном положении. При упорных срыгиваниях могут развиться симптомы гипотрофии.
Осложнения

Осложнениями эзофагитов могут стать следующие заболевания и состояния:
- пептическая язва пищевода (часто развивается при болезни Баррета), характеризуется образованием глубокого дефекта стенки пищевода, может вести к грубому рубцеванию и укорочению пищевода;
- сужение (стеноз) просвета пищевода (ведет к нарушению прохождения пищи в желудок, снижению массы тела);
- прободение стенки пищевода (перфорация) – осложнение, опасное для жизни, требует срочного хирургического вмешательства;
- гнойные осложнения эзофагита – абсцесс, флегмона (как правило, являются следствием повреждения пищевода инородным телом);
- болезнь Барретта (при продолжительном рефлюкс-эзофагите без адекватного лечения развивается перерождение эпителия пищевода – метаплазия). Пищевод Баррета – предраковое состояние.
Диагностика

Если острый эзофагит проявляется клинической симптоматикой, то диагностика этого заболевания, как правило, не составляет проблем – локализация болевого симптома весьма специфична и характерна. Опрос позволяет выявить вероятную причину развития эзофагита. Для подтверждения диагноза используется:
- Эзофагоскопия. Показывает изменения в слизистой, их выраженность. Проведение эндоскопического обследования пищевода проводят не ранее чем на шестой день после проявления выраженной клинической картины. Показания для эндоскопического обследования выявляются индивидуально. При необходимости берут эндоскопическую биопсию слизистой и исследуют гистологически.
- Манометрия. Нарушения моторной функции пищевода выявляются с помощью эзофагоманометрии.
- Рентген.Рентгенография пищевода позволяет выявить изменения контуров пищевода, изъязвления, отек стенки и скопление слизи.
Лечение эзофагита
Острый эзофагит
Эзофагит вследствие химического ожога требует срочного промывания желудка для удаления химического агента. Для лечения легких форм острых эзофагитов больным рекомендовано воздерживаться от приемов пищи 1-2 дня, медикаментозное лечение заключается в приеме антацидов и препаратов группы фамотидина. После начала питания исключают продукты, способные повредить слизистую (алкоголь, кофе, горячая, острая, грубая пища) и пища, активизирующая выработку желудочного сока (шоколад, жирные продукты). Всем больным эзофагитом рекомендован отказ от курения.
При тяжелом протекании болезни - бережное питание вплоть до отказа от энтерального питания, обволакивающие и гелевые антацидные препараты. При выраженной интоксикации проводится инфузионная терапия с помощью дезинтоксикационных растворов. Для подавления инфекционного процесса показана антибиотикотерапия.
При язвенном эзофагите с выраженным болевым симптомом прописано обезболивание и противопоказано промывание желудка. При безуспешности массированного лечения антибиотиками очагов гнойного воспаления (флегмона, абсцесс) – хирургическая санация. Также показанием к хирургическому лечению эзофагита является развитие тяжелой стриктуры пищевода, не поддающейся дилатации.
Хронический эзофагит
В терапии хронического эзофагита основное значение играет устранение фактора его возникновения. Важнейшей составляющей лечения является строгое соблюдение диеты и режима питания и образа жизни. Рекомендации по диете в период острых клинический проявлений: употребление умеренного количества мягкой протертой пищи комнатной температуры. Исключение из рациона продуктов, оказывающих раздражающее действие на слизистую – острые, жирные, жареные, газированные, алкоголесодержащие продукты. Также исключают пищу, содержащую большое количество клетчатки.
Больным эзофагитом необходимо отказаться от курения и приема лекарственных препаратов, влияющих на тонус сфинктера пищевода (седативные препараты, транквилизаторы, теофиллин, простагландины и т. п.). Также следует отказаться от приемов пищи не менее чем за полтора-два часа до сна, не принимать горизонтальное положение после еды, не проводить много времени наклонясь. Спать рекомендуется на приподнятом изголовье. Терапия хронического эзофагита:
- препараты, снижающие кислотность желудочного сока (антациды – оптимальным выбором являются гелевые антациды с анестетиками, ингибиторы протоновой помпы, блокаторы Н2-гистаминовых рецепторов);
- препараты, усиливающие тонус кардии (нижнего сфинктера пищевода и ускоряющие продвижение пищевого комка из желудка в двенадцатиперстную кишку (блокаторы дофа-рецепторов и холиномиметики).
- при рефлюкс-эзофагите хороший результат дает амплипульстерапия;
- снижение болевого синдрома достигается сеансами электрофореза ганглиоблокаторов;
- грязелечение и бальнеотерапия.
При тяжелом течении рефлюкс-эзофагита со стриктурами, язвами и стенозом физиотерапия противопоказана. Операции при стенозе пищевода заключаются в эндоскопическом рассечении стриктур, расширении или бужировании пищевода. По показаниям проводится резекция и пластика пищевода.
Прогноз и профилактика
При отсутствии осложнений (стеноз, перфорации, кровотечение, воспаление средостения и т. п.) прогноз благоприятен. Важным фактором в перспективе излечения эзофагита является строгое соблюдение режима питания, образа жизни и рекомендаций по диете.
Профилактика эзофагитов подразумевает избегание причин его развития – ожогов горячей пищей, химическими веществами, повреждений инородными телами и т. п. Профилактика хронического эзофагита – регулярное диспансерное обследование у гастроэнтеролога и при необходимости – лечение. Больным хроническим эзофагитом в качестве профилактики обострений показано санаторно-курортное лечение.

Наиболее распространенными заболеваниями пищевода являются гастроэзофагеальная рефлюксная болезнь (ГЭРБ), грыжа пищеводного отверстия диафрагмы. Значительно реже встречаются ахалазия кардии, варикозное расширение вен и дивертикулы пищевода.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) , часто называемая также рефлюкс-эзофагит, возникает из-за регулярного забрасывания (рефлюкса) кислого содержимого желудка в пищевод и повреждения нижних отделов пищевода под воздействием соляной кислоты и расщепляющего белки фермента пепсина.
Причинами рефлюкса является повреждение или функциональная недостаточность специальных запирательных механизмов, расположенных на границе пищевода и желудка. Факторами, способствующими развитию болезни, являются стресс; работа, связанная с постоянным наклоном туловища вниз; ожирение; беременность; а также прием некоторых лекарственных средств, жирная и острая пища, кофе, алкоголь и курение. Часто ГЭРБ развивается у людей с грыжей пищеводного отверстия диафрагмы.
Грыжа пищеводного отверстия диафрагмы – это смещение в грудную полость через пищеводное отверстие диафрагмы нижней части пищевода, части желудка, а иногда и петель кишечника. Заболевание способствует забрасыванию кислого содержимого желудка в пищевод, поэтому основным его симптомом является изжога. Грыжа существует у каждого двадцатого взрослого человека, а в возрасте старше 50-ти лет – у каждого второго.
Причиной возникновения грыжи может быть ослабление связочного аппарата. Она присутствует у 5% всего взрослого населения и примерно у 50% – в возрасте старше 50 лет (возрастное ослабление связочного аппарата), чаще встречается у нетренированных, астеничных людей. Другим фактором, провоцирующим развитие этого заболевания, является значительное повышение внутрибрюшного давления вследствие выраженного метеоризма, беременности, травм или крупных опухолей брюшной полости, приступов неукротимой рвоты или упорного кашля (например, у больных хроническим обструктивным бронхитом). Дискенизия (нарушения перистальтики) органов пищеварительного тракта, в частности пищевода, которые часто наблюдаются на фоне хронических воспалительных заболеваний язвенная
болезнь желудка и 12-типерстной кишки, гастродуоденит, панкреатит холецистит), также может приводить к развитию грыжи.
Ахалазия кардии - это хроническое нервно-мышечное заболевание, при котором не происходит рефлекторного раскрытия отверстия на границе желудка и пищевода при глотании. В результате нарушается перистальтика и тонус пищевода и прохождение пищи по нему.
Основными симптомами заболевания являются нарушение проглатывания пищи (дисфагия), срыгивание и пищеводная рвота и боль за грудиной. Дисфагия вначале возникает эпизодически на фоне стресса или при поспешной еде, затем становится постоянной и препятствует прохождению по пищеводу не только твердой пищи, но и жидкой (бульон, сок, вода). Невозможность проглотить пищу приводит к пищеводной рвоте – обратному поступлению пищи в глотку и рот при наклоне туловища и в положении лежа, особенно ночью во время сна. Это опасно, так как существует риск попадания содержимого пищевода в дыхательные пути, что может вызвать кашель, приступы удушья, аспирационную пневмонию.
Варикозное расширение вен пищевода происходит вследствие нарушений оттока крови из вен пищевода. Вены пищевода расширяются, извиваются и удлиняются, образуя варикозные узлы, стенки таких сосудов истончаются и могут разрываться, вызывая кровотечение.
Причиной этого нарушения наиболее часто является портальная гипертензия, то есть повышение давления в бассейне воротной вены. Причинами его могут быть заболевания печени (цирроз, хронический гепатит, опухоли, туберкулез, эхинококкоз и др.), тромбоз или сдавление воротной вены (опухоли, кисты, спайки, камни желчных протоков.
Дивертикул пищевода – это мешковидное выпячивание его стенки. Воспаление дивертикулов (дивертикулит) может стать причиной их нагноения, перфорации и, следовательно, кровотечения, стеноза (сужения просвета) пищевода, формирования свищей и перерождения их в злокачественную опухоль.
Эти образования могут быть врожденными или развиваться вследствие хронического воспаления в области средостения, поражений лимфатических узлов, при туберкулезе или гистоплазмозе – грибковом заболевании легких. Дивертикулы нижней части пищевода – частые осложнения рефлюкс-эзофагита, ахалазии кардии.
Злокачественное новообразование пищевода занимает шестое место по распространенности среди онкологических заболеваний. Развивается наиболее часто из эпителиальных клеток его слизистой оболочки (карцинома), реже наблюдается плоскоклеточный рак, редко – аденокарцинома, крайне редко – другие виды злокачественных новообразований.
Поскольку рак возникает, как правило, на фоне хронического эзофагита, то заболевания, при которых наблюдается длительный воспалительный процесс в пищеводе, современная медицинская наука рассматривает как предрасполагающие к онкологическому заболеванию, или предраковые состояния. К таким состояниям относят пищевод Баррета, гиперпластический эзофагит и т.д. Способствуют развитию заболевания особенности питания, в частности, употребление горячей и грубой пищи, маринадов, алкоголя; дефицит витаминов, особенно В2 и А, а также железа, меди и цинка; вредные привычки (курение, алкоголь, жевание табака). Большой риск связан с сочетанием табака и алкоголя.
К доброкачественным опухолям пищевода относят: полипы, папилломы и аденомы (растут из эпителиальных клеток), липомы и миомы (растут из жировых и мышечных тканей соответственно).
Доброкачественные новообразования обнаруживаются во всех отделах пищевода. Обычно это одиночные опухоли на широкой ножке, имеющие гладкую или бугристую структуру. Учитывая достаточно медленный рост таких новообразований, они могут никак не проявляться, а по достижению опухолью больших размеров появляются признаки непроходимости пищевода и сдавления органов средостения. Однако чаще всего доброкачественные опухоли пищевода являются случайной находкой во время эзофагогастродуоденоскопии.
Эзофагогастродуоденоскопия позволяет не только выявить заболевания пищевода, но и контролировать процесс лечения, а иногда и непосредственно лечить некоторые болезни пищевода. Для точной диагностики необходимо, чтобы процедуру проводил высококвалифицированный специалист на современном оборудовании. В нашей Клинике мы используем самое современное оборудование и приглашаем на работу ведущих врачей-эндоскопистов. Кроме того при желании у нас Вы сможете пройти процедуру эзофагогастродуоденоскопии под общим наркозом, не испытывая не малейшего дискомфорта.
Мезенхимальные новообразования желудочно-кишечного тракта представлены большой группой опухолей, исходящих из различных типов тканей. Эти опухоли обладают различным злокачественным и метастатическим потенциалом, разнятся подходами к лечению и последующему наблюдению. Гастроинтестинальная шваннома — медленнорастущее доброкачественное образование, которое может быть локализовано в любом отделе ЖКТ. При этом шванномы исходят из межмышечного нервного сплетения и требуют открытого хирургического лечения в объеме резекции. В данном обзоре литературы рассмотрены вопросы диагностики гастроинтестинальных шванном различной локализации и подходы к их лечению.
Enter the password to open this PDF file:
Полный текст статьи:
Шванномы ЖКТ — крайне редкие опухоли нейрогенного происхождения, развивающиеся из шванновских клеток, входящих в состав оболочки периферических нервов. В большинстве случаев шванномы желудочно-кишечного тракта развиваются из межмышечного сплетения (Ауэрбаха) [2]. На долю шванном приходится всего 2–6% всех мезенхимальных опухолей, представляющих собой гетерогенную группу новообразований, которые могут исходить из различных типов тканей [2, 4, 14]. В порядке убывания частоты встречаемости мезенхимальные опухоли ЖКТ также представлены гастроинтестинальными стромальными опухолями (ГИСО), лейомиомами, лейомиосаркомами, нейрофибромами, ганглионейромами, параганглиомами, липомами, зернистоклеточными и гломусными опухолями [2].
Точные показатели заболеваемости гастроинтестинальными шванномами не определены [12]. Но известно, что самая частая локализация шванномы в ЖКТ — желудок (83%), за ней следует тонкая кишка (12%) и наконец ободочная и прямая кишки [2].
Окончательная диагностика шванном желудочно-кишечного тракта основана на гистологическом и иммуногистохимическом исследовании резецированных опухолей (рис. 1, 2, 6 — С). Все гастроинтестинальные шванномы — твердые однородные опухоли, как правило, покрытые оболочкой. Микроскопически шванномы представлены веретенообразными клетками, переплетающимися пучками или тяжами с нечеткими границами слабобазофильной цитоплазмы и овальными либо вытянутыми ядрами. Клеточно-волокнистые пучки располагаются беспорядочно или формируют своеобразные ритмичные структуры в виде завихрений, параллельных рядов или палисадных структур. Все гастроинтестинальные шванномы иммунореактивны к белку S100, что позволяет дифференцировать их от других мезенхимальных опухолей ЖКТ. Они характеризуются низкой частотой митозов, отсутствием атипичных митотических фигур и ядерной гиперпигментацией. Степень агрессивности зависит от индекса Ki-67 и митотического индекса. В качестве показателя злокачественности рекомендуется использовать индекс Ki-67. Значение более 5% коррелирует с большей агрессивностью опухоли, а более 10% является показателем злокачественности [2, 7].
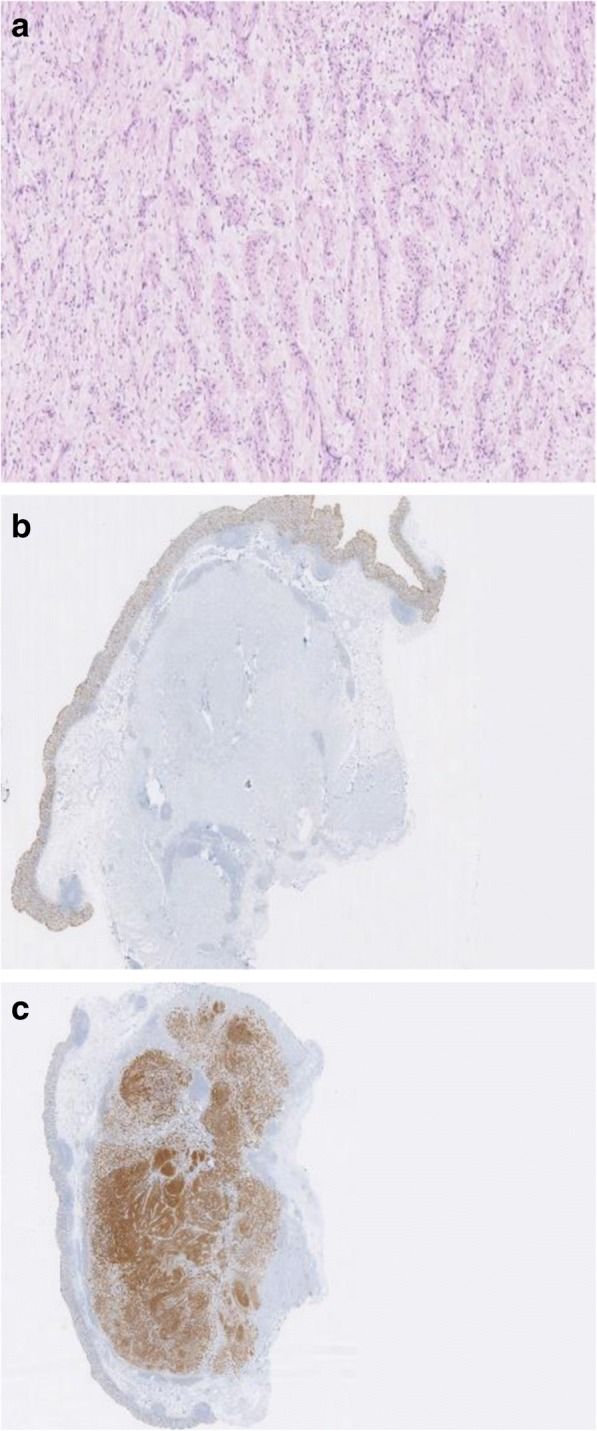
Рисунок 1. Гистологическое и иммуногистохимическое исследование шванномы слепой кишки [2].
A. Гистологическое исследование, окраска гематоксилином и эозином. Опухоль имеет веретеноклеточное строение.
B. Иммуногистохимическое исследование. Опухоль иммунонегативна к CD117.
C. Иммуногистохимическое исследование. Опухоль иммунореактивна к белку S100.
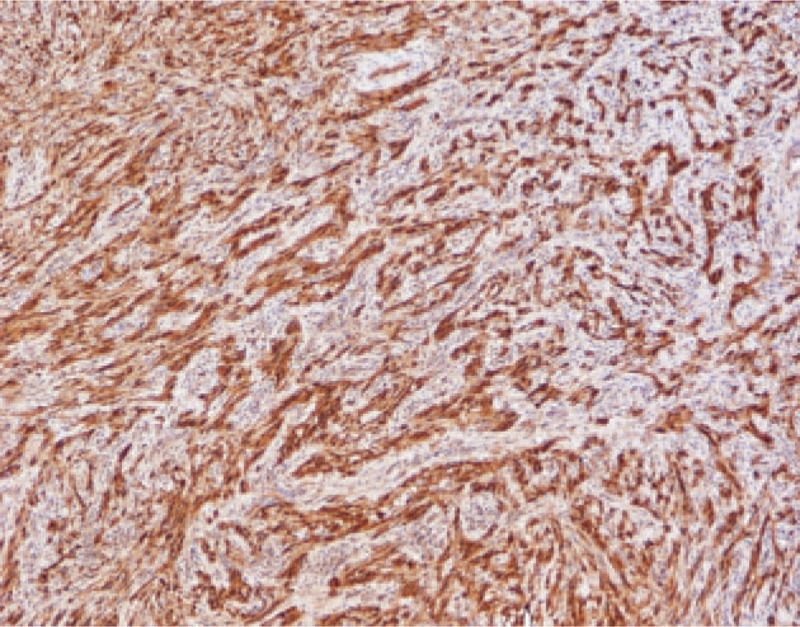
Рисунок 2. Иммуногистохимическое исследование шванномы прямой кишки, сильная иммунореактивность к белку S100 [15].
Шванномы пищевода (рис. 3). Доброкачественные первичные опухоли пищевода редки и составляют примерно 2% всех новообразований данной локализации. Более 80% доброкачественных опухолей пищевода представлено лейомиомами, но в редких случаях могут встречаться и шванномы. Шваннома пищевода чаще развивается у женщин, чем у мужчин, и эти опухоли обычно расположены в верхней и средней трети пищевода. Предоперационная диагностика заболевания сложна, и окончательный диагноз часто устанавливается только после резекции. Лечение шванном пищевода хирургическое. Торакоскопическая энуклеация используется для небольших опухолей диаметром ≤2 см. При опухолях больших размеров, ≥8 см, выполняется резекция пищевода с эзофагогастростомией. Химиотерапия и лучевая терапия неэффективны [5, 8].
Шванномы желудка. Шванномы желудка — редкое заболевание, на их долю приходится лишь 0,2% всех опухолей данной локализации [9, 10]. Voltaggio с соавторами подсчитали, что соотношение ГИСО к шванномам в желудке составляет примерно 45:1 [7]. Хотя эти опухоли очень схожи внешне, подходы к лечению и прогноз у них совершенно разные. Поэтому необходима тщательная дифференциальная диагностика данных заболеваний [9, 14].
Шванномы желудка у женщин встречаются несколько чаще, чем у мужчин, в соотношении 1,4:1. Средний возраст заболевших — 58 лет. Шванномы желудка могут протекать бессимптомно или проявляться слабой диспепсией. В случаях изъязвления возможно развитие кровотечения [10].
В большинстве случаев шванномы желудка — случайная находка при скрининговой гастроскопии. Эндоскопически это типичные субэпителиальные образования, покрытые визуально неизмененной слизистой (рис. 4, 6 — А) [10]. Компьютерная томография, магнитно-резонансная томография и позитронно-эмиссионная томография предоставляют ограниченную информацию для дифференциации шванномы от других мезенхимальных опухолей в желудке [11]. Эндосонография с тонкоигольной биопсией является ценным диагностическим методом. Эхоскопически шванномы желудка — гетерогенные гипоэхогенные поражения с четкими краями и краевым усилением, которые расположены в собственном мышечном слое. Эхогенность этих поражений ниже, чем у окружающего нормального мышечного слоя (рис. 5, 6 — В). Кистозные изменения и кальцификации встречаются редко. Эти особенности могут быть полезны для дифференциальной диагностики шванномы желудка от других мезенхимальных опухолей, особенно ГИСО [14]. Шваннома может быть диагностирована с помощью эндосонографии с тонкоигольной биопсией (ЭУС-ТИП), если получен достаточно большой образец. Однако ЭУС-ТИП не является идеальным методом для диагностики шванномы. Его чувствительность, по данным Takasumi и соавторов, составляет 66,5% [11].
В некоторых случаях возможно проведение эндоскопической резекции шванномы желудка. Но учитывая тот факт, что данные опухоли чаще исходят из межмышечного нервного сплетения, методом выбора является хирургическая резекция. Рецидивы этих опухолей также встречаются редко и в основном связаны с неполной резекцией [10].
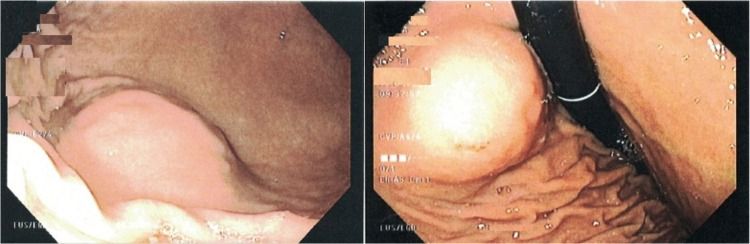
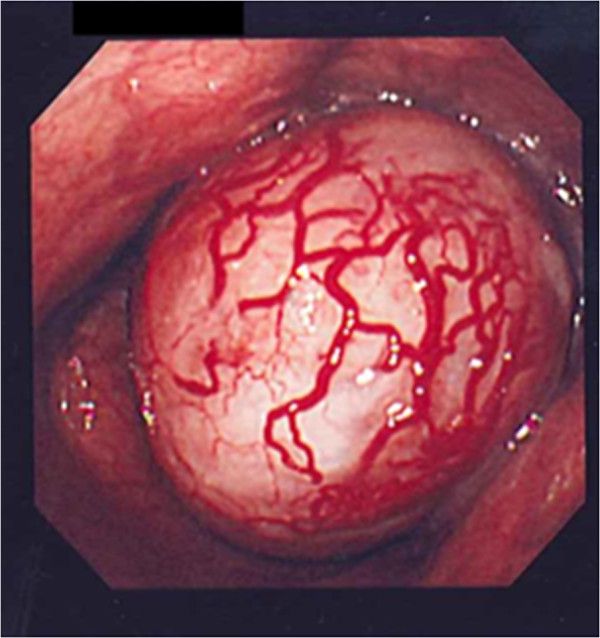
Рисунок 4. Шваннома желудка [10].
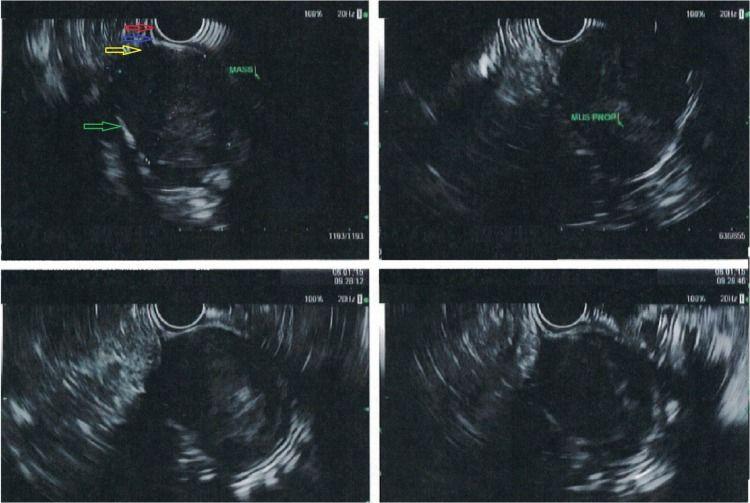
Рисунок 5. Эндосонография шванномы желудка [10]. В теле желудка лоцируется образование 3,5×3 см, исходящее из мышечного слоя (желтая стрелка). Дифференцируются другие эхослои стенки желудка: мышечная пластинка слизистой (красная стрелка), подслизистая (синяя стрелка) и серозная (зеленая стрелка) оболочки.
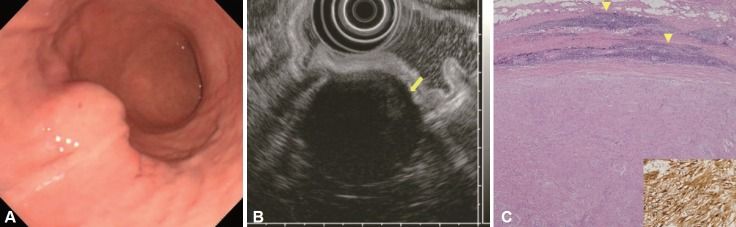
A. На гастроскопии выявлено субэпителиальное образование в средней трети тела желудка.
B. При ЭУС опухоль имеет гетерогенную гипоэхогенную по отношению к окружающему мышечному слою структуру с краевым усилением эхосигнала (указано стрелкой). Размеры образования 30×35 мм.
С. При микроскопическом исследовании (окраска гематоксилином и эозином, увеличение 40x) выявлена ограниченная опухоль, состоящая из веретенообразных клеток разного типа организации с лимфоидной инфильтрацией (указаны стрелками). При иммуногистохимическом исследовании клетки опухоли положительны к S100 (увеличение 400 x).
Шванномы двенадцатиперстной кишки. Шванномы данной локализации в основном расположены во второй или третьей части ДПК. Гендерных различий в заболеваемости шванномами двенадцатиперстной кишки не существует. Выявляются на пятом или шестом десятилетии жизни. Дуоденальные шванномы обычно протекают бессимптомно и выявляются случайно. Наиболее распространенные симптомы — кишечное кровотечение и дискомфорт в животе. Эндоскопически имеют вид типичного субэпителиального образования. Эндосонографические признаки точно не определены из-за редкости данного заболевания [4], однако, по всей видимости, являются общими для всех гастроинтестинальных шванном (рис. 7).
Дуоденальные шванномы обычно доброкачественные, а злокачественная трансформация происходит крайне редко. Гистологические критерии определения степени злокачественности шванномы на светооптическом уровне отсутствуют, а метастатический потенциал пока не известен. Поэтому иногда требуется тщательное наблюдение после операции [4].
Метод лечения — полная хирургическая резекция, объем которой зависит от размера опухоли, ее локализации и гистологических особенностей. Оптимальное лечение злокачественной шванномы полностью еще не определено. Роль химиотерапии и лучевой терапии остается неясной. Неполная резекция может быть связана с местным рецидивом. Таким образом, наиболее важный прогностический фактор — границы резекции [4].

Рисунок 7. Шваннома луковицы двенадцатиперстной кишки [4].
A. Дуоденоскопия: в луковице ДПК визуализируется субэпителиальное образование, покрытое неизмененной слизистой.
B. Эндосонография: опухоль имеет гетерогенную гипоэхогенную структуру с ровными четкими контурами, исходящую из мышечного слоя. Размеры образования 15×7 мм.
Колоректальные шванномы. Распространенность колоректальных шванном несколько больше среди женщин (59%), средний возраст заболевших — 60–65 лет, но могут возникнуть в любом возрасте [7]. Наиболее часто шваннома встречается в слепой (рис. 8) и восходящей ободочной кишках (30,5%), за которыми следуют сигмовидная (28,1%), прямая кишка (21,1%) (рис. 10), нисходящая ободочная кишка (8,3%), поперечная ободочная кишка (5,3%) и аппендикс (1,1%) (рис. 9). Шванномы в большинстве случаев протекают бессимптомно и являются случайными находками при проведении скрининговой колоноскопии. Таким образом, для данной группы пациентов используются стандартные рекомендации по подготовке к колоноскопии. Применение малообъемного препарата полиэтиленгликоля с аскорбатным комплексом (МОВИПРЕП ® ) так же эффективно, как и стандартного полиэтиленгликоля в объеме 4 л при условии, что они используются в одинаковом режиме. Отмечено, что препарат полиэтиленгликоля с аскорбатным комплексом (МОВИПРЕП ® ) лучше переносится, вызывая меньше нежелательных явлений в виде тошноты и рвоты, и особенно удобен для подготовки амбулаторных пациентов. В настоящее время рекомендуется использование двухэтапной подготовки или одноэтапной — в день исследования, так как на качество подготовки влияет время, прошедшее с момента приготовления до осмотра. Оптимальным интервалом является 4 часа, максимальным — 8 часов [3, 6, 13].
Эндоскопически колоректальные шванномы имеют типичный вид подслизистой опухоли с гладкой поверхностью, покрытой визуально неизмененной слизистой, и только в редких случаях (6,8%) имеют изъязвление [2, 7]. Как и при других субэпителиальных опухолях, щипцовая биопсия чаще всего неинформативна [2, 15].
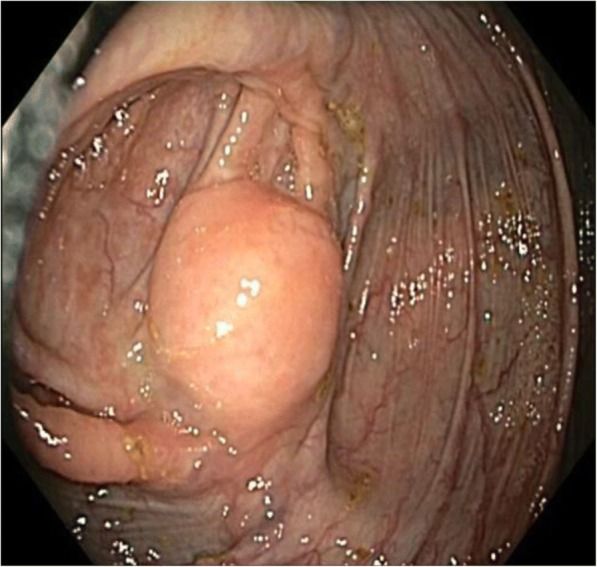
Рисунок 8. Шваннома слепой кишки [2].
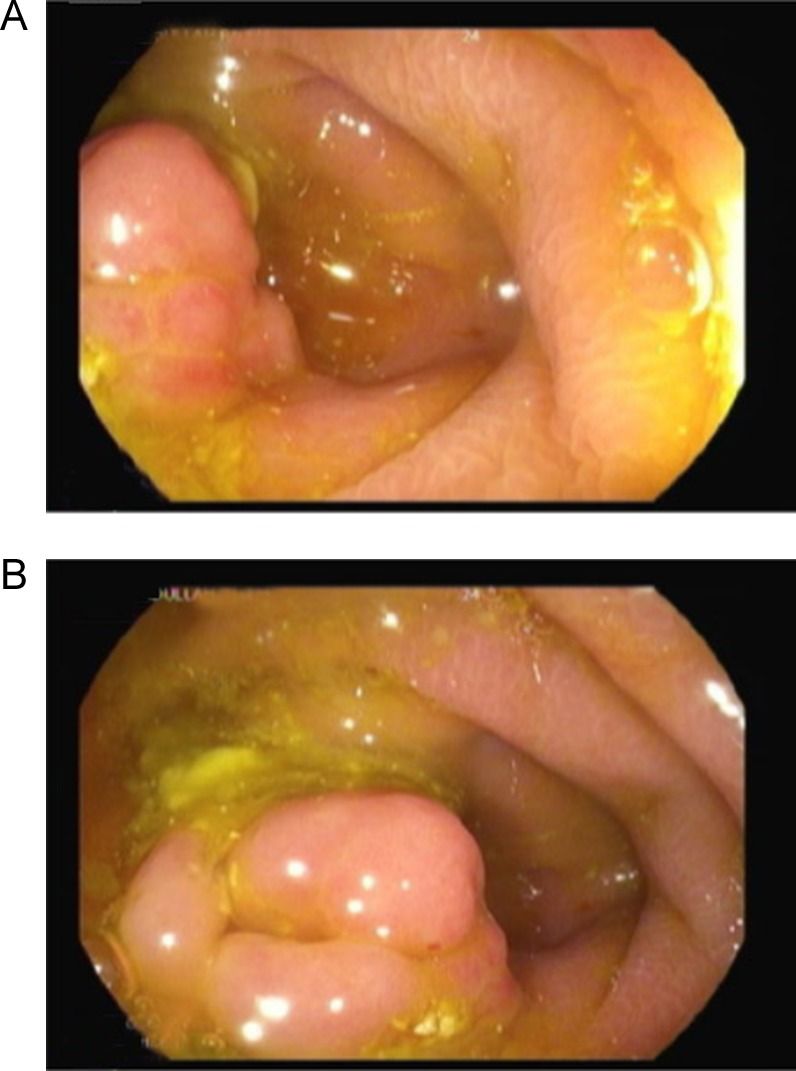
Рисунок 9. Шваннома аппендикса [1].
В устье аппендикса выявлено субэпителиальное образование.
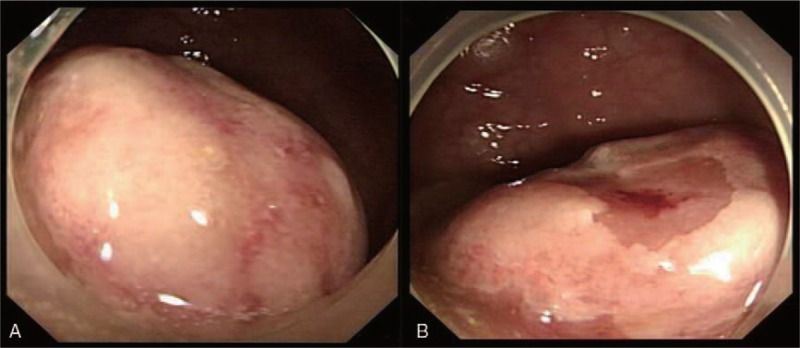
Рисунок 10. Шваннома прямой кишки [15].
Колоректальные шванномы являются доброкачественными в ≥98% случаев. Но так как опухоли исходят из межмышечного нервного сплетения, лучший метод лечения — полная хирургическая резекция [2, 10].
Шванномы желудочно-кишечного тракта — это крайне редкие субэпителиальные образования. В большинстве случаев протекают бессимптомно и являются случайной находкой при проведении эндоскопического исследования. На основании эндоскопической картины или щипцовой биопсии дифференциальная диагностика шванномы от других мезенхимальных опухолей желудочно-кишечного тракта невозможна. Окончательная диагностика гастроинтестинальных шванном основана на иммуногистохимическом исследовании удаленных опухолей. Шванномы данной локализации отличаются медленным ростом и доброкачественным течением. На сегодняшний день метод лечения шванном — хирургическая резекция. Развитие местных рецидивов связано с неполным удалением первичной опухоли.
Список литературы:
1. Alshamrani A.M., Sairafi R.A., Alzahrani A.M., Abdel-Raheem M. Appendicular schwannoma presenting as vague abdominal pain. J Surg Case Rep. 2018. Jul 3; 2018 (7): rjy149. eCollection 2018 Jul. PMID: 29992004. PMCID: PMC6031008. DOI: 10.1093/jscr/rjy149.
4. Kahng D.H., Kim G.H., Park S.G., Lee S.J., Park D.Y. A Rare Duodenal Subepithelial Tumor: Duodenal Schwannoma. Clin Endosc. 2018. May 15. PMID: 29764009. DOI: 10.5946/ce.2018.050.
6. Kojecky V., Dastych M., Zadorova Z., Varga M., Hajer J., Kment M., Kroupa R., Kunovska M., Matous J., Misurec M., Hep A., Kianicka B., Latta J. [Effective bowel preparation before coloscopy — low-volume PEG in the divided dose regimen]. Vnitr Lek. 2016. Apr; 62 (4): 249–254. PMID: 27250601.
8. Mishra B., Madhusudhan K.S., Kilambi R., Das P., Pal S., Srivastava D.N. Malignant Schwannoma of the Esophagus: A Rare Case Report. Korean J Thorac Cardiovasc Surg. 2016. Feb; 49 (1): 63–66. Epub 2016 Feb 5. PMID: 26889451. PMCID: PMC4757402. DOI: 10.5090/kjtcs.2016.49.1.63.
9. Sanei B., Kefayat A., Samadi M., Goli P., Sanei M.H., Khodadustan M. Gastric Schwannoma: A Case Report and Review of the Literature for Gastric Submucosal Masses Distinction. Case Rep Med.2018. Apr 10; 2018: 1230285. eCollection 2018. PMID: 29849652. PMCID: PMC5914132. DOI: 10.1155/2018/1230285.
10. Sunkara T., Then E.O., Reddy M., Gaduputi V. Gastric schwannoma-a rare benign mimic of gastrointestinal stromal tumor. Oxf Med Case Reports. 2018. Mar 12; 2018 (3): omy002. eCollection 2018 Mar. PMID: 29564143. PMCID: PMC5846295. DOI: 10.1093/omcr/omy002.
11. Takasumi M., Hikichi T., Takagi T., Suzuki R., Watanabe K., Nakamura J., Sugimoto M., Kikuchi H., Konno N., Waragai Y., Asama H., Obara K., Ohira H. Efficacy of endoscopic ultrasound-guided fine-needle aspiration for schwannoma: six cases of a retrospective study. Fukushima J Med Sci. 2017. Aug 9; 63 (2): 75–80. Epub 2017 Jul 5. PMID: 28680005. PMCID: PMC5597526. DOI: 10.5387/fms.2015-21.
12. Wang W.B., Chen W.B., Lin J.J., Xu J.H., Wang J.H., Sheng Q.S. Schwannoma of the colon: A case report and review of the literature. Oncol Lett. 2016 Apr; 11 (4): 2580–2582. Epub 2016 Feb 24. PMID: 27073520. PMCID: PMC4812459. DOI: 10.3892/ol.2016.4271.
13. Xie Q., Chen L., Zhao F., Zhou X., Huang P., et al. (2014) A Meta-Analysis of Randomized Controlled Trials of Low-Volume Polyethylene Glycol plus Ascorbic Acid versus Standard-Volume Polyethylene Glycol Solution as Bowel Preparations for Colonoscopy. PLoS One.9 (6): e99092. DOI:10.1371/journal.pone.0099092.
14. Yoon J.M., Kim G.H., Park D.Y., Shin N.R., Ahn S., Park C.H., Lee J.S., Lee K.J., Lee B.E., Song G.A. Endosonographic Features of Gastric Schwannoma: A Single Center Experience. Clin Endosc.2016. Nov; 49 (6): 548–554. Epub 2016 Mar 15. PMID: 26975861. PMCID: PMC5152784. DOI: 10.5946/ce.2015.115.
15. Zhang K., Qu S., Li J., Cheng Y., Shi J., Liu T. A case report of rectal schwannoma treated with laparoscopic proctectomy. Medicine (Baltimore). 2018. Feb; 97 (7):e9866. PMID: 29443751. PMCID: PMC5839841. DOI: 10.1097/MD.0000000000009866.
Читайте также:

