Осложнения после эндопротезирования коленного сустава свищ что делать
Обновлено: 23.04.2024
Данная группа заболеваний является серьезной, не решенной окончательно проблемой современной ортопедии. Единые стандарты лечения данной патологии отсутствуют. Подходы к лечению базируются на личном опыте отдельных авторов и клиник. Мы бы хотели осветить принципиальные моменты диагностики данной группы заболеваний и поделиться личным опытом их лечения.
Частота встречаемости септических артритов составляет от 2 до 10 случаев на 100 000 населения. Преобладает поражение коленного сустава (до 55%), затем следуют тазобедренный и голеностопный суставы. Страдают подобными заболеваниями преимущественно дети и пожилые люди.
Каковы предпосылки развития гнойных артритов? Это травмы области суставов, дегенеративные и ревматоидные заболевания суставов, выполнение инъекций в области сустава, артроскопических вмешательств, эндопротезирование сустава в анамнезе, гнойно-воспалительные заболевания, трофические язвы дистальных отделов конечностей, инфекции, передающиеся половым путем, системный прием препаратов глюкокортикоидов.
Клиническая картина заболевания. Проявления заболевания достаточно отчетливы при поражении суставов, близко расположенных к коже (локтевой, коленный, голеностопный). Это отек тканей в области сустава, местное покраснение и повышение температуры кожи. При поражении крупных, глубоко лежащих суставов, таких как плечевой и тазобедренный, местные изменения могут быть не выражены, и пациента будет беспокоить только боль в области сустава. Повышение температуры тела также может появиться не сразу. На представленной ниже фотографии типичная клиническая картина артрита коленного сустава: контуры правого коленного сустава сглажены, сустав увеличен в объеме.

Лабораторная диагностика заболевания. В объем обследования пациента с подозрением на гнойный процесс обязательно должны входить клинический анализ крови с подсчетом лейкоцитарной формулы и скорости оседания эритроцитов, анализ крови на С-реактивный белок. Среди лабораторных показателей хочется отдельно остановиться на уровне прокальцитонина. Прокальцитониновый тест в настоящее время является наиболее объективным методом определения генерализации бактериального инфекционного процесса. Динамическое повышение данного показателя в анализах крови пациента является показателем распространения гнойного процесса за пределы сустава, развития сепсиса.
Инструментальная диагностика: - рентгенография пораженного сустава; - спиральная компьютерная томография сустава; -пункция сустава с последующими микроскопией и посевами отделяемого для определения инфекционного агента и его чувствительности к антибиотикам. Данная манипуляция должна быть выполнена до начала антибиотикотерапии.
Лечение. При лечении гнойно – воспалительных заболеваний суставов нашей задачей является скорейшее купирование воспалительного процесса и, по возможности, сохранение функции сустава. По данным различных авторов, при гнойном процессе в суставе, суставной хрящ поражается на 4 – 6 сутки от начала заболевания и окончательно отмирает на 4-й неделе заболевания, после чего эффективность сохраняющих сустав операций резко снижается. При отсутствии признаков поражения костной ткани в настоящее время предпочтение отдается операциям, сохраняющим сустав. При поражении поверхностно расположенных суставов на ранних стадиях заболевания возможно использование пункционных методов и антибиотикотерапии широкого спектра действия. При неэффективности пункционных методов в течение 48 часов от начала заболевания рекомендовано выполнение дренирования сустава. В идеале – к этому склоняется большинство современных авторов – использование артроскопических методик.
Наш личный опыт: лечение септического артрита голеностопного сустава у 19-летнего пациента путем 3-х недельного проточно – промывного дренирования. Промывная система была установлена через доступы до 2-х см. Результат лечения – полное купирование воспалительного процесса, выздоровление пациента. За два года последующего наблюдения рецидива заболевания не отмечено. При распространении гнойного процесса на костную ткань выполняется удаление нежизнеспособных тканей и стабилизация области сустава с помощью аппарата наружной фиксации. В результате воспалительный процесс купируется и формируется артродез пораженного сустава, т. е сращение между костями, формирующими сустав, что обеспечивает в последующем адекватную опорную функции конечности.
Личный опыт: Пациентка, 81 год, поступила в клинику с болями в области тазобедренного сустава, беспокоившими в течение 4х месяцев, после падения с высоты роста. В течение недели перед поступлением в клинику боли неуклонно нарастали, нарушилась опорная функция конечности. Повышения температуры тела не отмечала, постоянно принимала противовоспалительные препараты (мовалис) в больших дозах.
Рентгенограмма при поступлении.

Определяются зоны деструкции в теле подвздошной кости, в головке бедренной кости.
При пункции тазобедренного сустава – густое гнойное содержимое.
В экстренном порядке пациентка прооперирована: вскрыт сустав, санирован очаг остеомиелита, удалена головка бедренной кости, сустав фиксирован стержневым внеочаговым аппаратом. Установлена система проточно–промывного дренирования. В течение 6ти недель пациентке проводилась терапия антибиотиками широкого спектра действия. На фоне лечения купированы боли в области тазобедренного сустава, в клинико–лабораторных тестах – снижение показателей воспалительного ответа.
Аппарат внешней фиксации демонтирован через 8 недель после операции. Тазобедренный сустав фиксирован ортопедическим фиксатором. Через 3 месяца после операции фиксатор снят. Пациентка самостоятельно ходит с полной нагрузкой на оперированную ногу. Воспалительный процесс купирован.
Результаты спиральной компьютерной томографии костей таза пациентки через 3 месяца после операции.

Определяются признаки формирования сращения между бедренной костью и телом подвздошной кости. Данное сращение обеспечивает в будущем адекватную опорную функцию конечности.
В настоящее время серьезной проблемой современной ортопедии являются гнойные осложнения эндопротезирования. По данным ЦИТО за 2012 год в России выполнено 80 000 эндопротезирований крупных суставов. Соотношение первичных и ревизионных эндопротезирований составило 9:1. Частота осложнений при первичном эндопротезировании крупных суставов составила 2,4%. Из них 40,6% это инфекционные осложнений. Частота осложнений при ревизионном эндопротезировании составила 12,9%. Из них 51,4% - инфекционные осложнения.
При ранних глубоких нагноениях после эндопротезирования тазобедренного сустава возможно сохранение эндопротеза. Хроническая инфекция области эндопротеза и деструктивный остеомиелит у взрослых, развившийся на фоне септического артрита являются показаниями для радикальной хирургической санации, удаления компонентов эндопротеза, некротизированных участков костной ткани.
Подходы к выполнению операций при нагноениях эндопротезов разнятся. Мы в своей практике используем артикулирующие спейсеры (временные «заменители» протеза) - индивидуально изготавливаемые из костного цемента с добавлением антибиотиков. Использование данных приспособлений позволяет сохранить длину конечности, обеспечить ходьбу с опорой на оперированную ногу, улучшить качество жизни пациента в послеоперационном периоде, облегчает последующее реэндопротезирование.
Клинический пример: Пациентка 65 лет. В анамнезе тотальное эндопротезирование тазобедренного сустава, выполненное заграницей в 2002 году. Динамического наблюдения за суставом не осуществлялось. В течение последних двух лет с 2012 года беспокоят периодические боли в области тазобедренного сустава. С сентября 2013 года, в течение 3х месяцев отмечает постепенное усиление болей. За две недели до поступления в клинику на дому осуществлялся массаж области сустава, иглорефлексотерапия. После курса указанных процедур отмечено резкое усиления болей, подъем температуры тела до 39 градусов.
Рентгенограммы пациентки при поступлении.


Определяются признаки деструкции вертлюжного компонента протеза, признаки деструкции костной ткани по ходу бедренного компонента протеза.
При пункции сустава получено густое гнойное содержимое Выполнено вскрытие полости сустава, удаление компонентов эндопротеза, радикальная обработка очага остеомиелита. При ревизии выявлено гнойное расплавление проксимального отдела бедренной кости. Установлен артикулирующий спейсер.
Рентгенограмма пациентки после операции.
Модель проксимального отдела бедра сформирована из костного цемента с антибиотиками, армирована проксимальным бедренным стержнем.
Послеоперационное течение гладкое. Воспалительный процесс купирован. Планируется выполнение реэндопротезирования. Данный клинический пример ярко демонстрирует необходимость своевременного обращения к специалисту травматологу – ортопеду и недопустимость выполнения физиотерапевтических процедур без предварительной адекватной диагностики причины болей в области суставов.
Специалисты Ортоцентра владеют всеми методами оперативного лечения гнойно – воспалительных заболеваний суставов и готовы прийти к Вам на помощь.
Гной в послеоперационной ране говорит о развитии инфекционных осложнений. В ортопедии и травматологии они тяжело поддаются лечению и приводят к инвалидизации пациентов. Парапротезные инфекции обусловливают увеличение срока пребывания в стационаре и требуют затрат на борьбу с ними.

Выделения из ТБС.
Инфекции после эндопротезирования бывают поверхностными или глубокими, острыми или хроническими, развиваться в раннем или позднем послеоперационном периоде. Воспалительный процесс может затрагивать только мягкие ткани нижней конечности или распространяться на прооперированный сустав.
Если после эндопротезирования у вас появился гной в шраме, повысилась температура и возникли боли в ноге – немедленно идите к врачу. Тот осмотрит вас, назначит нужные исследования и выяснит, насколько тяжелое у вас состояние. Вам придется лечь в стационар и пройти курс лечения.
Актуальность проблемы
По разным данным, частота развития ранней парапротезной инфекции после первичной замены крупных суставов составляет 0,3-0,5%, после ревизионной – 9%. Воспалительные процессы выявляют в течение первых трех недель после хирургического вмешательства.
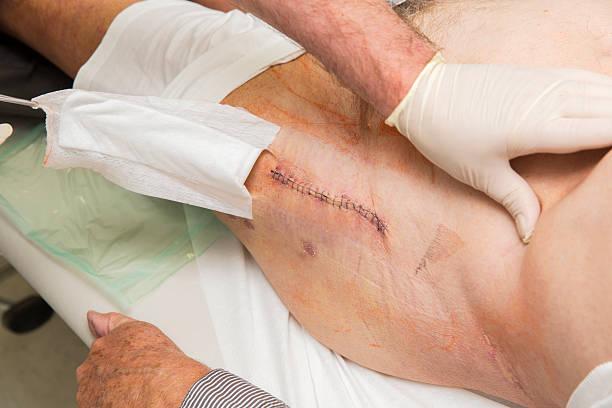
Пример «спокойного» шва.
Если говорить о частоте развития поздних инфекционных осложнений, то чаще всего они возникают в первые два года после эндопротезирования (1,63% пациентов). Реже (у 0,59% прооперированных) глубокие парапротезные инфекции развиваются в последующие 8 лет после операции.
Частота инфекционных осложнений на протяжении нескольких десятилетий остается неизменной. Однако заметно увеличилось общее количество артропластик, выросло и общее число осложнений. Поэтому становится все более актуальной их профилактика, ранняя диагностика и лечение.
Факт! Как показали научные исследования, риск развития инфекционных осложнений зависит от вида эндопротеза. Выяснилось, что в общей сумме имплантация отечественных моделей приводит к воспалению чаще (3-10% случаев), чем установка импортных (0,3-4,8%).
Что такое инфекция в области хирургического вмешательства
ИОХВ – это острое или хроническое воспаление, развивающееся в месте разреза или в области, которая подвергалась ятрогенному воздействию в ходе хирургического вмешательства. В 67% случаев инфекция затрагивает только зону операционного разреза, в 33% – распространяется на имплантированный сустав.
Факторы развития ИОХВ:
- длительность операции более 3 часов;
- технические трудности во время хирургического вмешательства;
- интраоперационная кровопотеря более 1 литра; ;
- использование дополнительных синтетических и биологических материалов в ходе операции;
- наличие тяжелых хронических заболеваний.

Воспалительные процессы, которые не распространяются на прооперированный сустав, можно победить без ревизионного эндопротезирования. Если же инфекция затрагивает костную ткань, компоненты эндопротеза, остатки суставной капсулы или другие части коленного или тазобедренного сустава – лечить ее будет крайне тяжело. В этом случае больному скорее всего потребуется повторное эндопротезирование.
Существует ряд факторов, которые отягощают состояние пациента, замедляют выздоровление и ухудшают прогноз: снижение иммунитета, перенесенные операции, частое лечение антибиотиками. Стойкость обнаруженной микрофлоры к антибактериальным средствам, плохое кровообращение в области сустава, массивные гнойные очаги тоже осложняют терапию.


Виды парапротезной инфекции
В ортопедии и травматологии используют несколько классификаций ИОХВ. Систематизация и отнесение инфекции к конкретному виду помогает врачам оценить тяжесть состояния пациента. Классификация Coventry-Fitzgerald-Tsukayama самая распространенная.
Таблица 1. Типы глубокой парапротезной инфекции по Coventry-Fitzgerald-Tsukayama.
| Тип | Время развития | Тактика лечения | |
| I | Острая послеоперационная | 1-й месяц | Ревизия послеоперационной раны, удаление некротизированных тканей, при необходимости – замена некоторых частей эндопротеза при сохранении его основных компонентов. |
| II | Поздняя хроническая | От 1 месяца до 1 года | Обязательное ревизионное эндопротезирование. |
| III | Острая гематогенная | После 1 года | Вполне оправданной является попытка сохранить установленный протез. |
| IV | Положительные интраоперационные культуры | Бессимптомная бактериальная колонизация поверхности импланта | Консервативное лечение, заключающееся в парентеральной антибиотикотерапии на протяжении 6 недель. |
В классификации, созданной Новосибирским НИИТО, ИОХВ делят на ранние острые, поздние острые и хронические. Первые развиваются на протяжении трех месяцев после эндопротезирования, вторые – на 3-12 месяце, третьи – после 1 года. Инфекционные осложнения могут протекать в латентной, свищевой, флегмоноподобной или атипичной форме.
По распространенности инфекции бывают эпифасциальными (поверхностными) и субфасциальными (глубокими). Могут сопровождаться тотальной, бедренной или тибиальной нестабильностью.
Поверхностные и глубокие инфекции
Возникают в первый месяц после эндопротезирования. Характеризуются развитием воспаления в мягких тканях нижней конечности. Сам бедренный или коленный сустав остается интактным, то есть не вовлекается в патологический процесс. Причиной осложнения чаще всего является занесение в рану патогенных микроорганизмов во время хирургического вмешательства или в послеоперационном периоде.
- некроз кожных покровов;
- лигатурные свищи;
- расхождение краев раны;
- подкожная гематома.
- некроз парапротезных тканей; ;
- инфицированная субфасциальная гематома.
Факт! Незначительная болезненность, локальная припухлость, покраснение и гипертермия кожи в области шрама обычно указывают на поверхностную инфекцию, которая поддается лечению. Появление лихорадки, спонтанное расхождение швов и сильные боли в ноге позволяют заподозрить воспаление глубоких тканей. В этом случае прогноз менее благоприятный.
Инфекции протезированного сустава
При патологии воспаление распространяется на полости и оболочки прооперированного сустава, остатки синовиальной оболочки, кости в месте фиксации эндопротеза и прилегающие мягкие ткани. Причиной осложнения является колонизация поверхностей сустава патогенной микрофлорой. Бактерии могут попадать из внешней среды или заноситься гематогенным путем.
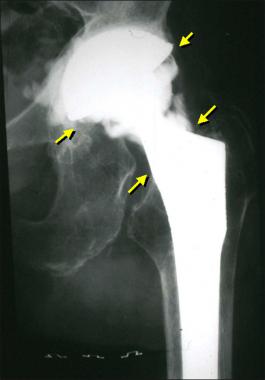
Так выглядит инфекция на рентгене.
Инфекции протезированного сустава самое грозное осложнение среди всех ИОХВ. Они не поддаются консервативной терапии, поэтому лечить их приходится хирургическим путем. Врачи заменяют эндопротез, однако иногда им все же удается сохранить его.
Существует три метода лечения инфекций протезированного сустава: ревизия раны без удаления импланта, ревизионное одноэтапное и двухэтапное эндопротезировение. Выбор методики зависит от состояния пациента, время манифестации инфекции, стабильности компонентов протеза и характера патогенной микрофлоры.
Методы диагностики ИОХВ
На наличие инфекционного процесса в области послеоперационной раны указывают гнойные выделения, боль, припухлость и локальное повышение температуры. Все эти симптомы появляются как при глубоких, так и при поверхностных инфекциях.
Рентгенологические исследования
Большую роль в дифференциальной диагностике свищевых форм инфекции играет рентгенофистулография. С ее помощью можно определить размер, форму и расположение свищей, выявить гнойные затеки и их связь с очагами костной деструкции. Это позволяет отличить поверхностные ИОХВ от глубоких.

Фото: Рентгенофистулография, свищ в нижней трети бедра.
Для диагностики инфекции протезированного сустава чаще всего используют рентгенографию. Метод на дает 100% верных результатов, однако позволяет заподозрить патологию. На наличие парапротезной инфекции указывает внезапное появление периостальной реакции и остеолиза. Если эти признаки возникают внезапно, вскоре после успешно проведенной операции, – есть повод заподозрить неладное.
Любопытно! МРТ, УЗИ и радиоизотопное сканирование в диагностических целях используют редко из-за их низкой информативности. К примеру, установленный эндопротез создает помехи при магнитно-резонансной томографии, что делает изображение размытым и нечетким.
Лабораторные анализы
Сдача анализов помогает выявить острые и хронические воспалительные процессы в организме. Повышение показателей не является достоверным признаком ИОХВ. Для постановки диагноза нужно учитывать наличие определенных клинических симптомом, данных рентгенографии и других методов исследования.
Клинически значимые лабораторные показатели:
- Количество лейкоцитов. Имеет значение в диагностике острой парапротезной инфекции. Ярким признаком воспаления является повышение общего количества лейкоцитов и нейтрофилов, сдвиг лейкоцитарной формулы влево.
- СОЭ. Является неспецифическим показателем. Нормальная скорость оседания эритроцитов говорит об отсутствии воспалительных процессов, повышенная – об их наличии.
- С-реактивный белок. СРБ является белком острой фазы воспаления и высокочувствительным маркером ИОХВ для людей, которым выполнили эндопротезирование. При диагностике парапротезных инфекций нужно обращать внимание именно на этот показатель.


Микробиологические исследования
Бактериоскопическое и бактериологическое исследования позволяют выявить и идентифицировать возбудителя инфекции, а также определить его чувствительность к антибиотикам. Количественные исследования дают возможность установить число микробных тел в гнойном отделяемом.
Для исследования могут использоваться такие материалы:
- отделяемое из раны;
- образцы ткани;
- жидкость из суставной полости;
- протезный материал.
При имплант-ассоциированной инфекции выявить бактерии в биологических жидкостях и тканях практически невозможно. Патогенные микроорганизмы обнаруживают на самих поверхностях эндопротезов. Они покрывают импланты в виде адгезивной пленки.
Факт! Кроме бактериологического исследования для диагностики могут использовать ПЦР – полимеразную цепную реакцию. Метод имеет высокую чувствительность, но низкую специфичность. Из-за этого он нередко дает ложноположительные результаты.
Лечение
Прежде чем решить, как бороться с инфекцией, врачи тщательно обследуют пациента. Лишь установив диагноз и определив чувствительность патогенной микрофлоры к антибиотикам, они принимают окончательное решение.
Таблица 2. Методы лечения парапротезных инфекций:
Имплант-сохраняющая тактика
Ее главная цель – устранение инфекционного процесса при одновременном сохранении эндопротеза. Больному проводят хирургическую обработку раны, в ходе которой удаляют гной и некротизированные ткани. При вовлечении в патологический процесс самого сустава выполняют артроскопический дебридмент. Больному назначают массивную антибактериальную терапию.
Любопытно! Научные исследования доказали эффективность безоперационного лечения ранних глубоких инфекций. Как выяснилось, комбинация антибиотиков и ферментных препаратов помогает ликвидировать воспаление за 5-7 дней.
Ревизионные операции
Выполняются в тех случаях, когда врачам не удается сохранить сустав. Хирурги полностью удаляют эндопротез, а на его место ставят новый. Риск повторного развития инфекции после ревизионного эндопротезирования выше, чем после первичного.

Парапротезная инфекция – это инфекционный процесс в области сустава, возникающий после эндопротезирования и патогенетически связанный с наличием имплантата. Проявляется локальными признаками воспаления: отеком, болезненностью, местной гиперемией и гипертермией, нарушением функции конечности в сочетании с симптомами общей интоксикации. Нередко протекает со стертой клинической симптоматикой. Диагностируется с учетом анамнеза, лабораторных анализов, рентгенологических методик, МРТ, УЗИ. В зависимости от вида параэндопротезной инфекции выполняются ревизии с сохранением эндопротеза либо удаление имплантата с реэндопротезированием, артродезом, костно-мышечной пластикой.
МКБ-10
Общие сведения
Парапротезная инфекция – актуальная проблема современной травматологии и ортопедии. Последние десятилетия ознаменовались широким распространением эндопротезирования. Увеличилось не только общее количество операций, но и количество протезируемых суставов. Если раньше замене, в основном, подвергали тазобедренный сустав, то в наши дни рутинной практикой стало протезирование коленного, плечевого, других средних и мелких суставов конечностей. Соответственно, возросло число случаев развития инфекционного процесса в области оперативного вмешательства. Распространенность патологии при первичном эндопротезировании составляет 0,3-1%. Частота осложнения при повторной установке искусственного сустава, по различным данным, колеблется от 9 до 40%. В большинстве случаев осложнение возникает в первые два года после операции.

Причины
Непосредственной причиной парапротезной инфекции становятся болезнетворные бактерии, при этом существует определенная связь между типом возбудителя и видом протеза, обусловленная склонностью микробов к адгезии к тем или иным инородным материалам, находящимся в организме пациента. Так, в области металлических частей имплантата инфекция чаще вызывается золотистым стафилококком, в зоне полимерных – эпидермальным стафилококком. Наряду со стафилококковой флорой воспаление могут провоцировать стрептококки, кишечная палочка и некоторые другие микроорганизмы. Обстоятельствами, способствующими возникновению воспалительного процесса, считаются:
- Особенности вмешательства. Установлено, что при длительности операции более 3 часов вероятность осложнения увеличивается, что связано с продолжительным контактом тканей с внешней средой, нарушениями кровообращения, локальными обменными расстройствами и общей реакцией организма на стресс. Большое значение имеют интраоперационные осложнения, технические трудности и значительная кровопотеря, усугубляющие действие перечисленных факторов.
- Особенности установки эндопротеза. Риск развития инфекции в зоне искусственного сустава повышается при применении дополнительных биологических и синтетических материалов, нестабильности имплантата. В первом случае имеет значение реакция организма на наличие чужеродных элементов, во втором появляется постоянный источник травматизации окружающих тканей, создаются благоприятные условия для внедрения инфекционных агентов.
К числу особенностей организма пациента, способствующих появлению данного осложнения, относят пожилой возраст, наличие тяжелой соматической патологии и иммунные нарушения различного генеза. Негативную роль играет многократное или длительное применение антибиотиков перед операцией, обуславливающее устойчивость микроорганизмов к антибактериальной терапии, нарушение рекомендаций врача относительно режима активности и реабилитационных мероприятий в послеоперационном периоде.
Патогенез
Парапротезная инфекция – разновидность имплантат-ассоциированной инфекции, которая возникает после эндопротезирования вследствие способности патогенных микробов к колонизации имплантатов. Бактерии, вызывающие это осложнение, обладают свойством формировать биофильмы (биологические пленки) на поверхностях чужеродных материалов в организме больного. Выделяют два механизма возникновения биопленок. Первый – неспецифическое взаимодействие непосредственно между поверхностью протеза и микроорганизмами за счет сил поверхностного натяжения, водородных связей, гидрофобности, электростатического поля и т. д.
Второй – контакт бактерий с белками, располагающимися на поверхности искусственной конструкции. После установки части эндопротеза очень быстро покрываются слоем белков, среди которых преобладают альбумины. При адгезии микробов к этим белкам формируются микроколонии. Вначале имплантат колонизируется аэробными микроорганизмами, в последующем в глубоких слоях биофильма создается благоприятная среда для развития анаэробной микрофлоры. При увеличении биопленки или под влиянием внешних воздействий ее части отрываются от поверхности имплантата, происходит диссеминация процесса. Исследование перечисленных механизмов позволило объяснить устойчивость инфекции и неэффективность консервативной терапии этого осложнения.
Классификация
Существует много вариантов классификации параэндопротезной инфекции, однако общепризнанная международная систематизация этого осложнения пока отсутствует. Обычно травматологи-ортопеды используют классификацию Ковентри-Фитцджеральда, в основе которой лежит временной период между операцией и манифестацией инфекционного процесса. Различают четыре типа парапротезной инфекции:
- Острая послеоперационная. Признаки инфицирования определяются в течение месяца после вмешательства.
- Поздняя хроническая. Осложнение диагностируется во временном промежутке от 1 месяца до 1 года с момента операции.
- Острая гематогенная. Симптомы патологии возникают через 1 и более год после установки искусственного сустава.
- Положительная интраоперационная культура. Характеризуется бессимптомным течением при выявлении бактерий в 2-х и более интраоперационных образцах ткани.
В российской клинической практике также применяют систематизацию инфекций в области хирургических вмешательств, разработанную сотрудниками Новосибирского НИИТО. Согласно этой классификации различают три вида послеоперационных инфекционных процессов: ранний острый (возникший в первые 3 месяца), поздний острый (развившийся в течение 3-12 месяцев), хронический (диагностированный спустя 1 год и более после операции). При постановке диагноза отмечают наличие или отсутствие нестабильности эндопротеза.
С учетом формы выделяют флегмоноподобную, свищевую, латентную и атипичную инфекции, с учетом глубины – поверхностную и глубокую. Несмотря на то, что поверхностная инфекция протекает без вовлечения эндопротеза (то есть, имеет другой патогенез), поражает только кожные покровы и подкожную клетчатку, поддается консервативной терапии, специалисты рассматривают ее в рамках параэндопротезной инфекции, поскольку такой подход позволяет учесть все возможные варианты инфекционных осложнений эндопротезирования.
Симптомы парапротезной инфекции
Проявления патологии зависят от времени возникновения и глубины процесса. Поверхностная инфекция развивается в период восстановления после операции, сопровождается воспалением мягких тканей при интактности оперированного сустава. Характеризуется гиперемией, локальной припухлостью, повышением местной температуры, незначительными или умеренными болями, нарушением заживления раны, расхождением ее краев, наличием гнойного отделяемого. Возможно образование участков поверхностного некроза, формирование лигатурных свищей. Выраженность общей интоксикации определяется распространенностью поражения кожи и жировой клетчатки.
Глубокая парапротезная инфекция может манифестировать как в раннем послеоперационном периоде, так и спустя продолжительное время после вмешательства. Поражает мышцы и фасции. Проявляется отечностью мягких тканей, болью в проекции сустава, ограничением функции конечности, общими интоксикационными симптомами: повышением температуры тела до 38 °С и выше, ознобами, слабостью, разбитостью, тахикардией, тахипноэ. Возможно сочетание глубокого и поверхностного процесса, рассматриваемое специалистами как разновидность глубокой инфекции. Из-за распространенности иммунологических нарушений в популяции патология часто протекает со сглаженной симптоматикой. Снижение иммунитета усугубляют переливания крови, лекарственная терапия и другие лечебные мероприятия, проводимые на пред- и послеоперационном этапе.
Осложнения
Наиболее частые осложнения параэндопротезной инфекции обусловлены распространением гнойного процесса. Наблюдается образование абсцессов и флегмон. Особенно опасны глубокие затеки в полость таза, иногда формирующиеся при поражении оперированного тазобедренного сустава. В тяжелых случаях возможно развитие сепсиса. При часто рецидивирующей патологии снижается или утрачивается трудоспособность, ухудшается качество жизни больных, персистирующий очаг инфекции оказывает негативное влияние на деятельность внутренних органов.
Диагностика
Диагноз обычно выставляют специалисты в области ортопедии, наблюдающие пациентов, перенесших эндопротезирование сустава. Из-за часто встречающихся стертых форм и неспецифичности результатов дополнительных методик распознавание парапротезной инфекции может представлять определенные затруднения. Программа обследования обычно включает следующие методы:
- Опрос, осмотр. Признаком, указывающим на вероятность возникновения данной патологии, является замена сустава в анамнезе. Ортопед уточняет жалобы, время появления и динамику развития симптомов, оценивает внешний вид и функцию сустава, выявляет признаки воспаления, участки некроза, свищевые ходы и пр.
- Ультразвуковое сканирование. УЗИ сустава применяется в качестве скринингового метода, позволяет обнаружить абсцессы или гематомы, выполнить прицельную пункцию гнойного очага для последующего изучения содержимого в процессе бактериологического исследования.
- Рентгенологические методики. Результаты обычной рентгенографии часто неоднозначны. О наличии заболевания могут свидетельствовать остеолиз и периостальная реакция, без видимых причин возникшие после успешного вмешательства. Для оценки динамики процесса обязательно выполняют контрольные снимки. При свищах производят рентгенофистулографию для определения локализации свищевых ходов и затеков.
- Магнитно-резонансная томография. Является уточняющим методом, назначается на этапе предоперационного обследования для оценки размеров и расположения глубоких (в том числе – внутритазовых) абсцессов, уточнения объема хирургического вмешательства.
- Лабораторные анализы. При острой патологии в ОАК обнаруживаются признаки воспаления: лейкоцитоз, нейтрофилез, лимфоцитопения, сдвиг формулы влево, повышение СОЭ. При хронических формах изменения крови могут быть выражены незначительно. Более специфичны результаты исследования на С-реактивный белок, отражающие динамику воспалительного процесса, а также данные бакпосева раневого отделяемого. Микробиологический анализ синовиальной жидкости часто отрицательный из-за формирования биопленок.
Лечение парапротезной инфекции
В случаях поверхностного инфекционного процесса тактика такая же, как при других инфицированных ранах. Осуществляется санация поверхностного гнойного очага на фоне антибиотикотерапии, операции на суставе не требуются. При глубокой инфекции тактика определяется типом патологии с учетом времени ее возникновения, наличием либо отсутствием нестабильности сустава, расположением и размером гнойных затеков, состоянием костей и мягких тканей, устойчивостью флоры к антибактериальным препаратам и некоторыми другими факторами. Лечение только хирургическое. Существуют следующие варианты вмешательств:
- Ревизия с сохранением имплантата. Проводится при раннем инфицировании, сохранении стабильности сустава, незначительном поражении элементов эндопротеза. Сустав вскрывают, исследуют его поверхности. Инфицированные окружающие ткани иссекают, полиэтиленовый вкладыш заменяют (при необходимости – вместе с головкой протеза), рану ушивают, дренируют.
- Ревизионное эндопротезирование. Рекомендуется при поздней хронической и иногда – острой гематогенной парапротезной инфекции, предполагает одно- двух- или трехэтапную замену имплантата. Чаще всего используют двухэтапное реэндопротезирование, на первом этапе выполняют ревизию раны, затем после курса антибиотикотерапии устанавливают новый протез. При трехэтапном вмешательстве на втором этапе производят костную пластику.
- Артродез сустава. Показан при рецидивирующей инфекции, резистентности патогенной флоры к антибиотикам. Предусматривает удаление эндопротеза и наложение аппарата внешней фиксации для создания неподвижного соединения между концами костей.
- Ампутация или экзартикуляция. Осуществляется редко, в качестве показаний рассматривается наличие упорно рецидивирующего очага инфекции, представляющего угрозу для жизни больного, при одновременной утрате функции конечности.
Прогноз и профилактика
1. Медицинские и социальные проблемы эндопротезирования суставов конечностей/ Москалев В.П., Корнилов Н.В., Шапиро. К.И. - 2001
2. Инфекционные осложнения после эндопротезирования крупных суставов как актуальная проблема современной ортопедии/ Муконин А.А.// Новые медицинские технологии - 2006 -№ 8
3. Лечение параэндопротезной инфекции тазобедренного сустава: клинические рекомендации/ Министерство здравоохранения РФ - 2013
1 ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Минздрава России

1. Masters J.P., Smith N.A., Foguet P. et al. A systematic review of the evidence for single stage and two stage revision of infected knee replacement. BMC Musculoskeletal Disorders // Jul 2013; 14:222 DOI: 10.1186/1471-2474-14-222.
2. Mittag F., Leichtle C.I., Schlumberger M. et al. Clinical outcome after infected total knee and total hip arthroplasty // Acta Ortopedica Brasileira. Jan 2016; 24 (1):43-47 DOI: 10.1590/1413-785220162401150767.
4. Uçkay I. [et al.] Low incidence of haematogenous seeding to total hip and knee prostheses in patients with remote infections // J. Infect. 2009; 59 (5):337-345.
5. Клюшин Н.М., Абабков Ю.В., Ермаков А.М. Парапротезная инфекция как причина ревизионных вмешательств после тотального эндопротезирования коленного сустава: этиология, диагностика, лечение // ЭНИ Забайкальский медицинский вестник. – 2015. – № 2. – С. 189-197.
6. Корнилов Н.Н. Артропластика коленного сустава / Н.Н. Корнилов, Т.А. Куляба // СПб., 2012. – 228 с.
7. Хирургическое лечение хронического гнойного поражения тазобедренного и коленного суставов после тотального эндопротезирования / В.П. Волошин, А.В. Еремин, Г.А. Оноприенко, К.И. Савицкая // Эндопротезирование в России: Всерос. монотем. сб. науч. статей. – Казань; СПб.: АБАК, 2008. – Вып. IV. – C. 201-212.
9. Lichstein P., Su S., Hedlund H. et al. Treatment of periprosthetic knee infection with a two-stage protocol using static spacers // Clinical Orthopaedics and Related Research. Aug 2015; 474 (1):120-125 DOI: 10.1007/s11999-015-4443-2.
10. Lima A.L., Oliveira P.R., Carvalho V.C. et al. Periprosthetic joint infections // Interdisciplinary Perspectives on Infectious Diseases. Aug 2013; 2013:542796 DOI: 10.1155/2013/542796.
11. Cancienne J.M., Granadillo V.A., Patel K.J. et al. Risk Factors for Repeat Debridement, Spacer Retention, Amputation, Arthrodesis, and Mortality after Removal of an Infected Total Knee Arthroplasty with Spacer Placement // J. Arthroplasty 2017 Sep; S0883-5403(17)30760-X. doi: 10.1016/j.arth.2017.08.037.
12. Nodzo S.R., Boyle K.K., Spiro S. et al. Success rates, characteristics, and costs of articulating antibiotic spacers for total knee periprosthetic joint infection // Knee. 2017 Oct; 24 (5):1175-1181. doi: 10.1016/j.knee.2017.05.016. Epub 2017 Aug 8.
Увеличение средней продолжительности жизни, несомненно, положительная тенденция настоящего времени, но обратной стороной медали является не всегда высокое качество жизни, особенно в старшем возрасте. Одним из факторов, снижающих это качество, всё чаще становятся заболевания суставов. Боль и ограничение способности к движению при этих заболеваниях со временем значительно осложняют жизнь пациентам. Наиболее эффективным способом лечения в этих случаях считается хирургическое вмешательство. Для лечения пациентов с тяжелыми посттравматическими осложнениями и дегенеративными заболеваниями суставов оптимальным методом считается эндопротезирование. Однако, несмотря на то что после тотального эндопротезирования коленного сустава наблюдается значительное улучшение состояния пациента, существует риск осложнения в виде парапротезной инфекции, при котором увеличиваются сроки и стоимость лечения. Кроме того, инфекционное осложнение может привести к неблагоприятному исходу хирургического лечения. Согласно исследованиям, проведенным в ряде разных центров, после тотального эндопротезирования коленного сустава инфицирование происходило в 0,5-5% случаев 3.
I. Uçkay с соавт. выполнили ретроспективный анализ 6101 случая реэндопротезирования крупных суставов с 1996 по 2008 г. Из них 2099 случаев – после эндопротезирования коленного сустава. Всего было удалено 234 (11,15%) протеза коленного сустава, из них по поводу инфекции удалено 24 (1,14%) протеза. Полученные результаты позволили авторам сделать вывод, что парапротезная инфекция – редкое осложнение [4; 5].
Внедрение эндопротезирования в клиническую практику в России происходило постепенно, и первоначальные результаты не внушали оптимизма. По данным H.Н. Корнилова с соавт., частота инфекционных осложнений в некоторых лечебных учреждениях, где выполнялось лишь несколько эндопротезирований в год, достигала 17% [5; 6].
Волошин В.П. с соавт. проанализировали опыт лечения 66 пациентов с тотальным эндопротезированием крупных суставов. В 87,9% случаев (58 пациентов), в сроки от 1,5 до 3 лет после эндопротезирования, отмечалось развитие гнойной инфекции. Глубокое нагноение отмечено у 6 пациентов (9,1%). В итоге 10 пациентам было выполнено артродезирование коленного сустава аппаратом Илизарова [5; 7].
Т.А. Куляба с соавторами проанализировали результаты лечения 44 пациентов, у которых после первичного и ревизионного эндопротезирования коленного сустава развилось инфекционное воспаление. Происходило это в разные сроки, у 18 пациентов (40,1%) в раннем послеоперационном периоде, а у 26 (59,1%) в отдаленном, но так или иначе, купировать воспаление и сохранить эндопротез удалось только у 10 (22,7%) больных. В подавляющем большинстве случаев потребовалось провести двухэтапное хирургическое лечение, которое позволило купировать гнойный процесс в 89,3% случаев. Артродез был выполнен у 4 (9,1%) больных [5; 8].
Инфицирование может происходить через прямую или гематогенную передачу бактериальной флоры. Некоторыми примерами прямой передачи являются: несоблюдение условий стерильности в операционных, передача от инфицированного пациента, небрежность хирургов и обслуживающего персонала. Гематогенное инфицирование наблюдается после эпизода бактериемии. Например, стрептококковая инфекция может развиться после стоматологического вмешательства, стафилококковая – как следствие кожного инфекционного заболевания, энтерококковая и анаэробные инфекции – в результате желудочно-кишечных инфекционных заболеваний и инфекций мочеполовой системы [9].
Отек, боль и дисфункция коленного сустава возникают после эндопротезирования коленного сустава и усиливаются по мере прогрессирования инфекции. На фоне инфекции происходит перипротезный остеолиз, приводящий к нестабильности эндопротеза. У пациентов, не получающих своевременного лечения, может развиться сепсис и опасный для жизни септический шок [10].
На основе метаанализа, проведенного Cancienne J.M. с соавт., описаны исходы лечения 18 533 пациентов с ранними инфекционными осложнениями (в течение 1 года) после тотального эндопротезирования коленного сустава [11]. Среди них:
- 691 пациент (3,7%) умер в стационаре;
- 574 пациентам (3,1%) потребовалась ампутация конечности;
- 852 пациента (4,5%) перенесли артродез коленного сустава;
- 2683 пациентам (14,5%) проведена вторичная хирургическая обработка, без реимплантации;
- 13743 (74,1%) пациента прошли через двухэтапное реэндопротезирование коленного сустава, из них 11420 пациентам (61,6%) в течение 1 года проведено удаление спейсера и реимплантация, а 2323 пациентам (12,5%) оставлен спейсер.
Nodzo S.R. и соавторы, при проведении двухэтапного реэндопротезирования, разделили пациентов на три группы в зависимости от типа используемого спейсера [12]. В первой группе использовались преформованные артикулирующие спейсеры, во второй – спейсеры из цемента изготавливались интраоперационно. В третьей группе – в качестве спейсера использовали автоклавированный бедренный компонент удаленного эндопротеза. Признаки санации инфекционного процесса отметили в первой группе пациентов в 82,7% случаях, во второй группе – в 88,4%. Наименьшее количество положительных результатов отмечено в третьей группе – 79,4%. Таким образом, использование цементных спейсеров, изготовленных интраоперационно с использованием антибиотика по чувствительности флоры, приносит максимально положительный результат.
Цель исследования: провести анализ частоты, структуры и причин возникновения инфекционных осложнений при тотальном эндопротезировании и реэндопротезировании коленного сустава и определить оптимальную тактику лечения при этих осложнениях.
Материал и методы. В Новосибирском НИИТО за период с 2007 по 2016 год было проведено 12 245 операций первичного эндопротезирования коленного сустава. Инфекционные осложнения возникли у 470 (3,84%) человек. При этом эпифасциальная (поверхностная) инфекция была зафиксирована у 252 (2,06%) пациентов. В эту группу включены пациенты с некрозом послеоперационного шва и подкожной клетчатки, лигатурными свищами. В случае распространения процесса в пределах 5-6 см по ходу операционного шва, пациентам проводилась одномоментная санация и ушивание кожного дефекта. В случаях распространения процесса на весь шов, пациентам проводились этапные санационные перевязки до очищения стенок раны с последующим вторичным швом раны. Как результат применения такой методики лечения, у всех пациентов отмечался положительный результат.
Группу пациентов с субфасциальной (глубокой) инфекцией, развившейся в разные сроки, составили 218 пациентов (1,8%), что соответствует мировым тенденциям. По нашим убеждениям, в случае глубокой парапротезной инфекции, на фоне сформированной биопленки, эндопротез сохранять бесполезно, и он подлежит удалению. Однако дальнейшая тактика зависит от патологической флоры и других факторов. После удаления выполняется либо одномоментная имплантация нового эндопротеза, либо проведение этапного лечения с целью санации и последующего реэндопротезирования. В случае невозможности выполнения последующего этапа реэндопротезирования, в рассматриваемых случаях выполнялся артродез коленного сустава.
Бактериальное исследование пациентов с глубокой парапротезной инфекцией дало следующие результаты:
· у 172 (78,9%) пациентов была выделена грамположительная кокковая флора: у 113 пациентов – MSSA, у 33 – MSSE, у 8 пациентов – MRSA, и у 18 пациентов – MRSE;
· грамотрицательные палочки (Klebsiella, Pseudomonas, E.coli) были выделены у 33 пациентов (15,1%);
· грамположительные палочки (Korinebacterium, Propionobacter) – у 2 пациентов (0,9%);
· у 11 пациентов (5,0%) была выявлена смешанная флора.
При выборе тактики хирургического лечения больных с глубокой парапротезной инфекцией анализировались сроки возникновения инфекции, степень стабильности компонентов эндопротеза и степень вирулентности возбудителя. Также немаловажную роль в выборе тактики оперативного лечения играли сопутствующая патология и желания самого пациента.
Одномоментное реэндопротезирование после удаления эндопротеза выполнялось пациентам без выраженной сопутствующей патологии, в раннем послеоперационном периоде (до 6 мес.), при отсутствии признаков нестабильности эндопротеза и в случае чувствительности флоры к возможному проведению антибиотикотерапии. В ходе данного вида оперативного лечения выполняли удаление эндопротеза, патологических грануляций мягких тканей и имплантировали новый эндопротез с добавлением в цемент антибактериальных препаратов, подобранных по чувствительности к флоре. В последующем проводили адресную антибиотикотерапию в течение 6 недель.
Этим способом были пролечены 28 пациентов. В 26 случаях инфекция была купирована. У двух пациентов наблюдался рецидив, потребовавший проведения двухэтапного ревизионного вмешательства. Таким образом, выживаемость имплантата составила 93%.
Клинический пример 1. Больная К., 62 года. Выполнено первичное эндопротезирование КС по поводу левостороннего гонартроза III ст.
Через 3 месяца после проведения оперативного лечения развилось осложнение в виде глубокой парапротезной инфекции. По результатам бактериологического исследования выявлен патогенный микроорганизм – MSSA. Больной выполнено удаление эндопротеза и одномоментное реэндопротезирование коленного сустава.
На контрольных осмотрах через 1 год, 3 и 5 лет признаков рецидива инфекции не было.
Двухэтапное ревизионное протезирование коленного сустава это наиболее распространенный способ оперативного лечения при парапротезной инфекции. Метод подразумевает дополнительный этап имплантации цементного спейсера с целью обеспечения «хирургической паузы» для санации полости сустава. Такой вид лечения применялся у большинства пациентов с глубокой инфекцией в различные сроки развития осложнений, при наличии возможности подбора антибиотика и отсутствии выраженной сопутствующей патологии.
В зависимости от степени сохранности связочного аппарата устанавливался артикулирующий либо неартикулирующий спейсер с добавлением антибиотика по чувствительности бактериальной флоры. После первого этапа пациенты получали антибиотикотерапию в течение 6-8 недель. Второй этап лечения – удаление цементного спейсера и реэндопротезирование коленного сустава, проводился по истечении 3-8 месяцев при условии нормализации клинических анализов и отсутствии положительных бактериологических исследований пунктата синовиальной жидкости.
Клинический пример 2. Больная Г., 62 года. Первичное эндопротезирование коленного сустава было проведено по поводу гонартроза III ст. Через 3 года после проведенной операции перенесла рожистое воспаление голени, осложнившееся глубокой парапротезной инфекцией. По результатам бактериологического исследования был выявлен патогенный микроорганизм – MRSA. Больной было выполнено удаление эндопротеза, санация и имплантация цементного артикулирующего спейсера (рис. 1).

Рис. 1. Клинический пример 2. Рентгенограмма коленного сустава после
имплантации артикулирующего спейсера коленного сустава
Антибиотикотерапия поводилась в течение 6 недель. Через 6 месяцев, когда признаки инфекции были полностью купированы, больной выполнен второй этап оперативного лечения – удаление цементного спейсера и реэндопротезирование коленного сустава (рис. 2). На контрольных осмотрах через 1 и 3 года признаков рецидива инфекции не обнаружено.

Рис. 2. Клинический пример 2. Рентгенограмма коленного сустава
после удаления спейсера и реэндопротезирования коленного сустава
За период наблюдения двухэтапное оперативное лечение было проведено 146 пациентам. У 124 пациентов признаки инфекции были купированы. Процедив отмечен у 22 пациентов. С целью купирования инфекционного процесса этим больным выполнялся артродез коленного сустава в аппарате внешней фиксации.
Первично артродез коленного сустава выполнялся пациентам с вирулентной флорой, на поддающейся антибиотикотерапии, с выраженной сопутствующей патологией, позволяющей оперировать пациента только по жизненным показаниям, и в случае желания пациента.
Клинический пример 3. Больная Л., 52 года. Первичное эндопротезирование коленного сустава было проведено по поводу вторичного артрозо-артрита коленного сустава III ст. на фоне ревматоидного полиартрита.
Через 6 месяцев после проведенного оперативного вмешательства у больной развилась глубокая парапротезная инфекция. Учитывая высокую активность основного заболевания, пациентка предпочла отказаться от дальнейших оперативных вмешательств, в связи с чем было выполнено удаление и артродез коленного сустава в аппарате внешней фиксации (рис. 3).

Рис. 3. Рентгенограмма коленного сустава после удаления эндопротеза и артродеза коленного сустава в аппарате внешней фиксации
По различным причинам артродез коленного сустава выполнялся в 66 случаях. В 54 случаях у пациентов сформировался костный анкилоз, и только в 12 случаях отмечалось формирование фиброзного анкилоза или неоартроза. Рецидива инфекции при выполнении артродеза коленного сустава зафиксировано не было.
Результаты. Таким образом, за 10 лет через отделение эндопротезирования коленного сустава Новосибирского НИИТО прошли 470 пациентов с парапротезной инфекцией. Эти пациенты получили следующее лечение:
- 252 (53,6%) пациентам с поверхностной инфекцией проведена вторичная хирургическая обработка, реимплантация эндопротеза не требовалась;
- 26 (5,5%) пациентам проведено одномоментное реэндопротезирование коленного сустава;
- 126 (26,8%) пациентов перенесли двухэтапное оперативное лечение;
- 66 (14,0%) пациентам по различным причинам выполнен артродез коленного сустава.
Ампутаций конечности и летальных исходов, вызванных инфекционным процессом, в отделении не отмечено.
1 ГБОУ ВПО «Новосибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации, кафедра травматологии и ортопедии
2 ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л.Цивьяна» Минздрава России
Проблема раневой инфекции по-прежнему остается одной из ключевых в современной травматологии и ортопедии, особенно при вмешательствах на крупных суставах. Цель исследования - проанализировать результаты лечения пациентов с парапротезной инфекцией коленного сустава, находившиеся в Новосибирском научно-исследовательском институте травматологии и ортопедии им. Я.Л.Цивьяна. Анализу подверглись 267 больных с выявленными признаками инфекции области хирургического вмешательства (ИОХВ), которым был применен дифференцированный подход. Этапную санацию раны с сохранением протеза применили у 104, одноэтапное реэндопротезирование у 47, двухэтапное реэндопротезирование у 68, артродез с использованием метода чрескостного остеосинтеза у 34 пациентов. Применение дифференцированного подхода к лечению парапротезной инфекции коленного сустава позволяет добиться поставленных задач в 71-100% случаях.

1. Ефименко Н.А., Гучев И.А., Сидоренко С.В. Инфекции в хирургии. Фармакотерапия и профилактика. Смоленск, 2004. С.17.
2. Кузьмин И.И. Проблема инфекционных осложнений в эндопротезировании суставов / Кузьмин И.И., Исаева М.П. – Владивосток: Дальнаука, 2006. 123 с.
3. Прохоренко В.М. Инфекционные осложнения при эндопротезировании тазобедренного сустава /В.М. Прохоренко, В.В. Павлов. – Новосибирск: Наука, 2010. 179 с.
4. Чрескостный остеосинтез в лечении больных хроническим остеомиелитом после эндопротезирования крупных суставов / Н.М.Клюшин, В.И.Шляхов, Б.Э.Чакушин, А.В.Злобин, С.И.Бурнашов, Ю.В.Абабков, А.Г.Михайлов // Гений ортопедии. – №2. – 2010. С.37-43.
5. Bacterial contaminants and antibiotic prophylaxis in total hip arthroplasty /Al-Maiyah M., Hill D., Bajwa A., et al. // J. Bone Joint. Surg. Br. – 2005. – Vol.87, N.9. – P.1256–1258.
6. Developing surgical site infection surveillance within clinical governance / Hogg S., Baird N., Richards J., et al. // Clinical Governance: An International Journal. – 2005. – Vol.10. – P.24-36.
7. Diagnosis of Chlamydia-induced reactive arthritis / Ito S., Sugihara M., Suzuki T., et al. // Intern. Med. – 2006. Vol.45, N.1. – P.37.
8. Guideline for prevention of surgical site infection, 1999. Hospital Infection Control Practices Advisory Committee / Mangram A.J., Horan T.C., Pearson M.L., et al. // Infect. Control Hosp. Epidemiol. – 1999. – Vol. 20, N.4. – Р.250–280.
9. Infection of surgical site infection after arthroplasty of the hip / Ridgeway S., Wilson J., Coello R., et al. // J. Bone Joint. Surg. Br. – 2005. – Vol.87. – P.855–850.
10. Mabry T.M. Articulating Antibiotic Spacers: A Matter of Per¬sonal Preference / T.M. Mabry, A.D. Hanssen // Orthopedics. – 2007. – Vol. 30. – P. 783.
Проблема раневой инфекции по-прежнему остается одной из ключевых в современной травматологии и ортопедии, особенно при вмешательствах на крупных суставах.
По данным A.T.Mangram et al. в США инфекция области хирургического вмешательства (ИОХВ) составляет 14–16 % от всей структуры нозокомиальной инфекции. Там же приводятся данные о том, что инфекция области хирургического вмешательства (ИОХВ) осложняет до 30 % операций на суставах с использованием имплантов 7.
По данным Hanssen, Thornhil, частота выявления парапротезной инфекции для коленного сустава составляет 1,6–2,5% [10].
В России нозокомиальная инфекция развивается в среднем у 5-10 % больных, находящихся в стационарах. По данным официальной статистки, ежегодно регистрируется от 50 до 60 тыс. случаев инфекционных осложнений [2, 5, 9].
Среди всех инфекционных осложнений, развивающихся у хирургических пациентов, на долю инфекций ИОХВ приходиться около 40%, две трети из них связаны с областью операционного разреза и одна треть затрагивает орган или полость [3].
По данным Ефименко Н.А. с соавт. «инфекция области хирургического вмешательства» (ИОХВ) – осложнение, развивающееся как в области разреза, так и в органах и тканях, подвергающихся ятрогенному воздействию в ходе оперативного вмешательства [1].
Условия, способствующие возникновению ИОХВ: несвоевременное выявление и неадекватное лечение хронических воспалительных процессов, наличие инородного тела, нестабильность имплантата, ишемия тканей в области имплантата (рубцовые изменения мягких тканей, внутриканальный дефект костной ткани и костного мозга и т.д.), а также снижение бактерицидных свойств тканевой жидкости ложа имплантата [4].
К факторам, обуславливающие сложность лечения парапротезной инфекции, мы относим следующие: снижение реактивности организма пациента вследствие хронической интоксикации, предшествующих операций и многократной антибактериальной терапии; толерантность микрофлоры (биопленки) к большинству применяемых антибактериальных препаратов; невозможность создания необходимой терапевтической концентрации антибиотиков в зоне гнойного поражения из-за нарушения кровоснабжения области имплантата, вынужденная высокая травматичность оперативного вмешательства из-за локализации и распространенности гнойного процесса; сложность обеспечения условий стабильной фиксации конечности после удаления имплантата и имеющиеся после удаления имплантата дефекты суставных концов приводят к выраженному нарушению опороспособности и стойкой утрате функции конечности.
Цель исследования: проанализировать результаты лечения пациентов с парапротезной инфекцией коленного сустава, находившиеся в НИИТО с 2010 по 2014 годы.
В своей работе мы пользуемся классификацией ИОХВ при эндопротезировании, разработанной в Новосибирском НИИТО:
Читайте также:

