Обмен веществ при волчанке
Обновлено: 04.05.2024
Клиника и диагностика системной красной волчанки (СКВ) у детей
Проявления болезни крайне разнообразны. У детей чаще всего наблюдается лихорадка, утомляемость, артралгия или артрит и сыпь. Симптомы могут возникать периодически или быть постоянными. Тщательное изучение анамнеза, а также физикальные и лабораторные исследования способствуют ранней диагностике и своевременному началу лечения.
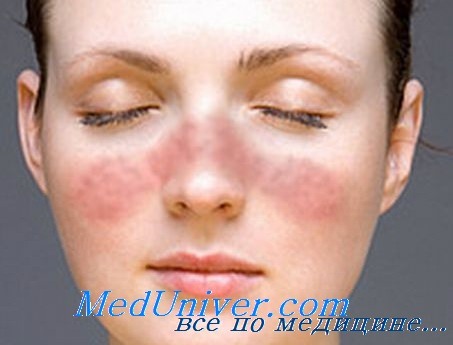
Характерна сыпь (эритема типа бабочки) на переносице — от небольшого покраснения до утолщения эпидермиса и шелушащихся пятен. Сыпь может провоцироваться солнечным светом и распространяться на все открытые части тела. На слизистых оболочках, особенно на нёбе и в носовой полости, могут появляться язвы. Дискоидные высыпания у детей встречаются редко. Однако при СКВ они появляются чаще, чем при только дискоидной красной волчанке. На долю последней у детей приходится 2-3 % всех случаев.
Другие кожные проявления включают красную пятнистую сыпь (особенно на пальцах, ладонях и стопах), геморрагическую сыпь, ливедо и синдром Рейно. Менее часто наблюдаются поражения кожи, напоминающие псориаз, буллезная сыпь и алопеция.
Костно-мышечные нарушения включают артралгию, артрит, тендинит и миозит. Деформирующий артрит нехарактерен. Повреждение связок может приводить к выраженной разболтанности суставов рук. Как осложнение сосудистых нарушений или кортикостероидной терапии часто развивается остеонекроз.
Поражение серозных поверхностей проявляется плевритом, перикардитом и перитонитом. Нередко находят гепатоспленомегалию и лимфаденопатию. К другим нарушениям ЖКТ, обычно связанным с васкулитом, относятся боль в животе, понос, мелена, язвенный колит и гепатит. В сердце патологический процесс может распространяться на все ткани: наблюдаются утолщение клапанов и веррукозный эндокардит (болезнь Либмана-Сакса), кардиомегалия, миокардит, нарушения проводимости, сердечная недостаточность, а также воспаление и тромбоз коронарных артерий.
Наблюдаются острые легочные кровотечения, инфильтраты в легких (иногда с присоединившейся инфекцией) и хронический фиброз легочной ткани.
При СКВ страдает как центральная, так и периферическая нервная система. У многих больных отмечаются потеря памяти и другие когнитивные нарушения, а также тяжелые психические расстройства, вплоть до психозов по критериям 4-го издания DSM). МРТ и КТ не всегда обнаруживают изменения, хотя с помощью однофотонной изотопной КТ нередко удается выявить аномалии.
В любом органе могут возникать бактериальные и венозные тромбозы, характерные для антифосфолипидного синдрома, которые часто связаны с невынашиванием беременности, ливедо, тромбоцитопенией и синдромом Рейно. Тромбозы сосудов ассоциируются также с присутствием волчаночного антикоагулянта и приобретенной устойчивостью фактора V к протеину С.
Поражения почек проявляются артериальной гипертонией, периферическими отеками, ретинопатией, клиническими признаками электролитных сдвигов, нефрозом или острой почечной недостаточностью.
Диагноз подтверждается клиническими и лабораторными данными, свидетельствующими о мультисистемном заболевании. Для диагноза СКВ необходимо одновременное или последовательное появление 4 из 11 признаков. В 1997 г. диагностические критерии были пересмотрены: вместо появления LE-клеток (при смешивании сыворотки больного с лейкоцитами здорового человека и ядрами разрушенных клеток) в число критериев включены антитела к кардиолипиновому антигену или положительный результат пробы на волчаночный антикоагулянт. Однако диагностическая значимость такой замены остается недоказанной.
Присутствие антинуклеарных антител для диагностики не требуется, хотя они и обнаруживаются в большинстве случаев. При подозрении на СКВ лечение следует начинать даже при наличии менее 4 признаков. Гипокомплементемия не имеет диагностического значения; крайне низкий уровень или полное отсутствие гемолитической активности комплемента могут указывать на недостаточность его компонентов. Для подтверждения диагноза волчаночного нефрита проводят биопсию почек.
Лабораторные исследования при системной красной волчанке у детей. У детей с активной СКВ часто обнаруживается повышенный титр антинуклеарных антител. Однако этот признак нельзя считать диагностическим, поскольку их титр бывает повышенным и в отсутствие какихлибо заболеваний, а также при других болезнях. Высокий уровень антител к двухцепочечной ДНК более специфичен и отражает активность СКВ.
Общая концентрация комплемента в сыворотке (СН50), а также уровень СЗ и С4 также зависят от активности болезни, снижаясь в ее активной стадии. Антитела к Sm-антигену клеточных ядер считаются специфичными для СКВ, но не отражают ее активность. Антитела к Ro- и La-антигенам иногда находят при синдроме Шегрена. При СКВ в сыворотке крови можно обнаружить различные аутоантитела. Столь же часто выявляется гипергаммаглобулинемия.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Системная красная волчанка: причины появления, симптомы, диагностика и способы лечения.
Определение
Системная красная волчанка (СКВ) – это хроническое аутоиммунное заболевание неустановленной этиологии, при котором иммунная система организма становится гиперактивной и поражает здоровые ткани.
Системную красную волчанку называют «болезнью с тысячей лиц», поскольку она затрагивает многие органы, следовательно, может проявляться большим количеством симптомов, при этом постановка диагноза часто затруднена.
СКВ характеризуется генерализованным поражением микроциркуляторного русла и системной дезорганизацией соединительной ткани с кожными, суставными и висцеральными изменениями.
Заболеваемость СКВ составляет порядка 40-50 случаев на 100 000 населения в год. Заболевание наиболее часто развивается в течение второго и третьего десятилетий жизни у девушек и молодых женщин. Около 20% пациентов заболевают в возрасте до 16 лет.
Причины появления системной красной волчанки
Волчанка является аутоиммунным заболеванием, но точная причина возникновения болезни неясна.
Иммунная система защищает организм и борется с антигенами, такими как вирусы, бактерии и микробы. Это происходит благодаря синтезу белков, называемых антителами.
Когда человек страдает аутоиммунным заболеванием, таким как красная волчанка, иммунная система не может отличить чужеродные вещества (или антигены) от клеток собственного организма.
В результате иммунная система направляет антитела как против здоровой ткани, так и против антигенов. Это вызывает воспаление и повреждение тканей.
Поскольку точные причины возникновения системной красной волчанки до сих пор не обнаружены, ученые выдвигают теории и делают предположения. На первое место они ставят генетическую предрасположенность. Ученым удалось определить более 60 локусов (местоположений определенного гена на генетической или цитологической карте хромосомы) предрасположенности к СКВ, которые можно разделить на несколько групп. Интересно, что многие локусы риска являются общими для СКВ и других аутоиммунных заболеваний.
Одним из механизмов, запускающих аутоиммунный ответ, является ультрафиолетовое излучение, поскольку после воздействия солнечного света у пациентов на коже часто проявляются покраснения и сыпь.
Развитие болезни, по-видимому, может спровоцировать и вирусная инфекция. Нельзя исключать, что в этом случае аутоиммунные реакции возникают из-за молекулярной мимикрии вирусов — феномена сходства вирусных антигенов с собственными молекулами организма.
Гормональная теория развития СКВ может объяснить тот факт, что, во-первых, у женщин заболевание отмечается в 10 раз чаще, чем у мужчин, а во-вторых, симптомы обычно появляются в фертильном возрасте - от 15 до 45 лет и только 20% - после 50 лет.
Классификация заболевания
По характеру течения:
- острое;
- подострое;
- хроническое.
- высокая;
- умеренная;
- минимальная.
В классификации учитываются общие проявления, такие как лихорадка, поражение кожи, суставов, неврологические нарушения, воспаление оболочки сердца и легких, нарушения в кровеносной системе, поражение почек.
Симптомы системной красной волчанки
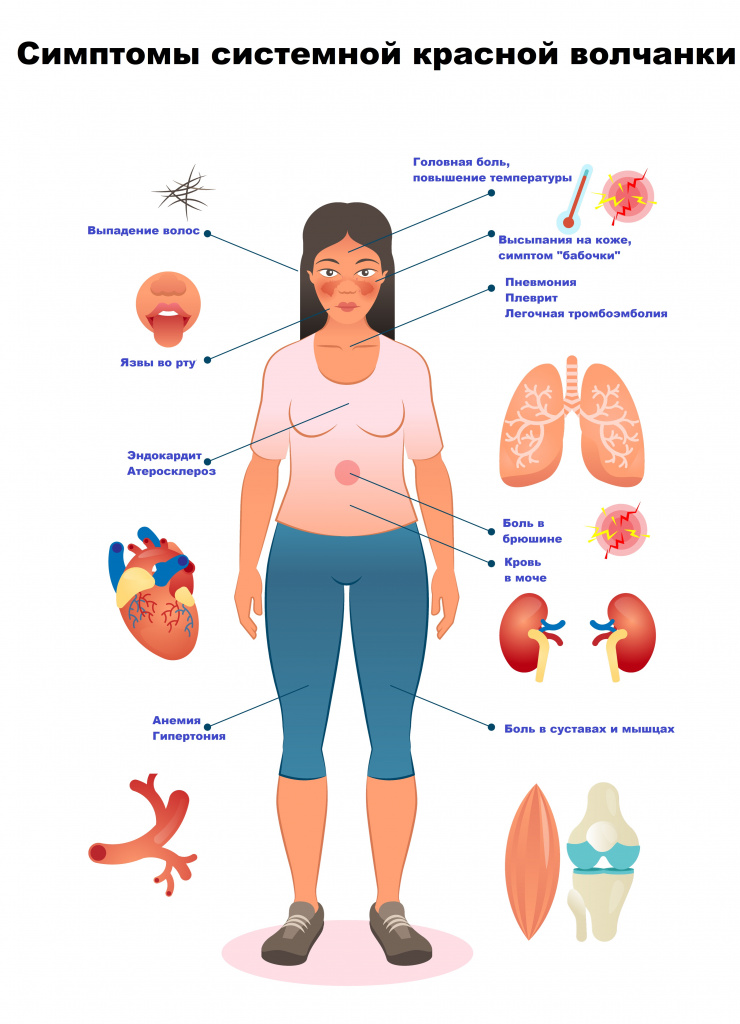
Симптомы системной красной волчанки могут быть весьма разнообразны, поэтому перечислим основные:
- боли в суставах;
- лихорадка (повышение температуры тела);
- головная боль;
- колебания настроения, ухудшение памяти;
- нарушение зрения;
- боль в грудной клетке;
- нарушение аппетита;
- выпадение волос;
- сухость кожи;
- отечность ног и/или периорбитальной зоны;
- увеличение лимфатических узлов;
- кожные высыпания;
- язвы во рту;
- бледные или пурпурные пальцы рук или ног от холода или стресса;
- эритематозный дерматит на лице по типу «бабочки».
Чаще всего волчанка начинается с появления красноты, отека и боли в области суставов, повышения температуры тела, различных кожных высыпаний, недомогания, слабости, снижения веса. Реже бывает острое начало с высокой температурой, резкими болями и припухлостью суставов, симптомом «бабочки», отеками ног, лица, сухостью кожи, снижением количества мочи, что говорит о поражении почек.
Диагностика системной красной волчанки
В первую очередь при постановке диагноза врач должен обращать внимание на жалобы и характерные симптомы заболевания. Для уточнения диагноза и оценки степени поражения потребуются следующие лабораторные и инструментальные обследования:
-
Клинический анализ крови с развернутой лейкоцитарной формулой.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Александрова Н.В. 1 Бенедицкая Е.В. 1 Александров А.В. 1 Алехина И.Ю. 1 Курбанова Р.Д. 1 Шилова Л.Н. 1 Емельянов Н.И. 1
Иммунологическая картина системных ревматических заболеваний характеризуется широким спектром аутоантител. Расширение спектра иммунологических методов диагностики может быть обеспечено внедрением в лабораторную практику иммуноферментного метода на основе иммобилизированных ферментов. Изучение процессов образования антител к ферментам пуринового метаболизма может быть использовано для составления более полной картины иммунологических нарушений, составляю-щих основу системных заболеваний соединительной ткани. По изменению иммунологической активности пуриннуклеозидфосфорилазы, аденозиндезаминазы и гуаниндезаминазы можно судить об активности патологического процесса, а также степени выраженности экстраартикулярных проявлений системной красной волчанки и системной склеродермии. Наличие аутоантител к данным ферментам пуринового метаболизма свидетельствует о глубине нарушения анаболических и деструктивных процессов у больных системной красной волчанкой и системной склеродермией.

2. Заводовский Б.В. Влияние терапии ксидифоном на гистохимические показатели больных системной красной волчанкой / Б.В. Заводовский, И.А. Зборовская, Е.Г. Трофимова, Л.Е. Сивордова // Научно-практическая ревматология. - 2005. - № 3. - С. 44.
4. Мартемьянов В.Ф. Активность энзимов пуринового метаболизма у больных склеродермией / В.Ф. Мартемьянов, Н.Б. Абрамов, С.А. Бедина, М.Ю. Стажаров, Е.Э. Мозговая, А.Б. Зборовский // Российский журнал кожных и венерических болезней. - 2010. - № 1. - С. 34-36.
5. Насонов Е.Л. Клинические рекомендации. Ревматология / под ред. Е.Л. Насонова. - М.: ГЭОТАР - Медиа, 2010. - 288 с.
6. Ревматология: национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. - М.: ГЭОТАР-Медиа, 2008. - 720 с.
8. Deshmukh U.S. Mechanisms of autoantibody diversification to SLE-related autoantigens / U.S. Deshmukh, F. Gaskin, J.E. Lewis, C.C. Kannapell, S.M. Fu // Ann. N.Y. Acad. Sci. - 2003. - Vol. 987 - Р. 91-98.
Распространенность системных ревматических заболеваний, в том числе системной красной волчанки (СКВ) и системной склеродермии (ССД), остается достаточно высокой и отмечается тенденция к ее нарастанию практически во всех возрастных группах.
Известно, что пуриновый обмен, играющий важную роль в поддержании многих функций организма (участие в метаболизме нуклеиновых кислот, регуляции сосудистого тонуса, свертываемости крови и т.д.), участвует в развитии и поддержании хронического воспаления, причем неизбежным следствием длительной тканевой гипоксии является перестройка метаболизма пуринов по катаболическому пути [4]. Иммунологическая картина большинства РЗ характеризуется широким спектром аутоантител, включая антитела к ферментам и антитела к нуклеозидам ДНК. Изменение биохимической и иммунологической активности основных ферментов пуринового метаболизма (ПМ) - пуриннуклеозидфосфорилазы, аденозиндезаминазы и гуаниндезаминазы, - играющих важную роль в организме, отражает нарушения в иммунной системе, а также способствует развитию экстраартикулярных проявлений РЗ.
Учитывая, что как СКВ, так и ССД чаще поражает женщин молодого и среднего возраста, вызывая высокий процент инвалидизации, очень важно правильно и в ранние сроки поставить диагноз. Это не всегда возможно в настоящее время, поэтому изучение патогенетических механизмов болезни, разработка новых диагностических тестов, объективно отражающих активность патологического процесса и позволяющих провести дифференциальную диагностику в группе диффузных заболеваний соединительной ткани, является актуальной задачей современной ревматологии.
Цель исследования: совершенствование методов иммунодиагностики СКВ и ССД с помощью иммобилизированных магнитоуправляемых антигенных наносистем (АНС) на основе пуриннуклеозидфосфорилазы (ПНФ, ЕС 2.4.2.1), аденозиндезаминазы (АДА, ЕС 3.5.4.4) и гуаниндезаминазы (ГДА, ЕС 3.5.4.3).
Материалы и методы исследования
Критерии включения больных СКВ и ССД в исследование: возраст 18 лет (включительно) и старше; наличие информированного согласия; наличие у больного диагноза СКВ или ССД, соответствующего диагностическим критериям; срок, прошедший после установления диагноза, - не менее 6 месяцев.
Критерии исключения больных СКВ и ССД из исследования: беременность или лактация; алкогольная и (или) наркотическая зависимость; инфицирование вирусом иммунодефицита человека или возбудителями вирусных гепатитов В и С; наличие злокачественного новообразования любой локализации на момент отбора; тяжелая сопутствующая патология (сахарный диабет 1 или 2 типа, хроническая сердечная недостаточность 3, 4 функционального класса, хроническая почечная недостаточность в терминальной стадии, дыхательная недостаточность 2, 3 степени), требующая активного лечения.
Под наблюдением находилось 60 больных СКВ. Средний возраст больных СКВ составил 36,32 ± 15,27 (М ± SD) лет, средний возраст лиц контрольной группы (30 доноров крови) - 26,0 ± 5,56 лет. Среди больных СКВ преобладали женщины (91,7%), абсолютное большинство составляли лица трудоспособного возраста (90%). Продолжительность СКВ составила 7,97 ± 7,36 лет, возраст дебюта болезни 28,5 ± 13,2 лет.
Активность СКВ оценивалась с помощью индексов SLEDAI (исходный показатель, М ± SD: 8,9 ± 5,7; 95% доверительный интервал для М - 7,5. 10,4) и ECLAM (исходный показатель, М ± SD: 5,3 ± 2,8; 95% доверительный интервал для М - 4,6. 6,0), а также по критериям, предложенным В.А. Насоновой (1985 г.): низкая - 9, умеренная - 34, высокая - 17 человек. Повреждение (необратимые изменения в состоянии здоровья) измерялось с помощью индекса SLICC/ACR (исходный показатель, М ± SD: 1,9 ± 1,7; 95% доверительный интервал для М - 1,5. 2,4). При оценке течения СКВ по критериям В.А. Насоновой были получены следующие результаты: у 2 пациентов имело место острое течение СКВ, у 44 - подострое, у 14 - хроническое.
Под наблюдением находилось 83 больных с достоверным диагнозом ССД, в том числе 81 (97,6%) - женщина и 2 (2,4%) мужчин. Средний возраст больных ССД составил 50,3 ± 11,9 лет, продолжительность заболевания 8,3 ± 7,06 лет. У 49 (59%) больных диагностировано подострое течение процесса, у 28 - хроническое, а у 6 пациентов - острое. I (начальная) стадия болезни выявлена у 11, II стадия (развернутая) - у 63, III поздняя (терминальная) - у 9 пациентов. Согласно индексам активности болезни, разработанным Европейской группой по изучению ССД [6], I степень активности (0-3 балла) диагностирована у 23, II (3,5-6 баллов) - у 46, III (более 6,5) - у 14 человек.
У всех больных определялся модифицированный кожный счет, оцениваемый в баллах (от 0 до 3) в 17 областях тела [5]. Среднее значение кожного счета составило 12,37 ± 7,18 баллов (таблица).
Выраженность кожного счета в зависимости от степени активности болезни
Примечание: М - среднее значение, m - ошибка репрезентативности, SD - стандартное отклонение, Ме - медиана, ДИ - доверительный интервал, IQR - межквартильный размах, n - количество больных.
С целью выявления тяжести течения болезни также определяли степень выраженности висцеральных поражений, используя критерии, предложенные в клинических рекомендациях Ассоциации ревматологов России. Было диагностировано 47 (56,6%) больных с I стадией выраженности, 28 (33,7%) - со II стадией и 8 (9,6%) - с III стадией.
Контрольную группу составили 30 практически здоровых лиц (17 женщин и 13 мужчин в возрасте от 25 до 47 лет).
Антитела к ПНФ (анти-ПНФ), ГДА (анти-ГДА), АДА (анти-АДА) определяли в сыворотке крови по модифицированной методике иммуноферментного анализа (Гонтарь И.П., 2002) с использованием иммобилизированных магнитоуправляемых антигенных наносистем (АНС) на основе соответствующего фермента в качестве антигенной матрицы. В качестве антигена использовались коммерческие препараты ПНФ, АДА и ГДА («Sigma», США). Иммобилизацию проводили методом эмульсионной полимеризации в потоке газообразного азота с включением магнитного материала в структуру полиакриламидного геля. Результаты учитывали на многоканальном микропланшетном спектрофотометре при длине волны 450 нм и выражали в единицах оптической плотности (Ед). Результаты считались положительными при превышении в дублированных образцах средних показателей оптической плотности средних значений нормальных сывороток (30 здоровых доноров крови) не менее чем на 2 стандартных отклонения.
Статистический анализ экспериментальных данных выполнялся с помощью программного пакета «STATISTICA 6.0 FOR WINDOWS» (StatSoft Inc., USA). Представление описательных статистик и выбор статистических критериев производились исходя из цели исследования, решаемых задач и рекомендаций руководств по биостатистике. Результат считался достоверным при р < 0,05.
Результаты исследования и их обсуждение
Системная красная волчанка
Анти-ПНФ были выявлены у 25 (41,7%) больных СКВ и коррелировали с увеличением индекса SLEDAI (p = 0,012) и активностью ПНФ в сыворотке крови (r = -0,72; p < 0,001). В группе больных СКВ, имеющих повышенные уровни анти-ПНФ, наблюдалось достоверно более частое поражение почек (хи квадрат с поправкой Йетса = 7,34, р = 0,006) и сердечно-сосудистой системы (хи квадрат с поправкой Йетса = 3,78, р = 0,048). Несколько чаще, но статистически незначимо, у больных с наличием анти-ПНФ отмечалось поражение мышц (p = 0,064). Более частое обнаружение анти-ПНФ у больных СКВ с поражением почек, положительная корреляционная связь с величиной протеинурии при этом заболевании, а также положительная динамика уровня анти-ПНФ на фоне терапии могут служить косвенными доказательствами важной роли данных антител в патогенезе нефропатии при СКВ. Наряду с этим, при анализе подгрупп больных СКВ с продолжительностью заболевания менее 1 года анти-ПНФ были обнаружены у 40% (2 из 5) больных.
Антитела к АДА были обнаружены у 22 больных СКВ (36,7%). При анализе зависимостей уровня анти-АДА была выявлена тесная связь с активностью СКВ: коэффициент корреляции с индексами активности SLEDA и ECLAM составил 0,312 (р = 0,017) и 0,328 (р = 0,009), соответственно. Уровень анти-АДА (М ± SD) у больных с умеренной (0,132 ± 0,076) и высокой (0,154 ± 0,082) активностью был значимо выше, чем у больных с низкой активностью СКВ (0,067 ± 0,023). В группе больных СКВ было отмечено, что антитела к фосфолипидам класса IgG чаще и в более высоком титре обнаруживались у анти-АДА-позитивных пациентов, чем у анти-АДА-негативных больных СКВ (c2 = 6,4; р < 0,02). Принимая во внимание, что определенная часть АДА сосредоточена во фракции плазматических мембран эритроцитов и тромбоцитов в виде комплекса с гликопротеидами, представляется вероятным возможность конформационного воздействия анти-АДА на b2-гликопротеин-I, что способствует экспрессии «скрытых» эпитопов в молекуле b2-гликопротеин-I и индукции синтеза антифосфолипидных антител.
При СКВ отмечена положительная корреляция уровня анти-ГДА со значениями индекса SLEDAI (r = 0,361) и отрицательная корреляция с биохимической активностью гуаниндезаминазы в сыворотке крови (r = -0,35). Наиболее высокие уровни анти-ГДА отмечались у больных СКВ с поражением печени (р = 0,024) и у больных с выраженным цитопеническим синдромом (р = 0,039).
При ССД повышенные уровни антител к ПНФ, АДА и ГДА были выявлены у 30 (36%), 45 (54,2%) и 44 (53%) человек (соответственно).
Европейской группой по изучению ССД разработаны и предложены критерии активности ССД по балльной системе оценки разных клинических проявлений заболевания. У больных, набравших 0-3 балла устанавливается I степень активности, 3,5-6 баллов - II степень активности, более 6,5 - III. В соответствии с этими критериями I степень активности диагностирована у 23 (27,7%) из наблюдавшихся нами пациентов, II - у 46 (55,4%), III - у 14 (16,9%). При сравнении больных с разной степенью активности, определенной по балльной системе, получены статистически значимые отличия между изучаемыми показателями для анти-ПНФ (между I и II степенями активности, M(SD): 0,11 ± 0,06 и 0,19 ± 0,09, U-test = 242, р = 0,0003; между II и III степенями активности, M(SD): 0,19 ± 0,09 и 0,27 ± 0,06,: U-test = 143, р = 0,002). При сравнении уровней анти-АДА и анти-ГДА в группах больных ССД с разной степенью активности выявлена тенденция к увеличению количества антител по мере нарастания активности патологического процесса, но отличия не были статистически значимыми (рисунок).
Уровень антител к ферментам пуринового метаболизма в зависимости от степени активности ССД
Наряду с этим в группе больных ССД, позитивных по анти-ПНФ, статистически значимо чаще выявлялись поражения сердца (χ² с поправкой Йетса = 4,16, р = 0,041), легких (χ² с поправкой Йетса = 3,46, р = 0,049), анемия (χ² с поправкой Йетса = 6,95, р = 0,008), выраженный синдром Рейно (χ² с поправкой Йетса = 8,74, р = 0,004). Было выявлено, что все больные с высоким содержанием антител к ПНФ имели высокую степень синдрома Рейно (II - IV), наличие которого приводит к ишемии и, следовательно, гипоксии тканей [1]. В условиях гипоксии происходит перестройка метаболизма пуринов по катаболическому пути и, как следствие этого, наблюдается накопление пуриновых нуклеозидов и оснований, как в клеточном, так и во внеклеточном пространстве, идет избыточное образование гипоксантина и ксантина, снижается или прекращается синтез АТФ в гепатоцитах. Выраженность происходящих явлений может быть связана и с изменением активности ферментов пуринового метаболизма при ССД, в результате которых происходит усиление пероксидации мембранных структур, апоптоза клеток, что при снижении антиоксидантной защиты, в том числе вследствие образования антител к ферментам, наблюдающейся при системных заболеваниях соединительной ткани, способствует развитию различной висцеральной патологии [3].
В группе больных, позитивных по анти-АДА, статистически значимо чаще выявлялось поражение печени (χ² с поправкой Йетса = 5,47, р = 0,02) и почек (χ² с поправкой Йетса = 2,93, р = 0,09).
В группе больных, позитивных по анти-ГДА, статистически значимо чаще выявлялось поражение печени (χ² с поправкой Йетса = 18,95, р = 0,001) и анемия (χ² с поправкой Йетса = 6,92, р = 0,009).
В нормальных условиях собственные белки приводят к развитию естественной толерантности, так как основные антигенные детерминанты собственных белков распознаются Т-клетками, следовательно, не могут вызвать образование антител. В случае изменения конформации белка на его поверхности появляются «скрытые эпитопы», т.е. те антигенные детерминанты, которые не участвовали в процессе выработки иммунологической толерантности, а значит, распознаются как чужеродные антиге- ны [8]. Конформационные изменения структуры белка могут происходить в результате разных причин, например, изменение биохимических параметров окружающей среды (рН, окисление SH-групп и т.д.). Одной из таких возможных причин могут явиться активные формы кислорода (АФК) и усиление перекисного окисления липидов (ПОЛ). При диффузных болезнях соединительной ткани имеет место накопление АФК, вторичных свободнорадикальных продуктов, которые активно реагируют с молекулами в ближайшем окружении [7]. В результате этих процессов происходит усиление пероксидации мембранных структур, апоптоза клеток, что при снижении антиокcидантной защиты, наблюдающейся при СКВ и ССД [3], способствует развитию различной висцеральной патологии. Помимо этого, апоптоз, приводящий к усилению секвестрации аутоантигенов в апоптотические тельца, будет способствовать срыву толерантности и увеличению выработки аутоантител.
Иммунные нарушения и изменения биохимических процессов неразрывно связаны. Так, с одной стороны, иммунные комплексы, находясь в кровеносном русле, в различных органах, способствуют развитию воспалительной реакции с привлечением полиморфно-ядерных нейтрофилов. При этом происходит высвобождение большого количества лизосомальных ферментов, коллагеназы, которые оказывают повреждающее действие на протеогликаны, коллаген и другие структурные компоненты соединительной ткани [2]. Дополнительным стимулятором макрофагов также служат лимфокины, высвобождаемые из активированных Т-клеток.
С другой стороны, активация макрофагов способствует гиперпродукции АФК. Чрезмерное образование свободных радикалов, вызывая повреждение мембран макрофагов, эритроцитов и других клеточных структур, способствует выходу в экстрацеллюлярное пространство многих биологически активных веществ, в том числе и ферментов. Наличие антигенных свойств у ферментов обеспечивает ответную реакцию при их выходе из клетки, а воздействие различных факторов воспаления (лизосомальные ферменты, АФК, продукты ПОЛ) усиливает антигенные свойства энзимов, вследствие возможного окисления их функциональных групп.
Таким образом, АФК играют важную роль в эффекторной фазе иммунного ответа и могут способствовать развитию хронического воспалительного процесса. Кроме того, вызывая повреждение различных клеточных и тканевых структур, они способствуют аутоиммунизации организма и тем самым образованию новых иммунных комплексов. Поэтому становится понятной выявленная нами положительная корреляционная связь между активностью болезни и уровнем антителогенеза к изучаемым энзимам.
Внедрение инновационных методов лабораторной диагностики на основе АНС может быть использовано для определения специфических маркеров СКВ и ССД. По изменению иммунологической активности ферментов ПМ можно судить об активности патологического процесса и степени выраженности экстраартикулярных проявлений системных заболеваний. Наличие аутоантител к ферментам ПМ может свидетельствовать о глубине нарушения анаболических и деструктивных процессов у больных СКВ и ССД.
Зборовский А.Б., д.м.н., профессор кафедры госпитальной терапии ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздравсоцразвития России, г. Волгоград;
Емельянов Д.Н., д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздравсоцразвития России, г. Волгоград.
Диагностика системной красной волчанки головного мозга по КТ, МРТ, ангиограмме
а) Терминология:
1. Сокращения:
• Системная красная волчанка (СКВ), «волчанка»
• Психоневрологическая СКВ (ПНСКВ), СКВ поражение ЦНС
2. Определение:
• Мультисистемное аутоиммунное нарушение:
о Вовлечение в процесс ЦНС наблюдается до 75% случаев
б) Визуализация:
1. Общие характеристики системной красной волчанки сосудов головного мозга:
• Лучший диагностический критерий:
о Наиболее частая находка = мелкоочаговое мультифокальное поражение белого вещества (БВ)
о фокальные инфаркты вариабельных размеров
о Симптоматические «мигрирующие» зоны отека
• Локализация:
о БВ, серое вещество (СВ):
- Субкортикальное БВ лобной, теменной долей - наиболее частая локализация
• Морфология
о Поражения округлой или неправильной формы
2. КТ при системной красной волчанки сосудов головного мозга:
• Бесконтрастная КТ:
о Изменений можете выявляться
о Рассеянные гиподенсные очаги в структуре коры/субкортикальных отделов
о Часто развивается диффузная атрофия
о Возможна визуализация участков инфаркта, кальцификации мозговой ткани
о Возможна визуализация отека головного мозга (волчаночный церебрит):
- Может быть жизнеугрожающим
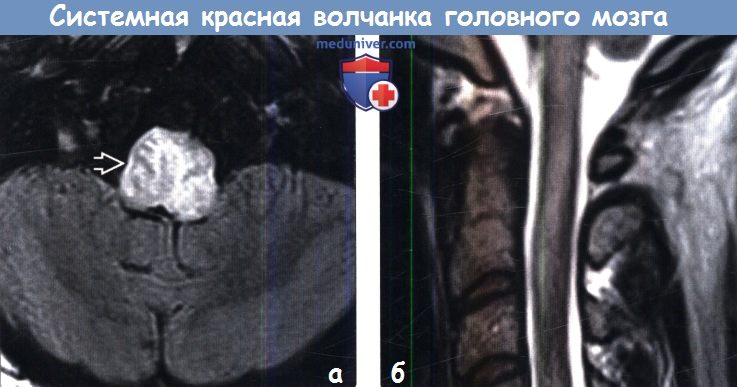
(а) МРТ, FLAIR, аксиальный срез: у женщины 32 лет с СКВ поражением ЦНС определяется выраженное увеличение в размерах ствола мозга, а также повышение интенсивности сигнала от него. В ходе лечения имеющиеся симптомы, а также лучевые признаки полностью разрешились.
(б) МРТ, Т2-ВИ, сагиттальный срез: гиперинтенсивный сигнал от шейного отдела спинного мозга, обусловленный развитием ассоциированного с системной красной волчанкой (СКВ) миелита, одного из типов поперечного миелита.
3. МРТ при системной красной волчанки сосудов головного мозга:
• Т2-ВИ:
о Четыре паттерна поражения:
- Фокальные инфаркты (с ↑ антикардиолипиновых антител, ↑ волчаночного антикоагулянта)
- Мультифокальные гиперинтенсивные на Т2-ВИ очаги (микроинфаркты)
- Гиперинтенсивные очаги, локализованные преимущественно в СВ
- Диффузные участки поражения субкортикальных структур, формирующиеся в ответ на стероидную терапию (↑ антител к нейрофиламентам)
о Наличие острых очагов на Т2-ВИ предполагает активную фазу ПНСКВ:
- Появление новых инфарктов, изолированного повреждения СВ, диффузных участков повышения сигнала от СВ, отека головного мозга
• FLAIR:
о Мультифокальные гиперинтенсивные очаги в БВ
• ДВИ:
о Ограничение диффузии (цитотоксический отек) при ишемии/инфаркте
о Повышение диффузии (вазогенный отек) при васкулопатии
• Постконтрастные Т1-ВИ:
о Возможно контрастное усиление острых/активных очагов поражения ЦНС
• МР-венография:
о Может быть выявлен дуральный венозный тромбоз пазухи
- Особенно в АФС
• МР-спектроскопия:
о Н-МР-спектроскопия у пациентов с ПНСКВ О ↓ N-ацетил-аспартата в очагах поражения мозговой ткани, а также во внешне неизмененном БВ/СВ
о ↑ холина связано с активностью заболевания, развитием инсульта, воспаления, хронического поражения БВ
о Нет ↑ пика лактата → анаэробный метаболизм не является фундаментальной характеристикой ПНСКВ
4. Ангиография:
• КТ-/МР-ангиография/ЦСА-редкое обнаружение волчаночного васкулита головного мозга
5. Радионуклидная диагностика:
• ПЭТ:
о Теменно-затылочной гипометаболизм = наиболее заметная находка при MPT-негативной ПНСКВ
• ОФЭКТ головного мозга с Тс-99m этилцистеинат-димером:
о Чувствительный инструмент для раннего выявления аномалий головного мозга при СКВ (более чувствителен, чем МРТ)
о Относительно неспецифичная региональная гипоперфузия коры головного мозга:
- Основные гипоперфузируемые области: теменные, лобные и височные доли (бассейн кровоснабжения СМА)
о Положительные результаты исследования также наблюдаются у пациентов без психоневрологических симптомов
6. Рекомендации по визуализации:
• Советы по протоколу исследования:
о МРТ в режимах Т2-ВИ, FLAIR, ДВИ
о Рассмотрите также возможность проведения ПЭТ при ПНСКВ в случае отрицательных результатов стандартного МРТ исследования
(а) МРТ, Т2-ВИ, аксиальный срез: значительное повышение сигнала от базальных ганглиев вследствие их отека. Обратите внимание на гиперинтенсивный сигнал от наружной и крайней капсул, обусловленный развитием одной из форм ПНСКВ, вероятно, вследствие развития нейротоксического ответа на антинейрональные антитела.
(б) МРТ, Т1-ВИ, аксиальный срез: мультифокальные участки гипреинтенсивного сигнала от коры затылочной области, повторяющие форму извилин, а также от серого вещества лобной доли в области передней зоны «водораздела» вследствие СЗОЭ - вторичного осложнения системного поражения почек при СКВ. (а) МРТ, Т2-ВИ, аксиальный срез: гиперинтенсивный сигнал от увеличенного в размерах моста и средних ножек мозжечка при нетипичном варианте СКВ-ассоциированного васкулита. Хотя при васкулите малых сосудов поражение структур задней черепной ямки встречается часто, обычно наблюдается мультифокальное поражение периферических структур.
(б) МРТ, постконтрастное Т1-ВИ, аксиальный срез: у этого же пациента определяются две области кольцевого контрастирования центральных отделов моста вследствие формирования участков ишемического некроза. СКВ-ассоциированный васкулит встречается нечасто. Некротические инфаркты при СКВ развиваются еще реже. (а) МРТ, FLAIR, аксиальный срез головного мозга пациента, страдающею СКВ, у которого отмечается появление новых неврологических симптомов. Обратите внимание на множественные гиперинтенсивные очаги в структуре белого вещества и мозолистого тела. У этого пациента также имеется антифосфолипидный синдром, часто встречающийся у пациентов с СКВ.
(б) ЦСА сосудов вертебробазилярною бассейна, боковая проекция: определяются мультифокальные стенозы, что типично для неспецифическою васкулита. Такая патология нечасто наблюдается при СКВ, для которой более характерно развитие васкулита малых сосудов, чем других воспалительных васкулитов. У пациентов с СКВ при ЦСА изменений часто не наблюдается.
в) Дифференциальная диагностика:
1. Артериолосклероз:
• При сахарном диабете, АГ, гиперхолестеринемии
• Гиперинтенсивные на Т2-ВИ очаги в глубоком СВ (базальные ганглии, таламусы), полуовальном центре
• Диффузно расположенные сливающиеся гиперинтенсивные области в перивентрикулярном БВ (лейкоареоз)
2. Рассеянный склероз (PC):
• Гиперинтенсивные на Т2-ВИ очаги в структуре БВ
• Перивентрикулярное БВ (каллосептальный переход)
• Поражения мозговой ткани при СКВ не ограничиваются перивентрикулярным БВ, локализуются в области перехода СВ-БВ или в структуре коры/глубоких ядер
3. Антифосфолипидный синдром (не СКВ):
• Спонтанный аборт, тромбоцитопения
• Ранний инсульт, рецидивирующие артериальные + венозные тромбозы
• Инфаркты вариабельных размеров и гиперинтенсивные на Т2-ВИ очаги в структуре БВ
4. Лайм-энцефалопатия:
• Гиперинтенсивные на Т2-ВИ очаги в структуре перивентрикулярного БВ
• Возможно контрастирование, схожее с очагами PC или ОДЭМ
5. Синдром Сусака:
• Микроангиопатия неизвестной этиологии
• Триада: головные боли/энцефалопатия, окклюзия ветвей артерии сетчатки, потеря слуха
• Мультифокальные гиперинтенсивные на Т2-ВИ, FLAIR очаги в структуре глубокого БВ, мозолистого тела:
о Центральные отделы мозолистого тела > каллозосептальный переход
о Возможно контрастное усиление (острый)
о Центральные «дыры» в мозолистом теле в подострую/хроническую стадию
6. Другие васкулиты:
• Первичный ангиит ЦНС, узелковый полиартериит (УПА), гранулематоз Вегенера, болезнь Бехчета, сифилис, синдром Шегрена
г) Патология:
1. Общие характеристики системной красной волчанки сосудов головного мозга:
• Этиология:
о ПНСКВ, вероятно, имеет мультифакторный генез
о Диффузные психоневрологические симптомы:
- Нейрональная дисфункция, опосредованная антителами: антинейрональные, антирибосомальный Р-белок, анти-цитокины
о Очаговые неврологические симптомы:
- Циркулирующие иммунные комплексы → повреждение сосудов
- Активация эндотелиальных клеток цитокинами и активация комплемента → окклюзионная васкулопатия
- Антифосфолипидные антитела (APL-Ab) → макро- и микрососудистый тромбоз
о Поздняя стадия СКВ: ускоренное развитие атеросклероза:
- ↑ комплемента и APL-Ab во внутрисосудистом русле
• Генетика:
о Генетическая предрасположенность к СКВ:
- Гены HLA-DR2, HLA-DR3, нулевые аллели гена комплемента
- Врожденный дефицит комплемента (С4, С2)
• Ассоциированные аномалии:
о СКВ-ассоциированный миелит (поперечный миелит) о Эндокардит Либмана-Сакса, эмболия о АФС
о Синдром задней обратимой энцефалопатии (СЗОЭ)
2. Макроскопические и хирургические особенности:
• Атрофия коры головного мозга, инфарктов, кровоизлияний
• Васкулит → ЦНС ишемия или кровоизлияние (интрапаренхимальное/субарахноидальное)
• Отек → обратимая лейкоэнцефалопатия
• БВ дегенерация, миелин вакуолизация спинного мозга
д) Клиническая картина:
1. Проявления системной красной волчанки сосудов головного мозга:
• Наиболее частые признаки/симптомы:
о Вовлечение в процесс ЦНС наблюдается до 75% случаев:
- Мигрень, судороги, инсульт, хорея
- Поперечная миелопатия, невропатия черепных нервов, асептический менингит
- Психоз, расстройства настроения, острое состояние спутанности сознания, когнитивная дисфункция
о Субклиническое поражение ЦНС при СКВ: преходящее событие
• Клинический профиль:
о Мультисистемное аутоиммунное нарушение с поражением дыхательной, сердечно-сосудистой, мочеполовой системы, ЖКТ, опорно-двигательного аппарата и ЦНС
о Вовлечение в патологический процесс головного мозга может предшествовать развернутой картине СКВ или развиваться по мере течения болезни:
- Чаще всего в течение первых трех лет
о Нарушения психического статуса, диффузные или очаговые неврологические симптомы
о Двигательные нарушения (хорея, паркинсонизм)
о Нередко перекрытие с антифосфолипидным синдромом (АФС)
- 25-40% пациентов, страдающих СКВ имеют АФС
2. Демография:
• Возраст:
о Может развиваться во всех возрастных группах; пик заболеваемости - молодые взрослые (20-45)
• Пол:
о Выраженное преобладание женского пола (5:1 -среди женщин детородного возраста)
• Этническая принадлежность:
о Высокая распространенность среди афроамериканских женщин
• Эпидемиология:
о Заболеваемость СКВ (США): 14,6-50,8 на 100000 человек
о СКВ поражение ЦНС встречается у 30-40% пациентов с СКВ
3. Течение и прогноз:
• Неврологические осложнения ухудшают прогноз СКВ:
о Преходящий неврологических дефицит, хроническое повреждение головного мозга
• Пациенты, страдающие СКВ, у которых обнаруживаются APL-Ab имеют дополнительный риск психоневрологических проявлений
• Показатель смертности при ПНСКВ: 7-40%
4. Лечение:
• Иммунодепрессанты (стероиды, цикпофосфамид) при подозрении на васкулит
• Пожизненная антикоагулянтная терапия APL-Ab-опосредованных тромбоэмболических событий
• Интратекальное введение метотрексата в сочетании с дексаметазоном в тяжелых случаях
• Первичная профилактика ускоренного развития атеросклероза и сужения просвета кровеносных сосудов: профилактический прием аспирина, гиполипидемические препараты
е) Диагностическая памятка:
1. Обратите внимание:
• Дифференцировка активных очагов ПНСКВ от старых представляет трудную задачу
• Проведение МРТ с ДВИ в течение 24 часов после возникновения неврологического события
2. Советы по интерпретации изображений:
• Важнейшая цель диагностической визуализации ПНСКВ: оценка острого очагового (инсультоподобного) неврологического дефицита:
о СКВ-опосредованный васкулит ЦНС
о Тромбоэмболические события, обусловленные васкулопатией или эндокардитом (Либмана-Сакса)
о APL-Ab-опосредованный тромбоз
о Микроангиопатия(включаятромботическуютромбоцитопени-ческую пурпуру)
о Ускоренное развитие атеросклероза
• Отрицательные результаты МРТ головного мозга не исключают СКВ поражения головного мозга
Лечение системной красной волчанки (СКВ) у детей. Прогноз
Лечение системной красной волчанки у детей зависит от того, какие органы и в какой степени поражены. Состояние больных оценивают на основании серологических маркеров активности заболевания, в том числе уровня комплемента в сыворотке крови. Применять НПВС следует с осторожностью, поскольку больные СКВ особенно чувствительны к гепатотоксическому действию этих средств. В относительно легких случаях (слабо выраженные кожные симптомы, утомляемость, артрит и артралгия) можно использовать противомалярийное средство гидроксихлорохин.
Больным с тромботическими осложнениями, антителами к фосфолипидам или волчаночным антикоагулянтом по крайней мере на период ремиссии следует назначать антикоагулянты. Препарат Для ослабления симптомов и блокады продукции антител применяют кортикостероиды, которые улучшают функцию почек и увеличивают выживаемость больных. Однако на фоне приема этих препаратов трудно диагностировать туберкулез. Поэтому перед их назначением всем больным необходимо проводить кожные туберкулиновые пробы. Относительно оптимальных доз и способов введения кортикостероидов существуют разногласия. При системных проявлениях заболевания обычно назначают преднизон внутрь по 1-2 мг/кг/сут дробными дозами. После нормализации уровне комплемента дозу постепенно, на протяжении 2-3 лет снижают, доводя ее до минимально эффективной.
Один из способов избежать побочночного действия кортикостероидов — принимать их через день. В тяжелых случаях может потребоваться пульс-терапия: на протяжении 3 дней 1 раз в сутки в течение 60 мин внутривенно вводят кортикостероид в дозе 30 мг/кг (но не более 1 г). В некоторых клиниках периодическое внутривенное введение кортикостероидов в высоких дозах сочетают с ежедневным приемом их низких доз внутрь. Побочные эффекты кортикостероидной терапии включают артериальную гипертонию, гастрит, катаракта, остеопению и кушингоидный облик.
При тяжелом течении болезни используют и цитотоксические средства. Внутривенная пульс-терапия циклофосфамидом замедляет прогрессирование волчаночного нефрита, особенно диффузного пролиферативного гломерулонефрита. Однако необходимая продолжительность такого лечения не определена. Циклофосфамид применяют при васкулите, легочном кровотечении и нарушениях ДНС, не поддающихся кортикостероидной терапии. Для замедления патологического процесса в почках используют и азатиоприн. Последствия длительной цитотоксической терапии, особенно у детей, практически неизвестны.
Ее побочные эффекты включают вторичные инфекции, нарушение функции половых желез и, возможно, повышение риска злокачественных опухолей. Применение цитотоксических средств в препубертатном возрасте сопряжено, вероятно, с меньшим риском последующего нарушения половой функции, чем их использование после начала полового созревания. Эффективность метотрексата, циклоспорина и микофеноловой кислоты остается неизвестной.
У взрослых больных с тяжелым течением СКВ испытывают действие гормональной терапии и трансплантации стволовых клеток костного мозга из пуповинной крови. Разрабатываются и биологические препараты, влияющие на продукцию цитокинов. Анализ мочи не всегда отражает степень поражения почек, и для оценки стадии заболевания иногда требуется биопсия почек. Исследование биоптатов помогает решить, нужно ли добавлять к кортикостероидной еще и иммуносупрессивную терапию (например, циклофосфамид). Пo классификации ВОЗ, выделяют шесть типов волчаночного нефрита.
Тип I — отсутствие изменений при световой и электронной микроскопии и иммунофлюоресцентном исследовании.
Тип IIA — минимальные отложения иммуноглобулинов и комплемента в мезангии, определяемые методами иммунофлюоресценции. В этих случаях прогноз в отношении функции почек хороший.
Тип IIB (мезангиальный гломерулонефрит) — лимфопролиферативная инфильтрация мезангия; мезангиальный гломерулонефрит иногда прогрессирует до более обширного поражения почек.
Тип III (очаговый и сегментарный пролиферативный гломерулонефрит) - очаговая пролиферация клеток вокруг капилляров с некрозом и лимфоцитарной инфильтрацией; часто приводит к хронической почечной недостаточности.
Тип IV (диффузный пролиферативный гломерулонефрит) — большая часть каждого клубочка заполнена клеточным инфильтратом, наблюдаются пролиферация клеток мезангия и новообразование капилляров одновременно с рубцеванием клубочков. У 50 % больных через 10 лет развивается хроническая почечная недостаточность; внутривенная пульс-терапия циклофосфамидом может снизить риск этого осложнения.
Тип V (мембранозная нефропатия) — утолщение стенок капилляров при световой микроскопии, а при электронной микроскопии видны субэпителиальные отложения и утолщение базальной мембраны. Эти изменения сопровождаются протеинурией (которая бывает и при других типах волчаночного нефрита); хроническая почечная недостаточность в таких случаях плохо поддается лечению.
При терапии СКВ важнее всего тщательно и повторно обследовать больных, уделяя особое внимание состоянию почек и серологическим признакам обострения болезни. Быстрое выявление и лечение обострений чрезвычайно важно для улучшения прогноза. СКВ — пожизненное заболевание, требующее постоянного врачебного наблюдения.
Осложнения и прогноз системной красной волчанки у детей
СКВ у детей раньше считали безусловно смертельным заболеванием. Совершенствование диагностики и лечения привело к тому, что 5-летняя выживаемость в настоящее время превышает 90%. Тем не менее многие больные позднее погибают. К наиболее частым причинам смерти таких больных относятся инфекции, нефрит, поражение ЦНС, легочные кровотечения и инфаркт миокарда. Поздние осложнения, связанные с отложением в тканях иммунных комплексов, могут быть следствием хронической кортикостероидной терапии.
СКВ у новорожденных обусловлена переносом материнских IgG-аутоантител (обычно к Ro-антигенам клеточных ядер) между 12-й и 16-й неделей беременности. Проявления включают врожденную АВ-блокаду, поражения кожи, гепатит, тромбоцитопению, нейтропению, а также поражения легких и ЦНС. Поражения кожи развиваются после УФ-облучения примерно на 6-й неделе жизни и сохраняются в течение 3-4 мес. Сыпь чаще всего появляется на лице и голове и в 25 % случаев оставляет после себя рубцы. Лечение симптоматическое. Большинство проявлений болезни исчезает, но АВ-блокада сохраняется и часто требует электрокардиостимуляции либо после рождения, либо, если блокаду удается выявить у плода, внутриутробно. При СКВ у матери на ЭКГ ребенка, даже в отсутствие симптомов, часто обнаруживается удлинение интервалов P-R. В редких случаях наблюдается кардиомиопатия, иногда требующая трансплантации сердца.
СКВ у новорожденных следует отличать от мультисистемной воспалительной болезни — редкого синдрома с лихорадкой, сыпью, артропатией, хроническим менингитом, судорогами, увеитом и лимфаденопатией. Этот синдром плохо поддается лечению и обычно требует длительного применения иммуносупрессивных средств.
Читайте также:

