Низкий гемоглобин при трофической язве
Обновлено: 01.05.2024
Анемия часто встречается при злокачественных заболеваниях, в частности у большинства пациентов, получающих химиотерапию. В статье обсуждаются причины анемии у онкологических больных и методы ее лечения, в том числе трансфузии эритроцитарной массы, стимуляторы эритропоэза и внутривенные препараты железа.
Ключевые слова: злокачественные опухоли, анемия, гемотрансфузии, стимуляторы эритропоэза, препараты железа.
Anaemia in oncology diseases
S.V. MOISEYEV
Department of Therapy and Occupational Diseases, I.M. Sechenov First Moscow State Medical University, Department of Internal Medicine, Faculty of Fundamental Medicine, M.V. Lomonosov Moscow State University
Anemia is common in malignant diseases, particularly in most patients receiving chemotherapy. The paper discusses the causes of anemia in cancer patients, its treatments, including packed red blood cell transfusion, erythropoietic stimulants, and intravenous iron preparations.
Key words: malignant tumors, anemia, hemotransfusion, erythropoietic stimulants, iron preparations.
Причины анемии в онкологии
Причины анемии можно разделить на 3 группы: снижение образования эритроцитов, усиление их разрушения и кровопотеря. У онкологических больных анемия имеет сложное происхождение и может быть обусловлена различными причинами, включая дефицит железа (хроническая кровопотеря, например, при колоректальном раке; недостаточное поступление железа при нарушении питания, связанном с отсутствием аппетита или тошнотой/рвотой; снижение всасывания железа при анемии хронических заболеваний), подавление эритропоэза (инфильтрация костного мозга опухолевыми клетками, например, при гемо-бластозах; подавление эритропоэза под действием различных цитокинов), гемолиз. Важную роль в развитии анемии играют химиотерапия и лучевая терапия, которые оказывают прямое подавляющее действие на кроветворение. Некоторые противоопухолевые препараты (например, содержащие платину) обладают нефротоксичностью и могут вызывать анемию за счет снижения образования эритропоэтина в почках. Миелосупрессивный эффект цитотоксических препаратов может накапливаться при повторных циклах химиотерапии, что приводит к постепенному нарастанию анемии. Так, в исследовании ECAS частота анемии увеличилась с 19,5% в первом цикле химиотерапии до 46,7% в пятом цикле [3]. Увеличение числа циклов химиотерапии сопровождалось также ростом доли больных с анемией 2-3-й степени.
Выяснение причины анемии у больных с онкологическими заболеваниями имеет ключевое значение при выборе метода лечения [5]. В зависимости от среднего объема эритроцитов (MCV) выделяют следующие типы анемии: микроцитарная (100 fL), нормоцитарная (80-100 fL).
Основными причинами микроцитарной анемии являются дефицит железа и анемия хронических заболеваний. Макроцитарная анемия (в большинстве случаев мегалобластная) обусловлена дефицитом витамина В12 или фолиевой кислоты. Нормоцитарная анемия развивается при кровопотере, гемолизе, недостаточности костного мозга, хронических заболеваниях и почечной недостаточности. На следующем этапе дифференциальной диагностики рассчитывают ретикулоцитарный индекс (РИ) по формуле:
РИ = число ретикулоцитов (%) х Ht / 45%,
где Ht - гематокрит, 45% - нормальное значение гематокрита.
В норме РИ составляет 1,0-2,0. Низкое значение индекса свидетельствует о снижении образования эритроцитов, которое может быть следствием дефицита железа, витамина В12 или фолиевой кислоты, аплазии костного мозга или дисфункции костного мозга, в том числе связанной с химиотерапией. Высокий РИ соответствует нормальному или повышенному образованию эритроцитов в костном мозге, которое характерно для кровопотери или гемолитической анемии.
Лечение анемии при опухолях
Основными методами лечения анемии при онкологических заболеваниях, в том числе связанной с химиотерапией, являются трансфузии эритроцитной массы и введение препаратов эритропоэтина, стимулирующих эритропоэз. Последние необходимо сочетать с применением внутривенных препаратов железа с целью устранения функционального дефицита железа (см. ниже). При абсолютной недостаточности железа возможно введение только препаратов железа. В эпидемиологическом исследовании ECAS, проводившемся в европейских странах, лечение анемии, связанной со злокачественными опухолями, проводилось всего у 39% больных [3]. Чаще всего с лечебной целью применяли препараты эритропоэтина (44%) ± препараты железы или проводили трансфузии эритроцитной массы (38%), несколько реже назначали только препараты железа (17%). Средний уровень гемоглобина, при котором врачи начинали терапию, составлял около 10 г/дл.
Трансфузии эритроцитной массы
Основное преимущество трансфузии аллогенной эритроцитной массы перед другими методами лечения анемии - быстрое увеличение уровня гемоглобина и гематокрита. Введение одной единицы эритроцитной массы (300 мл) вызывает увеличение уровня гемоглобина в среднем на 1 г/дл или гематокрита на 3% [6, 7]. Однако трансфузия эритроцитной массы дает кратковременный эффект и при хронической анемии не может рассматриваться как альтернатива другим методам лечения. Важное значение для оценки целесообразности гемотрансфузии имеет степень снижения уровня гемоглобина. Так, в руководстве EORTC указано, что трансфузия эритроцитной массы обоснована при снижении уровня гемоглобина
Однако при необходимости гемотрансфузии нельзя ориентироваться только на определенный пороговый уровень гемоглобина. Американские эксперты (National Comprehensive Cancer Network) в рекомендациях 2012 г. [5] предлагают выделять 3 категории онкологических пациентов с анемией: бессимптомная анемия, не сопровождающаяся серьезными сопутствующими заболеваниями; бессимптомная анемия, сочетающаяся с серьезными сопутствующими заболеваниями (застойная сердечная недостаточность, ишемическая болезнь сердца, хронические заболевания легких, цереброваскулярная болезнь) или ассоциирующаяся с высоким риском (прогрессирующее снижение уровня гемоглобина после интенсивной химиотерапии или лучевой терапии); анемия, сопровождающаяся клиническими симптомами (стойкая тахикардия, одышка, боль в груди, головокружение, обмороки, выраженная утомляемость), которые ограничивают трудоспособность или повседневную активность. При первой категории трансфузия эритроцитной массы не требуется, однако пациенты должны оставаться под наблюдением. При второй категории решение о гемотрансфузии принимают индивидуально с учетом степени снижения уровня гемоглобина, тяжести сопутствующих заболеваний, риска дальнейшего нарастания анемии или нарушения гемодинамики и т.п. При третьей категории следует проводить трансфузию эритроцитной массы. Выраженность клинических проявлений анемии зависит от скорости и степени снижения уровня гемоглобина, длительности анемии, а также других факторов, оказывающих влияние на потребность тканей в кислороде. Если анемия развивается остро, то симптомы ее обычно более тяжелые, в то время как при постепенном снижении уровня гемоглобина физиологические механизмы (увеличение сердечного выброса и коронарного кровотока, изменения вязкости крови, повышение экстракции кислорода) могут компенсировать ухудшение способности крови к переносу кислорода. Пациенты с заболеваниями сердечно-сосудистой системы или легких хуже переносят анемию вследствие нарушения компенсаторных механизмов. Даже при отсутствии клинических симптомов и сопутствующих заболеваний гемотрансфузии после химиотерапии могут быть показаны при прогрессировании снижения уровня гемоглобина.
Трансфузии эритроцитной массы могут вызывать различные осложнения, которые разделяют на следующие группы: острые иммунные (гемолитические, фебрильные негемолитические, аллергические и гемотрансфузионное острое поражение легких); острые неиммунные (бактериальные и вирусные инфекции, циркуляторная перегрузка, физический и/или химический гемолиз, эмболия, цитратная интоксикация, гиперкальциемия); отсроченные иммунные (гемолитические, болезнь «трансплантат против хозяина», посттрансфузионная пурпура) и неимунные (гемосидероз) [10].
В нескольких ретроспективных исследованиях было показано, что трансфузии эритроцитной массы у пациентов, которым проводилось хирургическое лечение некоторых злокачественных опухолей, в частности головы и шеи, могут ассоциироваться с увеличением частоты рецидивов и снижением общей выживаемости [11]. A. Churchhousea и соавт. [12] на основании 21 публикации проанализировали связь между гемотрансфузиями и исходами у 5378 пациентов, перенесших хирургическое лечение рака легкого. В части исследований было показано, что трансфузии сопровождаются увеличением риска рецидива опухоли после операции, а также снижением выживаемости. По мнению авторов, остается неясным, дают ли гемотранфузии прямой неблагоприятный эффект, или полученные данные отражают наличие других факторов, в частности самой анемии. Необходимо учитывать, что окончательно возможная связь между трансфузиями эритроцитарной массы и выживаемостью больных или риском рецидива опухоли не установлена. В приведенных выше исследованиях оценивали исходы у пациентов, которым проводилось хирургическое лечение опухолей, поэтому полученные результаты нельзя экстраполировать на другие клинические ситуации. Теоретический риск неблагоприятных исходов не может служить основанием для отказа от проведения трансфузии эритроцитной массы в тех случаях, когда это необходимо.
Стимуляторы эритропоэза
Альтернативой гемотрансфузиям в лечении анемии, связанной с химиотерапией, и анемии хронических заболеваний являются стимуляторы эритропоэза, которые включают в себя эритропоэтины альфа и бета и длительно действующие препараты, в том числе дарбэпоэтин альфа и метоксиполиэтиленгликольэпоэтин бета (активатор рецепторов эритропоэтина длительного действия). С 1993 г. эффективность этих препаратов в онкологической практике изучалась более чем в 80 контролируемых исследованиях, а также многочисленных мета-анализах [13]. J. Bohlius и соавт. [14] провели систематизированный обзор и метаанализ 57 рандомизированных клинических исследований, в которых сравнивали эффективность препаратов эритропоэтина в сочетании с трансфузиями эритроцитной массы или только гемотрансфузий в профилактике и лечении анемии у 9353 онкологических больных. Лечение эритропоэтином или дарбэпоэтином альфа привело к значительному снижению относительного риска трансфузии эритроцитной массы на 36% (относительный риск (ОР) 0,64; 95% доверительный интервал (ДИ) 0,60-0,68) и улучшению гематологического ответа (ОР 3,43; 95% ДИ 3,07-3,84).
Более сложным является вопрос о влиянии стимуляторов эритропоэза на выживаемость онкологических больных. В 2007 г. Администрация США по контролю за пищевыми продуктами и лекарствами (FDA) на основании результатов нескольких рандомизированных исследований рекомендовала внести в инструкцию по применению эритропоэтина альфа и дарбэпоэтина альфа предостережение, в котором лечение стимуляторами эритропоэза ассоциировалось со снижением общей выживаемости и/или локального контроля опухоли у пациентов с распространенным раком молочной железы, шейки матки, опухолями головы и шеи, лимфомами и немелкоклеточным раком легких [5]. В 3 из 8 исследований эффективность стимуляторов эритропоэза изучалась у пациентов, получавших химиотерапию, во всех исследованиях целевой уровень гемоглобина превышал 12 г/дл. Необходимо отметить, что у пациентов с хронической болезнью почек, которая остается основным показанием к лечению стимуляторами эритропоэза, более высокие целевые уровни гемоглобина при применении подобных препаратов также ассоциировались с ухудшением исходов [19]. Увеличение риска смерти при лечении стимуляторами эритропоэза у онкологических больных было подтверждено в нескольких метаанализах более 50 рандомизированных контролируемых исследований. Относительный риск смерти составлял от 1,10 до 1,17, т.е. увеличился на 10-17% [15, 16, 20]. В то же время H. Ludwig и соавт. [17] и J. Glaspy и со-авт. [18] не подтвердили неблагоприятное влияние стимуляторов эритропоэза на выживаемость больных или прогрессирование опухолей.
Эксперты FDA считают возможным применение стимуляторов эритропоэза только для лечения анемии, вызванной химиотерапией. После завершения курса химиотерапии эти препараты следует отменить [21]. Стимуляторы эритропоэза могут усиливать опухолевый рост, поэтому их нецелесообразно назначать в тех случаях, когда ожидаемым результатом первичной и адъювантной химиотерапии является излечение. Однако препараты эритропоэтина могут применяться у пациентов, которым проводится паллиативная химиотерапия [5]. Сходной позиции придерживаются и эксперты Европейского агентства по лекарствам (ЕМА) [22]:
Препараты железа
По данным M. Aapro [23], частота дефицита железа у онкологических больных составляет от 32 до 60%, при этом у большинства из них выявляется анемия [23]. Частота дефицита железа была выше всего (60%) у пациентов с колоректальным раком, что, вероятно, отражало более высокую частоту хронической кровопотери у таких пациентов [24]. В исследовании H. Ludwig [25] было показано, что дефицит железа не только приводит к развитию анемии, но и сам (т.е. без анемии) может ассоциироваться с ухудшением общесоматического статуса по ВОЗ. В дополнительных исследованиях [26, 27] у пациентов с хронической сердечной недостаточностью восполнение дефицита железа приводило к значительному увеличению толерантности к физической нагрузке и улучшению качества жизни независимо от наличия анемии. Причинами дефицита железа у онкологических больных могут быть не только кровопотеря или нарушение поступления железа при анорексии или после хирургического лечения опухолей желудочно-кишечного тракта, но и другие факторы, прежде всего увеличение секреции гепцидина - гормона, который образуется в печени, взаимодействует с ферропортином (белком, осуществляющим транспорт железа) и подавляет всасывание железа в кишечнике и его высвобождение из депо и макрофагов [28]. Повышение уровня гепцидина, отмечающееся при воспалении, считают основной причиной анемии хронических заболеваний. Дефицит железа может быть не только абсолютным, но и функциональным. Последний возникает в том случае, когда адекватное или даже повышенное общее содержание железа в организме оказывается недостаточным при увеличении потребности в нем костного мозга на фоне стимуляции эритропоэза под действием эритропоэтина. Пролиферирующим эритробластам необходимо все большее количество железа, что приводит к истощению лабильного пула железа и снижению сывороточного уровня ферритина. Для мобилизации и растворения железа, хранящегося в виде гемосидерина, требуется определенное время. В результате уменьшается количество поступающего в костный мозг железа, что приводит к развитию его функционального дефицита [19].
Препараты железа можно назначать внутрь или внутривенно. Хотя пероральные препараты удобнее парентеральных, они оказывают медленное действие и часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (у 10-40% пациентов). Внутривенное введение препаратов железа считают методом выбора, если необходимо добиться быстрого восполнения дефицита железа и увеличения уровня гемоглобина, например, при анемии, вызванной химиотерапией, а также при наличии анорексии или тошноты/рвоты, которые не позволяют принимать препараты железа внутрь. Кроме того, внутривенное введение железа считают более эффективным при лечении препаратами, стимулирующими эритропоэз. Некоторые препараты железа можно вводить внутримышечно, однако эти инъекции болезненны, вызывают изменение цвета кожи и ассоциируются с развитием саркомы ягодичной мышцы [30]. По мнению М. Auerbach и соавт. [31], от внутримышечного введения препаратов железа следует отказаться.
В России для внутривенного введения применяют карбоксимальтозат железа (феринжект), сахарат железа (венофер), глюконат железа (феррлецит) и декстран железа (космофер), которые представляют собой сферические железоуглеводные коллоиды. Углеводная оболочка придает комплексу стабильность, замедляет высвобождение железа и поддерживает образующиеся формы в коллоидной суспензии. Эффективность и безопасность внутривенных препаратов железа зависят от их молекулярной массы, стабильности и состава. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей. Значительная часть дозы подобных препаратов выводится через почки в первые 4 ч после приема препарата, и железо не используется для эритропоэза. Препараты декстрана железа характеризуются высокой молекулярной массой и стабильностью, но их применение связано с повышенным риском аллергических реакций. Карбоксимальтозат железа является железоуглеводным коллоидом, не содержащим декстран, крайне редко вызывает аллергические реакции и, в отличие от сахарата и глюконата железа, может вводиться в более высокой дозе.[32]. При применении карбоксимальтозата железа 1000 мг железа можно ввести внутривенно капельно в течение 15 мин, в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 3,5 ч, а длительность инфузии декстрана железа достигает 6 ч. Причем в двух последних случаях перед началом инфузии необходимо ввести тестовую дозу препарата. Введение большой дозы железа позволяет сократить необходимое число инфузий и затраты на лечение. Помимо удобства применения важными свойствами карбоксимальтозата железа являются низкая токсичность и отсутствие оксидативного стресса, которые определяются медленным и физиологичным высвобождением железа из стабильного комплекса с углеводом, по структуре сходного с ферритином. Феринжект вводят внутривенно в виде болюса (максимальная доза 4 мл, или 200 мг железа, не более 3 раз в неделю) или капельно (максимальная доза 20 мл, или 1000 мг железа, не чаще 1 раза в неделю).
Применение внутривенного введения препаратов железа может ассоциироваться со снижением затрат на лечение вследствие уменьшения доз, стимулирующих эритропоэз, и потребности в гемотрансфузии. F. Petrelli и соавт. [36] провели метаанализ рандомизированных контролируемых исследований, в которых изучали эффективность перорального и парентерального введения препаратов железа у 1606 онкологических больных, получавших стимуляторы эритропоэза. Парентеральная терапия привела к снижению риска гемотрансфузии на 23% и увеличению вероятности ответа на стимуляторы эритропоэза на 29%, в то время как пероральное применение препаратов железа не оказывало влияния на эти показатели.
В исследовании M. Hedenus и соавт. [37] внутривенное введение препарата железа позволило снизить дозу эритропоэтина бета, которое достигло статистической значимости через 13 нед (р=0,029). В целом кумулятивная доза эритропоэтина снизилась на 25%. Возможность уменьшения доз стимуляторов эритропоэза имеет важное значение для безопасного лечения этими препаратами, а также и сокращения затрат. В приведенном выше исследовании экономия затрат, связанная со снижением доз эритропоэтина, покрывала любые дополнительные затраты на внутривенное введение препарата железа.
В первом опубликованном исследовании у пациентов, получавших стимуляторы эритропоэза, суммарная доза препаратов железа достигала 3000 мг [34], однако в остальных 5 исследованиях она составляла около 1000 мг [23].
Заключение
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Трофическая язва: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Трофическая язва – это дефект покровных (кожи или слизистых оболочек) и мягких тканей, который не заживает на протяжении более 6 недель и возникает на фоне микроциркуляторных нарушений вследствие внешних или внутренних причин. Патология не является самостоятельной болезнью, а развивается вследствие различных заболеваний при нарушении кровотока, оттока лимфы и ухудшении питания (трофики) тканей. Трофическая язва характеризуется неспособностью тканей к самозаживлению.
Механизм формирования язвы кроется в длительной ишемии тканей, скоплении продуктов распада клеток, медиаторов воспаления и иммунных клеток. Под действием этих факторов развивается локальный некроз и отслоение поверхностных тканей с образованием открытого дефекта.
Трофические язвы могут появиться на любом участке тела, но чаще всего они локализуются на нижних конечностях (стопах, лодыжках, голенях).
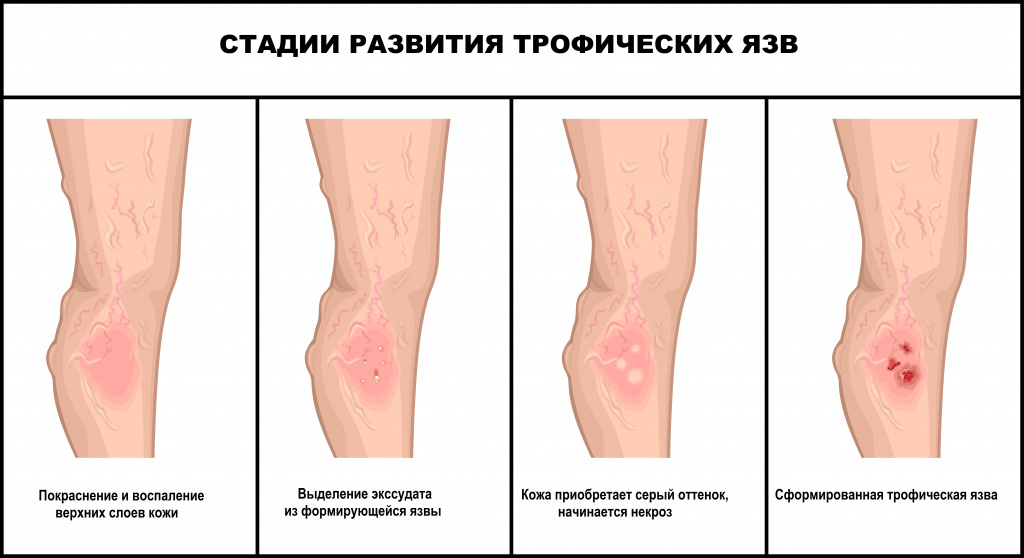
Предшествуют развитию язв сильная боль, отек, зуд и жжение кожи. На начальном этапе образуются глянцевые пятна темных оттенков, которые со временем превращаются в эрозии. На второй стадии процесс затрагивает не только эпителий, но и подкожные слои, кожа по краям раны становится неоднородной, приобретает синий оттенок, рана мокнет и болит. На последней стадии в патологический процесс вовлекаются клетчатка, мягкие ткани (мышцы), иногда твердые (сухожилия и даже кости), при прикосновении начинается кровоточивость. Внешне трофическая язва выглядит как мокнущая рана.
Открытая трофическая язва – это всегда потенциальный источник инфекции, многократно повышающий риск развития рожистого воспаления, флегмоны, лимфаденита, сепсиса, газовой гангрены. Проникновение патогенных микроорганизмов в суставы и костную ткань (остеомиелит) может привести даже к ампутации конечности.
Трофическая язва, представляя собой хронический воспалительный процесс, имеет риск злокачественного перерождения (малигнизации).
Разновидности трофических язв
Трофические язвы не возникают сами по себе, а являются следствием уже имеющейся патологии. В зависимости от этиологического фактора они могут быть следующих видов:
- венозная – вызвана варикозной болезнью или хронической венозной недостаточностью;
- артериальная – спровоцирована патологией артерий, чаще облитерирующим атеросклерозом;
- диабетическая – вызваны комплексным поражением мягких тканей при сахарном диабете;
- гипертоническая – развивается при тяжелом течении артериальной гипертонии;
- инфекционная – наблюдается при сифилисе, туберкулезе;
- пиогенная – возникает у пациентов с иммунодефицитом;
- нейротрофическая – обусловлена нарушениями в работе нервной системы, чаще травмой позвоночника и инсультом.
При поражении только кожи говорят о поверхностной трофической язве. Если в процесс вовлекается подкожная жировая клетчатка, язва считается глубокой. При поражении мышц и костей дефект классифицируют как очень глубокий.
Малыми язвами называют дефекты площадью до 5 см², средними – до 20 см², большими – до 50 см², гигантскими – больше 50 см².
Возможные причины возникновения трофических язв
Причины образования трофической язвы могут быть разными, но они так или иначе связаны с нарушением кровообращения или обмена веществ. Спровоцировать процесс способны следующие заболевания:
- Венозная недостаточность, васкулит, варикоз и посттромбофлебитическая болезнь. Трофические изменения обусловлены нарушением оттока венозной крови. Более чем в 70% случаев язвы формируются из-за хронических патологий вен.
- Анатомические и воспалительные заболевания лимфатических сосудов – острый или хронический лимфостаз.
- Артериальная гипертензия, злокачественное течение гипертонической болезни (синдром Марторелля), облитерирующий атеросклероз, облитерирующий эндартериит и неспецифический аорто-артериит. Наблюдается хроническая ишемия и тяжелая гипоксия тканей, в результате изменения давления в артериях или нарушения их проходимости.
- Диабетическая микроангиопатия и полинейропатия. Сопровождается микроциркуляторными нарушениями в периферических областях, изменением кислотно-основного состояния тканей, повреждением нервов. Роль нейропатических нарушений признается ведущей, поскольку не только снижает потенциал тканей к регенерации, но и приводит к травматизации стопы (синдром диабетической стопы).
- Травмы. Язва может возникнуть в результате повреждения спинальных структур или периферических нервных волокон, а также после обморожений, глубоких ожогов. Они возникают в денервированных зонах и отличаются безболезненным течением и крайне плохой регенерацией. Появление трофических язв нижних конечностей у больных, перенесших травму, обычно связано с повреждением седалищного или большеберцового нерва.
- В результате инфицирования ссадин, микротравм, как последствие фолликулитов, фурункулеза, пиодермий. Более чем в 90% случаев это больные с вторичным иммунодефицитом.
- Язвы при системных заболеваниях соединительной ткани, как правило, возникают в виде местных проявлений при коллагенозах – системной красной волчанке, геморрагическом васкулите (некротическая форма). Их выраженность коррелирует с активностью аутоиммунного процесса.
- Специфические и инфекционные факторы – болезнь Базена, лепра (проказа), язва Бурули, тропическая язва, лейшманиоз, риккетсиоз, онхоцеркоз (вид гельминтоза), интоксикации и др.
Лечение осуществляет врач-флеболог или хирург. Перед началом лечения больному следует проконсультироваться с дерматологом, эндокринологом, кардиологом и терапевтом. При наличии в анамнезе травмы позвоночника пациента осматривает нейрохирург.
Диагностика и обследования при трофической язве
Для диагностики трофической язвы врачу достаточно провести обычный визуальный осмотр. Намного важнее выявить причину ее развития.
Лабораторные исследования
-
Клинический анализ крови.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Длительное заживление раны: причины, диагностика и способы лечения
Определение
Регенерация (восстановление) кожи и тканей – важный и сложный физиологический процесс. Он зависит от площади и глубины повреждения, сопутствующих заболеваний и многих других факторов.
Длительно незаживающие раны привносят существенный дискомфорт в повседневную жизнь, поскольку им сопутствуют боль, отек, истечение из раны прозрачной жидкости, крови или гноя, неприятный запах из раны, чувство распирания в поврежденной области.
Разновидности незаживающих ран
В зависимости от причины возникновения все длительно незаживающие раны можно разделить на травматические (появившиеся в результате механической травмы, ожога и т.д.) и трофические (появившиеся в результате нарушения кровообращения в пораженной области).
Возможные причины длительного заживления ран
Длительное заживление ран является симптомом многих патологических состояний, характеризующихся нарушением нормальных физиологических процессов регенерации тканей.
Факторы, влияющие на заживление ран:
- Возраст оказывает прямое влияние на процесс восстановление тканей. У детей раны заживают гораздо быстрее, чем у пожилых людей. Это связано с более активным обменом веществ в организме ребенка по сравнению с взрослыми.
- Масса тела влияет на обменные процессы в организме. Жировая ткань не нуждается в интенсивном кровообращении, поэтому увеличение ее количества в несколько раз относительно нормы (ожирение) ведет к замедлению регенерации тканей и частым осложнениям течения раневого процесса. При крайне низкой массе тела наблюдается замедление обмена веществ в организме за счет уменьшения количества энергии, следовательно, все раны заживают медленнее.
- Адекватное кровообращение в области повреждения обеспечивает ткани достаточным количеством питательных веществ и кислорода для восстановления. Недостаточный приток артериальной крови и нарушенный отток венозной крови существенно замедляют течение раневого процесса и способствуют развитию различных осложнений. Длительное сдавливание тканей при нахождении в вынужденном положении (например, у лежачих больных) приводит к развитию пролежней, которые также характеризуются продолжительным заживлением.
- Инфицирование раны нарушает процесс регенерации за счет активного размножения микроорганизмов, их воздействия на ткани и постоянной активации выраженного воспалительного процесса. Образуется большое количество гнойного экссудата, формируются участки некроза и нарастает общая интоксикация.
- От состояния иммунитета зависит адекватность воспалительной реакции и способность организма противостоять присоединению вторичной инфекции.
- Сопутствующие заболевания, такие как сахарный диабет, тяжелые инфекции, нарушения в системе кроветворения, сердечная и дыхательная недостаточность, замедляют регенерацию за счет нарушения образования и доставки необходимых веществ в область раны, а также выведения токсичных продуктов обмена из организма.
- Применение некоторых лекарственных средств и видов лечения может оказывать существенное влияние на нормальное течение процесса заживления раны. Так, бесконтрольное применение обезболивающих (нестероидных противовоспалительных препаратов) может привести к замедлению регенерации из-за подавления воспалительных процессов, которые в норме происходят в любой ране. Применение лучевой и химиотерапии также может стать причиной замедленного заживления ран, так как погибают не только опухолевые клетки, но и клетки, отвечающие за регенерацию тканей. При этом сама злокачественная опухоль забирает большое количество питательных веществ на свой рост, что негативно сказывается на всех процессах в организме.
-
Хроническая венозная недостаточность (также проявляющаяся варикозным расширением вен) - одна из самых распространенных причин длительно незаживающих ран на ногах. Нарушается венозный отток от нижних конечностей и доставка питательных веществ к тканям, нарастает гипоксия (снижение притока кислорода к тканям). Впоследствии возникают обменные нарушения в тканях и формируются длительно незаживающие трофические язвы.
Людям, страдающим хронической венозной недостаточностью, требуется постоянный тщательный уход за кожей, а при возникновении трофической язвы - профилактика увеличения раневой поверхности и ее инфицирования.
Диагностика и обследования при длительном заживлении ран
В большинстве случаев врач назначит необходимый комплекс лабораторно-инструментальных методов исследования.
-
Клинический анализ крови: общий анализ с подсчетом тромбоцитов, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов).
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Анемии: причины появления, симптомы, диагностика и способы лечения.
Определение
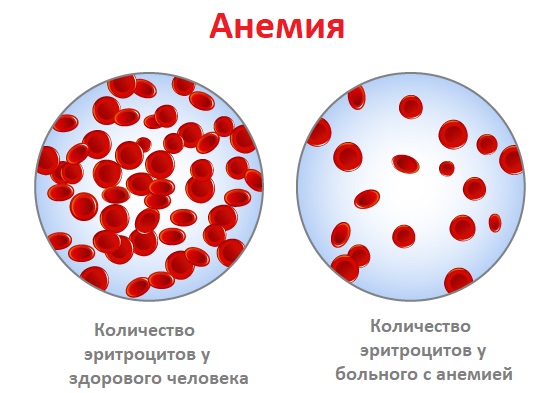
Анемия – это уменьшение содержания гемоглобина и/или снижение количества эритроцитов в единице объема крови, приводящее к снижению снабжения тканей кислородом.
Диагноз «анемия» ставят при снижении гемоглобина ниже 130 г/л у мужчин и ниже 115 г/л у женщин. У детей для постановки диагноза «анемия» принимают во внимание возраст ребенка.
Анемия встречается при ряде заболеваний (язвы и полипы желудочно-кишечного тракта, хроническая болезнь почек, онкологические, инфекционные заболевания, глистные инвазии и др). Чем ниже уровень гемоглобина, тем тяжелее протекает анемия.
Причины появления анемии
Анемия может возникнуть в результате нарушения образования эритроцитов, повышенного их разрушения или потери эритроцитов с кровью.
Статистика утверждает, что самой распространенной является анемия, возникшая после кровопотери (острой или хронической). Острой считается кровопотеря с объемом крови более 500-700 мл (у взрослых), которая происходит в течение короткого промежутка времени. Потеря крови может быть видимой (кровотечение из ран, кровавая рвота, маточное, носовое кровотечения) и первоначально скрытой (кровотечения в кишечник, в полость живота и/или плевры, большие гематомы).
Хронические кровопотери развиваются в результате незначительных, но длительных потерь крови (обильные и длительные менструации, язва желудка, рак, геморрой, проведение процедур гемодиализа и др.). С течением времени незначительные кровопотери приводят к истощению запасов железа в организме, когда количество теряемого организмом железа превышает его поступление с пищей. В результате дефицита железа нарушается синтез гемоглобина.
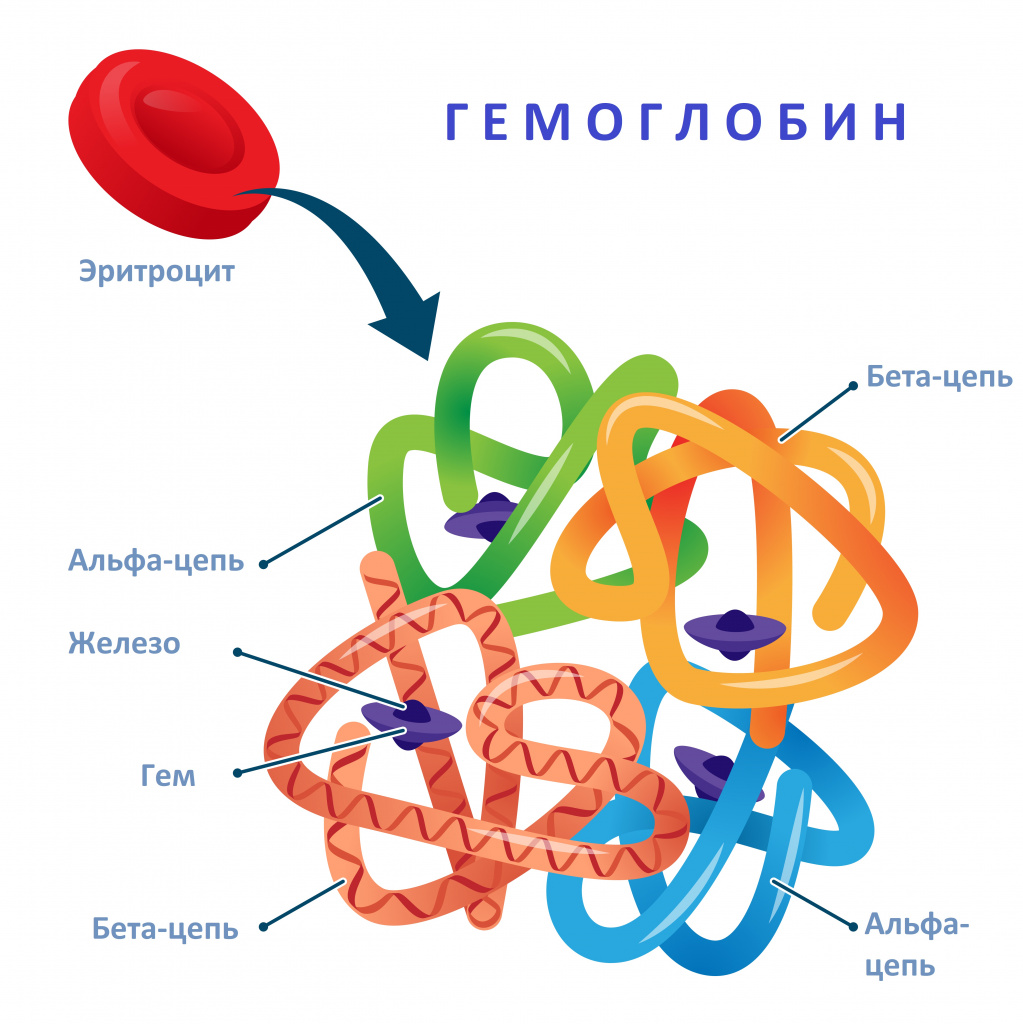
Каждый зрелый эритроцит покидает костный мозг с «комплектом» из 250-500 млн молекул гемоглобина. Молекула гемоглобина состоит из белковой части (четырех глобиновых субъединиц) и небелковой железосодержащей группы (гема). Основная биологическая функция гемоглобина – перенос кислорода от легких к тканям и транспорт углекислоты от тканей к легким. Продолжительность жизни эритроцитов составляет около 120 дней.
Дефицит железа может возникнуть из-за снижения всасывания железа в результате различных заболеваний двенадцатиперстной кишки и начальных отделов тонкой кишки (энтеритов, опухолей, состояний после оперативных вмешательств на данном участке кишечника). Состояния, приводящие к снижению уровня белков крови, являющихся переносчиками железа (нефротический синдром, нарушение белково-синтетической функции печени, синдром нарушенного всасывания, алиментарная недостаточность), также могут привести к его снижению и, как следствие, к анемии.
Железодефицитные анемии, связанные с исходно недостаточным уровнем железа (недостаток железа у матери в период беременности), наблюдаются у новорожденных и детей младшего возраста.
Анемии вследствие нарушенного кроветворения возникают:
- при недостаточном поступлении в организм или нарушении всасывания в желудочно-кишечном тракте компонентов, необходимых для образования эритроцитов (витамина В6, витамина В12, фолиевой кислоты и др.);
- поражении клеток костного мозга - предшественников эритроцитов токсическими веществами, ионизирующей радиацией;
- образовании вторичных очагов опухолевых клеток в костном мозге (метастазировании);
- нарушении синтеза небелковой части гемоглобина (гема) и накоплении его токсичных продуктов;
- нарушении регуляции образования эритроцитов (уменьшении продукции гормона, стимулирующего рост и размножение эритроцитов (эритропоэтин) или воздействии ингибиторов).
Развитие наследственных гемолитических анемий связано с генетическими дефектами (нарушением активности ферментов эритроцитов, нарушением структуры или синтеза гемоглобина, дефектами мембран эритроцитов).
Приобретенные гемолитические анемии могут быть обусловлены разрушением эритроцитов в результате воздействия на них антител, механических повреждений оболочки эритроцитов, химических повреждений эритроцитов, недостатка витаминов, разрушения эритроцитов паразитами.
Классификация анемий
1. Анемии, связанные с кровопотерей:
- анемии, связанные с нарушением образования гемоглобина;
- анемии, связанные с нарушением синтеза ДНК и РНК;
- анемии, связанные с нарушением процессов деления эритроцитов;
- анемии, связанные с угнетением пролиферации (размножения) клеток костного мозга.
- наследственные гемолитические анемии;
- приобретенные гемолитические анемии.
Существуют общие (неспецифические) проявления анемии и признаки, которые специфичны для определенного вида анемий.
К неспецифическим признакам анемии относятся бледность кожных покровов, слабость, повышенная утомляемость, сонливость, головокружение, обмороки, шум в ушах, мелькание «мушек» перед глазами, одышка, сердцебиение, учащенный пульс и др.
Отсутствие этих признаков не исключает наличие анемии, поскольку при легкой и среднетяжелой форме заболевания, а также его медленном развитии клиническая картина может быть смазанной.
Клинические проявления недостатка железа в организме: сухость кожи, нарушение целостности эпидермиса, ломкость ногтей, волос, изъязвления и трещины в углах рта, мышечная слабость. Может наблюдаться чувство жжения языка, извращение вкуса в виде неукротимого желания есть мел, зубную пасту, землю, сырую крупу, сырое мясо, а также пристрастие к некоторым запахам (ацетона, бензина).
Дефицит витамина В12 также может проявляться поражением желудочно-кишечного тракта (атрофическим гастритом) и неврологической симптоматикой (парестезиями, нарушением чувствительности, онемением конечностей). При крайне тяжелом течении заболевания наблюдаются психические нарушения, бред, галлюцинации, приобретенное слабоумие и др.
Клиническая картина дефицита фолиевой кислоты очень похожа на дефицит витамина В12, но при фолиеводефицитных состояниях отсутствует неврологическая симптоматика и редко возникает воспаление языка. Дефицит фолиевой кислоты приводит к обострению шизофрении, учащению и утяжелению приступов эпилепсии.
Для гемолитических анемий характерны желтушность кожных покровов и слизистых, увеличение размера селезенки, склонность к образованию камней в желчных путях.
При массивном гемолизе эритроцитов (гемолитическом кризе) кроме анемии, желтухи и ухудшения общего состояния могут наблюдаться тошнота, рвота, расстройство сознания, судороги, развитие острой почечной и/или сердечно-сосудистой недостаточности.
При апластической анемии, которая возникает на фоне угнетения пролиферации клеток костного мозга, происходят кровоизлияния (преимущественно в области бедер, голеней, живота, в местах инъекций образуются гематомы). Часто диагностируются бронхиты, пневмонии.
Диагностика анемии
Анемия может возникать под влиянием самых разнообразных факторов. Чаще всего встречаются дефицитные анемии (железодефицитные, B12-дефицитные, фолиеводефицитные и др.).
Большую роль в выявлении причины анемии играют сведения, полученные при опросе пациента: возраст, наличие профессиональных вредностей, характер диеты, наличие сопутствующих заболеваний, прием лекарственных препаратов, информация о наследственности и др. Не менее важны данные осмотра: изменение цвета и состояния кожи; увеличение лимфатических узлов, печени, селезенки; наличие поражения нервной системы.
Первый этап диагностики анемии обычно включает следующие исследования:
-
клинический анализ крови: определение концентрации гемоглобина, количества эритроцитов, лейкоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоцитарной формулы и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
«ФАРМАТЕКА»; Актуальные обзоры; № 13; 2012; стр. 9-14.
Д.Т. Абдурахманов
Кафедра терапии и профболезней ГБОУ ВПО "Первый МГМУ им. И.М. Сеченова" Минздравсоцразвития РФ, Москва
Обсуждается проблема железодефицитной анемии (ЖДА), развивающейся в т. ч. при заболеваниях желудочно-кишечного тракта. Представлены сведения, касающиеся причин возникновения ЖДА, патогенеза, симптоматики, диагностики и лечения данной патологии. Особое внимание уделено препарату Феринжект (железа карбоксимальтозат), который применяется в комплексной терапии пациентов с ЖДА, обусловленной воспалительными заболеваниями кишечника.
Ключевые слова: железодефицитная анемия, дефицит железа, ферротерапия, железа карбоксимальтозат
The article discusses the problem of iron deficiency anemia (IDA), which develops against the background of many diseases, including gastrointestinal diseases. The data on the causes of IDA, pathogenesis, symptoms, diagnosis and treatment of this disease are presented. Particular attention is paid to the drug Ferinject (ferric carboxymaltosate) used for the treatment of IDA in patients with inflammatory bowel diseases.
Key words: iron deficiency anemia, iron deficiency, ferrotherapy, ferric carboxymaltosate
Наиболее частая в популяции причина анемии — дефицит железа в организме. По данным отчета Всемирной организации здравоохранения (ВОЗ) о состоянии здоровья за 2002 г., железодефицитная анемия (ЖДА) входит в десятку глобальных факторов риска развития нетрудоспособности. Так, показано, что ЖДА встречается среди 30 % населения планеты [1]. В США ЖДА наблюдается среди 5-12 % небеременных женщин и 1-5 % мужчин [2].
Метаболизм железа в организме
Общее количество железа в организме взрослого человека составляет около 3,5-4,0 г, в среднем 50 и 40 мг/кг у мужчин и женщин соответственно. Основная часть железа входит в состав гемоглобина эритроцитов (около 2,5 г), значительная часть железа (около 0,5—1,0 г) депонируется в составе ферритина или входит в состав гемсодержащих и других ферментов (миоглобина, каталазы, цитохромов) организма (около 0,4 г) и небольшая часть железа (0,003—0,007 г) находится в связанном с трансферрином состоянии в крови.
Баланс железа в организме поддерживается соответствием количества поступающего железа его потерям. В пище железо присутствует в составе гема или как негемовое железо. Ежедневно с пищей (стандартный пищевой рацион) в организм человека поступает 10—20 мг железа, из которого в норме в кишечнике всасывается около 10 % (от 3 до 15 %), что компенсирует суточные потери железа, главным образом при слущивании эпителиальных клеток. Организм обеспечивает баланс железа в организме, регулируя процесс его всасывания в кишечнике. В случае развития дефицита железа организм увеличивает процент всасываемого железа (может достигать 25 %), при избытке — уменьшает [3]. В этом процессе ключевое значение придают гепсидину — белку, который синтезируется в печени. Поступление с пищей или выведение железа, как правило, вне контроля организма.
Около 25—30 мг железа ежедневно реутилизируется после разрушения (вследствие старения) эритроцитов в селезенке и поступает снова в костный мозг для синтеза новых эритроцитов. Железо, которое всасывается в кишечнике, предварительно на поверхности энтероцита восстанавливается с участием ферроредуктаз из трехвалентного (Fe 3+ ) в двухвалентнтное (Fe 2+ ), затем с помощью специфического переносчика — транспортера двухвалентных металлов (DMT1) поступает в цитоплазму [4]. Железо в составе гема (содержится в мясе, рыбе) всасывается напрямую. В дальнейшем двухвалентное железо с помощью другого переносчика, ферропортина (также мобилизует железо из ферритина), секретируется в кровь, где снова окисляется до трехвалентного (при участии белка гефестина) и связывается с плазменным белком трансферрином [5]. Трансферрин осуществляет транспорт железа в костный мозг, где оно утилизируется для синтеза эритроцитов, или преимущественно в печень, где железо депонируется в составе ферритина (рис. 1) [6].
При снижении запасов железа, гипоксии, анемии, усиленном эритропоэзе в печени снижается синтез гепсидина, что усиливает всасывание железа в кишечнике, при хроническом воспалении синтез гепсидина в печени увеличивается и, соответственно, всасывание железа в кишечнике снижается.
Рис 1. Регуляция всасывания железа в кишечнике [Guidi G.C., Santonastaso C.L., 2010]
Ферритин — ключевой белок, отражающий запасы железа в организме. Он депонирует железо в нетоксической форме, которое при необходимости мобилизуется. В среднем одна молекула ферритина содержит до 4500 атомов железа. Главным образом железо депонируется в печени, костном мозге и селезенке. Снижение уровня ферритина в сыворотке крови является достаточно надежным показателем дефицита железа в организме, его увеличение, как правило, указывает на перегрузку организма железом. В то же время необходимо помнить, что ферритин относится к белкам острой фазы воспаления, поэтому увеличение его содержания в крови может быть следствием активного воспалительного процесса, а не телько избытка железа. В ряде случаев некоторые злокачественные опухоли обладают способностью синтезировать и секретировать в кровь большое количество ферритина (в рамках паранеопластического синдрома). В норме содержание ферритина в сыворотке крови составляет 30-300 нг/мл.
Причины железодефицитной анемии
Выделяют три глобальные причины развития дефицита железа в организме (рис. 2):
1. Недостаточное поступление с пищей или повышенная потребность.
2. Нарушение всасывания железа в кишечнике.
3. Хронические потери крови.
Рис 2. Основные причины железодефицитной анемии
В популяции наиболее частой причиной ЖДА является недостаточное поступление с пищей: по данным ВОЗ, от четверти до трети населения в мире хронически голодают из-за нехватки продуктов питания, особенно мясной пищи. Однако в клинической практике среди основных причин ЖДА выделяют хронические потери крови, прежде всего из желудочно-кишечного тракта.
Клиническая картина
При ЖДА наблюдаются общие для всех анемий проявления циркуляторно-гипоксического синдрома:
Кроме того могут встречаться специфические признаки тканевого дефицита железа:
Диагностика
Лабораторная диагностика ЖДА основана на изучении обмена железа и выявлении его дефицита. Выделяют ряд признаков, указывающих на железодефицитный характер анемии (табл. 1).
Таблица 1
Лабораторные признаки дефицита железа и ЖДА
| Параметры | Значения при ЖДА | Норма |
| Железо сыворотки, мкг/дл | < 50 | 50-180 |
| Насыщение трансферрина железом, % | < 20 | 20-50 |
| Ферритин сыворотки, нг/мл | 30-300 | |
| Средний объем эритроцита (MCV), мкм 3 | < 80 | 80-100 |
| Гипохромные эритроциты, % | > 5 | < 5 |
| Ретикулоциты, тыс/мкл | < 40 | 40-100 |
| Растворимые рецепторы к трансферрину (sTfR), мг/л | Повышены | 0,76-1,76 |
Как правило, клинико-лабораторные проявления анемии (главным образом снижение гемоглобина) развиваются при потере организмом не менее 20— 30 % запасов железа.
Дифференциальный диагноз
ЖДА наиболее часто необходимо дифференцировать с анемией хронических заболеваний и талассемией. Кроме того, могут наблюдаться смешанные формы анемии (сочетание дефицита железа с дефицитом фолиевой кислоты и/или витамина В12, сочетание ЖДА и анемии хронических заболеваний и др.).
Выявление анемии, а также установление ее железодефицитного характера, как правило, в большинстве случаев не представляет сложностей. Наиболее трудным может оказаться установление причины дефицита железа, которое часто требует длительного дифференциально-диагностического поиска, но является необходимым условием успешного лечения и улучшения прогноза заболевания. Сам по себе дефицит железа и вызванная им анемия, как правило, не угрожают жизни больного (за исключением анемической комы, которая, впрочем, в настоящее время встречается достаточно редко). Организм достаточно хорошо адаптируется к развитию дефицита железа, и клинические проявления анемии обычно развиваются только при повышенных функциональных потребностях организма (стрессе, повышенной физической нагрузке, беременности, у девушек в период становления менструального цикла и др.). Поэтому очень часто анемия протекает бессимптомно и в большинстве случаев выявляется при случайном или профилактическом обследовании. Однако заболевания, которые обусловливают развитие ЖДА, в частности злокачественные опухоли, могут быть опасными, угрожающими здоровью и жизни пациента. Поэтому независимо от выраженности клинических проявлений и тяжести ЖДА выявление причины дефицита железа является обязательным условием полноценного обследования пациента.
ЖДА при заболеваниях желудочно-кишечного тракта
Заболевания желудочно-кишечного тракта (ЖКТ) являются одной из основных причин развития ЖДА, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника (табл. 2) [7].
Таблица 2
Заболевания ЖКТ, сопровождающиеся развитием ЖДА [Zhu A. и соавт., 2010]
| Верхние отделы ЖКТ | Нижние отделы ЖКТ | Весь ЖКТ |
| Язва желудка Язва 12-перстной кишки Рак желудка Грыжа пищеводного отверстия Эрозивный эзофагит Эрозивный гастрит Целиакия Атрофический гастрит Хронический гастрит, ассоциированный с Helicobacter pylori Операции на желудке | Аденома толстой кишки Рак толстой кишки Язвенный колит Идиопатическая язва слепой кишки | Болезнь Крона Телеангиэктазии сосудов ЖКТ Застойная гастро- и колонопатия при портальной гипертензии Паразитарные инфекции НПВС-ассоциированные гастропатия и энтеропатия |
Среди причин ЖДА (почти 30-50 % всех случаев) прежде всего рассматривают острые или хронические кровопотери из ЖКТ. Основной причиной ЖДА у женщин до менопаузы являются беременность и менструации, у женщин после менопаузы и у мужчин — хронические (латентные) потери крови из ЖКТ. Анализ кала на скрытую кровь — основной скрининговый метод выявления скрытого желудочно-кишечного кровотечения (тест положительный при выделении не менее 10 мл крови в сутки). При потере не менее 30 мл крови в сутки тест на скрытую кровь бывает положительным в 93 % случаев [8]. Наиболее часто при хронической ЖДА и особенно в случаях положительного результата кала на скрытую кровь выполняют эзофагогастродуодено- (ЭФГДС) и колоноскопию. В 5-10 % случаев анемий, связанных с заболеваниями ЖКТ, при ЭФГДС и колоноскопии не удается выявить очага поражения [9]. В 25 % случаев это обусловлено небольшим размером пораженного участка, который обнаруживается при повторном осмотре, в остальных случаях необходимо обследование тонкой кишки. В последние годы наиболее часто для выявления источника кровотечения из тонкой кишки используется беспроводная капсульная эндоскопия.
В 10-17 % случаев причиной ЖДА у мужчин и женщин старше 40 лет являются онкологические заболевания ЖКТ; прежде всего колоректальный рак. ЖДА в течение длительного времени может быть единственным проявлением рака толстой кишки правосторонней локализации, при этом размер опухоли обычно превышает 3 см. Другая наиболее частая причина ЖДА -язвенная болезнь желудка и двенадцатиперстной кишки.
При скрытых кровопотерях, обусловленных поражением тонкой кишки, наиболее часто в возрасте до 40 лет выявляют опухоли (лимфому, карциноид, аденокарциному, полипоз), ангиоэктазию артерий (Dieulafoy’s поражение), целиакию и болезнь Крона, в возрасте старше 40 лет -патологию сосудов различной природы и прием НПВС.
У трети больных воспалительными заболеваниями кишечника (болезнь Крона, язвенный колит) выявляется анемия, имеющая сложный генез (сочетание ЖДА и анемии хронических заболеваний).
При этом дефицит железа становится следствием нескольких причин:
Лечение
Лечение ЖДА включает прежде всего устранение причины дефицита железа (если это возможно) и прием препаратов железа (ферротерапия). Существует более 100 различных препаратов железа, в РФ наиболее часто используют около 10-15 лекарственных форм.
Суточная терапевтическая доза элементарного железа при лечении ЖДА для взрослых составляет в среднем 100— 200 мг в 2—3 приема. Поливитаминные комплексы, содержащие железо, не рекомендуют в качестве лечения ЖДА, т. к. они содержат недостаточное количество железа либо оно плохо всасывается в кишечнике.
При адекватном лечении уже в течение первых 3 суток наблюдается увеличение числа ретикулоцитов в крови, на 7—10-й день отмечается ретикулоцитарный криз (пик ретикулоцитоза). К 3—4-й неделе лечения имеет место увеличение уровня гемоглобина на 20 г/л. Прием препаратов железа необходимо продолжать еще в течение 3—6 месяцев после нормализации уровня гемоглобина — пока насыщение трансферрина железом не превысит 30 % и концентрация ферритина не достигнет 50 нг/мл (показатель восстановления тканевых запасов железа).
Среди 20—30 % пациентов в результате приема препаратов железа отмечаются различные диспептические расстройства (тошнота, дискомфорт в эпигастрии, диарея или запор). Риск развития желудочно-кишечных расстройств можно снизить, принимая препарат во время еды или на ночь, а также при постепенном увеличении дозы.
Среди причин неэффективности пероральных форм железа рассматривают целый ряд факторов [10]:
недостаточное поступление железа;
нерегулярный прием препаратов железа;
недостаточное содержание железа в принимаемом препарате.
Нарушение всасывания железа:
Продолжающиеся потери крови или повышенная потребность в железе:
Сопутствующие заболевания или состояния:
Неправильный диагноз или наличие других причин анемии:
Выделяют следующие показания к парентеральному введению, преимущественно внутривенному, препаратов железа:
Основная опасность при парентеральном введении железа — развитие тяжелых аллергических реакций, включая анафилактических шок с летальным исходом, которые наблюдаются в 0,6—1,0 % случаев. Данные реакции, в основном, характерны для препаратов железа, содержащих декстран.
Эффективность и безопасность Феринжекта при внутривенном введении были продемонстрированы при лечении ЖДА и в ряде других клинических ситуаций (у больных на гемодиализе, в послеродовом периоде, при тяжелом маточном кровотечении) 16.
Переливание компонентов крови (эритроцитарной массы) для лечения ЖДА применяется только при угрожающей жизни (анемической коме) или тяжелой анемии (Hb < 60 г/л), сопровождающейся признаками декомпенсации.
ЛИТЕРАТУРА
Читайте также:

