Нитрат серебра при экземе
Обновлено: 24.04.2024
Для цитирования: Думченко В.В., Орлов М.А., Дорфман И.П. Основные принципы фармакотерапии экземы. РМЖ. 2015;19:1171.
Экзема является распространенным атопическим заболеванием, протекающим с зудом, нарушением сна и качества жизни [31]. Экзема (от греч. еkzeо – вскипаю) – острое или хроническое рецидивирующее аллергическое заболевание кожи, формирующееся под влиянием экзогенных и эндогенных триггерных факторов и характеризующееся появлением полиморфной сыпи, острой воспалительной реакции, обусловленной серозным воспалением кожи, и сильным зудом [21].
Экзема составляет 30–40% всей кожной патологии. Заболевание появляется в любом возрасте, часто протекает остро, реже бывают хронические формы. Острая форма связана с эритемой и отеком. Лихенизация и шелушение – основные черты хронической формы. Это отражает морфологические изменения в коже, происходящие из-за сложного взаимодействия между генетическими и экологическими факторами, что ведет к иммунологическим и биохимическим изменениям, в результате чего появляются воспалительные поражения и зуд [21, 30, 36].
Около 1/3 всех случаев экземы составляет микробная экзема. В последние годы микробная экзема приобрела тенденцию к более тяжелому течению с частыми, продолжительными рецидивами, значительным распространением патологического процесса и характеризуется резистентностью к общепринятым методам лечения [7].
Экзема развивается в результате комплексного воздействия экзогенных и эндогенных факторов, среди которых большое значение имеют генетическая предрасположенность, состояние центральной и периферической нервной системы, наличие сенсибилизации к различным аллергенам, патология внутренних органов, нарушения функции желудочно-кишечного тракта, эндокринной системы, очаги хронической инфекции (холециститы, аднекситы, ЛОР-патология) и др. [8, 11].
Согласно современным представлениям, в механизме развития микробной экземы большую роль играет сенсибилизация к микробным антигенам на фоне изменения иммунной системы. Микробные аллергены обладают достаточно выраженной антигенной активностью, что ведет к сенсибилизации организма. В норме микробная флора кожи является непатогенной и участвует в бактериальной защите кожи за счет подавления патогенных штаммов непатогенными. Микрофлора кожи включает резидентную (Staphylococcus (S.) epidermidis, S. aureus, Micrococcus spp., Sarcina spp., коринеформные бактерии, Propionibacterium spp.) и транзиторную, представленную условно-патогенными и патогенными микроорганизмами [2]. Значительная часть микроорганизмов погибает под действием бактерицидной среды кожи (кислая реакция, жирные кислоты кожного сала, лизоцим) и не проникает через неповрежденный кожный барьер [7]. В связи с нарушением защитной функции кожи и изменением количества и качества липидов кожи у пациентов с экземой может развиваться бактериальная инфекция [27, 30]. Таким образом, ведущую роль в возникновении заболевания на фоне генетически детерминированной наследственной предрасположенности играет изменение микробного пейзажа – преобладание стафилококковой и стрептококковой флоры, а также грибов рода Candida [20].
По данным отечественных исследований, при соскобах с очагов поражения кожи у больных экземой в 80% случаев высевается S. аureus, в 14% – S. haemolyticus, в 40,7% – нелипофильные дрожжи рода Candida [5]. На участках экссудации и мокнутия количество микроорганизмов может достигать 1×107 на 1 см2. Токсины, секретируемые S. aureus (энтеротоксины А и В, токсин синдрома токсического шока), являются суперантигенами, стимулирующими одновременно несколько звеньев иммунного ответа [20]. У 57% больных в сыворотке крови выявлялись антитела к стафилококковым энтеротоксинам А, В, С и токсину синдрома токсического шока. Показано, что наиболее реактогенными свойствами обладает энтеротоксин В, и установлена взаимосвязь между тяжестью поражения кожи и сенсибилизацией к этому токсину [5, 9, 13]. Они связываются с b–цепью Т-клеточного рецептора и молекулой главного комплекса гистосовместимости II класса и активируют целое семейство клонов Т-лимфоцитов, что приводит к повышенной продукции провоспалительных цитокинов и усиливает реакцию аллергического воспаления. Бактериальная колонизация кожи S. aureus и высвобождение им энтеротоксинов – одна из причин формирования резистентности к стероидной терапии [13, 20, 29, 33, 34].
В двойном слепом многоцентровом рандомизированном контролируемом исследовании была продемонстрирована корреляция между тяжестью экземы и колонизацией S. aureus, и установлено, что бактериальная колонизация является важным фактором обострения кожных поражений [25]. Таким образом, микробная сенсибилизация является пусковым, поддерживающим и отягчающим фактором у больных экземой [3].
Лечение экземы проводят комплексно, с учетом формы и стадии заболевания, степени выраженности процесса, эндогенных и экзогенных факторов, лежащих в основе развития болезни [7, 12, 18, 23, 24]. Терапию экземы начинают с ограничения контактов с выявленными и потенциальными аллергенами и ирритантами. При всех формах экземы назначают общую гипосенсибилизирующую терапию, включающую антигистаминные препараты. Основными целями лечения являются предотвращение прогрессирования заболевания, уменьшение зуда, разрешение высыпаний, профилактика рецидивов [21].
Особое место в комплексном лечении микробной экземы занимает наружная терапия. Местное лечение определяется клинической картиной экземы. Наружная терапия проводится длительно и поэтапно, причем на разных стадиях используют различные лекарственные формы. Неизменным остается принцип местной терапии: «на мокрое – мокрое, на сухое – сухое» и «раздраженное не раздражать». Традиционно применяют примочки, влажно-высыхающие повязки. В связи с этим в стадии мокнутия применяются примочки, влажно-высыхающие повязки из антисептических и вяжущих растворов, аэрозоли с кортикостероидами для подавления признаков острого воспаления – гиперемии, отека, экссудации, зуда и болезненности [7, 11].
При обильном мокнутии, которое встречается обычно при истинной экземе (острой или обострении подострой и хронической), назначают примочки или влажно-высыхающие повязки из антисептических растворов, а при необильном, но упорном мокнутии – из вяжущих растворов. К антисептическим относятся растворы борной кислоты (Sol. ac. borici 1%, 2% и 3%), риванола (Sol. rivanoli 1:1000–1:4000), резорцина (Sol. resorcini 1–2%), фурацилина (Sol. furacilini 1:5000), марганцовокислого калия (Sol. Kalii hypermanganici 1:5000). Последний раствор обладает к тому же дезодорирующим свойством. Раствор резорцина выписывают в темном флаконе, т. к. на свету резорцин быстро разлагается. Группу вяжущих растворов составляют свинцовая вода (Aq. plumbi), буровская жидкость (Liq. Burovi; Liq. aluminii acetici 1–2 ст. ложки на 1 стакан воды), раствор ляписа (Sol. Argenti nitrici 0,1–0,25%), гулярдова вода (Ac. borici 6,0; Sp. aethylici 4,0; Aq. plumbi 200,0). Раствор ляписа, как и раствор резорцина, следует выписывать в темном флаконе.
Выбирая раствор для примочки или влажно-высыхающей повязки, необходимо учитывать следующие факторы. При осложнении, вызванном импетигинизацией процесса, показаны антисептические растворы, в первую очередь риванола и фурацилина. В случаях, сопровождающихся сильным зудом, хороший эффект дает гулярдова вода. При мокнущих формах микробной экземы и дисгидротической экземе показаны растворы более крепких концентраций: Sol. ac. borici 3%; Sol. resorcini 3%; Sol. rivanoli 1:1000 и др. Для примочек пожилым и ослабленным больным используют растворы слабых концентраций, т. к. крепкие могут вызывать у них жжение и болезненность. Иногда подобные больные плохо переносят и слабые концентрации. В таких случаях применяют примочки из различных растительных настоев: шалфея, ромашки, череды, чая и др. Что касается вяжущих средств, то обычно их назначают вслед за антисептическими растворами, когда в значительной степени стихли явления воспаления, однако продолжает держаться хотя и необильное, но упорное мокнутие. Наложение примочек из крепких растворов вяжущих средств на обширные очаги мокнутия с выраженными явлениями воспаления может привести к обострению и распространению процесса, что объясняется образованием пленки, препятствующей оттоку серозной жидкости и, следовательно, способствующей ее всасыванию (аутосенсибилизация). Особенно опасны в этом отношении настой коры дуба и раствор танина.
При угасании мокнутия назначают кремы и последовательно мази, содержащие кортикостероидные гормоны. При хронической экземе вне обострений лечение начинают с кремов или мазей. На очаги хронической экземы, покрытые сухими корками и обильными чешуйками, а также на очаги дисгидротической экземы наносят кремы и мази, содержащие и кортикостероидные гормоны, и салициловую кислоту. Салициловая кислота способствует отпадению корок и чешуек и более глубокому проникновению кортикостероидных гормонов в ткани очагов поражения [15].
Эффективность примочек и влажно-высыхающих повязок в острой стадии экземы не вызывает никакого сомнения, однако не всегда больные готовы в домашних условиях делать растворы и проводить методично по несколько раз в день процедуры с применением примочек [11]. Большинство классических растворов, паст, мазей имеют резкий и неприятный запах, пачкают и окрашивают белье и одежду, что ограничивает их применение, особенно в амбулаторной практике. Использование растворов требует применения повязок, которые мешают движению больных, ограничивая их повседневную и профессиональную деятельность. Действие примочек, паст, мазей развивается относительно медленно, требует госпитализации больных и проведения длительного поэтапного лечения [1]. Современный пациент ожидает от наружного лечения не только быстрого облегчения воспалительных и субъективных симптомов заболевания, сокращения сроков болезни, но и удобного и приятного терапевтического воздействия, не ограничивающего его социальную и профессиональную активность, и, как следствие этого, существенного улучшения качества жизни. Поэтому в современной клинической практике значительно возросли требования к лекарственным препаратам, используемым в терапии хронических дерматозов. Препарат должен обладать активным противовоспалительным действием, хорошо переноситься, иметь высокий профиль безопасности, обладать пролонгированным действием, не требующим многократного применения, быть эстетически привлекательным и не ограничивать привычный образ жизни [4, 19].
Во многом этим критериям соответствуют топические кортикостероидные препараты. Наружные глюкокортикостероиды, впервые появившиеся в терапевтическом арсенале дерматологов в середине прошлого века, в настоящее время являются базовой терапией воспалительных дерматозов. До настоящего времени им не существует терапевтической альтернативы по скорости наступления и выраженности (активности) противовоспалительного действия. Топические кортикостероиды обладают высокой противовоспалительной, противоаллергической, иммуносупрессивной активностью, а также сосудосуживающим и антимитотическим эффектом [22, 28]. Эти препараты, обладая мощным патогенетическим воздействием, позволяют быстро уменьшить воспалительные изменения кожи, в короткий срок снизить или устранить субъективные симптомы дерматозов (зуд, жжение).
Улучшение кожного статуса, несомненно, положительно сказывается на психоэмоциональном состоянии пациентов, восстановлении трудоспособности и повседневной активности, что значительно повышает их качество жизни. Успех терапии во многом определяется правильным выбором стероида с учетом его активности и методики применения в зависимости от характера, стадии течения, локализации дерматоза [4]. Согласно Европейской классификации потенциальной активности различают слабые (класс 1), средние (класс 2), сильные (класс 3), очень сильные (класс 4) стероиды. При остром воспалении, характеризующемся отеком, гиперемией, мокнутием, целесообразно использовать средние, сильные, реже – очень сильные топические кортикостероиды (уровни доказательности А, В). По мере уменьшения выраженности воспаления применяют средние и слабые кортикостероиды (уровни доказательности А, В) [16].
Большое значение имеет правильный выбор лекарственной формы препарата, определяющей активность всасывания стероида и рациональность проводимой наружной терапии (табл. 1). Одной из наиболее распространенных ошибок при назначении топических кортикостероидов является выбор препарата без учета топографических и морфофункциональных особенностей кожи, а также активности всасывания наружных средств на различных участках кожного покрова. Всасывание наружных лекарственных средств напрямую зависит от строения (толщины) эпидермиса. Сравнительные исследования выявили существенные различия всасывания одного и того же лекарственного препарата, наносимого на разные области кожи. Таким образом, одним из критериев выбора наружного стероида является локализация очага воспаления. На участки тонкой кожи (лица, половых органов, сгибательных поверхностей) предпочтительнее нанесение стероидов умеренной потенции. Следует учитывать, что наносить препараты, содержащие сильные стероиды, на вышеуказанные области кожи, относящиеся к зонам повышенной чувствительности к глюкокортикостероидам, крайне нежелательно, т. к. это может привести к высокому риску развития как местных побочных эффектов (атрофии, телеангиэктазии и др.), так и системных, а также активизации инфекционных агентов [4].
С учетом важной роли инфекционных агентов в патогенезе экземы, в частности микробной экземы, перед врачом стоит задача в максимально короткие сроки не только снять воспаление и субъективные симптомы, но и подавить сенсибилизацию к бактериальным и грибковым антигенам, нормализовать количество и состав микрофлоры кожи [7]. Инфекционные агенты могут не только способствовать развитию заболевания, но и осложнять его течение. В связи с этим в плане наружной терапии к топическим глюкокортикостероидам нужно присоединять препараты с антимикробными и противогрибковыми свойствами. Можно использовать последовательно несколько препаратов, но более предпочтительным является наружное применение комбинированных средств, которое обладает противовоспалительным, антибактериальным и противогрибковым действием [20].
Что касается антимикробного компонента, то необходимо отметить, что традиционно назначаемые комбинированные наружные глюкокортикостероиды содержат такие действующие вещества, как гентамицин, тетрациклин, клотримазол, натамицин, к которым многие возбудители бактериально-грибковых инфекций оказываются малочувствительными. В настоящее время неэффективность применения традиционных схем терапии дерматозов сочетанной этиологии в первую очередь связана с развитием устойчивости возбудителей к назначаемым препаратам [6]. Так, по данным проведенного в России микологического исследования чувствительности нозокомиальных штаммов S. aureus к длительно используемым в клинической практике антибиотикам, выявилась резистентность к гентамицину у 31% выделенных штаммов и к тетрациклину – у 37%. Таким образом, более чем у 1/3 пациентов применение этих препаратов в качестве антимикробной терапии не дает ожидаемого лечебного эффекта [14, 17]. В другом исследовании [32] у 87% больных хронической экземой и атопическим дерматитом при посевах с очагов поражения были обнаружены MRSА (methicillin-resistant S. aureus – метициллин-устойчивый золотистый стафилококк) штаммы. Группу риска по обсемененности MRSА составили больные с длительным течением дерматоза, пожилые пациенты, отягощенные соматическими заболеваниями (сахарный диабет, хронические инфекции легких и ЛОР-органов), а также часто и длительно пребывающие на стационарном лечении. При этом у женщин активность бактериального обсеменения кожи MRSA была выше, однако тяжелее инфекция протекала у мужчин [5]. По данным микробиологических исследований [10], устойчивость к гентамицину MRSA-штаммов составляет 56%. При выборе комбинированного глюкокортикостероида следует ориентироваться прежде всего на противоинфекционную эффективность его действия. Нерациональный выбор препарата приводит к дальнейшему повышению резистентности микроорганизмов, отсутствию эффекта от терапии и ухудшению течения кожного процесса [5].
Учитывая, что у 90% пациентов основным бактериальным агентом является S. aureus [25], к тому же в большинстве случае выделяются MRSА-штаммы, также резистентные к гентамицину, необходимо использовать препарат, обладающий достаточной антибактериальной активностью против таких возбудителей. Фузидовая кислота является сильным антибактериальным препаратом и ингибирует почти все штаммы золотистого стафилококка, включая S. aureus, S. epidermidis и метициллин-резистентные штаммы, стрептококков и других патогенных микроорганизмов. Препарат действует как ингибитор синтеза белка в бактериальной клетке, обладает бактериостатическим или бактерицидным действием в зависимости от размера инокулята. Местное применение фузидовой кислоты является безопасным и эффективным в лечении бактериальных инфекций кожи [17, 26, 30]. Развитие устойчивости к ней в целом остается низким или непродолжительным и может быть сведено к минимуму, если ограничить терапию курсом не более 14 дней [35]. Перекрестной резистентности, так же, как и перекрестной чувствительности, к фузидовой кислоте нет, т. к. это единственный антибиотик в своей группе. Лечебная эффективность при местном применении фузидовой кислоты обусловлена уникальной способностью глубоко проникать в кожу и накапливаться в дозировке, в разы превышающей минимальную терапевтическую.
Фузидовая кислота успешно использовалась вместе с кортикостероидами (бетаметазоном и гидрокортизоном). Гидрокортизона ацетат – мягкий кортикостероид его предпочтительнее применять при легкой степени поражения. Бетаметазон относится к группе сильных глюкокортикостероидов (группа III), что позволяет назначать его при выраженном воспалении [17]. Данные препараты особенно эффективны в лечении микробной экземы, т. к. их действие направлено на лечение как воспаления, так и инфекции. Использование антибиотиков и кортикостероидов как по отдельности, так и в фиксированных комбинациях дает хороший терапевтический эффект при экземе и также снижает колонизацию золотистого стафилококка. Раннее начало комбинированной топической терапии является необходимым для пациентов с экземой средней и тяжелой степени и уменьшает необходимость использования антибиотиков на более поздних стадиях заболевания [25]. Назначение одного лекарственного препарата, обладающего широким терапевтическим диапазоном, заменяющего несколько медикаментозных средств, позволяет исключить полипрагмазию, избежать побочных действий и нежелательных взаимодействий между препаратами, уменьшить затраты и повысить комплаентность пациентов [4].
Комплексный подход в терапии экземы позволит уменьшить выраженность воспаления, сопровождающегося зудом и экссудацией, причиняющими больному значительные страдания, и тем самым окажет благоприятное влияние на качество жизни пациентов.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
ГУ "МОНИКИ им М.Ф. Владимирского", Москва
Комплексное лечение длительно незаживающих ран разной этиологии
Журнал: Клиническая дерматология и венерология. 2013;11(3): 101‑106
Третьякова Е.И. Комплексное лечение длительно незаживающих ран разной этиологии. Клиническая дерматология и венерология. 2013;11(3):101‑106.
Tret'iakova EI. Combination treatment for persistent wounds of various etiologies. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(3):101‑106. (In Russ.).
ГУ "МОНИКИ им М.Ф. Владимирского", Москва
Представлены результаты наружного лечения 2% кремом Аргосульфан 47 больных с длительно не заживающими ранами разной этиологии. В результате комплексного лечения полная эпителизация трофических язв у больных с хронической венозной недостаточностью, облитерирующим эндоартериитом и липоидным некробиозом наступила у 10 (41,7%) пациентов, частичный регресс - у 14 (58,3%). Явления пиодермии разрешились у 7 (87,5%) больных, значительно уменьшились - у 1 (12,5%). Трещины в области ладоней и подошв на фоне разрешения тилотической экземы заэпителизировались у всех 15 (100%) пациентов. Крем Аргосульфан в комплексной терапии больных с длительно не заживающими ранами оказался высокоэффективным, отличался хорошей переносимостью, удобством в применении.
ГУ "МОНИКИ им М.Ф. Владимирского", Москва
Важнейшей медико-социальной проблемой является лечение длительно не заживающих ран разной этиологии. Трофические язвы и глубокие трещины кожи в области нижних конечностей, а также хронические язвенные пиодермии резко снижают качество жизни и надолго ограничивают активность больных. Особое место в лечении и профилактике этих заболеваний, предупреждающей развитие инфекционного процесса в ране и являющейся барьером на пути распространения инфекции, занимает местная терапия.
Современные высокоэффективные средства для местного лечения длительно не заживающих ран имеют ряд лечебных качеств, которые позволяют применять их с учетом фаз раневого процесса. Они должны обладать противовоспалительным и протеолитическим действием, иметь широкий антибактериальный спектр воздействия, сохранять активность в кислой среде, не вызывать явлений гипергрануляции и пигментации, иметь гипоаллергенные качества, быть нетоксичными и удобными в применении.
Существует много комбинированных препаратов для местного лечения, содержащих антибиотики или сульфаниламиды в сочетании друг с другом и/или разными антисептиками. Для таких препаратов характерно более медленное развитие микробной резистентности и более широкий охват бактериальных агентов — возбудителей инфекций.
Присутствующие в составе крема ионы серебра усиливают антибактериальное действие сульфаниламида — тормозят рост и деление бактерий путем связывания с дезоксирибонуклеиновой кислотой микробной клетки [1]. Постепенное высвобождение ионов серебра подавляет рост патогенной микрофлоры на протяжении длительного периода нахождения повязки на ране, что важно при высоком риске реинфекции госпитальными штаммами и является постоянным барьером на пути распространения инфекции.
Кроме того, ионы серебра ослабляют сенсибилизирующие свойства сульфаниламида. Существует мнение, согласно которому аппликация на кожу и слизистые оболочки сульфаниламидов нежелательна в связи с невысокой активностью и риском возникновения аллергической реакции. При нанесении такой мази на ожоговую или инфицированную поверхность могут наблюдаться жжение и боль [1]. Гидрофильная основа крема Аргосульфан, имеющая оптимальный рН и содержащая большое количество воды, обеспечивает его увлажняющее и аналгезирующее действие и приводит к уменьшению сроков заживления ран.
Благодаря минимальной резорбции Аргосульфан-крем, нанесенный даже на обширные раневые поверхности, не оказывает токсического действия, так как сульфатиазол серебра обладает небольшой растворимостью, благодаря чему концентрация лекарственного средства в ране длительно поддерживается на одинаковом уровне. Незначительное количество сульфатиазола серебра, оказавшегося в кровотоке, в печени подвергается ацетилированию и в моче находится в виде неактивных метаболитов и частично в неизмененном виде [1]. В связи с отсутствием системной абсорбции препарата можно использовать крем Аргосульфан в сочетании с другими препаратами. Повязки с кремом Аргосульфан, содержащие ионы серебра, безболезненны при наложении на раневую поверхность, не присыхают к ране и легко удаляются с ее поверхности, обладают мягким подсушивающим эффектом, хорошо проникают в некротизированную ткань и экссудат. Тканевый детрит, пропитанный препаратом, образует «защитную подушку», под которой идет форсированное образование грануляций и эпителизация.
Мы применяли крем Аргосульфан при длительно не заживающих ранах у больных с трофическими язвами разной этиологии, липоидном некробиозе, хронической язвенной и язвенно-вегетирующей пиодермиях, глубоких трещинах, осложняющих течение тилотической экземы.
Появление трофических язв может осложнить течение многих заболеваний – от болезней системы кровообращения до нарушений обмена веществ, причем развитие язвенного дефекта сопровождается как нарушением нормального кровообращения, так и изменением иннервации. Именно поэтому процесс выздоровления может потребовать применения комплексного воздействия и достаточно продолжительного лечения.
Различают варикозные, ишемические и нейротрофические язвы [2—5]. Наибольшую группу (1—2% взрослого населения) составляют больные с хронической венозной недостаточностью (ХВН) нижних конечностей, развивающейся при нарушении венозного оттока и повышении давления внутри капилляров. Основные причины ХВН — варикозное расширение вен и посттромбофлебитический синдром. При повреждении клапанов глубоких вен голени нарушается функция мышечно-венозной помпы и возникает ретроградный ток крови. Повреждение прободающих вен, которые соединяют поверхностные вены с глубокими, усугубляет венозную недостаточность. Из-за отложения фибрина в периваскулярном пространстве и угнетения тканевого фибринолиза развиваются склероз и облитерация лимфатических и мелких кровеносных сосудов. Периваскулярный фиброз нарушает доставку питательных веществ к эпидермису, что приводит к образованию варикозных трофических язв [2—5].
Ишемические язвы формируются при заболеваниях периферических артерий, в частности при облитерирующем атеросклерозе (ОАС). ОАС всегда сопровождается поражением кожи — от постепенно нарастающей ишемии до инфаркта, т.е. некроза, развивающегося при внезапном нарушении кровоснабжения в результате атероэмболии — закупорки мелких артерий фрагментами атеросклеротических бляшек. Ишемические язвы локализуются на часто травмируемых участках и местах сдавления, сопровождаются выраженными болевыми ощущениями. Смешанные язвы развиваются у больных, страдающих и ХВН, и ОАС, у которых клинически присутствуют черты обоих заболеваний [4, 5].
Причиной нейротрофических язв являются поражение чувствительных и двигательных нервов, нарушения кровообращения и атеросклероз при сахарном диабете и его осложнениях, вторичном гиперпаратиреозе, гранулематозном воспалении в ответ на дегенерацию коллагена при липоидном некробиозе [6, 7].
Липоидный некробиоз — редкий хронический дерматоз сосудисто-обменного характера, который обычно относят к группе локализованных липоидозов кожи. Провоцирующими факторами при липоидном некробиозе в 1 /3 случаев является сахарный диабет, еще у 1 /3 — нарушение толерантности к глюкозе, поэтому необходимы семейный анамнез и исследования для выявления скрытых форм сахарного диабета. Началу заболевания нередко предшествует травма. Дегенерация коллагена приводит к усиленной агрегации тромбоцитов, микроангиопатиям, поражению артериол, склерозированию и облитерации сосудов в очагах некробиоза. Сосудистые нарушения приводят к нарушению трофики и некробиотическим изменениям дермы с последующим отложением в ней липидов. Заболевание часто имеет длительное рецидивирующее течение, его выраженность не зависит от тяжести сахарного диабета, формирующиеся трофические язвы сопровождаются выраженными болевыми ощущениями и заживают, как правило, с формированием грубого рубца [6, 7].
Без специального лечения трофические язвы характеризуются низкой тенденцией к заживлению и длительным рецидивирующим течением [8, 9]. Общепризнано, что оперативное лечение ХВН и ОАС лучше выполнять после заживления трофической язвы или тщательной санации ее поверхности. Однако консервативное лечение с применением устаревших малоэффективных местных медикаментозных средств часто осложняется дерматитом, экземой, рожистым воспалением, что отодвигает сроки выполнения сосудистой операции. На выбор лекарственного препарата влияют фаза течения заболевания и выраженность воспалительной реакции (I фаза — предъязвенное состояние; II фаза — дистрофические изменения, некроз, воспаление кожи и прилежащих тканей; III фаза — очищение язвы и регенерация; IV фаза — эпителизация и рубцевание), осложнения (микозы, экзема, пиодермии, рожистое воспаление, рецидивирующий тромбофлебит, малигнизация и др.), видовой состав микрофлоры язвы. В многочисленных бактериологических исследованиях качественного состава микрофлоры поверхности трофических язв выявлена полирезистентная грампозитивная и грамнегативная микрофлора. Содержание микроорганизмов в индуративно измененных тканях, окружающих язву, иногда достигает 10 7 -10 9 микробных тел на 1 г ткани раны, что указывает на высокий риск генерализации инфекционного процесса [10]. Как правило, выделяемые микроорганизмы высокорезистентны не только к традиционным антибактериальным препаратам, но и к наиболее часто используемым в таких случаях местным средствам — растворам фурацилина, хлоргексидина, синтомициновой эмульсии, мазям с антибиотиками (тетрациклином, гентамицином) и др. На стадиях грануляции и эпителизации, для их ускорения, а также при осложнении ран дерматитом, экземой или другими проявлениями аллергии на традиционные препараты, средством выбора могут стать соли серебра, учитывая их высокую эффективность в подавлении как грампозитивной, так и грамнегативной микрофлоры, лучшую переносимость и редкость аллергических реакций даже у пациентов с отягощенным аллергоанамнезом.
Пиодермии (гнойничковые заболевания кожи) представляют собой группу дерматозов, в основе которых лежит гнойное воспаление кожи и ее придатков, а также подкожно-жировой клетчатки. На долю пиодермий приходится 1 /3 всех случаев заболеваний кожи [4, 5]. Развитию пиодермий способствуют микротравмы, мацерация и загрязнение эпидермиса, повышенное потоотделение, переохлаждение, перегревание, эндокринопатии (сахарный диабет), гипогаммаглобулинемия, недостаточное поступление белков, гиповитаминоз, нарушения иммунитета и тяжелые соматические заболевания, переутомление, хронические интоксикации, персистирующие очаги стафилококковой инфекции. Наиболее частыми возбудителями пиодермий являются золотистый и эпидермальный стафилококк (80—90% больных), в 10—15% случаев выявляется смешанная инфекция (стафилококк в сочетании со стрептококком, синегнойной палочкой, протеем, кишечной палочкой и др.) [1, 4, 10].
Хронические язвенная и язвенно-вегетирующая пиодермии относятся к глубоким стрептостафилококковым пиодермиям, характеризуются образованием плохо заживающих язвенных гнойных поражений кожи и подлежащих тканей. Нередко заболевание сопровождается ухудшением общего состояния, повышением температуры тела, слабостью, явлениями интоксикации, лимфангиитами и лимфаденитом. Язвенная пиодермия (стрептостафилококковое импетиго) проявляется фликтенами, эктимами, располагающимися на фоне эритемы. Высыпания, как правило, диссеминированные, захватывают обширные участки кожного покрова. Под корками характерно образование глубоких язв с вялыми грануляциями на дне и воспаленными мягкими краями. Стрептостафилококковое импетиго нередко является осложнением зудящих дерматозов (экземы, чесотки, атопического дерматита и др.). Хроническая язвенно-вегетирующая пиодермия характеризуется язвенными образованиями неправильной формы с выраженными вегетациями в области краев и дна. Нередко вокруг язвы присутствует застойно-розовый венчик гиперемии. Характерно хроническое течение с периодическими обострениями с появлением новых язв или серпигенизации основного язвенного образования.
Терапия пиодермий должна быть этиопатогенетической. При лечении хронических, рецидивирующих и глубоких форм пиодермий используют антибиотики (местно и системно), антисептические растворы, по показаниям глюкокортикостероиды, иммуномодуляторы, витамины, проводят вскрытие пустул и абсцессов, при необходимости — удаляют и выскабливают вегетации и некротические ткани.
Тилотическая (роговая) экзема — хроническое упорно рецидивирующее аллергическое заболевание кожи, разновидность истинной экземы. Тилотическая экзема проявляется гиперкератозом ладоней и подошв с образованием грубых роговых и корковых наслоений, сухостью кожи, а также глубокими болезненными длительно не заживающими, нередко кровоточащими трещинами. Данное заболевание характеризуется поливалентной сенсибилизацией и аутосенсибилизацией, протекает на фоне нейроэндокринных сдвигов, сопровождается изменениями в центральной и вегетативной нервной системе, нарушениями обменных процессов и трофики тканей [4, 5]. Поражение подошв и ладоней, как правило, симметричное, трещины формируются на фоне эритемы, шелушения, особенно на участках наибольшего давления и нагрузки, в том числе и на боковых поверхностях пальцев. Воспаление может быть выражено на ограниченном участке или занимать всю подошву и/или ладонь, боль в области трещин может быть более интенсивной, чем зуд. Тенденция к углублению трещин связана с возрастом пациента, длительностью болезни, холодным временем года и наличием фоновых заболеваний.
В трещины на подошвах легко может проникать пиогенная инфекция, развиваться рожистое воспаление или пиодермии. Тилотическая экзема резистентна к лечению, склонна к рецидивированию, к улучшению состояния приводят частое и сильное увлажнение кожи и немедленное прекращение ношения влажной обуви [11].
Под нашим наблюдением находились 47 больных (13 мужчин, 34 женщины) в возрасте 44—75 лет с трофическими язвами, развившимися на фоне ХВН и облитерирующего эндартериита, нарушениях кровоснабжения и трофики при липоидном некробиозе, а также с пиодермиями и тилотической экземой. Длительность заболевания составляла от 2 мес до 4 лет. Все больные в составе комплексной терапии наружно применяли крем Аргосульфан.
У 11 (23,4%) больных имелись варикозные, у 5 (10,6%) — смешанные трофические язвы, у 8 (17%) — трофические язвы при липоидном некробиозе; у 8 (17%) — хроническая язвенная и хроническая язвенно-вегетирующая пиодермии, у 15 (32%) — тилотическая экзема с глубокими трещинами на ладонях и подошвах.
У 22 (46,8%) больных дерматозы протекали на фоне эндокринных заболеваний: у 4 (8,4%) — сахарного диабета, у 2 (4,2%) — нарушений толерантности к глюкозе, у 5 (10,6%) — узлового зоба, у 1 (2,1%) — гипотиреоза, у 1 (2,1%) — патологии надпочечников. У 2 (4,2%) больных был выявлен хронический бронхит, у 3 (6,3%) — хронический гастрит, у 5 (10,6%) — хронический панкреатит, у 2 (4,2%) — вирусный гепатит С, у 10 (21,3%) — гипертоническая болезнь, у 9 (1%) — ишемическая болезнь сердца, у 2 (4,2%) — миома матки.
При бактериологических исследованиях качественного состава микрофлоры с поверхности очагов (язв, трещин) у 29 (61,7%) больных выявлен золотистый и эпидермальный стафилококк, у 18 (38,3%) — смешанная инфекция (стафилококки в сочетании со стрептококком, кишечной палочкой, бактероидами, протеем, дрожжевыми грибами) в количестве 104—105 микробных тел на 1 г ткани раны.
Всем пациентам назначался охранительный режим. Предлагалось ограничить пребывание в вертикальном положении с целью уменьшения статической нагрузки, размещать пораженную конечность в возвышенном положении. Рекомендовалось уменьшить потребление с пищей соли и экстрактивных продуктов, больным с тилотической экземой назначалась гипоаллергенная диета, пациентам с липоидным некробиозом — диета с ограничением углеводно-жировой нагрузки.
В составе комплексной терапии все больные получали сосудистые препараты и венопротекторы (пентоксифиллин, детралекс, эскузан), антиагреганты (курантил), десенсибилизирующие средства (глюконат кальция, тиосульфат натрия), улучшающие трофику (солкосерил, актовегин) и антигистаминные (супрастин, тавегил, лоратадин) препараты. Пациентам с трофическими язвами, липоидным некробиозом, пиодермиями проводилось лечение антибиотиками цефалоспоринового ряда, иммуномодуляторами (метилурацил, виферон, циклоферон), витаминами (мильгамма), с тилотической экземой — препаратами витамина А (аевит, ретинола пальмитат), с липоидным некробиозом — препаратами липоевой кислоты (берлитион).
В качестве наружного средства все больные использовали 2% крем Аргосульфан. После очищения 0,1% водным раствором хлоргексидина и/или хирургической обработки раневых поверхностей препарат слоем 2—3 мм ежедневно 2 раза в сутки наносили на очаги поражения на трещины или язвы с середины к краям до полного впитывания. На очаги, имеющие большую площадь, крем Аргосульфан наносили ежедневно под окклюзионную повязку на ночь. Рана во время лечения покрывалась препаратом полностью, если ее часть открывалась, крем наносили дополнительно. Курс комплексного лечения составлял 25—30 сут.
Болевых ощущений, а также местных и общих аллергических реакций при использовании крема Аргосульфан не наблюдалось.
Крем Аргосульфан при местном лечении длительно не заживающих ран позволил добиться улучшения у всех больных. В результате комплексной терапии полная эпителизация трофических язв у больных с ХВН, ОАС и липоидным некробиозом наступила в 10 (41,7%) случаях, частичный регресс (уменьшение размеров, воспалительных и дистрофических изменений кожи, появление зрелых грануляций и краевой эпителизации с минимально выраженной пигментацией) — в 14 (58,3%). Явления пиодермии разрешились у 7 (87,5%) пациентов, значительно уменьшились (с резким замедлением роста микрофлоры до 102 микробных тел на 1 г ткани раны) — у 1 (12,5%). Отсутствие под повязкой с кремом Аргосульфан гипергрануляций в ране способствовало формированию негрубых подвижных слабопигментированных рубцов. Трещины в области ладоней и подошв на фоне разрешения тилотической экземы эпителизировались у всех 15 (100%) пациентов.
Поскольку крем Аргосульфан — препарат длительного применения, что обусловлено медленным восстановлением физиологических процессов в эпидермисе и дерме, больным с трофическими язвами и пиодермией мы рекомендовали использовать его по ранее применяемой схеме амбулаторно в течение 1—2 мес после окончания курса лечения в стационаре (до полного заживления или пересадки кожи).
Таким образом, 2% крем Аргосульфан в комплексной терапии больных с длительно не заживающими ранами оказался высокоэффективным как на стадии формирования трофических язв, так и в период заполнения глубоких ран грануляционной тканью, что во многих случаях привело к самостоятельному заживлению их под повязкой. Препарат отличался хорошей переносимостью, удобством в применении, позволил значительно снизить стоимость лечения больного в стационаре и успешно продолжить лечение амбулаторно.
Что такое отомикоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Саидовой Бурлият Солтанпашаевны, ЛОРа со стажем в 4 года.
Над статьей доктора Саидовой Бурлият Солтанпашаевны работали литературный редактор Юлия Липовская , научный редактор Евгений Буданов и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Отомикоз — это заболевание наружного или среднего уха, вызванное грибами, чаще всего дрожжеподобными и плесневыми.
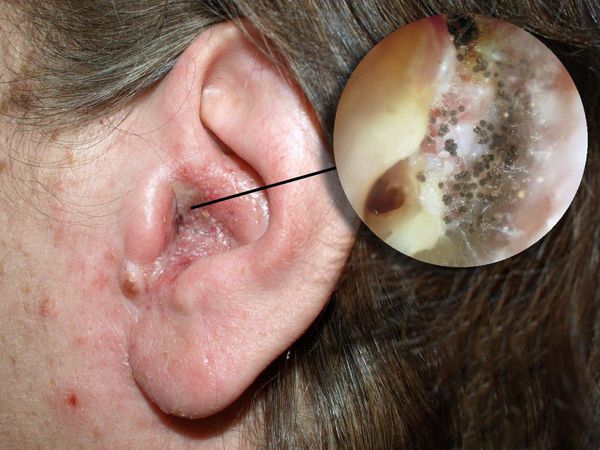
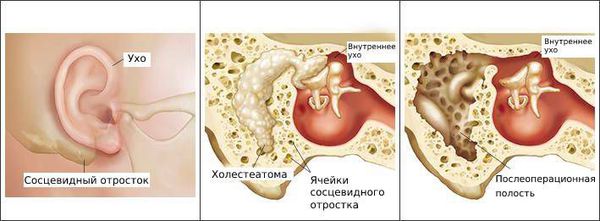
Болезнь развивается в наружном слуховом проходе, иногда процесс затрагивает кожу ушной раковины и барабанную перепонку. Также отомикоз может развиваться в барабанной и послеоперационной полости среднего уха, которая образуется в результате удаления патологически изменённых тканей среднего уха (например, при гнойном среднем отите с холестеатомой ) .
Чаще всего отомикоз начинается с зуда, возможно покалывание в ухе, а в дальнейшем появляются заложенность, ушной шум и выделения [7] .
В группу заболеваний, относящихся к отомикозам, включают [2] [4] :
- Наружный грибковый отит. Затрагивает кожу ушной раковины, стенки наружного слухового прохода и барабанную перепонку.
- Грибковый средний отит. Грибы развиваются в барабанной полости.
- Грибковый мирингит. Грибковое заболевание поражает барабанную перепонку.
- Микоз послеоперационной полости. Процесс развивается в послеоперационной полости среднего уха.
Распространённость
Среди взрослого населения частота развития отомикозов составляет 18,6 %. У детей распространённость заболевания 26,3 % [1] . Чаще всего отомикоз встречается в жарких и влажных климатических зонах, так как влажность и тепло благоприятно влияют на рост грибов. Также существует связь между заболеваемостью и временем года: в весенне-летний период она растёт [10] .
Среди отомикозов самым распространённым является наружный грибковый отит: 62 % от общего числа. Грибковый средний и послеоперационный отит составляют 20 % и 17 %, соответственно. На долю грибкового мирингита приходится 1 % случаев [2] [5] [10] [12] [15] .
Причины и факторы риска развития отомикоза
Причиной развития отомикозов являются грибы, которые входят в состав нормальной микрофлоры уха. В обычных условиях они себя никак не проявляют и не представляют опасности. Но когда появляются благоприятные для грибов условия, они начинают размножаться и приводят к развитию отомикоза. Возбудителями могут стать плесневые грибы рода Aspergillus или дрожжеподобные грибы рода Candida, иногда Mucor, Cladosporium, Alternaria, Penicillium, Geotrichum или Aspergillus и Candida в сочетании друг с другом [4] .
Предрасполагающими факторами, которые могут запускать развитие болезни, являются различные эндогенные (внутренние) и экзогенные (внешние) обстоятельства, а также их сочетания.
Основной экзогенный фактор — это механическая травма кожи наружного слухового прохода при слишком тщательной гигиене ушей с использованием ватных палочек и других подручных средств. Когда пациент слишком тщательно проводит эту процедуру, он не только травмирует кожу, но и удаляет главный фактор защиты — ушную серу. Это приводит к тому, что полезная микрофлора погибает и её место занимают грибы, для размножения которых имеются все условия: тёплая влажная среда и отсутствие защитного барьера — серы [8] .
- Лечение антибиотиками, что приводит к нарушению микрофлоры и размножению грибов.
- Цитостатическая и лучевая терапия, которые обладают иммуносупрессивным действием, т. е. подавляют работу иммунитета.
- Кожные заболевания в виде дерматитов и экземы.
- Длительный приём гормональных препаратов, например глюкокортикостероидов при аутоиммунных заболеваниях.
- Производственные и бытовые вредности: работа во влажных, сырых и пыльных помещениях.
- Гнойные отиты.
- Нарушенный обмен веществ: прежде всего сахарный диабет и гиперкортицизм (повышенное выделение корой надпочечников гормона кортизола), так как они способствуют росту грибов [2][7][11][19] .
- Гипо- и авитаминозы.
- Длительный воспалительный процесс в послеоперационной полости с повреждением эпителия. Образующийся при этом воспалительный экссудат выступает в роли хорошей питательной среды, богатой белками, углеводами, минеральными солями и другими веществами. В совокупности с постоянной температурой, влажностью, свободным доступом воздуха в послеоперационной полости среднего уха появляются благоприятные условия для размножения грибов.
- Послеоперационная травма уха, а также попадание нестерильной воды могут запускать процесс развития микоза послеоперационной полости среднего уха [11] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы отомикоза
Первый симптом отомикоза — зуд внутри уха. Сначала зуд ненавязчивый, возникает периодически и не доставляет сильного дискомфорта. Но потом становится постоянным, нестерпимо сильным и снижает качество жизни пациента [7] [9] [12] . По мере распространения инфекции и прорастания мицелия грибов в кожу возникает повышенная чувствительность и болезненность кожи наружного уха и слухового прохода [2] .
С первых дней заболевания пациенты отмечают появление патологических выделений из уха. Цвет может быть от светло-жёлтого до коричнего-чёрного, консистенция — от жидкой или кашицеобразной до плотной. Возможно образование себорейных корочек [10] .
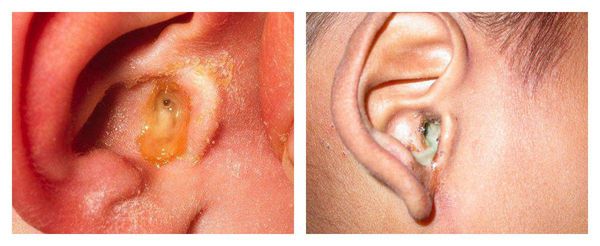
Выделения пациент может заметить на подушке после сна, если они достаточно жидкие и вытекают из наружного слухового прохода. Также их может заметить человек, стоящий рядом.
У некоторых пациентов снижается слух со стороны больного уха. Это возможно при поражении барабанной перепонки и полостей среднего уха, в редких случаях причиной становится повреждение наружного слухового прохода. Иногда отмечают появление шумов в ухе, заложенность, дискомфорт и ощущение полноты внутри уха. Часто имеются неспецифические симптомы, такие как повышение температуры тела и общее недомогание [2] [10] .
Патогенез отомикоза
Ушная раковина представляет собой эластический хрящ, покрытый кожей. Полость ушной раковины воронкообразно углубляется и переходит в наружный слуховой проход. Функцией данной структуры является улавливание звуков, их концентрация и направление в наружный слуховой проход.
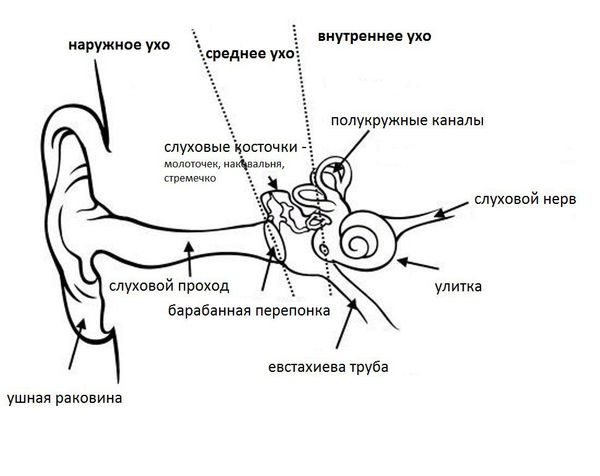
Наружный слуховой проход представляет собой полую трубку диаметром 0,3-1,0 см и длиной около 2,5 см у взрослых. Он состоит из хрящевой части, которая является продолжением хряща ушной раковины, и костной части, занимающей 2/3 наружного слухового прохода. Кожа в наружных отделах слухового прохода содержит волосы, сальные и серные железы [2] .
Барабанная перепонка проводит наружные колебания и является границей, которая отделяет наружное ухо от среднего. Среднее ухо состоит из центральной части, которая представлена барабанной полостью. Кпереди и книзу от барабанной полости находится слуховая труба (евстахиева труба). Кзади от барабанной полости находятся сосцевидные ячейки.
В норме полость среднего уха стерильна, т. е. грибков и других микробов в ней нет. Их попаданию препятствует изоляция от внешней среды за счёт барабанной перепонки, дренажной функции слуховой трубы и местного иммунитета. Тем не менее, грибы могут проникать в среднее ухо через слуховую трубу из глотки либо через систему крово- и лимфообращения.
Основными патогенетическими звеньями возникновения микоза являются адгезия грибов, т. е. прикрепление гриба к коже или раневой поверхности, колонизация гриба и инвазивный рост [7] . При тяжёлой форме микоза может произойти генерализация процесса, т. е. проникновение возбудителя в кровь с распространением по организму и появлением вторичных очагов грибковой инфекции в различных органах и тканях. Микозы могут выступать своеобразными "маркерами" нарушения иммунитета, так как иммунодефицит является одним из основных моментов в патогенезе грибковой инфекции.
Классификация и стадии развития отомикоза
По характеру возбудителя:
- дрожжеподобный — возбудителем выступают дрожжеподобные грибы рода Candida;
- плесневой — выделяют плесневые грибы рода Aspergillus;
- смешанный — присутствует сочетанное поражение грибами родов Aspergillus и Candida.
По локализации:
- наружный грибковый отит — процесс расположен в наружном слуховом проходе;
- грибковый мирингит — при поражении барабанной перепонки;
- грибковый средний отит и грибковый средний послеоперационный отит — при поражении среднего уха;
- сочетанное поражение наружного и среднего уха.
По стороне поражения:
По клиническому течению:
- Острый. Под острым отомикозом понимают впервые выявленный случай грибкового поражения, если речь идёт об острой фазе процесса продолжительностью до 3-4 недель. Пациент при этом жалуется на впервые возникшие симптомы, характерные для этой патологии: зуд в ушах, выделения из слухового прохода, болевой синдром и др.
- Хронический [18] . Этот диагноз пациенту уже ставили ранее и он получал лечение, но спустя какое-то время снова обратился с такими же жалобами. Характерно длительное и вялое течение свыше трёх месяцев с периодами улучшения и повторяющимися обострениями, при которых возобновляются боли в ухе и выделения.
Осложнения отомикоза
- Местное распространение. При вовремя начатом и адекватном лечении осложнения встречаются редко, но при отсутствии лечения отомикоз может приводить к обширному поражению всего слухового прохода, барабанной перепонки и окружающих ухо тканей [2] .
- Генерализация заболевания. Грибковая инфекция опасна тем, что быстро распространяется и угрожает поражением внутренних органов, особенно в послеоперационный период. При неблагоприятном течении отомикоз может являться причиной распространённого микоза внутренних органов и грибкового сепсиса. Такие осложнения возникают достаточно редко, обычно при сопутствующих патологиях: снижении общих иммунных сил организма, ВИЧ, аутоиммунных заболеваниях и т. д.
- Хронизация заболевания. При локализации патологического процесса в среднем ухе часто происходит хронизация процесса, выражающаяся в длительных и многократных обострениях.
- Рубцово-спаечный процесс. В течение времени могут образоваться спайки в полости среднего уха (адгезивный отит). Это будет затруднять нормальное звуковосприятие и приведёт к тугоухости, которая может носить необратимый характер [15] . Также из-за спаек возможно сужение (стеноз) наружного слухового прохода. Однако отомикоз не приводит к полной потере слуха.
Диагностика отомикоза
Опрос, сбор анамнеза
Диагностика начинается со сбора анамнеза. Врач задаёт ряд вопросов:
- Когда началась болезнь и как протекала.
- Был ли у пациента ранее средний отит.
- Было ли грибковое поражение других органов и систем, например урогенитального тракта.
- Как долго пациент болеет, с какой частотой, были ли обострения.
- Принимает ли пациент антибиотики, стероидные препараты, цитостатики (чаще всего используются при лечении онкозаболеваний) и химиотерапевтические препараты.
- Страдает ли пациент аллергией [2][3] .
- Есть ли неблагоприятные факторы в быту и производстве.
- Какими сопутствующими заболеваниями болел пациент.
- Есть ли хронические инфекции [6] .
Осмотр, оценка жалоб
Если речь идёт о кандидозе, пациенты жалуются на беловатые выделения из уха творожистой консистенции. При отоскопии наблюдается сужение слухового прохода в хрящевой части и гиперемия (покраснение) барабанной перепонки [6] [11] .
При аспергиллёзном поражении выделения тёмные, почти чёрные, имеют густую консистенцию. При отоскопии наблюдаются сужения в костной части слухового прохода, барабанная перепонка может выпирать и терять свои опознавательные знаки [13] [15] .
При пенициллиозе зуд более выражен, выделения напоминают жидкую ушную серу, хрящевой участок инфильтрирован, на барабанной перепонке может наблюдаться выпячивание, гиперемия или эрозия, что ложно указывает на перфорацию (сквозное повреждение).
Если говорить о поражении микозом среднего уха и послеоперационной полости, то основными жалобами являются снижение слуха, выделения из уха, периодический зуд, также может наблюдаться головокружение [9] .
Как правило, при любой форме грибкового поражения наружного уха слух не страдает или выявляются незначительные нарушения по типу звукопроводимости: ухудшается передача звуковой волны по слуховому проходу к среднему уху. В этом случае возникает ощущение заложенности уха. Такие симптомы, как боль и зуд, могут наблюдаться при любом типе грибкового поражения [3] [6] [20] .
Некоторые пациенты в остром периоде обращаются с жалобами на головную боль на стороне поражения, повышение температуры тела до 38 °C , гиперчувствительность ушной раковины, наружного слухового прохода и заушной области [6] .
Лабораторная диагностика
Из лабораторных методов исследования основным является взятие мазка из уха и его микологический посев на специальные питательные среды (Сабуро, Чапека и др.). Специалист берёт образцы с помощью аттикового зонда ATIC или ложки Фолькмана. Материал берётся под контролем зрения, чтобы не повредить барабанную перепонку, поскольку субстрат собирается из глубоких отделов слухового прохода [12] .
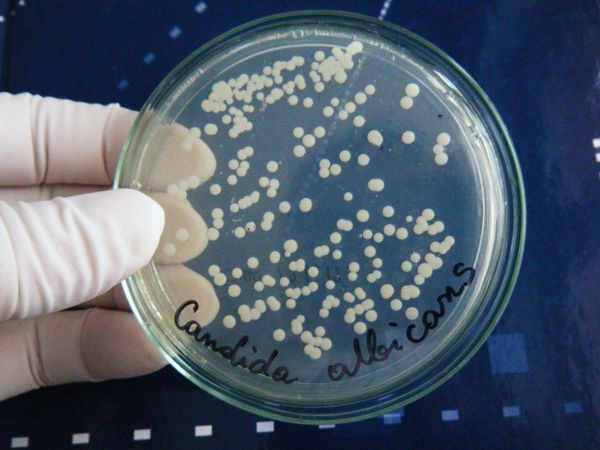
Помимо микологического посева собранного материала, проводится его микроскопия с использованием 10 % гидроксида калия, если это нативный материал. Иногда проводится окрашивание по Романовскому — Гимза. Эти 2 исследования вместе позволяют точно определить возбудителя процесса. Для диагностики микоза титр культуры (количество в 1 мл) должен быть не менее 10 4 КОЕ/мл.
Также проводится ряд общеклинических исследований, таких как клинический и биохимический анализы крови с определением уровня глюкозы, общего белка, АсАТ (аспартатаминотрансферазы), АлАТ (аланинаминотрансферазы) и креатинина. Выполняется анализ крови на сифилис, ВИЧ-инфекцию и гепатиты В и С с целью исключить эти заболевания и выявить сопутствующие патологии [9] .
Инструментальная диагностика
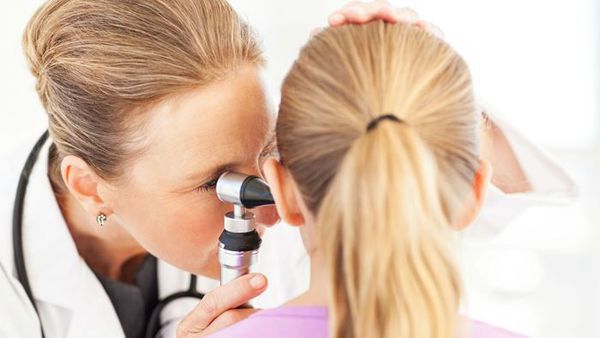
Из инструментальных методов исследования следует выделить отомикроскопию больного уха с использованием бинокулярных линз, микроскопической оптики или с помощью эндоскопа [12] [15] .
Дифференциальный диагноз
Дифференциальный диагноз необходимо проводить с воспалительными процессами наружного и среднего уха негрибовой этиологии (например, с бактериальным или вирусным средним и наружным отитом), с серными пробками и новообразованиями уха, такими как холестеатома.
Окончательный диагноз отомикоза может быть поставлен только при комплексном микологическом исследовании [9] [11] .
Лечение отомикоза
При выборе терапии врач учитывает эффективность ранее проведённого лечения, если оно имелось. Если у пациента есть хронические заболевания, то в первую очередь необходима их коррекция [2] . Например, при сахарном диабете важно контролировать уровень глюкозы, так как его повышение провоцирует развитие отомикоза [3] .
Лечение инфекции начинается с устранения возбудителя, при этом используется сочетание местных лекарственных форм и препаратов системного действия. Перед применением препаратов важно тщательно очистить ухо от патологических выделений, ведь даже небольшое количество грибковых масс может негативно сказаться на эффективности медикаментозной терапии [18] .
Если при отоскопии наблюдаются полипы или грануляции в слуховом проходе, то предварительно нужно обработать их 5-10 % раствором нитрата серебра и удалить [7] [15] .
Местное лечение
Препаратом выбора для местного лечения является хлорнитрофенол и 1 % раствор нафтифина. Препараты используются в качестве аппликаций на коже наружного слухового прохода в течение 10-14 дней. Лечение необходимо продолжать ещё 14 дней после исчезновения клинических признаков и/или до получения трёхкратного отрицательного лабораторного анализа [12] [17] [18] .
Если при микологическом посеве выделены грибы Candida, то назначаются аппликации комбинацией препаратов: 1 % раствор клотримазола и 1 % раствор нафтифина в течение 10-14 дней с продолжением терапии в течение 14 дней после исчезновения клинических признаков и/или до получения трёхкратного отрицательного результата лабораторного исследования [3] [18] .
Системное лечение
Если возбудителем являются грибы рода Candida, рекомендуется назначать флуконазол. При лечении грибкового среднего отита и микоза послеоперационной полости среднего уха, вызванного плесневыми грибами, применяется итраконазол [18] .
В период лечения и реабилитации пациенту необходимо ограничить контакт с источниками пыли и грязи, избегать повышенной влажности и попадания воды в ухо, чтобы не допустить рецидивов и возможных осложнений [7] .
Прогноз. Профилактика
Прогноз при впервые выявленном неосложнённом наружном грибковом отите благоприятный. Если лечение было своевременным и грамотным, то удаётся полностью уничтожить возбудителя.
При хроническом течении избавиться от грибка полностью сложно, поэтому случаются рецидивы. Из-за спаечных процессов возможно снижение слуха по типу звукопроведения. Чтобы избежать рецидивов, необходимо в течение 4 недель после клинического выздоровления аккуратно протирать кожу наружного уха противогрибковым средством или делать аппликации турундой, стараясь не травмировать кожу слухового прохода.
В качестве неспецифических методов профилактики можно рекомендовать соблюдение правил личной гигиены:
- тщательно и часто мыть руки;
- не трогать кожу ушей грязными руками и предметами;
- пользоваться только личным полотенцем;
- при любых заболеваниях уха проводить тщательный его туалет.
В осенне-зимний период особенно важно укреплять защитные силы организма и повышать иммунитет, избегать переохлаждений и заветриваний ушей. Если имеется сахарный диабет, необходима коррекция уровня глюкозы крови [6] [15] .
Читайте также:

