Неовир или циклоферон что лучше при герпесе
Обновлено: 18.04.2024
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем. Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2; причем наиболее часто — ВПГ-2. Согласно данным сероэпидемиологических исследований, инфицирование ВПГ-1 выявляется у 20—40%, а ВПГ-2 — у 50—70% больных генитальным герпесом [2]. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом. Нередко генитальным герпесом заражаются от лиц, не имеющих симптомов заболевания на момент полового контакта или не знающих о том, что они инфицированы [5]. Эта особенность ВПГ, связанная с бессимптомным вирусоносительством, является сложной задачей, от решения которой зависит не только трудоспособность и здоровье, но и личная судьба миллионов потенциальных больных. Имеются сведения о том, что от 60 до 80% новорожденных, у которых развивается неонатальный герпес, рождаются от матерей с бессимптомным носительством [6].
ВПГ-инфекция также может быть причиной нарушения репродуктивной функции, невынашивания беременности, преждевременных родов и патологии плода. Возможно участие ВПГ в развитии онкологических заболеваний гениталий, иммунодефицитных состояний, что позволяет считать герпесвирусные инфекции важной медико-социальной проблемой практического здравоохранения [2].
Лечение хронических, часто рецидивирующих форм ВПГ-инфекции, до настоящего времени представляет определенные трудности, которые объясняются особенностями взаимодействия вируса с макроорганизмом. Жизнедеятельность вирусов герпеса основывается на следующих биологических особенностях:
- все вирусы герпеса являются внутриклеточными паразитами;
- герпесвирусы пожизненно персистируют в аксоноганглиальных структурах центральной и периферической нервной системы;
- в течение жизни человек многократно реинфицируется новыми штаммами вирусов герпеса, при этом возможно одновременное сосуществование нескольких видов и штаммов вирусов [12];
- при нарушении динамического равновесия между иммунным гомеостазом и вирусами последние переходят в активную форму [9].
Согласно данным проведенных исследований только 20% инфицированных ВПГ имеют диагностированный генитальный герпес, 60% — нераспознанный симптоматический генитальный герпес (атипичную форму) и 20% — бессимптомный герпес. В настоящее время только 27% пациентов с диагнозом генитальный герпес получают противовирусную терапию, из них треть — местное лечение [2]. По данным некоторых авторов, около 95% пациентов с клиническими проявлениями генитального герпеса вообще никак не лечатся [11].
Все разнообразие методов терапии и профилактики герпесвирусных инфекций в конечном счете сводится к трем главным подходам:
- химиотерапия;
- иммунотерапия;
- комбинация этих двух методов.
Каждый врач в своей практической работе так или иначе сталкивается с необходимостью решения этой сложной задачи, требующей тонкого индивидуального подхода к каждому пациенту, страдающему ВПГ.
Теоретически идеальным вариантом химиотерапии был и остается механизм прямой инактивации вирусной ДНК, но из-за неизбежного общего токсического, цитопатического и канцерогенного эффекта этот способ для клинического использования оказался неприемлемым [8]. Поэтому был разработан менее опасный способ инактивации вирусной ДНК — подавление активности вирусных ферментов, обеспечивающих жизнедеятельность ДНК. Наиболее безопасным вариантом оказалось создание синтетических аналогов нуклеозидов герпесвирусной ДНК, которые избирательно фосфорилируются не клеткой, а вирусспецифическим ферментом — тимидинкиназой. В процессе копирования вирусной ДНК эти псевдонуклеазиды встраиваются в дочерние вирусные ДНК, что приводит к генетическому дефекту или нежизнеспособности вирусной ДНК [1]. Первый лечебный синтетический нуклеозид — ацикловир (ациклический аналог гуанозина) — стал «золотым стандартом» противогерпетической химиотерапии. Ацикловир, будучи включен в какой-либо участок новой ДНК, никогда не заменяется естественным гуанином [13]. В последнее время синтезированы и широко используются новые противовирусные препараты этой группы — валтрекс и фамвир.
Различают два способа применения противовирусных химиопрепаратов: эпизодическое назначение (при обострениях герпесвирусной инфекции по мере необходимости) и супрессивная или превентивная терапия. В первом случае препарат назначается коротким курсом (5—10 дней), во втором — ежедневный прием препарата в течение нескольких месяцев, а то и лет призван помочь не столько купировать рецидив, сколько предотвратить развитие рецидивов как таковых.
Однако за последние 10 лет увеличилось число исследований, в ходе которых было показано, что изоляты вируса простого герпеса, полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 месяцев), обладают резистентностью по отношению к ацикловиру [10].
К тому же ни ацикловир, ни другие противовирусные агенты — фамцикловир, валацикловир — не предотвращают перехода вируса в латентное состояние, возникновения рецидивов после их отмены либо передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции, то есть не гарантируют полного излечения. Поэтому на протяжении последних двух десятилетий ученые изыскивают методы непосредственного воздействия на иммунную систему больных генитальным герпесом с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса [1].
Главной мишенью применения иммуномодулирующих препаратов служат вторичные иммунодефициты, которые проявляются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами разной локализации [7]. Именно к таким процессам, требующим иммунокоррекции, и относится хроническая рецидивирующая герпесвирусная инфекция (ХРГВИ), в частности ее генитальная форма. Иммуномодуляторы назначают в комплексной терапии одновременно с противовирусными средствами.
Полиоксидоний — отечественный иммуномодулятор с широким спектром фармакологического действия, не имеющий аналогов в мире [3]. Опыт применения полиоксидония начиная с 1996 года показал его высокую клиническую эффективность в комплексном лечении многих вторичных иммунодефицитных состояний, проявляющихся хроническими, рецидивирующими, вялотекущими инфекционно-воспалительными процессами различной локализации, в том числе в ходе терапии вирусных инфекций [4].
У нас также имеется определенный позитивный опыт применения полиоксидония у пациентов, резистентных к ацикловиру [9].
Мы проводили исследование открытым методом у 50 пациентов с ХРГВИ. В исследование включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с достоверным диагнозом ХРГВИ. К исследованию не допускались пациенты с гиперчувствительностью к полиоксидонию и беременные женщины. Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. Обязательным условием для женщин детородного возраста было соблюдение полноценной контрацепции.
На предварительном этапе были сформированы две равнозначные группы пациентов по 25 человек. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки. Все пациенты предъявляли жалобы на пузырьковые или эрозивные высыпания в области гениталий, зуд, жжение. До лечения всем пациентам проводилась ПЦР-диагностика ВПГ-2 (мазок) — положительный результат получен в 98,3 %.
Возрастной состав пациентов, страдающих генитальной формой герпесвирусной инфекции, в обеих группах был приблизительно одинаковым (43,6 года в первой группе и 38,9 — во второй), в то время как в первой группе средний возраст женщин и мужчин был несколько выше по сравнению со второй группой.
Дозировка и схемы введения. Всем пациентам производилась в/м инъекция препарата утром, под контролем врача. 1-я схема: терапия проводилась в течение 45 дней: пациенты получали по 6 мг полиоксидония в день в/м в течение 5 дней и по 6 мг в/м через день в течение 10 дней. Поддерживающая терапия — по 6 мг в/м 2 раза в неделю в течение месяца. 2-я схема: 6 мг полиоксидония в/м через день в течение 10 дней (всего 5 инъекций на курс).
Обследование проводилось до приема препарата и на 12—14-й день от начала приема препарата, а также на 3—6-й день после окончания приема препарата. Обследование включало общее клиническое, иммунологическое исследования крови, исследование мочи (общее), объективное исследование. Накануне приема препарата собирался подробный анамнез пациента. В состав исследуемых включались совершеннолетние пациенты мужского и женского пола с достоверным диагнозом ХРГВИ.
Объем сопутствующей терапии: все пациенты получали стандартную сопутствующую терапию (ацикловир по 0,2 г 5 раз в день в течение 5 дней и антиоксиданты).
Критериями оценки эффективности являлись следующие параметры: первичные критерии — время достижения полного выздоровления (полная реэпитализация); вторичные критерии — длительность ремиссии и частота рецидивов в ближайшем и отдаленном периоде после терапии полиоксидонием. С целью оценки местных симптомов проводился наружный осмотр места поражения. Оценивалось состояние кожных покровов и слизистых: наличие пузырьков, язвочек, корочек, гиперемии; выяснялись жалобы пациента (зуд, жжение, общее состояние, температура, миалгия).
На фоне лечения полиоксидонием по первой схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,44 до 3,5 дня, в то время как на фоне стандартной терапии (ацикловир и антиоксиданты) те же показатели изменились с 6,44 до 5,16 дня соответственно. После курса терапии в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем составляла 4 дня. В процессе лечения препаратом свежие высыпания ни у одного пациента не появились. 76% (19 человек) отметили уменьшение тяжести течения рецидива; остальные — 24% (6 человек) — не отметили разницы по сравнению с периодом до получения препарата. На фоне лечения полиоксидонием по второй схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,72 до 4,24 дня вместо 6,72 — 5,04 дня соответственно. После лечения полиоксидонием в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем также составляли 4 дня. 64 % (16 человек) отметили уменьшение тяжести течения рецидива; остальные — 36% (9 человек) — не отметили никаких изменений по сравнению с периодом до получения препарата.
Частота рецидивов у пациентов, получавших полиоксидоний по первой схеме в течение 6 месяцев после лечения, уменьшилась в среднем с 6,5 до 3 раз по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 27 до 75 дней. Максимальная длительность ремиссии увеличилась в среднем с 45 до 180 дней (у отдельных пациентов максимальная ремиссия достигала 190–220 дней, что связано с неравномерностью возникновения рецидивов в исследуемом временном интервале). У 84% пациентов (21 человек) отмечалось ослабление клиники течения рецидива; у 16% (4 человека) после лечения клиника не изменилась. Ухудшения течения заболевания отмечено не было. Частота рецидивов у пациентов, получавших полиоксидоний по второй схеме, в течение 6 месяцев после лечения уменьшилась в среднем с 6 до 3,6 раза по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 33 до 62 дней. Показатель максимальной длительности ремиссии в обеих группах вырос в среднем примерно одинаково — с 45 до 180 дней. У 72% пациентов (18 человек) отмечалось ослабление клиники течения рецидива; у 28% (7 человек) после лечения клиника не изменилась. Как и в первой группе, ухудшений течения заболевания отмечено не было.
Максимальная длительность ремиссии за период наблюдения (2 года) составила 1,9 года в первой группе (у 9 пациентов — 36 %) и 1,1 года во второй группе (у 4 пациентов — 16 %).
До лечения полиоксидонием в обеих группах частота встречаемости и выраженность местных и общих клинических проявлений ХРГВИ была выше по сравнению с теми же показателями на фоне лечения полиоксидонием.
Парентеральное (в/м) введение полиоксидония в соответствии со схемами (см. выше) не вызывало аллергических реакций, не оказывало гепатонефротоксического действия и токсического действия на кроветворные органы; пациенты отмечали хорошую переносимость препарата.
По данным общеклинических и лабораторных методов исследования, побочных эффектов и осложнений при приеме полиоксидония не было.
Использование полиоксидония в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции является эффективным способом уменьшения клинических проявлений в фазе обострения, сокращения длительности рецидивов и заметного уменьшения их частоты в отдаленном периоде.
Раннее назначение полиоксидония способствует более быстрой реэпителизации и более стойкой ремиссии.
Использование инъекционной формы полиоксидония не вызывает аллергических реакций, а также других побочных эффектов и осложнений.
При соблюдении указанного режима дозирования препарат не обладает нефро- и гепатотоксическим действием.
А. Е. Шульженко, кандидат медицинских наук ГНЦ — Институт иммунологии МЗ РФ, Москва

Нередко у людей появляются вирусные инфекции. Они проявляются различными симптомами, которые люди стараются устранить. Однако устранить одни симптомы недостаточно. Чтобы полностью победить заболевание, нужно устранить его возбудитель. Для вирусных инфекций используются противовирусные препараты. На сегодняшний день фармацевтические компании представляют широкий перечень противовирусных средств. Популярными являются Неовир и Циклоферон. Нередко люди задаются вопросом, какой из препаратов лучше? Чтобы дать ответ, нужно сравнить особенности и показания данных медикаментов.
Неовир
Активным компонентом является криданимод. Выпускается в форме инъекционного раствора и таблеток. Является противовирусным и иммуномодулирующим средством.

За счет средства увеличивается активность клеток костного мозга. Также улучшается иммунная защита у людей с иммунодефицитными состояниями. Максимальная концентрация отмечается через несколько часов после применения и остается на протяжении 16-20 часов. Биодоступность составляет около 90%. При попадании в плазму крови, увеличивается уровень интерферона в организме. К обычным показателям данный уровень возвращается только спустя двое суток.
Препарат применяется в качестве монотерапии, а также в составе комплексной терапии при вторичных иммунодефицитах организма. В основном Неовир назначается при:
- Вирусе герпеса.
- Радиационном иммунодефиците.
- Урогенитальных инфекциях.
- Рассеянном склерозе.
- Цитомегаловирусной инфекции.
- Гепатитах В и С.
- Хламидийных инфекциях.
- Онкологических заболеваниях.
- Кандидозе.
Основными противопоказаниями являются:
- Беременность.
- Кормление грудью.
- Почечная недостаточность.
- Детский возраст.
Форма препарата и длительность приема назначается индивидуально врачом, в зависимости от заболевания.
Циклоферон
Активными компонентом является меглюмина акридонацетат. Выпускается в форме таблеток, мази и инъекционного раствора.

Циклоферон – это противовирусное средство, обладающее иммуномодулирующим действием. Способствует выработке эндогенного интерферона.
В организме имеется широкий спектр биоактивности. После попадания в организм, начинается продуцирование интерферонов. Особенно выражена продукция в легких, селезенке, кишечнике. Также активизируются стволовые клетки костного мозга. У людей с иммунодефицитными состояниями усиливает защиту организма.
При наличии инфекционных заболеваний, прием Циклоферона способствует улучшению состояния пациента. Также препарат способствует борьбе с опухолевыми процессами и метастазами. Также при ревматических заболеваниях снижается отечность и болевой синдром.
Мазь при местном применении обладает противовоспалительным эффектом. Максимальная концентрация отмечается через 2-3 часа после приема. На протяжении последующего времени происходит постепенное снижение концентрации. Время полувыведения составляет 4-5 часов. Если препарат применяется в рекомендуемых дозах, то накопления в организме не происходит.
Препарат назначается в таблетках при:
- Вирусе герпеса.
- Нейроинфекции.
- Гриппе и ОРЗ.
- Острых кишечных инфекциях.
- Вторичных иммунодефицитах.
- Гепатите В и С.
- ВИЧ-инфекции.
Данные показания относятся в том числе и к детям.
Внутримышечное введение проводится только для взрослых пациентов в составе комплексного лечения. Применяется при вышеперечисленных заболеваниях, а также при:
- Красной волчанке.
- Ревматоидном артрите.
- Заболеваниях суставов.
- Хламидийных инфекциях.
Мазь применяется при герпетической инфекции, уретрите и бактериальном вагините.
- Цирроз печени.
- Беременность и период лактации.
- Непереносимость компонентов.
- Дети до 4 лет.
Также не рекомендуется принимать пациентам, имеющим заболевания пищеварительной системы в фазе обострения.
Что выбрать?
Если провести сравнение препаратов, то можно сделать вывод, что оба они являются противовирусными средствами, но с разным составом. Отличительной чертой является и форма выпуска препаратов. Неовир выпускается в форме таблеток и раствора для инъекций. У Циклоферона кроме данных форм имеется и форма мази. Показания у препаратов практически одинаковые. Однако Циклоферон также можно применять при заболеваниях суставов, так как обладает противовоспалительным действием.
Противопоказания также практически одинаковые. Однако явной отличительной особенностью является то, что Неовир нельзя принимать детям. Циклоферон разрешено назначать детям с 4 лет, но только в форме таблеток.
Оба препарата имеют побочные действия. У Неовира это может проявляться болью при введении средства или появлении аллергических реакций. У Циклоферона могут наблюдаться лишь аллергические реакции. И у того и у другого медикамента, они проявляются достаточно редко.
Отзывы о Неовире говорят о том, что препарат эффективен в отношении инфекционных заболеваний. Однако уколы достаточно болезненные и в некоторых случаях требуется применение обезболивающего средства. Циклоферон имеет также положительные отзывы. Многие отмечают эффективность данного средства в различных формах. Эффективность препарата резко снижается при употреблении алкоголя.
Неовир выпускается в России. Стоимость 5 ампул составляет около 1200 рублей. Таблетки стоят около 600 рублей. Циклоферон также является отечественным препаратом. Стоимость таблеток составляет около 150 рублей. 5 ампул раствора стоят около 300 рублей.

Вывод
Таким образом, оба медикамента являются достаточно эффективными противовирусными средствами. Они имеют хорошую активность в отношении многих вирусов. Если требуется лечение детям, то рекомендуется выбрать Циклоферон, так как Неовир нельзя применять детям. Также данному медикаменту стоит отдать предпочтение, если исходить из финансового вопроса, так как он стоит горазд дешевле Неовира. В любом случае, выбор определяется врачом, и исходя из клинической картины заболевания.
В статье описана группа препаратов, рекомендованных МЗ РФ к применению на территории РФ, охарактеризованная как иммуномодуляторы с противовирусной активностью. Представлены их биологические эффекты, дана характеристика препаратов и описана их клиническачя значимость. Акцентируется внимание на преимуществах этой группы препаратов и указаны их недостатки. Подробно описаны результаты фармакотерапевтической эффективности клинически перспективного, ориентированного в педиатрическую практику, метилглюкамина акридонацетата ( циклоферона). Показана его эффектив-ность, изученная в плацебо-контролируемых и сравнительно-контролируемых исследованиях при социально-значимых заболеваниях у детей (ВИЧ-инфекция, вирусные гепатиты, респираторные инфекции, кишечные инфекции). Обсуждаются полученные результаты фармакотерапевтической эффективности препарата на этапе пострегист-рационных исследований.

К иммуномодулирующим средствам И.С.Фрейдлин (1989) относит препараты химической и биологической природы, способные модулировать (угнетать или стимулировать) реакции иммунитета. Они (препараты) воздействуют на иммунокомпетентные клетки, на процессы созревания, миграции, кооперации, а также на взаимодействие этих клеток и их продуктов ( цитокинов) с соответствующими мишенями [21]. Следовательно, лечение той или иной патологии иммунотропными средствами есть иммунотерапия; кроме того, к иммунотерапии необходимо относить методы лечения заболеваний, направленные на нормализацию нарушений в иммунной системе и основанные на использовании иммунотропных средств при заболеваниях, в патогенезе которых имеются нарушения, затрагивающие систему иммунитета[ 22]
По мнению Хаитова Р.М.(2003), основным критерием для назначения иммуномодуляторов является клиническая картина заболевания, проявляющаяся хроническим инфекционно-воспали-тельным процессом, трудно поддающимся адекватному антиинфекционному лечению [23 ].
К лекарственным препаратам с выраженными иммуномодулирующими средствами следует отнести интерфероны и их индукторы поскольку главное фармакологическое свойство этих препаратов - противовирусное, но интерферон как составляющая часть цитокиновой сети организма является иммунорегуляторной молекулой, оказывающей действие на все клетки иммунной системы [ 10, 23].
Таблица 1. Классификация индукторов интерферона [цит.по 10]
Синтетические соединения
Природные соединения
Индукторы интерферонов разных групп
Изучение эффективности индукторов при различных экспериментальных вирусных инфекциях выявило спектр активности этих препаратов и позволило наметить основные пути их дальнейшего клинического применения [ 8,9,14].
Таблица 2. Клиническое значение индукторов интерферона, разрешенных к применению МЗРФ (цит.по 8,14)
Амиксин
Кагоцел
Неовир
Полудан
Герпетический кератит и кератоконъюктивит икератоконьюнктивит
Ридостин
Известно, что одним из свойств индукторов интерферона является формирование в организме стойкой неспецифической резистентности длительный период времени после их введения, который может продолжаться иногда неделями. Сформировавшаяся резистентность не может быть объяснена только действием эндогенного интерферона, синтезированного в ответ на введение индуктора, так как этот интерферон выводится из организма гораздо раньше. Резистентность, по-видимому, является следствием непосредственного влияния индукторов интерферона на клеточный и гуморальный иммунитет, что требует углубленного и детального изучения [9].
Применяемые в клинике индукторы интерферона, индуцируют синтез смеси альфа, бета, гамма- интерферонов в разных пропорциях. Они хорошо сочетаются с другими индукторами, интерферонами разных типов, иммуномодуляторами и химиотерапевтическими средствами. Важно особо подчеркнуть, что комбинированное их введение с другими препаратами часто приводит к синергидному эффекту.
Хотя активность индукторов практически аналогична активности интерферонов, но они ( индукторы) имеют свои "точки приложения" в иммунной системе.
Например, амиксин вызывает медленную продукцию интерферона Т-лимфоцитами, а циклоферон вызывает быструю продукцию интерферона В-лимфоцитами.
Заметно отличаются индукторы и по способности "включать" синтез интерферона в различных органах (мозг, легкие, печень, селезенка и др.), что определяет тактику их использования при различных вариантах органной патологии. Так низкомолекулярные препараты (циклоферон, амиксин) способны преодолевать гематоэнцефаличесий барьер, поэтому активны при вирусных энцефалитах.
У индукторов интерферона есть достоинства, выходящие за рамки только "включения" системы интерферона. Как недавно показано в наших исследованиях, циклоферон вызывает образование ряда провоспалительных и противовоспалительных цитокинов. Это очень важное обстоятельство позволяет рассматривать данный препарат как биорегулятор цитокиновой сети.
Необходимо отметить и некоторые преимущества [9,10] индукторов интерферона:
- в отличие от наиболее широко используемых в настоящее времярекомбинантных интерферонов они не обладают антигенность ;
- синтез ИФН при введении индукторов сбалансирован и контролируется организмом, что предотвращает побочные эффекты, наблюдаемые при передозировке ИФН;
- даже однократное введение индукторов приводит к длительной продукции ИФН в терапевтических дозах, тогда как срок полужизни этих препаратов составляет 20 минут.
Наконец, некоторые индукторы интерферона обладают уникальной способностью "включать" синтез интерферона в определенных популяциях клеток и органов, что в ряде случаев имеет определенные преимущества перед поликлональной стимуляцией иммуноцитов интерферонами.
Эта группа препаратов не лишена и недостатков:
- в отдельных случаях их применение не сопровождается синтезом эндогенного продукта вследствии гипореактивности;
- относительно высокая токсичность амиксина, образование устойчивых комплексов с ДНК;
- невозможность преодоления гематоэнцефалического барьера ларифаном и ридостином, невозможность синтеза эндогенного продукта при пероральном применении;
Основными условиями для медицинского применения индукторов интерферона служат:
- специфическая активность;
- низкая токсичность;
- отсутствие мутагенности, канцерогенности, эмбриотоксичности.
Для правильного использования индукторов интерферона, когда их биологические эффекты выявляются наиболее полно, необходимо знать:
- какие клетки продуцируют интерферон в ответ на введение индуктора,
- какой тип интерферона индуцируется в органах-мишенях [9].
Характеристика индукторов интерферона ( цит.по 8,14)
Амиксин- стимулирует образование альфа/бета и гамма интерферонов, усиливает антителообразование,обладает антибактериальным и противовирусным действием.Пик накопления интерферона в крови (60-120 МЕ/мл) отмечается через 12-18 часов после приема, затем полностью исчезает из кровотока к 72 часам.В лейкоцитах человека индуцированный интерферон не превышает 120 МЕ/мл.
Противопоказания: болезни почек, аллергические заболевания
Ридостин - стимулирует продукцию раннего интерферона альфа/бета типов, отмечается два пика продукции: ранний через 4 часа, поздний - к 48 часам. Уровень интерферона снижается к 72 часам от момента введения препарата.
Наибольшей чувствительностью к препарату обладают лейкоциты больных гриппом, генитальным герпесом.
Наибольшей чувствительностью к препарату обладают лейкоциты больных генитальным герпесом, гриппом, ангиной, ОРВИ.
Арбидол - противовирусный препарат с интерферониндуцирующей активностью,оказывает ингибирующее действие на вирусы гриппа А,В; стимулирует фагоцитоз и антителообразование,Стимулирует гуморальные и клеточные реакции иммунитета.
Клинически наиболее перспективными классами соединений среди ароматических углеводородов оказались низкомолекулярные производные акридина - акридона - препарат циклоферон - метилглюкамина акридонацетат [3 ].
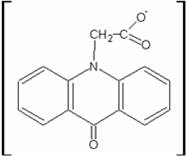
ЦИКЛОФЕРОН
Метилглюкамина акридонацетат
ДОЗА ДЛЯ ДЕТЕЙ -10 мг/кг массы тела.
Клинические исследования эффективности циклоферона проводились у детей и включали плацебо-контролируемые, сравнительно-контро-лируемые исследования. Мы приводим ниже основные результаты, полученные при исследовании эффективности препаратов циклоферона при различной патологии.
Вирусные гепатиты. Исследования проводились у детей, страдающих вирусными хроническими гепатитами с парентеральным механизмом заражения. В результате законченных исследований, установлено, что первичная ремиссия наблюдалась у 47,2%, а стабильная ремиссия у 55,4%, причем полная ремиссия установилась у 44,4% больных, рецидивы заболевания регистрировались лишь в 5,6% случаев.
У наркозависимых подростков с хроническим гепатитом С наблюдалась нормализация иммунного дисбаланса. Клиническое улучшение отмечено у 85% пролеченных лиц. Это проявилось в нормализации пигментного обмена, размеров печени, купированием болевого синдрома и цитолиза. Репликативная активность вируса сохранялась после 4-х месячного курса лечения, но у 58% пациентов уровень виремии снижался от 2-х до 7 раз. Максимальное снижение идет у больных с умеренной и низкой «нагрузкой» (до 600 000 копий), более низкий эффект у больных с высокой виремией (до 1-8 млн. копий) [2,6,7,18].
При ВИЧ-инфекции установлен выраженный лечебный эффект на стадиях IIБ,IIB - IIIА за счет стабилизации иммунного статуса и снижения репликативной активности вируса ( менее 200 копий РНК/ВИЧ в мл).Препарат оказывал наилучшее иммуномодулирующее действие при числе СD4 менее 500, но не ниже 200, при уровне вирусной нагрузке до 30 тысяч копий в 1 мл.
Повышение эффективности лечения гастродуоденальной патологии ( хронический гастродуоденит) с использованием циклоферона увеличилось на 20%. Терапия была направлена на элиминацию H.pylori, а также повышение иммунной защиты организма.
При наблюдении в катамнезе за детьми, страдающими хроническими эрозивными гастродуоденитами, после терапии циклофероном, отмечен рецидив у 6.0% больных, против 17-20.0% больных, получавших стандартный курс терапии [11].
Респираторные заболевания. При проведении многоцентровых плацебо-контролируемых исследований ( «эпидемиологический опыт») у детей и подростков, относящихся к категории часто и длительно болеющих отмечено снижение респираторной заболеваемости в 2.6-2.9 раза, установлен уровень защиты от 41 до 61%. При атопических состояниях наблюдалось снижение уровня Ig E и уменьшение в 2.4 раза частоты рецидивов и повторных обструктивных синдромов. При лечении бронхитов снижается частота и длительность рецидивов заболевания, за счет нормализации параметров иммунного ответа [4,5,15,17].
Результаты, вызывающие определенный интерес отмечены при использовании таблетированной лекарственной формы циклоферона в комплексной терапии острых кишечных инфекций [12,19,20].
Микробиологическая санация организма регистрировалась у 90,3% больных получавших циклоферон при дизентерии, сальмонеллезе, а применение циклоферона при сальмонеллезной инфекции обеспечило нормализацию микроэкологии просвета толстой кишки, увеличение индигенной анаэробной и факультативно-анаэробной флоры, элиминацию возбудителя и условно-патогенной микрофлоры, повышение уровня местного секреторного иммуноглобулина А. Включение циклоферона в терапию ротавирусных инфекций у детей приводило к стимуляции синтеза противоротавирусных антител ( до 0.58 отн.ед., против 0.36-0.39 до начала терапии и у больных группы сравнения), обеспечивая быструю санацию кишечника от возбудителя.
В настоящее время проводятся посттрегистрационные исследования эффективности циклоферона при нейроинфекциях.[1] Позитивные результаты получены при серозном менингите. Санация ликвора и длительность стационарного лечения были достоверно короче (11.7 дней, против 18.7), быстрее купировались менингеальные симптомы Цереброастенический синдром возникал гораздо реже, в сравнении с детьми, получавших стандартную терапию. При вирусных энцефалитах отмечали купирование судорожно-коматозного статуса, регресс очаговой неврологической симптоматики, формирование минимального органического дефицита на МРТ - только в случае раннего начала терапии.
При клещевых нейроинфекциях отмечено сокращение лихорадочного периода и сроков санации ликвора, что привело к сокращению длительности пребывания в стационаре, а также к быстрейшему купированию менингеальных симптомов. В катамнезе в течение года не отмечено хронизации процесса.
Анализ клинического течения заболевания при бактериальных менингитах не выявил особой разницы в группе больных, получавших циклоферон и в группе сравнения; Но в группе больных, получавших циклоферон, обратное развитие субдурального выпота происходило на фоне консервативной терапии, а в группе сравнения в половине случаев, пришлось прибегнуть к дренированию субдурального пространства.
Таким образом, фармакотерапевтическая эффективность циклоферона при столь широкой патологии обеспечивается его механизмом действия, включающим противовирусный, интерферониндуцирующий, иммунокорригирующий и противовоспалительный компоненты [17, с.99-109].
Учитывая противовирусное, интерферониндуцирующее и иммуномодулирующее действие ЦФ, он активно используется для системного и местного применения в терапии вирусных инфекций, в т. ч. папилломавирусных заболеваний кожи и слизистых оболочек (Аполихина И. А., Логинова Н. С, 2003; Димтриев Г. А., Биткина О. А., 2006; Логинова Н. С, Логинов В. В., 2004; Федотов В. П. и др., 2005). ЦФ эффективен в отношении цитомегаловируса, ВИЧ-1, ВПГ, вируса папилломы и других вирусов. Циклоферон используют как монотерапию либо в сочетании с другими противовирусными и иммунотропными препаратами. Так, больным нитевидными бородавками назначали бемитил по 1 таблетке 4 раза в день в течение 14 дней с последующей электрокоагуляцией. Внутримышечные инъекции 12,5% раствора ЦФ по 1 ампуле (250 мг) № 5 через день дополнительно назначали больным в случае большого количества бородавок или при развитии рецидивов после местного деструктивного лечения. Курс лечения ЦФ повторяли через 10 дней. Линимент ЦФ (лЦФ) назначался при вульгарных бородавках, чередуя с теброфеновой мазью в течение 4-6 недель, после предварительной обработки кератолитическими средствами. При отсутствии эффекта проводилось местное деструктивное лечение. Больным остроконечными кондиломами назначался изопринозин 2 таблетки 4 раза в день, наружно — кондилин. Как альтернативу, можно рассматривать применение ЦФ при ограниченных формах заболевания. В случае недостаточной эффективности проведенной терапии проводилась электрокоагуляция. При развитии отсроченных рецидивов назначали внутримышечно по 2 мл ЦФ № 10 через день, после чего проводили деструктивную терапию (Федотов В. П. и др., 2005).
Часто ПВИ сочетается с урогенитальным хламидиозом. При обследовании таких пациенток мы выявляли дисбиоз влагалища и кишечника. Проводилось комплексное лечение с антибиотиками, вифероном-3, про- или пребиотиками, в результате чего старались добиться восстановления кишечной и влагалищной эндоэкологии. Нередко небольшие папилломы уменьшаются в размерах, снижается активность ВПЧ. Если клиническая картина ВПЧ-инфекции оставалась без изменения, то проводили деструктивное лечение основных кондилом и назначали курс ЦФ внутримышечно 10 инъекций по 2 мл (250 мг) по основной схеме (1, 2, 4, 6, 8, 11, 14, 17, 20 и 23-й дни лечения). Местно нередко использовали аппликации 5% лЦФ, либо гидрогель алломедина 3-4 раза в день (Исаков В. А., Ермоленко Д. К., 2005).
Хороший эффект получен от комплексного лечения остроконечных кондилом с использованием галавита внутримышечно по схеме (200 мг — первый день, 100 мг — второй день, а с третьего дня по 100 мг через 48 часов, курс 10-15 инъекций) и местно 5% лЦФ. После первого курса терапии оставшиеся небольшие элементы удаляли цитотоксическим методом и назначали курс инъекций ЦФ по 2 мл по основной схеме.
Положительные результаты отмечены в случае лечения ПВИ изоп-ринозином по 2 таблетки (1000 мг) 3 раза в сутки в течение 14-28 дней в сочетании с внутримышечным введением ЦФ по 4 мл (500 мг) № 10 по основной схеме. В данном случае использовали противовирусный и иммуномодулирующий эффекты изопринозина и выраженную интерферон-индуцирующую активность ЦФ. Известно, что высокие дозы ЦФ (500 мг) способствуют активному синтезу ИФН-у, который обладает иммунорегуляторными и антипролиферативными свойствами, а также обеспечивает индукцию ТЫ-типа иммунного ответа.
Инфекционный процесс сопровождается воспалительной реакцией, в связи с чем нейтрофилы и другие иммунокомпетентные клетки активируются и мигрируют в очаг воспаления. Эти процессы сопровождаются усилением свободнорадикального окисления (СРО), вследствие чего активируется система антиоксидантной защиты (АОЗ). Между СРО и АОЗ существует динамическое равновесие, сдвиги которого сопровождаются нарушением функции клеток организма. Для объективной количественной оценки соотношения СРО-АОЗ используют тиолдисульфидный коэффициент крови (ТДС, соотношение SS/SH-rpynn).
Оптимальная работа клеток может осуществляться только при ТДС от 0,4 до 0,6; при ТДС больше 0,6 — АОЗ в состоянии активации, при ТДС меньше 0,4 — клетки испытывают цитотоксическое воздействие. Известно, что многие иммуномодулирующие препараты обладают антиоксидантной активностью, в связи с чем было изучено влияние иммунопрепаратов на интерфероновый статус (ИФС) и ТДС в цельной крови больных ПВИ и генитальным герпесом с целью подбора пациентам индивидуальной иммунотерапии (Логинова Н. С, Логинов В. В., 2004).
Сначала был проведен анализ частоты выбора иммуномодулятора (на основе оценки ИФС) с противовирусным компонентом в спектре действия 4 препаратов. Оказалось, что нормализующее влияние этих препаратов на ИФС проявлялось у полиоксидония и ридостина в 30-39%, у циклоферона — в 21%, у неовира — в 1%). Из 10 иммуномодуляторов с различным механизмом действия на основе их нормализующего влияния на ТДС основная доля выбора приходилась на циклоферон (24%) и неовир (19%), на два препарата — иммунофан и инстенон — 27%, на остальные 6 препаратов — 30%. Использование двух методов индивидуального подбора иммуномодулятора по его нормализующему действию (на ТДС и ИФС) показало перераспределение частоты выбора в пользу циклоферона (44%) и неовира (37%) по сравнению с ридостином (13%) и полиоксидонием (6%). С учетом высокой частоты ассоциированной инфекции ВПЧ с простым герпесом препаратами выбора индивидуальной иммунотерапии рекомендован циклоферон, а затем неовир (Логинова Н. С, Логинов В. В., 2004).
Инфекции, передающиеся половым путем (ИППП), — это группа инфекций, возбудители которых передаются преимущественно при половом контакте. Спектр подобных возбудителей очень широк; они включают в себя бактерии, вирусы, простейшие, грибы. Оценить истинную распространенность заболеваний, передающихся половым путем, очень трудно, учитывая возможность малосимптомного или бессимптомного течения, большое число нераспознанных случаев, а также отсутствие учета. У врачей заболевания, передающиеся половым путем, обычно ассоциируются с гонореей, сифилисом и ВИЧ-инфекцией, хотя другие заболевания этой группы по распространенности значительно превосходят (например, трихомониаз, хламидийная инфекция мочеполовых органов) или по крайней мере не уступают им (ВПЧ-инфекция, генитальный герпес) (табл. 13).
Таблица 13. Частота инфекций, передающихся половым путем, в мире (данные ВОЗ)
| Заболевание | Число случаев в год (млн) |
| Трихомониаз | 120 |
| Хламидийная инфекция половых органов | 50 |
| Генитальные кондиломы | 30* |
| Гонорея | 25 |
| Генитальный герпес | 20 |
| Сифилис | 3,5 |
| Шанкроид | 2 |
* В мире 300 миллионов женщин старше 15 лет имеют вирусоносительство папил-ломавируса (ВПЧ).
Начиная с конца 80-х — начала 90-х годов на территории Российской Федерации отмечается рост заболеваний, передаваемых половым путем. Проблема диагностики, лечения и профилактики ИППП является одной из актуальных проблем здравоохранения для многих регионов России (Тайц Б.М., 1994; Ильин Б. И., 1996; Смирнова Т. С, 2005). По официальной статистике, только в Санкт-Петербурге регистрируется в год от 80 до 100 тыс. случаев заболеваний, передаваемых половым путем (Тайц Б. М. с соавт., 1997).
До настоящего времени варианты местной терапии заболеваний урогенитального тракта, применяемой специалистами-гинекологами, венерологами и урологами, основывались в основном на антибиотиках и других лекарственных формах, зачастую не дающих полной местной санации, при этом вызывающих нарушение биоценоза, возникновение кандидозных поражений, нарушение местного иммунитета слизистых уретры и влагалища. Внедрение в клиническую практику жидкого линимента циклоферона позволяет решить многие проблемы, возникающие при лечении ИППП.
Установлено выраженное противовирусное, антибактериальное и антихламидийное действие препарата за счет активации системы иммунитета, противовоспалительное и антипролиферативное действие ЦФ. Показана эффективность лЦФ в комплексной терапии острых и хронических бактериальных и вирусных инфекций (хламидиозы, бактериальные и грибковые инфекции мочеполовой сферы, генитальный герпес, папилломавирусная инфекция).
Считают, что ВПЧ-5, ВПЧ-6 и ВПЧ-11 типов ответственны за развитие остроконечных кондилом (ОК). 28 взрослых больных ОК получили двухэтапное лечение. Сначала проводили удаление ОК методом криодеструкции жидким азотом, затем 17 больным назначили интравагинальные и интрауретральные инстилляции 5% лЦФ один раз в сутки № 10 через день для предотвращения рецидивов заболевания. 11 пациентам контрольной группы лечение проводили только методом криодеструкции. В течение 10-24 часов на месте криоаппликации развивался отек и гиперемия с последующим образованием пузырей и эрозий. Пузыри и эрозии обрабатывались раствором фукорцина, зона воздействия промывалась раствором хлоргексидина биглюконата в течение 2 недель, с целью профилактики вторичного инфицирования. Полное отторжение новообразований и эпителизация наблюдались на 10-14-й день (Федотов В. П. и др., 2005). В результате лечения у пациентов основной и контрольной групп рецидивы в первые дни после криодеструкции наблюдались у 3 (17,6%) и 2 (18%) больных соответственно (табл. 14). В течение 1-го месяца после операции рецидивы ОК наблюдались у 4 (23,5%) больных основной и у 3 (27,2%) контрольной групп. В течение 2-го месяца рецидивы отмечались у 1 (5,8%) и 3 (27,7%) пациентов соответственно. Оценивая полученные результаты следует отметить эффективность местного применения лЦФ. Так, уже в течение 2-го месяца после криодеструкции частота рецидивов ОК была достоверно выше в контрольной группе по сравнению с основной группой больных (27,2 и 5,8% соответственно, р
Таблица 14. Частота рецидивов у больных остроконечными кондиломами с учетом вида терапии
| Период наблюдения | Основная группа пациентов | Контрольная группа пациентов |
| В первые дни после эпителизации | 3 (17,6%) | 2 (18%) |
| В течение 1-го месяца | 4 (23,5%) | 3 (27,2%) |
| В течение 2-го месяца | 1 (5,8%) | 3 (27,7%) |
| Всего | 8 (49,9%) | 8 (72,7%) |
Линимент циклоферона 5% не обладает побочными эффектами, ограничивающими его использование при интрауретральном введении, и рекомендуется в комплексной терапии урогенитального хламидиоза, ПВИ в качестве иммунокорригирующего препарата. Применение лЦФ эффективно у женщин как в ходе монотерапии урогенитальных инфекций, так и в виде комбинированного лечения. Препарат хорошо сочетается как с различными официнальными интравагинальными препаратами, так и с лекарственными смесями, приготовленными ex tempore. Доказана эффективность лЦФ у женщин при следующих ИППП: неспецифический бактериальный вагинит, бактериальный вагиноз, кандидозный вагинит, неспецифический уретрит, рецидивирующие остроконечные кондиломы. У мужчин эффективность лЦФ в моно- и комбинированной терапии доказана при хламидиозе, уреаплазмозе, гонорейном уретрите, генитальном герпесе, кандидозном баланопостите, стрептостафилококковом баланопостите, рецидивирующих остроконечных кондиломах, хроническом простатите, хроническом колликулите.
Схемы для лечения лЦФ урогенитальных инфекций могут быть вариабельны в зависимости от тяжести заболевания, его нозологической формы и характера местных изменений. Линимент ЦФ не вызывает побочных явлений и аллергических реакций, которые могли бы явиться показанием для прерывания курса лечения или ограничивать его использование при интрауретральном (интравагинальном) введении. Базовыми можно считать нижеприведенные схемы:
- При генитальном герпесе, рецидивирующих остроконечных кондиломах — внутриуретральные (интравагинальные) инсталляции один раз в сутки по 5 мл (один флакон) в течение 10-15 дней ежедневно. Возможно сочетание лЦФ с другими противовирусными средствами (как системными, так и местными) в виде аппликаций мази (геля) к очагу поражения.
- При терапии неспецифических и кандидозных уретритов: интрауретральные инстилляции в объеме 5-10 мл (1-2 флакона) в зависимости от уровня поражения мочеиспускательного канала. При поражении переднего отдела уретры у мужчин канюлю шприца с линиментом вводят в наружное отверстие мочеиспускательного канала, затем отверстие зажимают на 1,5-3 мин. После чего инсталляционный раствор эвакуируется самотеком. Через 30 мин пациенту рекомендуют помочиться. Более длительная экспозиция препарата может привести к отеку слизистой уретры. При поражении заднего отдела уретры, области семенных желез применяют внутриуретральные инстилляции по катетеру в объеме 5-10 мл препарата в течение 10-14 дней через день (на курс 5-7 инстилляции).
- При терапии уретритов специфической этиологии — сочетанное применение внутриуретральных инстилляции ЦФ со специфическими антимикробными лекарственными средствами по традиционным схемам.
- При терапии кандидозного вагинита, неспецифического вагинита (эндоцервицита) и бактериального вагиноза возможно применение препарата как в виде монотерапии, так и в ходе комплексного лечения. Применяют интравагинальные инстилляции препарата по 5-10 мл (1-2 флакона) ежедневно в течение 10-15 дней. Для предотвращения свободной эвакуации препарата вход во влагалище тампонируется небольшим стерильным ватным тампоном на 2-3 часа.
Параллельно в случае сочетанного поражения слизистых влагалища и уретры (папилломавирусная инфекция и пр.) целесообразно применение сочетания интравагинальных и внутриуретральных инстилляций (в объеме 5 мл ежедневно, 10-14 дней). При хронических формах заболеваний лЦФ хорошо сочетается с использованием как официнальных лекарственных средств (вагинальных таблеток, свечей), так и приготовленных ex tempore. Учитывая широкий спектр воздействия 5% линимента циклоферона, можно сказать, что он не только занял свое место в лечении урогенитальных инфекций, но и потеснил традиционные препараты, используемые в лечении ИППП.
Метод системной энзимотерапии (СЭТ) основан на кооперативном терапевтическом взаимодействии целенаправленно составленных смесей гидролитических ферментов растительного и животного происхождения. Влияя на основные патофизиологические процессы в организме, препараты СЭТ оказывают противовоспалительное, противоотечное, фибринолитическое, иммуномодулирующее и вторично анальгезирующее действие (Насонова В. А. и др., 2003; Репина М. А., Кнорринг Г. Ю., 2002). Назначение энзимных препаратов (вобэнзим, флогэнзим, вобэмугос) приводит к снижению активности воспалительного процесса и модуляции защитных реакций организма. Больным с ПВИ и генитальным герпесом в комплексной терапии назначали вобэнзим по 7-10 драже 3 раза в день в течение 2-3 недель, что способствовало ускорению купирования местных проявлений, сокращению периода высыпаний и вирусовыделения из влагалищного секрета. Достоверно увеличились сроки ремиссии, происходила коррекция иммунных нарушений у больных, получавших вобэнзим ВЭ (Ремезов А. П. и др., 2003; Сафронова М. М., Репина М. А., 2001, 2003).
Известно участие иммуномикроэкологической системы человека в поддержании его здоровья и снижении риска развития заболеваний. Нарушения в иммунном и микроэкологическом статусе человека имеют важное, а порой и определяющее значение при традиционных инфекционных заболеваниях и в этиопатогенезе многих новых, т. н. «болезней цивилизации» (Алешкин В. А. и др., 2004). Можно сказать, что любая патология внутренних органов сопровождается изменениями кишечного микробиоценоза (Гриневич В. Б. и др., 2002; Шендеров Б. А. и др., 1997). Важно, что если в ходе лечения не удалось добиться оптимизации состояния кишечного микробиоценоза, чаще наступают рецидивы и варианты осложненного течения основного заболевания (Гриневич В. Б. и др., 2002, 2004). В связи с этим при лечении дисбиоза кишечника и влагалища используют пробиотики, пребиотики, симбиотики и синбиотики.
Эубикор (ООО ВАЛМЕД) — одно из первых, синтезированных в России, и наиболее эффективных современных средств из группы пребиотиков. Состав эубикора представлен оптимальным соотношением специально селектированного штамма винных дрожжей — Saccharomyces cerevisiae (vini), сорбированного на экструдированных пшеничных отрубях. Технология производства обеспечивает инактивацию дрожжей с одновременной высокой степенью сохранности и наработки в процессе ферментации большого количества биологически активных веществ (полисахаридов, комплекса аминокислот, витаминов, ферментов, убихинонов, минеральных веществ, микроэлементов, коэнзим Q, цитохром С), которые оказывают положительное влияние на кишечный микробиоценоз и организм человека в целом (Гриневич В. Б. и др., 2002; Михайлов И. Б. и др., 2004). Эубикор является средством с многогранной позитивной клинической эффективностью. При этом наряду с сорбционными свойствами он обладает выраженным бифидо-и лактогенным влиянием на микрофлору кишечника. Эубикор выпускают в порошке коричневого цвета с приятными органолептическими свойствами (вкусом, напоминающим высушенный хлеб). В упаковке 30 пакетиков по 3 г. Препарат принимают 3 раза в сутки во время еды, запивая водой (150 мл) в течение 3-4 недель. Режим однократного дозирования: детям от 2 до 6 лет — 0,5 пакетика, детям от 6 до 12 лет — 1 пакетик, детям от 12 лет и старше — 1-2 пакетика.
Дозировки некоторых препаратов для лечения дисбиоза кишечника (Гриневич В. Б. и др., 2003)
Бифидумбактерин сухой — 5 доз 2-3 раза в день, 4-6 недель.
Лактобактерин — 3 дозы 3 раза в день, 2-3 недели.
Лактофлор — по 10 мл 2 раза в день (развести водой), 3-4 недели.
Ацилакт — 5 доз 2 раза в день, 3-4 недели.
Линекс — 1-2 капе. 3 раза в день, 5-7 дней.
Бифиформ — 1 капе. 2-3 раза в день, 7-10 дней.
Хилак-форте — 20-40 капель 3 раза в день, 3-4 недели.
Дюфалак (лактулоза) — 1-3 чайных ложки 3 раза в день, 3-4 недели.
Среди лекарственных препаратов, применяемых для лечения герпетической инфекции, наибольшее распространение в клинической практике приобрели синтетические аналоги пуриновых и пиримидиновых нуклеозидов, ингибирующих ключевые ферменты репликации вируса: — ац
Среди лекарственных препаратов, применяемых для лечения герпетической инфекции, наибольшее распространение в клинической практике приобрели синтетические аналоги пуриновых и пиримидиновых нуклеозидов, ингибирующих ключевые ферменты репликации вируса: — ацикловир (вролекс, зовиракс, ациклогуанозин), а также валцикловир (валтрекс), фамцикловир (пенцикловир), фоскарнет, видарабин и их всевозможные комбинации, а также препараты ненуклеозидной природы — интерфероны, ДС-РНК, ингибиторы протеолиза и др.
Однако опыт длительного применения этих средств, особенно ацикловира, показал существенное снижение клинического эффекта во времени, что обусловлено образованием резистентных штаммов вируса герпеса.
Вследствие этого в настоящее время наибольшее внимание уделяется разработке комбинированных методов лечения с применением аналогов нуклеозидов, ингибиторов ферментов, цитокинов и индукторов интерферона.
В настоящее время наиболее изученным из разрешенных к клиническому применению индукторов интерферона является препарат циклоферон, выпускаемый в виде раствора для инъекций и хорошо себя зарекомендовавший для лечения широкого спектра вирусных и бактериальных инфекций, в том числе герпетической.
Исследования показали, что препарат in vitro полностью подавляет репликацию вируса герпеса первого типа и цитомегаловируса в культуре клеток, и проявляет высокую эффективность in vivo на моделях герпетического поражения (герпетический конъюнктивит и герпетический энцефалит) у экспериментальных животных (кроликов).
Учитывая эпидемиологию герпетической инфекции и необходимость амбулаторного применения препарата, представляется целесообразным внедрение в клиническую практику более удобной оральной формы циклоферона.
Целью настоящей работы явилось проведение рандомизированного клинико-лабораторного исследования эффективности оральной лекарственной формы циклоферона у 90 пациентов для лечения герпетической инфекции двойным слепым методом.
Исследуемый препарат: циклоферон (Cycloferonum) N-метил-N-(1-дезокси-d-глуцитол-1-ил) аммоний-10-карбоксиметиленакридон в виде таблеток коричневого цвета с кишечнорастворимой оболочкой по 0,15 г. Вводился орально один раз в сутки в дозе 0,3-0,6 г (две-четыре таблетки).
Препарат сравнения: ацикловир (Acyclovirum, производства AZT, Россия) в виде таблеток по 0,2 г. Принимается орально пять раз в сутки в суточной дозе 80-100 мг/кг.
В клиническое исследование были включены больные герпетической инфекцией, удовлетворяющие следующим условиям: возраст 14-60 лет; отсутствие тяжелых сопутствующих заболеваний.
Диагноз герпетической инфекции ставился на основе клинико-эпидемиологических данных и подтверждался лабораторными методами (ПЦР, ИФА).
Всего было обследовано 125 пациентов, из них 42 мужчины и 83 женщины. Возраст — от 18 до 60 лет, в среднем 33,9±10,3 лет. Диагноз H.labialis был поставлен 23 пациентам, H.henitalis — у 94, сочетанная форма — у 8.
Длительность заболевания колебалась от 0,5 лет до 16 лет, составляя в среднем 4,1±0,8 лет.
35 пациентов ранее использовали ацикловир или его аналоги в лечении герпетической инфекции.
Было сформировано три группы больных.
Первая группа (группа I) из 38 пациентов получала циклоферон по одной таблетке орально два раза в сутки на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29-й день лечения. Курс лечения один месяц. Всего на курс лечения 24 таблеток циклоферона.
Вторая группа (группа II) из 36 человек получала ацикловир ежедневно по две таблетки по 0,2 г пять раз в день в течение 8—10 дней. Всего на курс лечения 40—50 таблеток ацикловира.
Третья группа (группа III) из 51 пациентов принимала циклоферон по одной таблетке на прием два раза в сутки на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29-й день лечения и дополнительно ацикловир ежедневно по одной таблетке пять раз в день в течение 8—10 дней.
Рандомизация больных осуществлялась по очередности поступления (первый в группу I, второй в группу II и т. д.).
Эффективность проводимой терапии оценивалась по клиническим и лабораторным критериям оценки протекания герпетической инфекции.
Для этого использовали следующие клинические показатели:
- частота обострений;
- длительность обострений;
- интенсивность обострений.
Частота обострений у пациентов с положительной динамикой показана в табл. 1.
Таблица 1. Количество обострений в год
Таблица 2. Длительность обострений, дни
Интенсивность проявлений герпетической инфекции оценивалась лечащим врачом по пятибалльной шкале. Результаты представлены в табл. 3.
Таблица 3. Интенсивность обострений, в баллах по 5-балльной шкале
Таким образом, на основании результатов клинического обследования пациентов можно сделать вывод о том, что циклоферон, используемый в качестве средства лечения герпетической инфекции, в большей степени улучшает основные клинические показатели состояния больного, чем ацикловир.
Вирусу простого герпеса в организме хозяина противостоят различные иммунные механизмы, включающие цитотоксические Т-лимфоциты, естественные киллеры, факторы гуморального иммунитета, мононуклеарные фагоциты, цитокины. При таком разнообразии факторов, участвующих в контроле герпесвирусной инфекции, важно оценить относительный вклад каждого из них до и после лечения, благодаря чему можно сделать вывод о том, какие звенья иммунной системы преимущественно активизируются (или подавляются) под воздействием того или иного лекарственного препарата. С этой целью в рамках данного исследования был проанализирован широкий спектр иммунологических показателей, характеризующих состояние различных компонентов клеточного и гуморального иммунитета.
Динамика изменений общего сывороточного IFN представлена в табл. 4.
Таблица 4. Содержание общего сывороточного IFN, ME/мл (норма: 0-8)
Как видно из таблицы, содержание IFN под действием ацикловира увеличивалось в среднем на 7%, тогда как циклоферон повышал уровень IFN в крови в среднем на 18%. Наиболее эффективным оказалось сочетание этих двух препаратов, их совместное применение приводило к повышению содержания IFN в среднем на 22%. Различие по этому показателю между группами II и III было статистически достоверным (Р<0,05).
В табл. 5 представлены средние значения уровня продукции IFN-a/b у пациентов с положительными изменениями до и после приема препаратов.
Таблица 5. Уровень продукции IFN-a/b, ME/мл (норма: 250—520)
Из таблицы видно, что монотерапия циклофероном и сочетание циклоферона с ацикловиром приводили к увеличению уровня продукции IFN-a/b практически до нормы, тогда как у пациентов, принимавших ацикловир, уровень продукции интерферона после лечения оставался ниже нормальных значений.
Наибольший стимулирующий эффект в отношении продукции интерферонов a и b наблюдался у пациентов III группы, принимавших одновременно циклоферон и ацикловир.
Сравнение средних величин относительного приращения уровня продукции IFN-g показало отсутствие значимых различий между группами. Таким образом, на основании полученных результатов можно сделать вывод о том, что изучаемые препараты и их сочетание равноценны по своему воздействию на продукцию IFN-g клетками.
Естественные цитотоксические клетки (natural killer — NK), обладающие спонтанной цитотоксической активностью в отношении широкого спектра клеток-мишеней, в том числе клеток, инфицированных вирусами, являются важным клеточным звеном неспецифического иммунного ответа. Эти клетки представляют первую линию защиты от вирусинфицированных клеток, а также продуцируют ряд цитокинов.
Средние значения активности NK-клеток у больных с положительными изменениями представлены в табл. 6.
Таблица 6. Цитотоксическая активность NK-клеток, % (норма: 46—50)
Как видно из таблицы, активность NK-клеток в группах II и III повышается на большую величину, чем в группе II, причем в группах I и III показатель активности после лечения практически достигал нормы, тогда как в группе II эти значения до и после лечения оставались ниже нормальных показателей.
Терапия циклофероном как в отдельности, так и в сочетании с ацикловиром более эффективно повышала активность мононуклеарных фагоцитов, чем терапия ацикловиром, средние показатели фагоцитоза после лечения в группах I и III практически соответствовали норме, тогда как в группе II и после лечения эти величины оставались пониженными.
Спонтанная миграция клеток увеличивалась приблизительно на треть. Статистический анализ показал, что достоверных различий между группами по этому показателю нет.
Наибольшее среднее приращение результатов НСТ-теста наблюдалось в группе II, однако статистический анализ свидетельствует о том, что различия между группами недостоверны.
Определение сывороточных иммуноглобулинов является одним из основных количественных тестов, позволяющих оценить состояние гуморального звена иммунитета. В данном исследовании измеряли концентрацию иммуноглобулинов трех основных классов — М, А и G. Для определения использовали метод радиальной иммунодиффузии по Манчини.
Различия в величине приращения концентрации Ig М после лечения были статистически недостоверны для всех трех групп.
Циклоферон и ацикловир по отдельности вызывают сходные эффекты. Продукции Ig А и их средние значения статистически не отличаются друг от друга. Сочетанное применение этих препаратов, напротив, повышало уровень Ig А в крови.
Эффект воздействия циклоферона и ацикловира на уровень IgG был одинаков.
Для оценки специфического гуморального ответа, направленного против вируса герпеса, определяли IgG к вирусу простого герпеса I и II типа методом иммуноферментного анализа.
Различия в эффектах препаратов между группами были статистически недостоверны.
В рамках данного исследования определялось наличие или отсутствие делеции гена GSTM1. Этот анализ проводился с целью проверки предположения о том, что продукт этого гена участвует в метаболизме циклоферона в организме и тем самым способствует интерферон-индуцирующей активности этого препарата. Группы пациентов, получавших циклоферон (группы I и III), были разделены на две подгруппы: пациенты, имеющие ген (GSTM+), и пациенты с делецией гена (GSTM 0/0). В этих подгруппах анализировали результаты клинических наблюдений (частота и длительность рецидивов, интенсивность проявления обострений заболевания) и данные лабораторных исследований (интерфероновый статус и активность NK-клеток). Сравнивались изменения как в подгруппе в целом, так и отдельно у пациентов с положительными и отрицательными изменениями.
Проведенный статистический анализ данных не выявил достоверных различий между подгруппами GSTM 0/0 и GSTM1+ по эффекту препаратов на частоту и длительность рецидивов, интенсивность обострений, уровень общего интерферона в сыворотке, продукцию интерферонов a, b и g in vitro, а также цитотоксическую активность NK-клеток.
На основе полученных данных можно предположить, что действие циклоферона не связано с его метаболизмом, и это позволяет одинаково эффективно использовать этот препарат в генетически гетерогенных группах пациентов.
Заключение
При проведении исследования было использовано несколько схем терапии таблетированным препаратом циклоферон. Помимо стандартной схемы, описанной выше, наиболее эффективными, особенно с профилактической точки зрения, оказались короткие схемы приема препарата (по одной таблетке два раза в день в течение недели) с месячным перерывом.
В целом результаты исследования позволяют сделать следующие выводы.
1. Таблетированная форма циклоферона хорошо переносится и не вызывает побочных эффектов при использовании вышеупомянутых схем терапии. В настоящем исследовании не было отмечено случаев индивидуальной непереносимости препарата.
2. Наиболее эффективной в терапии рецидивирующей герпетической инфекции оказалась схема лечения, сочетающая использование противовирусного препарата (в нашем исследовании ацикловир) и индуктора интерферона циклоферон.
3. Препарат циклоферон не обладает иммунотоксическими эффектами, об этом можно судить по отсутствию подавления функциональных и количественных параметров иммунной системы.
4. Таблетированная форма циклоферона эффективно индуцировала выработку интерферонов a/b и в меньшей степени g -интерферона, а также цитотоксическую активность NK-клеток, обеспечивая таким образом противовирусное действие препарата.
5. Самостоятельный курс приема таблеток циклоферона в виде монотерапии может эффективно использоваться при лечении герпетической инфекции.
6. Отсутствие различий в эффективности терапии у генетически гетерогенных по экспрессии гена, кодирующего глутатион-S-трансферазу, пациентов может быть важным доказательством того, что именно неизменная молекула циклоферона является действующим индуктором.
Полученные данные позволяют рекомендовать таблетки циклоферона в стандартных дозах различным пациентам независимо от их способности к метаболизму ксенобиотиков.
Литература
1. Кондратьева Г. А., Екимова В. И., Иовлев В. И. Определение противовирусной активности интерферонов человека микрометодом / Реаферон (сборник научных трудов). Л., 1988, с. 105-109.
2. Manaseki S., Searle R. F. Natural killer (NK) cells activity of first trimester human decidua // Cellular Immunology. 1989. Vol. 121. № 1. P. 166-173.
3. Park B. H. Infection and nitroblutetrasolium reduction by neutrophis // Lancet. 1968. Vol. 2. P. 532-534.
Читайте также:

