Назначили актовегин при гематоме
Обновлено: 15.04.2024
М.Д. Дибиров (1), Р.У. Гаджимурадов (1, 2), О.Х. Халидов (1, 2), М.Р. Какубава (1, 2), М.В. Полянский
(1) Кафедра хирургических болезней и клинической ангиологии ГБОУ МГМСУ им. А.И. Евдокимова Минздрава России, Москва; (2) Городская клиническая больница № 81 ДЗ Москвы
Цель работы составила оценка эффектов препарата Актовегин в комплексном лечении хронических ран различной этиологии. Под наблюдением находились 118 пациентов, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета. Больные были разделены по этиологическому фактору на три группы, включавшие в себя патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. Каждая из групп была разделена на пациентов получавших только традиционную терапию, и пациентов получавших помимо традиционной терапии Актовегин. Результаты исследования показали: по сравнению с больными которым была назначена только традиционная терапия, у пациентов получавших Актовегин, на 3-4 суток раньше уменьшались размеры хронических ран, на 2-3 суток раньше снижался болевой синдром,. Вышеперечисленное позволяет рекомендовать Актовегин для лечения хронических ран различной этиологии.
Актуальность проблемы
Хронические раны представляют собой серьезную проблему для мирового здравоохранения на протяжении многих лет. Многие российские и зарубежные авторы занимались ее изучением, принимая различные определения этого понятия и предлагая множество методов лечения при данной патологии [1, 3, 6, 9]. Несмотря на массу научных трудов по этой тематике и сотни предложенных инновационных методов лечения, проблема лечения хронических ран и сейчас остро стоит перед хирургами во всем мире [2–4, 11, 12]. Ежегодные затраты на лечение хронических ран достигают 9 млрд долл. США и требуют массу времени и усилий медицинского персонала для организации длительного адекватного наблюдения за этой категорией пациентов [5, 6, 8, 10, 12].
В 1996 г. Европейское общество репарации тканей на специальном заседании приняло определение: «хронической следует считать рану, не заживающую в течение периода, который является нормальным для ран подобного типа или локализации». Отечественные авторы дополнили это определение и описывают хроническую рану как рану, репарация которой нарушена из-за неблагоприятных фоновых состояний. Понятие «хроническая рана» – очень широкое и включает также трофические язвы, хроническую анальную трещину и другие длительно не заживающие раневые дефекты. Причины, обусловливающие формирование хронических ран, также бывают весьма разнообразными. Хорошо изучены этиологические факторы, приводящие к развитию трофических язв. Они бывают венозными на фоне хронической лимфовенозной недостаточности, артериальными, при хронической ишемии нижних конечностей, на фоне диабетической полинейропатии, микро- и макроангиопатии, гипертоническими (синдром Марторелла), при системных заболеваниях (болезни крови, обмена веществ, коллагенозы, васкулиты), нейротрофическими, рубцово-трофическими; застойными (на фоне недостаточности кровообращения), пиогенными, специфическими и инфекционными, малигнизированными, при синдроме Лайелла, при врожденных пороках развития сосудистой системы, лучевыми, артифициальными [2, 3, 7]. Генез большинства хронических ран полиэтиологичен с вовлечением различных патогенетических механизмов, затрагивающих клеточный и тканевой метаболизм, микрососудистый эндотелий [7, 9, 11]. В связи с этим актуально применение терапевтических методик с использованием, в частности, фармакологических препаратов, влияющих на различные звенья патогенеза. Препарат Актовегин, обладающий плейотропными эффектами, показал свой терапевтический потенциал в отношении пациентов с сахарным диабетом и хронической ишемией нижних конечностей, сопровождающейся язвенно-некротическими осложнениями [1, 3, 4, 7]. С учетом вышесказанного целью нашей работы стала оценка эффектов препарата Актовегин в комплексном лечении хронических ран различной этиологии.

Материал и методы
Под нашим наблюдением находились 118 пациентов в возрасте от 52 до 80 лет, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета ГКБ № 81. Все пациенты находились на лечении в связи с наличием хронических раневых дефектов. Больные были разделены по этиологическому фактору на три группы, включившие патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. В 1-ю группу были включены 54 пациента, страдавших длительно незаживающими трофическими язвами нижних конечностей вследствие хронической венозной недостаточности. У всех пациентов при ультразвуковом дуплексном сканировании (УЗДС) вен нижних конечностей диагностирована несостоятельность клапанов подкожных вен и наличие длительно существующих (от 2 до 48 месяцев) незаживающих раневых дефектов в области нижней и средней третях голеней. Всем больным выполнено этиопатогенетическое лечение: после курса антибактериальной терапии с учетом микробного пейзажа и очистки раневых дефектов была проведена кроссэктомия в сочетании с операцией Линтона. В послеоперационном периоде больные были разделены по 27 пациентов на две группы – основную и контрольную, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больным проведена медикаментозная терапия и местное лечение в полном объеме. Пациенты основной группы помимо традиционного лечения получали Актовегин внутривенно (1200 мг 1 раз в сутки в течение 14 дней) и местно в форме геля, мази или крема в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки больным назначен препарат Актовегин по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе местное лечение осуществлено мазевыми повязками (Бетадин, метилурацил, Левосин).
Во 2-ю группу включены 36 пациентов с симптомами хронической артериальной ишемии нижних конечностей, а также длительно незаживающими раневыми дефектами на различных уровнях стоп на фоне облитерирующего атеросклероза и эндартериита. При УЗДС артерий нижних конечностей диагностированы окклюзии бедренно-подколенно-берцового сегмента на различных уровнях. Всем больным по показаниям выполнена коррекция магистрального кровотока: бедренно-дистальные шунтирования аутовенной или синтетическими протезами, проведена консервативная гемореологическая (реополиглюкин, декстран и т.д.), антикоагулянтная (гепарин, Плавикс, Вессел Дуэ Ф), дезагрегантная (пентоксифилин, ацетилсалициловая кислота) терапия в полном объеме. В послеоперационном периоде пациенты были разделены по 18 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больные основной группы помимо стандартного лечения получали Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе Актовегин не применялся, а местное лечение осуществлено раствором Бетадин, мазью Левомеколь, метилурациловой мазью.
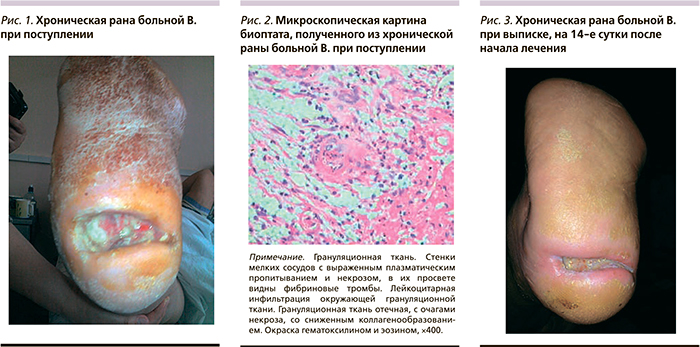
В 3-ю группу включены 28 пациентов, длительное время страдавших сахарным диабетом 2 типа, с клиническими признаками полинейропатии и длительно существующими раневыми дефектами нижних конечностей, не связанными с хронической артериальной или венозной недостаточностью. У этих пациентов проведены коррекция углеводного обмена (инсулинотерапия), местное лечение в объеме некрэктомии (по показаниям), гемореологическая и нейротропная терапия (Октолипен, Берлитион), ультразвуковая кавитация ран в регенерационном режиме через день, перевязки с гелем Hydrosorb, раствором Бетадин. Эти больные также были разделены по 14 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии.
В основной группе больные помимо общепринятого лечения получали препарат Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
Во всех нозологических группах пациентов до и после курсов комплексной терапии произведен визуальный контроль ран по системе MEASURE [11], а также выполнены исследования микроциркуляции методом лазерной допплеровской флоуметрии. Датчик располагался в дне раневых дефектов. Помимо этого всем больным выполнено гистологическое исследование биоптатов из ран на протяжении всего срока стационарного лечения в динамике. Биоптаты фиксировали в 10%-ном нейтральном формалине и,по общепринятой методике заливали в парафиновые блоки. Изготовленные из парафиновых блоков гистологические срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином.
Результаты и их обсуждение
У пациентов 1-й группы, проходивших лечение по поводу хронических ран, вызванных хронической венозной недостаточностью, уменьшение площади раневых дефектов (высчитывалась из линейных размеров ран) в основной группе отмечено на 4–5-е сутки, в контрольной группе – на 7–9-е послеоперационного периода.
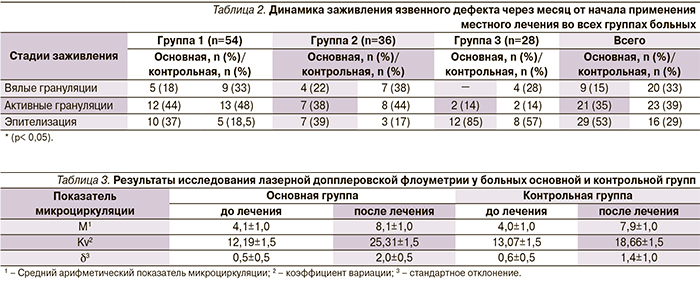
В обеих группах на 3–4-е сутки послеоперационного периода уменьшалось количество экссудата с умеренного до скудного, причем качественно экссудат оценивался нами как серозный или серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е сутки, тогда как в контрольной группе – на 6–7-е. На момент выписки хронические раны полностью зажили у 10 (37%) пациентов основной группы и у 5 (18,5%) – контрольной. Через 3 недели после выписки раны зажили в основной группе у всех (100%) больных, в контрольной группе – у 15 (55,5%) пациентов.
У пациентов 3-й группы, проходивших лечение по поводу хронических ран, на фоне нейропатической формы синдрома диабетической стопы, уменьшение площади раневых дефектов в основной группе отмечено на 2–3-е сутки, в контрольной группе – на 4–5-е сутки после начала лечения. Количество экссудата уменьшалось с умеренного до скудного в основной группе на 1–2-е сутки, в контрольной группе – на 2–3-е сутки, причем качественно экссудат оценивался нами как серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е и на 5–6-е сутки в контрольной группе. На момент выписки хронические раны полностью зажили у 12 (85%) пациентов основной группы и у 8 (57%) пациентов контрольной группы. В течение первых 3 недель после выписки раны зажили у всех пациентов основной группы (100%) и у 12 (85,7%) пациентов контрольной группы.
Особое внимание уделено динамике заживления язвенного дефекта в обследуемых группах как одному из важнейших показателей эффективности терапии. Результаты исследования показали, что при сочетании применения Актовегина для наружного использования и внутривенных инфузий через месяц от начала лечения эпителизация язвенного дефекта наблюдалась более чем у половины (53%) пациентов, что статистически достоверно.
При применении Актовегина наружно в виде геля, крема и мази средние сроки очищения ран от гнойных и некротических масс появление грануляций были в среднем меньше по сравнению со сроками в контрольных группах на 3–4-е суток (табл. 1). Через месяц от начала терапии у 29 пациентов основной группы и у 16 контрольной наблюдали эпителизацию язвенного дефекта. У 9 больных основной группы наблюдались вялые грануляции с отложениями фибрина, в контрольной группе – у 20 больных (табл. 2).
Результаты исследования микроциркуляции методом лазерной допплеровской флоуметрии представлены в табл. 3.
При гистологическом анализе биоптатов из ран после срока стационарного лечения у всех пациентов, получавших Актовегин, по сравнению с пациентами контрольных групп отмечалась нормализация процессов пролиферации и дифференцировки грануляционной ткани (коллагенообразования и новообразования сосудов), менее выраженная лейкоцитарная инфильтрация, активные процессы эпидермизации участков поражения кожи (рост эпителиального пласта на границе с грануляционной тканью).
В качестве иллюстрации эффектов комплексной терапии приводим клинический пример.
Пациентка В. 67 лет с синдромом «диабетическая стопа», нейропатией 2-й степени по Wagner, трофической язвой подошвенной поверхности резецированной правой стопы на фоне натоптыша в течение трех месяцев (рис. 1). Больная лечилась амбулаторно в поликлинике, по назначению хирурга применялись перевязки с мазью левомеколь в течение одного месяца без эффекта. Пациентка была направлена в отделение гнойной хирургии и гнойных осложнений сахарного диабета в плановом порядке. При обследовании: клинико-биохимические показатели в пределах нормы, при УЗДС артерий нижних конечностей окклюзия дистальных отделов передней и задней большеберцовой артерий.
В заключение стоит отметить, что назначение препарата Актовегин оказалось не случайным и обусловлено его фармакологическими свойствами: выраженным метаболическим и эндотелиопротекторным действиями на уровне микрососудистого русла. Актовегин улучшает коллатеральный кровоток, трофическое обеспечение кислородом тканей при их хронической ишемии, а также при сосудистых и нейропатических осложнениях сахарного диабета [1–3, 7]. Полученные результаты позволили сделать нам следующие выводы и рекомендации:
В комплексном лечении хронических ран ведущая роль принадлежит патогенетическому лечению.
Для лечения хронических ран различной этиологии применение Актовегина в составе комплексной терапии достоверно позволяет увеличивать ее эффективность. При применении Актовегина на 3–4 суток раньше уменьшаются размеры хронических ран, на 2-3 суток раньше снижается болевой синдром по сравнению с больными контрольной группы.
Назначение Актовегина позволяет достоверно улучшать микроциркуляцию в хронической ране (средний показатель микроциркуляции в среднем выше на 0,2 пФ в группе пациентов, получавших Актовегин).
Мы рекомендуем включать препарат Актовегин в схему комплексного лечения больных с хроническими ранами различной этиологии по следующей схеме: внутривенно по 1200 мг 1 раз в сутки в течение 14 дней. Далее переход на таблетированную форму: по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
Для местного лечения чистых хронических ран различной этиологии мы рекомендуем использовать Актовегин в форме геля 1 раз в сутки до полного заживления.
Литература
Об авторах / Для корреспонденции
М.Д. Дибиров – д.м.н., проф., зав. кафедрой хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, Москва; заслуженный деятель науки РФ, заслуженный врач РФ
Р.У. Гаджимурадов – д.м.н., проф. кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, врач сердечно-сосудистый хирург ГКБ №81 ДЗ Москвы
О.Х. Халидов – д.м.н., проф. кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, зам. глав.врача по хирургии ГКБ №81 ДЗ Москвы
М.Р. Какубава – к.м.н., ассистент кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, врач-хирург отделения гнойной хирургии ГКБ №81 ДЗ Москвы
М.В. Полянский – ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, ГКБ №81 ДЗ Москвы
Ншанян С.Ю.
Филиал “Мединцентр” ГлавУПДК при Министерстве иностранных дел РФ, Москва
Обосновывается необходимость применения в составе программ вспомогательных репродуктивных технологий (ВРТ) препаратов, обладающих антигипоксическим и метаболическим действием, таких как Актавегин. Указывается, что применение Актовегина на ранних сроках беременноcти, наступившей после применения методов ВРТ, в большинстве случаев ассоциируется с благоприятными акушерскими и перинатальными исходами. У женщин позднего репродуктивного возраста со сниженным овариальным резервом препарат широко используется для оптимизации роста фолликулов и получения зрелых, годных для оплодотворения ооцитов. В целом многообразие лечебных эффектов препарата Актовегин делает целесообразным включение его в комплекс профилактических и лечебных мероприятий, используемых в рамках программ ВРТ, повышая вероятность сохранения и восстановления репродуктивного здоровья женщин.
Проблемы преодоления женского бесплодия несомненно являются весьма актуальными для современной медицины, и поиски путей повышения эффективности проводимых в этом направлении лечебных мероприятий продолжаются.
Частота бесплодных браков в нашей стране, по данным ряда исследователей, составляет 12–15 % и имеет тенденцию к росту. Такая демографическая ситуация, разумеется, способствует более широкому внедрению вспомогательных репродуктивных технологий (ВРТ) для планирования беременности.
Современный уровень развития медицинских технологий позволяет повысить эффективность проводимых программ экстракорпорального оплодотворения (ЭКО) и частоту наступления беременности до 35–50 % из расчета на перенос эмбрионов в полость матки. Показатели варьируются, по данным различных авторов, в широких пределах и зависят от генеза, а также длительности бесплодия, возраста пациенток и множества других факторов. Однако частота прерывания беременностей, наступивших в рамках программ ЭКО, по-прежнему остается высокой, достигая у определенного контингента пациенток 66 % [15, 16].
Беременные после ЭКО составляют группу риска по невынашиванию беременности, развитию гестоза и плацентарной недостаточности [1, 12, 19]. Отягощенное течение беременности у этого контингента женщин связано, как правило, с более старшим возрастом, сопутствующими акушерско-гинекологическими заболеваниями и большей вероятностью многоплодных беременностей. Указанные обстоятельства диктуют необходимость назначения помимо стандартной комплексной гормональной и токолитической терапии препаратов, обладающих антигипоксическим и метаболическим действиями.
К числу лекарственных средств, отвечающих данным требованиям, относится Актовегин (Никомед ГмбХ, Австрия) – высокоочищенный гемодериват из крови молодых телят, содержащий комплекс микроэлементов, аминокислот и низкомолекулярных пептидов. Установлено, что Актовегин способствует увеличению утилизации и потребления кислорода (повышает устойчивость к гипоксии), усиливает энергетический метаболизм и увеличивает потребление глюкозы. Суммарный эффект всех этих процессов состоит в усилении энергетического статуса клетки, особенно в условиях кислородной недостаточности. Препарат не обладает иммуногенностью и органоспецифичностью, апирогенен. Оказывает выраженные антигипоксические, антиоксидантные и метаболические эффекты за счет усиления транспорта глюкозы в ткани и увеличения синтеза АТФ, активации фермента супероксиддисмутазы, подавляющей процессы перекисного окисления липидов.
Метаболическое действие Акто-вегина связано с входящими в его состав компонентами, в частности микроэлементами, аминокислотами, низкомолекулярными пептидами, усиливающими работу внутриклеточных систем. Благодаря перечисленным механизмам действия препарат значительно улучшает функциональное состояние клеток, нормализуя функции тканей и органов.
По данным Назаренко Т.А. и соавт., применение Актовегина на ранних сроках беременноcти, наступившей после применения методов ВРТ, в большинстве случаев ассоциируется с благоприятными акушерскими и перинатальными исходами [19]. Препарат назначают по 200 мг в таблетках 2–3 раза в день вплоть до родоразрешения.
Актовегин также с успехом используется у беременных с угрожающим самопроизвольным выкидышем в I триместре беременности, особенно при наличии ретрохориальной гематомы [4].
Для профилактики первичной плацентарной недостаточности у беременных из группы риска проводится внутривенное введение Актовегина в дозе 5 мл (200 мг) вместе с 200–400 мл физиологического раствора хлористого натрия или 5 % глюкозы. По данным Стрижакова и соавт. [9, 19], на фоне применения Актовегина в 51,7 % случаев наблюдается улучшение и в 21,5 % – стабилизация плацентарного кровотока.
На основании результатов проведенных исследований установлено, что использование Актовегина для коррекции гипоксии во время родов улучшает перинатальные исходы. Показано, что под влиянием инфузий Актовегина происходит улучшение кислородного гомеостаза плода в родах. Известно, что в условиях внутриклеточной недостаточности кислорода клетка обеспечивает собственные энергетические потребности за счет активации процессов анаэробного гликолиза. Истощение внутренних энергетических резервов ведет к деструкции клеточных мембран, разрушению клеток и тканевому ацидозу. Длительное изменение внутриклеточного метаболизма в сторону преобладания анаэробных процессов является одним из ведущих патогенетических механизмов развития гипоксических и ишемических повреждений органов и тканей. Актовегин оказывает системное действие на организм, увеличивая кислородный энергообмен в клетках, находящихся в состоянии метаболической недостаточности [3, 9, 18].
На основании имеющихся данных о метаболическом, антигипоксическом и некоторых других эффектах Актовегина его применение в рамках программ ВРТ в последние годы значительно расширилось. Это обусловлено изменениями в структуре женского бесплодия, формированием определенных групп пациенток, восстановление репродуктивной функции которых требует включения в комплексную терапию дополнительных препаратов.
Значительные социально-экономи-ческие изменения, произошедшие за последние десятилетия, успехи медицинской науки оказали существенное влияние на контингент пациенток, обращающихся за помощью в клиники ВРТ. Среди них возросло число женщин, находящихся в позднем репродуктивном возрасте, имеющих отягощенный акушерско-гинекологический анамнез, предпринимавших в прошлом неэффективные попытки ЭКО.
Репродуктивному здоровью женщин позднего репродуктивного возраста (35–44 года) в последнее время стали уделять особое внимание, что связано, помимо прочего, с заметным увеличением численности женского населения этой возрастной категории. В России они составляют 30 % от числа всех женщин репродуктивного возраста. Поискам методов оптимизации лечения этого контингента посвящена значительная часть современных медицинских исследований в сфере акушерства и гинекологии [2, 7, 8, 10, 11, 13].
Однако возраст женщины далеко не всегда является абсолютным критерием, определяющим конечный результат применения ВРТ. Определяющую роль могут играть индивидуальные особенности организма женщины, связанные со временем менархе и менопаузы, расовые и национальные особенности, перенесенные заболевания (хронический аднексит, спаечная болезнь органов малого таза), ухудшающие кровоснабжение яичников, различные аутоиммунные поражения яичников, эндокринные нарушения, часто выражающиеся в синдроме поликистозных яичников, а также оперативные вмешательства – односторонняя аднексэктомия, резекции яичников и т. д. Все эти обстоятельства могут существенно влиять на количество оставшихся в яичниках фолликулов и далеко не всегда связаны с возрастом пациенток. Тем не менее возраст женщины является одним из важных факторов, влияющих на эффективность методов ВРТ, поскольку этот параметр непосредственно связан с качеством яйцеклеток, находящихся в яичниках. Данный показатель также не является абсолютным, поскольку у 45-летней женщины могут быть яйцеклетки хорошего качества и она может сохранять достаточно высокую фертильность, хотя такого рода ситуация чаще все же нестандартная, чем обычная. По данным Broekmans F. и соавт. [14], эффективность программ ЭКО у пациенток старше 40 лет составляет 10–13 %. К 44 годам эффективность лечения бесплодия еще больше снижается (до 3 % на цикл) [17].
С другой стороны, встречаются женщины, у которых и в 25 лет отмечается наличие “некачественных” яйцеклеток, вследствие чего они могут даже нуждаться в донации ооцитов.
Планируемая эффективность программ ВРТ напрямую связана с состоянием овариального резерва, возрастом пациентки, длительностью бесплодия и многими иными факторами. Для оценки состояния яичников используется термин “овариальный резерв”, характеризующийся количеством антральных фолликулов в обоих яичниках, содержанием фолликулостимулирующего гормона (ФСГ) на 2–3-й день менструального цикла, а также уровнем антимюллерового гормона (АМГ).
На основании оценки вышеперечисленных показателей можно сделать заключение о состоянии овариального резерва женщины.
Так, низкий овариальный резерв предполагается, если:
- возраст пациентки > 35 лет;
- уровень ФСГ на 2–3-й день менструального цикла > 10 МЕ/л;
- число антральных фолликулов менее 10 мм в диаметре на 2–3-й день менструального цикла < 5 в каждом яичнике;
- объем яичника < 8 см3;
- низкое содержание антимюллерова гормона.
С учетом выраженных антигипоксических, антиоксидантных и метаболических эффектов Актовегина этот препарат широко используется в рамках подготовки пациенток со сниженным овариальным резервом в циклах до и во время стимуляции суперовуляции для оптимизации роста фолликулов и получения зрелых, годных к оплодотворению ооцитов. Актовегин может вводиться внутривенно капельно в цикле подготовки (5 мл на 200–400 мл физиологического раствора) и перорально в таблетках в циклах индуцированной суперовуляции.
Для преодоления бесплодия методами ВРТ большое значение имеет не только получение достаточного количества качественных ооцитов, но и создание оптимальных условий для имплантации перенесенных в полость матки эмбрионов. Так, у женщин, перенесших одностороннюю оварио- или аднексэктомию, наиболее выраженные патологические изменения происходят на уровне маточных артерий. Характерными патологическими особенностями гемодинамики в маточных артериях таких женщин являются асимметрия кровотока в исходном состоянии, асинхронность снижения показателей кривых скорости кровотока в динамике лечебного цикла при относительном сохранении интенсивности кровотока лишь на стороне сохраненного яичника. Такое нарушение маточной гемодинамики, по-видимому, объясняет достоверно низкую частоту наступления беременности в программах ВРТ с более высокой частотой самопроизвольных абортов в ранние сроки гестации [5].
В настоящее время большое внимание уделяется не только повышению качества ооцитов и эмбрионов, но и изучению роли факторов эндометрия, влияющих на имплантацию [2, 10, 11].
Частой проблемой у женщин, обращающихся за помощью в клиники ВРТ, является патология эндометрия [20, 21]. Еще одной причиной снижения восприимчивости эндометрия и имплантационных потерь может быть неадекватность кровотока в тканях матки. У некоторых женщин использование в программах ЭКО схем гормональной стимуляции закономерно приводит к активации свертывающей системы крови и как следствие – к нарушению микроциркуляторных процессов в эндометрии [21].
Применение Актовегина у данных категорий пациенток наряду с фибринолитическими и антиагрегантными препаратами нормализует микроциркуляцию в тканях матки и яичников, улучшая прогноз проводимого лечения.
Зачастую на фоне индукции суперовуляции отмечаются неадекватный рост и трансформация эндометрия за счет перенесенного хронического воспаления, травматизации слизистой оболочки эндометрия частыми внутриматочными вмешательствами, нарушения местного рецепторного аппарата. По данным некоторых исследователей, частота развития хронического эндометрита у пациенток с бесплодием и неудачными попытками ЭКО в анамнезе превышает 65 %. Этот контингент женщин требует тщательной подготовки и дополнительной медикаментозной терапии перед проведением программ ВРТ. Назначение Актовегина после курса антибактериальной терапии в составе комплексного лечения (гестагены, физио-, гирудотерапия, гипербарическая оксигенация и т. д.) дает хороший лечебный эффект. В частности, данные ультразвукового исследования в циклах индуцированной суперовуляции и при подготовке к переносу криоконсервированных эмбрионов позволяют отметить признаки адекватного роста эндометрия и его секреторной трансформации.
На основании вышеизложенного можно сделать выводы о целесообразности назначения препарата Актовегин в составе общепринятых медикаментозных схем определенным группам пациенток с бесплодием и необходимостью дальнейших исследований.
Многообразие лечебных эффектов препарата Актовегин обусловливает включение его в комплекс профилактических и лечебных мероприятий, используемых в рамках программ ВРТ, повышая вероятность сохранения и восстановления репродуктивного здоровья женщин.

Врачи для активизации обмена веществ, улучшения питания и стимуляции процесса восстановления тканей назначают пациентам актовегин. Препарат выпускается в форме таблеток и раствора для инъекций. Основное действующее вещество – депротеинизированный гемодериват. Его получают из крови телят.
При применении препарата повышается поглощение и усвоение кислорода тканями, улучшается транспорт и утилизация глюкозы, ускоряются энергетические процессы, снижается количество лактата, образующегося в условиях кислородного голодания.
Для чего назначают уколы взрослым
- Диабетической полиневропатии;
- Постинсультных когнитивных расстройств;
- Деменции;
- Нарушений периферического кровообращения.
В официальной аннотации указано, что актовегин применяют только с восемнадцати лет. Но проведенные рандомизированные исследования показали, что лекарственное средство обладает выраженным терапевтическим эффектом при лечении новорожденных и детей, у которых выявлены перинатальные поражения центральной нервной системы.
Акушеры-гинекологи применяют актовегин при беременности, если нарушается снабжение эмбриона кровью. При применении препарата улучшается транспорт кислорода и глюкозы, нормализуются обменные процессы в плаценте, организме беременной, нормализуется развитие плода. Актовегин назначают беременным при развитии плацентарной недостаточности, внутриутробной задержке развития.
Почему актовегин запрещён во многих странах
Основное действующее вещество актовегина получают из крови телят. Использование вытяжек из крупного рогатого скота запрещено с начала девяностых годов в США и европейских странах. По этой причине актовегин не входит в реестр лекарственных средств, которые разрешены к применению в этих странах.
Что лучше взрослому – актовегин или церебролизин
Исследователи считают, что для пациента не имеет значения, какой препарат ему назначают – церебролизин или актовегин. Разница в том, что первое лекарственное средство изготовлено из тканей мозга свиней, а второе – из крови телят. Учитывая, что актовегин выпускается в форме таблеток и раствора для инъекций, а церебролизин – только в виде раствора, взрослым удобнее принимать первый препарат.
Что лучше взрослым – актовегин или кортексин
Оба препарата выпускаются из природного сырья. Они улучшают обменные процессы в клетках организма и снабжение тканей кислородом, стабилизируют клеточные мембраны. Актовегин – препарат, который относится к метаболическим средствам.
Выпускается в виде раствора для инъекций, который вводят как внутривенно, так и внутримышечно, и в форме таблеток, мази. Препарат назначают не только взрослым, но и новорожденным, детям грудного возраста для лечения заболеваний центральной и периферической нервной системы, нарушений периферического кровообращения.
Кортексин стимулирует обменные процессы в клетках головного мозга, повышает умственную способность. Выпускается в виде раствора для инъекций. Его можно вводить только в мышцы. Препарат назначают при нарушении кровоснабжения головного мозга, последствиях черепно-мозговой травмы, инсульта, энцефалопатиях. Его не применяют для лечения пациентов, страдающих полинейропатией, ангиопатией. Врачи решают индивидуально, какой препарат лучше подходит пациенту.
Побочные действия актовегина
При применении препарата редко проявлялись аллергические реакции в виде лекарственной лихорадки и шока, чаще – покраснение и высыпания на коже (крапивница).
Противопоказания
Лекарственное средство беременным назначают в том случае, если польза от его применения превышает риск развития осложнений со стороны матери и плода.
Дозы и способ введения
Таблетки актовегина следует принимать перед едой, не разжевывая, запивая небольшим количеством очищенной негазированной воды. В остром периоде ишемического инсульта лекарственное средство вводят в вену капельно. После 20 инфузий пациенту дают принимать таблетки актовегина внутрь. Продолжительность курса терапии – полгода.
Пациенты, страдающие деменцией, принимают по две таблетки актовегина трижды в день в течение двадцати недель. При нарушении периферического кровообращения назначают по одной или две таблетки трижды в день. Длительность курса лечения варьирует от четырех до шести недель.
Пациентам, страдающим диабетической полинейропатией, вначале проводят двадцать внутривенных инфузий актовегина. Затем в течение пяти месяцев они принимают по две таблетки препарата трижды в день.
Актовегин и алкоголь
Совместимость актовегина и алкоголя не исследовалась, но врачи считают, что на время лечения препаратом следует отказаться от употребления спиртных напитков. Алкоголь угнетает обменные процессы, вызывает кислородное голодание тканей. То есть, его действие противоположно эффекту, который ожидают от применения актовегина.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.

Центральная нервная система подвергается постоянным испытаниям, поэтому требует внимания и поддержки. Острые и хронические стрессы, недосыпания, сосудистые патологии, интоксикации, шоковые состояния – все это ведет к нарушениям работы головного мозга. Чтобы вернуть ее в здоровое русло, врач дает пациенту рекомендации к приему определенных лекарственных препаратов. «Мексидол» — препарат для защиты мозга от действия свободных радикалов, насыщения крови кислородом и нормализации метаболизма в тканях.
Видео: когда применять Мексидол
«Мексидол»: показания к применению
Действующее вещество Мексидола – этилметилгидроксипиридина сукцинат. Лекарство также содержит вспомогательные вещества: магния стеарат, повидон К-30 и лактозу.
- инсульты
- черепно-мозговые травмы
- синдром вегетативной дистонии
- когнитивные нарушения из-за атеросклероза сосудов
- тревожные расстройства
- похмельный синдром
«Мексидол» могут назначить в качестве вспомогательного средства при острых гнойных поражениях внутренних органов – панкреатите, перитоните, нейроинфекциях и т.д. Его также рекомендуют при остром инфаркте миокарда в сочетании с ингибиторами АПФ, антиагрегантами, антикоагулянтами, нитратами и бета-адреноблокаторами. «Мексидол» демонстрирует хороший терапевтический эффект в лечении болезни Паркинсона.
Препарат выпускается в форме таблеток для перорального приема и раствора для внутривенных инфузий или внутримышечных инъекций. Кратность приема и дозировка рассчитывается индивидуально, в зависимости от показаний. Длительность курса также определяет лечащий врач.
Для чего назначают «Мексидол»?
- антигипоксическое, ноотропное, антиоксидантное действие
- улучшает устойчивость организма к стрессу
- улучшает кровоснабжение тканей мозга и сердца
- уменьшает уровень холестерина и ЛПНП
Препарат чаще принимают перорально, проглатывая и запивая большим количеством воды. Употребление пищи не оказывает влияния на усвоение и эффективность лекарства, поэтому пить его можно в любое время. Обычная суточная доза варьируется между 200 и 600 мг, максимальная дневная дозировка составляет 800 мг.
«Мексидол» также можно вводить внутримышечно, предварительно растворив в 0,9% хлористого натрия. Дозировки обычно не превышают 500-600 мг в сутки, хотя в шоковых и других тяжелых состояниях могут достигать 1200 мг. В стационарных условиях «Мексидол» вводят капельно или комбинированно.
Продолжительность лечения «Мексидолом» составляет от 5 дней до 2-3 недель. Препарат отменяется постепенно после достижения стабильного терапевтического результата.
С чем колют «Мексидол» в комплексе внутримышечно?
«Мексидол» хорошо взаимодействует с другими препаратами и способен усиливать эффект следующих категорий лекарств:
- агонисты дофамина;
- бензодиазепины;
- антидепрессанты;
- седативные препараты;
- противоэпилептические и противосудорожные лекарства;
- нейролептики;
- снотворные средства.
Можно ли принимать «Мексидол» при беременности и грудном вскармливании?
На сегодняшний день влияние «Мексидола» на ребенка и развитие беременности не выяснено до конца. По этой причине применение при беременности и грудном вскармливании противопоказано.
Что эффективнее – «Цитофлавин» или «Мексидол»?
«Цитофлавин» считают аналогом «Мексидола», хотя его основой служит другое действующее вещество – янтарная кислота. Он также содержит комплекс витаминов: рибофлавин, инозин и никотинамид. «Мексидол» является монокомпонентным препаратом. Считается, что за счет комбинированного состава «Цитофлавин» более эффективен и действует лучше. Но окончательный выбор следует предоставить врачу, который знаком с клиническим случаем и изучил анамнез.
Может ли от «Мексидола» болеть голова: побочные эффекты
- понижение или повышение артериального давления;
- тревожность;
- повышенная эмоциональная возбудимость;
- головная боль;
- сонливость;
- нарушения сна (бессонница);
- гипергидроз ладоней и стоп;
- расстройства координации движений;
- тошнота и рвота;
- ощущение пересыхания в ротовой полости и горле;
- аллергические реакции (преимущественно с кожными проявлениями).
- тяжелые нарушения функций печени и почек;
- острая почечная и печеночная недостаточность;
- индивидуальная непереносимость основного действующего вещества и вспомогательных компонентов.
Поскольку «Мексидол» способен провоцировать сонливость, его прием не рекомендовано сочетать с вождением автомобиля и занятиями другой потенциально опасной деятельностью, требующей осторожности и предельной концентрации.
«Мексидол» и алкоголь: совместимость
«Мексидол» часто назначают больным в состояниях алкогольной интоксикации и абстинентного синдрома. Лекарство активно применяют при стационарном выведении из запоя. Препарат снижает токсичность этилового спирта и продуктов его распада, а также ускоряет выведение алкоголя из организма.
В то же время, «Мексидол» не способен защищать клетки головного мозга и печени от алкогольного повреждения. По этой причине его бессмысленно принимать совместно с алкоголем в надежде на нейтрализацию пагубного действия спирта.
«Мексидол» – один из классических антиоксидантов, широко применяемых в современной медицине. Он способен поддержать организм и защитить клетки центральной нервной системы в разнообразных опасных состояниях, включая травмы и острые нарушения мозгового кровообращения. Препарат почти всегда назначают в составе комплексного лечения. «Мексидол» отпускают по рецепту, поэтому его применение требует обязательной консультации и назначения врача. Обратитесь за помощью к компетентному специалисту.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.

Благоприятно протекающая беременность, роды в срок, рождение здорового малыша — на такое развитие событий должна настраивать себя будущая мама. Позитивный настрой очень важен. Стресс и жизнь в условиях пандемии Covid-19 может негативно отразиться на здоровье мамы и её будущего ребёнка.
В этой статье мы поговорим о Курантиле — препарате, который часто назначают во время беременности. Главная ценность курантила во время беременности — сохраняет маточно-плацентарное кровообращение и, тем самым, способствует рождению здорового малыша.
Состав Курантила
Действующее вещество Курантила — дипиридамол. Он разжижает кровь и расширяет сосуды. Благодаря этим эффектам снижается артериальное давление, угроза жизни беременной и плода.
Курантил при беременности для чего назначают?
Для начала, рассмотрим основные патологические состояния во время беременности, требующие назначения Курантила:
- Нарушение плацентарного кровообращения. Одна из наиболее распространенных причин назначения дипиридамола. Нарушение плацентарного кровообращения может приводить к недостаточному поступлению кислорода к плоду, что в дальнейшем отразится на его росте и развитии.
- Появление признаков нарушения питания плаценты.
- Гестозы.
- Спазм мелких сосудов, судороги.
- Тромбообразование..
- Заболевания вен нижних конечностей (варикозная болезнь, тромбофлебит).
- Заболевания сердца и почек.
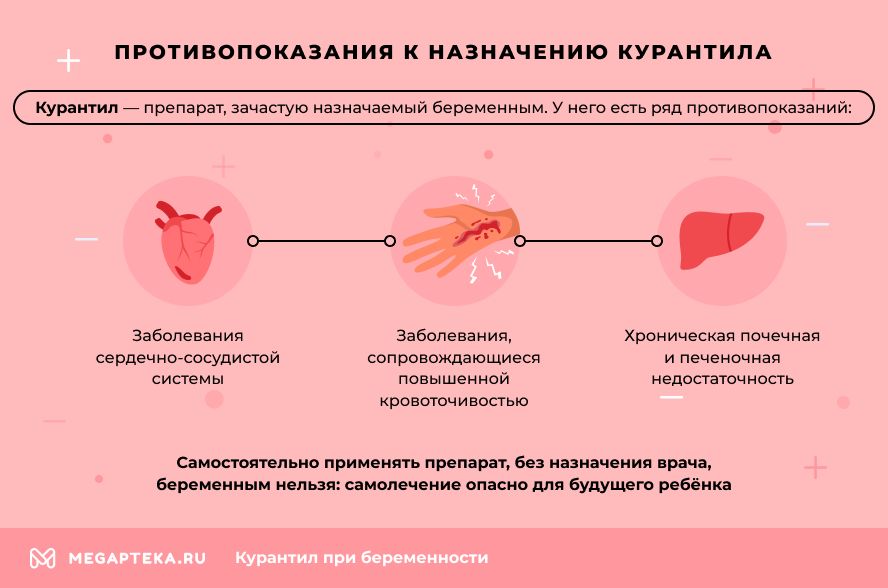
- Заболевания сердечно-сосудистой системы (острый инфаркт миокарда, выраженное атеросклеротическое сужение венечных артерий, гипотензия, тяжелая гипертензия, декомпенсированная сердечная недостаточность, тяжелые нарушения ритма и многие другие).
- Хронические почечная и печеночная недостаточность.
- Заболевания, сопровождающиеся повышенной кровоточивостью.
- Как и при использовании любого лекарственного средства, во время приема дипиридамола возможно развитие различных нежелательных реакций.
Побочные действия Курантила при беременности
- Ощущение прилива к лицу, покраснение лица.
- Учащенные сердцебиения, или, наоборот, брадикардия.
- Диспепсические явления. Именно поэтому необходимо с осторожностью принимать лицам, имеющим хронические заболевания желудочно-кишечного тракта, такие как хронический гастродуоденит, язвенная болезнь.
- Повышенная кровоточивость.
- Шум и боль в голове.
- Появление аллергических высыпаний.
Курантил при беременности: дозировка
Курантил выпускается в виде таблеток с различной дозировкой: 25, 75 мг. Врач может назначить препарат как во втором, так и в третьем триместре беременности. Основное показание к его назначению — профилактика плацентарной недостаточности. Предотвращая это патологическое состояния, Курантил помогает плоду получать достаточное количество кислорода и питательных веществ, избежать задержки внутриутробного развития.
Кофе, чай и препараты кофеина ослабляют эффект препарата. Одновременный прием с ацетилсалициловой кислотой (аспирином) усиливает кроверазжижающий эффект, и может вызвать кровотечение.
Самостоятельно применять препарат, без назначения врача, беременным нельзя: самолечение опасно для будущего ребёнка.
Читайте также:

