Может ли от герпеса быть рассеянный склероз
Обновлено: 24.04.2024
Присутствие в клетках человека определённой разновидности вируса герпеса связано с повышенной вероятностью рассеянного склероза.
Рассеянный склероз – аутоиммунное заболевание, при котором иммунитет атакует липидную оболочку нервных волокон в головном и спинном мозге, что, естественно, сильно вредит работе нервной системы. У рассеянного склероза много разных причин, и одной из них считается разновидность вируса герпеса – HHV6.
Олигодендроциты – клетки, формирующие миелиновую оболочку нервных волокон; на фото эта оболочка окрашена красным, а ядра олигодендроцитов – синим. (Фото: GerryShaw / Wikipedia)
Об этом начали говорить ещё в начале 90-х голов прошлого века, но результаты исследований долгое время оставались противоречивыми; к тому же у самого вируса есть две разновидности, HHV6A и HHV6B. Возможно, данные о рассеянном склерозе и вирусе герпеса можно было бы сделать менее противоречивыми, если бы мы могли отличать одну разновидность от другой. Но HHV6A и HHV6B похожи друг на друга, и долгое время не было метода, с помощью которого можно было бы точно сказать, какой именно вирус есть у конкретного человека – один, другой или оба.
Однако сейчас такой метод появился, и сотрудники Каролинского института использовали его, чтобы проверить связь между вирусом герпеса и рассеянным склерозом. Попав в организм, вирус герпеса может ненадолго вызвать лихорадку с сыпью (которые обычно случаются у детей), после чего надолго засыпает в наших клетках. Однако антитела, которые иммунитет выработал против вируса, ещё очень долго циркулируют в крови, так что их можно обнаружить даже у взрослого человека.
Метод различения HHV6A и HHV6B как раз и состоял в том, чтобы отличить антитела против HHV6A от антител против HHV6B. В исследовании участвовали более 8700 человек с рассеянным склерозом и более 7200, и оказалось, что рассеянному склерозу чаще сопутствует HHV6A, нежели HHV6B. У здоровых людей всё было наоборот – у них HHV6B встречался чаще, чем HHV6A. Среди вирусов, которые связаны с рассеянным склерозом, обычно называют ещё и вирус Эпштейна–Барр (тоже из группы герпесвирусов). Как говорится в Frontiers in Immunology, по-видимому, вирус Эпштейна–Барр повышает вероятность болезни, если в организме уже есть HHV6A.
Почему именно HHV6A вообще провоцирует рассеянный склероз, пока ещё не вполне понятно, но можно предположить, что всё дело в разном поведении HHV6A и HHV6B. Оба внедряются в нервные клетки, но HHV6A входит ещё и в олигодендроциты – вспомогательные клетки нервной системы, которые формируют ту самую липидную (миелиновую) оболочку нервных волокон.
Когда HHV6A по какой-то причине просыпается и начинает размножаться и формировать новые вирусные частицы, он прихватывает для этого какие-то собственные белки клетки-хозяина, то есть олигодендроцита. Иммунная система, поймав вирусную частицу, вместе с чисто вирусными белками увидит и белок олигодендроцита, который воспримет как ещё один признак патогена. И теперь иммунные клетки начнут бить не только по вирусу, но и по клеткам, формирующим миелиновую оболочку.
Отсюда следует, что сначала должен проснуться вирус, а потом уже начнёт развиваться рассеянный склероз. Авторы работы полагают, что так оно и есть: у тех молодых людей с рассеянным склерозом, у которых болезнь ещё только начиналась, был наиболее высокий уровень антител к вирусу герпеса HHV6A – то есть вирус у них уже вовсю проснулся, а болезнь пока ещё малозаметна.
Тем не менее, хотя вирус герпеса и рассеянный склероз явно связаны друг с другом, исследователи пока с осторожностью говорят о том, какая именно причинно-следственная связь здесь имеет место. Но если вирус действительно провоцирует рассеянный склероз, надо подумать о том, какие лекарственные средства могли бы как можно полнее избавить от него нервную систему.
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
КГБУЗ "Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями"
Герпетическая инфекция и атипичный рассеянный склероз
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2015;115(8‑2): 73‑74
Попова Е.В., Бойко А.Н. Герпетическая инфекция и атипичный рассеянный склероз. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2015;115(8‑2):73‑74.
Popova EV, Boĭko AN. Gerpeticheskaja infektsija i atipichnyj rassejannyj skleroz. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2015;115(8‑2):73‑74. (In Russ.).
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
КГБУЗ "Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями"
Рассеянный склероз (РС) является социально значимым заболеванием в связи с тем, что часто приводит к инвалидизации лиц молодого, трудоспособного возраста. Для данного заболевания характерны как разнообразные дебюты, так и разные типы течения. В результате научно-технического прогресса появился целый ряд препаратов, нацеленных на стабилизацию ремиттирующего РС (РРС), разрабатываются препараты для лечения вторично-прогрессирующего течения заболевания. В общей популяции больных РС выделяются и атипичные формы, к которым также можно отнести и первично-прогрессирующий РС (ППРС). Проблемы, возникающие в ходе терапии данной категории больных, связаны, прежде всего, с разными механизмами развития ППРС и РРС. К настоящему времени достоверно известно, что одними из основных триггеров развития РС являются вирусные инфекции, ведущую позицию среди которых занимает герпетическая группа вирусов: вирус простого герпеса 1 (ВПГ1), вирус простого герпеса 2 (ВПГ2), цитомегаловирус (ЦМВ), вирус Эпштейна—Барр (ЭБВ). С целью изучения иммунологического ответа на вирусы герпетической группы нами были обследованы 2 кардинально отличающихся по выраженности аутоиммунных воспалительных реакций группы пациентов: 27 больных с псевдотуморозным дебютом РС и 15 больных с ППРС. При проведении анализа полученных данных двух гомогенных по демографическим показателям групп были выявлены достоверно значимые различия (р<0,0001) в титрах IgG: ВПГ1 — 24,13 и 31,93 Ед/мл, ВПГ2 — 24,6 и 32,59 Ед/мл, ЦМВ — 72,6 и 218,9 Ед/мл, ЭБВ — 88,2 и 398,5 Ед/мл соответственно. В ходе факторного анализа было выявлено, что выраженность иммунного ответа ко всем этим герпетическим инфекциям занимает одну из ведущих причин, приводящих к разным дебютам Р.С. Известно, что вирусам герпетической группы характерна высокая мутагенность. Возможно, именно комбинация индивидуальных особенностей иммунной системы и мутагенности вирусов герпетической группы может лежать в основе разной выраженности аутоиммунной агрессии при РС, что и определяет тип дебюта и течение в последующем.
Работа поддержана грантом РНФ 14−14−00605.
- (бесплатный номер
по вопросам подписки)
пн-пт с 10 до 18
- Издательство «Медиа Сфера»
а/я 54, Москва, Россия 127238
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
КГБУЗ "Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями"
ФГБНУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко», Москва
Кафедра неврологии и нейрохирургии Российского национального исследовательского медицинского университета
Вирус Эпштейна-Барр в патогенезе рассеянного склероза (обзор)
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(2‑2): 29‑34
Попова Е.В., Бойко А.Н., Хачанова Н.В., Шаранова С.Н. Вирус Эпштейна-Барр в патогенезе рассеянного склероза (обзор). Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(2‑2):29‑34.
Popova EV, Boĭko AN, Khachanova NV, Sharanova SN. Epstein-Barr virus in the pathogenesis of multiple sclerosis (a review). Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(2‑2):29‑34. ().
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
Рассеянный склероз (РС) в настоящее время рассматривается как заболевание, в основе которого лежит генетическая предрасположенность, а триггерным механизмом развития являются различные экзогенные факторы. В данной работе в качестве пускового механизма рассматривается вирусная инфекция, а именно вирус Эпштейна-Барр. В обзоре приведены данные о возможных путях влияния вируса Эпштейна-Барр на развитие РС.
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
КГБУЗ "Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями"
ФГБНУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко», Москва
Кафедра неврологии и нейрохирургии Российского национального исследовательского медицинского университета
Рассеянный склероз (PC) - это тяжелое хроническое аутоиммунное заболевание центральной нервной системы (ЦНС), характеризующееся разрушением миелиновой оболочки, хроническим воспалением с изменениями аксонов и олигодендроцитов и прогрессирующим неврологическим дефицитом. Речь идет о том, что в основе данного заболевания прежде всего лежат процессы демиелинизации и разной степени выраженности нейродегенерации [1, 2]. PC считается мультифакториальным заболеванием. Важную роль в его этиологии играет взаимодействие внешних факторов и особенностей структуры большого количества генов, принимающих участие в регуляции иммунных процессов в организме. За последнее десятилетие представления об этиологии и патогенезе PC претерпели значительные изменения. К настоящему времени ни у кого не вызывает сомнения, что в этиологии PC существенную роль играют внешние факторы. Среди наиболее вероятных, участвующих в запуске иммунопатологического процесса, традиционно перечисляются различные инфекции и интоксикации. Наиболее активно обсуждается персистирующая инфекция в ЦНС или в организме в целом, что может являться мощным пусковым механизмом иммунопатологического ответа как напрямую, так и через активацию каскада аутоиммунных процессов [3].
Несмотря на пристальное внимание к данному вопросу, недостаточно изученным остается вклад в развитие РС одного специфического вируса или совокупности вирусных агентов [4]. В результате ряда ранее проведенных исследований 7, одним из потенциальных кандидатов в качестве персистирующей инфекции, которому на протяжении последних лет уделяется повышенное внимание, является вирус Эпштейна-Барр (ЭБВ). В течение последних двух десятилетий серо-эпидемиологические исследования 12 убедительно продемонстрировали практически 100% частоту выявления антител к ЭБВ у взрослых пациентов с PC по сравнению с контролем. Интересно, что подобные высокие серо-положительные показатели не наблюдаются в отношении других изучаемых вирусов [11, 13, 14]. Несмотря на то что появляется все больше данных, указывающих на одну из ведущих ролей ЭБВ в патогенезе PC, остается недостаточно ясным, является ли ЭБВ основным пусковым механизмом или действует в сочетании с другими факторами, активирующими иммунопатологические процессы, лежащие в основе PC [8, 15].
Вирусология и биология ЭБВ-инфекции
ЭБВ, открытый в 1964 г. М. Эпштейном и И. Барр, относится к γ-герпес-вирусам. ЭБВ имеет в своем составе 3 антигена: капсидный (VCA), ранний (ЕА) и ядерный (EBNA). Своеобразие патологического процесса при ЭБВ-инфекции определяется способностью этого вируса к пожизненной персистенции в организме человека, индукции вторичного иммунодефицитного состояния, аутоиммунных реакций, злокачественных опухолей и, в отличие от других вирусов герпеса, не вызывать гибель В-клеток, а, наоборот, активировать их пролиферацию и трансформацию. Известно, что первично входными воротами ЭБВ-инфекции является носоглоточная лимфоидная ткань, где и происходит инфицирование В-клеток [16]. Контакт с инфекционным агентом обычно случается в детском возрасте, в результате чего происходит трансформация В-клеток в В-лимфобласты с ограниченным количеством необходимого вирусного генетического продукта (ядерный антиген-1б - EBNA-16, латентный мембранный белок 1, 2а и 2b - LMP1, 2a, 2b, некодируемый малый РНК - EBER и несколько микро-РНК) 18. Инфицирование ЭБВ имеет достаточно широкое распространение у людей, но довольно часто оно приобретает латентную форму, при которой имеет место формирование пула специфичных В-клеток памяти [21, 22]. Этот тип ЭБВ-инфицирования (латентная инфекция) также был получен in vitro в ростке лимфобластов и обычно не вызывает продуцирования вируса [22]. Данное ЭБВ-инфицирование В-лимфобластов стимулирует здоровый Т-клеточный ответ, затрагивающий около 60% всех Т-лимфоцитов, большинство из которых уничтожается впоследствии [23, 24]. Цитокины, продуцируемые в ходе данного процесса, вызывают развитие клинического синдрома инфекционного мононуклеоза. Впоследствии формируется пожизненно персистирующий клон В-клеток памяти к ЭБВ, и процесс сопровождается немым носительством большинства генов вируса, при котором экспрессируется только некодируемый малый РНК [25, 26]. В связи с выключением большинства ЭБВ-кодируемых антигенов, ЭБВ-специфические В-клетки памяти становятся невидимыми для иммунной системы и перманентно циркулируют в кровеносном русле в малом, но стабильном количестве для поддержания жизни клона клеток [27]. При пролиферации данные В-клетки памяти могут продуцировать EBNA-1, который играет решающую роль в поддержании вирусного эпитопа [28]. В-клетки памяти преимущественно локализуются в лимфатических узлах и могут экспрессировать латентные мембранные протеины и EBNA-1, подвергаться ограниченной активации и пролиферации в рамках латентного состояния [29, 30]. В настоящее время остается еще недостаточно изученным механизм проникновения ЭБВ в пул В-клеток памяти. Обсуждается 3 равноценных версии: вирус может инфицировать уже сформированные В-клетки памяти как первичная инфекция; может инфицировать наивные В-клетки, которые в дальнейшем дифференцируются в В-клетки памяти посредством естественных физиологических процессов; или ЭБВ при инфицировании наивных В-клеток может запускать механизмы формирования пула ЭБВ-специфичных В-клеток памяти [17, 31-34].
В норме ЭБВ-инфекция находится под строгим контролем ЭБВ-специфичных иммунных реакций, особенно под контролем CD8+ Т-лимфоцитов, которые элиминируют пролиферирующие и литически инфицированные В-клетки [24]. В развивающихся странах большинство детей инфицируются в первые 3 года жизни, и антитела к ЭБВ обнаруживаются у 100% детей уже в первую декаду жизни [35]. Подобная ранняя инфекция практически всегда протекает бессимптомно. В противоположность этому в развитых странах около половины детей к концу первой декады жизни остаются серонегативными к ЭБВ, их инфицирование происходит только в подростковом или юношеском возрасте [35]. Примерно в 50% случаев отсроченная первичная инфекция протекает в форме инфекционного мононуклеоза. Незначительное физиологическое воздействие, включающее выработку стрессовых гормонов, может быть триггером для реактивации ЭБВ из латентного состояния, что приводит к увеличению экспрессии вирусных генов и запуску иммунопатологических реакций [36] при генетической предрасположенности, в основе чего лежит несостоятельность контроля Т-клетками пула В-клеток памяти.
Нарушение иммунного ответа к ЭБВ и риск РС
Известно, что повышенный риск развития PC ассоциируется с перенесенным инфекционным мононуклеозом в анамнезе 38 и более высоким уровнем сывороточных анти-ЭБВ-антител [5, 40-43]. К примеру, в недавно проведенном метаанализе исследований по методу случай-контроль и когортных исследований (всего 18 работ), перенесенный инфекционный мононуклеоз ассоциировался с двукратным увеличением риска PC (относительный риск 2,17, 95% ДИ 1,97-2,39) [44]. Кроме того, повышение титров анти-ЭБВ-антител, в особенности антител IgG к ядерному антигенному комплексу ЭБВ (EBNA) и EBNA-1, в течение нескольких лет предшествует появлению первых симптомов PC [41, 42, 45]. Эти антитела у пациентов с мононуклеозом появляются только в период выздоровления, а затем сохраняются на стабильном уровне в течение многих лет, что является маркером перенесенной инфекции. Среди тех людей, у которых разовьется PC, по всей вероятности возникнет повторное (т.е. несвязанное с первичной ЭБВ-инфекцией) повышение титра анти-EBNA-l-антител в возрасте 17-29 лет [42]. Интересно, что в одном недавно проведенном анализе уровня ЭБВ-антител с использованием двух независимых методов измерения (ELISA и иммунофлюоресценция) было показано, что относительный риск развития PC при серонегативном статусе равен нулю (95% ДИ 0-0,43) [46]. В другом исследовании ЭБВ-серонегативных участников по первому тесту крови была продемонстрирована 100% сероконверсия всех случаев еще до развития PC по сравнению с 35,7% в группе контроля в течение одинакового периода времени (p<0,0001) [47].
В работе K. Simon и соавт. [48] было показано, что высокие титры анти-EBNA у здоровых людей достаточно сильно коррелируют с высоким риском развития PC в будущем. Также отмечено, что повышенные титры анти-EBNA-1-антител коррелируют с радиологической активностью заболевания [49], но серологические признаки реактивации ЭБВ-инфекции (антитела к раннему антигену) не ассоциируются с клинической активностью у больных PC [50]. Кроме того, была продемонстрирована связь между повышенными титрами анти-EBNA-антител и риском PC как у HLA-DRB1*15-негативных, так и HLA-DRB1*15-позитивных лиц. По всей вероятности, аллель DR15 и титры анти-EBNA-антител выступают независимыми факторами риска с мультипликативными эффектами [51].
Также накапливаются данные, указывающие, что для пациентов с PC характерен более высокий ЭБВ-специфичный клеточный иммунный ответ на уровне как CD4 + , так и CD8 + Т-клеток 53.
В настоящее время известно, что ЭБВ запускает ряд механизмов, нарушающих иммунную систему, включающих молекулярную мимикрию, белки теплового шока и суперантигены, провоспалительные цитокины и формирование клона В-клеток памяти. В отношении молекулярной мимикрии более ранние исследования показали, что основной белок миелина (ОБМ) и специфический клон Т-клеток, полученные от пациента с PC, перекрестно реагируют с ДНК-полимеразным пептидом вируса Эпштейна-Барр [8, 57, 58]. ЭБВ-специфичные Т-клетки, перекрестно реагирующие с ОБМ, также были обнаружены в ЦСЖ больных PC [56, 59].
В 2011 г. группой российских исследователей из ЦСЖ больных PC было выделено 13 клонов клеток, специфичных к ОБМ, которые продуцировали антитела как к фрагментам 65-92 и 130-156 ОБМ, так и к мембранному белку ЭБВ LMP1 [60]. Альтернативно или в дополнение к этому хроническая персистенция ЭБВ-инфицированных В-клеток в ЦНС, возможно ассоциируемая с литической реактивацией, может непосредственно инициировать каскад иммунопатологических реакций, вызывающих повреждение ткани ЦНС у пациента. Подобное предположение подтверждается аккумуляцией ЭБВ-специфичных CD8 + Т-клеток в ЦСЖ больных PC [53].
Кроме того, известно, что в ЦСЖ больных PC присутствует большое количество В-клеток памяти 62, а наличие олигоклональных IgG является характерным признаком PC. Так, при изучении специфичности олигоклональных антител IgG у пациентов с PC в отношении ЭБВ были выделены 2 наиболее частых PC-специфичных и высокоаффинных эпитопа вируса - EBNA-1 и другой, менее характерный структурный ЭБВ-протеин BRRF2 [64], а также повышенная частота EBNA-1-специфичных антител IgG в ЦСЖ [65]. На основании полученных данных высказывается предположение не только о системном повышении, но и существенной продукции ЭБВ-специфичных антител в ЦСЖ больных PC, что, возможно, влияет на патологические процессы в мозговой ткани [66].
Потенциальные механизмы участия ЭБВ-инфекции в патогенезе РС
Первые доказательства роли ЭБВ-инфекции в развитии PC появились в 1979 г., когда K. Fraser и соавт. [67] отметили факт повышенной тенденции к спонтанной in vitro ЭБВ-индуцированной трансформации периферических В-лимфоцитов крови больных PC с клинически активным заболеванием. Первоначально предпочтение отдавалось гипотезе молекулярной мимикрии между ЭБВ и антигенами ЦНС, ведущей к иммунологической перекрестной реактивности с последующим аутоиммунным повреждением ткани ЦНС [57]. Согласно этой гипотезе, присутствие ЭБВ-инфицированных В-лимфоцитов в ЦНС не обязательно, поскольку активация иммунологической перекрестной реактивности происходит в периферических лимфоидных органах.
В 2003 г. была предложена новая гипотеза, согласно которой РС вызывается аккумуляцией ЭБВ-инфицированных аутореактивных В-лимфоцитов в ЦНС - благодаря им в ЦСЖ присутствуют олигоклональные группы IgG, происходит синтез патогенных аутоантител и формирование ко-стимулирующих сигналов для выживания аутореактивных Т-клеток [68]. Кроме того, считалось, что предрасположенность к развитию хронического аутоиммунного заболевания после ЭБВ-инфекции зависит от генетически детерминированного количественного дефицита цитотоксичных CD8 + Т-клеток, которые в норме осуществляют строгий контроль за ЭБВ-инфекцией. Исходом подобного нарушения является постоянная циркуляция В-клеток иммунологической памяти, а также возможное их проникновение и активация в ЦНС, ведущие к запуску хронического воспалительного процесса с развитием РС [15, 68, 69]. В подтверждение данной гипотезы были опубликованы результаты исследований с использованием иммуногистохимии с антителами, специфичными к ЭБВ-белкам, и реакций гибридизации in situ к ЭБВ-некодируемым малым РНК на образцах ткани, полученных посмертно от 22 пациентов с вторично-прогрессирующим PC. В работе была отмечена высокая частота встречаемости ЭБВ-специфических В-клеток памяти, инфильтрирующих очаги в белом веществе головного мозга, в отличие от других воспалительных заболеваний ЦНС, а ЭБВ был обнаружен в 95% образцов ткани, взятой из очагов демиелинизации [70].
В 2007 г. другой группой авторов было рассмотрено 4 возможных сценария, объясняющих нарушение гуморальных и клеточно-опосредованных иммунных реакций против ЭБВ при различных аутоиммунных заболеваниях, в том числе и при PC, и его потенциальное участие в патогенезе болезни: 1) ЭБВ-специфичные Т-клетки или антитела могут перекрестно реагировать с аутоантигенами, экспрессированными в ЦНС, и атаковать миелиновую оболочку аксонов. При этом усиленная реактивность ЭБВ-специфичных CD4 + Т-клеток является результатом повышенной реактивации вируса из аутоагрессивных В-клеток как компенсации ослабленных ЭБВ-специфичных реакций со стороны CD8 + Т-лимфоцитов; 2) ЭБВ помогает в поддержании аутореактивности В-клеток; 3) ЭБВ трансактивирует экпрессию элементов эндогенных ретровирусов человека (HERV), которые являются цитотоксичными для олигодендроцитов; 4) нарушенные иммунные реакции против ЭБВ как непатогенный эпифеномен. В подобном сценарии можно предположить, что нарушенные иммунологические реакции в отношении ЭБВ являются результатом действия других факторов, предопределяющих развитие аутоиммунного заболевания, и они могут непосредственно не участвовать в патогенезе PC. К примеру, повышенная стимуляция В-клеток аутоантигенами стимулирует усиленную репликацию вируса, вследствие чего увеличиваются нагрузка вирусными антигенами и противирусные иммунные реакции. Альтернативно аутоиммунитет, развивающийся в результате дисрегуляции регуляторных Т-клеток, может также вести к усиленным ЭБВ-специфичным иммунным реакциям, и без которых ответственен за патогенез PC [66].
Относительно недавно на основании нескольких работ была высказана очередная гипотеза, согласно которой вирус-инфицированных клеток может быть совсем мало, однако эти клетки могут продуцировать достаточное количество провоспалительных цитокинов, что может вести к развитию болезни. Подобное предположение основано, во-первых, на данных, свидетельствующих о первичной ЭБВ-инфекции эндотелиальных клеток микрососудов мозга человека in vitro, во-вторых, на эффективности препаратов β-интерферона в предотвращении развития обострений PC посредством подавления репликации вируса и последующего выброса цитокинов [71].
Присутствие ЭБВ в ткани ЦНС у больных РС
К настоящему времени доказательства присутствия ЭБВ-инфицированных клеток в мозге больных PC остаются противоречивыми. Некоторыми группами авторов [1, 69, 70, 72-77] отмечено, что В-лимфоциты и плазматические клетки являются неотъемлемой частью воспалительных инфильтратов в белом веществе и оболочках головного мозга при РС, особенно у пациентов с прогрессирующим течением заболевания при достаточно тяжелом воспалительном и нейродегенеративном процессах [70, 74, 75, 78, 79]. Другими авторами 81 в последующих исследованиях с использованием аналогичных технологий лишь в единичных случаях были описаны подобные изменения и доказательства присутствия ЭБВ в мозговой ткани больных РС.
Для обоснования столь противоречивых результатов в июле 2010 г. в Вене состоялось 2-дневное заседание рабочей группы исследователей, изучающих роль ЭБВ в патогенезе PC. После разностороннего и углубленного изучения всех опубликованных результатов участники рабочей группы не смогли дать независимого подтверждения наличия ЭБВ-ассоциированной инфекции в ЦНС при PC. По мнению членов рабочей группы, для подтверждения присутствия вируса в мозговой ткани больных PC, по всей видимости, следует не только проводить исследования с использованием всех трех существующих технологий (гибридизация in situ, иммуногистохимия и ПЦР), но и отправлять исследуемые образцы в независимые лаборатории [84]. Также не стоит забывать, что при применении одинаковых технологий возможны методологические различия, ведущие к разной чувствительности используемых тестов. Кроме того, существует богатый спектр патологических признаков очагов PC в зависимости от типа и тяжести течения заболевания, равно как и от стадии бляшки [2, 85], влияющих на полученные результаты.
Несмотря на достаточно пристальное внимание к этиологии PC, в настоящее время остается недостаточно изученной связь между персистирующей ЭБВ-инфекцией и типом манифестации и течения РС. Дальнейшее более глубокое изучение тонких механизмов воздействия ЭБВ-инфекции на генетически предрасположенный к несостоятельности иммунного ответа организм с учетом имеющихся современных знаний о патогенезе PC поможет приблизиться к пониманию возможных механизмов различных типов манифестации и прогрессирования РС, что, в свою очередь, будет способствовать разработке адекватной профилактики возникновения и прогрессирования данного заболевания.

Рассеянный склероз — опасное заболевание нервных волокон в головном и спинном мозге. У такого склероза много разных причин, в том числе разновидность вируса герпеса.
Еще в 1990-х годах исследователи предположили, что очень распространенный тип вируса герпеса —тогда известный как человеческий герпесвирус 6 (HHV6) — мог быть каким-то образом вовлечен в развитие рассеянного склероза. Результаты, опубликованные в ноябре прошлого года, говорят о том, что предыдущие противоречивые исследования могут быть хотя бы частично объяснены тем фактом, что ученые не могли различить два вируса. О новых исследования в этой области сообщает The Scientist.
HHV6A и HHV6B — два из восьми герпесвирусов, которыми, как известно, заражаются люди. Больше известно о варианте HHV6B, которым большинство людей инфицируется в младенчестве. Болезнь вызывает краткую сыпь, известную как розеола. Оба вируса, как правило, бездействуют после первоначальной инфекции, иногда реактивируясь в более позднем возрасте. К счастью для исследователей, антитела против них задерживаются в крови в зрелом возрасте.
Сотрудники Каролинского института проанализировали связь вируса герпеса с рассеянным склерозом. В исследовании участвовали более 8700 пациентов с рассеянным склерозом. И оказалось, что ему чаще сопутствует HHV6A, нежели HHV6B. У здоровых людей всё было наоборот — у них HHV6B встречался чаще.
Почему именно HHV6A вообще провоцирует рассеянный склероз, пока ещё не вполне понятно. Тем не менее, хотя вирус герпеса и рассеянный склероз явно связаны друг с другом, ученые пока делают выводы осторожно. Надо подумать о том, какие лекарственные средства могли бы как можно лучше избавить от рассеянного склероза нервную систему человека.
Лечение рассеянного склероза существует, но все известные методы работают, подавляя иммунную систему, делая пациентов более уязвимыми для других инфекций.
Что такое рассеянный склероз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Новикова Юрия Олеговича, мануального терапевта со стажем в 41 год.
Над статьей доктора Новикова Юрия Олеговича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Рассеянный склероз (РС) является одним из частых хронических аутоиммунных заболеваний центральной нервной системы (ЦНС).
Распространенность РС высока и делится на зоны с высокой, умеренной и низкой встречаемости заболевания. Высокая распространённость отмечена в Северной Америке и Северо-Западной Европе.
В мире выявлено около 2 млн больных РС. В нашей стране в различных областях количество заболвших РС колеблется от 2 до 70 больных на 100 000 человек, причём значительно реже болезнь встречается в Средней Азии и Закавказье. В крупных промышленных районах и городах заболеваемость выше, чем в сельской местности, у лиц мужского и женского пола она одинакова.
- начало болезни в молодом возрасте, обычно между 20 и 35 годами (в отдельных случаях заболевают люди и более молодого, и более старшего возраста);
- многосимтомность;
- полиморфизм (многообразность) проявлений;
- прогрессирующее течение с весьма типичной наклонностью к ремиссиям и новым обострениям. [1][2]
Причина возникновения РС точно не установлена. Высказывалось мнение об инфекционной природе этого заболевания. Такое предположение основывается на случае острого развития заболевания с повышением температуры и свойственными инфекционным заболеваниям изменениям ликвора и крови, а также патоморфологических данных.
В настоящее время известно, что возбудителем РС может являться нейтропный фильтрующийся вирус, идентичный вирусу рассеянного энцефаломиелита. Исследователи из Гарвардской медицинской школы обнаружили, что риск рассеянного склероза увеличивается в 32 раза после заражения вирусом Эпштейна – Барр . Также учёные установили, что вероятность развития РАС не повышалась при инфицировании цитомегаловирусом и вирусом герпеса [17] .
В основе демиелинизации (избирательного поражения головного мозга) лежит аутоиммунный процесс. Пути передачи инфекции не выяснены. Заражения непосредственно от больного не происходит. Возможность контактного пути распространения болезни следует считать маловероятным. [3] [4]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рассеянного склероза
При всём многообразии и изменчивости расстройств, свойственных РС, можно выделить основную, наиболее частую, типичную его форму—цереброспинальную.
Обычно заболевание цереброспинальной формой РС начинается в молодом возрасте. Эта форма характеризуется:
- сочетанием пирамидных и мозжечковых расстройств;
- нередким поражением зрительных нервов;
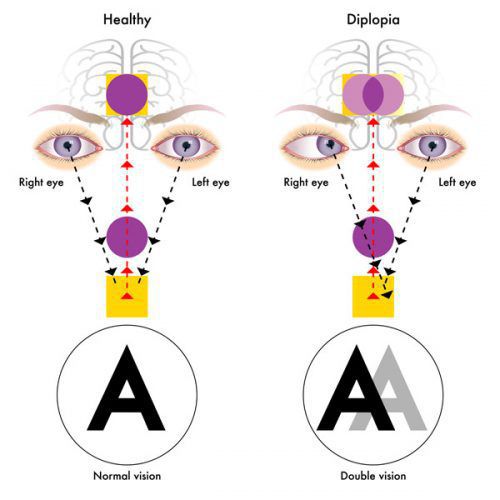
- иногда преходящей диплопией (раздвоение видимых объектов);
- ремиттирующим течением (повторные ремиссии).
Развитие пирамидных и мозжечковых расстройств обусловлено частым образованием очагов воспаления в боковых столбах спинного мозга, мозговом стволе и ножках мозжечка.
Наиболее ранними симптомами являются:
- утрата брюшных рефлексов;
- утомляемость и слабость ног;
- лёгкое интенционное дрожание в руках;
- нистагм (неконтролируемое ритмичное движение глаз).
Офтальмологические проявления
Нередко начальным изолированным расстройством является поражение зрения, развивающееся по типу так называемого ретробульбарного неврита (острое воспаление зрительного нерва). При этом возникает слепота или скотома (слепой участок в поле зрения) того или иного глаза.

Поскольку процесс локализуется не в соске зрительного нерва, а в его стволе (ретробульбарно), то на глазном дне в течение иногда довольно длительного срока изменений не обнаруживается.
При значительном поражении поперечника зрительного нерва утрачивается прямая реакция зрачка слепого глаза на свет при сохранённой реакции сужения его в случае освещения другого глаза (содружественная реакция зрачка).
Для ретробульбарного неврита при РС характерно выпадение центральных полей зрения (центральная скотома), так как бляшки развиваются обычно внутри ствола зрительного нерва. В отличие от этого при ретробульбарном неврите сифилитической этиологии или при воспалении придаточных полостей носа чаще наблюдается концентрическое сужение полей зрения, так как воспалительный процесс развивается с наружной поверхности зрительного нерва — с его оболочек.

Через известный срок при РС обнаруживаются изменения глазного дна — побледнение соска зрительного нерва (атрофия). Типичным для РС является преимущественное побледнение височных половин сосков зрительных нервов. Утрата зрения может быть полной или частичной, одно- или двусторонней. Через некоторое время обычно наступает улучшение, но процесс может и нарастать. Двусторонняя слепота отмечается редко.
Мозжечковые и пирамидные расстройства
Наиболее ранними мозжечковыми расстройствами является:
- интенционное дрожание в руках, обнаруживаемое при пальце-носовой пробе;
- расстройство почерка;
- нистагм глазных яблок при отведении в стороны.
Резко выраженный нистагм (иногда не только горизонтальный, но и вертикальный или ротаторный), зависящий от пораженпя мозжечка, расстройства речи (скандированная речь) и дрожание головы или туловища являются уже признаком далеко зашедшего процесса.
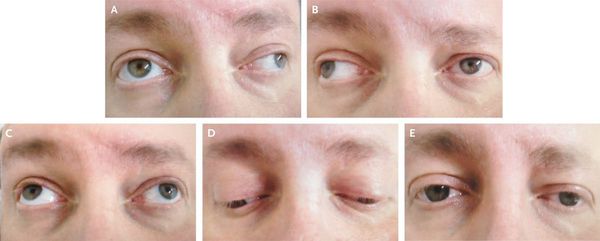
Развиваются и другие мозжечковые симптомы — адиадохокинез (невозможность быстрой смены противоположных движений — сгибания или вращения), шаткая походка и др.
Иногда, наряду с выраженными симптомами пирамидного поражения, отмечаются и симптомы поражения периферического двигательного неврона: утрата сухожильных рефлексов конечностей, атрофии мышц.
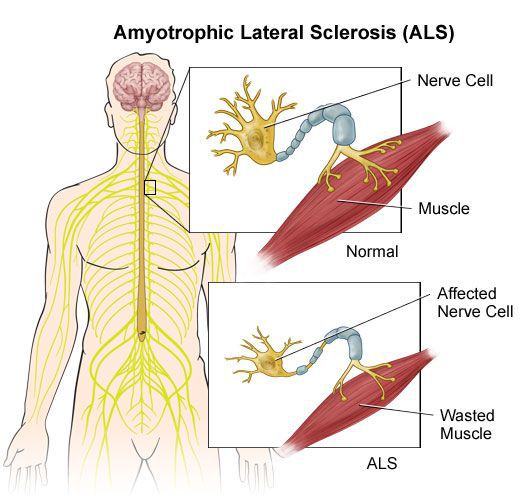
Нарушения чувствительности не столь выражены, как двигательные расстройства. Своеобразной парестезией (ощущение жжения, мурашек, покалывания) при РС является возникающее при резком сгибании головы к груди ощущение электрического тока, как бы пробегающего по позвоночнику вниз, с иррадиацией в ноги, иногда в руки. В некоторых случаях наблюдаются нарушения суставно-мышечного и вибрационного чувства в нижних конечностях. Значительно реже расстраивается поверхностная чувствительность.
Из черепномозговых нервов, кроме зрительных, чаще поражаются отводящий и глазодвигательный нервы. Паралич глазных мышц обычно имеет преходящий характер и выражается лишь диплопией, которая может быть начальным симптомом заболевания.
Нередки поражения тройничного, лицевого и подъязычного нервов. Развитие склеротических бляшек в надъядерных отделах кортико-нуклеарного пути может стать причиной возникновения псевдобульбарного синдрома, а в мозговом стволе — развития бульбарных симптомов (симптомы поражения черепных нервов).
Нарушения функций тазовых органов являются нередкими симптомами РС. Встречаются следующие нарушения:
- императивные (внезапные и неподавляемые) позывы, учащения, задержки мочи и стула;
- недержание, неполное опорожнение мочевого пузыря, приводящее к уросепсису — характерны для боле поздних стадий.
Нередки нарушения функции половой системы. Эти проблемы могут одновременно являться функциональными нарушениями тазовых органов, а также могут быть самостоятельными симптомами.
Психические нарушения редки. Деменция и выраженные формы психического расстройства свойственны лишь поздним периодам заболевания и обусловлены множественными и распространенными очагами в коре и подкорковых образованиях больших полушарий.
Патогенез рассеянного склероза
Для того, чтобы понять механизм развития РС, необходимо ознакомиться с патологической анатомией данного заболевания.
При микроскопическом исследовании обнаруживаются заметные и достаточно характерные изменения, выявляемые с наибольшим постоянством в спинном мозгу, мозговом стволе и полушариях головного мозга. Видны множественные бляшки различной величины (от точечных до весьма массивных, которые, к примеру, занимают весь поперечник спинного мозга), рассеянные преимущественно в белом веществе. Такая множественность и разбросанность очаговых изменений и определяет название болезни.
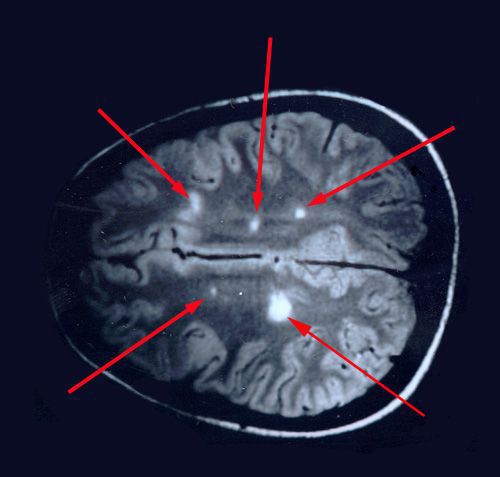
Отдельные бляшки имеют округлую форму, они нередко сливаются и создают изменения сложных очертаний. Цвет бляшек на разрезе розовато-серый (недавно образовавшиеся очаги) или серый, желтоватый (старые очаги).
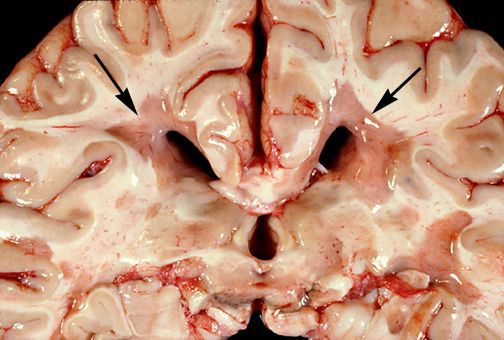
При разрезе бляшки определяется их большая плотность по сравлению с нормальной мозговой тканью. Эти уплотнения, склерозирование бляшек дало возможность охарактеризовать заболевание как склероз.
При микроскопии на первый план выступают изменения миелиновых волокон. В области очага, бляшки, в белом веществе наблюдаются в той или иной степени распад миелиновой оболочки, покрывающей нервные волокна центральных проводников, причём осевой цилиндр нередко остаётся неповреждённым.
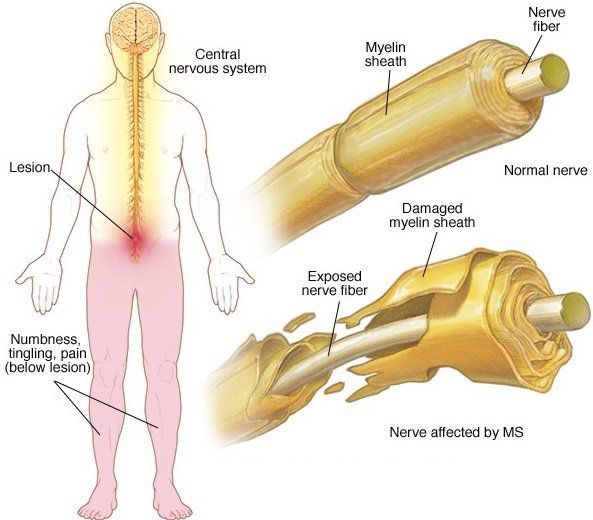
В остром периоде, при наличии отёка и инфильтрации, в очаге поражения нарушается проводимость по нервным волокнам. В дальнейшем, при условии гибели осевых цилиндров, возникают необратимые, стойкие выпадения.
После периода острого воспаления оказывается, что осевые цилиндры частично сохраняют свою целостность и проводимость, иногда даже наблюдается ремиелинизация нервных волокон. В результате наблюдается не только ремиссия, но даже и вполне удовлетворительное восстановление отдельных утраченных ранее функций, что очень характерно для РС.
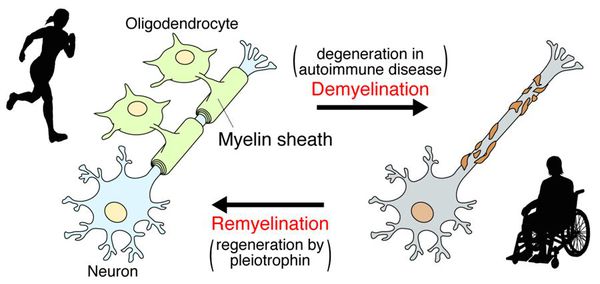
Образование новых воспалительных очагов определяет ухудшение и возникновение новых симптомов. [2] [5]
Классификация и стадии развития рассеянного склероза
Строгой и общепринятой классификации РС нет. Некоторые авторы предлагают подразделять РС по клиническому течению, другие по локализации процесса. [9]
По характеру течения выделяют:
- ремитирующую форму — характеризуется редкими обострениями, чередующимися с ремиссиями, иногда длящимися годами, причём поражённые участки мозга восстанавливаются как частично, так и полностью;
- первично прогрессирующую — незаметное начало и медленное, но необратимое нарастание симптоматики;
- вторично-прогрессирующую — сначала напоминает ремитирующую, но на поздних стадиях характерен переход в прогрессирующую форму;
- прогрессирующе-ремитирующую — редкая форма, когда заболевание, начинаясь с ремитирующего течения, переходит в первично-прогрессирующее.
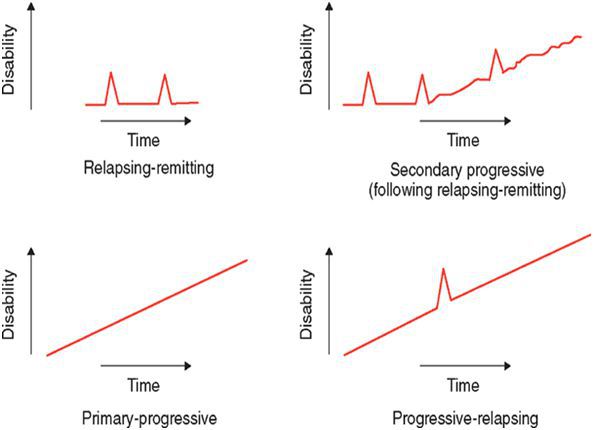
По локализации поражения мозга:
- церебральная — страдает пирамидная система;
- стволовая — наиболее тяжёлая форма РС, быстро приводящая больного к инвалидности;
- мозжечковая — церебеллярные нарушения, часто сочетается с поражением ствола мозга;
- оптическая — страдает зрительная система;
- спинальная — поражается спинной мозг, возникают тазовые расстройства и спастический нижний парапарез;
- цереброспинальная форма — наиболее распространённая, характеризуется большим количеством склеротических бляшек в головном и спинном мозге, клинически выявляются мозжечковые и церебральные нарушения, патология зрительной, вестибулярной и глазодвигательной систем.
По стадиям РС делят на:
- острую стадию, которая длиться первые две недели обострения;
- подострую, длящуюся два месяца от начала обострения и является переходной стадией к хроническому прогрессированию заболевания;
- стадию стабилизации, при которой в течение трёх месяцев не наблюдается обострений.
Осложнения рассеянного склероза
Серьёзными осложнениями, особенно при спинальных формах, являются пролежни и глубокие нарушения тазовых органов.
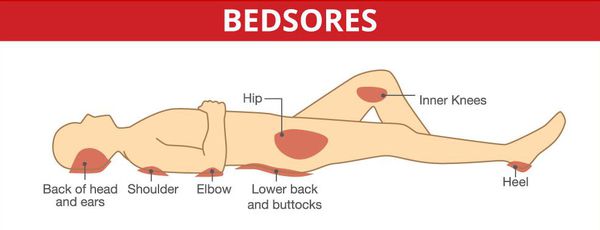
Неблагоприятно могут протекать также острые и подострые случаи с поражением жизненно важных отделов мозгового ствола.
Неврологический статус пациента напрямую зависит от его иммунитета. Зачастую появляется повышенная утомляемость, развивается мышечная слабость, головокружение. В стадии прогрессирования отмечается атаксия (нарушение координации и произвольных движений), значительное уменьшение физических и особенно двигательных возможностей конечностей с развитием спастики (двигательные нарушения в связи с повышенным тонусом мышц).
Весьма часто резко снижается острота зрения, теряется чёткость изображения, уменьшаются поля зрения, происходит искажение цветов, диплопия, развивается амблиопия и стабизм (косоглазие).
У пациентов зачастую возникает раздражительность, неустойчивость настроения, в некоторых случаях эйфория, неадекватное отношение к своему состоянию.
При РС нередки когнитивные нарушения — снижение памяти, концентрации внимания, нарушение пространственной ориентации.
Также при РС появляются тазовые нарушения — задержка мочеиспускания и длительные запоры, впоследствии больной теряет возможность контролировать процессы опорожнения кишечника и мочевого пузыря. В результате неполного опорожнения мочевого пузыря возникают урологические заболевания, вплоть до уросепсиса.
Вышеперечисленные осложнения требуют особого внимания, так как именно они могут стать причиной смертельного исхода для больного. [15] [16]
Диагностика рассеянного склероза
При вероятном РС, наряду с полным неврологическим осмотром, необходимо проводить исследование головного и спинного мозга при помощи МРТ. Этот способ исследования является наиболее информативным дополнительным методом диагностики. С его помощью можно обнаружить участки изменённой плотности в белом веществе головного мозга (очаги демиелинизации и глиоз). [10]
Исследование зрительных вызванных потенциалов, применяемое для определения степени сохранности некоторых проводящих путей, может также являться одним ранних диагностических критериев.
При изучении ликвора информативным считается метод изоэлектрического фокусирования спинномозговой жидкости, позволяющий выделить олигоклональные группы IgG.
Для диагностики РС широко используются критерии, предложенные Международной экспертной группой. [11]
Читайте также:

