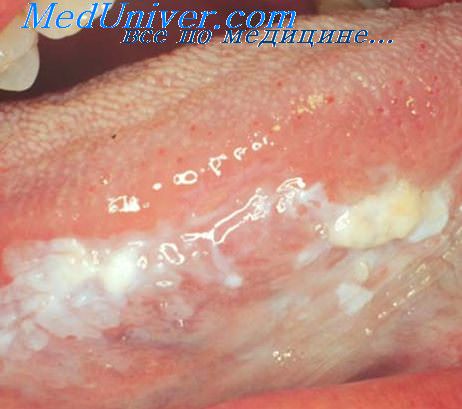
Митотическая активность эпителия это
Обновлено: 25.04.2024
Американский Объединенный комитет по онкологии добавил показатель частоты митозов в протокол клинической диагностики. Показатель митозов заменил другой индекс — уровень проникновения по Кларку для меланом, стадия T1.
Американские ученые (Dermatol Surg. 2011 Aug;37(8):1080-8) поставили задачу оценить необходимость биопсии сторожевых лимфоузлов на основании показателя митотической активности тонких (до 1 мм) меланом.
Что означает митотическая активность при меланоме?
Митоз — процесс деления (размножения клеток). Если в гистологическом препарате удаленной родинки (опухоли) определяются делящиеся клетки, находящиеся в процессе деления (митоза). Митотическая активность (митотический индекс) определяется под микроскопом, как процент делящихся клеток от 1000 клеток препарата (опухоли).
Наличие митозов демонстрирует рост и активность опухоли, а также дает определенный прогноз развития заболевания. Важно применить агрессивное лечение, в случаях, когда в гистологическом препарате определяются митозы. Вовремя проведенное правильное лечение спасает жизнь.
Одним из эффективных способов лечения и предотвращения метастазирования является биопсия сторожевого лимфоузла
Биопсия сторожевого лимфоузла
эффективное лечение и точный прогноз
В исследовании установлена необходимость выполнения биопсии сторожевого лимфоузла при митотическом индексе более 1, при толщине опухоли менее 1 мм. Также необходима биопсия сторожевого лимфоузла в случае изъязвления опухоли, при толщине опухоли менее 1 мм.
Митотический индекс оказался более четким прогностическим критерием, чем глубина проникновения по Кларку, в случае тонких меланом (до 1 мм). Самым точным методом, в этом случае, является биопсия сигнального лимфоузла.
При обнаружении микрометастазов в лимфоузле выполняется удалении регионарных лимфоузлов, что примерно на 20% повышает шанс на полное излечение.
Диагноз — меланома. Что делать?
Немедленно обращайтесь в клинику онкодерматологии Меланома Юнит
Вам будет составлен четкий план действий, в зависимости от предоставленных меддокументов и данных о заболевании
В данном случае промедление может привести к крайне неблагоприятным последствиям, даже в случае если Вам сказали только наблюдаться. На данный момент, в России биопсия сигнальных лимфоузлов при меланоме еще не выполняется
В большинстве случаев меланома поддается правильному лечению, на ранних стадиях практически гарантированно полное выздоровление.
Митотический режим опухолевых клеток. Митозы раковых клеток.
В морфологической характеристике опухолевых клеток большую роль играют исследования митотического режима. Исчерпывающие сведения о митотическом режиме в нормальных клетках можно найти в фундаментальных работах И. А. Алова, а о митотическом режиме в опухолевых клетках—в работах И. А. Алова и И. А. Казанцевой.
Накопленные факты позволили определить следующие основные направления возможного использования исследования митотического режима в опухолях: 1) ранняя диагностика рака; 2) дифференциальная диагностика доброкачественных и злокачественных опухолей сходного гистогенеза; 3) разработка методов прогнозирования малигнизации предопухолевых процессов, 4) дифференциальная диагностика опухолей разного гистогенеза и уточнение гистогенетнческой принадлежности новообразования (первичного н метастатического), 5) оценка степени терапевтического повреждения опухоли.
Суммируя материалы, полученные И. А. Казанцевой, можно следующим образом охарактеризовать особенности митотического режима при гиперпластических и диспластических процессах и в опухолевых клетках.
Для многих нормальных эпителиальных тканей характерны умеренная митотическая активность, которая, однако, значительно выше в быстро обновляющихся тканях; примерно одинаковое количество клеток в стадии профазы и метафазы с преобладанием иногда первой; невысокая частота патологических митозов.
При фоновых процессах (умеренная дисплазня эпителия гортани и шейки матки, эпидермизация псевдоэрозий шейки матки, простая железисто-кистозная гиперплазия эндометрия и др. ) отмечают некоторое увеличение митотической активности, небольшое преобладание клеток в стадии метафазы, повышение количества патологических митозов, среди которых около 90% составляют колхициноподобные метафазы и отставание хромосом в метафазе.
При гиперпластических и диспластических процессах, которые могут рассматриваться как предраковые (тяжелая дисплазня шейки эпителия матки, атипическая гиперплазия эпителия гортани и др ), а также при некоторых доброкачественных опухолях может наблюдаться дальнейшее нарастание нарушений митотического режима, связанных с преобладанием метафаз, учащением числа патологических митозов и их разнообразие с появлением разновидностей, ведущих к анеуплоидин, расширение зоны, где встречаются делящиеся клетки.
Для клеток злокачественных опухолей характерно преобладание метафаз над другими стадиями митоза, резкое возрастание частоты патологических митозов, различная степень повышения митотической активности, нередко незначительная. Существуют опухоли, в которых митотическая активность ниже, чем в нормальных тканях. Мнение, что во всех опухолях клетки делятся чаше, чем в норме, неверно.
Нет, по-видимому, и прямой связи между митотической активностью и быстротой роста опухоли.
Обнаружение соответствующих нарушений митотического режима может быть дополнительным ранним диагностическим признаком наступившей малигнизации или иметь прогностическое значение при оценке предопухолевых процессов чем резче выражены нарушения митотического режима, тем неблагоприятнее прогноз.
Не исключено, что, возможно, имеют место некоторые различия в характере нарушения митотического режима в опухолях разного гистогенеза.
На основании изучения митотического режима может быть получена полезная информация для оценки степени повреждения опухолевых клеток при лучевом или лекарственном лечении новообразований. Например, снижение митотического индекса и нарастание так называемых комковатых митозов, являющихся разновидностью К-митозов и ведущих клетку к гибели, может служить одним из критериев терапевтического эффекта.
Исследование закономерностей митотического режима в новообразованиях имеет решающее значение для понимания механизмов, определяющих книети ку популяции опухолевых клеток, которая по многим параметрам оказывается весьма гетерогенной. Если рассматривать популяцию опухолевых клеток с точки зрения их деления, то следует отметить, что вышедшие из митотического цикла опухолевые клетки могут или вступить на путь диффереицировки, или вновь вступить в митоз и продолжать пролиферировать, или остаться в покоящемся состоянии. Таким образом, в популяции имеется 3 группы клеток, нахо дящихся во взаимосвязи друг с другом недифференцированные покоящиеся клетки, недифференцированные пролиферирующие клетки и дифференцирующиеся, но уже не пролифернрующие клетки.
Покоящиеся опухолевые клетки, как было показано О. И. Епифановой и соавт., сохраняют жизнеспособность и пролиферативный потенциал, они резистентны к химиотерапевтическим препаратам (цитостатикам, алкилирующим соединениям, антибиотикам), митотическим ингибиторам Сохраняя способность при каких-то условиях вновь вступать в митоз, эти клетки являются источником рецидивов, что делает их изучение крайне важным. Хотя существуют сведения о том, что в покоящихся опухолевых клетках ниже проницаемость плазматической мембраны, более резко конденсирован хроматин, возможно, в ДНК имеются участки, более прочно связанные с белком, повы шено обновление молекул, однако их практическая идентификация в опухоли пока еще невозможна, так как мы не знаем их особенностей нх обмена, ни их морфологических, гистохимических или ультраструктурных особенностей, ко торые позволили бы отличить их от других недифференцированных опухолевых клеток.
В связи с тем что недифференцированные пролиферирующие опухолевые клетки чувствительны к лучевому и химнотерапевтическому лечению, делают попытки перевести покоящиеся клетки в группу пролиферирующих путем гормональных воздействий или иных мероприятий.
Катаплазия на светооптическом уровне касается не только морфологии опухолевых клеток (их фенотипа), но еще в большей степени их морфогенетических потенций, что выражается в нарушении обычной тканевой и органной структуры новообразований. Органная и тканевая катаплазия, являющаяся, так же как инвазивный рост и метастазирование, наиболее характерным морфологическим признаком опухолевого роста, наряду с клеточной катаплазией составляют ту сумму признаков, которые позволяют на светооптическом уровне идентифицировать опухоль во всем многообразии ее строения.
Классические гистологические методы поэтому были и остаются основой морфологической диагностики новообразований человека, однако использование только их не дает возможности решать встающие перед онкологией новые задачи. Расширить методические возможности морфологической верификации новообразований можно с помощью таких современных способов исследования, как электронная микроскопия, гистохимия, иммуногистохимия. Анализ ультраструктурных, гистохимических, иммуногистохимических и биологических особенностей опухолевых клеток главным образом в плане диагностики и установления гистогенеза новообразований человека дан в последующих трех разделах.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Факторы определяющие степень злокачественности меланомы.
Количество митозов в дермальном компоненте опухоли, особенно их число на 1 мм2 площади, является важным прогностическим фактором для меланомы. Митотическая активность выше, чем 6 митозов на 1 ммг, измеренная в компоненте вертикальной стадии роста опухоли, является фактором высокой степени риска. Можно использовать прогностический индекс (pi) для меланомы, который вычисляется путем умножения числа митозов, приходящихся на 1 мм2 площади опухоли, на показатель толщины опухоли в миллиметрах. Это более точный показатель прогноза для пациента, чем любая из этих двух переменных в отдельности.
Изъязвление меланомы
Изъязвление эпидермиса над дермальной частью опухоли — важная прогностическая переменная. Фактически в нескольких исследованиях она была представлена как независимый фактор прогноза. Но не все исследователи согласны с этим выводом. Изъязвление появляется в опухолях с достаточной глубиной инвазии для появления метастазов, но в проведенных исследованиях этот факт не учитывался. Однако в тех случаях, когда изучались опухоли, согласованные по толщине, сокращение периода выживания у пациентов с изъязвленными опухолями снизилось с 80 до 55%, при этом прогностическое значение имели изъязвления диаметром более 3 мм.
Лимфоидная инфильтрация меланомы
В меланомах ответная реакция организма на неопластический процесс представлена, в основном, лимфоцитами. Опухоли с выраженным лимфоцитарной инфильтрацией имеют лучший прогноз. W.H. С1аrk с соавт. ввели термин TTLs («лимфоциты, инфильтрирующие опухоль»), чтобы учеств наличие лимфоцитов, фактически проникающих между клетками опухоли, что особенно важно для вертикальной стадии роста опухоли. В своих исследованиях они не относили к TILs лимфоциты, инфильтрирующие строму опухоли, и лимфоциты, связанные с радиальной стадией роста меланомы. Посредством многофакторного анализа эти ученые установили, что TILs является вторым наиболее важным прогностическим фактором для стадии I и II, а опухоль с оживленным TILs-ответом имеет более благоприятный исход. Отсутствие иммунного ответа в опухолях толщиной 3,65 мм и более служит отрицательным прогностическим фактором в отношении выживания больных и положительным в отношении вероятности развития костных и висцеральных метастазов.
Регрессия меланомы
Один из уникальных аспектов меланомы — способность опухоли к спонтанной регрессии. Регрессия может быть частичной или полной.
Сложившиеся противоречия вокруг понятия «спонтанной регрессии» в меланоме как прогностического фактора являются результатом использования различных определений самой «регрессии». Регрессия может проис-ходитв как в радиальной, так и в вертикальной стадии роста. Однако именно регрессия при радиальной стадии роста исторически была изучена как потенциальный прогностический признак меланомы. Эта регрессия была определена как отсутствие элементов опухоли в эпидермисе. Участок регрессии характеризовался фиброзом сосочкового слоя дермы, повышенной васкуляризацией и смешанной инфильтрацией лимфоцитами и меланофагами. Регрессия описывалась как «ак-ивная», когда присутствовали TILs, и как «прошлая», когда все клетки опухоли исчезали. Полное исчезновение клеток опухоли можно определить и как «истинную» регрессию. Несколько групп исследователей наблюдали неблагоприятные результаты у пациентов с частичной регрессией опухоли, в то время как другие не отмечали подобных результатов. W.H. Clark и соавт. предположили, что регрессия при радиальной стадии роста опухоли является важным независимым фактором прогноза выживания, но только у пациентов с наличием компонента вертикальной стадии роста. Невозможно предсказать прогноз у пациентов, если опухоль полностью регрессировала, или у пациентов, имевших только радиальную стадию роста опухоли, потому что статистически последние имеют выживание в 100% случаев, независимо от присутствия регрессии или любого другого прогностического фактора.

Гистологический подтип меланомы
Исторически сложилось, что подтип меланомы (злокачественное лентиго, поверхностно распространяющаяся или узловая меланома и т.д.) рассматривается как важный прогностический фактор, однако он не является независимым фактором прогноза. Так, неблагоприятный прогноз при узловой меланоме связан с толщиной опухоли, а не с гистологическим подтипом. Узловая меланома — по определению, опухоль в вертикальной стадии роста, в среднем ее толщина больше, чем при других гистологических подтипах, которые классифицируются на основании присутствия компонента радиальной стадии роста. Меланома типа злокачественного лентиго — единственная форма, имеющая лучший прогноз, чем другие подтипы.
Неточный состав компонента вертикальной стадии роста меланомы
Все меланомы имеют области, содержащие эпителиоидные и веретенообразные клетки, хотя в большинстве случаев отдельный клеточный тип преобладает. Меланомы, состоящие из веретенообразных клеток, имеют лучший прогноз, но при анализе клеточный состав редко рассматривается как независимый фактор прогноза. Плоидностъ
Проточная цитометрия для определения плоидности клеток применялась и при изучении меланом. В результате установлено, что анеуплоидность постоянно коррелирует с толщиной, уровнем инвазии и изъязвлением и является независимым фактором риска развития рецидива для опухолей толщиной более 1,5 мм и менее 3,0 мм. Анеуплоидность клеток также связана и с короткой ремиссией. Komino с соавт. выявили, что анеуплоидность может обнаруживаться в маленьких меланомах (и менее 6 мм) и уже на этой стадии связана с высоким риском рецидивирования и метастазирования.
Маркеры пролиферации меланомы
Митотическая активность в меланомах связана с рецидивами и выживанием. Иммуногистохимическое выявление высокого показателя пролиферации Ki-67 (MIBl) в меланомах коррелирует с толшиной опухоли. Толшина опухоли и максимальная числовая плотность Ki-67-положительных ядер является независимым фактором прогноза, более существенным по своему значению, чем толщина опухоли или число митозов по отдельности. Рецепторы эстрогена
Поскольку существуют явные различия в анатомическом местоположении и биологическом поведении меланом у мужчин и женщин, была исследована роль эстрогена и его рецепторов в меланомах. Меланомы имеют способность закрепления гормона стероида, однако не все исследования до настоящего времени сумели подтвердить наличие белка эстроген-рецептора в меланомах, даже в течение беременности. Тем не менее Walker с соавт. выявили наличие белка рецептора в 37-50% меланом как у мужчин, гак и у женщин и определили его как фактор прогноза, наряду с толшиной опухоли и уровнем инвазии. Присутствие и роль эстроген-рецепторов в меланомах требуют дальнейшего изучения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Гиперплазия — это увеличение количества клеток без увеличения их размеров. Гиперпластические процессы могут предшествовать развитию онкологического заболевания. Гиперплазия эндометрия — одна из форм патологических пролиферативных изменений эндометрия, с преимущественной пролиферацией железистого компонента по сравнению со стромальным компонентом [1].
Существует гистологическая классификация гиперпластических процессов эндометрия, предложенная ВОЗ (2014) [2]:
- гиперплазия без атипии (железисто-кистозная гиперплазия эндометрия);
- атипичная гиперплазия: аденоматоз, диффузная или очаговая аденоматозная гиперплазия, аденоматозные полипы;
- полипы эндометрия: железистые, железисто-кистозные, железисто-фиброзные.
Гиперплазия эндометрия без атипии — это пролиферация с изменением строения желез и клеток, но без клеточной атипии. Изменения в строении обычно видны при малом увеличении, но важной особенностью, которая определяет прогноз и возможность малигнизации — это клеточная атипия. Все типы гиперплазии характеризуются увеличением отношения железы к строме, неравномерностью формы железы и изменением размера железы (рис. 1 а и б). При гиперплазии без атипии железистый эпителий напоминает пролиферирующий эндометрий (рис. 1 б). Клетки столбчатые с амфофильной цитоплазмой и имеют псевдостратифицированные ядра, ориентированы к базальной мембране и имеют овальную форму с гладкими контурами, равномерно распределенный хроматин и небольшие незаметные ядрышки. Митотическая активность может быть переменной и может быть меньше, чем в пролиферирующем эндометрии. Частота митоза не влияет на диагноз [5].
Как правило, гиперплазия диффузная, но может быть очаговой из-за локальных различий в содержании рецепторов эстрогена и прогестерона в эндометрии. При простой гиперплазии присутствует строма в значительном объеме. Строение стромы напоминает нормальное, характерное для пролиферативной фазы, строма состоит из маленьких овальных клеток со скудной цитоплазмой. Как и в железах, в строме отмечена митотическая активность. Когда гиперплазия является полипоидной, строма может содержать артерии с толстой стенкой, подобные тем, которые наблюдаются в полипах. По мере прогрессирования гиперплазии железы располагаются более тесно. Обычно железы плотно прилегают друг к другу, хотя всегда присутствует небольшое количество стромы между ними [5].

а) Гиперплазия без атипии. Немногочисленные железы, имеющие различия в размерах и форме, разделены обильной стромой. Некоторые железы расширены и слегка кистозные.
б) Ядра железистых клеток имеют овальную форму, псевдостратифицированы и с однородными контурами, признаков клеточной атипии нет, ядра ориентированы к базальной мембране. Ядрышки нечеткие. Как железистые, так и стромальные клетки имеют сходное строение с клетками эндометрия в пролиферативной фазе. Видно несколько митотических фигур.
К предраковым заболеваниям эндометрия относятся [2]:
- атипическая гиперплазия эндометрия (аденоматоз и аденоматозные полипы);
- рецидивирующая железистая гиперплазия эндометрия.
Эндометрий — мишень половых гормонов, так как эта ткань имеет специфические рецепторы. Клетки эндометрия обновляются ежемесячно под влиянием гормональной регуляции. Нарушение гормонального статуса женщины может изменять рост и дифференцировку клеток. Поэтому могут возникнуть гиперпластические процессы [2].
- нарушение центральной регуляции репродуктивной системы, вызывающие недостаточность лютеиновой фазы и ановуляция;
- гиперпластические процессы и гормональные опухоли яичников;
- нарушения тканевой рецепции и метаболизма половых гормонов;
- болезни обмена и эндокринной системы (СД, ожирение);
- заболевания гепатобиллиарной системы, ЖКТ, иммунной системы и щитовидной железы.
а) Атипичная гиперплазия / EIN (эндометриальная интраэпителиальная неоплазия). Железы немногочисленные, но небольшое количество стромы охватывает каждую железу. Среди клеток заметна ядерная атипия с несколькими слоистыми округлыми ядрами. Видны апоптотические тела.
б) Железы близко расположены, но каждая железа окружена стромой с базальной мембраной. Папиллярные пучки эозинофильных клеток проецируются в просвет многих желез. В строме отмечается плотный воспалительный инфильтрат.
Атипичная гиперплазия отличается наличием ядерной атипии и сложным строением с тесно расположенными железами. Железы обычно неправильной формы и размера. Каждая железа имеет базальную мембрану, окруженную тонким слоем стромы, отделяющей его от соседних желез. Однако в некоторых случаях железы расположены далеко друг от друга. Встречаются как железы без клеточной атипии, так и атипичные [5].
Специфические особенности при атипичной гиперплазии включают: стратификацию, увеличение размера ядер с измененным хроматином и ядрышками. В ядрах отмечена истинная стратификация (2–4 слоя), и потеря ориентирования к базальной мембране [5].

а) Хотя в доброкачественном полипе (справа) всегда ожидается сближение желез, иногда обычная гиперплазия с близко расположенными железами включает полип (слева)
б) Очаговая пролиферация в доброкачественном полипе эндометрия. В просвете небольшие папиллярные пучки. Атипии нет.
На фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу, может развиваться рак тела матки (РТМ) — это злокачественная опухоль, происходящая из слизистой оболочки тела матки (эндометрия). Чаще всего РТМ носит спорадический характер, и в 5 % случаев РТМ ассоциирован с наследственными синдромами, например, с синдромом Линча. Среди факторов риска: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [3].
Эпидемиология РТМ
Патогенез
Развитие РТМ обусловлено гиперэстрогенией, основной причиной которой является нарушение овуляции. Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности рака эндометрия позволили обосновать концепцию о двух основных патогенетических вариантах заболевания [2].
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток II патогенетического варианта, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз [2].
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия. Примерно у 80% больных РТМ диагностируют эндометриоидную аденокарциному [2].
Выделяют три степени дифференцировки аденокарциномы эндометрия [2]:
G1 — высоко дифференцированная;
G2 — умеренно дифференцированная;
G3 — низко дифференцированная или недифференцированная.

а) Эндометриоидная карцинома, G1.
В новообразовании видны хорошо сформированные железы, иногда они сливаются. Ядра с минимальным плеоморфизмом, небольшими ядрышками и низкой скоростью митоза.
б) Железы смыкаются, хотя контуры некоторых желез все еще можно проследить. Это свидетельствует о нарушении стромы
в) Эндометриоидная карцинома, G2. Несмотря на то, что прослеживается дифференцирование желез, в значительной части (примерно 30 %) опухоли наблюдается устойчивый рост.
г) Эндометриоидная карцинома, G3. Присутствует несколько желез, более 50 % клеток опухоли характеризуются устойчивым ростом злокачественных эпителиальных клеток.
Клиника
Ранний симптом прогрессирования рака эндометрия — появление жидких водянистых белей, нередко с примесью крови, и зуда наружных половых органов. Кровянистые выделения из половых путей бывают в виде мажущих серозно-кровянистых выделений, которые становятся порой обильными. Кровотечение, как правило, контактное или появляется после физической нагрузки [2].
Возможны боли внизу живота, которые на ранних стадиях рака носят схваткообразный характер. Это связано с сокращениями эндометрия и опорожнением матки от скопившейся в ней крови или гноевидной жидкости (гематометра, пиометра), отток которой в результате обтурации внутреннего зева затруднен. После таких схваткообразных болей появляются обильные выделения из матки — гной и кровь. При поздних стадиях боли постоянные, особенно интенсивные по ночам, связаны со сдавлением раковым инфильтратом нервных сплетений в малом тазу. При переходе процесса на мочевой пузырь и прямую кишку появляются симптомы нарушения функционирования этих органов [2].
Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [6].
Генри Миллер писал: «Хаос — это порядок, который нам непонятен». Трансформация клеток с последующим безудержным ростом опухолевой массы представляет, на первый взгляд, участок анархии в организме, но изучение биологии канцерогенеза постепенно формирует понимание связей и законов опухолевой системы. В клинической практике переход от периода «смуты» выражается в совершенствовании классификаций опухолей. Одной из очевидных, но далеко не самых простых характеристик неоплазий является морфологическая картина. Она позволяет судить о «темпераменте» опухоли, определяющем степень ее злокачественности.
Градация (Grade) — категория степени гистологической злокачественности, основанная на том, как атипичные клетки и опухолевая ткань в целом выглядят при световой микроскопии.
Количество градаций варьирует от 3 до 4 в зависимости от типа опухоли. Если злокачественно трансформированные клетки и структурная организация опухолевой ткани близки к нормальным, опухоль является «хорошо дифференцированной» (Grade 1). Эти опухоли имеют тенденцию расти и метастазировать медленнее, чем «мало/плохо дифференцированные» (Grade 2 и/или Grade 3) или «недифференцированные» (Grade 3 или 4). Более высокий Grade сочетается с увеличением агрессивности опухоли и ухудшением прогноза.
Основываясь на этих и других различиях в микроскопической картине, патологоанатомы вычисляют числовую «оценку» большинства онкологических заболеваний. Факторы, используемые для определения степени злокачественности опухоли, различаются в зависимости от локализации.
Степень злокачественности опухоли не совпадает со стадией. Стадия определяется комбинацией значений T, N, M, описывающих размер первичной опухоли, поражение регионарных лимфатических узлов и наличие метастазов и их характеристику. Валидные гистологические системы классификации достаточно длительно используются при верификации рака молочной железы [1], предстательной железы [2], эндометрия [3], сарком мягких тканей [4] и опухолей почек [5].
Для некоторых опухолей для определения градации используют уникальные по гистологическому строению участки. Например, низкодифференцированные кластеры (poorly differentiated clusters, PDCs) рассматриваются в качестве гистопатологического предиктора рака прямой кишки. PDCs состоит из пяти и более раковых клеток, которые формируют инвазивный компонент при отсутствии железистой паренхимы опухоли (рис.1) [6].
.

Рисунок 1. Верификация степени злокачественности колоректального рака с учетом количества низкодифференцированных кластеров (PDC)
Рассмотрим для примера определение гистологической градации при раке молочной железы. Для объективизации процесса и унификации используется полуколичественная оценка морфологических характеристик опухоли. В настоящее время она представлена Ноттингемской модификацией системы Скарфа-Блума-Ричардсона или Ноттингемской градирующей системой, принятой во всем мире. Кратко ее пункты отражены в таблице 1 (и пусть вас не запутает мнемоника, основанная на аналогии с Tumor/Nodulus/Metastasis).
.

Разберем составляющие ингредиенты гистологической градации.
Оценка железистых структур проводится во всех участках доставленного материала. В зависимости от доли фрагментов с наличием таких элементов выставляется определенное число баллов:
- 1 балл – более 75 % опухолевого поля формируют железистые/тубулярные структуры
- 2 балла — от 10 % до 75 % опухолевого образца
- 3 балла – менее 10 % опухолевого образца.
Не всякая щель в препарате – железа, могут быть и артифициальные повреждения материала. Нам нужны только структуры с четко определяемым центральным просветом, окруженным поляризованными злокачественно трансформированными клетками.
Ядерный полиморфизм – морфологическое проявление опухолевой дифференцировки на цитологическом (клеточном) уровне. Это визуальный паттерн генетических поломок в опухолевой клетке: анеуплоидии, генетической нестабильности и изменения транскрипции.
Индивидуальность во взглядах делает нас особенными личностями, но, к сожалению, в морфологической оценке выражается в субъективизме, особенно при рассмотрении ядер клеток.
Ядерный полиморфизм оценивается по балльной системе:
- 1 балл — ядра маленькие, незначительно увеличены по сравнению с клетками эпителия нормальных структур, с правильными очертаниями, моноформным ядерным хроматином, невыраженной разницей в размерах
- 2 балла — клетки больше, чем нормальные эпителиоциты, с везикулярными ядрами, выраженными ядрышками, умеренными различиями в размерах и форме.
- 3 балла — везикулярные ядра, часто с заметными ядрышками, значимые различия по форме и размеру, зачастую с причудливыми формами.
Количество митозов указывает на уровень пролиферативной активности опухоли. Поэтому справедливо отдать лавры самого прогностически значимого компонента гистологической градации букве «М».
Митоз или не митоз — вот в чем вопрос… Для подсчета используют только достоверные фигуры митоза, отражающие различные его стадии. Этот показатель невероятно капризен и реагирует на качество фиксации материала. Поэтому в спектр компетенций патологоанатома включается также и взаимодействие с лабораторией, чтобы осознавать возможные «помехи» и при необходимости запрашивать повторную подготовку опухолевого материала.
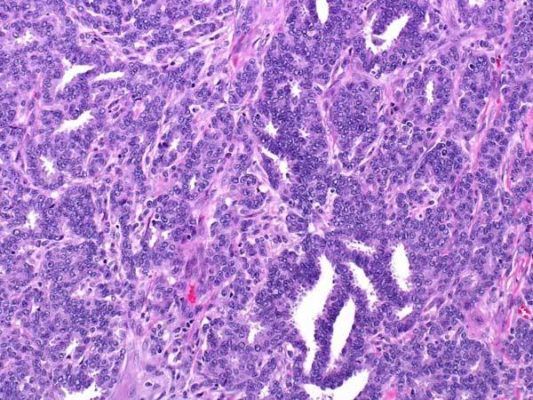
Рисунок 2. Grade 1: инвазивная протоковая карцинома состоит из небольших желез с достаточно однотипными ядрами. Карциномы G1 менее агрессивны и имеют лучший прогноз, чем менее дифференцированные. Они также чаще ER-положительные (иммуногистохимический показатель — экспрессия рецепторов эстрогена на опухолевых клетках), что является еще одной особенностью, связанной с более благоприятным прогно зом.
.
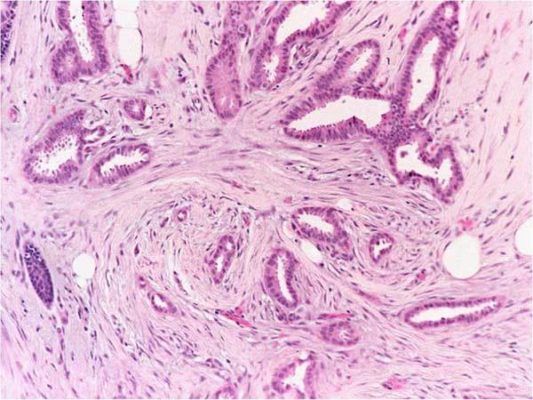
Рисунок 3. Grade 2: некоторые участки этой инвазивной протоковой карциномы образуют структуры наподобие трубчатых желез, но другие области представлены плохо сформированными железами с гнездными скоплениями клеток, содержащих умеренно атипичные ядра. Карциномы G2 имеют промежуточный прогноз.
.
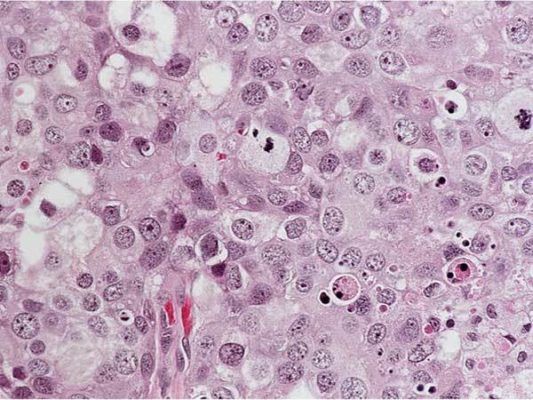
Рисунок 4. Grade 2: эта инвазивная протоковая карцинома состоит из отдельных и гнездно расположенных атипичных клеток с выраженным ядерным полиморфизмом и высокой митотической активностью. Карциномы G3 имеют максимально неблагоприятный прогноз. Молекулярный подтип таких опухолей чаще трижды негативный (отсутствует экспрессия рецепторов эстрогена, прогестерона, отрицательный HER2), что ассоциировано с агрессивным поведением опухоли и худшим прогнозом.
Опухолевая гетерогенность проявляется и в пролиферативной активности. Для максимально точной оценки подсчет проводят в 10 HPF (high-power field, поле зрения при большом увеличении микроскопа) по периферии опухолевого узла, где ожидается наибольшее число пролиферирующих клеток. Важным аспектом являются характеристики используемого микроскопа. Количество определяемых митозов зависит от площади поля зрения. Патологоанатом должен знать объем поля зрения на окуляре и показатели объектива своего верного «помощника».
.

А — объектив Nikon или Labophot с кратностью увеличения в 40 раз (40x) или сопоставимый с диаметром поля 0,44 мм;
В — объектив Leitz или Ortholux 25x или сопоставимый с диаметром поля 0,59 мм;
С — объектив Leitz или Diaplan 40x или сопоставимый с диаметром поля 0,63 мм.
Итоговая оценка Grade основана на подсчете суммы 3 вышеуказанных компонентов:
- I степень злокачественности (Grade 1, G1) = от 3 до 5 баллов
- II степень злокачественности (Grade 2, G2) = 6–7 баллов
- III степень злокачественности (Grade 3, G3) = 8–9 баллов
Введение в онкологическую практику оценки степени злокачественности опухоли подчеркивает важность биологических свойств атипичных клеток. Потенциал к неконтролируемому агрессивному росту, инвазии и метастазированию можно оценить по визуальным характеристикам отдельных клеток и особенностям сформированных ими структур. Для различных локализаций новообразований разрабатываются собственные системы оценки, которые непрерывно совершенствуются. Но даже самый точный, идеально сконструированный алгоритм не будет работать при отсутствии достаточной компетенции специалиста. Сохранить ясный взгляд, педантичность и скрупулезность в течение каждого, даже самого тяжелого рабочего дня крайне важно для онкоморфологов. Их кропотливый труд завершается распечаткой листа с надписью «результаты патологоанатомического исследования», на котором в нескольких строках в графе «заключение» расписаны ориентиры для клиницистов, определяющие судьбу пациента.
Читайте также:

