Микроциркуляция крови для кожи что это
Обновлено: 25.04.2024
Федорович А.А. 1,2 , Багдасарян А.Г. 3 , Учкин И.Г. 3 , Зудин А.М. 3
1 – Институт клинической кардиологии им.А.Л.Мясникова ФГБУ РКНПК МЗ РФ, Москва
2 – ГНЦ РФ Институт медико-биологических проблем РАН, Москва
3 – Отдел хирургии сосудов ПМГМУ им.И.М.Сеченова, Москва
Резюме
В обзоре рассматриваются структурные и гемодинамические аспекты нарушений микроциркуляторного кровотока в коже нижних конечностей при поражении артериального и венозного сосудистого русла, и патогенетические принципы медикаментозной коррекции развивающихся метаболических нарушений.
Ключевые слова: микроциркуляция, артериоло-венулярное шунтирование, транскапиллярный обмен, микрососудистый эндотелий.
Введение
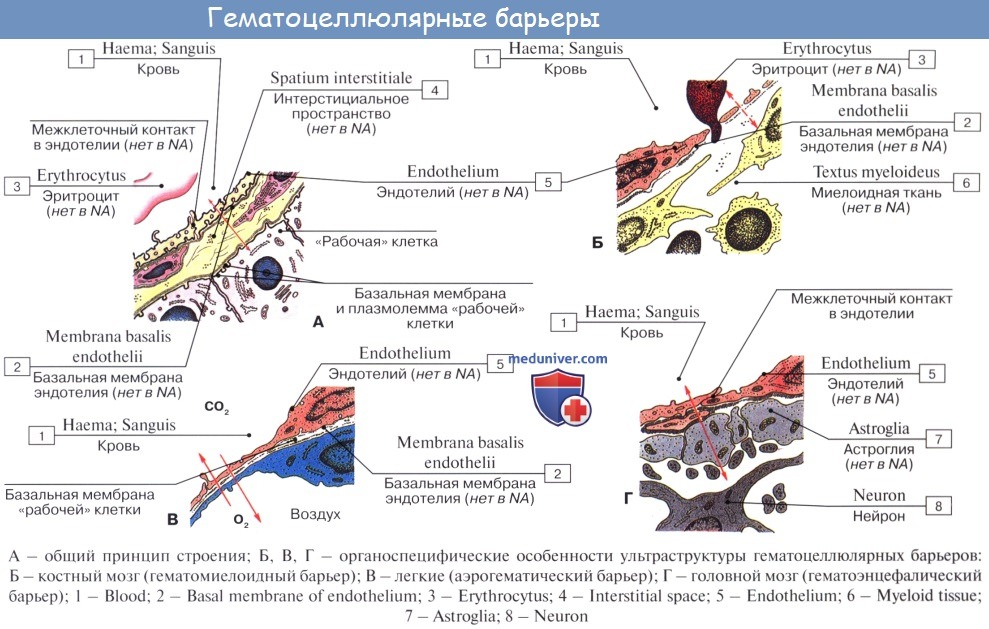
Основной функцией микроциркуляторного русла (МЦР) является обеспечение тканевого гомеостаза на оптимальном уровне независимо от действия различных внешних и внутренних факторов. Транспорт необходимых для нормальной жизнедеятельности организма веществ из крови в интерстициальное пространство зависит от взаимно перекрывающегося влияния четырех групп факторов: 1) градиента концентрации транспортируемого вещества (кровь-ткань); 2) характера вещества (конфигурация молекулы, молекулярный вес); 3) состояния эндотелия обменных микрососудов; 4) гемодинамического фактора 2.
Есть движение – есть обмен, нет обмена – движение не нужно, поэтому ключевым механизмом в обмене веществ является гемодинамический фактор, который на уровне МЦР непосредственно определяет параметры фильтрационно-реабсорбционного механизма обмена. Процессы фильтрации и реабсорбции через стенку капилляров описываются уравнением Старлинга, которое было сформулировано еще в 1896 году, и зависят от нескольких переменных, основными среди которых являются параметры гидростатического и коллоидно-осмотического давления крови. Первые результаты прямого измерения давления непосредственно в капиллярах кожи человека, выполненные еще в конце 20-х годов ХХ столетия E.M.Landis показали, что давление в артериальном отделе капилляра составляет в среднем 32 мм рт.ст., а в венозном – 12 мм рт.ст. [4]. Коллоидно-осмотическое давление цельной крови, в некотором смысле величина постоянная, и составляет порядка 25-28мм рт.ст. Эффективность фильтрационно-реабсорбционного механизма обмена, обусловленного смещением точки равновесия между процессами фильтрации и реабсорбции в ту или иную сторону, определяется исключительно параметрами кровотока в артериолярном и венулярном отделах МЦР [5,6].
Кожа является наиболее доступным и удобным объектом для неинвазивного исследования микроциркуляции у человека. Бурное развитие современных технологий привело к появлению целого ряда новых и перспективных методов для неинвазивной оценки микроциркуляторного кровотока у человека – лазерная допплеровская флоуметрия (ЛДФ), компьютерная капилляроскопия (ККС), высокочастотная ультразвуковая допплерография и другие. И не смотря на то, что микрососуды кожи не подвержены барорефлекторной регуляции, накопленные данные по ЛДФ и ККС позволяют говорить о том, что МЦР кожи может отражать состояние микроциркуляторных процессов в других органах и системах 9.
МЦР, являясь противоположным сердцу «полюсом» сердечно-сосудистой системы, анатомически находится между артериальной и венозной системами, и поэтому самым непосредственным образом зависит от функционального состояния последних. В связи с этим, особый интерес представляет исследование микроциркуляторного кровотока в коже нижних конечностей, которые подвержены поражению как артериального (система притока), так и венозного (система оттока) сосудистого русла.
Патология артериального русла нижних конечностей
Причины поражения артериального русла могут быть весьма разнообразны, но, не смотря на природу этиологического фактора, основной мишенью является сосудистый эндотелий. Уже в дебюте атеросклеротического поражения сосудистого русла отмечается дисбаланс продукции эндотелием сосудорасширяющих и сосудосуживающих веществ [11,12]. Не смотря на это, в начальных стадиях окклюзионно-стенотического поражения артерий нижних конечностей давление в капиллярах кожи остается на нормальном уровне [13], что, вероятнее всего, объясняется компенсаторным повышением вазомоторной активности артериолярных микрососудов кожи по данным ЛДФ [14]. Однако, не смотря на компенсацию гемодинамических параметров микрокровотока, уже на самых ранних стадиях заболевания отмечается повышенная проницаемость капилляров [15], что свидетельствует о вовлечении в патологический процесс всех без исключения отделов сосудистого русла с нарушением трофики не только тканей, но и самой сосудистой стенки артерий. Нарушения в системе vasa-vasorum, которая по своим морфо-функциональным характеристикам является типичным представителем МЦР, рассматриваются в качестве одной из возможных причин прогрессирования атеросклеротического поражения магистральных сосудов [16,17]. Проведенные А.С.Barger с соавторами (1984) исследования показали, что существует выраженная корреляция между нарушениями в системе vasa-vasorum и прогрессированием атеросклероза в коронарных артериях [18].
На начальных стадиях окклюзионно-стенотического поражения артерий регуляторные механизмы микрокровотока способны поддерживать капиллярную гемодинамику на оптимальном для транскапиллярного обмена уровне только в условиях покоя, а при выполнении различных функциональных тестов отмечаются снижение уровня постокклюзионной реактивной гиперемии с удлинением времени ее развития 19, снижение прироста перфузии при тепловой пробе [21], снижение как эндотелий зависимой (ацетилхолин), так и эндотелий независимой (нитропруссид натрия) дилатации микрососудов 23.
По мере прогрессирования патологии с развитием хронической ишемии нижних конечностей (ХИНК) нарушения на уровне МЦР усугубляются, что во многом обусловлено снижением венуло-артериолярной констрикторной реакции 25, которая в норме носит защитный характер, ограничивая артериальный приток при повышении венозного давления, что предохраняет капилляры от чрезмерного повышения давления. Снижение венуло-артериолярной констрикторной реакции на фоне нарастающих нарушений проницаемости эндотелия капилляров способствуют развитию тканевого отека [15], который не только приводит к грубым метаболическим нарушениям за счет существенного увеличения расстояния диффузии для питательных веществ и продуктов тканевого обмена, но и способствует нарушению оттока крови от капилляров за счет экстравазальной компрессии тонкостенных венулярных микрососудов. Повышение венулярного давления приводит к дальнейшему росту капиллярного давления и усугублению отека. Патологический круг замыкает развитие феномена шунтирования крови по артериоло-венулярным анастомозам (АВА), минуя капиллярное русло, что еще больше усугубляет тканевую ишемию.
Патология венозного русла нижних конечностей
Несколько иной механизм нарушения микроциркуляторных процессов при хронической венозной недостаточности (ХВН). Ведущим патогенетическим механизмом нарушений микроциркуляции при ХВН является флебогипертензия, что приводит к росту посткапиллярного сопротивления и увеличения капиллярного давления. При повышении давления в капиллярах выше 50 мм рт.ст. наблюдается выход из капилляров в интерстициальное пространство крупномолекулярных веществ, которые обладают высоким коллоидно-осмотическим потенциалом [34]. У пациентов с ХВН наличие повышенной проницаемости капилляров отмечается уже в ранних стадиях заболевания, когда характерные морфологические изменения капилляров (расширение, штопорообразная извитость) еще не выражены [35,36].
При дальнейшем прогрессировании венозной недостаточности происходит истощение компенсаторных механизмов, развиваются грубые нарушения структуры и проницаемости капилляров с нарастанием тканевого отека, уменьшается количество функционирующих капилляров и снижается напряжение кислорода в коже [36,37]. Все это в итоге приводит к развитию трофических нарушений. В области трофических расстройств отмечается выраженное снижение напряжения кислорода, но на этом фоне, по данным ЛДФ, отмечается увеличение уровня перфузии в 3-5 раз по сравнению с группой контроля [38]. Одни авторы полагают, что увеличение уровня перфузии можно объясняется венулярной гиперемией на фоне застойных явлений [38], когда количество эритроцитов, отражающих лазерное излучение, очень большое. Другие авторы считают, что данный феномен обусловлен наличием шунтирования кровотока по АВА, что также может давать увеличение сигнала ЛДФ [39]. До настоящего времени, вопрос о том, является ли раскрытие АВА пусковым механизмом в развитии ХВН или шунтирование кровотока развивается вторично для выравнивания давления между приносящей и дренирующей частями капилляра, остается открытым. Но совершенно не вызывает сомнения тот факт, что наличие артериоло-венулярных шунтов, в конечном итоге, приводит к нарушению транскапиллярного обмена, усугублению микроциркуляториых расстройств с развитием трофических нарушений при ХВН нижних конечностей.
Заключение
В данном кратком обзоре мы не ставили перед собой задачу осветить все нарушения, возникающие на уровне МЦР кожи при заболеваниях сосудистого русла конечностей, хотя совершенно очевидно, что они сопровождаются целым каскадом изменений реологических и гематокоагуляционных свойств крови, тем более что кровоток на уровне МЦР характеризуется преобладанием вязких сил над кинетическими. Основной акцент в данной работе был сделан на развивающихся нарушениях микрогемодинамики.
Независимо от ведущего механизма нарушений периферической циркуляции крови в конечностях (приток или отток), на первый план выходит нарушение функции эндотелия микрососудов, которая проявляется в повышенной проницаемости капилляров уже на ранних стадиях патологии. Являясь единственным видом клеток в человеческом организме, который непосредственно контактируют с кровью, эндотелий первым принимает на себя удар от всех видов повреждающих агентов (химической или биологической природы), которые тем или иным способом попадают в сосудистое русло (дыхательная система или пищеварительный тракт, непосредственно внутривенно или трансдермально). На уровне МЦР между кровью и эндотелием развиваются, если можно так выразиться, самые «интимные» взаимоотношения, что обусловлено самыми низкими скоростями кровотока во всей сердечно-сосудистой системе и, соответственно, самым продолжительным периодом контакта с повреждающим агентом, поэтому сосуды МЦР первыми и вовлекаются в патологический процесс.
Нарушения микроциркуляции в системе vasa-vasorum при поражении артериальных сосудов сегодня уже можно считать доказанным фактом [17,18], а вот работ, касающихся нарушений питания стенки венозных сосудов, в доступной литературе, мы не встретили. Особенностью системы vasa-vasorum артериальных сосудов является трофическое обеспечение только адвентициального слоя и наружного слоя медии, а интима и внутренние слои медии питательные вещества получают непосредственно из просвета сосудов. В венозных сосудах система vasa-vasorum обеспечивается питание всех трех оболочек [40], т.к. наличие питательных веществ в венозной крови природой не предусмотрено. Учитывая данные структурные особенности строения венозной стенки, вполне логично предполагать, что нарушения в системе vasa-vasorum для венозных сосудов может являться более критичным фактором, чем для артериальных. Нарушения в системе vasa-nervorum при сахарном диабете существенно усугубляет как гемодинамические, так и трофические нарушения в коже нижних конечностей, являясь одним из основных патогенетических механизмов такого тяжелого осложнения патологии как «диабетическая стопа».
МЦР, благодаря большому количеству различных регуляторных механизмов, обладает большим «запасом прочности» и на протяжении длительного времени компенсирует развивающиеся нарушения гемодинамики, поддерживая трофическое обеспечение кожи на достаточном уровне. Но при дальнейшем прогрессировании патологии, компенсаторные механизмы системы микроциркуляции истощаются, а развивающиеся трофические нарушения кожи выходят на первый план, что требует активного и чаще всего хирургического лечения. Но самой эффективной операцией является та, которой удалось избежать, поэтому вопрос о медикаментозной коррекции развивающихся нарушений является очень важным.
Одним из медикаментозных препаратов, который позволяет компенсировать нарушения микроциркуляции при заболеваниях сосудистого русла нижних конечностей различной этиологии, является Актовегин – препарат, который более чем за полувековую историю применения, доказал свою высокую метаболическую эффективность [41,42]. Применение Актовегина способствует развитию коллатерального кровотока и улучшению трофического обеспечения тканей при хронической ишемии нижних конечностей [43,44], при трофических нарушениях венозной этиологии [45], а также сосудистых и нейропатических осложнениях сахарного диабета [46].
Клиническая эффективность Актовегина обусловлена его выраженным эндотелиопротекторным действием именно на уровне микрососудистого русла, что продемонстрировано на здоровых добровольцах по данным ЛДФ и ККС. Через 2 часа после окончания внутривенной инфузии Актовегина отмечается существенное увеличение вазомоторной активности прекапиллярных артериол, увеличение скорости капиллярного кровотока, уменьшение элементов артериоло-венулярного шунтирования и снижение степени гидратации (отека) интерстициального пространства [47,48]. Выраженное увеличение вазомоций в диапазоне эндотелиального ритма на фоне Актовегина, вероятнее всего, обусловлено двумя факторами. К первому можно отнести увеличение вазомоторной активности прекапиллярных артериол за счет повышенной выработки эндотелием оксида азота [48], а ко второму – увеличение непосредственно обменной функции эндотелия, проявляющееся в увеличении поступления кислорода в ткани, что наглядно продемонстрировано на взаимосвязи эндотелиальных вазомоций и обмена кислорода [49].
Полученные на здоровых добровольцах результаты подтверждают положение о том, что эффективность обменных процессов зависит от сочетанного действия нескольких факторов, ведущим из которых является состояние эндотелия микрососудов, который и должен быть основной мишенью для медикаментозного воздействия как с лечебной, так и с профилактической целью.
ФГБУ "НИИ глазных болезней" РАМН, Москва
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», Москва
ФГБНУ «НИИ глазных болезней», Россолимо ул., 11, А, Б, Москва, Российская Федерация, 119021
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Россия, 119021
Исследование микроциркуляции кровотока и лимфотока в коже век методом лазерной допплеровской флоуметрии
Журнал: Вестник офтальмологии. 2017;133(3): 16‑21
ФГБУ "НИИ глазных болезней" РАМН, Москва
Цель — изучить микроциркуляцию кровотока и лимфотока век в норме. Материал и методы. В исследование включены 108 добровольцев (216 глаз) от 20 до 80 лет без признаков изменения структур переднего отрезка глаза, сгруппированных по возрасту (20—30, 31—40, 41—50, 51—60, 61—70, 71—80 лет), группы были сопоставимы по гендерному и количественному составу. У добровольцев исследовали микроциркуляцию кожи верхнего и нижнего века методом лазерной допплеровской флоуметрии (ЛДФ) (анализатор периферического кровотока и лимфотока «ЛАЗМА МЦ-1», комплекс лазерный диагностический «ЛАЗМА МЦ», ООО НПП «ЛАЗМА»). Оценивали средние значения изменения перфузии крови и потока лимфы и анализировали осцилляции кровотока и лимфотока. Результаты. Кровоток и лимфоток в микроциркуляторном русле верхнего и нижнего века вариабелен и не зависит от возраста и гендерной принадлежности исследуемого. На ЛДФ-граммах увеличение амплитуды в записи кровотока соответствует уменьшению амплитуды в записи лимфотока. Заключение. Неинвазивный метод ЛДФ расширяет диагностические возможности, позволяя исследовать не только кровоток, но и лимфоток. Полученные данные могут служить отправной точкой для исследования микроциркуляции в различных возрастных группах при патологических процессах.
ФГБУ "НИИ глазных болезней" РАМН, Москва
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», Москва
ФГБНУ «НИИ глазных болезней», Россолимо ул., 11, А, Б, Москва, Российская Федерация, 119021
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Россия, 119021
Изменения в системе микроциркуляции способствуют возникновению различных заболеваний, в том числе и заболеваний век.
Веки обладают обширной сосудистой сетью. Артериальное кровоснабжение век осуществляется из двух главных источников: внутренней сонной артерии (глазная артерия и ее ветви) и наружной сонной артерии (артерии лица). Обширные коллатерали между этими двумя системами, анастомозирующие на всем протяжении верхнего и нижнего века, формируют краевую и периферическую аркаду. В верхнем веке выделяют две аркады. В нижнем веке часто существует только одна артериальная аркада. Венозная система век обеспечивает претарзальный и посттарзальный отток. По лимфатическим сосудам медиальной части века отток осуществляется в поднижнечелюстные лимфатические узлы, латеральной части — в поверхностные предушные и глубокие узлы шеи [1]. Существуют трудности объективизации состояния микрососудов век. Исследовать микроциркуляцию возможно с помощью анализатора периферического кровотока и лимфотока «ЛАЗМА МЦ-1» (Комплекс лазерный диагностический «ЛАЗМА МЦ», ООО НПП «ЛАЗМА»), в котором реализован метод лазерной допплеровской флоуметрии (ЛДФ). Для записи движения кровотока и лимфотока использован эффект Допплера при зондировании ткани лазерным излучением. Метод ЛДФ получил широкое развитие благодаря циклу работ, выполненных в период 1977—1985 гг. несколькими исследовательскими коллективами. Первый коммерческий прибор, реализующий принципы метода ЛДФ, был создан шведской группой исследователей — G. Wilsson, T. Tenland, P. Oberg [2, 3]. Метод ЛДФ применяли для оценки поверхностного кровотока при раневом процессе, в послеоперационном периоде, для прогнозирования жизнеспособности кожных лоскутов и трансплантатов, диагностики состояния периорбитальных тканей, доброкачественных и злокачественных поражений век [4—6]. Однако работ по изучению лимфотока век проведено не было.
В анализаторе «ЛАЗМА МЦ-1» осуществляется фильтрация допплеровского сдвига частоты при регистрации обратно-отраженного излучения как от эритроцитов в диапазоне их скоростей в микрогемососудах, так и от рассеивателей лимфообразования в лимфососудах в диапазоне скоростей, соответствующих их движению.
В данной статье представлены результаты исследований микроциркуляции кожи век в группе здоровых добровольцев в возрасте от 20 до 80 лет методом ЛДФ.
Цель работы — изучить микроциркуляцию кровотока и лимфотока век в норме.
Материал и методы
В исследование включены 108 добровольцев (216 глаз) от 20 до 80 лет (53 мужчины и 55 женщин) без признаков изменения структур переднего отрезка глаза, сгруппированных по возрасту (20—30, 31—40, 41—50, 51—60, 61—70, 71—80 лет). Группы были сопоставимы по гендерному и количественному составу. Критериями исключения служили наличие гипертонической болезни (кроме гипертонической болезни I стадии, компенсированной лекарственными препаратами), наличие нарушений ритма сердца (мерцательная аритмия, экстрасистолия), эндокринных и аутоиммунных заболеваний. Помимо стандартного офтальмологического обследования, всем добровольцам исследовали микроциркуляцию кожи верхнего и нижнего века методом ЛДФ (анализатор периферического кровотока и лимфотока «ЛАЗМА МЦ-1», комплекс лазерный диагностический «ЛАЗМА МЦ», ООО НПП «ЛАЗМА»). Исследование микроциркуляции век проводили, устанавливая датчик прибора неподвижно в медиальной, средней и латеральной частях верхнего и нижнего века.
Обследование осуществляли при комнатной температуре (23 °С) в положении лежа на спине с закрытыми глазами после 15-минутного отдыха. Состояние микроциркуляции в каждой точке исследования изучали трехкратно в течение 10 мин.
Оценивали средние значения изменения перфузии крови и потока лимфы, а также анализировали осцилляции кровотока и лимфотока. Измеряли средние значения перфузии кровотока и лимфотока (М, σ и Kv) и исследовали активные и пассивные осцилляции с помощью анализа их амплитудно-частотного спектра (АЧС). Для изучения кровотока определяли показатели активного тонусформирующего диапазона частот (эндотелиального (Э), нейрогенного симпатического (Н), собственно миогенного или вазомоций (М)) и пассивных частотных диапазонов (кардиального или сердечного ©, дыхательного (Д)). Активность соответствующего регуляторного фактора вычисляли по формуле А/М, где, А — усредненная максимальная амплитуда осцилляций в соответствующем частотном диапазоне вейвлет-спектра, М — величина среднего потока крови (М), обе в перфузионных единицах (п.ед.). При амплитудно-частотном анализе лимфотока определяли осцилляции в следующих частотных диапазонах: эндотелиальном, пейсмекерном фазном, миогенном и дыхательном. Осцилляторную пейсмекерную активность определяли по формуле Ал/Мл, где Ал — усредненная максимальная амплитуда пейсмекерных фазных осцилляций в вейвлет-спектре колебаний лимфотока. Метод ЛДФ определяет динамическую характеристику микроциркуляции потока частиц — изменение потока в единицу времени в зондируемом объеме.
ЛДФ-сигнал имеет постоянную и переменную от времени составляющие. Постоянная составляющая М — это средний поток в микроциркуляторном русле за определенный промежуток времени исследований или за выбранный временной интервал анализа ЛДФ-граммы.
Переменная составляющая ЛДФ-сигнала обусловлена факторами, влияющими на постоянство потока частиц в микроциркуляторном русле, т. е. изменением величины скорости и концентрацией частиц. Характер изменения величины переменной составляющей определяется вариациями во времени как просвета сосудов, их внутренних диаметров, так и скорости потока, которые контролируются регуляторными факторами в системе микроциркуляции.
Расчетные параметры М, σ (среднее квадратическое отклонение) и Kv (коэффициент вариации) дают общую оценку состояния микроциркуляции кровотока и лимфотока.
Более детальный анализ микроциркуляции кровотока и лимфотока проводят при исследовании АЧС осцилляций.
Активные факторы контроля микроциркуляции крови (тонусформирующие факторы, непосредственно воздействующие на микрососуды) — это эндотелиальный, миогенный и нейрогенный механизмы регуляции просвета сосудов. Эти факторы модулируют поток крови со стороны сосудистой стенки и реализуются через ее мышечно-тонический компонент. В физиологических условиях мишенью нейрогенной регуляции являются артериолы и артериоло-венулярные анастомозы, мишенью собственно миогенного компонента регуляции — прекапилляры и сфинктеры. Эндотелиальная регуляция диаметра сосудов затрагивает преимущественно более проксимальные сосуды (мелкие артерии, крупные артериолы). Активные механизмы создают поперечные колебания кровотока в результате чередования сокращения и расслабления мышц сосудов (сменяющие друг друга эпизоды вазоконстрикции и вазодилатации).
Пассивные факторы (факторы, формирующиеся вне системы микроциркуляции крови) — это пульсовая волна со стороны артерий и «присасывающее действие дыхательного насоса» со стороны вен. Эти колебания проникают с кровотоком в зондируемую область, так как микроциркуляторное русло, являющееся составной частью общей системы кровообращения, топографически расположено между артериями и венами. Благодаря пассивным факторам возникают продольные колебания кровотока, выражающиеся в периодическом изменении давления и объема крови в сосуде. В артериолах характер этих изменений определяется пульсовой волной, в венулах — колебаниями «дыхательного насоса».
Осцилляции микрокровотока и микролимфотока оценивали с помощью программного обеспечения с применением математического аппарата вейвлет-преобразования.
Статистическую обработку данных проводили с помощью программы MS Excell 2007.
Результаты и обсуждение
В ходе исследования нами впервые был проведен одновременный анализ кровотока и лимфотока кожи век. Мы выявили, что отличия показателей микроциркуляции в различных частях век статистически недостоверны, поэтому представленные результаты получены при изучении микроциркуляции в латеральной части верхнего и нижнего века. Нормальные значения микрогемо- и лимфоциркуляции в разных возрастных группах были вариабельны и индивидуальны. Наиболее высокие значения кровотока в верхнем веке наблюдали в группе 20—30 лет (М=23,45±1,83). В возрасте от 31 до 50 лет отмечали их снижение (М=21,5±2,38 и М=20,26±1,39 соответственно). В группах 51—60 и 61—70 лет показатель микроциркуляции повышался (М=21,73±1,84 и М=22,14±1,65 соответственно), 71—80 лет — снижался (М=21,98±2,09). Кровоток в нижнем веке в группе добровольцев 20—50 лет возрастал (М=21,06±1,93 и М=21,65±0,30 соответственно), 51—60 лет — снижался (М=20,83±2,14), 60—70 лет — повышался (М=21,1±1,42), 71—80 лет — снижался (М=19,02±2,64).
Показатели микроциркуляции лимфотока в верхнем веке имели тенденцию к увеличению в возрасте от 20 до 50 лет (М=0,49±0,04 и М=0,55±0,03 соответственно). В группе 51—60 лет установлено их понижение (М=0,52±0,04), 61—70 лет — повышение (М=0,53±0,02), 71—80 лет — уменьшение (М=0,50±0,04). Лимфоток нижнего века возрастал в группе 20—40 лет (М=0,57±0,06 и М=0,60±0,04 соответственно). Его снижение наблюдали у добровольцев от 41 до 70 лет (М=0,58±0,06 и М=0,53±0,02 соответственно), а повышение — в группе 71—80 лет (М=0,54±0,03). Анализ ЛДФ-грамм добровольцев всех возрастных групп показал, что увеличение амплитуды кровотока соответствовало уменьшению амплитуды лимфотока (рис. 1). Сходные данные получены И.А. Филатовой и соавторами, которые также изучали кровоток век, но с помощью отечественного прибора ЛАКК-02 (исполнение 4, ООО НПП «ЛАЗМА») [7—9]. Авторы сделали вывод, что гендерные отличия недостоверны, что совпадает с нашими данными. Однако в ходе нашего исследования установлено наличие различий в значениях параметра М верхнего и нижнего века. При исследовании кровотока во всех возрастных группах, кроме группы 41—50 лет, было установлено, что в верхнем веке среднее значение перфузии кровотока на 5% выше, чем в нижнем веке (p<0,05).

Рис. 1. ЛДФ-грамма верхнего века пациента К. 62 лет.

Рис. 2. Средние значения изменения кровотока (а) и лимфотока (б) верхнего (вв) и нижнего (нв) века для здоровых возрастных групп.

Рис. 3. Распределение амплитуд ритмов кровотока верхнего (а) и нижнего (б) века для здоровых возрастных групп.

Рис. 4. Распределение амплитуд ритмов лимфотока верхнего (а) и нижнего (б) века для здоровых возрастных групп.
Доминирование нейрогенных ритмов отмечено в возрастных группах 20—30, 31—40 и 61—70 лет при анализе распределения амплитуд ритмов лимфотока нижнего века (см. рис. 4, б), а миогенных ритмов — в группах 41—50, 51—60 и 71—80 лет. Значения пиков нейрогенных ритмов в обоих веках в группе 61—70 лет, вероятно, указывают на отсутствие тенденции к снижению активности лимфатической системы в данной возрастной группе. Анализ осцилляций кровотока и лимфотока нижнего века (см. рис. 3, б, рис. 4, б) выявил снижение всех амплитуд осцилляций кровотока, но повышение всех амплитуд осцилляций лимфотока только для возрастной группы 41—50 лет. Возможно, это связано с гормональным влиянием на регуляцию тонуса микрососудов.
Заключение
Таким образом, неинвазивный метод ЛДФ расширяет диагностические возможности, позволяя исследовать не только кровоток, но и лимфоток. Анализ полученных данных исследования микроциркуляции век в разных возрастных группах показал, что кровоток и лимфоток в микроциркуляторном русле верхнего и нижнего века нестабилен, вариабелен и не зависит от возраста и гендерной принадлежности исследуемого. Это связано с индивидуальными особенностями микроциркуляторного русла — пространственной неоднородностью распределения кровеносных сосудов и временной изменчивостью перфузии ткани. На ЛДФ-граммах добровольцев увеличение амплитуды в записи кровотока соответствовало уменьшению амплитуды в записи лимфотока. Учитывая разброс значений, полученные результаты не позволяют однозначно определить их диапазон в норме. Однако, по нашему мнению, они могут служить отправной точкой для исследования микроциркуляции при патологических процессах в веках и способом оценки эффективности лечения у каждого конкретного пациента.
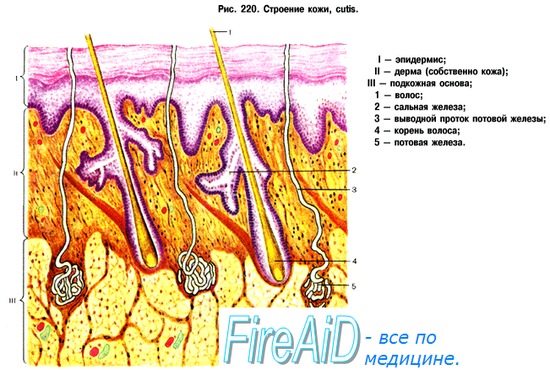
Кровоснабжение кожи. Интенсивность кровотока в сосудах кожи. Миогенная, гуморальная регуляция кровотока в коже.
Кожа в большей степени, чем другие органы, подвержена прямому действию высоких и низких температур, ультрафиолетовых лучей, механических факторов и т. д. Кровоток по ее сосудам значительно превышает собственные нутритивные потребности. Это объясняется тем, что выполнение важнейшей функции кожи человека — участие в терморегуляции — определяется не активностью метаболических процессов в ней, а теплопереносящей функцией кровотока.
В покое при нейтральной температуре внешней среды кожа получает от 5 до 10 % сердечного выброса. Суммарный кожный кровоток взрослого человека при этом составляет 200—500 мл/мин. В различных частях поверхности тела кожный кровоток значительно отличается. Например, в коже спины он составляет 9,5 мл/100 г/мин, на передней поверхности тела 15,5 мл/100 г/мин. Наиболее интенсивный кровоток отмечается в коже пальцев рук и ног, где находится большое количество артериовенозных анастомозов.
Диапазон возможного возрастания кровотока в коже велик: отношение объемной скорости кровотока в покое к максимальной его величине составляет 1:8. Максимальной величины кожный кровоток у человека достигает при тепловом стрессе. В условиях высокой внешней температуры он может возрастать с 200—500 мл/мин до 2,5—3 л/мин, а при продолжительном нагревании организма человека (температура кожи 42 °С) увеличивается до 8 л/мин, составляя 50—70 % сердечного выброса.
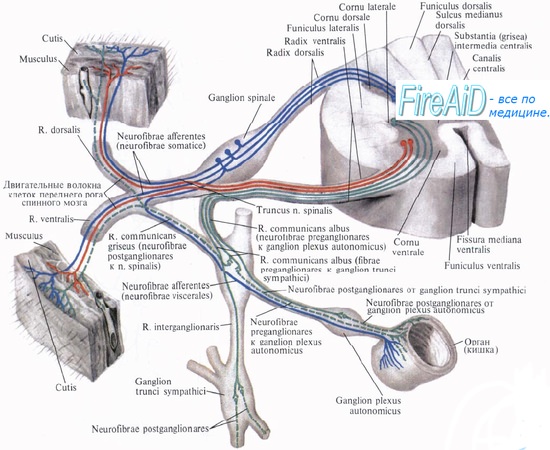
Нервная регуляция кровоснабжения кожи обеспечивается широко представленной иннервацией ее сосудов (особенно артериовенозных анастомозов) симпатическими адренергическими сосудосуживающими волокнами. Повышение их активности обусловливает сужение кожных сосудов, а торможение — приводит к вазодилатации.
Главным фактором в регуляции кожного кровотока является температура тела, снижение которой приводит к рефлекторному сужению как артериальных, так и венозных сосудов кожи, что способствует перемещению крови в глубокие вены и сохранению тепла. При общем охлаждении снижается кровоток как через артериовенозные анастомозы, так и через капилляры кожи. Эта реакция опосредована через гипоталамус, а эффектор-ными ее путями являются адренергические нервные волокна. При общем воздействии на организм высоких температур происходит увеличение кожного кровотока за счет, главным образом, раскрытия артериовенозных анастомозов, кровоток через которые увеличивается в 3—3,5 раза. Раскрытие анастомозов является следствием угнетения сосудосуживающей им-пульсации к кожным сосудам по симпатическим адренергическим волокнам, обусловливающим стимуляцию В-адренорецепторов. Медиаторами активной кожной вазодилатации являются гистамин и допамин.
Гуморальная регуляция. В коже имеется большое количество тучных клеток — источника вазоактивных веществ. Дегрануляция тучных клеток и выделение вазоактивных веществ (гистамина, серотонина и др.) происходит при непосредственном воздействии на кожу ультрафиолетового облучения, механических и других факторов. В сосудах кожи имеются Н,-и Н2-гистаминовые рецепторы, опосредующие вазодилататорное действие эндогенного и экзогенного гистамина. Расширение сосудов кожи вызывает субстанция Р, оказывая при этом как прямое влияние на гладкую мышцу сосудов, так и опосредованное — через гистамин, выделяющийся из тучных клеток. В коже происходит биосинтез простагландинов. Внутрикожное введение простагландинов Е2 и Н2 вызывает расширение кожных сосудов, а простагландина F2a — сужение их.
Температура самой крови является фактором, играющим важную роль в локально действующих механизмах контроля сосудистых функций в коже. При локальном нагревании кожи имеет место увеличение капиллярного кровотока без существенных изменений кровотока через артериовенозные анастомозы. В механизме вазодилатации при локальном нагревании кожи большую роль играет освобождение вазоактивных веществ (АТФ, субстанция Р, гистамин) и накопление метаболитов. Однако большее значение в развитии гиперемии в этом случае имеет прямое действие тепла на гладко-мышечные элементы кожных сосудов. При повышении температуры крови снижается миогенный тонус и уменьшаются реакции гладких мышц сосудов кожи на симпатическую импульсацию и вазоконстрикторные вещества, в частности на норадреналин. Снижение адренореактивности гладких мышц кожных сосудов под влиянием гипертермии связано с уменьшением чувствительности их альфа-адренорецепторов.
При локальном действии на кожу низких температур имеют место вазоконстрикции и снижение кожного кровотока, что обусловлено как повышением сосудистого тонуса, так и увеличением вязкости крови.
Кровообращение начинается в тканях, где совершается обмен веществ через стенки капилляров (кровеносных и лимфатических).
Капилляры составляют главную часть микроциркуляторного русла, в колюром происходит микроциркуляция крови и лимфы. К микроциркулятор-ному руслу относятся также лимфатические капилляры и интерстициальные пространства.
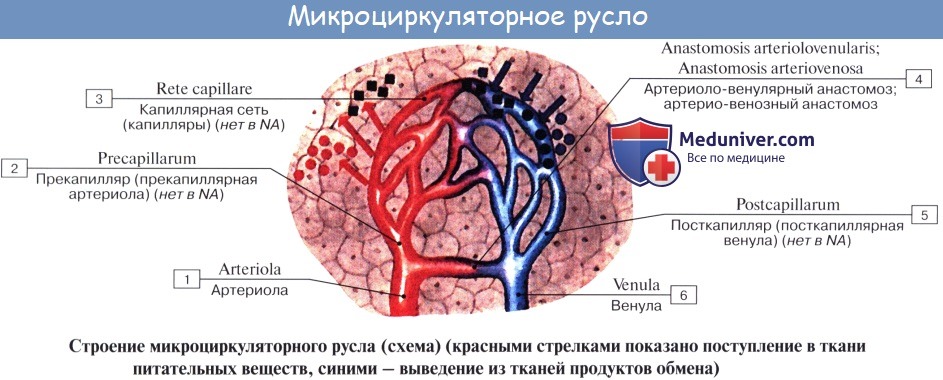
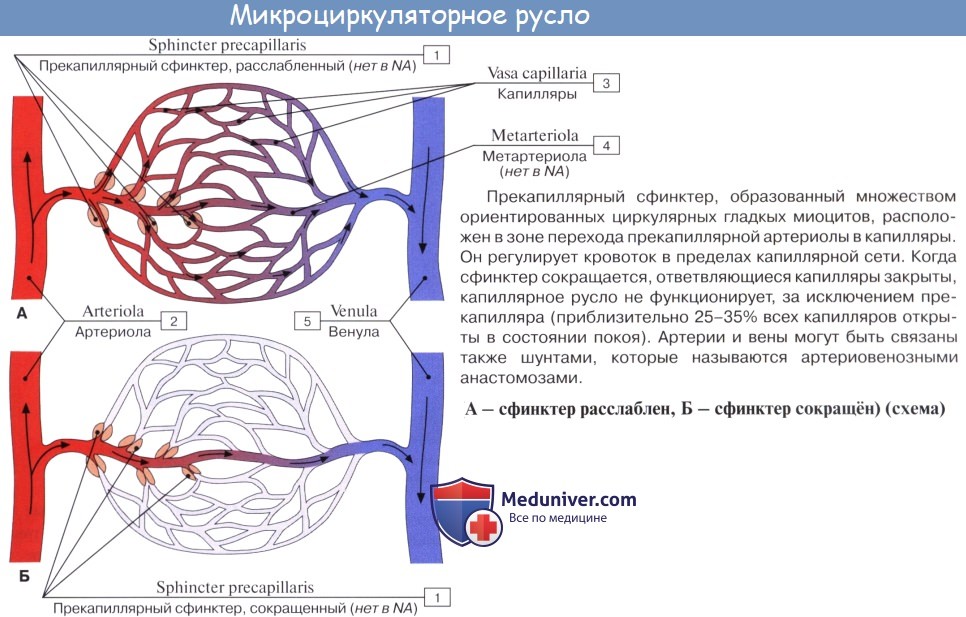
Микроциркуляция — это движение крови и лимфы в микроскопической части сосудистого русла. Микроциркуляторное русло, по В. В. Куприянову, включает 5 звеньев: 1) артериолы как наиболее дистальные звенья артериальной системы, 2) прекапилляры, или прекапиллярные артериолы, являющиеся промежуточным звеном между артериолами и истинными капиллярами; 3) капилляры; 4) посткапилляры, или посткапиллярные венулы, и 5) венулы, являющиеся корнями венозной системы.
Все эти звенья снабжены механизмами, обеспечивающими проницаемость сосудистой стенки и регуляцию кровотока на микроскопическом уровне. Микроциркуляция крови регулируется работой мускулатуры артерий и артериол, а также особых мышечных сфинктеров, существование которых предсказал И. М. Сеченов и назвал их «кранами». Такие сфинктеры находятся в пре- и посткапиллярах. Одни сосуды микроциркуляторного русла (артериолы) выполняют преимущественно распределительную функцию, а остальные (прекапилляры, капилляры, посткапилляры и венулы) — преимущественно трофическую (обменную).
В каждый данный момент функционирует только часть капилляров (открытые капилляры), а другая остается в резерве (закрытые капилляры).
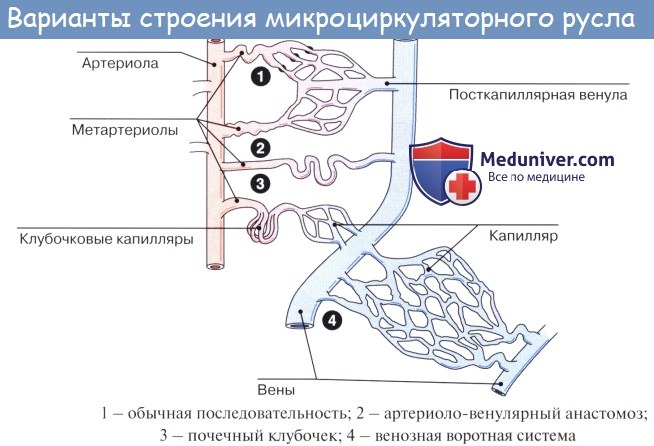
Кроме названных сосудов, советскими анатомами доказана принадлежность к микроциркуляторному руслу артериоловенулярных анастомозов, имеющихся во всех органах и представляющих пути укороченного тока артериальной крови в венозное русло, минуя капилляры. Эти анастомозы подразделяются на истинные анастомозы, или шунты (с запирательными устройствами, способными перекрывать ток крови, и без них), и на межарте-риолы, или полушунты.
Благодаря наличию артериоловенулярных анастомозов терминальный кровоток делится на два пути движения крови: 1) транскапиллярный, служащий для обмена веществ, и 2) необходимый для регуляции гемодинамического равновесия внекапиллярный юкстакапиллярный (от лат. juxta — около, рядом) ток крови; последний совершается благодаря наличию прямых связей (шунтов) между артериями и венами (артериовенозные анастомозы) и артериолами и венулами (артериоловенулярные анастомозы).

Благодаря внекапиллярному кровотоку происходят при необходимости разгрузка капиллярного русла и ускорение транспорта крови в органе или данной области тела. Это как бы особая форма окольного, коллатерального, кровообращения (Куприянов В. В., 1964).
Микроциркуляторное русло представляет не механическую сумму различных сосудов, а сложный анатомо-физиологический комплекс, состоящий из 7 звеньев (5 кровеносных, лимфатического и интерстициального) и обеспечивающий основной жизненно важный процесс организма — обмен веществ. Поэтому В. В. Куприянов рассматривает его как систему микроциркуляции.
Строение микроциркуляторного русла имеет свои особенности в разных органах, соответствующие их строению и функции. Так, в печени встречаются широкие капилляры — печеночные синусоиды, в которые поступает артериальная и венозная (из воротной вены) кровь. В почках имеются артериальные капиллярные клубочки. Особые синусоиды свойственны костному мозгу и т. п.
Пропесс микроциркуляции жидкости не ограничивается микроскопическими кровеносными сосудами. Организм человека на 70 % состоит из воды, которая содержится в клетках и тканях и составляет основную массу крови и лимфы. Лишь xls всей жидкости находится в сосудах, а остальные 4/5 ее содержатся в плазме клеток и в межклеточной среде. Микроциркуляция жидкости осуществляется, кроме кровеносной системы, также в тканях, в серозных и других полостях и на пути транспорта лимфы.
Из микроциркуляторного русла кровь поступает по венам, а лимфа — по лимфатическим сосудам, которые в конечном счете впадают в присердеч-ные вены. Венозная кровь, содержащая присоединившуюся к ней лимфу, вливается в сердце, сначала в правое предсердие, а из него в правый желудочек. Из последнего венозная кровь поступает в легкие по малому (легочному) кругу кровообращения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Нарушения микроциркуляции. Критерии расстройства микроциркуляции. Кровь. Основные функции крови. Реология. Реологические свойства. Сладж феномен.
Механизмы нарушения микроциркуляции едины для всех видов шока. Периферическая вазоконстрикция, как ответная реакция на уменьшение МОС, блокирует капиллярный кровоток спазмом пре- и посткапиллярного сфинктеров, в результате чего гидростатическое давление в капиллярах уменьшается. Это вызывает переход жидкости из интерстиция в сосуды системы микроциркуляции. При уменьшении капиллярного кровотока нарушается доставка кислорода и энергетических субстратов к тканям и выведение отработанных продуктов жизнедеятельности, что способствует формированию ацидоза. Закисление в капилляроне способствует снятию спазма прекапиллярного сфинктера при сохраненном высоком тонусе его посткапиллярного отдела. Кровь начинает свободно поступать в систему микроциркуляции, но ее отток нарушен. Повышается внутри капиллярное давление, плазма крови начинает пропотевать в интерстиций, развивается агрегация, а в последующем — стаз форменных элементов крови и сладж-синдром. С микротромбоза в системе капилляров, в свою очередь, начинается развитие грозного осложнения — диссеминирован-ного внутрисосудистого свертывания (ДВС-синдрома).
Важнейшие клинические критерии расстройств микроциркуляции:
1. Уменьшение диуреза до 0,5 мл/мин. (менее 30 мл/ч).
2. Возрастание температурного градиента между кожей и прямой кишкой более 2'С.
3. Наличие метаболического ацидоза.

Основные функции крови: транспорт кислорода, питательных веществ, гормонов, регуляция водно-электролитного обмена, кислотно-щелочного состояния и теплового равновесия. Для нормальной функции сердца прежде всего необходим должный объем циркулирующей крови. Дефицит объема (гиповолемия) — наиболее частая причина шока. Избыток жидкости в сосудистом русле называется гиперволемией.
Состав крови определяет ее реологические свойства. Реология — специальный раздел жидкостной механики, изучающий свойства неньютоновских жидкостей. Реологические свойства крови зависят от ВЯЗКОСТИ (она, в свою очередь, зависит от концентрации БЕЛКА в плазме и ГЕМАТОКРИТА) и СКОРОСТИ тока крови.
Основным феноменом реологических расстройств крови является агрегация эритроцитов, совпадающая с повышением вязкости. В основе этого явления, как правило, лежит замедление кровотока. Агрегация эритроцитов может быть как ложной, так и истинной, в дальнейшем порождающей явления сладжа (анг. слово sludge можно перевести как «отстой»). Агрегация «закрывает» капиллярен, и участок ткани, который он кровоснабжает, становится ишемизированным.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

