Микоз при гепатите с
Обновлено: 18.04.2024
Цитомегаловирусный гепатит является ведущим клиническим проявлением врожденной цитомегаловирусной инфекции. Поражение печени при цитомегаловирусной инфекции всегда является признаком генерализованного процесса.
Что провоцирует / Причины Цитомегаловирусного гепатита:
Возбудитель цитомегаловирусной инфекции- ДНК-геномный вирус рода Cytomegalovirus (Cytomegalovirus hominis) подсемейства Веtaherpesvirinae семейства Herpesviridae. Известно 3 штамма вируса: Davis, AD-169 и Kerr. Медленная репродукция вируса в клетке возможна без её повреждения. Вирус инактивируется при нагревании и замораживании, хорошо сохраняется при комнатной температуре. При - 90 °С сохраняется длительное время, сравнительно стабилен при рН 5,0-9,0 и быстро разрушается при рН 3,0.
Резервуар и источник инфекции - человек с острой или латентной формой заболевания. Вирус может находиться в различных биологических секретах: слюне, отделяемом носоглотки, слезах, моче, испражнениях, семенной жидкости, секрете шейки матки.
Механизмы передачи многообразны, пути передачи - воздушно-капельный, контактный (прямой и опосредованный - через предметы обихода) и трансплацентарный. Возможно заражение половым путём, при пересадке внутренних органов (почек или сердца) и переливании крови инфицированного донора. Интранатальное заражение ребёнка наблюдают гораздо чаще трансплацентарного. Наиболее опасно для плода инфицирование матери в I триместр беременности. В подобных ситуациях наиболее велика частота нарушений внутриутробного развития.
Естественная восприимчивость людей высокая, но широко распространена латентная инфекция. Клинические проявления инфекции, относимой к оппортунистическим заболеваниям, возможны в условиях первичного или вторичного иммунодефицита.
Основные эпидемиологические признаки цитомегаловирусной инфекции. Болезнь регистрируют повсеместно, о её широком распространении свидетельствуют противовирусные антитела, выявляемые у 50-80% взрослых. Многообразие путей заражения ЦМВ и полиморфность клинической картины определяют эпидемиологическую и социальную значимость ЦМВ-инфекции. Это заболевание играет важную роль в трансплантологии, гемотрансфузиологии, перинатальной патологии, может быть причиной недоношенности, мертворождений, врождённых дефектов развития. У взрослых ЦМВ-инфекцию встречают как сопутствующее заболевание при различных иммунодефицитных состояниях. Продолжающееся загрязнение окружающей среды, применение цитостатиков и иммунодепрессантов способствуют росту частоты ЦМВ-инфекции. В последние годы особенно актуальным стало её обострение у ВИЧ-инфицированных. У беременных с латентной ЦМВ-инфекцией поражение плода происходит далеко не всегда. Вероятность внутриутробного заражения значительно выше при первичном инфицировании женщины во время беременности. Сезонных или профессиональных особенностей заболеваемости не выявлено.
Патогенез (что происходит?) во время Цитомегаловирусного гепатита:
При различных путях передачи воротами инфекции могут быть слизистые оболочки верхних дыхательных путей, ЖКТ или половых органов. Вирус проникает в кровь; кратковременная вирусемия быстро завершается локализацией возбудителя при внедрении в лейкоциты и мононуклеарные фагоциты, где происходит его репликация. Инфицированные клетки увеличиваются в размерах (цитомегалия), приобретают типичную морфологию с ядерными включениями, представляющими собой скопления вируса. Образование цитомегалических клеток сопровождается интерстициальной лимфогистиоцитарной инфильтрацией, развитием узелковых инфильтратов, кальцификатов и фиброза в различных органах, железистоподобных структур в головном мозге.
Вирус способен длительно и латентно персистировать в органах, богатых лимфоидной тканью, будучи защищенным от воздействия антител и интерферона. В то же время он может подавлять клеточный иммунитет прямым воздействием на Т-лимфоциты. При различных иммунодефицитных состояниях (в раннем детском возрасте, при беременности, применении цитостатиков и иммунодепрессантов, ВИЧ-инфекции) и прежде всего при нарушениях клеточного иммунитета, дополнительно усугублённых прямым воздействием вируса, возможны реактивация возбудителя и его гематогенная генерализация с поражением практически всех органов и систем. При этом большое значение имеет эпителиотропность вируса. Она особенно выражена по отношению к эпителию слюнных желёз, под воздействием вируса превращающемуся в цитомегалические клетки.
Особое место при ЦМВИ занимает патология печени. Цитомегаловирусный гепатит, развивающийся в ответ на внедрение ЦМВ, характеризуется перерождением эпителия желчных путей и гепатоцитов, звездчатых эндотелиоцитов и эндотелия сосудов. Они формируют цитомегалические клетки, в их окружении располагаются воспалительные мононуклеарные инфильтраты. Совокупность этих изменений приводит к внутрипеченочному холестазу. Цитомегалические клетки слущиваются, заполняют просветы желчных протоков, являясь причиной механического компонента желтухи. В то же время перерожденные ЦМВ гепатоциты деструктивно изменены вплоть до некроза, обусловливая развитие синдрома цитолиза. Необходимо отметить, что при ЦМВ-гепатите, имеющем пролонгированное, подострое или хроническое течение, ведущее значение принадлежит синдрому холестаза.
Симптомы Цитомегаловирусного гепатита:
Цитомегаловирусный гепатит может протекать в безжелтушной и желтушной форме.
Безжелтушная форма ЦМВ-гепатита протекает с очень скудной клинической симптоматикой, состояние детей остается удовлетворительным. Выявление безжелтушной формы гепатита возможно в связи с обнаружением гепатомегалии и повышенного уровня аминотрансфераз. Активность аминотрансфераз повышается незначительно (в 1,5-2,0 раза) с преобладанием АсАТ над АлАТ.
При желтушной форме гепатита выделено две группы больных: одна с благоприятным течением и постепенным выздоровлением и другая группа с прогрессирующим заболеванием печени и формированием билиарного цирроза вследствие развития облитерирующего холангита.
Состояние детей с желтушной формой ЦМВ-гепатита существенно не нарушается. У них отмечается гепатоспленомегалия. Желтуха у большинства детей обнаруживалась в первые дни после рождения.
Желтушная форма ЦМВ-гепатита с благоприятным течением характеризуется неяркой желтухой кожных покровов, темной мочой и окрашенным калом, гепатоспленомегалией, умеренной гиперферментемией с преобладанием АсАТ над АлАТ, повышением уровня билирубина с преобладанием прямой фракции, а также наличием маркеров активной репликации ЦМВ.
Одним из вариантов цитомегаловирусного поражения печени при врожденной ЦМВИ является формирование билиарного цирроза печени, приводящего к летальному исходу, как правило, во 2-ой половине первого года жизни.
Дети, рождающиеся с цитомегаловирусным гепатитом, имеют низкие баллы по шкале Апгар (шкала, отражающая состояние нервной системы ребенка на момент рождения), недостаточное развитие мышц, повышенный или пониженный их тонус. Могут быть кратковременные мышечные подергивания или судороги, ребенок не берет грудь, снижены все врожденные рефлексы. В целом состояние такого ребенка будет тяжелым, выраженным будет геморрагический синдром (кровотечения из носа, желудочно–кишечные кровотечения, геморрагическая сыпь на коже и слизистых), снижается количество эритроцитов и тромбоцитов в крови, поражается центральная нервная система. Желтушность кожных покровов, слизистых и склер появляется в первые сутки или двое, постепенно нарастая, она держится 1–2 месяца. При осмотре печень увеличена, селезенка также увеличена. Часто вовлекается дыхательная система, дети кашляют, имеется одышка. Вскоре могут обнаружиться признаки гидроцефалии или микроцефалии, олигофрении, поражения зрительных нервов, почек, желудка и кишечника. В крови будут резко повышены печеночно–клеточные ферменты, белок и альбуминовая фракция белка будут понижены. Такое течение процесса часто заканчивается летально. При доброкачественном течении желтуха остается 2–3 месяца, после чего начинает спадать.
Диагностика Цитомегаловирусного гепатита:
Диагноз цитомегаловирусного гепатита устанавливался на основании анамнестических, клинических и биохимических данных с обязательным подтверждением диагноза обнаружением маркеров ЦМВИ. У всех больных исследовали маркеры парентеральных вирусных гепатитов.
В диагностике цитомегаловирусного гепатита большое значение имеют результаты пункционной биопсии печени (обнаружение в пунктате гигантских, диаметром 25–40 мкм, цитомегалических клеток в виде совиного глаза с огромным ядром и узкой каймой цитоплазмы), а также цитологический метод (выявление в осадке мочи цитомегалических клеток) и серологический метод (обнаружение антител – Ig М к ЦМВИ). Дифференциальную диагностику ЦМВ-гепатита проводят с другими вирусными гепатитами: В, Эпштейна-Барра, герпетическим гепатитом.
В биохимическом анализе крови выявляется отчетливая гиперферментемия с преобладанием АсАТ (160,0±25,6 мкмоль/мин.л) над АлАТ (120,0±25,6 мкмоль/мин.л) и гипербилирубинемия (112,0±8,5 мкмоль/л) с преобладанием прямой фракции (62,0±6,7 мкмоль/л).
К каким докторам следует обращаться если у Вас Цитомегаловирусный гепатит:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Цитомегаловирусного гепатита, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
ВИЧ-инфекция и хронические вирусные гепатиты видоизменяют классическую клиническую картину дерматозов. В большинстве случаев они протекают атипично, имеют склонность к обширному распространению и резистентны к стандартному лечению. При этом на развитие и
Comorbidity in patients with chronic viral infections: features of the course of dermatological pathology M. M. Tlish, T. G. Kuznetsova, M. E. Shavilova, N. L. Sycheva, F. A. Psavok
HIV infection and chronic viral hepatitis modify the classical clinical picture of dermatoses. In most cases, they are atypical, prone to widespread and resistant to standard treatment. In this case, the development and course of dermatoses can also be influenced by the ongoing antiretroviral therapy. Comorbidity of dermatoses with chronic infections can lead to tactical and diagnostic errors, which subsequently lengthens and complicates the therapeutic process. In this regard, the article describes clinical observations of dermatological patients with combined HIV infection and chronic viral hepatitis C.
В настоящее время хронические вирусные инфекции являются серьезной медико-социальной проблемой. К наиболее значимым возбудителям относятся вирусы иммунодефицита человека (ВИЧ-инфекция), гепатитов В и С (ВГB и ВГС). Несмотря на достигнутые успехи в изучении этиологии, патогенеза и клиники этих заболеваний, они до сих пор трудно поддаются терапии, что приводит к снижению работоспособности зараженного населения и росту финансовых затрат здравоохранения.
Характеризуясь в начальном периоде малосимптомным течением, вирусные инфекции нередко вовремя не распознаются, что способствует их широкому распространению. По данным ВОЗ, в мире насчитывается 36,7 млн человек с ВИЧ-инфекцией (на конец 2016 г.) и 325 млн зараженных ВГB и ВГС (ВОЗ Global hepatitis report, 2017). Нередко эти заболевания протекают сочетанно. Так, хронический гепатит С регистрируется в среднем у 20% ВИЧ-инфицированных [1, 2].
Сосуществование двух или более заболеваний, совпадающих по времени или патогенетически взаимосвязанных между собой у одного пациента, называется коморбидностью. Данное состояние видоизменяет обычную клиническую картину этих заболеваний. В большинстве случаев при наличии сочетанных состояний, ассоциированных с ВИЧ-инфекцией, ведущую роль в патогенезе играет вирус иммунодефицита человека. Сопутствующие заболевания также нередко сами индуцируют иммунные нарушения, поэтому развитие на их фоне ВИЧ-инфекции часто усугубляет ее течение, обусловливая развитие резистентности к проводимой антиретровирусной терапии [3].
Наиболее часто на фоне ВИЧ-инфекции регистрируются туберкулез, вирусные гепатиты, микозы, опоясывающий герпес, вторичные пиодермии, что связано с несостоятельностью иммунологического ответа [4, 5].
Появление высокоактивной антиретровирусной терапии позволило существенно улучшить качество и продолжительность жизни пациентов. При этом отмечено, что, по мере старения пациентов с ВИЧ-инфекцией, у них стали чаще регистрироваться выраженные сопутствующие соматические, онкологические, психоневрологические и дерматологические заболевания [4, 6, 7].
Кожные поражения в разные сроки ВИЧ-инфекции отмечаются у 90% пациентов. Как правило, коморбидность видоизменяет классическую клиническую картину дерматозов. В большинстве случаев они протекают атипично, имеют склонность к обширному распространению и резистентны к стандартному лечению [8, 9].
Известно, что при ВИЧ-инфекции уменьшается количество CD4+ лимфоцитов и увеличивается число CD8+ хелперов, что обусловливает преобладание аутоиммунных заболеваний, связанных с Т-клетками CD8+. Так, псориаз у ВИЧ-инфицированных встречается с частотой до 6?%, что превышает значение данного показателя в популяции. При этом дерматоз протекает тяжело, часто с развитием генерализованных пустулезных и эритродермических форм, быстрым прогрессированием артрита [10–14].
На течение дерматозов также может оказывать влияние проводимая антиретровирусная терапия. Полипрагмазия, возникающая в ходе лечения пациентов с ВИЧ-инфекцией, способствует росту вероятности развития местных и системных побочных эффектов лекарственных препаратов. К таким проявлениям можно отнести развитие поздней кожной порфирии и меланодермии [8].
Таким образом, коморбидность с хроническими инфекциями практически всегда изменяет обычное течение дерматозов, что может приводить к тактико-диагностическим ошибкам, удлинять и усложнять терапевтический процесс [15]. В связи с этим приводим собственные клинические наблюдения сочетанной патологии: ВИЧ-инфекции, хронического вирусного гепатита С с хроническими дерматозами.
Клинический случай № 1
В стационарном отделении ГБУЗ ККВД МЗ КК под нашим наблюдением в ноябре 2017 г. находился пациент З., 30 лет, с жалобами на распространенные высыпания, потерю веса на 8 кг за последние 6 месяцев.
При сборе анамнеза выяснилось, что впервые высыпания появились в 2009 г. на коже волосистой части головы, локтей, в связи с чем больной обратился к дерматологу по месту жительства, где был установлен диагноз «псориаз». С 2009 г. по 2017 г. пациент отмечал относительно спокойное течение заболевания с обострениями 1 раз в год. В июле 2017 г. после длительного пребывания на солнце появились высыпания на коже лица, груди, кистей, которые сопровождались жжением. Несколько позднее пациент стал отмечать легкую ранимость кожи и длительное ее заживление после травматизации, периодическое изменение цвета мочи. За медицинской помощью не обращался. Самолечение отрицает.
В период с сентября по октябрь 2017 г. с диагнозом: «Псориаз вульгарный, распространенный, прогрессирующая стадия, внесезонная форма» лечился амбулаторно по месту жительства. Получал гипосенсибилизирующую и стандартную наружную терапию (Федеральные клинические рекомендации по ведению пациентов с псориазом, 2015 г.), после которой отмечал непродолжительное улучшение. Учитывая распространенность кожного патологического процесса, торпидность течения, отсутствие эффекта от проводимой терапии, больной был направлен на стационарное лечение в ГБУЗ ККВД МЗ КК.
Из анамнеза: частое употребление алкоголя. Состоит с 2017 г. на диспансерном учете у инфекциониста с диагнозом: «Хронический вирусный гепатит С».
Специальный статус при поступлении. На коже лица (в области выступающих областей: лба, щек), плеч, предплечий располагаются множественные гиперпигментированные пятна, неправильной формы, а также участки нежной рубцовой атрофии. В области ушных раковин, лица, разгибательных поверхностей предплечий, плеч на фоне видимо неизмененной кожи регистрируются единичные неправильной формы эрозии диаметром до 1,0 см, покрытые по краям серозно-геморрагическими корочками (рис. 1–3).
На коже шеи, верхних и нижних конечностей симметрично локализуются множественные лентикулярные и нуммулярные папулы ярко-розового цвета правильно округлой и овальной формы, четко отграниченные от окружающей кожи, с признаками умеренной и выраженной инфильтрации. Поверхность элементов покрыта серебристо-белыми чешуйками (рис. 2, 4, 5). Отдельные элементы имеют ободок роста — симптом Пильнова. Псориатическая триада определяется в полном объеме.
Результаты обследования:
- Общий анализ крови: эритроциты — 4,4 × 10 12 /л; гемоглобин — 159 г/л, лейкоциты — 3,6 × 10 9 /л; палочкоядерные лейкоциты — 4%, сегментоядерные лейкоциты — 47%; эозинофилы — 13%, лимфоциты — 32%, моноциты — 4%; СОЭ — 25 мм/ч.
- Биохимический анализ крови: общий белок — 77 г/л; креатинин — 75,26 мкмоль/л; холестерин — 5,1 ммоль/л; билирубин общий — 23,1 мкмоль/л; щелочная фосфатаза — 208 ЕД/л; альфа-амилаза — 128 ЕД/л; глюкоза — 4,7 ммоль/л; гамма-глутамилтрансфераза — 865 ЕД/л; аланинаминотрансфераза — 132 ЕД/л; аспартатаминотрансфераза — 124 ЕД/л.
- Общий анализ мочи: цвет — темно-коричневый, прозрачность — мутная, удельный вес — 1026, рН — кислая, белок — отсутствует; лейкоциты — 3–4 в поле зрения; соли — оксалаты +++.
- Анализ мочи на уропорфирин: реакция положительная.
- Копропорфирин: реакция положительная.
- Иммуноферментный анализ (ИФА) крови на ВИЧ — антиген (АГ)/антитела (АТ) ВИЧ обнаружены.
- Кровь на сифилис: реакция микропреципитации (РМП) — отрицательно; ИФА — отрицательно.
- ИФА крови на вирусные гепатиты В и С: HBsAg — отрицательно; AbHCV (cor) — подтвержденный положительный; AbНCV (ns) — подтвержденный положительный.
- Соскоб с языка на Candida albicans — обнаружены дрожжевые грибы.
- Ультразвуковое исследование органов гепатобилиарной зоны: признаки спленомегалии, кальцинатов в структуре селезенки, диффузных изменений печени, поджелудочной железы.
- Консультация инфекциониста ГБУЗ КЦПБ СПИД МЗ КК: ВИЧ-инфекция. Стадия вторичных заболеваний 4а, потеря массы тела менее 10%, грибковые поражения слизистых (орофарингеальный кандидоз). Хронический вирусный гепатит С, умеренной степени активности.
На основании жалоб, анамнеза болезни, клинической картины, данных лабораторных и дополнительных методов исследования установлен окончательный клинический диагноз: «Псориаз вульгарный, распространенный, прогрессирующая стадия, внесезонная форма. Пустулез ладонный. Поздняя кожная порфирия, стадия обострения. ВИЧ-инфекция. Стадия вторичных заболеваний 4а, потеря массы тела менее 10%, грибковые поражения слизистых (орофарингеальный кандидоз). Хронический вирусный гепатит С, умеренной степени активности».
После проведенного обследования и получения заключения инфекциониста пациент направлен на лечение в ГБУЗ КЦПБ СПИД МЗ КК.
Представленный клинический случай демонстрирует:
- вирус-индуцированный генез поздней кожной порфирии;
- выраженную взаимосвязь распространенности псориаза, торпидности его течения и трансформации в тяжелую форму на фоне хронического вирусного гепатита С и ВИЧ-инфекции;
- невозможность проведения патогенетической терапии как по псориазу, так и терапию аминохинолинами по поздней кожной порфирии вследствие измененных клинико-лабораторных показателей, вызванных коморбидной патологией.
Клинический случай № 2
Больная С., 40 лет, в марте 2018 г. самостоятельно обратилась за консультацией на кафедру дерматовенерологии ФГБОУ ВО КубГМУ МЗ РФ с жалобами на высыпания на коже спины.
Считает себя больной с января 2017 г., когда появились первые локализованные высыпания на коже спины. Дебют заболевания пациентка связывала с приемом антиретровирусных препаратов. Дерматологом по месту жительства был установлен диагноз «токсикодермия». Проводилось лечение: мазь бетаметазон 2 раза в день, ретинола пальмитат + метилурацил 2 раза в день, аскорбиновая кислота + рутин 3 раза в день, цетиризин 10 мг 1 раз в сутки. Эффекта от терапии не было. В период с января по март 2018 г. на фоне продолжающейся антиретровирусной терапии появились новые очаги.
Из анамнеза: не работает. Прием наркотических средств с 2006 г. С 2008 г. состоит на «Д»-учете у инфекциониста с диагнозом «хронический вирусный гепатит С». В октябре 2017 г. в ГБУЗ КЦПБ СПИД МЗ КК установлен диагноз: «ВИЧ-инфекция. Стадия вторичных заболеваний 4а. Потеря массы тела более 10%, орофарингеальный кандидоз».
Наследственность и аллергологический анамнезы не отягощены. Гемотрансфузий не проводилось. Из перенесенных в прошлом заболеваний отмечает острые респираторные заболевания, ветряную оспу в детстве. Менструации с 16 лет, установились сразу с интервалом 28 дней, регулярные, по 5–6 дней, умеренные. Половая жизнь с 20 лет вне брака. Прием оральных контрацептивов отрицает. Беременностей — 0, родов — 0, абортов — 0.
Специальный статус. На коже надключичных и подключичных областей, лопаток, подлопаточной, поясничной областей располагается различной степени выраженности сетчатая и сливная гиперпигментация от светло-бурого до насыщенно-бурого цвета. Поверхность пятен с наличием местами скудного шелушения. Кожный рисунок выражен, инфильтрация отсутствует (рис. 8–10). Видимые слизистые чистые.
На основании анамнеза, клинической картины и данных гистопатологического исследования был установлен окончательный диагноз: «Меланодермия токсическая. ВИЧ-инфекция. Стадия вторичных заболеваний 4а. Потеря массы тела более 10%, орофарингеальный кандидоз. Хронический вирусный гепатит С».
Данный случай представляет интерес в том отношении, что:
- описанное наблюдение имеет редкое сочетание коморбидной патологии;
- меланодермия токсическая является редким заболеванием, требующим полноты собранного анамнеза, проведения дифференциального диагноза и патоморфологического исследования;
- дебют клинических проявлений токсической меланодермии был спровоцирован приемом антиретровирусных препаратов.
Таким образом, знание патогенеза и взаимосвязей ассоциированных заболеваний, инфекционная настороженность, углубленный сбор анамнеза и соблюдение полноты диагностического алгоритма позволяют своевременно установить окончательный клинический диагноз и определить тактику адекватной терапии.
Литература
М. М. Тлиш, доктор медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
М. Е. Шавилова 1
Н. Л. Сычева, кандидат медицинских наук
Ф. А. Псавок, кандидат медицинских наук
ФГБОУ ВО КубГМУ МЗ РФ, Краснодар
Коморбидность у больных хроническими вирусными инфекциями: особенности течения дерматологической патологии/ М. М. Тлиш, Т. Г. Кузнецова, М. Е. Шавилова, Н. Л. Сычева, Ф. А. Псавок
Для цитирования: Лечащий врач № 11/2018; Номера страниц в выпуске: 49-53
Теги: вирус, сочетанная инфекция, дерматоз, иммунодефицит
На сервисе СпросиВрача доступна консультация инфекциониста по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Полностью посмотреть печень- УЗИ, фиброскан, АЛТ, АСТ, билирубин. Препарат очень токсичный для печени, поэтому применять только после оценки функции печени.


Здравствуйте Игорь. Перед началом приема желательно сдать биохимический анализ крови(АЛТ, АСТ, билирубин, мочевину, креатинин, белок и др.) и УЗИ брюшной полости и почек(если не делали ранее). Если лечение длительное, то желателен также контроль биохимии в процессе лечения. Дозировка должна подбираться с учетом вашего заболевания


Добрый день. Препарат токсичный и по факту вызовет токсическую реакцию даже при изначально нормальной функции печени. Поскольку чаще всего курсы лечения очень длительные, то желательно рассмотреть альтернативные варианты с дерматологом. Здоровья Вам!
Наталья, здравствуйте.Диагноз HCV ,был обнаружен недавно и я еще не знаю генотип. А врачу дерматологу стыдно было сказать о гепатите. А теперь после назначения лечения грибка понимаю,что это неправильно.Теперь незнаю что делать посоветуйте пожалуйста.Т.к. грибок нужно лечить, но имея другой диагноз, как поступить незнаю.




Зря Вы стыдитесь. Не нужно этого делать. Сейчас гепатит регистрируется у совершенно социально адаптированных людей, и их большинство, тем более, что он сейчас лечится. Я бы рекомендовала бы Вам сначала пролечить гепатит, грибок лечить местно, а после выздоровления гепатита приступить к системной терапии грибковой инфекции.

Здравствуйте! Можно, только под контролем лабораторных показателей и при необходимости защите функции печени.


Здравствуйте! Этот препарат токсичен для печени.Необходимо повторно проконсультироваться с дерматологом,учитывая хронический гепатит с.Возможно применение местной противогрибковой терапии.

перед началом приема препараты необходимо сдать все необходимые анализы и проконсультироваться с инфекционистом, так как данный препарат токсичен очень сильно для печени

Во-первых, нужно понять, грибковое ли у вас поражение ногтей. Для этой цели необходимо сдать соскоб с ногтей, а также с кожи стоп (если поражены ногти на стопах) или кожи ладоней (если поражены ногти кистей), поскольку часто поражена и прилегающая кожа, и ногтевые пластины. Перед сдачей анализа необходимо отменить за неделю все препараты, которые вы наносите на ногти или кожу (если такие имеются, конечно).
Во-вторых, важно провести не только микроскопическое, но и культуральное исследование (посев на среду).
В-третьих, неплохо было бы, чтобы вы приложили хотя бы фото ногтей и кожи стоп или ладоней.
Существует огромное количество негрибковых поражений ногтей, поэтому если диагноз поставлен «на глаз», то это ещё совершенно ничего не значит.
Только после того, как лабораторно и клинически подтвердится микоз, можно говорить о безопасности соответствующей терапии. В любом случае, перед назначением антимикотика, а также во время самого лечения противогрибковым средством необходимо сдавать биохимический анализ крови с определением печёночных ферментов.
Микоз грибовидный - злокачественная опухоль лимфоидной ткани, характеризующаяся избыточной пролиферацией Т-хелперов в коже. На поздних стадиях поражаются лимфатические узлы и внутренние органы. Синдром Сезари (Сезари ретикулёз, эритродермия ретикулярная) - разновидность грибовидного микоза, характеризующаяся эритродермией с шелушением и зудом, меланодермией, лимфаденопатией, алопецией, а также лейкоцитозом и наличием в крови атипичных макрофагов.
Обычно грибовидный микоз начинается со стойких шелушащихся пятен, которые плохо поддаются местному лечению с помощью смягчающих средств и стероидных препаратов. В среднем от времени начала развития кожного поражения до постановки диагноза проходит 7 лет. В этой ранней фазе заболевание часто диагностируется как бляшечный парапсориаз. Со временем пятна уплотняются и становятся бляшками. Постепенно образуются кожные опухоли и могут вовлекаться лимфатические узлы. Поражения висцеральных органов при этой низкодифференцированной лимфоме появляются поздно. Средняя продолжительность жизни у пациентов с этим заболеванием на стадии пятен и бляшек составляет 12 лет, на стадии опухоли - 5 лет, на стадии поражения лимфатических узлов и висцеральных органов - 3 года.
Грибовидным микозом болеют оба пола, мужчины несколько чаще. Заболевание встречается преимущественно в возрасте 40-60 лет. Частота. 0,29 случаев на 100 000 населения.
В последние годы случаи регистрации грибовидного микоза участились, возможно, за счет улучшения диагностики, особенно в ранних стадиях заболевания.
Что провоцирует / Причины Грибовидного микоза:
Причины развития грибовидного микоза до сих пор не ясны. До настоящего времени не известны побудительные мотивы неконтролируемой Т-клеточной пролиферации. Предполагается, что возникновение грибовидного микоза может быть связано с персестирующей вирусной инфекцией. Так, в ряде работ сообщается о выявлении в первичной клеточной культуре, полученной из лимфоузла больного в инфильтративно-бляшечной стадии грибовидного микоза, вирусных частиц, морфологически характерных для ретровирусов типа С. Кроме того, в ДНК первичных клеточных культур, полученных от больных грибовидным микозом, выявлено наличие последовательности, родственной гену gag HTLV-1.
Определенную роль в возникновении злокачественных лимфом отводят генетическим факторам. Доказано, что развитие различных видов солидных опухолей и лейкемий связано с появлением и дальнейшим нарастанием хромосомных аномалий. В последние годы появились публикации о хромосомных перестройках при ГМ, которые способствуют активации онкогенов и инактивации генов опухолевой супрессии при развитии лимфопролиферативного процесса. В настоящее время в литературе широко обсуждается положение о том, что значимые патогенетические факторы ГМ могут быть носителями ксеногенной информации, приводящей к патологическим сбоям в функционировании различных систем и клеток макроорганизма. В первую очередь такие изменения наблюдались со стороны иммунокомпетентных клеток, эпидермоцитов, макрофагальных элементов кожи, рецепторного аппарата кожи и продукции цитокинов. Имеющиеся в отечественной и зарубежной литературе сведения о состоянии иммунного гомеостаза убедительно свидетельствуют о стойких патологических сдвигах как в клеточном, так и в гуморальном звеньях иммунитета. Анализ иммунного статуса показал, что у большинства больных ГМ при нормальном количестве в сосудистом русле В-лимфоцитов среднее содержание Т-клеток значительно снижено по сравнению с показателями здоровых доноров. Отмечено снижение как Т-супрессорных, так и Т-хелперных лимфоцитов, причем количество последних снижается более существенно. Относительную лимфопению многие авторы рассматривают как наиболее часто встречающийся гематологический признак ГМ. Другие, кроме того, отмечают наличие абсолютной лимфопении в опухолевой стадии заболевания. Функциональная активность лимфоцитов у больных ГМ, по данным ряда авторов, снижена. Другие сообщают об отсутствии достоверных различий в характере пролиферации лимфоцитов периферической крови больных и здоровых лиц. Установлено, что течение патологического процесса при ГМ сопровождается снижением активности естественных киллеров.
Разноречивы результаты исследований состояния гуморального звена иммунитета. В ряде работ не выявлено существенных нарушений в продукции В-лимфоцитами иммуноглобулинов. Вместе с тем есть указания на наличие при ГМ явного IgМ- и скрытого IgA- и IgG-дефицита антителообразования. Другие исследователи выявили увеличение в крови больных ГМ количества IgA, IgМ, а также значительный рост концентрации IgG. При этом увеличение уровня иммуноглобулинов объясняют хелперным фенотипом опухолевого субстрата при ГМ. Таким образом, изменения показателей иммунного статуса у больных ГМ характеризуются значительной вариабельностью и отсутствием признаков, имеющих безусловное диагностическое значение.
Патогенез (что происходит?) во время Грибовидного микоза:
В эритематозной стадии грибовидного микоза обнаруживают обычный воспалительный инфильтрат; лишь иногда в нем имеется небольшое количество ретикулярных клеток. В бляшечной стадии инфильтрат располагается преимущественно в сосочковой части дермы. Характерны значительное содержание в нем эозинофилов и наличие своеобразных, атипичных ретикулярных клеток («микозные» летки), а также «микроабсцессов» Потрие (небольшие скопления в мальпигиевом узле лимфоцитов и гистиоцитов). В опухолевой стадии увеличивается количество ретикулярных, «микозных» клеток и сам инфильтрат глубоко проникает в подкожную жировую клетчатку.
При патологоанатомическом исследовании больных грибовидным микозом во внутренних органах (в легких, желудке, печени и др.) обнаруживаются узлы с гистологическими изменениями, идентичными изменениями в коже.
Симптомы Грибовидного микоза:
Наиболее часто встречается форма Алибера - Базена, которую подразделяют на три стадии: эритематозную, бляшечную (инфильтративную) и опухолевую. В эритематозной стадии появляются желтовато-розовые или синюшно-багровые пятна с легким сероватым шелушением, сопровождающиеся очень сильным зудом, который может предшествовать высыпаниям. Вначале высыпания располагаются на туловище, разгибательных поверхностях конечностей, а затем, сливаясь, могут захватывать значительные участки кожного покрова. Эта стадия нередко имеет полиморфную картину и может напомнить многие дерматозы (парапсориаз, почесуху, красный плоский лишай, герпетиформный дерматоз и др.). Одни авторы считают, что ряд дерматозов может трансформироваться в грибовидный микоз. Другие полагают, что эритематозная стадия грибовидного микоза может клинически напоминать экзему, псориаз и другие дерматозы. Незаметно, через различные сроки (от нескольких месяцев до нескольких десятков лет), возникает бляшечная (инфильтративная) стадия, в которой происходят инфильтрация и уплотнение пятен, их рост по периферии; зуд становится еще более мучительным. Инфильтративные пятна приобретают более насыщенный кирпично-красный, багровый цвет, напоминая корки апельсина. В результате регресса бляшек образуются фигуры в виде гирлянд, дуг, колец. Ряд авторов первые две стадии называют премикозом, или зремикотическим периодом. Более характерна последняя стадия - стадия опухолей, при которой элементы достигают размеров апельсина и более и имеют красновато-желтоватый или красновато-синюшный цвет. Эти «помидоры» могут встречаться одновременно с инфильтратами бляшечной стадии.
Во всех трех стадиях отмечают увеличение лимфатических узлов. Вначале в процесс вовлекаются паховые и бедренные гимфатические узлы.
Значительно реже встречаются форма Видаля-Брока, при соторой отсутствуют «премикотические» периоды и на видимо щоровой коже внезапно образуются опухоли, и эритродермическая форма Галлопо-Бенье, для которой характерно развитие универсальной эксфолиативной эритродермии (гиперемированная, щфильтрированная кожа покрыта крупнопластинчатыми чешуйками).
Диагностика Грибовидного микоза:
Лечение Грибовидного микоза:
Существует мнение, что при начальных, благоприятно протекающих формах грибовидного микоза целесообразно назначать консервативное общеукрепляющее лечение (витамины группы В, витамин С) и наружно стероидные мази. Показано также санаторно-курортное лечение.
В более выраженных стадиях болезни предпочтительнее назначать комбинированную терапию: цитостатики, противоопухолевые антибиотики. Целесообразно сочетать проспидин с кортикостероидами.
В этих случаях эффект наступает быстрее при меньших дозах препаратов, в связи с чем уменьшается число побочных явлений и осложнений.
В опухолевой стадии грибовидного микоза применяют рентгенотерапию. Наружно назначают средства, направленные на уменьшение зуда, в том числе кортикостероидные мази.
Прогноз
При современных методах лечения грибовидного микоза в большинстве случаев можно добиться длительной ремиссии. В этих случаях летальный исход может наступить в результате осложнений ли интеркуррентных заболеваний. В опухолевой стадии прогноз уже.
К каким докторам следует обращаться если у Вас Грибовидный микоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Грибовидного микоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Инфекции дрожжевых грибов - кандидоз: диагностика, лечение, профилактика
Грибы вызывают широкий спектр заболеваний — от кожных дерматофитных инфекций до тяжёлых заболеваний у пациентов со сниженным иммунитетом. Причиной микозов могут быть как дрожжевые, так и нитевидные формы грибов.
Грибы рода Candida, широко распространённые в окружающей среде, входят в состав условно-патогенной микрофлоры кожи, желудочно-кишечного тракта и женских половых органов. Их чрезмерное размножение, возникающее вследствие антибактериальной терапии, может привести к развитию инфекционных заболеваний.
Наиболее подвержены микозам пациенты с иммунодефицитами. Возбудитель большинства грибковых инфекций — С. albicans. Другие виды, такие как С. tropicalis, С. parapsilosis, С. glabrata и С. pseudotropicalis, представляют опасность для пациентов со сниженным иммунитетом, так как они устойчивы к действию большинства противогрибковых препаратов.
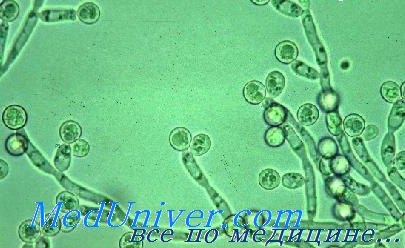
Грибы рода Candida - возбудители кандидоза
Патогенез инфекции дрожжевых грибов. Несмотря на то что грибы имеют факторы адгезии, экстрацеллюлярные липазы и протеазы, они обладают достаточно слабой инвазивностью. Инфекция обычно возникает при нарушении баланса нормальной микрофлоры (при применении антибиотиков) или снижении иммунитета.
Клинические признаки инфекции дрожжевых грибов. Кандидозы обычно сопровождаются болью, зудом и образованием творожистого налёта на поверхности слизистых оболочек, при удалении которого возникает кровоточивость. Часто возникает поражение кожи и ногтевых пластин. У пациентов со сниженным иммунитетом развивается тяжёлый фарингит и эзофагит, сопровождающийся дисфагией и снижением массы тела (часто наблюдают у больных СПИДом).
При нейтропении возникают системные микозы. Кроме того, на фоне применения антибиотиков широкого спектра действия в отделениях интенсивной терапии грибы рода Candida могут вызывать генерализованные и катетер-ассоциированные инфекции.
Лабораторная диагностика инфекции дрожжевых грибов. Поскольку грибы рода Candida — представители нормальной микрофлоры, их культивирование и выделение оправдано только на фоне уже сложившейся клинической картины. Они хорошо растут на обычных питательных средах. Методы диагностики — микроскопия, молекулярные методы исследований (у пациентов со сниженным иммунитетом), биохимические методы или секвенирование 18S рибосомальной РНК (для видовой идентификации).
Чувствительность инфекции дрожжевых грибов к препаратам. Большинство грибов чувствительны к амфотерицину В (за исключением С. lusitaniae). Кроме того, терапевтическим эффектом обладают производные имидазола (флуконазол) и 5-флуцитозин. При кандидемии рекомендовано назначение каспофунгина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

